このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
インビボ 皮内 カンジダ・アルビカン ス感染におけるTh17免疫誘導のための皮膚樹状細胞の分別サブセットの機能
要約
ここでは、深部皮膚カンジダ・アルビカンス感染のTh17免疫における皮膚樹状細胞サブセットのin vivo機能を示します。
要約
皮膚は体内で最も外側のバリア器官であり、そこには数種類の樹状細胞(DC)が含まれています。これは、専門的な抗原提示細胞のグループです。皮膚が侵入する病原体に遭遇すると、さまざまな皮膚DCが体を保護するために異なるT細胞免疫応答を開始します。侵入する病原体の中で、真菌感染症は特に防御的なインターロイキン-17産生Th17免疫応答を引き起こします。Th17免疫の誘導に関与する皮膚DCのサブセットを調査するために、 皮内カンジダアルビカンス 感染によってTh17細胞を効率的に分化するためのプロトコルが開発されました。フローサイトメトリーと遺伝子発現解析により、皮膚を排出するリンパ節と感染した皮膚におけるTh17免疫応答の顕著な誘導が明らかになりました。ジフテリア毒素誘発性DCサブセット枯渇マウス系統を用いて、CD301b+ 経皮DCがこのモデルで最適なTh17分化をマウントする役割を担っていることがわかった。したがって、このプロトコルは、皮膚深部真菌感染症に対するTh17免疫を決定するために、皮膚DCの差動サブセットの in vivo 機能を研究するための貴重な方法を提供します。
概要
皮膚は最も外側のバリア器官であり、外部の病原体や刺激の侵入から体を保護します1。皮膚は、表皮(ケラチノサイトの層状上皮)と、その下にある真皮(コラーゲンやその他の構造成分の密なネットワーク)の2つの異なる層で構成されています。主要な上皮バリア組織として、皮膚は主に物理的バリアを提供し、多数の常在免疫細胞2,3を含んでいるため、追加の免疫学的バリアに貢献します。皮膚免疫細胞の中でも、樹状細胞(DC)は専門的な抗原提示細胞の一種であり、自己抗原と非自己抗原を積極的に取り込み、所属リンパ節(LN)に移動して、抗原の性質に応じて抗原特異的なT細胞応答と耐性を開始します4。
皮膚には、表皮抗原提示細胞、すなわちランゲルハンス細胞(LC)と、少なくとも2種類のDCs(真皮型1型従来型DC(cDC1)と真皮型2型従来型DC(cDC2)5)が存在します。表皮LCは胚性単球起源であり、恒常性条件下での自己永続化によって細胞数を維持します6。対照的に、真皮cDC1およびcDC2は造血幹細胞起源であり、DCコミットされた前駆細胞5によって継続的に補充されます。皮膚DCは、ランゲリン+(LCおよびcDC1を含む)とCD11b+ランゲリン-集団(主にcDC2)に大別される表面マーカーによって特徴付けられます。また、このグループは、CD11b+Langerin-DC集団がCD301b発現7によってさらに2つに分類されることを明らかにしました。
皮膚DCの重要な機能的特徴は、主にDCの各サブセットの本質的な性質、DCのその場の位置、組織の微小環境、および局所的な炎症の手がかり8によって決定される分業に集中している。皮膚DCのこれらの機能的特性は、皮膚の特定の種類の免疫応答におけるDCの特定のサブセットの役割を調査する必要があります。ドレインLN中の皮膚DCによる抗原刺激により、ナイーブCD4+ T細胞はヘルパーT細胞の特定のサブセットに分化し、ヘルパーT細胞はエフェクター機能を発揮するための一連の定義されたサイトカインを産生する9。CD4+ヘルパーT細胞サブセットの中で、インターロイキン-17(IL-17)産生Th17細胞は、自己免疫疾患および抗真菌免疫において重要な役割を果たす10。この点で、皮膚真菌感染症は、in vivo 11,12,13でTh17免疫を研究するための堅牢なモデルとなっています。テープで剥がされた皮膚をカンジダ・アルビカンス(C. albicans)酵母に皮下的にさらすと、表皮LCは抗原特異的なTh17の分化を促進する上で極めて重要な役割を果たす14。
皮内感染に対する防御免疫 C. albicans は、線維芽細胞や食細胞の線維素溶解活性などの自然免疫を必要とする15。しかし、深部 皮膚C.アルビカンス 感染におけるTh17免疫の確立における皮膚DCサブセットの役割については、ほとんど知られていません。この論文では、 C. albicansの皮内皮膚感染の方法について説明し、これにより局所的および局所的なTh17免疫応答が生じます。ジフテリア毒素(DT)誘発性DCサブセット枯渇マウス系統の適用により、このモデルではCD301b+ 経皮DCがTh17免疫に重要であることが明らかになりました。ここで説明するアプローチにより、深部皮膚侵襲性真菌感染症に対するTh17応答の研究が可能になります。
プロトコル
(注)すべての動物実験は、施設動物管理委員会(IACUC、承認ID:2019-0056、2019-0055)によって承認されています。この研究では、体重18〜24 gの7〜9週齢の野生型(WT)C57BL / 6匹の雌マウスを使用しました。一部の研究は、同年齢・同体重の雌のランゲリン・ジフテリア毒素受容体(DTR)マウスとCD301b-DTRマウスを用いて行われた。実験には各グループで4〜6匹のマウスを使用し、データは3つの独立した実験を代表するものです。この作業はバイオセーフティレベル3の条件下で実施されましたが、施設のガイドライン(室温23°C±3°C、湿度50%±10%)に従ってバイオセーフティレベル2の条件下でも実施できます。
1.カンジダ・アルビカンスの調製
注:このセクションの実験は、生物学的安全キャビネットで行われました。
- Streak C. albicansは 、接種ループと針を使用して、酵母-ペプトン-デキストロース-アデニン(YPDA)寒天プレートにSC5314を濾過します。
- プレートを逆さまにして30°Cで2日間インキュベートします。
注: C.アルビカンス を含むYPDA寒天プレートは、4°Cで最大1か月間保存できます。 - 滅菌ピペットチップを使用して、50 mLチューブ内の10 mLのYPDA培地に接種するために、プレートから単一のコロニーを分離します。
- 30°Cでインキュベートし、230-250rpmで~17時間振とうします。
- キュベットに酵母懸濁液を置き、OD600 が1.5-2.0に達するまでUV-VIS分光光度計を使用して30分ごとに600 nmで光学密度(OD)を測定します。
注:この手順には16〜18時間かかる場合があります。 - 酵母懸濁液を1000 × g で5分間回転させます。
- 上清を捨て、酵母細胞を適切な量の滅菌リン酸緩衝生理食塩水(PBS)に再懸濁します。
- 血球計算盤を使用して C.アルビカンス 細胞をカウントし、懸濁液を1000 × g で5分間回転させます。
- 上清を捨て、PBS中の C.アルビカンス 細胞をフットパッドあたり40μLのPBS中に1×107 細胞の濃度に再懸濁します。
- 加熱死(HK) C.アルビカンスの調製には、細胞番号を決定した後、加熱ミキサーを使用して65°Cで60分間加熱することにより、酵母細胞を死滅させます。
2. マウスフットパッドのC. albicans感染
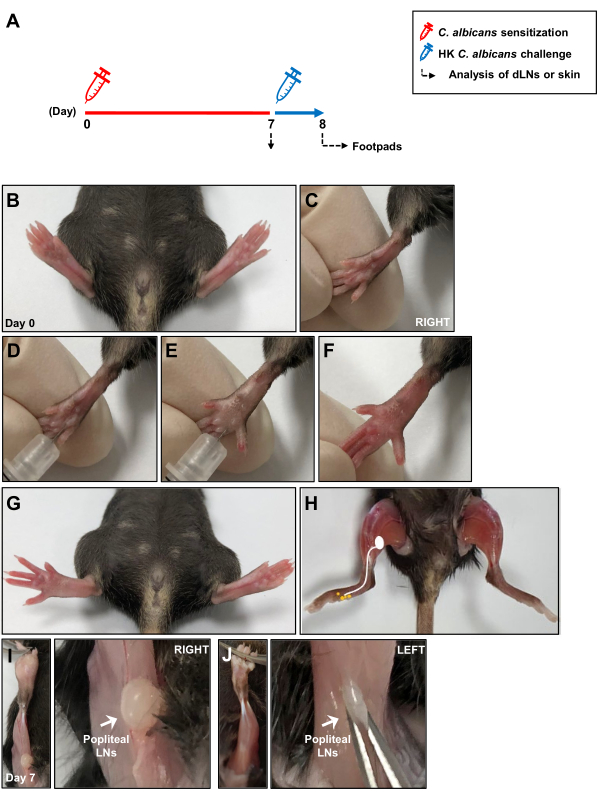
図1:皮内カンジダ・アルビカンス感染モデルの模式図(A)マウスの後足板に1 ×1 107C.アルビカンスを皮内注射した。7日後、マウスのフットパッドを皮内注射により1 × 107 HK C. albicansに再曝露し、抗原チャレンジの24時間後に遅延型過敏反応を測定した。C. albicansの感作中の局所免疫応答は、皮膚を排出するLNで7日後に分析されました。(B、C) C. albicansの皮内フットパッド注射前のフットパッドの画像。(D、E)C.アルビカンスを右足裏の真皮深部に注射します。(F、G)-右足パッドのフットパッド注射後の発赤と腫れの臨床徴候。(H)C.アルビカンス注射後のフットパッドから膝窩LNへのリンパ経路を示すスケッチ。(I) C. albicans注射の7日後に膝の後ろに位置する膝窩LNが露出し、(J)注射なし。略語:HK =熱殺された;LNs = リンパ節。この図の拡大版を表示するには、ここをクリックしてください。
- マウスの呼吸数が遅くなり、つま先や尾のつま先や尾のつまみに対する離脱反応が見られなくなるまで、誘導チャンバーでイソフルランでマウスを麻酔します。.
注:麻酔中は、ドライアイを防ぐために、特に5分以上続く麻酔には、目の軟膏が推奨されます。 - 31Gの針からキャップを取り外し、細胞を混合した後、ステップ1.9で調製した C.アルビカンス を0.3mLインスリンシリンジにロードします。
- 麻酔をかけたマウスを誘導室から取り出し、酵母細胞40μL(1細胞×107細胞) を右足の真皮深部に穏やかに注入し、 C.アルビカンス 感作を行います。
注:フットパッドに注入できる最大容量は50μLです。 - 注射針を注射部位からゆっくりと引き抜きます。.
- 麻酔から完全に回復するまで各マウスをケージに一人で置き、その後、安全に自宅のケージに戻します。
- C. albicansに対する抗原特異的応答を発現させるためには、前述のように、感作の7日後に調製したHK C. albicansを用いてマウスの右足パッドにチャレンジし、感作の7日後に皮内注射を行った(1 × 107細胞;フットパッドあたり40μL;ステップ2.1-2.5を繰り返す)。
- C. albicans感作または病変性フットパッド組織の7日後に、安楽死後の抗原チャレンジの24時間後に、CO2チャンバーで皮膚を排出するLNを採取します。
3. ジフテリア毒素による樹状細胞のin vivoでの枯渇
注:この研究では、Langerin-DTRマウスとCD301b-DTRマウスの両方を 、C. albicansに対する皮内感作の1日前と1日後にDTで治療しました。
- PBS中のDTの10 μg/mL溶液を調製します。
- 1 mLインスリン注射器の針からキャップを取り外し、DTを混合し、シリンジにDTを充填します。.
- マウスを頭を下にして適切に拘束します。
- マウスの腹側を70%エタノールで消毒します。
- 各マウスに100μLの1μgDTを腹腔内ゆっくりと注入し、腹部の左下象限に注入して、特定の樹状細胞サブセットを枯渇させます。
注:注射中に臓器を傷つけないように注意してください。 - 5 秒待ちます。次に、ゆっくりと針を外します。
4. 定量的なリアルタイムポリメラーゼ連鎖反応
- 呼吸の動きが観察されなくなるまで、マウスをCO2 チャンバーに入れます。
- マウスを70%エタノールで消毒し、鉗子とハサミを使用して後足パッドの皮膚から病変を細かく切り取ります。
- スライスした組織をRNA単離試薬に完全に浸します。
- 製造元の指示に従って、組織ホモジナイザーを使用してサンプルをホモジナイズします(30 Hzで3分間の2サイクル)。
注:この研究では、組織溶解にステンレス鋼ビーズを使用しました。 - 10,000 × g で5分間、4°Cで遠心します。
- 上清を新しいチューブに慎重に移します。
- トータルRNAアイソレーションキットを使用して、病変の皮膚からトータルRNAを単離します。
- UV-Vis分光光度計を使用してRNA濃度を測定します。
- 逆転写キットを使用してcDNAを合成し、定量的なリアルタイムポリメラーゼ連鎖反応(qPCR)を行います。
- リアルタイムPCRシステムでは、緑色蛍光色素を使用してPCRサイクル中の二本鎖DNAの合成をモニタリングし、リアルタイムqPCRを実施します。
注:この研究では、結果はヒポキサンチン-グアニンホスホリボシルトランスフェラーゼ(Hprt)のレベルに正規化されました。プライマー配列を 表1に示し、PCRプロトコルは以下の通りである:95°Cで30秒間の初期変性、42サイクルの増幅(95°Cで5秒間、60°Cで30秒間)。
5. 細胞単離とフローサイトメトリー解析
- CO2 安楽死後、鉗子とハサミを使用してマウスを解剖し、膝の後ろにある膝窩LNと呼ばれる足パッドを排出するLNを注意深く露出させて収穫します。
- 各マウスのフットパッドドレインLNからシングルセル懸濁液を調製し、ホモジナイズ後、3mLシリンジのプランジャーを使用して70μmのストレーナで組織をろ過します。
- 細胞をPBSで洗浄し、500 × g で4°Cで5分間遠心します。
- 上清を捨て、再度PBSで細胞を洗浄します。
- 500 × g で4°Cで5分間遠心します。
- 上清を廃棄し、T細胞刺激用の24ウェルプレートに55 μMのβ-メルカプトエタノール、50 ng/mLのホルボール12-ミリスチン酸13-酢酸(PMA)、および500 ng/mLのイオノマイシンを含む完全なRPMI-10培地に細胞を再懸濁します。
- 1時間後、10 μg/mLのブレフェルジンAと1000倍モネンシンを細胞懸濁液に加え、さらに5時間培養します。
- 細胞を回収し、蛍光活性化セルソーティング(FACS)バッファーで洗浄します。
- 500 × g で4°Cで5分間遠心し、上清を捨てます。
- 固定可能な死細胞染色色素で死細胞を染色し、4°Cで30分間インキュベートします。
- サンプルをFACSバッファーで洗浄し、500 × g で4°Cで5分間遠心します。
- 上清を捨て、蛍光色素標識表面マーカー抗体とFc受容体遮断薬で細胞を4°Cで30分間染色します。
- サンプルをFACSバッファーで洗浄し、500 × g で4°Cで5分間遠心します。
- 上清を廃棄し、ペレット化した細胞を固定および透過化溶液に4°Cで15〜20分間再懸濁して細胞内染色します。
- サンプルを1倍洗浄バッファーで洗浄し、500 × g で4°Cで5分間遠心します。
- 上清を捨て、4°Cで30分間細胞内サイトカイン染色を行います。
- サンプルを1x洗浄バッファーで洗浄し、500 x g で4°Cで5分間遠心します。
- 細胞を適切な容量(200-300μL)のFACSバッファーに再懸濁します。
- フローサイトメトリーを用いたタンパク質発現の解析
結果
ここでは、in vivoでの皮膚DC媒介Th17免疫応答の役割を研究するために、C.アルビカンスの皮内感染モデルを実証しました。C.アルビカンスをフットパッドに最初に皮内注射した後、皮膚を排出するLNが拡大しました(図2A)。感作期間中、CD4+とCD8+エフェクターT細胞の比率は著しく増加しました(図2B...
ディスカッション
この論文では、in vivoでのTh17免疫応答における皮膚DCの役割の研究を可能にする、皮内感染のC.アルビカンス感染の方法について説明します。DT誘導マウス系統を用いたマルチパラメトリックフローサイトメトリー解析を適用することにより、CD301b+経皮DCは、深部真皮C.アルビカンス感染に対するTh17免疫を開始するための重要な皮膚DCサブセ...
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
本研究は、延世大学医学部のサムジョン・ダリム学部研究助成(6-2019-0125)、教育部(2019R1A6A1A03032869)および科学情報通信技術部(2018R1A5A2025079、2019M3A9E8022135、2020R1C1C1014513)の資金提供を受けた大韓民国国立研究財団による基礎科学研究プログラム、および韓国疾病管理予防センター(KCDC, 2020-ER6714-00)。
資料
| Name | Company | Catalog Number | Comments |
| 0.3 mL (31 G) insulin syringe | BD | 328822 | |
| 1x Perm/Wash buffer | BD | 554723 | |
| 1 mL (30 G) syringe insulin syringe | BD | 328818 | |
| 24 well-plate | Falcon | 353047 | |
| 50 mL conical tube | Falcon | 50050 | |
| 70 μm strainer | Falcon | 352350 | |
| 70% ethanol | |||
| ABI StepOnePlus real-time PCR system | Applied Biosystems | ||
| Anesthesia chamber | Harvard Apparatus | ||
| Brefeldin A | BD | BD 555029 | |
| β-Mercaptoethanol | Gibco | 21985023 | |
| Candida albicans strain SC5314 | provided by Daniel Kaplan at Pittsburgh University | ||
| CD3 | BioLegend | 100216 | Clone 17A2 |
| CD301b-DTR mice | provided by Akiko Iwasaki at Yale University | ||
| CD4 | BioLegend | 100408 | Clone GK1.5 |
| CD44 | eBioscience | 47-0441-80 | Clone IM7 |
| CD8a | BD Biosciences | 553031 | Clone 53.6.7 |
| Centrifuge | |||
| Clicker counter | |||
| Cuvette | Kartell | KA.1938 | |
| Cytofix/Cytoperm solution | BD | 554722 | |
| Diphtheria toxin (DT) | Sigma | ||
| Dulbecco's phosphate-buffered saline (DPBS) | Welgene | LB001-02 | |
| FACS (Fluorescence-activated cell sorting) buffer | In-house | ||
| Fc receptor blocker | BD | 553142 | |
| Fetal bovine serum (FBS) | Welgene | S101-07 | |
| Forceps | Roboz | for harvesting sample | |
| Hemocytometer | Fisher Scientific | 267110 | |
| Hybrid-R total RNA kit | GeneAll Biotechnology | 305-101 | |
| hydroxyethyl piperazine ethane sulfonic acid (HEPES) | Gibco | 15630-080 | |
| IL-17A (intracellular cytokine) | BioLegend | 506912 | Clone TC11-18H10.1 |
| Ionomycin | Sigma | I0634 | |
| Isoflurane | |||
| Langerin-DTR | provided by Heung Kyu Lee at Korea Advanced Institute of Science and Technology | ||
| LIVE/DEAD Fixable Aqua Dead Cell Stain Kit | Invitrogen | L34957 | |
| Loop and Needle | SPL | 90010 | |
| Monensin | BD | BD554724 | |
| NanoDrop 2000 | Thermo Scientific | ||
| Penicillin | Gibco | 15140-122 | |
| Petri dish | SPL | 10090 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma | P8139 | |
| PrimeScript RT Master Mix | Takara Bio | RR360A | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scissors | Roboz | for harvesting sample | |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | |
| Sterile pipette tip | |||
| SYBR Green Premix Ex Taq II | Takara Bio | RR820A | |
| TCRβ | BioLegend | 109228 | Clone H57-597 |
| ThermoMixer C | Eppendorf | ||
| TissueLyser | QIAGEN | ||
| UV-VIS spectrophotometer | PerkinElmer | ||
| Wild-type C57BL/6 mice | Orient Bio | 7- to 9-week-old mice were used | |
| Yeast-peptone-dextrose-adenine (YPDA) medium, liquid, sterile (1% yeast extract, 2% Bacto peptone, 2% dextrose) | |||
| YPDA agar plate, sterile (1% yeast extract, 2% Bacto peptone, 2% dextrose, 2% Bacto agar) |
参考文献
- Nestle, F. O., Di Meglio, P., Qin, J. Z., Nickoloff, B. J. Skin immune sentinels in health and disease. Nature Reviews Immunology. 9 (10), 679-691 (2009).
- Bouwstra, J. A., Ponec, M. The skin barrier in healthy and diseased state. Biochimica et Biophysica Acta. 1758 (12), 2080-2095 (2006).
- Kabashima, K., Honda, T., Ginhoux, F., Egawa, G. The immunological anatomy of the skin. Nature Reviews Immunology. 19 (1), 19-30 (2019).
- Banchereau, J., et al. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Kashem, S. W., Haniffa, M., Kaplan, D. H. Antigen-presenting cells in the skin. Annual Review of Immunology. 35, 469-499 (2017).
- Kaplan, D. H. Ontogeny and function of murine epidermal Langerhans cells. Nature Immunology. 18 (10), 1068-1075 (2017).
- Kim, T. G., et al. Skin-specific CD301b(+) dermal dendritic cells drive IL-17-mediated psoriasis-like immune response in mice. Journal of Investigative Dermatology. 138 (4), 844-853 (2018).
- Durai, V., Murphy, K. M. Functions of murine dendritic cells. Immunity. 45 (4), 719-736 (2016).
- O'Shea, J. J., Paul, W. E. Mechanisms underlying lineage commitment and plasticity of helper CD4+ T cells. Science. 327 (5969), 1098-1102 (2010).
- Korn, T., Bettelli, E., Oukka, M., Kuchroo, V. K. IL-17 and Th17 cells. Annual Review of Immunology. 27, 485-517 (2009).
- Hernandez-Santos, N., Gaffen, S. L. Th17 cells in immunity to Candida albicans. Cell Host & Microbe. 11 (5), 425-435 (2012).
- Burstein, V. L., et al. IL-17-mediated immunity controls skin infection and T helper 1 response during experimental Microsporum canis dermatophytosis. Journal of Investivative Dermatology. 138 (8), 1744-1753 (2018).
- Sparber, F., et al. The skin commensal yeast Malassezia triggers a type 17 response that coordinates anti-fungal immunity and exacerbates skin inflammation. Cell Host & Microbe. 25 (3), 389-403 (2019).
- Igyarto, B. Z., et al. Skin-resident murine dendritic cell subsets promote distinct and opposing antigen-specific T helper cell responses. Immunity. 35 (2), 260-272 (2011).
- Santus, W., et al. Skin infections are eliminated by cooperation of the fibrinolytic and innate immune systems. Science Immunology. 2 (15), (2017).
- Kashem, S. W., et al. Candida albicans morphology and dendritic cell subsets determine T helper cell differentiation. Immunity. 42 (2), 356-366 (2015).
- Chen, H., Zhou, X., Ren, B., Cheng, L. The regulation of hyphae growth in Candida albicans. Virulence. 11 (1), 337-348 (2020).
- Santus, W., Mingozzi, F., Vai, M., Granucci, F., Zanoni, I. Deep dermal injection as a model of Candida albicans skin infection for histological analyses. Journal of Visualized Experiments: JoVE. (136), e57574 (2018).
- Villablanca, E. J., Mora, J. R. A two-step model for Langerhans cell migration to skin-draining LN. European Journal of Immunology. 38 (11), 2975-2980 (2008).
- Persson, E. K., et al. IRF4 transcription-factor-dependent CD103(+)CD11b(+) dendritic cells drive mucosal T helper 17 cell differentiation. Immunity. 38 (5), 958-969 (2013).
- Marcoux, D., et al. Deep cutaneous fungal infections in immunocompromised children. Journal of the American Academy of Dermatology. 61 (5), 857-864 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved