A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
in vivo תפקוד תת-קבוצות דיפרנציאליות של תאים דנדריטיים עוריים לגרימת חסינות Th17 בזיהום קנדידה אלביקנס תוך-עורי
In This Article
Summary
כאן, אנו מדגימים את התפקוד in vivo של תת-קבוצות של תאים דנדריטיים עוריים בחסינות Th17 של זיהום קנדידה אלביקנס עמוק בעור.
Abstract
העור הוא איבר המחסום החיצוני ביותר בגוף, המכיל מספר סוגים של תאים דנדריטיים (DCs), קבוצה של תאים מקצועיים המציגים אנטיגן. כאשר העור נתקל בפתוגנים פולשים, DCs עוריים שונים יוזמים תגובה חיסונית מובהקת של תאי T כדי להגן על הגוף. בין הפתוגנים הפולשים, זיהום פטרייתי מניע באופן ספציפי תגובה חיסונית מגנה של אינטרלוקין-17 המייצר Th17. פותח פרוטוקול להבדיל ביעילות תאי Th17 על ידי זיהום קנדידה אלביקנס תוך-עורי כדי לחקור תת-קבוצה של DCs עוריים האחראים להשראת חסינות Th17. ציטומטריית זרימה וניתוחי ביטוי גנים חשפו אינדוקציה בולטת של תגובה חיסונית Th17 בבלוטות לימפה המנקזות את העור ובעור נגוע. באמצעות זני עכברים המדלדלים תת-קבוצה של DC המושרים על ידי רעלן דיפתריה, נמצא כי DCs עוריים CD301b+ אחראים להרכבת התמיינות Th17 אופטימלית במודל זה. לפיכך, פרוטוקול זה מספק שיטה רבת ערך לחקר תפקוד in vivo של תת-קבוצות דיפרנציאליות של DCs עוריים כדי לקבוע חסינות Th17 מפני זיהום פטרייתי בעור עמוק.
Introduction
העור הוא איבר המחסום החיצוני ביותר, המגן על הגוף מפני פלישת פתוגנים וגירויים חיצוניים1. העור מורכב משתי שכבות נפרדות, כולל האפידרמיס - אפיתל מרובד של קרטינוציטים - והדרמיס הבסיסי - רשת צפופה של קולגן ורכיבים מבניים אחרים. כרקמת מחסום אפיתל ראשונית, העור מספק בעיקר מחסומים פיזיים ותורם למחסומים חיסוניים נוספים מכיוון שהוא מכיל תאים חיסוניים רבים 2,3. בין תאי החיסון העוריים, תאים דנדריטיים (DCs) הם סוג של תאים מקצועיים המציגים אנטיגן, הלוקחים באופן פעיל אנטיגנים עצמיים ולא עצמיים ונודדים לבלוטות הלימפה האזוריות (LNs) כדי ליזום תגובות וסבילות של תאי T ספציפיים לאנטיגן בהתאם לאופי האנטיגנים4.
העור מכיל תאים מציגי אנטיגן אפידרמיס, כלומר תאי לנגרהנס (LCs) ולפחות שני סוגים של DCs, כולל DCs קונבנציונליים עוריים מסוג 1 (cDC1) ו-DCs קונבנציונליים עוריים מסוג 2 (cDC2)5. LCs אפידרמיסיים הם ממקור מונוציטי עוברי ושומרים על מספר התאים שלהם על ידי הנצחה עצמית בתנאים הומאוסטטיים6. לעומת זאת, cDC1 ו-cDC2 עוריים הם ממקור תאי גזע המטופויאטיים ומתחדשים באופן רציף על ידי אבות המחויבים ל-DC5. DCs עוריים מאופיינים בסמני פני השטח שלהם, המחולקים באופן גס לאוכלוסיות Langerin+ (כולל LCs ו-cDC1) ו-CD11b+Langerin- אוכלוסיות (בעיקר cDC2). בנוסף, קבוצה זו חשפה כי אוכלוסיית CD11b+Langerin-DC מסווגת עוד יותר לשתי תת-קבוצות על פי ביטוי CD301b7.
המאפיינים התפקודיים החשובים של DCs עוריים מתרכזים בחלוקת עבודה, הנקבעת בעיקר על ידי האופי הפנימי של כל תת-קבוצה של DCs, מיקומים באתרם של DCs, מיקרו-סביבת הרקמה ורמזים דלקתיים מקומיים8. מאפיינים תפקודיים אלה של DCs עוריים מחייבים חקירה של תפקידן של תת-קבוצות ספציפיות של DCs במהלך סוגים מסוימים של תגובה חיסונית של העור. עם גירוי אנטיגני על ידי DCs עוריים ב-LNs המנקזים, תאי CD4+ T נאיביים מתמיינים לתת-קבוצות ספציפיות של תאי T עוזרים, המייצרים קבוצה של ציטוקינים מוגדרים להפעלת תפקוד האפקטור שלהם9. בין תת-הקבוצות של תאי T מסייעים CD4+, תאי Th17 המייצרים אינטרלוקין-17 (IL-17) ממלאים תפקיד מכריע במחלות אוטואימוניות וחסינות אנטי פטרייתית10. בהקשר זה, זיהום פטרייתי עורי היה מודל חזק לחקר חסינות Th17 in vivo 11,12,13. כאשר עורות מופשטים בסרט נחשפים באופן אפיעורי לשמרי קנדידה אלביקנס (C. albicans), LCs אפידרמיס ממלאים תפקיד מרכזי בהנעת התמיינות Th17 ספציפית לאנטיגן14.
חסינות מגנה מפני זיהום תוך-עורי של C. albicans דורשת חסינות מולדת כגון פעילות פיברינוליטית של פיברובלסטים ופגוציטים15. עם זאת, מעט ידוע על תפקידן של תת-קבוצות DC עוריות בביסוס חסינות Th17 בזיהום עמוק של C. albicans . מאמר זה מתאר שיטה של זיהום עור תוך עורי של C. albicans, המייצרת תגובות חיסוניות מקומיות ואזוריות של Th17. היישום של זני עכברים המושרים על ידי רעלן דיפתריה (DT) גילה כי DCs עוריים CD301b+ חיוניים לחסינות Th17 במודל זה. הגישה המתוארת כאן מאפשרת לחקור את תגובת Th17 לזיהום פטרייתי פולשני עמוק בעור.
Access restricted. Please log in or start a trial to view this content.
Protocol
הערה: כל הניסויים בבעלי חיים אושרו על ידי הוועדה לטיפול ושימוש בבעלי חיים של המוסד (IACUC, מזהה אישור: 2019-0056, 2019-0055). למחקר זה נעשה שימוש בעכברים נקבות C57BL/6 בנות שבעה עד 9 שבועות במשקל 18-24 גרם. חלק מהמחקרים בוצעו באמצעות נקבות קולטן רעלן לנגרין-דיפתריה (DTR) ועכברי CD301b-DTR באותו גיל ומשקל. ארבעה עד שישה עכברים שימשו בכל קבוצה לניסוי, והנתונים מייצגים שלושה ניסויים עצמאיים. עבודה זו בוצעה בתנאי בטיחות ביולוגית רמה 3, שיכולה להתבצע גם בתנאי בטיחות ביולוגית רמה 2 על פי הנחיות מוסדיות (טמפרטורת החדר 23 מעלות צלזיוס ± 3 מעלות צלזיוס, לחות 50% ±-10%).
1. הכנת קנדידה אלביקנס
הערה: הניסויים בחלק זה בוצעו בארון בטיחות ביולוגי.
- פס C. albicans מסנן את SC5314 על צלחת אגר שמרים-פפטון-דקסטרוז-אדנין (YPDA) באמצעות לולאת חיסון ומחט.
- דגרו את הצלחת הפוכה למשך יומיים בחום של 30 מעלות צלזיוס.
הערה: ניתן לאחסן את צלחת האגר YPDA עם C. albicans בטמפרטורה של 4 מעלות צלזיוס עד חודש. - בודד מושבה בודדת מהצלחת לחיסון ל-10 מ"ל של מדיום YPDA בצינור של 50 מ"ל באמצעות קצה פיפטה סטרילי.
- דגירה בטמפרטורה של 30 מעלות צלזיוס עם ניעור ב-230-250 סל"ד למשך ~17 שעות.
- הנח את מתלה השמרים בקובטה, ומדוד את הצפיפות האופטית (OD) ב-600 ננומטר כל 30 דקות באמצעות ספקטרופוטומטר UV-VIS עד שה-OD600 מגיע ל-1.5-2.0.
הערה: שלב זה עשוי להימשך 16-18 שעות. - סובב את מתלה השמרים בחום של 1000 × גרם למשך 5 דקות.
- השליכו את הסופרנטנט והשעו מחדש את תאי השמרים בכמות מתאימה של מי מלח סטריליים עם חוצץ פוספט (PBS).
- ספרו את תאי C. albicans באמצעות המוציטומטר וסובבו את התרחיף ב-1000 × גרם למשך 5 דקות.
- השליכו את הסופרנטנט, והשעו מחדש את תאי C. albicans ב-PBS לריכוז של 1 ×-107 תאים ב-40 מיקרוליטר של PBS לכל כרית כף הרגל.
- להכנת C. albicans הורג בחום (HK), הרגו את תאי השמרים על ידי חימום בטמפרטורה של 65 מעלות צלזיוס למשך 60 דקות באמצעות מערבל חימום לאחר קביעת מספר התא.
2. זיהום כרית כף הרגל של העכבר עם C. albicans
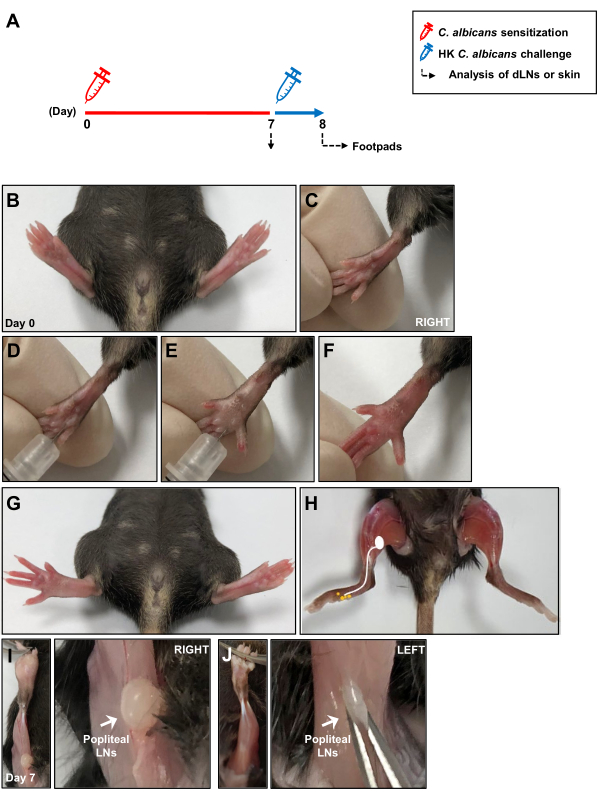
איור 1: דיאגרמה סכמטית של מודל זיהום קנדידה אלביקנס תוך עורי. (A) כריות כף הרגל האחוריות של עכברים הוזרקו תוך עורית עם 1 × 107 C. albicans. לאחר 7 ימים, כריות כף הרגל של עכברים נחשפו מחדש ל-1 ×10 7 HK C. albicans על ידי הזרקה תוך עורית, ותגובת רגישות היתר המושהית נמדדה 24 שעות לאחר אתגר האנטיגן. התגובה החיסונית המקומית במהלך רגישות ל-C. albicans נותחה לאחר 7 ימים ב-LNs מנקזים את העור. (B, C) תמונות של כריות כף הרגל לפני הזרקת כרית כף הרגל התוך-עורית עם C. albicans. (ד, ה) הזרקת C. albicans לדרמיס העמוק של כרית כף הרגל הימנית. (ו, ז) סימנים קליניים של אדמומיות ונפיחות בעקבות הזרקת כרית כף הרגל הימנית. (H) שרטוט שמראה מסלולי לימפה מכרית כף הרגל ל-LNs פופליטאליים לאחר הזרקת קלוסטרידיום אלביקנס . (I) LNs פופליטאליים חשופים הממוקמים מאחורי הברך 7 ימים לאחר הזרקת C. albicans ו-(J) ללא הזרקה. קיצורים: HK = נהרג בחום; LNs = בלוטות לימפה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- הרדמו את העכברים עם איזופלורן בתא אינדוקציה עד שלעכברים יש קצב נשימה איטי ואינם מראים תגובות נסיגה לצביטות בבוהן או בזנב.
הערה: במהלך ההרדמה, מומלץ להשתמש במשחת עיניים למניעת יובש בעיניים, במיוחד להרדמה הנמשכת יותר מ-5 דקות. - הסר את המכסה ממחט של 31 גרם, וטען את מזרק האינסולין של 0.3 מ"ל עם C. albicans המוכן משלב 1.9 לאחר ערבוב התאים.
- הסר את העכבר המורדם מתא האינדוקציה, והזריק בעדינות 40 מיקרוליטר מתאי השמרים (1 × 107 תאים ) לדרמיס העמוק של כרית כף הרגל הימנית לרגישות של C. albicans .
הערה: הנפח המרבי שניתן להזריק לכרית כף הרגל הוא 50 מיקרוליטר. - משוך את מחט המזרק לאט ממקום ההזרקה.
- הניחו כל עכבר לבד בכלוב עד להתאוששות מלאה מההרדמה ולאחר מכן החזירו אותו בבטחה לכלוב הביתי.
- כדי לפתח תגובה ספציפית לאנטיגן ל - C. albicans , אתגר את כרית כף הרגל הימנית של העכברים עם HK C. albicans המוכן באמצעות הזרקה תוך עורית 7 ימים לאחר הרגישות, כפי שתואר קודם לכן (1 × 107 תאים; 40 מיקרוליטר לכל כרית כף הרגל; חזור על שלבים 2.1-2.5).
- יש לקצור LNs מנקזים את העור 7 ימים לאחר רגישות ל-C. albicans או רקמות נגע בכף הרגל 24 שעות לאחר אתגר אנטיגן לאחר המתת חסד בתא CO2 .
3. דלדול תאים דנדריטיים הנגרמת על ידי רעלן דיפתריה in vivo
הערה: במחקר זה, גם עכברי Langerin-DTR וגם CD301b-DTR טופלו ב-DT יום אחד לפני ואחרי רגישות תוך עורית ל-C. albicans.
- הכן תמיסה של 10 מיקרוגרם/מ"ל של DT ב-PBS.
- הסר את המכסה מהמחט של מזרק אינסולין בנפח 1 מ"ל, ערבב את ה-DT ומלא את המזרק ב-DT.
- רסן כראוי את העכברים במצב ראש כלפי מטה.
- חיטוי הצד הגחוני של העכברים עם 70% אתנול.
- הזריק לאט לכל עכבר 100 מיקרוליטר של 1 מיקרוגרם DT תוך צפקי לרבע השמאלי התחתון של הבטן כדי לרוקן תת-קבוצות ספציפיות של תאים דנדריטיים.
הערה: היזהר לא לפגוע באיברים במהלך ההזרקה. - המתן 5 שניות; לאחר מכן, הסר לאט את המחט.
4. תגובת שרשרת פולימראז כמותית בזמן אמת
- הנח את העכבר בתא CO2 עד שלא נצפתה תנועת נשימה.
- חטאו את העכבר עם 70% אתנול, וחתכו את הנגע מעור כרית כף הרגל האחורית לחתיכות קטנות בעזרת מלקחיים ומספריים.
- טבלו לחלוטין את הרקמות החתוכות במגיב בידוד RNA.
- הומוגניזציה של הדגימות באמצעות הומוגנייזר רקמות בהתאם להוראות היצרן (2 מחזורים של 3 דקות ב-30 הרץ).
הערה: חרוזי נירוסטה שימשו לליזה של רקמות במחקר זה. - סובב ב-10,000 × גרם למשך 5 דקות, 4 מעלות צלזיוס.
- העבירו בזהירות את הסופרנטנט לצינור טרי.
- בודד את ה-RNA הכולל מהעור הנגעי באמצעות ערכת בידוד RNA מלאה.
- קבע את ריכוז ה-RNA באמצעות ספקטרופוטומטר UV-Vis.
- לסנתז cDNA באמצעות ערכת שעתוק הפוך לתגובת שרשרת פולימראז כמותית בזמן אמת (qPCR).
- בצע qPCR בזמן אמת עם מערכת ה-PCR בזמן אמת על ידי ניטור הסינתזה של DNA דו-גדילי במהלך מחזורי PCR באמצעות צבע פלואורסצנטי ירוק.
הערה: במחקר זה, התוצאות נורמלו לרמה של היפוקסנטין-גואנין פוספוריבוסילטרנספראז (Hprt). רצפי הפריימר מפורטים בטבלה 1, ופרוטוקול ה-PCR הוא כדלקמן: דנטורציה ראשונית ב-95 מעלות צלזיוס למשך 30 שניות, הגברה למשך 42 מחזורים (95 מעלות צלזיוס למשך 5 שניות, 60 מעלות צלזיוס למשך 30 שניות).
5. בידוד תאים וניתוח ציטומטרי זרימה
- לאחר המתת חסד של CO2 , נתחו את העכברים באמצעות מלקחיים ומספריים, חשפו בזהירות וקצרו את ה-LNs המנקזים את כרית כף הרגל הנקראים LNs פופליטאליים, הממוקמים מאחורי הברך.
- הכן תרחיפים חד-תאיים מה-LNs המנקזים את כרית הרגל של כל עכבר על ידי סינון הרקמות דרך מסננת של 70 מיקרומטר לאחר הומוגניזציה באמצעות הבוכנה של מזרק 3 מ"ל.
- שוטפים את התאים עם PBS וסובבים בחום של 500 × גרם למשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס.
- השליכו את הסופרנטנט ושטפו שוב את התאים עם PBS.
- יש לסובב בחום של 500 × גרם למשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס.
- השליכו את הסופרנטנט והשעו מחדש את התאים במדיום RPMI-10 שלם המכיל 55 מיקרומטר β-מרקפטואתנול, 50 ננוגרם/מ"ל פורבול 12-מיריסטאט 13-אצטט (PMA) ו-500 ננוגרם/מ"ל יונומיצין בצלחת 24 בארות לגירוי תאי T.
- לאחר שעה אחת, הוסף 10 מיקרוגרם/מ"ל של ברפלדין A ו-1000x מוננסין לתרחיף התא ולתרבית למשך 5 שעות נוספות.
- קצרו את התאים ושטפו אותם עם מאגר מיון תאים מופעל פלואורסצנטי (FACS).
- סובבו בחום של 500 × גרם למשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס והשליכו את הסופרנטנט.
- צבעו את התאים המתים בצבע מכתים תאים מתים הניתן לתיקון ודגרו למשך 30 דקות בטמפרטורה של 4 מעלות צלזיוס.
- שטפו את הדגימות עם מאגר FACS וסובבו אותן בטמפרטורה של 500 × גרם למשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס.
- השליכו את הסופרנטנט וצבעו את התאים בנוגדנים לסמן משטח מצומד פלואורוכרום וחוסם קולטן Fc למשך 30 דקות בטמפרטורה של 4 מעלות צלזיוס.
- שטפו את הדגימות עם מאגר FACS וסובבו אותן בחום של 500 × גרם למשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס.
- השליכו את הסופרנטנט והשעו מחדש את התאים הגלולים בתמיסת קיבוע וחדירות למשך 15-20 דקות בטמפרטורה של 4 מעלות צלזיוס לצביעה תוך תאית.
- שטפו את הדגימות עם מאגר כביסה 1x וסובבו אותן בחום של 500 × גרם למשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס.
- השליכו את הסופרנטנט ובצעו צביעת ציטוקינים תוך תאית למשך 30 דקות בטמפרטורה של 4 מעלות צלזיוס.
- שטפו את הדגימות עם מאגר כביסה 1x וסובבו ב-500 x גרם למשך 5 דקות ב-4 מעלות צלזיוס.
- השעו מחדש את התאים בנפח המתאים (200-300 מיקרוליטר) של מאגר FACS.
- לנתח את ביטוי החלבון באמצעות ציטומטריית זרימה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
כאן, הדגמנו מודל זיהום תוך עורי של C. albicans כדי לחקור את התפקיד של תגובה חיסונית Th17 עורית בתיווך DC in vivo. לאחר הזרקה ראשונית תוך עורית עם C. albicans לתוך כרית כף הרגל, ה-LNs המנקזים את העור הוגדלו (איור 2A). במהלך תקופת הרגישות, היחס בין תאי T אפקטור CD4+<...
Access restricted. Please log in or start a trial to view this content.
Discussion
מאמר זה מתאר שיטה לזיהום תוך-עורי של C. albicans המאפשרת לחקור את תפקידם של DCs עוריים בתגובה החיסונית Th17 in vivo. על ידי יישום ניתוח ציטומטרי זרימה רב-פרמטרי עם זני עכברים המושרים על ידי DT, מצאנו כי DCs עוריים CD301b+ הם תת-קבוצה עורית חיונית להתחלת חסינות Th17 כנגד זיהום ע...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
מחקר זה נתמך על ידי מענק מחקר של הפקולטה סמג'ונג-דאלים של המכללה לרפואה של אוניברסיטת יונסי (6-2019-0125), על ידי תוכנית מחקר מדעית בסיסית באמצעות קרן המחקר הלאומית של הרפובליקה של קוריאה במימון משרד החינוך (2019R1A6A1A03032869) ומשרד המדע וטכנולוגיית המידע והתקשורת (2018R1A5A2025079, 2019M3A9E8022135 ו-2020R1C1C1014513), ועל ידי המרכזים לבקרת מחלות ומניעתן בקוריאה (KCDC, 2020-ER6714-00).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.3 mL (31 G) insulin syringe | BD | 328822 | |
| 1x Perm/Wash buffer | BD | 554723 | |
| 1 mL (30 G) syringe insulin syringe | BD | 328818 | |
| 24 well-plate | Falcon | 353047 | |
| 50 mL conical tube | Falcon | 50050 | |
| 70 μm strainer | Falcon | 352350 | |
| 70% ethanol | |||
| ABI StepOnePlus real-time PCR system | Applied Biosystems | ||
| Anesthesia chamber | Harvard Apparatus | ||
| Brefeldin A | BD | BD 555029 | |
| β-Mercaptoethanol | Gibco | 21985023 | |
| Candida albicans strain SC5314 | provided by Daniel Kaplan at Pittsburgh University | ||
| CD3 | BioLegend | 100216 | Clone 17A2 |
| CD301b-DTR mice | provided by Akiko Iwasaki at Yale University | ||
| CD4 | BioLegend | 100408 | Clone GK1.5 |
| CD44 | eBioscience | 47-0441-80 | Clone IM7 |
| CD8a | BD Biosciences | 553031 | Clone 53.6.7 |
| Centrifuge | |||
| Clicker counter | |||
| Cuvette | Kartell | KA.1938 | |
| Cytofix/Cytoperm solution | BD | 554722 | |
| Diphtheria toxin (DT) | Sigma | ||
| Dulbecco's phosphate-buffered saline (DPBS) | Welgene | LB001-02 | |
| FACS (Fluorescence-activated cell sorting) buffer | In-house | ||
| Fc receptor blocker | BD | 553142 | |
| Fetal bovine serum (FBS) | Welgene | S101-07 | |
| Forceps | Roboz | for harvesting sample | |
| Hemocytometer | Fisher Scientific | 267110 | |
| Hybrid-R total RNA kit | GeneAll Biotechnology | 305-101 | |
| hydroxyethyl piperazine ethane sulfonic acid (HEPES) | Gibco | 15630-080 | |
| IL-17A (intracellular cytokine) | BioLegend | 506912 | Clone TC11-18H10.1 |
| Ionomycin | Sigma | I0634 | |
| Isoflurane | |||
| Langerin-DTR | provided by Heung Kyu Lee at Korea Advanced Institute of Science and Technology | ||
| LIVE/DEAD Fixable Aqua Dead Cell Stain Kit | Invitrogen | L34957 | |
| Loop and Needle | SPL | 90010 | |
| Monensin | BD | BD554724 | |
| NanoDrop 2000 | Thermo Scientific | ||
| Penicillin | Gibco | 15140-122 | |
| Petri dish | SPL | 10090 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma | P8139 | |
| PrimeScript RT Master Mix | Takara Bio | RR360A | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scissors | Roboz | for harvesting sample | |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | |
| Sterile pipette tip | |||
| SYBR Green Premix Ex Taq II | Takara Bio | RR820A | |
| TCRβ | BioLegend | 109228 | Clone H57-597 |
| ThermoMixer C | Eppendorf | ||
| TissueLyser | QIAGEN | ||
| UV-VIS spectrophotometer | PerkinElmer | ||
| Wild-type C57BL/6 mice | Orient Bio | 7- to 9-week-old mice were used | |
| Yeast-peptone-dextrose-adenine (YPDA) medium, liquid, sterile (1% yeast extract, 2% Bacto peptone, 2% dextrose) | |||
| YPDA agar plate, sterile (1% yeast extract, 2% Bacto peptone, 2% dextrose, 2% Bacto agar) |
References
- Nestle, F. O., Di Meglio, P., Qin, J. Z., Nickoloff, B. J. Skin immune sentinels in health and disease. Nature Reviews Immunology. 9 (10), 679-691 (2009).
- Bouwstra, J. A., Ponec, M. The skin barrier in healthy and diseased state. Biochimica et Biophysica Acta. 1758 (12), 2080-2095 (2006).
- Kabashima, K., Honda, T., Ginhoux, F., Egawa, G. The immunological anatomy of the skin. Nature Reviews Immunology. 19 (1), 19-30 (2019).
- Banchereau, J., et al. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Kashem, S. W., Haniffa, M., Kaplan, D. H. Antigen-presenting cells in the skin. Annual Review of Immunology. 35, 469-499 (2017).
- Kaplan, D. H. Ontogeny and function of murine epidermal Langerhans cells. Nature Immunology. 18 (10), 1068-1075 (2017).
- Kim, T. G., et al. Skin-specific CD301b(+) dermal dendritic cells drive IL-17-mediated psoriasis-like immune response in mice. Journal of Investigative Dermatology. 138 (4), 844-853 (2018).
- Durai, V., Murphy, K. M. Functions of murine dendritic cells. Immunity. 45 (4), 719-736 (2016).
- O'Shea, J. J., Paul, W. E. Mechanisms underlying lineage commitment and plasticity of helper CD4+ T cells. Science. 327 (5969), 1098-1102 (2010).
- Korn, T., Bettelli, E., Oukka, M., Kuchroo, V. K. IL-17 and Th17 cells. Annual Review of Immunology. 27, 485-517 (2009).
- Hernandez-Santos, N., Gaffen, S. L. Th17 cells in immunity to Candida albicans. Cell Host & Microbe. 11 (5), 425-435 (2012).
- Burstein, V. L., et al. IL-17-mediated immunity controls skin infection and T helper 1 response during experimental Microsporum canis dermatophytosis. Journal of Investivative Dermatology. 138 (8), 1744-1753 (2018).
- Sparber, F., et al. The skin commensal yeast Malassezia triggers a type 17 response that coordinates anti-fungal immunity and exacerbates skin inflammation. Cell Host & Microbe. 25 (3), 389-403 (2019).
- Igyarto, B. Z., et al. Skin-resident murine dendritic cell subsets promote distinct and opposing antigen-specific T helper cell responses. Immunity. 35 (2), 260-272 (2011).
- Santus, W., et al. Skin infections are eliminated by cooperation of the fibrinolytic and innate immune systems. Science Immunology. 2 (15), (2017).
- Kashem, S. W., et al. Candida albicans morphology and dendritic cell subsets determine T helper cell differentiation. Immunity. 42 (2), 356-366 (2015).
- Chen, H., Zhou, X., Ren, B., Cheng, L. The regulation of hyphae growth in Candida albicans. Virulence. 11 (1), 337-348 (2020).
- Santus, W., Mingozzi, F., Vai, M., Granucci, F., Zanoni, I. Deep dermal injection as a model of Candida albicans skin infection for histological analyses. Journal of Visualized Experiments: JoVE. (136), e57574(2018).
- Villablanca, E. J., Mora, J. R. A two-step model for Langerhans cell migration to skin-draining LN. European Journal of Immunology. 38 (11), 2975-2980 (2008).
- Persson, E. K., et al. IRF4 transcription-factor-dependent CD103(+)CD11b(+) dendritic cells drive mucosal T helper 17 cell differentiation. Immunity. 38 (5), 958-969 (2013).
- Marcoux, D., et al. Deep cutaneous fungal infections in immunocompromised children. Journal of the American Academy of Dermatology. 61 (5), 857-864 (2009).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved