Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İn vivo İntradermal Candida albicans Enfeksiyonunda Kutanöz Dendritik Hücrelerin Diferansiyel Alt Kümelerinin Th17 Bağışıklığını İndükleme İşlevi
Bu Makalede
Özet
Burada, derin dermal Candida albicans enfeksiyonunun Th17 bağışıklığında kutanöz dendritik hücre alt kümelerinin in vivo fonksiyonunu gösterdik.
Özet
Deri, bir grup profesyonel antijen sunan hücre olan çeşitli dendritik hücre (DC'ler) içeren vücudun en dıştaki bariyer organıdır. Cilt istilacı patojenlerle karşılaştığında, farklı kutanöz DC'ler vücudu korumak için farklı bir T hücresi bağışıklık tepkisi başlatır. İstilacı patojenler arasında, mantar enfeksiyonu özellikle koruyucu bir interlökin-17 üreten Th17 bağışıklık tepkisine neden olur. Th17 bağışıklığını indüklemekten sorumlu kutanöz DC'lerin bir alt kümesini araştırmak için Th17 hücrelerini intradermal Candida albicans enfeksiyonu ile etkili bir şekilde ayırt etmek için bir protokol geliştirilmiştir. Akım sitometrisi ve gen ekspresyon analizleri, cildi boşaltan lenf nodlarında ve enfekte ciltte Th17 immün yanıtının belirgin bir indüksiyonunu ortaya çıkardı. Difteri toksininin neden olduğu DC alt kümesini tüketen fare suşları kullanılarak, CD301b + dermal DC'lerin bu modelde optimal Th17 farklılaşmasının montajından sorumlu olduğu bulundu. Bu nedenle, bu protokol, derin deri mantar enfeksiyonuna karşı Th17 bağışıklığını belirlemek için kutanöz DC'lerin diferansiyel alt kümelerinin in vivo fonksiyonunu incelemek için değerli bir yöntem sağlar.
Giriş
Deri, vücudu istilacı dış patojenlerden ve uyaranlardan koruyan en dıştaki bariyer organıdır1. Deri, keratinositlerin tabakalı bir epiteli olan epidermis ve altta yatan dermis, yoğun bir kollajen ağı ve diğer yapısal bileşenler dahil olmak üzere iki ayrı katmandan oluşur. Birincil epitelyal bariyer dokusu olarak, cilt esas olarak fiziksel engeller sağlar ve çok sayıda yerleşik bağışıklık hücresi içerdiğinden ek immünolojik engellere katkıda bulunur 2,3. Kutanöz immün hücreler arasında, dendritik hücreler (DC'ler), aktif olarak kendi kendine ve öz olmayan antijenleri alan ve antijenlerin doğasına göre antijene özgü T hücresi yanıtlarını ve toleransını başlatmak için bölgesel lenf düğümlerine (LN'ler) göç eden bir tür profesyonel antijen sunan hücrelerdir4.
Deri, epidermal antijen sunan hücreleri, yani Langerhans hücrelerini (LC'ler) ve dermal tip 1 konvansiyonel DC'ler (cDC1) ve dermal tip 2 konvansiyonel DC'ler (cDC2) dahil olmak üzere en az iki tip DC'yi barındırır5. Epidermal LC'ler embriyonik monositik kökenlidir ve homeostatik koşullar altında kendi kendini devam ettirerek hücre sayılarını korurlar6. Buna karşılık, dermal cDC1 ve cDC2 hematopoietik kök hücre kökenlidir ve DC'ye bağlı progenitörler5 tarafından sürekli olarak yenilenir. Kutanöz DC'ler, kabaca Langerin+ (LC'ler ve cDC1 dahil) ve CD11b+Langerin- popülasyonlarına (esas olarak cDC2) ayrılan yüzey belirteçleri ile karakterize edilir. Ek olarak, bu grup CD11b+Langerin-DC popülasyonunun CD301b ekspresyon7'ye göre iki alt kümeye ayrıldığını ortaya koymuştur.
Kutanöz DC'lerin önemli fonksiyonel özellikleri, esas olarak DC'lerin her bir alt kümesinin içsel doğası, DC'lerin in situ konumları, doku mikroçevresi ve lokal inflamatuar ipuçları8 tarafından belirlenen bir iş bölümüne odaklanır. Kutanöz DC'lerin bu fonksiyonel özellikleri, cildin belirli immün yanıt tipleri sırasında DC'lerin spesifik alt kümelerinin rolünün araştırılmasını gerektirir. Drenaj LN'lerinde kutanöz DC'ler tarafından antijenik stimülasyon üzerine, saf CD4 + T hücreleri, efektörfonksiyonlarını 9 uygulamak için bir dizi tanımlanmış sitokin üreten yardımcı T hücrelerinin spesifik alt kümelerine farklılaşır. CD4 + yardımcı T hücresi alt kümeleri arasında, interlökin-17 (IL-17) üreten Th17 hücreleri, otoimmün hastalıklarda ve antifungal bağışıklıkta çok önemli bir rol oynar10. Bu bağlamda, kutanöz mantar enfeksiyonu, in vivo Th17 bağışıklığını incelemek için sağlam bir model olmuştur 11,12,13. Bantla soyulmuş deriler epikütan olarak Candida albicans (C. albicans) mayasına maruz kaldığında, epidermal LC'ler antijene özgü Th17 farklılaşmasının tetiklenmesinde çok önemli bir rol oynar14.
İntradermal C. albicans enfeksiyonuna karşı koruyucu bağışıklık, fibroblastların ve fagositlerin fibrinolitik aktivitesi gibi doğuştan gelen bağışıklık gerektirir15. Bununla birlikte, derin dermal C. albicans enfeksiyonunda Th17 bağışıklığının oluşturulmasında kutanöz DC alt kümelerinin rolü hakkında çok az şey bilinmektedir. Bu yazıda, lokal ve bölgesel Th17 immün yanıtları üreten C. albicans'ın intradermal deri enfeksiyonu yöntemi anlatılmaktadır. Difteri toksini (DT) ile indüklenen DC alt küme tükenmesi fare suşlarının uygulanması, CD301b + dermal DC'lerin bu modelde Th17 bağışıklığı için çok önemli olduğunu ortaya koydu. Burada açıklanan yaklaşım, derin dermal invaziv mantar enfeksiyonuna Th17 yanıtının incelenmesine izin verir.
Access restricted. Please log in or start a trial to view this content.
Protokol
NOT: Tüm hayvan deneyleri Kurum Hayvan Bakım ve Kullanım Komitesi tarafından onaylanmıştır (IACUC, Onay No: 2019-0056, 2019-0055). Bu çalışma için 18-24 g ağırlığında yedi ila 9 haftalık vahşi tip (WT) C57BL / 6 dişi fareler kullanıldı. Bazı çalışmalar, aynı yaş ve ağırlıktaki dişi Langerin-difteri toksin reseptörü (DTR) ve CD301b-DTR fareleri kullanılarak yapılmıştır. Bir deney için her grupta dört ila altı fare kullanıldı ve veriler üç bağımsız deneyi temsil ediyor. Bu çalışma, Biyogüvenlik Seviye 3 koşulları altında gerçekleştirilmiştir ve kurumsal yönergelere göre Biyogüvenlik Seviye 2 koşulları altında da gerçekleştirilebilir (oda sıcaklığı 23 °C ± 3 °C, nem %50 ± %10).
1. Candida albicans'ın hazırlanması
NOT: Bu bölümdeki deneyler biyolojik güvenlik kabininde gerçekleştirilmiştir.
- Streak C. albicans , SC5314'ü bir aşılama halkası ve iğne kullanarak bir maya-pepton-dekstroz-adenin (YPDA) agar plakasına süzer.
- Plakayı 30 °C'de 2 gün boyunca baş aşağı inkübe edin.
NOT: C. albicans içeren YPDA agar plakası 4 °C'de 1 aya kadar saklanabilir. - Steril bir pipet ucu kullanarak 50 mL'lik bir tüpte 10 mL YPDA ortamına aşılama için plakadan tek bir koloniyi izole edin.
- 30 °C'de 230-250 rpm'de ~17 saat çalkalayarak inkübe edin.
- Maya süspansiyonunu bir küvete yerleştirin ve OD 600 1.5-2.0'a ulaşana kadar bir UV-VIS spektrofotometre kullanarak her 30 dakikada bir600 nm'de optik yoğunluğu (OD) ölçün.
NOT: Bu adım 16-18 saat sürebilir. - Maya süspansiyonunu 1000 × g'da 5 dakika döndürün.
- Süpernatanı atın ve maya hücrelerini uygun miktarda steril fosfat tamponlu salin (PBS) içinde yeniden süspanse edin.
- Bir hemositometre kullanarak C. albicans hücrelerini sayın ve süspansiyonu 5 dakika boyunca 1000 × g'da döndürün.
- Süpernatanı atın ve PBS'deki C. albicans hücrelerini, ayak pedi başına 40 μL PBS'de 1 × 107 hücre konsantrasyonuna yeniden süspanse edin.
- Isıyla öldürülmüş (HK) C. albicans'ın hazırlanması için, hücre sayısını belirledikten sonra bir ısıtma karıştırıcısı kullanarak 65 °C'de 60 dakika ısıtarak maya hücrelerini öldürün.
2. C. albicans ile fare ayak pedi enfeksiyonu
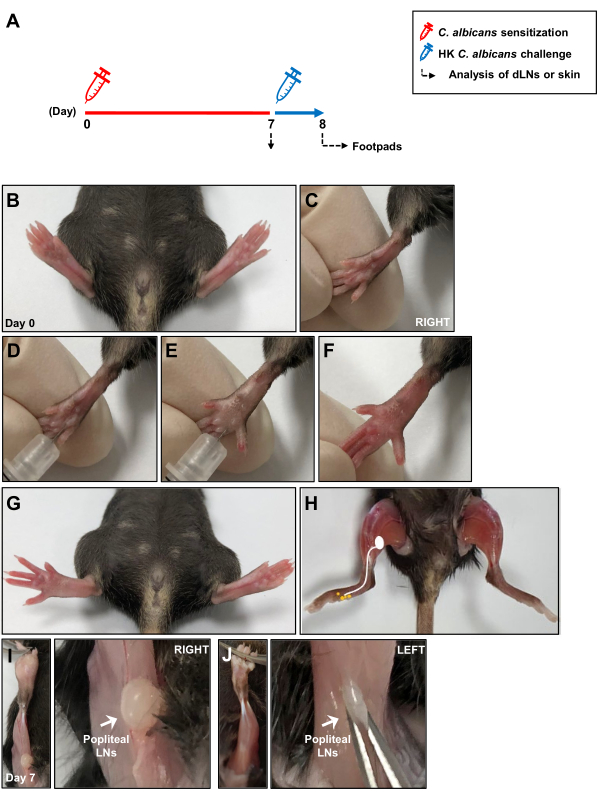
Şekil 1: İntradermal Candida albicans enfeksiyon modelinin şematik diyagramı. (A) Farelerin arka ayak tabanlarına 1 × 107 C. albicans ile intradermal olarak enjekte edildi. 7 gün sonra, farelerin ayak pedleri intradermal enjeksiyon ile 1 × 107 HK C. albicans'a yeniden maruz bırakıldı ve gecikmiş tip aşırı duyarlılık yanıtı antijen zorluğundan 24 saat sonra ölçüldü. C. albicans duyarlılığı sırasında lokal immün yanıt, cildi boşaltan LN'lerde 7 gün sonra analiz edildi. (B, C) C. albicans ile intradermal ayak tabanı enjeksiyonundan önce ayak tabanlarının görüntüleri.(D, E) C. albicans'ın sağ ayak tabanının derin dermisine enjeksiyonu. (F, G) Sağ ayak pedine ayak pedi enjeksiyonunu takiben kızarıklık ve şişlik klinik belirtileri. (H) C. albicans enjeksiyonunu takiben ayak tabanından popliteal LN'lere kadar lenfatik yolları gösteren bir eskiz. (I) C. albicans enjeksiyonundan 7 gün sonra diz arkasında bulunan ve (J) enjeksiyonsuz maruz kalan popliteal LN'ler. Kısaltmalar: HK = ısıyla öldürülmüş; LN'ler = lenf düğümleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Fareler yavaş bir solunum hızına sahip olana ve ayak parmağı veya kuyruk tutamaklarına geri çekilme tepkisi göstermeyene kadar fareleri bir indüksiyon odasında izofluran ile uyuşturun.
NOT: Anestezi sırasında, özellikle 5 dakikadan uzun süren anestezi için göz kuruluğunu önlemek için göz merhemi önerilir. - Kapağı 31 G'lik bir iğneden çıkarın ve hücreleri karıştırdıktan sonra 0.3 mL insülin şırıngasını 1.9. adımdan itibaren hazırlanan C. albicans ile yükleyin.
- Anestezi uygulanmış fareyi indüksiyon odasından çıkarın ve 40 μL maya hücrelerini (1 × 107 hücre) C. albicans duyarlılığı için sağ ayak tabanının derin dermisine nazikçe enjekte edin.
NOT: Bir ayak tabanına enjekte edilebilecek maksimum hacim 50 μL'dir. - Şırınga iğnesini enjeksiyon bölgesinden yavaşça çekin.
- Her fareyi anesteziden tamamen iyileşene kadar tek başına bir kafese koyun ve ardından güvenli bir şekilde ev kafesine geri koyun.
- Antijene özgü bir yanıt geliştirmek için C. albicans , daha önce tarif edildiği gibi, duyarlılıktan 7 gün sonra intradermal enjeksiyon yoluyla hazırlanan HK C. albicans ile farelerin sağ ayak tabanına meydan okuyun (1 × 107 hücre; ayak pedi başına 40 μL; 2.1-2.5 adımlarını tekrarlayın).
- Bir CO2 odasında ötenaziden sonra antijen uyarısından 24 saat sonra C. albicans duyarlılığından veya lezyonel ayak tabanı dokularından 7 gün sonra cildi boşaltan LN'leri hasat edin.
3. İn vivo difteri toksininin neden olduğu dendritik hücre tükenmesi
NOT: Bu çalışmada, hem Langerin-DTR hem de CD301b-DTR fareleri, C. albicans'a karşı intradermal sensitizasyondan 1 gün önce ve sonra DT ile tedavi edildi.
- PBS'de 10 μg / mL'lik bir DT çözeltisi hazırlayın.
- 1 mL'lik bir insülin şırıngasının iğnesinden kapağı çıkarın, DT'yi karıştırın ve şırıngayı DT ile doldurun.
- Fareleri baş aşağı pozisyonda uygun şekilde tutun.
- Farelerin ventral tarafını% 70 etanol ile dezenfekte edin.
- Spesifik dendritik hücre alt kümelerini tüketmek için her fareye 100 μL 1 μg DT intraperitoneal olarak karnın sol alt kadranına yavaşça enjekte edin.
NOT: Enjeksiyon sırasında organlara zarar vermemeye dikkat edin. - 5 saniye bekleyin; Ardından iğneyi yavaşça çıkarın.
4. Kantitatif gerçek zamanlı polimeraz zincir reaksiyonu
- Fareyi, solunum hareketi gözlenene kadar bir CO2 odasına yerleştirin.
- Fareyi% 70 etanol ile dezenfekte edin ve lezyonu arka ayak pedi derisinden forseps ve makas kullanarak küçük parçalar halinde kesin.
- Dilimlenmiş dokuları tamamen RNA izolasyon reaktifine daldırın.
- Numuneleri üreticinin talimatlarına göre bir doku homojenizatörü kullanarak homojenize edin (30 Hz'de 3 dakikalık 2 döngü).
NOT: Bu çalışmada doku lizisi için paslanmaz çelik boncuklar kullanılmıştır. - 10.000 × g'da 5 dakika, 4 °C döndürün.
- Süpernatanı dikkatlice yeni bir tüpe aktarın.
- Bir total RNA izolasyon kiti kullanarak lezyonel deriden total RNA'yı izole edin.
- Bir UV-Vis spektrofotometresi kullanarak RNA konsantrasyonunu belirleyin.
- Kantitatif gerçek zamanlı polimeraz zincir reaksiyonu (qPCR) için bir ters transkripsiyon kiti kullanarak cDNA'yı sentezleyin.
- Yeşil floresan boya kullanarak PCR döngüleri sırasında çift sarmallı DNA sentezini izleyerek gerçek zamanlı PCR sistemi ile gerçek zamanlı qPCR gerçekleştirin.
NOT: Bu çalışmada sonuçlar hipoksantin-guanin fosforibosiltransferaz (Hprt) seviyesine normalize edildi. Primer dizileri Tablo 1'de listelenmiştir ve PCR protokolü aşağıdaki gibidir: 30 saniye boyunca 95 ° C'de ilk denatürasyon, 42 döngü için amplifikasyon (5 saniye için 95 ° C, 30 saniye için 60 ° C).
5. Hücre izolasyonu ve akış sitometrik analizi
- CO2 ötenazisinden sonra, fareleri forseps ve makas kullanarak inceleyin, diz arkasında bulunan popliteal LN'ler olarak adlandırılan ayak tabanını boşaltan LN'leri dikkatlice açığa çıkarın ve hasat edin.
- 3 mL'lik bir şırınganın pistonu kullanılarak homojenizasyondan sonra dokuları 70 μm'lik bir süzgeçten süzerek her farenin ayak tabanını boşaltan LN'lerinden tek hücreli süspansiyonlar hazırlayın.
- Hücreleri PBS ile yıkayın ve 500 × g'da 4 ° C'de 5 dakika döndürün.
- Süpernatanı atın ve hücreleri tekrar PBS ile yıkayın.
- 500 × g'da 4 °C'de 5 dakika döndürün.
- Süpernatanı atın ve hücreleri, 55 μM β-merkaptoetanol, 50 ng / mL forbol 12-miristat 13-asetat (PMA) ve 500 ng / mL iyonomisin içeren tam RPMI-10 ortamında yeniden süspanse edin T hücresi stimülasyonu için 24 oyuklu bir plakada.
- 1 saat sonra, hücre süspansiyonuna 10 μg / mL brefeldin A ve 1000x monensin ekleyin ve 5 saat daha kültürleyin.
- Hücreleri hasat edin ve floresanla aktive edilen hücre sıralama (FACS) tamponu ile yıkayın.
- 500 × g'da 4 ° C'de 5 dakika döndürün ve süpernatanı atın.
- Ölü hücreleri sabitlenebilir bir ölü hücre boyama boyası ile boyayın ve 4 ° C'de 30 dakika inkübe edin.
- Numuneleri FACS tamponu ile yıkayın ve 500 × g'da 4 °C'de 5 dakika döndürün.
- Süpernatanı atın ve hücreleri florokrom konjuge yüzey işaretleyici antikorlar ve Fc reseptör blokeri ile 4 ° C'de 30 dakika boyunca boyayın.
- Numuneleri FACS tamponu ile yıkayın ve 500 × g'da 4 °C'de 5 dakika döndürün.
- Süpernatanı atın ve peletlenmiş hücreleri hücre içi boyama için 4 ° C'de 15-20 dakika boyunca fiksasyon ve geçirgenleştirme solüsyonunda yeniden süspanse edin.
- Numuneleri 1x yıkama tamponu ile yıkayın ve 500 × g'da 4 °C'de 5 dakika döndürün.
- Süpernatanı atın ve 4 ° C'de 30 dakika boyunca hücre içi sitokin boyaması yapın.
- Numuneleri 1x yıkama tamponu ile yıkayın ve 500 x g'da 4 °C'de 5 dakika döndürün.
- Hücreleri uygun hacimde (200-300 μL) FACS tamponunda yeniden süspanse edin.
- Akış sitometrisi kullanarak protein ekspresyonunu analiz edin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Burada, kutanöz DC aracılı Th17 immün yanıtının rolünü in vivo olarak incelemek için C. albicans'ın intradermal bir enfeksiyon modelini gösterdik. Ayak tabanına C. albicans ile ilk intradermal enjeksiyonu takiben, cildi boşaltan LN'ler genişledi (Şekil 2A). Duyarlılık periyodu sırasında, CD4 + 'nın CD8 + efektör T hücrelerine oranı önemli ölçüde artmıştır (Ş...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu yazıda, Th17 immün yanıtında kutanöz DC'lerin rolünün in vivo olarak incelenmesine izin veren bir intradermal C. albicans enfeksiyonu yöntemi tanımlanmıştır. DT ile indüklenen fare suşları ile multiparametrik akış sitometrik analizi uygulayarak, CD301b+ dermal DC'lerin derin dermal C. albicans enfeksiyonuna karşı Th17 bağışıklığını başlatmak için çok önemli bir kutanöz DC alt grubu olduğunu bulduk. Ayrıca, sonuçl...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu araştırma, Yonsei Üniversitesi Tıp Fakültesi'nin Samjung-Dalim Fakültesi araştırma bursu (6-2019-0125), Milli Eğitim Bakanlığı (2019R1A6A1A03032869) ve Bilim ve Bilgi ve İletişim Teknolojileri Bakanlığı (2018R1A5A2025079, 2019M3A9E8022135 ve 2020R1C1C1014513) tarafından finanse edilen Kore Cumhuriyeti Ulusal Araştırma Vakfı aracılığıyla bir Temel Bilim Araştırma Programı tarafından desteklenmiştir. 2020-ER6714-00).
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.3 mL (31 G) insulin syringe | BD | 328822 | |
| 1x Perm/Wash buffer | BD | 554723 | |
| 1 mL (30 G) syringe insulin syringe | BD | 328818 | |
| 24 well-plate | Falcon | 353047 | |
| 50 mL conical tube | Falcon | 50050 | |
| 70 μm strainer | Falcon | 352350 | |
| 70% ethanol | |||
| ABI StepOnePlus real-time PCR system | Applied Biosystems | ||
| Anesthesia chamber | Harvard Apparatus | ||
| Brefeldin A | BD | BD 555029 | |
| β-Mercaptoethanol | Gibco | 21985023 | |
| Candida albicans strain SC5314 | provided by Daniel Kaplan at Pittsburgh University | ||
| CD3 | BioLegend | 100216 | Clone 17A2 |
| CD301b-DTR mice | provided by Akiko Iwasaki at Yale University | ||
| CD4 | BioLegend | 100408 | Clone GK1.5 |
| CD44 | eBioscience | 47-0441-80 | Clone IM7 |
| CD8a | BD Biosciences | 553031 | Clone 53.6.7 |
| Centrifuge | |||
| Clicker counter | |||
| Cuvette | Kartell | KA.1938 | |
| Cytofix/Cytoperm solution | BD | 554722 | |
| Diphtheria toxin (DT) | Sigma | ||
| Dulbecco's phosphate-buffered saline (DPBS) | Welgene | LB001-02 | |
| FACS (Fluorescence-activated cell sorting) buffer | In-house | ||
| Fc receptor blocker | BD | 553142 | |
| Fetal bovine serum (FBS) | Welgene | S101-07 | |
| Forceps | Roboz | for harvesting sample | |
| Hemocytometer | Fisher Scientific | 267110 | |
| Hybrid-R total RNA kit | GeneAll Biotechnology | 305-101 | |
| hydroxyethyl piperazine ethane sulfonic acid (HEPES) | Gibco | 15630-080 | |
| IL-17A (intracellular cytokine) | BioLegend | 506912 | Clone TC11-18H10.1 |
| Ionomycin | Sigma | I0634 | |
| Isoflurane | |||
| Langerin-DTR | provided by Heung Kyu Lee at Korea Advanced Institute of Science and Technology | ||
| LIVE/DEAD Fixable Aqua Dead Cell Stain Kit | Invitrogen | L34957 | |
| Loop and Needle | SPL | 90010 | |
| Monensin | BD | BD554724 | |
| NanoDrop 2000 | Thermo Scientific | ||
| Penicillin | Gibco | 15140-122 | |
| Petri dish | SPL | 10090 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma | P8139 | |
| PrimeScript RT Master Mix | Takara Bio | RR360A | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scissors | Roboz | for harvesting sample | |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | |
| Sterile pipette tip | |||
| SYBR Green Premix Ex Taq II | Takara Bio | RR820A | |
| TCRβ | BioLegend | 109228 | Clone H57-597 |
| ThermoMixer C | Eppendorf | ||
| TissueLyser | QIAGEN | ||
| UV-VIS spectrophotometer | PerkinElmer | ||
| Wild-type C57BL/6 mice | Orient Bio | 7- to 9-week-old mice were used | |
| Yeast-peptone-dextrose-adenine (YPDA) medium, liquid, sterile (1% yeast extract, 2% Bacto peptone, 2% dextrose) | |||
| YPDA agar plate, sterile (1% yeast extract, 2% Bacto peptone, 2% dextrose, 2% Bacto agar) |
Referanslar
- Nestle, F. O., Di Meglio, P., Qin, J. Z., Nickoloff, B. J. Skin immune sentinels in health and disease. Nature Reviews Immunology. 9 (10), 679-691 (2009).
- Bouwstra, J. A., Ponec, M. The skin barrier in healthy and diseased state. Biochimica et Biophysica Acta. 1758 (12), 2080-2095 (2006).
- Kabashima, K., Honda, T., Ginhoux, F., Egawa, G. The immunological anatomy of the skin. Nature Reviews Immunology. 19 (1), 19-30 (2019).
- Banchereau, J., et al. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Kashem, S. W., Haniffa, M., Kaplan, D. H. Antigen-presenting cells in the skin. Annual Review of Immunology. 35, 469-499 (2017).
- Kaplan, D. H. Ontogeny and function of murine epidermal Langerhans cells. Nature Immunology. 18 (10), 1068-1075 (2017).
- Kim, T. G., et al. Skin-specific CD301b(+) dermal dendritic cells drive IL-17-mediated psoriasis-like immune response in mice. Journal of Investigative Dermatology. 138 (4), 844-853 (2018).
- Durai, V., Murphy, K. M. Functions of murine dendritic cells. Immunity. 45 (4), 719-736 (2016).
- O'Shea, J. J., Paul, W. E. Mechanisms underlying lineage commitment and plasticity of helper CD4+ T cells. Science. 327 (5969), 1098-1102 (2010).
- Korn, T., Bettelli, E., Oukka, M., Kuchroo, V. K. IL-17 and Th17 cells. Annual Review of Immunology. 27, 485-517 (2009).
- Hernandez-Santos, N., Gaffen, S. L. Th17 cells in immunity to Candida albicans. Cell Host & Microbe. 11 (5), 425-435 (2012).
- Burstein, V. L., et al. IL-17-mediated immunity controls skin infection and T helper 1 response during experimental Microsporum canis dermatophytosis. Journal of Investivative Dermatology. 138 (8), 1744-1753 (2018).
- Sparber, F., et al. The skin commensal yeast Malassezia triggers a type 17 response that coordinates anti-fungal immunity and exacerbates skin inflammation. Cell Host & Microbe. 25 (3), 389-403 (2019).
- Igyarto, B. Z., et al. Skin-resident murine dendritic cell subsets promote distinct and opposing antigen-specific T helper cell responses. Immunity. 35 (2), 260-272 (2011).
- Santus, W., et al. Skin infections are eliminated by cooperation of the fibrinolytic and innate immune systems. Science Immunology. 2 (15), (2017).
- Kashem, S. W., et al. Candida albicans morphology and dendritic cell subsets determine T helper cell differentiation. Immunity. 42 (2), 356-366 (2015).
- Chen, H., Zhou, X., Ren, B., Cheng, L. The regulation of hyphae growth in Candida albicans. Virulence. 11 (1), 337-348 (2020).
- Santus, W., Mingozzi, F., Vai, M., Granucci, F., Zanoni, I. Deep dermal injection as a model of Candida albicans skin infection for histological analyses. Journal of Visualized Experiments: JoVE. (136), e57574(2018).
- Villablanca, E. J., Mora, J. R. A two-step model for Langerhans cell migration to skin-draining LN. European Journal of Immunology. 38 (11), 2975-2980 (2008).
- Persson, E. K., et al. IRF4 transcription-factor-dependent CD103(+)CD11b(+) dendritic cells drive mucosal T helper 17 cell differentiation. Immunity. 38 (5), 958-969 (2013).
- Marcoux, D., et al. Deep cutaneous fungal infections in immunocompromised children. Journal of the American Academy of Dermatology. 61 (5), 857-864 (2009).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır