A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التقييم الكمي لكثرة الخلايا العصبية في الخلايا مفرطة النشاط mTORC1 باستخدام قياس التدفق الخلوي
In This Article
Summary
يوفر هذا البروتوكول أدوات تجريبية لتقييم امتصاص الخلايا الكبيرة للعناصر الغذائية (الكربوهيدرات والبروتين) بواسطة الخلايا مفرطة النشاط mTORC1. يتم وصف خطوات مفصلة لتحديد امتصاص ديكستران وألبومين مصل الأبقار (BSA) المسمى بالفلورسنت.
Abstract
كثرة الخلايا العصبية هي عملية داخلية محفوظة للغاية تعتمد على الأكتين تسمح بامتصاص المواد خارج الخلية ، بما في ذلك البروتينات والدهون. في الخلايا المتكاثرة ، يمكن أن يوصل كثرة الخلايا الكبيرة العناصر الغذائية خارج الخلية إلى الجسيم الليزومي ، ومعالجتها في اللبنات الأساسية للجزيئات الكبيرة. سلطت الدراسات الحديثة الضوء على اعتماد العديد من أنواع السرطان على كثرة الخلايا الكبيرة ، بما في ذلك سرطان الثدي والقولون والمستقيم والبنكرياس. يعتقد أن طفرات Ras هي الأحداث الدافعة وراء بدء كثرة الخلايا الكبيرة ، مما يؤدي إلى تنشيط العمليات الابتنائية الخلوية عبر مسار إشارات mTORC1. ومن المثير للاهتمام ، أن mTORC1 يمكن أيضا تنشيطه عن طريق كثرة الخلايا الكبيرة بشكل مستقل عن Ras. لذلك ، يمثل كثرة الخلايا الكبيرة ضعفا أيضيا يمكن الاستفادة منه لاستهداف أورام الخلايا الكبيرة عن طريق الحد من وصولها إلى العناصر الغذائية علاجيا.
في مركب التصلب الحدبي (TSC) والورم العضلي اللمفي (LAM) ، يؤدي فرط نشاط mTORC1 إلى تعزيز كثرة الخلايا الكبيرة وإعادة برمجة التمثيل الغذائي. هنا ، نصف بروتوكولا قائما على قياس التدفق الخلوي لتقييم كثرة الخلايا الكبيرة في خلايا الثدييات كميا. يتم استخدام MEFs التي تعاني من نقص TSC2 ، والتي تظهر تنشيطا شاذا ل mTORC1 وقد ثبت أنها زادت من كثرة الخلايا الكبيرة مقارنة بالخلايا التي تعبر عن TSC2. يتم تحضين الخلايا المعالجة بالمثبطات الدوائية لكثرة الخلايا الكبيرة بألبومين مصل الأبقار المسمى بالفلورسنت ، والقابل للتثبيت بالليسين ، أو 70 كيلو دالتون ديكستران ، أو ألبومين مصل الأبقار المسمى بالفلورسنت (BSA) الذي يتم فحصه بواسطة قياس التدفق الخلوي. حتى الآن ، تم تطوير تقنيات قوية قائمة على الصور لتقييم كمي كثرة الخلايا السرطانية في الخلايا السرطانية في المختبر وفي الجسم الحي. يوفر هذا التحليل تقييما كميا لكثرة الخلايا الكبيرة في ظروف تجريبية متعددة ويكمل التقنيات القائمة على الصور الحالية.
Introduction
كثرة الخلايا العصبية هي عملية داخلية مخصصة لامتصاص كميات كبيرة من المواد خارج الخلية متبوعا بتكوين الماكروبينوسومات ، إما المعاد تدويرها إلى غشاء البلازما أو الاندماج مع الجسيمات الحالة لتحلل الحمولة الداخلية1،2. على الرغم من أن امتصاص البضائع غير انتقائي ، إلا أن كثرة الخلايا الكبيرة هي عملية متعددة الخطوات ، يتم تنظيمها بإحكام بواسطة Rab GTPases و Membrane Phospholipids3،4. والجدير بالذكر أن الخلايا السرطانية تستخدم كثرة الخلايا الكبيرة لاستيعاب العناصر الغذائية خارج الخلية ، بما في ذلك البروتينات والسكريات والدهون. يتم تنشيط كثرة الخلايا السرطانية في الخلايا السرطانية بواسطة الجينات المسرطنة في اتجاه مجرى Ras أو v-Src كآلية لدعم تكاثرها ، خاصة في ظل ظروف إجهاد المغذيات5،6. لذلك ، يمثل كثرة الخلايا الكبيرة نهجا علاجيا جديدا لاستهداف الخلايا السرطانية عن طريق تعطيل مسارات امتصاص المغذيات7،8.
في مركب التصلب الحدبي (TSC) والورم العضلي اللمفي (LAM) ، يؤدي فقدان الطفرات الوظيفية في TSC1 أو TSC2 إلى فرط نشاط الهدف الثديي / الميكانيكي لمركب الرابامايسين 1 (mTORC1) 9. من المعروف أن تنشيط mTORC1 الشاذ يقود إعادة برمجة التمثيل الغذائي على نطاق واسع ، بما في ذلك امتصاص الجلوكوز والجلوتامين واستخدامه ، وتخليق الحمض النووي المعزز ، وتخليق الدهون ، والالتهام الذاتي10،11. للتعويض عن هذه المتطلبات الابتنائية المتزايدة ، تزيد الخلايا مفرطة النشاط mTORC1 من امتصاص العناصر الغذائية الخارجية عن طريق كثرة الخلايا الكبيرة وتعزز التحلل الليزوزومي للشحنة الداخلية12. في العمل الأخير ، حددنا الريتانسيرين ، وهو مثبط لثنائي الجلسرين كيناز ألفا (DGKA) كعامل يمنع بشكل انتقائي تكاثر الخلايا التي تعاني من نقص TSC2 13. DGKA هو كيناز دهني يعمل على استقلاب ثنائي الجلسرين إلى حمض الفوسفاتيديك (PA) 14. PA هو جزيء رسول ثان حاسم يلعب أيضا دورا حيويا في الحفاظ على توازن غشاء الخلية. من المثير للدهشة أن الريتانسيرين يثبط بقوة كثرة الخلايا الكبيرة عن طريق إعادة برمجة استقلاب الدهون الفوسفورية في الخلايا التي تعاني من نقص TSC2. لذلك ، فإن استهداف مسار امتصاص المغذيات لكثرة الخلايا الكبيرة في الخلايا التي تعاني من نقص TSC2 قد يوفر طرقا علاجية جديدة في TSC و LAM.
يمكن أن يوفر القياس الكمي لامتصاص الخلايا الكبيرة في المختبر وفي الجسم الحي رؤى مهمة حول تنظيم تكوين الماكروبينوسوم وتسريع اكتشاف الآليات الجزيئية مع تحديد الأساليب العلاجية الجديدة2،6. حتى الآن ، تم تطوير منهجيات متعددة تحدد بشكل كاف امتصاص الخلايا الكبيرة للديكستران الفلوري في المختبر وفي الجسم الحي2،15. نصف هنا نهجا قائما على قياس التدفق الخلوي لتقييم كمية الديكستران والألبومين الداخلي بشكل مباشر في الخلايا مفرطة النشاط mTORC1 (الشكل 1). يمكن استخدام هذه الطريقة لتحليل ظروف تجريبية متعددة بالتوازي وتكمل الأساليب القائمة على الصور الحالية.
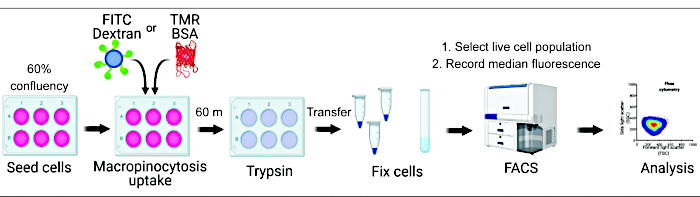
الشكل 1. سير العمل لتقييم كثرة الخلايا الكبيرة في خلايا الثدييات. يتم زرع الخلايا في صفائح من ستة آبار وتعالج لاحقا بمركبات ذات أهمية. يضاف ديكستران الفلورسنت أو BSA لمدة 60 دقيقة ، ويتم منع الامتصاص عن طريق الغسيل باستخدام PBS المثلج. يتم إصلاح الخلايا باستخدام بارافورمالدهايد ، ويتم قياس شدة التألق عن طريق قياس التدفق الخلوي. يتم تجميع الخلايا ، ويتم تحليل البيانات باستخدام البرنامج المناسب. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. علاج الخلايا
اليوم 1
- الخلايا الليفية الجنينية للفأر (MEFs) التي تعاني من نقص TSC2 وTSC2 في ثلاث نسخ ، في كل بئر من صفيحة زراعة الأنسجة المكونة من ستة آبار باستخدام DMEM ، مع استكمال 10٪ FBS. يجب أن تكون الخلايا متقاربة بنسبة 60-70٪ بحلول اليوم الثالث.
- بذور آبار تحكم إضافية لكل حالة دوائية لن يتم تلطيخها ب FITC-Dexterrn أو TMR-BSA.
اليوم 2
- اسحب الوسائط بعناية واشطف الخلايا مرتين باستخدام PBS في درجة حرارة الغرفة.
- عالج الخلايا بالمركبة (DMSO) ، 100 ميكرومتر من حمض الفوسفاتيديك (PA) ، 25 ميكرومتر من EIPA ، 10 ميكرومتر من الريتانسيرين ، أو مزيج من PA والريتانسيرين. استخدم DMEM المكمل بنسبة 1٪ FBS.
ملاحظة: يجب أن يساوي حجم DMSO الحد الأقصى لحجم المذيب المستخدم في ظروف المعالجة. على سبيل المثال ، إذا تم استخدام 10 ميكرولتر من EIPA ، فيجب أن يكون حجم DMSO في ظروف السيارة 10 ميكرولتر.
- عالج الخلايا بالمركبة (DMSO) ، 100 ميكرومتر من حمض الفوسفاتيديك (PA) ، 25 ميكرومتر من EIPA ، 10 ميكرومتر من الريتانسيرين ، أو مزيج من PA والريتانسيرين. استخدم DMEM المكمل بنسبة 1٪ FBS.
اليوم 3
- يستعاض عن الوسائط ب DMEM الخالي من المصل الذي يحتوي على الأدوية المذكورة أعلاه و 0.5 ملغم / مل من FITC-Dextrann أو 0.5 مجم / مل من TMR-BSA بعد 16 ساعة من العلاج. احتضان الخلايا في حاضنة ثقافة خلايا 37 درجة مئوية / 5٪ ثاني أكسيد الكربون2 لمدة 60 دقيقة.
ملاحظة: لتقليل التبييض الضوئي للفلوروفورات ، يجب لف أنابيب FITC-Dextern و TMR-BSA بورق الألمنيوم ويجب إجراء التجربة في خزانة زراعة الخلايا مع إطفاء الأضواء. - استنشق الوسائط واغسلها مرتين باستخدام PBS المثلج.
- افصل الخلايا باستخدام 500 ميكرولتر من التربسين. ضع الخلايا في حاضنة زراعة خلايا 37 درجة مئوية / 5٪ ثاني أكسيد الكربون2 لمدة 2-3 دقائق.
ملاحظة: تأكد من فصل جميع الخلايا عن طريق مراقبتها تحت مجهر المجال الساطع. - باستخدام طرف ماصة نظيف في كل مرة، اجمع الخلايا في أنابيب سعة 1.5 مل باستخدام 1٪ FBS المكمل ب DMEM على الجليد.
- خلايا الحبيبات عن طريق الطرد المركزي عند 425 × جم لمدة دقيقتين عند 4 درجات مئوية.
- شفط المادة الطافية.
- افصل الخلايا باستخدام 500 ميكرولتر من التربسين. ضع الخلايا في حاضنة زراعة خلايا 37 درجة مئوية / 5٪ ثاني أكسيد الكربون2 لمدة 2-3 دقائق.
- أعد تعليق حبيبات الخلية باستخدام 50 ميكرولتر من 2٪ بارافورمالدهايد.
تنبيه: بارافورمالدهيد شديد السمية ويجب التعامل معه تحت غطاء دخان مناسب. يجب التخلص من النفايات المحتوية على الفورمالديهايد وفقا للمبادئ التوجيهية المؤسسية.- احتضان الخلايا في درجة حرارة الغرفة لمدة 10 دقائق.
- أضف 1 مل من PBS المثلج إلى كل أنبوب وأعد تعليق حبيبات الخلية برفق. ضع الأنابيب على الجليد.
- خلايا الطرد المركزي عند 425 × جم لمدة دقيقتين عند 4 درجات مئوية.
- شفط المادة الطافية.
- أعد تعليق حبيبات الخلية في 300 ميكرولتر من PBS المثلج.
- نقل الخلايا إلى أنابيب FACS المناسبة على الجليد.
- استمر في قياس التدفق الخلوي.
2. قياس التدفق الخلوي
- قم بدوامة الخلايا لفترة وجيزة قبل إدخالها في حامل عينة FACS.
- باستخدام تدفق منخفض السرعة ، قم بتوصيل الخلايا الحية من كل عينة غير ملوثة (تحكم سلبي) باستخدام طاقة الليزر المناسبة كما هو موضح في الشكل 2 أ. تختلف هذه الخطوة بين الأدوات وستحتاج إلى تحسينها لكل تجربة. اضبط الطاقة لكل من التشتت الأمامي (FSC) والمبعثر الجانبي (SSC) بحيث تكون الخلايا الحية مختلفة عن الحطام أو مجموعات الخلايا.
- باستخدام ميزة autogate، حدد مجموعات الخلايا الحية لكل عينة لتجنب حطام الخلايا ومجموعات الخلايا.
ملاحظة: يتم تسجيل جميع أحداث الخلية (بغض النظر عن البوابة) في النهاية بواسطة مقياس الخلوي. لذلك فإن اختيار بوابة في هذه الخطوة ليس أمرا بالغ الأهمية. - سجل شدة التألق من كل عينة باستخدام الليزر الأخضر أو الأحمر المناسب.
3. تحليل قياس التدفق الخلوي
- خلايا البوابة باستخدام معلمات التشتت الأمامية والجانبية. تطبيق نفس البوابة على جميع العينات.
- قم بإنشاء الرسوم البيانية للتألق في كل عينة كما في الشكل 2 ب.
- داخل كل بوابة خلية ، احسب متوسط / متوسط شدة التألق لجميع العينات.
- تصدير البيانات للتحليل الإحصائي المناسب.
ملاحظة: أثناء تحليل البيانات ، يجب تطبيع متوسط / متوسط شدة التألق لكل عينة عن طريق طرح قيم العينة غير الملوثة.
النتائج
يمنع الريتانسيرين كثرة الخلايا الكبيرة في الخلايا التي تعاني من نقص TSC2
لقد أظهرنا سابقا أن امتصاص الخلايا الكبيرة للمغذيات يزداد بمقدار ثلاثة أضعاف في الخلايا التي تعاني من نقص TSC2 مقارنة بالخلايا التي تعبر عن TSC2 16
Discussion
هنا ، نصف نهجا كميا لتقييم كثرة الكثرة باستخدام قياس التدفق الخلوي. توفر هذه الطريقة قياسا دقيقا وسريعا لديكستران وألبومين البضائع الكبيرة المسمى بالفلورسنت. وصفت الدراسات السابقة بعناية مؤشر الخلايا الكبيرة للخلايا السرطانية باستخدام مناهج الفحص المجهري متحد البؤر
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
جائزة مؤسسة لام للتطوير الوظيفي. تم إنشاء الشكل 1 باستخدام BioRender.com. أجرت القراءة النقدية هيلير سي لام.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11965-092 | Growth media |
| EIPA (amiloride) | Sigma Aldrich | A3085 | Macropinocytosis inhibitor |
| FBS | R&D Systems | S11150 | Fetal Bovine Serum |
| FITC-Dextran | Invitrogen | D1822 | Fluorescent polysaccharide (70kDa) |
| Parafolmadehyde | Pierce | 28906 | Fixation agent |
| PBS | Gibco | 10010-023 | Phosphate Buffer Saline |
| Penicilin/Streptomycin | Sigma Aldrich | P4458-100ML | Cell culture antibiotics |
| Phosphatidic Acid | Avanti | 840101P | Phospholipid derived from egg |
| Ritanserin | Tocris | 1955 | DGKA inhibitor |
| TMR-BSA | Invitrogen | A23016 | Fluorescent albumin |
| Trypsin | Sigma Aldrich | 25300-054 | Dissociation agent |
References
- Yoshida, S., Pacitto, R., Inoki, K., Swanson, J. Macropinocytosis, mTORC1 and cellular growth control. Cellular and Molecular Life Sciences. 75 (7), 1227-1239 (2018).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Maxson, M. E., Sarantis, H., Volchuk, A., Brumell, J. H., Grinstein, S. Rab5 regulates macropinocytosis by recruiting the inositol 5-phosphatases OCRL/Inpp5b that hydrolyze PtdIns(4,5)P2. Journal of Cell Science. , (2021).
- Bohdanowicz, M., et al. Phosphatidic acid is required for the constitutive ruffling and macropinocytosis of phagocytes. Molecular Biology of the Cell. 24 (11), 1712 (2013).
- Ramirez, C., Hauser, A. D., Vucic, E. A., Bar-Sagi, D. Plasma membrane V-ATPase controls oncogenic RAS-induced macropinocytosis. Nature. 576 (7787), 477-481 (2019).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Kim, S. M., et al. Targeting cancer metabolism by simultaneously disrupting parallel nutrient access pathways. Journal of Clinical Investigation. 126 (11), 4088-4102 (2016).
- Selwan, E. M., Finicle, B. T., Kim, S. M., Edinger, A. L. Attacking the supply wagons to starve cancer cells to death. FEBS Letters. 590 (7), 885-907 (2016).
- Henske, E. P., Jozwiak, S., Kingswood, J. C., Sampson, J. R., Thiele, E. A. Tuberous sclerosis complex. Nature Reviews Disease Primers. 2, 16035 (2016).
- Duvel, K., et al. Activation of a metabolic gene regulatory network downstream of mTOR complex 1. Molecular Cell. 39 (2), 171-183 (2010).
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Choo, A. Y., et al. Glucose addiction of TSC null cells is caused by failed mTORC1-dependent balancing of metabolic demand with supply. Molecular Cell. 38 (4), 487-499 (2010).
- Kovalenko, A., et al. Therapeutic targeting of DGKA-mediated macropinocytosis leads to phospholipid reprogramming in Tuberous Sclerosis Complex. Cancer Research. , (2021).
- Swanson, J. A. Phorbol esters stimulate macropinocytosis and solute flow through macrophages. Journal of Cell Science. 94, 135-142 (1989).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Filippakis, H., et al. Vps34-mediated macropinocytosis in Tuberous Sclerosis Complex 2-deficient cells supports tumorigenesis. Scientific Reports. 8 (1), 14161 (2018).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biol Int. 39 (5), 531-539 (2015).
- Jachimska, B., Wasilewska, M., Adamczyk, Z. Characterization of globular protein solutions by dynamic light scattering, electrophoretic mobility, and viscosity measurements. Langmuir. 24 (13), 6866-6872 (2008).
- Armstrong, J. K., Wenby, R. B., Meiselman, H. J., Fisher, T. C. The hydrodynamic radii of macromolecules and their effect on red blood cell aggregation. Biophysical Journal. 87 (6), 4259-4270 (2004).
- Lee, S. W., Alas, B., Commisso, C. Detection and Quantification of Macropinosomes in Pancreatic Tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T. D., Kay, R. R. The physiological regulation of macropinocytosis during Dictyostelium growth and development. Journal of Cell Science. 131 (6), (2018).
- Koivusalo, M., et al. Amiloride inhibits macropinocytosis by lowering submembranous pH and preventing Rac1 and Cdc42 signaling. Journal of Cell Biology. 188 (4), 547-563 (2010).
- Ohkuma, S., Poole, B. Fluorescence probe measurement of the intralysosomal pH in living cells and the perturbation of pH by various agents. Proceedings of the National Academy of Sciences of the United States of America. 75 (7), 3327-3331 (1978).
- Murphy, R. F. Analysis and isolation of endocytic vesicles by flow cytometry and sorting: demonstration of three kinetically distinct compartments involved in fluid-phase endocytosis. Proceedings of the National Academy of Sciences of the United States of America. 82 (24), 8523-8526 (1985).
- Williams, T., Kay, R. R. High-throughput Measurement of Dictyostelium discoideum Macropinocytosis by Flow Cytometry. Journal of Visualized Experiments. (139), e58434 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved