È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Valutazione quantitativa della macropinocitosi in cellule iperattive mTORC1 mediante citometria a flusso
In questo articolo
Riepilogo
Questo protocollo fornisce strumenti sperimentali per valutare l'assorbimento macropinocitico di nutrienti (carboidrati e proteine) da parte delle cellule iperattive di mTORC1. Vengono descritti i passaggi dettagliati per quantificare l'assorbimento del destrano marcato in fluorescenza e dell'albumina sierica bovina (BSA).
Abstract
La macropinocitosi è un processo endocitico altamente conservato, dipendente dall'actina, che consente l'assorbimento di materiale extracellulare, comprese proteine e lipidi. Nelle cellule proliferanti, la macropinocitosi può fornire nutrienti extracellulari al lisosoma, trasformati in blocchi critici delle macromolecole. Studi recenti hanno evidenziato la dipendenza di più tumori dalla macropinocitosi, tra cui il cancro al seno, al colon-retto e al pancreas. Si ritiene che le mutazioni di Ras siano gli eventi driver dietro l'inizio della macropinocitosi, portando all'attivazione di processi anabolici cellulari attraverso la via di segnalazione mTORC1. È interessante notare che mTORC1 può anche essere attivato dalla macropinocitosi indipendentemente da Ras. Pertanto, la macropinocitosi rappresenta una vulnerabilità metabolica che può essere sfruttata per colpire i tumori macropinocitici limitando terapeuticamente il loro accesso ai nutrienti.
Nel complesso della sclerosi tuberosa (TSC) e nella linfangioleiomiomatosi (LAM), l'iperattivazione di mTORC1 porta a un aumento della macropinocitosi e della riprogrammazione metabolica. Qui, descriviamo un protocollo basato sulla citometria a flusso per valutare quantitativamente la macropinocitosi nelle cellule di mammifero. Vengono impiegati MEF carenti di TSC2, che mostrano un'attivazione aberrante di mTORC1 e hanno dimostrato di avere un aumento della macropinocitosi rispetto alle cellule che esprimono TSC2. Le cellule trattate con inibitori farmacologici della macropinocitosi vengono incubate con destrano (BSA) marcato in fluorescenza, fissabile con lisina, o albumina sierica bovina (BSA) marcata in fluorescenza, dosata mediante citometria a flusso. Ad oggi, sono state sviluppate solide tecniche basate su immagini per valutare quantitativamente la macropinocitosi nelle cellule tumorali in vitro e in vivo. Questa analisi fornisce una valutazione quantitativa della macropinocitosi in molteplici condizioni sperimentali e integra le tecniche esistenti basate su immagini.
Introduzione
La macropinocitosi è un processo endocitico dedicato all'assorbimento di massa di materiale extracellulare seguito dalla formazione di macropinosomi, riciclati nella membrana plasmatica o fusi con lisosomi per degradare il carico internalizzato 1,2. Sebbene l'assorbimento del carico non sia selettivo, la macropinocitosi è un processo a più fasi, strettamente regolato dalle GTPasi Rab e dai fosfolipidi di membrana 3,4. In particolare, le cellule tumorali impiegano la macropinocitosi per internalizzare i nutrienti extracellulari, tra cui proteine, polisaccaridi e lipidi. La macropinocitosi nelle cellule tumorali è attivata da oncogeni a valle di Ras o v-Src come meccanismo per supportare la loro proliferazione, specialmente in condizioni di stress nutrizionale 5,6. Pertanto, la macropinocitosi rappresenta un nuovo approccio terapeutico per colpire le cellule tumorali interrompendo le vie di assorbimento dei nutrienti 7,8.
Nel complesso della sclerosi tuberosa (TSC) e nella linfangioleiomiomatosi (LAM), la perdita di mutazioni funzionali in TSC1 o TSC2 porta all'iperattivazione del bersaglio mammifero/meccanicistico del complesso rapamicina 1 (mTORC1)9. È noto che l'attivazione aberrante di mTORC1 guida un'ampia riprogrammazione metabolica, tra cui l'assorbimento e l'utilizzo di glucosio e glutammina, l'aumento della sintesi degli acidi nucleici, la sintesi dei lipidi e l'autofagia10,11. Per compensare queste aumentate richieste anaboliche, le cellule iperattive di mTORC1 aumentano l'assorbimento di nutrienti esogeni attraverso la macropinocitosi e migliorano la degradazione lisosomiale del carico internalizzato12. In un recente lavoro, abbiamo identificato la ritanserina, un inibitore della diacilglicerolo chinasi alfa (DGKA) come un agente che inibisce selettivamente la proliferazione delle cellule carenti di TSC2 13. DGKA è una lipide chinasi che metabolizza il diacilglicerolo in acido fosfatidico (PA)14. PA è una seconda molecola messaggera cruciale che svolge anche un ruolo vitale nel mantenimento dell'omeostasi della membrana cellulare. Sorprendentemente, la ritanserina inibisce fortemente la macropinocitosi riprogrammando il metabolismo dei fosfolipidi nelle cellule carenti di TSC2. Pertanto, il targeting della via di assorbimento dei nutrienti della macropinocitosi nelle cellule carenti di TSC2 può fornire nuovi approcci terapeutici nella TSC e nella LAM.
La quantificazione dell'assorbimento dei macropinociti in vitro e in vivo può fornire informazioni cruciali sulla regolazione della formazione dei macropinosomi e accelerare la scoperta di meccanismi molecolari, identificando al contempo nuovi approcci terapeutici 2,6. Ad oggi, sono state sviluppate diverse metodologie che quantificano adeguatamente l'assorbimento macropinocitico del destrano fluorescente sia in vitro che in vivo 2,15. Qui descriviamo un approccio basato sulla citometria a flusso per valutare direttamente la quantità di destrano e albumina internalizzati nelle cellule iperattive di mTORC1 (Figura 1). Questo metodo può essere utilizzato per analizzare più condizioni sperimentali in parallelo e integra gli approcci basati su immagini esistenti.
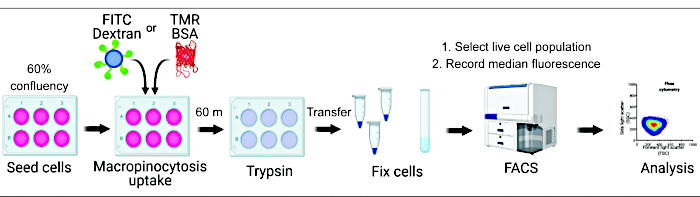
Figura 1. Flusso di lavoro per la valutazione della macropinocitosi in cellule di mammifero. Le cellule vengono seminate in piastre a sei pozzetti e successivamente trattate con composti di interesse. Il destrano fluorescente o il BSA vengono aggiunti per 60 minuti e l'assorbimento viene inibito dal lavaggio con PBS ghiacciato. Le cellule vengono fissate utilizzando paraformaldeide e l'intensità della fluorescenza viene quantificata mediante citometria a flusso. Le celle vengono gate e i dati vengono analizzati con il software appropriato. Clicca qui per visualizzare una versione più grande di questa figura.
Protocollo
1. Trattamento cellulare
Giorno 1
- Seme di fibroblasti embrionali di topo (MEF) carenti di TSC2 e TSC2 esprimenti in triplicato, in ciascun pozzetto di una piastra di coltura tissutale a sei pozzetti utilizzando DMEM, integrati con il 10% di FBS. Le cellule dovrebbero essere confluenti al 60-70% entro il giorno 3.
- Seminare pozzetti di controllo aggiuntivi per ogni condizione farmacologica che non saranno colorati con FITC-destrano o TMR-BSA.
Giorno 2
- Aspirare accuratamente il terreno e sciacquare le celle due volte con PBS a temperatura ambiente.
- Trattare le cellule con veicolo (DMSO), 100 μM di acido fosfatidico (PA), 25 μM di EIPA, 10 μM di ritanserina o una combinazione di PA e ritanserina. Utilizzare DMEM integrato con FBS all'1%.
NOTA: Il volume del DMSO deve essere uguale al volume massimo di solvente utilizzato nel trattamento delle condizioni. Ad esempio, se si utilizzano 10 μl di EIPA, anche il volume di DMSO nelle condizioni del veicolo dovrebbe essere di 10 μl.
- Trattare le cellule con veicolo (DMSO), 100 μM di acido fosfatidico (PA), 25 μM di EIPA, 10 μM di ritanserina o una combinazione di PA e ritanserina. Utilizzare DMEM integrato con FBS all'1%.
Giorno 3
- Sostituire i terreni con DMEM privo di siero contenente i farmaci sopra menzionati e 0,5 mg/mL di FITC-destrano o 0,5 mg/mL di TMR-BSA 16 ore dopo il trattamento. Incubare le cellule in un incubatore per colture cellulari a 37 °C/5% di CO2 per 60 minuti.
NOTA: Per ridurre al minimo il fotosbiancamento dei fluorofori, le provette FITC-Dextran e TMR-BSA devono essere avvolte in un foglio di alluminio e l'esperimento deve essere eseguito in una cella di coltura cellulare con le luci spente. - Aspirare il terreno e lavare due volte con PBS ghiacciato.
- Staccare le cellule utilizzando 500 μL di tripsina. Posizionare le cellule in un incubatore per colture cellulari a 37 °C/5% di CO2 per 2-3 minuti.
NOTA: Assicurarsi che tutte le cellule siano staccate osservandole al microscopio a campo chiaro. - Utilizzando ogni volta un puntale di pipetta pulito, raccogliere le cellule in provette da 1,5 mL utilizzando DMEM integrato con FBS all'1% su ghiaccio.
- Celle a pellet per centrifugazione a 425 x g per 2 min a 4 °C.
- Aspirare il surnatante.
- Staccare le cellule utilizzando 500 μL di tripsina. Posizionare le cellule in un incubatore per colture cellulari a 37 °C/5% di CO2 per 2-3 minuti.
- Risospendere il pellet cellulare utilizzando 50 μl di paraformaldeide al 2%.
ATTENZIONE: La paraformaldeide è altamente tossica e deve essere maneggiata sotto una cappa aspirante appropriata. I rifiuti contenenti formaldeide devono essere smaltiti secondo le linee guida istituzionali.- Incubare le cellule a temperatura ambiente per 10 minuti.
- Aggiungere 1 mL di PBS ghiacciato a ciascuna provetta e risospendere delicatamente il pellet cellulare. Metti i tubi sul ghiaccio.
- Centrifugare le celle a 425 x g per 2 min a 4 °C.
- Aspirare il surnatante.
- Pellet di cella di risospensione in 300 μL di PBS ghiacciato.
- Trasferire le cellule nelle apposite provette FACS su ghiaccio.
- Procedere con la citometria a flusso.
2. Citometria a flusso
- Agitare brevemente le celle prima di inserirle nel portacampioni FACS.
- Utilizzando un flusso a bassa velocità, estrarre cellule vive da ciascun campione non colorato (controllo negativo) utilizzando un'adeguata potenza laser, come mostrato nella Figura 2A. Questo passaggio varia da uno strumento all'altro e dovrà essere ottimizzato per ogni esperimento. Regolare la potenza sia per la diffusione diretta (FSC) che per la dispersione laterale (SSC) in modo che le cellule vive siano distinte dai detriti o dai gruppi di cellule.
- Utilizzando la funzione autogate, selezionare le popolazioni di cellule vive per ciascun campione evitando detriti cellulari e cluster cellulari.
NOTA: Tutti gli eventi cellulari (indipendentemente dal gating) vengono infine registrati dal citometro. Pertanto, la selezione di un cancello in questa fase non è fondamentale. - Registrare l'intensità della fluorescenza da ciascun campione utilizzando i laser verdi o rossi appropriati.
3. Analisi di citometria a flusso
- Gate delle celle utilizzando i parametri di dispersione diretta e laterale. Applicare lo stesso gate a tutti i campioni.
- Creare istogrammi per la fluorescenza in ciascun campione come nella Figura 2B.
- All'interno di ogni porta di cella calcolare l'intensità di fluorescenza media/mediana per tutti i campioni.
- Esporta i dati per un'analisi statistica appropriata.
NOTA: Durante l'analisi dei dati, l'intensità di fluorescenza media/mediana di ciascun campione deve essere normalizzata sottraendo i valori del campione non colorato.
Risultati
La ritanserina inibisce la macropinocitosi nelle cellule carenti di TSC2
Abbiamo precedentemente dimostrato che l'assorbimento macropinocitico dei nutrienti è aumentato di tre volte nelle cellule carenti di TSC2 rispetto alle cellule che esprimono TSC2 16. Nella TSC e nella LAM, la macropinocitosi è mediata dalla diacilglicerolo chinasi alfa (DGKA). Il prodotto metabolico della DGKA...
Discussione
Qui, descriviamo un approccio quantitativo per valutare la macropinocitosi utilizzando la citometria a flusso. Questo metodo fornisce una misurazione accurata e rapida del destrano e dell'albumina del carico macropinocitico marcati in fluorescenza. Studi precedenti hanno accuratamente caratterizzato l'indice macropinocitico delle cellule tumorali utilizzando approcci di microscopia confocale15,20. Sebbene questi metodi quantifich...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Il premio per lo sviluppo della carriera della Fondazione LAM. La Figura 1 è stata creata con BioRender.com. La lettura critica è stata eseguita da Hilaire C. Lam.
Materiali
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11965-092 | Growth media |
| EIPA (amiloride) | Sigma Aldrich | A3085 | Macropinocytosis inhibitor |
| FBS | R&D Systems | S11150 | Fetal Bovine Serum |
| FITC-Dextran | Invitrogen | D1822 | Fluorescent polysaccharide (70kDa) |
| Parafolmadehyde | Pierce | 28906 | Fixation agent |
| PBS | Gibco | 10010-023 | Phosphate Buffer Saline |
| Penicilin/Streptomycin | Sigma Aldrich | P4458-100ML | Cell culture antibiotics |
| Phosphatidic Acid | Avanti | 840101P | Phospholipid derived from egg |
| Ritanserin | Tocris | 1955 | DGKA inhibitor |
| TMR-BSA | Invitrogen | A23016 | Fluorescent albumin |
| Trypsin | Sigma Aldrich | 25300-054 | Dissociation agent |
Riferimenti
- Yoshida, S., Pacitto, R., Inoki, K., Swanson, J. Macropinocytosis, mTORC1 and cellular growth control. Cellular and Molecular Life Sciences. 75 (7), 1227-1239 (2018).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Maxson, M. E., Sarantis, H., Volchuk, A., Brumell, J. H., Grinstein, S. Rab5 regulates macropinocytosis by recruiting the inositol 5-phosphatases OCRL/Inpp5b that hydrolyze PtdIns(4,5)P2. Journal of Cell Science. , (2021).
- Bohdanowicz, M., et al. Phosphatidic acid is required for the constitutive ruffling and macropinocytosis of phagocytes. Molecular Biology of the Cell. 24 (11), 1712 (2013).
- Ramirez, C., Hauser, A. D., Vucic, E. A., Bar-Sagi, D. Plasma membrane V-ATPase controls oncogenic RAS-induced macropinocytosis. Nature. 576 (7787), 477-481 (2019).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Kim, S. M., et al. Targeting cancer metabolism by simultaneously disrupting parallel nutrient access pathways. Journal of Clinical Investigation. 126 (11), 4088-4102 (2016).
- Selwan, E. M., Finicle, B. T., Kim, S. M., Edinger, A. L. Attacking the supply wagons to starve cancer cells to death. FEBS Letters. 590 (7), 885-907 (2016).
- Henske, E. P., Jozwiak, S., Kingswood, J. C., Sampson, J. R., Thiele, E. A. Tuberous sclerosis complex. Nature Reviews Disease Primers. 2, 16035 (2016).
- Duvel, K., et al. Activation of a metabolic gene regulatory network downstream of mTOR complex 1. Molecular Cell. 39 (2), 171-183 (2010).
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Choo, A. Y., et al. Glucose addiction of TSC null cells is caused by failed mTORC1-dependent balancing of metabolic demand with supply. Molecular Cell. 38 (4), 487-499 (2010).
- Kovalenko, A., et al. Therapeutic targeting of DGKA-mediated macropinocytosis leads to phospholipid reprogramming in Tuberous Sclerosis Complex. Cancer Research. , (2021).
- Swanson, J. A. Phorbol esters stimulate macropinocytosis and solute flow through macrophages. Journal of Cell Science. 94, 135-142 (1989).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Filippakis, H., et al. Vps34-mediated macropinocytosis in Tuberous Sclerosis Complex 2-deficient cells supports tumorigenesis. Scientific Reports. 8 (1), 14161 (2018).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biol Int. 39 (5), 531-539 (2015).
- Jachimska, B., Wasilewska, M., Adamczyk, Z. Characterization of globular protein solutions by dynamic light scattering, electrophoretic mobility, and viscosity measurements. Langmuir. 24 (13), 6866-6872 (2008).
- Armstrong, J. K., Wenby, R. B., Meiselman, H. J., Fisher, T. C. The hydrodynamic radii of macromolecules and their effect on red blood cell aggregation. Biophysical Journal. 87 (6), 4259-4270 (2004).
- Lee, S. W., Alas, B., Commisso, C. Detection and Quantification of Macropinosomes in Pancreatic Tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T. D., Kay, R. R. The physiological regulation of macropinocytosis during Dictyostelium growth and development. Journal of Cell Science. 131 (6), (2018).
- Koivusalo, M., et al. Amiloride inhibits macropinocytosis by lowering submembranous pH and preventing Rac1 and Cdc42 signaling. Journal of Cell Biology. 188 (4), 547-563 (2010).
- Ohkuma, S., Poole, B. Fluorescence probe measurement of the intralysosomal pH in living cells and the perturbation of pH by various agents. Proceedings of the National Academy of Sciences of the United States of America. 75 (7), 3327-3331 (1978).
- Murphy, R. F. Analysis and isolation of endocytic vesicles by flow cytometry and sorting: demonstration of three kinetically distinct compartments involved in fluid-phase endocytosis. Proceedings of the National Academy of Sciences of the United States of America. 82 (24), 8523-8526 (1985).
- Williams, T., Kay, R. R. High-throughput Measurement of Dictyostelium discoideum Macropinocytosis by Flow Cytometry. Journal of Visualized Experiments. (139), e58434 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon