Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Quantitative Beurteilung der Macropinozytose in mTORC1-hyperaktiven Zellen mittels Durchflusszytometrie
In diesem Artikel
Zusammenfassung
Dieses Protokoll bietet experimentelle Werkzeuge zur Bewertung der makropinozytären Aufnahme von Nährstoffen (Kohlenhydrate und Proteine) durch mTORC1-hyperaktive Zellen. Detaillierte Schritte zur Quantifizierung der Aufnahme von fluoreszenzmarkiertem Dextran und Rinderserumalbumin (BSA) werden beschrieben.
Zusammenfassung
Die Macropinozytose ist ein hochkonservierter, aktinabhängiger endozytärer Prozess, der die Aufnahme von extrazellulärem Material, einschließlich Proteinen und Lipiden, ermöglicht. In proliferierenden Zellen kann die Makropinozytose extrazelluläre Nährstoffe an das Lysosom liefern, die zu kritischen Makromolekül-Bausteinen verarbeitet werden. Jüngste Studien haben die Abhängigkeit mehrerer Krebsarten von der Makropinozytose hervorgehoben, darunter Brust-, Darm- und Bauchspeicheldrüsenkrebs. Es wird angenommen, dass Ras-Mutationen die treibenden Kräfte hinter der Initiierung der Makropinozytose sind, die zur Aktivierung zellulärer anaboler Prozesse über den mTORC1-Signalweg führen. Interessanterweise kann mTORC1 auch unabhängig von Ras durch Makropinozytose aktiviert werden. Daher stellt die Makropinozytose eine metabolische Schwachstelle dar, die genutzt werden kann, um makropinozytäre Tumoren zu bekämpfen, indem ihr Zugang zu Nährstoffen therapeutisch eingeschränkt wird.
Beim tuberösen Sklerose-Komplex (TSC) und bei der Lymphangioleiomyomatose (LAM) führt die mTORC1-Hyperaktivierung zu einer verstärkten Makropinozytose und metabolischen Reprogrammierung. In dieser Arbeit beschreiben wir ein durchflusszytometrisches Protokoll zur quantitativen Beurteilung der Makropinozytose in Säugetierzellen. Es werden TSC2-defiziente MEFs verwendet, die eine aberrante Aktivierung von mTORC1 aufweisen und im Vergleich zu TSC2-exprimierenden Zellen eine erhöhte Makropinozytose aufweisen. Zellen, die mit pharmakologischen Inhibitoren der Makropinozytose behandelt werden, werden mit fluoreszenzmarkiertem, lysinfixierbarem, 70 kDa Dextran oder fluoreszenzmarkiertem Rinderserumalbumin (BSA) inkubiert, das durch Durchflusszytometrie untersucht wird. Bisher wurden robuste bildbasierte Techniken entwickelt, um die Makropinozytose in Tumorzellen in vitro und in vivo quantitativ zu beurteilen. Diese Analyse ermöglicht eine quantitative Beurteilung der Makropinozytose unter verschiedenen experimentellen Bedingungen und ergänzt bestehende bildbasierte Techniken.
Einleitung
Die Macropinozytose ist ein endozytärer Prozess, der sich der Massenaufnahme von extrazellulärem Material widmet, gefolgt von der Bildung von Makropinosomen, die entweder an die Plasmamembran zurückgeführt werden oder mit Lysosomen fusionieren, um die internalisierte Fracht abzubauen 1,2. Obwohl die Ladungsaufnahme nicht selektiv ist, ist die Makropinozytose ein mehrstufiger Prozess, der durch Rab-GTPasen und Membranphospholipide streng reguliert wird 3,4. Insbesondere Krebszellen nutzen die Makropinozytose, um extrazelluläre Nährstoffe wie Proteine, Polysaccharide und Lipide zu internalisieren. Die Macropinozytose in Krebszellen wird durch Onkogene stromabwärts von Ras oder v-Src als Mechanismus zur Unterstützung ihrer Proliferation aktiviert, insbesondere unter Nährstoffstressbedingungen 5,6. Daher stellt die Makropinozytose einen neuen therapeutischen Ansatz dar, um Krebszellen durch Unterbrechung der Nährstoffaufnahmewege zu bekämpfen 7,8.
Beim tuberösen Sklerose-Komplex (TSC) und der Lymphangioleiomyomatose (LAM) führt der Funktionsverlust von Mutationen in TSC1 oder TSC2 zu einer Hyperaktivierung des säugetierlichen/mechanistischen Ziels des Rapamycin-Komplexes 1 (mTORC1)9. Es ist bekannt, dass eine aberrante mTORC1-Aktivierung eine umfangreiche metabolische Reprogrammierung antreibt, einschließlich der Aufnahme und Verwertung von Glukose und Glutamin, einer verbesserten Nukleinsäuresynthese, Lipidsynthese und Autophagie10,11. Um diesen erhöhten anabolen Bedarf zu kompensieren, erhöhen mTORC1-hyperaktive Zellen die Aufnahme exogener Nährstoffe über die Makropinozytose und verstärken den lysosomalen Abbau der internalisierten Fracht12. In neueren Arbeiten haben wir Ritanserin, einen Inhibitor der Diacylglycerinkinase alpha (DGKA), als Wirkstoff identifiziert, der selektiv die Proliferation von TSC2-defizienten Zellen hemmt13. DGKA ist eine Lipidkinase, die Diacylglycerin zu Phosphatidsäure (PA)14 metabolisiert. PA ist ein wichtiges Botenstoffmolekül, das auch eine wichtige Rolle bei der Aufrechterhaltung der Homöostase der Zellmembran spielt. Überraschenderweise hemmt Ritanserin die Makropinozytose stark, indem es den Phospholipidstoffwechsel in TSC2-defizienten Zellen umprogrammiert. Daher könnte die Ausrichtung auf den Nährstoffaufnahmeweg der Makropinozytose in TSC2-defizienten Zellen neue therapeutische Ansätze bei TSC und LAM bieten.
Die Quantifizierung der makropinozytären Aufnahme in vitro und in vivo kann entscheidende Einblicke in die Regulation der Makropinosomenbildung liefern und die Entdeckung molekularer Mechanismen beschleunigen, während gleichzeitig neue therapeutische Ansätze identifiziertwerden 2,6. Bisher wurden mehrere Methoden entwickelt, die die makropinozytäre Aufnahme von Fluoreszenzdextran sowohl in vitro als auch in vivo angemessen quantifizieren 2,15. Hier beschreiben wir einen durchflusszytometrischen Ansatz, um die Menge an internalisiertem Dextran und Albumin in mTORC1-hyperaktiven Zellen direkt zu bestimmen (Abbildung 1). Diese Methode kann verwendet werden, um mehrere experimentelle Bedingungen parallel zu analysieren und ergänzt bestehende bildbasierte Ansätze.
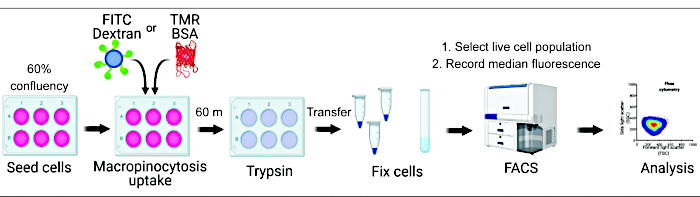
Abbildung 1. Arbeitsablauf zur Beurteilung der Makropinozytose in Säugetierzellen. Die Zellen werden in Sechs-Well-Platten ausgesät und anschließend mit interessanten Verbindungen behandelt. Fluoreszierendes Dextran oder BSA werden für 60 min zugegeben, und die Aufnahme wird durch das Waschen mit eiskaltem PBS gehemmt. Die Zellen werden mit Paraformaldehyd fixiert, und die Fluoreszenzintensität wird durch Durchflusszytometrie quantifiziert. Die Zellen werden mit einem Gated versehen und die Daten mit der entsprechenden Software analysiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Behandlung von Zellen
Tag 1
- Züchten Sie TSC2-defiziente und TSC2-exprimierende embryonale Fibroblasten (MEFs) der Maus in dreifacher Ausfertigung in jeder Vertiefung einer Sechs-Well-Gewebekulturplatte unter Verwendung von DMEM, ergänzt mit 10 % FBS. Die Zellen sollten an Tag 3 zu 60-70% konfluent sein.
- Säen Sie zusätzliche Kontrollvertiefungen für jede Arzneimittelerkrankung, die nicht mit FITC-Dextran oder TMR-BSA gefärbt wird.
Tag 2
- Saugen Sie das Medium vorsichtig an und spülen Sie die Zellen zweimal mit PBS bei Raumtemperatur.
- Behandeln Sie die Zellen mit Vehikel (DMSO), 100 μM Phosphatidsäure (PA), 25 μM EIPA, 10 μM Ritanserin oder einer Kombination aus PA und Ritanserin. Verwenden Sie DMEM, ergänzt mit 1% FBS.
HINWEIS: Das DMSO-Volumen sollte dem maximalen Volumen des Lösungsmittels entsprechen, das bei der Behandlung von Bedingungen verwendet wird. Wenn beispielsweise 10 μl EIPA verwendet werden, sollte das Volumen von DMSO unter Fahrzeugbedingungen ebenfalls 10 μl betragen.
- Behandeln Sie die Zellen mit Vehikel (DMSO), 100 μM Phosphatidsäure (PA), 25 μM EIPA, 10 μM Ritanserin oder einer Kombination aus PA und Ritanserin. Verwenden Sie DMEM, ergänzt mit 1% FBS.
Tag 3
- Ersetzen Sie das Medium durch serumfreies DMEM, das die oben genannten Arzneimittel und 0,5 mg/ml FITC-Dextran oder 0,5 mg/ml TMR-BSA 16 h nach der Behandlung enthält. Inkubieren Sie die Zellen in einem 37 °C/5% CO2 -Zellkultur-Inkubator für 60 Minuten.
HINWEIS: Um das Photobleichen der Fluorophore zu minimieren, sollten FITC-Dextran- und TMR-BSA-Röhrchen in Aluminiumfolie eingewickelt werden und das Experiment sollte in einem Zellkulturschrank bei ausgeschaltetem Licht durchgeführt werden. - Medien ansaugen und zweimal mit eiskaltem PBS waschen.
- Trennen Sie die Zellen mit 500 μl Trypsin. Legen Sie die Zellen für 2-3 Minuten in einen 37 °C/5 % CO2 -Zellkultur-Inkubator.
HINWEIS: Stellen Sie sicher, dass alle Zellen abgelöst sind, indem Sie sie unter einem Hellfeldmikroskop beobachten. - Sammeln Sie die Zellen jedes Mal mit einer sauberen Pipettenspitze in 1,5-ml-Röhrchen mit 1 % FBS-supplementiertem DMEM auf Eis.
- Pelletzellen durch Zentrifugation bei 425 x g für 2 min bei 4 °C.
- Aspirieren Sie den Überstand.
- Trennen Sie die Zellen mit 500 μl Trypsin. Legen Sie die Zellen für 2-3 Minuten in einen 37 °C/5 % CO2 -Zellkultur-Inkubator.
- Resuspendieren Sie das Zellpellet mit 50 μl 2 % Paraformaldehyd.
ACHTUNG: Paraformaldehyd ist hochgiftig und sollte unter einem geeigneten Abzug gehandhabt werden. Formaldehydhaltige Abfälle sollten gemäß den institutionellen Richtlinien entsorgt werden.- Inkubieren Sie die Zellen 10 Minuten lang bei Raumtemperatur.
- Geben Sie 1 ml eiskaltes PBS in jedes Röhrchen und resuspendieren Sie das Zellpellet vorsichtig. Lege die Röhren auf Eis.
- Zellen bei 425 x g für 2 min bei 4 °C zentrifugieren.
- Aspirieren Sie den Überstand.
- Resuspendieren Sie das Zellpellet in 300 μl eiskaltem PBS.
- Übertragen Sie die Zellen in die entsprechenden FACS-Röhrchen auf Eis.
- Fahren Sie mit der Durchflusszytometrie fort.
2. Durchflusszytometrie
- Wirbeln Sie die Zellen kurz ein, bevor Sie sie in den FACS-Probenhalter einsetzen.
- Bei Verwendung einer Strömung mit niedriger Geschwindigkeit werden lebende Zellen von jeder ungefärbten Probe (Negativkontrolle) mit geeigneter Laserleistung geschnappt, wie in Abbildung 2A zu sehen ist. Dieser Schritt ist je nach Gerät unterschiedlich und muss für jedes Experiment optimiert werden. Passen Sie die Leistung sowohl für die Vorwärtsstreuung (FSC) als auch für die Seitenstreuung (SSC) so an, dass lebende Zellen von Ablagerungen oder Zellclustern unterschieden werden.
- Wählen Sie mit der Autogate-Funktion die lebenden Zellpopulationen für jede Probe aus, um Zelltrümmer und Zellcluster zu vermeiden.
HINWEIS: Alle Zellereignisse (unabhängig vom Gating) werden letztendlich vom Zytometer aufgezeichnet. Daher ist die Auswahl eines Tores in diesem Schritt nicht kritisch. - Zeichnen Sie die Fluoreszenzintensität jeder Probe mit den entsprechenden grünen oder roten Lasern auf.
3. Durchflusszytometrische Analyse
- Gate-Zellen mit Vorwärts- und Seitenstreuparametern. Wenden Sie denselben Gate auf alle Proben an.
- Erstellen Sie Histogramme für die Fluoreszenz in jeder Probe wie in Abbildung 2B.
- Berechnen Sie in jedem Cell Gate die mittlere/mittlere Fluoreszenzintensität für alle Proben.
- Exportieren Sie Daten für eine geeignete statistische Analyse.
HINWEIS: Während der Datenanalyse sollte die mittlere/mittlere Fluoreszenzintensität jeder Probe durch Subtraktion der ungefärbten Probenwerte normalisiert werden.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Ritanserin hemmt die Makropinozytose in TSC2-defizienten Zellen
Wir haben bereits gezeigt, dass die makropinozytäre Aufnahme von Nährstoffen in TSC2-defizienten Zellen im Vergleich zu TSC2-exprimierenden Zellen um das Dreifache erhöht ist16. Bei TSC und LAM wird die Makropinozytose über die Diacylglycerinkinase alpha (DGKA) vermittelt. Das Stoffwechselprodukt von DGKA ist Phosphat...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Hier beschreiben wir einen quantitativen Ansatz zur Beurteilung der Makropinozytose mittels Durchflusszytometrie. Diese Methode ermöglicht eine genaue und schnelle Messung des fluoreszenzmarkierten makropinozytären Frachtdextrans und Albumins. Frühere Studien haben den makropinozytären Index von Krebszellen mit Hilfe der konfokalen Mikroskopie sorgfältig charakterisiert15,20. Obwohl diese Methoden die Internalisierung, Grö?...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Der LAM Foundation Career Development Award. Abbildung 1 wurde mit BioRender.com erstellt. Die kritische Lesung übernahm Hilaire C. Lam.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11965-092 | Growth media |
| EIPA (amiloride) | Sigma Aldrich | A3085 | Macropinocytosis inhibitor |
| FBS | R&D Systems | S11150 | Fetal Bovine Serum |
| FITC-Dextran | Invitrogen | D1822 | Fluorescent polysaccharide (70kDa) |
| Parafolmadehyde | Pierce | 28906 | Fixation agent |
| PBS | Gibco | 10010-023 | Phosphate Buffer Saline |
| Penicilin/Streptomycin | Sigma Aldrich | P4458-100ML | Cell culture antibiotics |
| Phosphatidic Acid | Avanti | 840101P | Phospholipid derived from egg |
| Ritanserin | Tocris | 1955 | DGKA inhibitor |
| TMR-BSA | Invitrogen | A23016 | Fluorescent albumin |
| Trypsin | Sigma Aldrich | 25300-054 | Dissociation agent |
Referenzen
- Yoshida, S., Pacitto, R., Inoki, K., Swanson, J. Macropinocytosis, mTORC1 and cellular growth control. Cellular and Molecular Life Sciences. 75 (7), 1227-1239 (2018).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Maxson, M. E., Sarantis, H., Volchuk, A., Brumell, J. H., Grinstein, S. Rab5 regulates macropinocytosis by recruiting the inositol 5-phosphatases OCRL/Inpp5b that hydrolyze PtdIns(4,5)P2. Journal of Cell Science. , (2021).
- Bohdanowicz, M., et al. Phosphatidic acid is required for the constitutive ruffling and macropinocytosis of phagocytes. Molecular Biology of the Cell. 24 (11), 1712(2013).
- Ramirez, C., Hauser, A. D., Vucic, E. A., Bar-Sagi, D. Plasma membrane V-ATPase controls oncogenic RAS-induced macropinocytosis. Nature. 576 (7787), 477-481 (2019).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Kim, S. M., et al. Targeting cancer metabolism by simultaneously disrupting parallel nutrient access pathways. Journal of Clinical Investigation. 126 (11), 4088-4102 (2016).
- Selwan, E. M., Finicle, B. T., Kim, S. M., Edinger, A. L. Attacking the supply wagons to starve cancer cells to death. FEBS Letters. 590 (7), 885-907 (2016).
- Henske, E. P., Jozwiak, S., Kingswood, J. C., Sampson, J. R., Thiele, E. A. Tuberous sclerosis complex. Nature Reviews Disease Primers. 2, 16035(2016).
- Duvel, K., et al. Activation of a metabolic gene regulatory network downstream of mTOR complex 1. Molecular Cell. 39 (2), 171-183 (2010).
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Choo, A. Y., et al. Glucose addiction of TSC null cells is caused by failed mTORC1-dependent balancing of metabolic demand with supply. Molecular Cell. 38 (4), 487-499 (2010).
- Kovalenko, A., et al. Therapeutic targeting of DGKA-mediated macropinocytosis leads to phospholipid reprogramming in Tuberous Sclerosis Complex. Cancer Research. , (2021).
- Swanson, J. A. Phorbol esters stimulate macropinocytosis and solute flow through macrophages. Journal of Cell Science. 94, Pt 1 135-142 (1989).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Filippakis, H., et al. Vps34-mediated macropinocytosis in Tuberous Sclerosis Complex 2-deficient cells supports tumorigenesis. Scientific Reports. 8 (1), 14161(2018).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biol Int. 39 (5), 531-539 (2015).
- Jachimska, B., Wasilewska, M., Adamczyk, Z. Characterization of globular protein solutions by dynamic light scattering, electrophoretic mobility, and viscosity measurements. Langmuir. 24 (13), 6866-6872 (2008).
- Armstrong, J. K., Wenby, R. B., Meiselman, H. J., Fisher, T. C. The hydrodynamic radii of macromolecules and their effect on red blood cell aggregation. Biophysical Journal. 87 (6), 4259-4270 (2004).
- Lee, S. W., Alas, B., Commisso, C. Detection and Quantification of Macropinosomes in Pancreatic Tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T. D., Kay, R. R. The physiological regulation of macropinocytosis during Dictyostelium growth and development. Journal of Cell Science. 131 (6), (2018).
- Koivusalo, M., et al. Amiloride inhibits macropinocytosis by lowering submembranous pH and preventing Rac1 and Cdc42 signaling. Journal of Cell Biology. 188 (4), 547-563 (2010).
- Ohkuma, S., Poole, B. Fluorescence probe measurement of the intralysosomal pH in living cells and the perturbation of pH by various agents. Proceedings of the National Academy of Sciences of the United States of America. 75 (7), 3327-3331 (1978).
- Murphy, R. F. Analysis and isolation of endocytic vesicles by flow cytometry and sorting: demonstration of three kinetically distinct compartments involved in fluid-phase endocytosis. Proceedings of the National Academy of Sciences of the United States of America. 82 (24), 8523-8526 (1985).
- Williams, T., Kay, R. R. High-throughput Measurement of Dictyostelium discoideum Macropinocytosis by Flow Cytometry. Journal of Visualized Experiments. (139), e58434(2018).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten