Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Количественная оценка макропиноцитоза в гиперактивных клетках mTORC1 с помощью проточной цитометрии
В этой статье
Резюме
Этот протокол предоставляет экспериментальные инструменты для оценки поглощения макропиноцитарных питательных веществ (углеводов и белков) гиперактивными клетками mTORC1. Подробно описаны шаги по количественной оценке поглощения флуоресцентно меченного декстрана и бычьего сывороточного альбумина (БСА).
Аннотация
Макропиноцитоз является высококонсервативным, актин-зависимым эндоцитарным процессом, который позволяет поглощать внеклеточный материал, включая белки и липиды. В пролиферирующих клетках макропиноцитоз может доставлять внеклеточные питательные вещества в лизосому, перерабатываемые в важнейшие строительные блоки макромолекул. Недавние исследования выявили зависимость множественных видов рака от макропиноцитоза, включая рак молочной железы, колоректальный рак и рак поджелудочной железы. Считается, что мутации Ras являются движущими событиями инициации макропиноцитоза, приводящими к активации клеточных анаболических процессов через сигнальный путь mTORC1. Интересно, что mTORC1 также может быть активирован путем макропиноцитоза независимо от Ras. Таким образом, макропиноцитоз представляет собой метаболическую уязвимость, которая может быть использована для нацеливания на макропиноцитарные опухоли путем ограничения их доступа к питательным веществам терапевтическим путем.
При комплексе туберозного склероза (ТСК) и лимфангиолейомиоматозе (ЛАМ) гиперактивация mTORC1 приводит к усилению макропиноцитоза и метаболическому перепрограммированию. В данной статье мы описываем основанный на проточной цитометрии протокол для количественной оценки макропиноцитоза в клетках млекопитающих. Используются TSC2-дефицитные MEF, которые демонстрируют аберрантную активацию mTORC1 и, как было показано, увеличивают макропиноцитоз по сравнению с клетками, экспрессирующими TSC2. Клетки, обработанные фармакологическими ингибиторами макропиноцитоза, инкубируют с флуоресцентно меченным, фиксируемым лизином, декстрана 70 кДа или флуоресцентно меченным бычьим сывороточным альбумином (БСА), анализируемым методом проточной цитометрии. На сегодняшний день разработаны надежные методы на основе изображений для количественной оценки макропиноцитоза в опухолевых клетках in vitro и in vivo. Этот анализ обеспечивает количественную оценку макропиноцитоза в различных экспериментальных условиях и дополняет существующие методы, основанные на изображениях.
Введение
Макропиноцитоз — это эндоцитарный процесс, направленный на массовое поглощение внеклеточного материала с последующим образованием макропиносом, либо перерабатываемых в плазматическую мембрану, либо сливающихся с лизосомами для разложения интернализованного груза 1,2. Несмотря на то, что поглощение груза является неселективным, макропиноцитоз является многоступенчатым процессом, жестко регулируемым Rab ГТФазами и мембранными фосфолипидами 3,4. Примечательно, что раковые клетки используют макропиноцитоз для усвоения внеклеточных питательных веществ, включая белки, полисахариды и липиды. Макропиноцитоз в раковых клетках активируется онкогенами, расположенными ниже по течению от Ras или v-Src, в качестве механизма поддержки их пролиферации, особенно в условиях нутриентного стресса 5,6. Таким образом, макропиноцитоз представляет собой новый терапевтический подход к нацеливанию на раковые клетки путем нарушения путей поглощения питательных веществ 7,8.
При комплексе туберозного склероза (ТСК) и лимфангиолейомиоматозе (ЛАМ) потеря функциональных мутаций в TSC1 или TSC2 приводит к гиперактивации млекопитающей/механистической мишени рапамицинового комплекса 1 (mTORC1)9. Известно, что аберрантная активация mTORC1 приводит к обширному метаболическому перепрограммированию, включая поглощение и утилизацию глюкозы и глутамина, усиленный синтез нуклеиновых кислот, синтез липидов и аутофагию10,11. Чтобы компенсировать эти повышенные анаболические потребности, гиперактивные клетки mTORC1 увеличивают поглощение экзогенных питательных веществ посредством макропиноцитоза и усиливают лизосомальную деградацию интернализованного груза. В недавней работе мы идентифицировали ритансерин, ингибитор диацилглицеролкиназы альфа (DGKA) как агент, который избирательно ингибирует пролиферацию клеток с дефицитом TSC2 13. DGKA — это липидкиназа, которая метаболизирует диацилглицерин в фосфатидную кислоту (PA)14. ПА является важнейшей молекулой-посредником, которая также играет жизненно важную роль в поддержании гомеостаза клеточной мембраны. Удивительно, но ритансерин сильно ингибирует макропиноцитоз, перепрограммируя метаболизм фосфолипидов в клетках с дефицитом TSC2. Таким образом, нацеливание на путь поглощения питательных веществ макропиноцитозом в клетках с дефицитом TSC2 может обеспечить новые терапевтические подходы при ТСК и ЛАМ.
Количественная оценка поглощения макропиноцитов in vitro и in vivo может дать решающее представление о регуляции образования макропиносом и ускорить открытие молекулярных механизмов при одновременном выявлении новых терапевтических подходов 2,6. На сегодняшний день разработано множество методологий, которые адекватно количественно оценивают макропиноцитарное поглощение флуоресцентного декстрана как in vitro, так и in vivo 2,15. Здесь мы описываем подход, основанный на проточной цитометрии, для прямой оценки количества интернализованного декстрана и альбумина в гиперактивных клетках mTORC1 (рис. 1). Этот метод может быть использован для параллельного анализа нескольких экспериментальных условий и дополняет существующие подходы, основанные на изображениях.
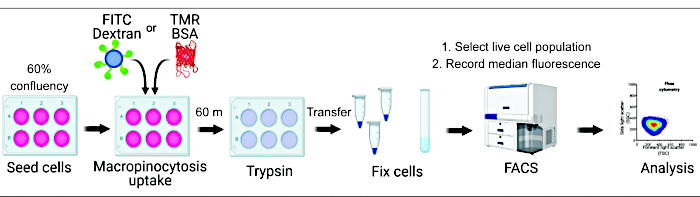
Рисунок 1. Схема работы по оценке макропиноцитоза в клетках млекопитающих. Клетки засеивают в шестилуночные планшеты и затем обрабатывают представляющими интерес соединениями. Флуоресцентный декстран или БСА добавляются в течение 60 минут, а их поглощение подавляется промыванием ледяным PBS. Клетки фиксируют с помощью параформальдегида, а интенсивность флуоресценции количественно оценивают с помощью проточной цитометрии. Ячейки закрыты, а данные анализируются с помощью соответствующего программного обеспечения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
протокол
1. Клеточная обработка
День 1
- Затравите TSC2-дефицитные и TSC2-экспрессирующие эмбриональные фибробласты (MEF) мышей в трех экземплярах, в каждой лунке шестилуночного планшета для культивирования тканей с использованием DMEM, с добавлением 10% FBS. К 3-му дню клетки должны быть слиты на 60-70%.
- Засейте дополнительные контрольные лунки для каждого состояния препарата, который не будет окрашен FITC-Dextan или TMR-BSA.
День 2
- Тщательно отсадите среду и дважды промойте клетки PBS при комнатной температуре.
- Обрабатывайте клетки носителем (ДМСО), 100 мкМ фосфатидной кислоты (ПА), 25 мкМ ЭЙПА, 10 мкМ ритансерина или комбинацией ПА и ритансерина. Используйте DMEM с добавлением 1% FBS.
ПРИМЕЧАНИЕ: Объем ДМСО должен быть равен максимальному объему растворителя, используемого в условиях обработки. Например, если используется 10 мкл EIPA, то объем ДМСО в условиях автомобиля также должен составлять 10 мкл.
- Обрабатывайте клетки носителем (ДМСО), 100 мкМ фосфатидной кислоты (ПА), 25 мкМ ЭЙПА, 10 мкМ ритансерина или комбинацией ПА и ритансерина. Используйте DMEM с добавлением 1% FBS.
День 3
- Замените среды бессывороточными DMEM, содержащими вышеупомянутые препараты и 0,5 мг/мл FITC-Dextan или 0,5 мг/мл TMR-BSA через 16 ч после процедуры. Инкубируйте клетки в инкубаторе для клеточных культур с температурой 37 °C / 5%CO2 в течение 60 минут.
Примечание: Чтобы свести к минимуму фотообесцвечивание флуорофоров, пробирки FITC-Dextran и TMR-BSA следует обернуть алюминиевой фольгой, а эксперимент проводить в шкафу для клеточных культур с выключенным светом. - Асасируйте среду и дважды промывайтесь ледяным PBS.
- Отделите клетки с помощью 500 мкл трипсина. Поместите клетки в инкубатор для клеточных культур с температурой 37 °C/5% CO2 на 2-3 минуты.
ПРИМЕЧАНИЕ: Убедитесь, что все клетки отделены, наблюдая за ними под светлопольным микроскопом. - Каждый раз используя чистый наконечник для пипетки, соберите клетки в пробирки объемом 1,5 мл с помощью 1% FBS DMEM на льду.
- Пеллетные ячейки путем центрифугирования при 425 x g в течение 2 мин при 4 °C.
- Аспирируйте надосадочную жидкость.
- Отделите клетки с помощью 500 мкл трипсина. Поместите клетки в инкубатор для клеточных культур с температурой 37 °C/5% CO2 на 2-3 минуты.
- Ресуспендируйте клеточную гранулу с использованием 50 мкл 2% параформальдегида.
ВНИМАНИЕ: Параформальдегид очень токсичен и должен обрабатываться в соответствующем вытяжном шкафу. Отходы, содержащие формальдегид, следует утилизировать в соответствии с руководящими принципами учреждения.- Инкубировать клетки при комнатной температуре в течение 10 мин.
- Добавьте 1 мл ледяного PBS в каждую пробирку и осторожно ресуспендируйте клеточную гранулу. Поместите трубки на лед.
- Центрифугируйте ячейки при давлении 425 x g в течение 2 мин при 4 °C.
- Аспирируйте надосадочную жидкость.
- Ресуспендируйте клеточную гранулу в 300 мкл ледяного PBS.
- Перенесите ячейки в соответствующие трубки FACS на льду.
- Приступайте к проточной цитометрии.
2. Проточная цитометрия
- Кратковременно сделайте вихревую обработку клеток перед тем, как вставить их в держатель образцов FACS.
- Используя низкоскоростной поток, забирайте живые клетки из каждого неокрашенного образца (отрицательный контроль) с использованием соответствующей мощности лазера, как показано на рисунке 2A. Этот шаг отличается в зависимости от прибора и должен быть оптимизирован для каждого эксперимента. Отрегулируйте мощность как для прямого рассеяния (FSC), так и для бокового рассеяния (SSC) так, чтобы живые клетки отличались от мусора или кластеров клеток.
- Используя функцию автогейта, выберите популяции живых клеток для каждого образца, избегая клеточного мусора и кластеров клеток.
Примечание: Все клеточные события (независимо от стробирования) в конечном итоге регистрируются цитометром. Поэтому выбор строба на этом этапе не является критичным. - Запишите интенсивность флуоресценции каждого образца с помощью соответствующих зеленых или красных лазеров.
3. Анализ проточной цитометрии
- Ячейки затвора с использованием параметров прямого и бокового рассеяния. Примените один и тот же затвор ко всем образцам.
- Создайте гистограммы для флуоресценции в каждом образце, как показано на рисунке 2B.
- В пределах каждого клеточного затвора рассчитайте среднюю/медианную интенсивность флуоресценции для всех образцов.
- Экспортируйте данные для соответствующего статистического анализа.
ПРИМЕЧАНИЕ: Во время анализа данных средняя/медианная интенсивность флуоресценции каждого образца должна быть нормализована путем вычитания неокрашенных значений образца.
Результаты
Ритансерин ингибирует макропиноцитоз в клетках с дефицитом TSC2
Ранее мы показали, что макропиноцитарное поглощение питательных веществ увеличивается в три раза в клетках с дефицитом TSC2 по сравнению с клетками, экспрессирующими ...
Обсуждение
В данной статье мы описываем количественный подход к оценке макропиноцитоза с помощью проточной цитометрии. Этот метод обеспечивает точное и быстрое измерение флуоресцентно меченного макропиноцитарного грузового декстрана и альбумина. В предыдущих исследованиях ?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Премия LAM Foundation за развитие карьеры. Рисунок 1 был создан с помощью BioRender.com. Критическое чтение было выполнено Хилэром К. Ламом.
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11965-092 | Growth media |
| EIPA (amiloride) | Sigma Aldrich | A3085 | Macropinocytosis inhibitor |
| FBS | R&D Systems | S11150 | Fetal Bovine Serum |
| FITC-Dextran | Invitrogen | D1822 | Fluorescent polysaccharide (70kDa) |
| Parafolmadehyde | Pierce | 28906 | Fixation agent |
| PBS | Gibco | 10010-023 | Phosphate Buffer Saline |
| Penicilin/Streptomycin | Sigma Aldrich | P4458-100ML | Cell culture antibiotics |
| Phosphatidic Acid | Avanti | 840101P | Phospholipid derived from egg |
| Ritanserin | Tocris | 1955 | DGKA inhibitor |
| TMR-BSA | Invitrogen | A23016 | Fluorescent albumin |
| Trypsin | Sigma Aldrich | 25300-054 | Dissociation agent |
Ссылки
- Yoshida, S., Pacitto, R., Inoki, K., Swanson, J. Macropinocytosis, mTORC1 and cellular growth control. Cellular and Molecular Life Sciences. 75 (7), 1227-1239 (2018).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Maxson, M. E., Sarantis, H., Volchuk, A., Brumell, J. H., Grinstein, S. Rab5 regulates macropinocytosis by recruiting the inositol 5-phosphatases OCRL/Inpp5b that hydrolyze PtdIns(4,5)P2. Journal of Cell Science. , (2021).
- Bohdanowicz, M., et al. Phosphatidic acid is required for the constitutive ruffling and macropinocytosis of phagocytes. Molecular Biology of the Cell. 24 (11), 1712 (2013).
- Ramirez, C., Hauser, A. D., Vucic, E. A., Bar-Sagi, D. Plasma membrane V-ATPase controls oncogenic RAS-induced macropinocytosis. Nature. 576 (7787), 477-481 (2019).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Kim, S. M., et al. Targeting cancer metabolism by simultaneously disrupting parallel nutrient access pathways. Journal of Clinical Investigation. 126 (11), 4088-4102 (2016).
- Selwan, E. M., Finicle, B. T., Kim, S. M., Edinger, A. L. Attacking the supply wagons to starve cancer cells to death. FEBS Letters. 590 (7), 885-907 (2016).
- Henske, E. P., Jozwiak, S., Kingswood, J. C., Sampson, J. R., Thiele, E. A. Tuberous sclerosis complex. Nature Reviews Disease Primers. 2, 16035 (2016).
- Duvel, K., et al. Activation of a metabolic gene regulatory network downstream of mTOR complex 1. Molecular Cell. 39 (2), 171-183 (2010).
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Choo, A. Y., et al. Glucose addiction of TSC null cells is caused by failed mTORC1-dependent balancing of metabolic demand with supply. Molecular Cell. 38 (4), 487-499 (2010).
- Kovalenko, A., et al. Therapeutic targeting of DGKA-mediated macropinocytosis leads to phospholipid reprogramming in Tuberous Sclerosis Complex. Cancer Research. , (2021).
- Swanson, J. A. Phorbol esters stimulate macropinocytosis and solute flow through macrophages. Journal of Cell Science. 94, 135-142 (1989).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Filippakis, H., et al. Vps34-mediated macropinocytosis in Tuberous Sclerosis Complex 2-deficient cells supports tumorigenesis. Scientific Reports. 8 (1), 14161 (2018).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biol Int. 39 (5), 531-539 (2015).
- Jachimska, B., Wasilewska, M., Adamczyk, Z. Characterization of globular protein solutions by dynamic light scattering, electrophoretic mobility, and viscosity measurements. Langmuir. 24 (13), 6866-6872 (2008).
- Armstrong, J. K., Wenby, R. B., Meiselman, H. J., Fisher, T. C. The hydrodynamic radii of macromolecules and their effect on red blood cell aggregation. Biophysical Journal. 87 (6), 4259-4270 (2004).
- Lee, S. W., Alas, B., Commisso, C. Detection and Quantification of Macropinosomes in Pancreatic Tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T. D., Kay, R. R. The physiological regulation of macropinocytosis during Dictyostelium growth and development. Journal of Cell Science. 131 (6), (2018).
- Koivusalo, M., et al. Amiloride inhibits macropinocytosis by lowering submembranous pH and preventing Rac1 and Cdc42 signaling. Journal of Cell Biology. 188 (4), 547-563 (2010).
- Ohkuma, S., Poole, B. Fluorescence probe measurement of the intralysosomal pH in living cells and the perturbation of pH by various agents. Proceedings of the National Academy of Sciences of the United States of America. 75 (7), 3327-3331 (1978).
- Murphy, R. F. Analysis and isolation of endocytic vesicles by flow cytometry and sorting: demonstration of three kinetically distinct compartments involved in fluid-phase endocytosis. Proceedings of the National Academy of Sciences of the United States of America. 82 (24), 8523-8526 (1985).
- Williams, T., Kay, R. R. High-throughput Measurement of Dictyostelium discoideum Macropinocytosis by Flow Cytometry. Journal of Visualized Experiments. (139), e58434 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены