Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Évaluation quantitative de la macropinocytose dans les cellules hyperactives mTORC1 à l’aide de la cytométrie en flux
Dans cet article
Résumé
Ce protocole fournit des outils expérimentaux pour évaluer l’absorption macropinocytaire des nutriments (glucides et protéines) par les cellules hyperactives mTORC1. Les étapes détaillées permettant de quantifier l’absorption du dextran marqué par fluorescence et de l’albumine sérique bovine (BSA) sont décrites.
Résumé
La macropinocytose est un processus endocytaire hautement conservé et dépendant de l’actine qui permet l’absorption de matériel extracellulaire, y compris les protéines et les lipides. Dans les cellules en prolifération, la macropinocytose peut fournir des nutriments extracellulaires au lysosome, transformés en éléments constitutifs critiques des macromolécules. Des études récentes ont mis en évidence la dépendance de plusieurs cancers à la macropinocytose, notamment le cancer du sein, le cancer colorectal et le cancer du pancréas. On pense que les mutations Ras sont les événements moteurs de l’initiation de la macropinocytose, conduisant à l’activation des processus anaboliques cellulaires via la voie de signalisation mTORC1. Il est intéressant de noter que mTORC1 peut également être activé par la macropinocytose indépendamment de Ras. Par conséquent, la macropinocytose représente une vulnérabilité métabolique qui peut être exploitée pour cibler les tumeurs macropinocytaires en limitant leur accès aux nutriments à des fins thérapeutiques.
Dans le complexe de sclérose tubéreuse (TSC) et la lymphangioléiomyomatose (LAM), l’hyperactivation de mTORC1 entraîne une augmentation de la macropinocytose et de la reprogrammation métabolique. Ici, nous décrivons un protocole basé sur la cytométrie en flux pour évaluer quantitativement la macropinocytose dans les cellules de mammifères. Des MEF déficients en TSC2 sont utilisés, qui présentent une activation aberrante de mTORC1 et ont montré une macropinocytose accrue par rapport aux cellules exprimant TSC2. Les cellules traitées avec des inhibiteurs pharmacologiques de la macropinocytose sont incubées avec du dextran de 70 kDa marqué par fluorescence, fixable à la lysine, ou de l’albumine sérique bovine (BSA) marquée par fluorescence, dosée par cytométrie en flux. À ce jour, des techniques robustes basées sur l’image ont été développées pour évaluer quantitativement la macropinocytose dans les cellules tumorales in vitro et in vivo. Cette analyse fournit une évaluation quantitative de la macropinocytose dans de multiples conditions expérimentales et complète les techniques existantes basées sur l’image.
Introduction
La macropinocytose est un processus endocytaire dédié à l’absorption massive de matériel extracellulaire suivie de la formation de macropinosomes, soit recyclés dans la membrane plasmique, soit fusionnant avec des lysosomes pour dégrader la cargaison intériorisée 1,2. Bien que l’absorption de la cargaison ne soit pas sélective, la macropinocytose est un processus en plusieurs étapes, étroitement régulé par les GTPases Rab et les phospholipides membranaires 3,4. Notamment, les cellules cancéreuses utilisent la macropinocytose pour internaliser les nutriments extracellulaires, y compris les protéines, les polysaccharides et les lipides. La macropinocytose dans les cellules cancéreuses est activée par les oncogènes en aval de Ras ou v-Src comme mécanisme de soutien à leur prolifération, en particulier dans des conditions de stress nutritionnel 5,6. Par conséquent, la macropinocytose représente une nouvelle approche thérapeutique pour cibler les cellules cancéreuses en perturbant les voies d’absorption des nutriments 7,8.
Dans le complexe de sclérose tubéreuse (TSC) et la lymphangioléiomyomatose (LAM), la perte de mutations fonctionnelles de TSC1 ou TSC2 conduit à une hyperactivation de la cible mammifère/mécaniste du complexe de rapamycine 1 (mTORC1)9. L’activation aberrante de mTORC1 est connue pour entraîner une reprogrammation métabolique étendue, y compris l’absorption et l’utilisation du glucose et de la glutamine, l’amélioration de la synthèse des acides nucléiques, la synthèse des lipides et l’autophagie10,11. Pour compenser ces demandes anabolisantes accrues, les cellules hyperactives de mTORC1 augmentent l’absorption de nutriments exogènes via la macropinocytose et améliorent la dégradation lysosomale de la cargaison12 internalisée. Dans des travaux récents, nous avons identifié la ritansérine, un inhibiteur de la diacylglycérol kinase alpha (DGKA) comme un agent qui inhibe sélectivement la prolifération des cellules déficientes en TSC2 13. DGKA est une kinase lipidique qui métabolise le diacylglycérol en acide phosphatidique (PA)14. Le PA est une deuxième molécule messagère cruciale qui joue également un rôle essentiel dans le maintien de l’homéostasie de la membrane cellulaire. Étonnamment, la ritansérine inhibe fortement la macropinocytose en reprogrammant le métabolisme des phospholipides dans les cellules déficientes en TSC2. Par conséquent, le ciblage de la voie d’absorption des nutriments de la macropinocytose dans les cellules déficientes en TSC2 peut fournir de nouvelles approches thérapeutiques dans la TSC et la LAM.
La quantification de l’absorption des macropinocytes in vitro et in vivo peut fournir des informations cruciales sur la régulation de la formation des macropinosomes et accélérer la découverte de mécanismes moléculaires tout en identifiant de nouvelles approches thérapeutiques 2,6. À ce jour, de multiples méthodologies ont été mises au point pour quantifier adéquatement l’absorption macropinocytaire du dextran fluorescent in vitro et in vivo2,15. Nous décrivons ici une approche basée sur la cytométrie en flux pour évaluer directement la quantité de dextran et d’albumine internalisés dans les cellules hyperactives mTORC1 (Figure 1). Cette méthode peut être utilisée pour analyser plusieurs conditions expérimentales en parallèle et complète les approches existantes basées sur l’image.
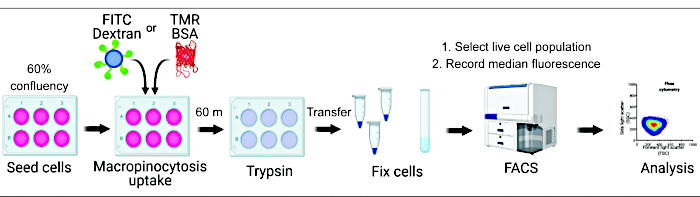
Graphique 1. Flux de travail pour l’évaluation de la macropinocytose dans les cellules de mammifères. Les cellules sont ensemencées dans des plaques à six puits et ensuite traitées avec des composés d’intérêt. Du dextran fluorescent ou du BSA sont ajoutés pendant 60 min, et l’absorption est inhibée par un lavage avec du PBS glacé. Les cellules sont fixées à l’aide de paraformaldéhyde et l’intensité de la fluorescence est quantifiée par cytométrie en flux. Les cellules sont contrôlées et les données sont analysées à l’aide du logiciel approprié. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
1. Traitement cellulaire
Jour 1
- Grainez des fibroblastes embryonnaires de souris (MEF) déficients en TSC2 et exprimant TSC2 en trois exemplaires, dans chaque puits d’une plaque de culture tissulaire à six puits à l’aide de DMEM, complété par 10 % de FBS. Les cellules devraient être confluentes à 60-70 % au jour 3.
- Ensemencez des puits de contrôle supplémentaires pour chaque condition médicamenteuse qui ne sera pas colorée avec FITC-Dextran ou TMR-BSA.
Jour 2
- Aspirez soigneusement le milieu et rincez les cellules deux fois avec du PBS à température ambiante.
- Traiter les cellules avec un véhicule (DMSO), 100 μM d’acide phosphatidique (PA), 25 μM d’EIPA, 10 μM de ritansérine ou une combinaison de PA et de ritansérine. Utilisez du DMEM complété par 1 % de FBS.
REMARQUE : Le volume de DMSO doit être égal au volume maximal de solvant utilisé dans le traitement des conditions. Par exemple, si 10 μL d’EIPA sont utilisés, le volume de DMSO dans les conditions du véhicule doit également être de 10 μL.
- Traiter les cellules avec un véhicule (DMSO), 100 μM d’acide phosphatidique (PA), 25 μM d’EIPA, 10 μM de ritansérine ou une combinaison de PA et de ritansérine. Utilisez du DMEM complété par 1 % de FBS.
Jour 3
- Remplacer le milieu par du DMEM sans sérum contenant les médicaments mentionnés ci-dessus et 0,5 mg/mL de FITC-Dextran ou 0,5 mg/mL de TMR-BSA 16 h après le traitement. Incuber les cellules dans un incubateur de culture cellulaire à 37 °C/5 % de CO2 pendant 60 min.
REMARQUE : Pour minimiser le photoblanchiment des fluorophores, les tubes FITC-Dextran et TMR-BSA doivent être enveloppés dans une feuille d’aluminium et l’expérience doit être réalisée dans une enceinte de culture cellulaire avec les lumières éteintes. - Aspirez le support et lavez-le deux fois avec du PBS glacé.
- Détachez les cellules à l’aide de 500 μL de trypsine. Placer les cellules dans un incubateur de culture cellulaire à 37 °C/5 % de CO2 pendant 2 à 3 min.
REMARQUE : Assurez-vous que toutes les cellules sont détachées en les observant au microscope à fond clair. - À l’aide d’une pointe de pipette propre à chaque fois, prélevez les cellules dans des tubes de 1,5 mL en utilisant du DMEM supplémenté à 1 % de FBS sur de la glace.
- Cellules à granulés par centrifugation à 425 x g pendant 2 min à 4 °C.
- Aspirez le surnageant.
- Détachez les cellules à l’aide de 500 μL de trypsine. Placer les cellules dans un incubateur de culture cellulaire à 37 °C/5 % de CO2 pendant 2 à 3 min.
- Remettre en suspension la pastille cellulaire à l’aide de 50 μL de paraformaldéhyde à 2 %.
ATTENTION : Le paraformaldéhyde est très toxique et doit être manipulé sous une hotte appropriée. Les déchets contenant du formaldéhyde doivent être éliminés conformément aux directives institutionnelles.- Incuber les cellules à température ambiante pendant 10 min.
- Ajoutez 1 mL de PBS glacé dans chaque tube et remettez doucement la pastille en suspension. Placez les tubes sur de la glace.
- Cellules de centrifugation à 425 x g pendant 2 min à 4 °C.
- Aspirez le surnageant.
- Mettre en suspension la pastille cellulaire dans 300 μL de PBS glacé.
- Transférez les cellules dans les tubes FACS appropriés sur de la glace.
- Procéder à la cytométrie en flux.
2. Cytométrie en flux
- Vortex brièvement les cellules avant de les insérer dans le porte-échantillon FACS.
- À l’aide d’un écoulement à basse vitesse, filtrer les cellules vivantes de chaque échantillon non coloré (contrôle négatif) à l’aide de la puissance laser appropriée, comme le montre la figure 2A. Cette étape diffère d’un instrument à l’autre et devra être optimisée pour chaque expérience. Ajustez la puissance pour la diffusion directe (FSC) et la diffusion latérale (SSC) afin que les cellules vivantes soient distinctes des débris ou des amas de cellules.
- À l’aide de la fonction de porte automatique, sélectionnez les populations de cellules vivantes pour chaque échantillon, en évitant les débris cellulaires et les amas de cellules.
REMARQUE : Tous les événements cellulaires (indépendamment du gating) sont finalement enregistrés par le cytomètre. Par conséquent, le choix d’une porte à cette étape n’est pas critique. - Enregistrez l’intensité de fluorescence de chaque échantillon à l’aide des lasers verts ou rouges appropriés.
3. Analyse par cytométrie en flux
- Cellules de porte à l’aide des paramètres de diffusion directe et latérale. Appliquez le même gate à tous les échantillons.
- Créez des histogrammes de fluorescence dans chaque échantillon, comme à la figure 2B.
- À l’intérieur de chaque porte de cellule, calculez l’intensité de fluorescence moyenne/médiane de tous les échantillons.
- Exporter les données pour une analyse statistique appropriée.
REMARQUE : Au cours de l’analyse des données, l’intensité de fluorescence moyenne/médiane de chaque échantillon doit être normalisée en soustrayant les valeurs de l’échantillon non coloré.
Résultats
La ritansérine inhibe la macropinocytose dans les cellules déficientes en TSC2
Nous avons précédemment montré que l’absorption macropinocytaire des nutriments est multipliée par trois dans les cellules déficientes en TSC2 par rapport aux cellules exprimant TSC2 16. Dans la TSC et la LAM, la macropinocytose est médiée par la diacylglycérol kinase alpha (DGKA). Le produit m?...
Discussion
Ici, nous décrivons une approche quantitative pour évaluer la macropinocytose à l’aide de la cytométrie en flux. Cette méthode permet une mesure précise et rapide du dextran et de l’albumine macropinocytaires marqués par fluorescence. Des études antérieures ont soigneusement caractérisé l’indice macropinocytaire des cellules cancéreuses à l’aide d’approches de microscopie confocale15,20. Bien que ces métho...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Le prix de développement de carrière de la Fondation LAM. La figure 1 a été créée avec BioRender.com. La lecture critique a été réalisée par Hilaire C. Lam.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11965-092 | Growth media |
| EIPA (amiloride) | Sigma Aldrich | A3085 | Macropinocytosis inhibitor |
| FBS | R&D Systems | S11150 | Fetal Bovine Serum |
| FITC-Dextran | Invitrogen | D1822 | Fluorescent polysaccharide (70kDa) |
| Parafolmadehyde | Pierce | 28906 | Fixation agent |
| PBS | Gibco | 10010-023 | Phosphate Buffer Saline |
| Penicilin/Streptomycin | Sigma Aldrich | P4458-100ML | Cell culture antibiotics |
| Phosphatidic Acid | Avanti | 840101P | Phospholipid derived from egg |
| Ritanserin | Tocris | 1955 | DGKA inhibitor |
| TMR-BSA | Invitrogen | A23016 | Fluorescent albumin |
| Trypsin | Sigma Aldrich | 25300-054 | Dissociation agent |
Références
- Yoshida, S., Pacitto, R., Inoki, K., Swanson, J. Macropinocytosis, mTORC1 and cellular growth control. Cellular and Molecular Life Sciences. 75 (7), 1227-1239 (2018).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Maxson, M. E., Sarantis, H., Volchuk, A., Brumell, J. H., Grinstein, S. Rab5 regulates macropinocytosis by recruiting the inositol 5-phosphatases OCRL/Inpp5b that hydrolyze PtdIns(4,5)P2. Journal of Cell Science. , (2021).
- Bohdanowicz, M., et al. Phosphatidic acid is required for the constitutive ruffling and macropinocytosis of phagocytes. Molecular Biology of the Cell. 24 (11), 1712 (2013).
- Ramirez, C., Hauser, A. D., Vucic, E. A., Bar-Sagi, D. Plasma membrane V-ATPase controls oncogenic RAS-induced macropinocytosis. Nature. 576 (7787), 477-481 (2019).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Kim, S. M., et al. Targeting cancer metabolism by simultaneously disrupting parallel nutrient access pathways. Journal of Clinical Investigation. 126 (11), 4088-4102 (2016).
- Selwan, E. M., Finicle, B. T., Kim, S. M., Edinger, A. L. Attacking the supply wagons to starve cancer cells to death. FEBS Letters. 590 (7), 885-907 (2016).
- Henske, E. P., Jozwiak, S., Kingswood, J. C., Sampson, J. R., Thiele, E. A. Tuberous sclerosis complex. Nature Reviews Disease Primers. 2, 16035 (2016).
- Duvel, K., et al. Activation of a metabolic gene regulatory network downstream of mTOR complex 1. Molecular Cell. 39 (2), 171-183 (2010).
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Choo, A. Y., et al. Glucose addiction of TSC null cells is caused by failed mTORC1-dependent balancing of metabolic demand with supply. Molecular Cell. 38 (4), 487-499 (2010).
- Kovalenko, A., et al. Therapeutic targeting of DGKA-mediated macropinocytosis leads to phospholipid reprogramming in Tuberous Sclerosis Complex. Cancer Research. , (2021).
- Swanson, J. A. Phorbol esters stimulate macropinocytosis and solute flow through macrophages. Journal of Cell Science. 94, 135-142 (1989).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Filippakis, H., et al. Vps34-mediated macropinocytosis in Tuberous Sclerosis Complex 2-deficient cells supports tumorigenesis. Scientific Reports. 8 (1), 14161 (2018).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biol Int. 39 (5), 531-539 (2015).
- Jachimska, B., Wasilewska, M., Adamczyk, Z. Characterization of globular protein solutions by dynamic light scattering, electrophoretic mobility, and viscosity measurements. Langmuir. 24 (13), 6866-6872 (2008).
- Armstrong, J. K., Wenby, R. B., Meiselman, H. J., Fisher, T. C. The hydrodynamic radii of macromolecules and their effect on red blood cell aggregation. Biophysical Journal. 87 (6), 4259-4270 (2004).
- Lee, S. W., Alas, B., Commisso, C. Detection and Quantification of Macropinosomes in Pancreatic Tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T. D., Kay, R. R. The physiological regulation of macropinocytosis during Dictyostelium growth and development. Journal of Cell Science. 131 (6), (2018).
- Koivusalo, M., et al. Amiloride inhibits macropinocytosis by lowering submembranous pH and preventing Rac1 and Cdc42 signaling. Journal of Cell Biology. 188 (4), 547-563 (2010).
- Ohkuma, S., Poole, B. Fluorescence probe measurement of the intralysosomal pH in living cells and the perturbation of pH by various agents. Proceedings of the National Academy of Sciences of the United States of America. 75 (7), 3327-3331 (1978).
- Murphy, R. F. Analysis and isolation of endocytic vesicles by flow cytometry and sorting: demonstration of three kinetically distinct compartments involved in fluid-phase endocytosis. Proceedings of the National Academy of Sciences of the United States of America. 82 (24), 8523-8526 (1985).
- Williams, T., Kay, R. R. High-throughput Measurement of Dictyostelium discoideum Macropinocytosis by Flow Cytometry. Journal of Visualized Experiments. (139), e58434 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon