このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
フローサイトメトリーを用いたmTORC1-Hyperactive Cellsにおけるマクロピノサイトーシスの定量的評価
要約
このプロトコルは、mTORC1-hyperactive cellsによる栄養素(炭水化物およびタンパク質)のマクロピノサイト摂取を評価するための実験ツールを提供します。蛍光標識されたデキストランおよびウシ血清アルブミン(BSA)の取り込みを定量化するための詳細な手順について説明します。
要約
マクロピノサイトーシスは、タンパク質や脂質などの細胞外物質の取り込みを可能にする、高度に保存されたアクチン依存性のエンドサイトーシスプロセスです。増殖細胞では、マクロピノサイトーシスは細胞外栄養素をリソソームに送達し、重要な高分子ビルディングブロックに加工することができます。最近の研究では、乳がん、結腸直腸がん、膵臓がんなど、複数のがんがマクロピノサイトーシスに依存していることが強調されています。Ras変異は、マクロピノサイトーシスの開始の背後にあるドライバーイベントであると考えられており、mTORC1シグナル伝達経路を介して細胞同化プロセスの活性化につながります。興味深いことに、mTORC1はRasとは無関係にマクロピノサイトーシスによっても活性化されます。したがって、マクロピノサイトーシスは、治療上の栄養素へのアクセスを制限することにより、マクロピノサイトーシス腫瘍を標的にするために活用できる代謝の脆弱性を表しています。
結節性硬化症複合体(TSC)およびリンパ管平滑筋腫症(LAM)では、mTORC1の過剰活性化により、マクロピノサイトーシスと代謝リプログラミングが促進されます。ここでは、哺乳類細胞のマクロピノサイトーシスを定量的に評価するためのフローサイトメトリーベースのプロトコルについて説明します。 TSC2欠損MEFが採用されており、mTORC1の異常な活性化を示し、 TSC2発現細胞と比較してマクロピノサイトーシスが増加することが示されています。マクロピノサイトーシスの薬理学的阻害剤で処理した細胞を、蛍光標識、リジン固定可能な70 kDaデキストラン、または蛍光標識したウシ血清アルブミン(BSA)をフローサイトメトリーでアッセイしてインキュベートします。今日まで、 in vitro および in vivoで腫瘍細胞のマクロピノサイトーシスを定量的に評価するための堅牢な画像ベースの技術が開発されてきました。この分析は、複数の実験条件でのマクロピノサイトーシスの定量的評価を提供し、既存の画像ベースの手法を補完します。
概要
マクロピノサイトーシスは、細胞外物質の大量取り込みとそれに続くマクロピノソームの形成に特化したエンドサイトーシスプロセスであり、原形質膜にリサイクルされるか、リソソームと融合して内在化されたカーゴ1,2を分解します。カーゴの取り込みは非選択的ですが、マクロピノサイトーシスは多段階のプロセスであり、Rab GTPaseと膜リン脂質によって厳密に制御されています3,4。特に、がん細胞はマクロピノサイトーシスを利用して、タンパク質、多糖類、脂質などの細胞外栄養素を内在化します。がん細胞におけるマクロピノサイトーシスは、特に栄養ストレス条件下で、Rasまたはv-Srcの下流のがん遺伝子によって活性化され、その増殖を支えるメカニズムとして5,6。したがって、マクロピノサイトーシスは、栄養素の取り込み経路を阻害することにより、がん細胞を標的とするための新しい治療アプローチを表しています7,8。
結節性硬化症複合体(TSC)およびリンパ管平滑筋腫症(LAM)では、TSC1またはTSC2の機能喪失変異が、ラパマイシン複合体1(mTORC1)の哺乳類/機構標的の過剰活性化につながる9。mTORC1の異常な活性化は、グルコースとグルタミンの取り込みと利用、核酸合成の増強、脂質合成、オートファジーなど、広範な代謝リプログラミングを促進することが知られています10,11。これらの増加した同化要求を補うために、mTORC1-hyperactive細胞は、マクロピノサイトーシスを介して外因性栄養素の取り込みを増加させ、内在化された貨物のリソソーム分解を促進します12。最近の研究では、ジアシルグリセロールキナーゼα(DGKA)の阻害剤であるリタンセリンを、TSC2欠損細胞の増殖を選択的に阻害する薬剤として同定した13。DGKAは、ジアシルグリセロールをホスファチジン酸(PA)14に代謝する脂質キナーゼです。PAは、細胞膜の恒常性を維持する上でも重要な役割を果たす重要なセカンドメッセンジャー分子です。驚くべきことに、リタンセリンは、TSC2欠損細胞のリン脂質代謝を再プログラミングすることにより、マクロピノサイトーシスを強力に阻害します。したがって、TSC2欠損細胞におけるマクロピノサイトーシスの栄養取り込み経路を標的とすることで、TSCおよびLAMにおける新たな治療アプローチが得られる可能性があります。
in vitroおよびin vivoでのマクロピノサイト取り込みの定量化は、マクロピノソーム形成制御に関する重要な洞察を提供し、分子メカニズムの発見を加速させると同時に、新しい治療アプローチを特定することができます2,6。今日までに、in vitroおよびin vivoの両方で蛍光デキストランのマクロピノサイト摂取を適切に定量する複数の方法論が開発されてきました2,15。ここでは、mTORC1-hyperactive細胞における取り込まれたデキストランとアルブミンの量を直接評価するためのフローサイトメトリーベースのアプローチについて説明します(図1)。この方法は、複数の実験条件を並行して解析するために利用でき、既存の画像ベースのアプローチを補完します。
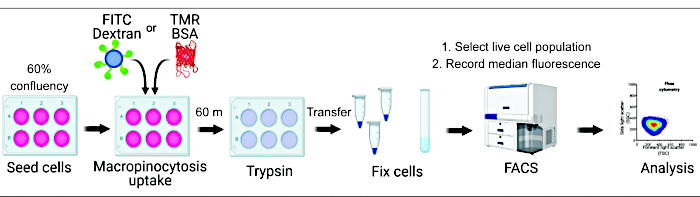
図 1.哺乳類細胞におけるマクロピノサイトーシスの評価のためのワークフロー。 細胞を6ウェルプレートに播種し、その後、目的の化合物で処理します。蛍光デキストランまたはBSAを60分間添加し、氷冷PBSで洗浄することにより取り込みを抑制します。細胞はパラホルムアルデヒドを使用して固定され、蛍光強度はフローサイトメトリーによって定量されます。細胞をゲートし、適切なソフトウェアでデータを解析します。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
1. 細胞治療
1日目
- TSC2欠損マウスおよびTSC2発現マウス胚性線維芽細胞(MEFs)を、DMEMを用いて6ウェル組織培養プレートの各ウェルに三重に播種し、10%FBSを添加する。細胞は3日目までに60〜70%がコンフルエントになるはずです。
- FITC-DextranまたはTMR-BSAで染色されない各薬物状態のための追加のコントロールウェルを播種します。
2日目
- 培地を慎重に吸引し、室温でPBSで細胞を2回すすぎます。
- ビヒクル(DMSO)、100 μMのホスファチジン酸(PA)、25 μMのEIPA、10 μMのリタンセリン、またはPAとリタンセリンの組み合わせで細胞を治療します。1% FBSを添加したDMEMを使用してください。
注:DMSOの容量は、処理条件で使用される溶媒の最大容量と等しくなければなりません。たとえば、10 μL の EIPA を使用する場合、車両条件での DMSO の容量も 10 μL である必要があります。
- ビヒクル(DMSO)、100 μMのホスファチジン酸(PA)、25 μMのEIPA、10 μMのリタンセリン、またはPAとリタンセリンの組み合わせで細胞を治療します。1% FBSを添加したDMEMを使用してください。
3日目
- 治療後16時間後に、上記の薬剤と0.5 mg/mLのFITC-Dextranまたは0.5 mg/mLのTMR-BSAを含む無血清DMEMと培地を交換してください。細胞を37°C/5%CO2 細胞培養インキュベーターで60分間インキュベートします。
注:蛍光色素の光退色を最小限に抑えるために、FITC-デキストランおよびTMR-BSAチューブをアルミホイルで包み、ライトをオフにして細胞培養キャビネット内で実験を行う必要があります。 - 培地を吸引し、氷冷したPBSで2回洗浄します。
- 500 μLのトリプシンを使用して細胞を剥離します。細胞を37°C/5%CO2 細胞培養インキュベーターに2〜3分間置く。
注:明視野顕微鏡で観察することにより、すべての細胞が剥離していることを確認します。 - 毎回清潔なピペットチップを使用して、氷上で1% FBSを添加したDMEMを使用して1.5 mLチューブに細胞を回収します。
- 細胞を425 x g で2分間、4°Cで遠心分離してペレット化します。
- 上清を吸引します。
- 500 μLのトリプシンを使用して細胞を剥離します。細胞を37°C/5%CO2 細胞培養インキュベーターに2〜3分間置く。
- 50 μL の 2% パラホルムアルデヒドを使用して細胞ペレットを再懸濁します。
注意:パラホルムアルデヒドは非常に毒性が高いため、適切なドラフトの下で取り扱う必要があります。ホルムアルデヒドを含む廃棄物は、機関のガイドラインに従って処分する必要があります。- 細胞を室温で10分間インキュベートします。
- 氷冷したPBSを各チューブに1 mL加え、細胞ペレットを穏やかに再懸濁します。チューブを氷の上に置きます。
- 細胞を425 x g で2分間、4°Cで遠心分離します。
- 上清を吸引します。
- 細胞ペレットを氷冷PBS300 μLに再懸濁します。
- 氷上の適切なFACSチューブに細胞を移します。
- フローサイトメトリーに進みます。
2. フローサイトメトリー
- 細胞をFACSサンプルホルダーに挿入する前に、細胞を短時間ボルテックスします。
- 低速流を使用して、 図2Aに示すように、適切なレーザー出力を使用して、各未染色サンプルから生細胞をゲートします(ネガティブコントロール)。この手順は装置によって異なり、実験ごとに最適化する必要があります。前方散乱光(FSC)と側方散乱光(SSC)の両方の検出力を調整して、生細胞が破片や細胞クラスターと区別されるようにします。
- オートゲート機能を使用して、細胞破片や細胞クラスターを避けて、各サンプルの生細胞集団を選択します。
注:すべての細胞イベント(ゲーティングに関係なく)は、最終的にサイトメーターによって記録されます。したがって、このステップでゲートを選択することは重要ではありません。 - 適切な緑色または赤色のレーザーを使用して、各サンプルの蛍光強度を記録します。
3. フローサイトメトリー解析
- 前方散乱および側面散乱パラメータを使用してセルをゲートします。すべてのサンプルに同じゲートを適用します。
- 図2Bのように、各サンプルの蛍光のヒストグラムを作成します。
- 各セルゲート内で、すべてのサンプルの平均/中央値の蛍光強度を計算します。
- 適切な統計分析のためにデータをエクスポートします。
注:データ解析中、各サンプルの平均/中央蛍光強度は、未染色のサンプル値を差し引いて正規化する必要があります。
結果
リタンセリンはTSC2欠損細胞のマクロピノサイトーシスを阻害します
我々は以前に、TSC2欠損細胞では、TSC2発現細胞と比較して、栄養素のマクロピノサイト摂取が3倍に増加することを示しました16。TSCおよびLAMでは、マクロピノサイトーシスはジアシルグリセロールキナーゼα(DGKA)を介し?...
ディスカッション
ここでは、フローサイトメトリーを使用してマクロピノサイトーシスを評価するための定量的アプローチについて説明します。この方法により、蛍光標識されたマクロピノサイトカーゴデキストランとアルブミンを正確かつ迅速に測定できます。以前の研究では、共焦点顕微鏡法を用いて癌細胞のマクロピノサイト指数を慎重に特徴付けてきた15,20<...
開示事項
著者は何も開示していません。
謝辞
LAM財団キャリア開発賞。 図 1 は BioRender.com を使用して作成されました。批判的読解はHilaire C. Lamによって行われました。
資料
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11965-092 | Growth media |
| EIPA (amiloride) | Sigma Aldrich | A3085 | Macropinocytosis inhibitor |
| FBS | R&D Systems | S11150 | Fetal Bovine Serum |
| FITC-Dextran | Invitrogen | D1822 | Fluorescent polysaccharide (70kDa) |
| Parafolmadehyde | Pierce | 28906 | Fixation agent |
| PBS | Gibco | 10010-023 | Phosphate Buffer Saline |
| Penicilin/Streptomycin | Sigma Aldrich | P4458-100ML | Cell culture antibiotics |
| Phosphatidic Acid | Avanti | 840101P | Phospholipid derived from egg |
| Ritanserin | Tocris | 1955 | DGKA inhibitor |
| TMR-BSA | Invitrogen | A23016 | Fluorescent albumin |
| Trypsin | Sigma Aldrich | 25300-054 | Dissociation agent |
参考文献
- Yoshida, S., Pacitto, R., Inoki, K., Swanson, J. Macropinocytosis, mTORC1 and cellular growth control. Cellular and Molecular Life Sciences. 75 (7), 1227-1239 (2018).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Maxson, M. E., Sarantis, H., Volchuk, A., Brumell, J. H., Grinstein, S. Rab5 regulates macropinocytosis by recruiting the inositol 5-phosphatases OCRL/Inpp5b that hydrolyze PtdIns(4,5)P2. Journal of Cell Science. , (2021).
- Bohdanowicz, M., et al. Phosphatidic acid is required for the constitutive ruffling and macropinocytosis of phagocytes. Molecular Biology of the Cell. 24 (11), 1712 (2013).
- Ramirez, C., Hauser, A. D., Vucic, E. A., Bar-Sagi, D. Plasma membrane V-ATPase controls oncogenic RAS-induced macropinocytosis. Nature. 576 (7787), 477-481 (2019).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Kim, S. M., et al. Targeting cancer metabolism by simultaneously disrupting parallel nutrient access pathways. Journal of Clinical Investigation. 126 (11), 4088-4102 (2016).
- Selwan, E. M., Finicle, B. T., Kim, S. M., Edinger, A. L. Attacking the supply wagons to starve cancer cells to death. FEBS Letters. 590 (7), 885-907 (2016).
- Henske, E. P., Jozwiak, S., Kingswood, J. C., Sampson, J. R., Thiele, E. A. Tuberous sclerosis complex. Nature Reviews Disease Primers. 2, 16035 (2016).
- Duvel, K., et al. Activation of a metabolic gene regulatory network downstream of mTOR complex 1. Molecular Cell. 39 (2), 171-183 (2010).
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Choo, A. Y., et al. Glucose addiction of TSC null cells is caused by failed mTORC1-dependent balancing of metabolic demand with supply. Molecular Cell. 38 (4), 487-499 (2010).
- Kovalenko, A., et al. Therapeutic targeting of DGKA-mediated macropinocytosis leads to phospholipid reprogramming in Tuberous Sclerosis Complex. Cancer Research. , (2021).
- Swanson, J. A. Phorbol esters stimulate macropinocytosis and solute flow through macrophages. Journal of Cell Science. 94, 135-142 (1989).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Filippakis, H., et al. Vps34-mediated macropinocytosis in Tuberous Sclerosis Complex 2-deficient cells supports tumorigenesis. Scientific Reports. 8 (1), 14161 (2018).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biol Int. 39 (5), 531-539 (2015).
- Jachimska, B., Wasilewska, M., Adamczyk, Z. Characterization of globular protein solutions by dynamic light scattering, electrophoretic mobility, and viscosity measurements. Langmuir. 24 (13), 6866-6872 (2008).
- Armstrong, J. K., Wenby, R. B., Meiselman, H. J., Fisher, T. C. The hydrodynamic radii of macromolecules and their effect on red blood cell aggregation. Biophysical Journal. 87 (6), 4259-4270 (2004).
- Lee, S. W., Alas, B., Commisso, C. Detection and Quantification of Macropinosomes in Pancreatic Tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T. D., Kay, R. R. The physiological regulation of macropinocytosis during Dictyostelium growth and development. Journal of Cell Science. 131 (6), (2018).
- Koivusalo, M., et al. Amiloride inhibits macropinocytosis by lowering submembranous pH and preventing Rac1 and Cdc42 signaling. Journal of Cell Biology. 188 (4), 547-563 (2010).
- Ohkuma, S., Poole, B. Fluorescence probe measurement of the intralysosomal pH in living cells and the perturbation of pH by various agents. Proceedings of the National Academy of Sciences of the United States of America. 75 (7), 3327-3331 (1978).
- Murphy, R. F. Analysis and isolation of endocytic vesicles by flow cytometry and sorting: demonstration of three kinetically distinct compartments involved in fluid-phase endocytosis. Proceedings of the National Academy of Sciences of the United States of America. 82 (24), 8523-8526 (1985).
- Williams, T., Kay, R. R. High-throughput Measurement of Dictyostelium discoideum Macropinocytosis by Flow Cytometry. Journal of Visualized Experiments. (139), e58434 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved