Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
mTORC1-Hiperaktif Hücrelerde Makropinositozun Flow Sitometri Kullanılarak Kantitatif Değerlendirilmesi
Bu Makalede
Özet
Bu protokol, mTORC1-hiperaktif hücreler tarafından besinlerin (karbonhidrat ve protein) makropinositik alımını değerlendirmek için deneysel araçlar sağlar. Floresan etiketli dekstran ve sığır serum albümininin (BSA) alımını ölçmek için ayrıntılı adımlar açıklanmaktadır.
Özet
Makropinositoz, proteinler ve lipitler dahil olmak üzere hücre dışı materyalin alımına izin veren, yüksek oranda korunmuş, aktine bağımlı bir endositik süreçtir. Çoğalan hücrelerde makropinositoz, kritik makromolekül yapı taşlarına işlenen lizozoma hücre dışı besinler sağlayabilir. Son çalışmalar, meme, kolorektal ve pankreas kanseri dahil olmak üzere çoklu kanserlerin makropinositoza bağımlılığını vurgulamıştır. Ras mutasyonlarının, mTORC1 sinyal yolu yoluyla hücresel anabolik süreçlerin aktivasyonuna yol açan makropinositoz başlangıcının arkasındaki itici olaylar olduğu düşünülmektedir. İlginç bir şekilde, mTORC1, Ras'tan bağımsız olarak makropinositoz ile de aktive edilebilir. Bu nedenle makropinositoz, terapötik olarak besinlere erişimlerini sınırlayarak makropinositik tümörleri hedeflemek için kullanılabilecek metabolik bir güvenlik açığını temsil eder.
Tüberöz Skleroz Kompleksi (TSC) ve Lenfanjioleiomyomatozda (LAM), mTORC1 hiperaktivasyonu artmış makropinositoz ve metabolik yeniden programlamaya yol açar. Burada, memeli hücrelerinde makropinositozu kantitatif olarak değerlendirmek için akış sitometrisi tabanlı bir protokol açıklıyoruz. mTORC1'in anormal aktivasyonunu sergileyen ve TSC2 eksprese eden hücrelere kıyasla makropinositozu arttırdığı gösterilen TSC2 eksikliği olan MEF'ler kullanılır. Makropinositozun farmakolojik inhibitörleri ile tedavi edilen hücreler, akış sitometrisi ile test edilen floresan işaretli, lizin ile fikse edilebilir, 70 kDa dekstran veya floresan işaretli sığır serum albümini (BSA) ile inkübe edilir. Bugüne kadar, in vitro ve in vivo tümör hücrelerinde makropinositozu kantitatif olarak değerlendirmek için sağlam görüntü tabanlı teknikler geliştirilmiştir. Bu analiz, çoklu deneysel koşullarda makropinositozun kantitatif bir değerlendirmesini sağlar ve mevcut görüntü tabanlı teknikleri tamamlar.
Giriş
Makropinositoz, hücre dışı materyalin toplu alımına ve ardından plazma zarına geri dönüştürülen veya içselleştirilmiş kargoyubozmak için lizozomlarla kaynaştırılan makropinozomların oluşumuna adanmış endositik bir süreçtir 1,2. Kargo alımı seçici olmamasına rağmen, makropinositoz, Rab GTPazlar ve membran fosfolipidleri 3,4 tarafından sıkı bir şekilde düzenlenen çok aşamalı bir süreçtir. Özellikle, kanser hücreleri, proteinler, polisakkaritler ve lipitler dahil olmak üzere hücre dışı besinleri içselleştirmek için makropinositoz kullanır. Kanser hücrelerinde makropinositoz, özellikle besin stresi koşulları altında proliferasyonlarını desteklemek için bir mekanizma olarak Ras veya v-Src'nin aşağı akışındaki onkogenler tarafından aktive edilir 5,6. Bu nedenle, makropinositoz, besin alım yollarını bozarak kanser hücrelerini hedeflemek için yeni bir terapötik yaklaşımı temsil eder 7,8.
Tüberöz Skleroz Kompleksi (TSC) ve Lenfanjioleiomyomatozis (LAM) 'de, TSC1 veya TSC2'deki fonksiyon kaybı mutasyonları, rapamisin kompleksi 1'in (mTORC1) memeli / mekanik hedefinin hiperaktivasyonuna yol açar9. Anormal mTORC1 aktivasyonunun, glikoz ve glutamin alımı ve kullanımı, gelişmiş nükleik asit sentezi, lipid sentezi ve otofaji dahil olmak üzere kapsamlı metabolik yeniden programlamayı yönlendirdiği bilinmektedir10,11. Bu artan anabolik talepleri telafi etmek için, mTORC1-hiperaktif hücreler makropinositoz yoluyla eksojen besinlerin alımını arttırır ve içselleştirilmiş kargonun lizozomal bozunmasını arttırır12. Son çalışmalarda, bir diasilgliserol kinaz alfa (DGKA) inhibitörü olan ritanserini, TSC2 eksikliği olan hücrelerin13 proliferasyonunu seçici olarak inhibe eden bir ajan olarak tanımladık. DGKA, diasilgliserolü fosfatidik aside (PA) metabolize eden bir lipid kinazdır14. PA, hücre zarı homeostazının korunmasında da hayati bir rol oynayan çok önemli bir ikinci haberci moleküldür. Şaşırtıcı bir şekilde, ritanserin, TSC2 eksikliği olan hücrelerde fosfolipid metabolizmasını yeniden programlayarak makropinositozu güçlü bir şekilde inhibe eder. Bu nedenle, TSC2 eksikliği olan hücrelerde makropinositozun besin alım yolunu hedeflemek, TSC ve LAM'da yeni terapötik yaklaşımlar sağlayabilir.
Makropinositik tutulumun in vitro ve in vivo olarak ölçülmesi, makropinozom oluşumunun düzenlenmesi hakkında önemli bilgiler sağlayabilir ve yeni terapötik yaklaşımları tanımlarken moleküler mekanizmaların keşfini hızlandırabilir 2,6. Bugüne kadar, floresan dekstranın makropinositik alımını hem in vitro hem de in vivo olarak yeterince ölçen çoklu metodolojiler geliştirilmiştir 2,15. Burada, mTORC1-hiperaktif hücrelerde içselleştirilmiş dekstran ve albümin miktarını doğrudan değerlendirmek için akış sitometrisine dayalı bir yaklaşımı açıklıyoruz (Şekil 1). Bu yöntem, birden fazla deneysel koşulu paralel olarak analiz etmek için kullanılabilir ve mevcut görüntü tabanlı yaklaşımları tamamlar.
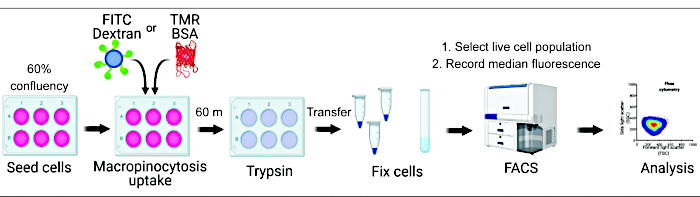
Şekil 1. Memeli hücrelerinde makropinositozun değerlendirilmesi için iş akışı. Hücreler altı oyuklu plakalara ekilir ve daha sonra ilgilenilen bileşiklerle muamele edilir. Floresan dekstran veya BSA 60 dakika boyunca eklenir ve buz gibi soğuk PBS ile yıkanarak alım engellenir. Hücreler paraformaldehit kullanılarak sabitlenir ve floresan yoğunluğu akış sitometrisi ile ölçülür. Hücreler kapılanır ve veriler uygun yazılımla analiz edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
1. Hücre tedavisi
1. Gün
- TSC2 eksikliği olan ve TSC2 eksprese eden fare embriyonik fibroblastlarını (MEF'ler), % 10 FBS ile desteklenmiş DMEM kullanılarak altı oyuklu bir doku kültürü plakasının her bir oyuğunda üç kopya halinde tohumlayın. Hücreler 3. güne kadar% 60-70 oranında birleşmiş olmalıdır.
- FITC-Dextran veya TMR-BSA ile lekelenmeyecek her ilaç durumu için tohum ek kontrol kuyuları.
2. Gün
- Ortamı dikkatlice aspire edin ve hücreleri oda sıcaklığında PBS ile iki kez durulayın.
- Hücreleri araç (DMSO), 100 μM fosfatidik asit (PA), 25 μM EIPA, 10 μM ritanserin veya PA ve ritanserin kombinasyonu ile tedavi edin. % 1 FBS ile desteklenmiş DMEM kullanın.
NOT: DMSO hacmi, tedavi koşullarında kullanılan maksimum çözücü hacmine eşit olmalıdır. Örneğin, 10 μL EIPA kullanılıyorsa, araç koşullarındaki DMSO hacmi de 10 μL olmalıdır.
- Hücreleri araç (DMSO), 100 μM fosfatidik asit (PA), 25 μM EIPA, 10 μM ritanserin veya PA ve ritanserin kombinasyonu ile tedavi edin. % 1 FBS ile desteklenmiş DMEM kullanın.
3. Gün
- Tedaviden 16 saat sonra besiyerini yukarıda belirtilen ilaçları ve 0.5 mg / mL FITC-Dekstran veya 0.5 mg / mL TMR-BSA içeren serumsuz DMEM ile değiştirin. Hücreleri 37 °C /% 5 CO2 hücre kültürü inkübatöründe 60 dakika inkübe edin.
NOT: Floroforların foto-ağartılmasını en aza indirmek için, FITC-Dextran ve TMR-BSA tüpleri alüminyum folyoya sarılmalı ve deney, ışıklar kapalı olarak bir hücre kültürü kabininde yapılmalıdır. - Ortamı aspire edin ve buz gibi PBS ile iki kez yıkayın.
- 500 μL tripsin kullanarak hücreleri ayırın. Hücreleri 37 °C /% 5 CO2 hücre kültürü inkübatörüne 2-3 dakika yerleştirin.
NOT: Tüm hücreleri parlak alan mikroskobu altında gözlemleyerek ayrıldığından emin olun. - Her seferinde temiz bir pipet ucu kullanarak, buz üzerinde% 1.5 FBS takviyeli DMEM kullanarak hücreleri 1 mL tüplerde toplayın.
- 4 ° C'de 2 dakika boyunca 425 x g'da santrifüjleme ile pelet hücreleri.
- Süpernatanı aspire edin.
- 500 μL tripsin kullanarak hücreleri ayırın. Hücreleri 37 °C /% 5 CO2 hücre kültürü inkübatörüne 2-3 dakika yerleştirin.
- 50 μL %2 paraformaldehit kullanarak hücre peletini yeniden süspanse edin.
DİKKAT: Paraformaldehit oldukça toksiktir ve uygun bir çeker ocak altında kullanılmalıdır. Formaldehit içeren atıklar kurumsal yönergelere göre bertaraf edilmelidir.- Hücreleri oda sıcaklığında 10 dakika inkübe edin.
- Her tüpe 1 mL buz gibi soğuk PBS ekleyin ve hücre peletini nazikçe yeniden süspanse edin. Tüpleri buzun üzerine yerleştirin.
- Hücreleri 425 ° C'de 2 dakika boyunca 4 x g'da santrifüjleyin.
- Süpernatanı aspire edin.
- Hücre peletini 300 μL buz gibi soğuk PBS'de yeniden süspanse edin.
- Hücreleri buz üzerindeki uygun FACS tüplerine aktarın.
- Akış sitometrisi ile devam edin.
2. Akış sitometrisi
- Hücreleri FACS numune tutucusuna yerleştirmeden önce kısaca girdaplayın.
- Düşük hızlı akış kullanarak, Şekil 2A'da görüldüğü gibi uygun lazer gücü kullanarak boyanmamış her numuneden (negatif kontrol) canlı hücreler oluşturun. Bu adım, cihazlar arasında farklılık gösterir ve her deney için optimize edilmesi gerekir. Hem ileri saçılma (FSC) hem de yan saçılma (SSC) için gücü, canlı hücrelerin enkaz veya hücre kümelerinden farklı olması için ayarlayın.
- Otomatik geçit özelliğini kullanarak, hücre kalıntılarından ve hücre kümelerinden kaçınarak her örnek için canlı hücre popülasyonlarını seçin.
NOT: Tüm hücre olayları (kapıdan bağımsız olarak) sonuçta sitometre tarafından kaydedilir. Bu nedenle, bu adımda bir kapı seçmek kritik değildir. - Uygun yeşil veya kırmızı lazerleri kullanarak her numuneden floresan yoğunluğunu kaydedin.
3. Akış sitometrisi analizi
- İleri ve yan saçılma parametrelerini kullanarak hücreleri geçit edin. Tüm numunelere aynı kapıyı uygulayın.
- Şekil 2B'deki gibi her örnekte floresan için histogramlar oluşturun.
- Her hücre kapısı içinde, tüm numuneler için ortalama/medyan floresan yoğunluğunu hesaplayın.
- Uygun istatistiksel analiz için verileri dışa aktarın.
NOT: Veri analizi sırasında, her bir numunenin ortalama/medyan floresan yoğunluğu, lekelenmemiş numune değerleri çıkarılarak normalleştirilmelidir.
Sonuçlar
Ritanserin, TSC2 eksikliği olan hücrelerde makropinositozu inhibe eder
Daha önce, TSC2 eksikliği olan hücrelerde besinlerin makropinositik alımının, TSC2 eksprese eden hücrelere kıyasla üç kat arttığını göstermiştik16. TSC ve LAM'da makropinositoza diasilgliserol kinaz alfa (DGKA) aracılık eder. DGKA'nın metabolik ürünü, hücresel zarların çok önemli bir bi...
Tartışmalar
Burada, akış sitometrisi kullanarak makropinositozu değerlendirmek için kantitatif bir yaklaşım tanımlanmıştır. Bu yöntem, floresan olarak işaretlenmiş makropinositik kargo, dekstran ve albüminin doğru ve hızlı bir şekilde ölçülmesini sağlar. Önceki çalışmalar, konfokal mikroskopi yaklaşımları15,20 kullanarak kanser hücrelerinin makropinositik indeksini dikkatlice karakterize etmiştir. Bu yöntemler...
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
LAM Vakfı Kariyer Geliştirme Ödülü. Şekil 1 , BioRender.com ile oluşturulmuştur. Eleştirel okuma Hilaire C. Lam tarafından gerçekleştirildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11965-092 | Growth media |
| EIPA (amiloride) | Sigma Aldrich | A3085 | Macropinocytosis inhibitor |
| FBS | R&D Systems | S11150 | Fetal Bovine Serum |
| FITC-Dextran | Invitrogen | D1822 | Fluorescent polysaccharide (70kDa) |
| Parafolmadehyde | Pierce | 28906 | Fixation agent |
| PBS | Gibco | 10010-023 | Phosphate Buffer Saline |
| Penicilin/Streptomycin | Sigma Aldrich | P4458-100ML | Cell culture antibiotics |
| Phosphatidic Acid | Avanti | 840101P | Phospholipid derived from egg |
| Ritanserin | Tocris | 1955 | DGKA inhibitor |
| TMR-BSA | Invitrogen | A23016 | Fluorescent albumin |
| Trypsin | Sigma Aldrich | 25300-054 | Dissociation agent |
Referanslar
- Yoshida, S., Pacitto, R., Inoki, K., Swanson, J. Macropinocytosis, mTORC1 and cellular growth control. Cellular and Molecular Life Sciences. 75 (7), 1227-1239 (2018).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Maxson, M. E., Sarantis, H., Volchuk, A., Brumell, J. H., Grinstein, S. Rab5 regulates macropinocytosis by recruiting the inositol 5-phosphatases OCRL/Inpp5b that hydrolyze PtdIns(4,5)P2. Journal of Cell Science. , (2021).
- Bohdanowicz, M., et al. Phosphatidic acid is required for the constitutive ruffling and macropinocytosis of phagocytes. Molecular Biology of the Cell. 24 (11), 1712 (2013).
- Ramirez, C., Hauser, A. D., Vucic, E. A., Bar-Sagi, D. Plasma membrane V-ATPase controls oncogenic RAS-induced macropinocytosis. Nature. 576 (7787), 477-481 (2019).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Cancer Research. 75 (3), 544-553 (2015).
- Kim, S. M., et al. Targeting cancer metabolism by simultaneously disrupting parallel nutrient access pathways. Journal of Clinical Investigation. 126 (11), 4088-4102 (2016).
- Selwan, E. M., Finicle, B. T., Kim, S. M., Edinger, A. L. Attacking the supply wagons to starve cancer cells to death. FEBS Letters. 590 (7), 885-907 (2016).
- Henske, E. P., Jozwiak, S., Kingswood, J. C., Sampson, J. R., Thiele, E. A. Tuberous sclerosis complex. Nature Reviews Disease Primers. 2, 16035 (2016).
- Duvel, K., et al. Activation of a metabolic gene regulatory network downstream of mTOR complex 1. Molecular Cell. 39 (2), 171-183 (2010).
- Sancak, Y., et al. The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science. 320 (5882), 1496-1501 (2008).
- Choo, A. Y., et al. Glucose addiction of TSC null cells is caused by failed mTORC1-dependent balancing of metabolic demand with supply. Molecular Cell. 38 (4), 487-499 (2010).
- Kovalenko, A., et al. Therapeutic targeting of DGKA-mediated macropinocytosis leads to phospholipid reprogramming in Tuberous Sclerosis Complex. Cancer Research. , (2021).
- Swanson, J. A. Phorbol esters stimulate macropinocytosis and solute flow through macrophages. Journal of Cell Science. 94, 135-142 (1989).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Filippakis, H., et al. Vps34-mediated macropinocytosis in Tuberous Sclerosis Complex 2-deficient cells supports tumorigenesis. Scientific Reports. 8 (1), 14161 (2018).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biol Int. 39 (5), 531-539 (2015).
- Jachimska, B., Wasilewska, M., Adamczyk, Z. Characterization of globular protein solutions by dynamic light scattering, electrophoretic mobility, and viscosity measurements. Langmuir. 24 (13), 6866-6872 (2008).
- Armstrong, J. K., Wenby, R. B., Meiselman, H. J., Fisher, T. C. The hydrodynamic radii of macromolecules and their effect on red blood cell aggregation. Biophysical Journal. 87 (6), 4259-4270 (2004).
- Lee, S. W., Alas, B., Commisso, C. Detection and Quantification of Macropinosomes in Pancreatic Tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T. D., Kay, R. R. The physiological regulation of macropinocytosis during Dictyostelium growth and development. Journal of Cell Science. 131 (6), (2018).
- Koivusalo, M., et al. Amiloride inhibits macropinocytosis by lowering submembranous pH and preventing Rac1 and Cdc42 signaling. Journal of Cell Biology. 188 (4), 547-563 (2010).
- Ohkuma, S., Poole, B. Fluorescence probe measurement of the intralysosomal pH in living cells and the perturbation of pH by various agents. Proceedings of the National Academy of Sciences of the United States of America. 75 (7), 3327-3331 (1978).
- Murphy, R. F. Analysis and isolation of endocytic vesicles by flow cytometry and sorting: demonstration of three kinetically distinct compartments involved in fluid-phase endocytosis. Proceedings of the National Academy of Sciences of the United States of America. 82 (24), 8523-8526 (1985).
- Williams, T., Kay, R. R. High-throughput Measurement of Dictyostelium discoideum Macropinocytosis by Flow Cytometry. Journal of Visualized Experiments. (139), e58434 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır