Method Article
إنتاج الجسيمات النانوية الدهنية المحملة بالحمض النووي الريبوزي المرسال (siRNA) باستخدام جهاز الموائع الدقيقة
In This Article
Summary
جذبت طرق إنتاج الجسيمات النانوية الدهنية القائمة على الموائع الدقيقة (LNP) الانتباه في أنظمة توصيل الأدوية (DDSs) ، بما في ذلك تسليم الحمض النووي الريبي. يصف هذا البروتوكول عمليات التصنيع وإنتاج LNP (LNP المحمل بواسطة siRNA) وعمليات تقييم LNP باستخدام جهاز الموائع الدقيقة الأصلي المسمى iLiNP.
Abstract
يعد تطوير الجسيمات النانوية الدهنية الوظيفية (LNPs) أحد التحديات الرئيسية في مجال أنظمة توصيل الأدوية (DDS). في الآونة الأخيرة ، جذبت أنظمة توصيل الحمض النووي الريبي القائمة على LNP ، أي LNPs المحملة بالحمض النووي الريبي الانتباه إلى علاج الحمض النووي الريبي. وعلى وجه الخصوص، تمت الموافقة على لقاحات LNP المحملة بالحمض النووي الريبوزي المرسال للوقاية من كوفيد-19، مما أدى إلى تحول نموذجي نحو تطوير الجيل التالي من الأدوية النانوية. بالنسبة للأدوية النانوية القائمة على LNP ، يعد حجم LNP عاملا مهما في التحكم في التوزيع الحيوي LNP وأداء LNP. لذلك ، لا غنى عن تقنية التحكم الدقيق في حجم LNP لعملية إنتاج LNP. هنا ، نقوم بالإبلاغ عن بروتوكول لإنتاج LNP يتم التحكم فيه بالحجم باستخدام جهاز microfluidic ، يسمى iLiNP. يتم أيضا إنتاج LNPs المحملة ب siRNA باستخدام جهاز iLiNP ويتم تقييمها من خلال تجربة في المختبر . يتم عرض النتائج التمثيلية لحجم LNP ، بما في ذلك LNPs المحملة ب siRNA ، وإمكانات Z ، وكفاءة تغليف siRNA ، والسمية الخلوية ، ونشاط إسكات الجينات المستهدفة.
Introduction
الجسيمات النانوية الدهنية (LNP) هي واحدة من أكثر الناقلات النانوية استخداما على نطاق واسع لأنظمة توصيل الحمض النووي الريبي. في الآونة الأخيرة ، تمت الموافقة على LNPs المحملة بالحمض النووي الريبوزي المرسال كلقاحات للوقاية من COVID-191,2,3. بشكل عام ، يلعب حجم LNP دورا حاسما في أداء أنظمة التوزيع الحيوي وتوصيل الأدوية (DDS) ، بما في ذلك إسكات الجينات أو التعبير عن البروتين4،5،6. لذلك ، هناك حاجة إلى طريقة دقيقة للتحكم في حجم LNP لعملية إنتاج LNP.
لإنتاج LNPs التي يتم التحكم فيها في الحجم ، جذبت أجهزة الموائع الدقيقة الانتباه على مر السنين 7. في عام 2018 ، تم تطوير أول LNPs محملة بالحمض النووي الريبوزي المرسال (siRNA) المعتمدة من إدارة الغذاء والدواء (FDA) (على سبيل المثال ، Onpattro) باستخدام جهاز الموائع الدقيقة8,9. في طريقة إنتاج LNP القائمة على الموائع الدقيقة ، يتم إدخال محلول دهني ومحلول مائي بشكل منفصل في جهاز الموائع الدقيقة ، ثم يتم خلطهما في القناة الدقيقة. لتعزيز كفاءة الخلط ، تم استخدام جهاز الخلاط الفوضوي لإنتاج LNP 10،11،12. يتيح جهاز الخلاط الفوضوي إنتاج LNPs بحجم محدد.
تم تطوير جهاز ميكروفلويديك بسيط ، يسمى إنتاج الجسيمات النانوية الدهنية الغازية (iLiNP) ، مجهز بهياكل محيرة ، للتحكم في حجم LNP بدقة13,14. بالمقارنة مع جهاز الخلاط الفوضوي ، تمكن جهاز iLiNP من التحكم في حجم LNP الذي يتراوح من 20 إلى 100 نانومتر على فترات 10 نانومتر. بالإضافة إلى ذلك ، أنتج جهاز iLiNP LNPs 6 المحملة ب siRNA ، و LNPs15 المحملة بالحمض النووي الريبي ، و LNPs16 المحملة بالبروتين الريبي ، و LNPs17 الشبيهة بالإكسوسوم. الهدف من هذه الورقة هو تقديم عملية إنتاج LNP المحملة بالتصنيع و siRNA لجهاز iLiNP ووصف عملية تقييم LNP التي ينتجها جهاز iLiNP.
Protocol
1. تصنيع جهاز iLiNP
ملاحظة: يتم تصنيع جهاز iLiNP باستخدام طريقة الطباعة الحجرية الناعمة القياسية18. تم الإبلاغ عن بروتوكول التصنيع التفصيلي سابقا10,13.
- SU-8 تصنيع القالب
- صب SU-8 3050 على رقاقة سيليكون مقاس 3 بوصات. قم بتدوير رقاقة السيليكون للحصول على طبقة SU-8 بسماكة 100 ميكرومتر.
- تخبز رقاقة السيليكون عن طريق وضعها على صفيحة ساخنة عند 65 درجة مئوية لمدة 5 دقائق و 95 درجة مئوية لمدة 45 دقيقة.
- بعد الخبز ، ضع رقاقة السيليكون على مسرح نظام الطباعة الحجرية بدون قناع لسطح المكتب.
- قم بتعريض رقاقة السيليكون لضوء الأشعة فوق البنفسجية عند 365 نانومتر لمدة 1.5 ثانية لكل موضع واحد.
ملاحظة: تم استخدام نظام الطباعة الحجرية بدون قناع سطح المكتب في هذه التجربة. يعرض النظام تلقائيا ضوء الأشعة فوق البنفسجية في منطقة تشعيع مقسمة (موضع واحد) من القناة الدقيقة. - بعد الأشعة فوق البنفسجية ، اخبز رقاقة السيليكون على السخان عند 65 درجة مئوية لمدة 1 دقيقة و 95 درجة مئوية لمدة 5 دقائق.
- قم بتبريد رقاقة السيليكون ، ثم انقع في مطور SU-8 لمدة 15 دقيقة لإزالة SU-8 غير المكشوفة.
- عالج قالب SU-8 ببخار Trichloro (1H ، 1H ، 2H ، 2H-perfluorooctyl) silane باستخدام مضخة مجففة ومفرغة.
- تصنيع جهاز iLiNP
- امزج قاعدة السيليكون وعامل معالجة البولي ثنائي ميثيل سيلوكسان (PDMS) بنسبة 10: 1 (ث / ث).
- قم بفك الخليط باستخدام مضخة تفريغ ومجفف.
ملاحظة: تم تفريغ PDMS باستخدام مضخة تفريغ لمدة 10 دقائق في درجة حرارة الغرفة. - صب PDMS منزوع الغاز على قالب SU-8 في طبق بتري 100 مم يصل سمكه إلى 0.5 إلى 1 سم ، يليه الخبز في فرن على درجة حرارة 80 درجة مئوية لمدة 1 ساعة.
- قم بتبريد القالب ، ثم قشر ركيزة PDMS من قالب SU-8 باستخدام ملقط.
- ثقب ثلاثة ثقوب (0.5 مم) في ركيزة PDMS. قم بربط الركيزة PDMS وشريحة زجاجية باستخدام منظف بلازما الأكسجين لبناء جهاز iLiNP (انظر الشكل 1)13.
- قم بتوصيل ثلاث شعيرات دموية PEEK (I.D. 0.3 مم ، O.D. 0.5 مم) بمداخل ومخرج جهاز iLiNP وعلاجها باستخدام غراء فائق.
ملاحظة: طول الشعيرات الدموية PEEK قابل للتعديل ويعتمد على التجربة.
2. إعداد محاليل الدهون
- تحضير محاليل الدهون / الإيثانول: 13.4 mM 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine (POPC) ، 10 mM 1,2-Distearoyl-sn-glycero-3-phosphocholine (DSPC) ، 20 mM 1,2-dioleoyloxy-3-trimethylammonium propane (DOTAP) ، 5 mM 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (DMG-PEG2k) ، و 20 mM cholesterol. قم بتخزين حلول المخزون عند -20 درجة مئوية قبل التجربة.
- لإنتاج LNPs المحملة ب siRNA ، امزج حلول DOTAP و DSPC و cholesterol و DMG-PEG2k بنسبة مولية تبلغ 50/10/38.5/1.5. يتم ضبط تركيز الدهون الكلي إلى 8 ملليمتر.
3. إعداد المحاليل المائية
- تحضير المحاليل المائية: 154 ملليمتر كلوريد الصوديوم (محلول ملحي) ، مخزن خلات 25 مللي متر عند درجة الحموضة 4.0 باستخدام الماء المقطر الخالي من DNase / RNase.
- قم بتصفية الحلول من خلال مرشحات غشائية بحجم 0.2 ميكرومتر أو مرشحات محاقن.
4. إعداد حل siRNA / المخزن المؤقت
- قم بإذابة 70 ميكروغرام من siGL4 إلى 1 مل من المخزن المؤقت لخلات 25 مللي متر (الرقم الهيدروجيني 4.0).
ملاحظة: يستخدم siGL4 لضربة قاضية من جين luciferase.
5. إعداد جهاز iLiNP وإنتاج LNPs
ملاحظة: انظر الشكل 1 للاطلاع على المخططات.
- املأ المحاقن الزجاجية سعة 1 مل بالمحاليل الدهنية والمائية (من الخطوتين 3.1 و 4.1 في المحاقن الفردية) ، على التوالي.
ملاحظة: اضبط حجم الدهون والمحلول المائي اعتمادا على الكمية المطلوبة لتجربة تقييم LNP. - قم بتوصيل المحاقن الزجاجية بالشعيرات الدموية PEEK باستخدام موصلات المحاقن.
- اضبط معدل تدفق المحاليل الدهنية والمائية.
ملاحظة: تتراوح نسبة معدل التدفق (FRR) للطور المائي إلى الطور الدهني من 3: 1 إلى 9: 1. - أدخل الدهون والمحاليل المائية بشكل منفصل في جهاز iLiNP باستخدام مضخات المحاقن.
- جمع معلقات LNP في أنبوب دقيق من مخرج جهاز iLiNP (الشكل 1).
6. غسيل الكلى من تعليق LNP وقياس حجم LNP
- قم بتحويل تعليق LNP باستخدام غشاء غسيل الكلى (قطع 12-14 kDa MW) عند 4 درجات مئوية بين عشية وضحاها ضد محلول ملحي أو D-PBS ل POPC LNPs و LNPs المحملة ب siRNA ، على التوالي.
ملاحظة: لا يذوب POPC في محلول ملحي (يرجى الاطلاع على 2.1). يتم تخفيف محلول POPC / الإيثانول بمحلول ملحي في جهاز iLiNP. - جمع معلقات LNP المشوهة في microtubes.
- ماصة 20-30 ميكرولتر من تعليق LNP إلى خلية كوارتز صغيرة.
- قم بقياس حجم LNP وتوزيع حجم LNP ومؤشر التشتت المتعدد بواسطة تشتت الضوء الديناميكي (DLS).
7. قياس إمكانات Z لل LNP
ملاحظة: لقياس الجهد Z، تم استخدام محلل الجسيمات (انظر جدول المواد) وفقا لتعليمات الشركة المصنعة.
- قم بتخفيف تعليق LNP الذي تم الحصول عليه من الخطوة 6.1 ، 35 مرة باستخدام مخزن مؤقت HEPES 10 mM (الرقم الهيدروجيني 7.4).
- ماصة 700 إلى 1000 ميكرولتر من تعليق LNP المخفف إلى خلية شعرية.
- قم بقياس إمكانات Z وفقا لتعليمات الشركة المصنعة.
8. كفاءة تغليف siRNA بواسطة فحص RiboGreen
ملاحظة: يتم إجراء فحص Ribogreen لتقييم تغليف siRNA في LNPs19. يمكن لفحص Ribogreen قياس كمية الحمض النووي الريبي داخل وخارج LNPs مع / بدون خافض للتوتر السطحي (على سبيل المثال ، TritonX-100).
- قم بتخفيف 2 ملغم / مل من siGL4 مع مخزن مؤقت HEPES 10 mM (الرقم الهيدروجيني 7.4) إلى محلول siGL4 سعة 500 نانوغرام / مل.
- قم بإعداد سلسلة التخفيف (0 ، 12.5 ، 25 ، 50 ، 100 ، 200 نانوغرام / مل) من محلول siGL4 لإنشاء منحنى معايرة لعينات Triton (+) و Triton (-).
- قم بتخفيف نظام التعليق LNP 100 مرة باستخدام مخزن مؤقت HEPES سعة 10 ملليمتر (درجة الحموضة 7.4).
- امزج ما يلي لمحلول Triton (+): 980 ميكرولتر من 10 mM HEPES (الرقم الهيدروجيني 7.4) ، و 20 ميكرولتر من 10٪ w / v TritonX-100 ، و 1.25 ميكرولتر من RiboGreen ل 10 آبار من صفيحة صغيرة من 96 بئرا.
- امزج ما يلي لمحلول Triton (-): 1000 ميكرولتر من 10 mM HEPES (الرقم الهيدروجيني 7.4) و 1.25 ميكرولتر من RiboGreen ل 10 آبار من صفيحة صغيرة من 96 بئرا.
- ماصة 100 ميكرولتر من سلسلة التخفيف من محلول siGL4 ومعلقات LNP المخففة في آبار صفيحة سوداء ذات 96 بئرا.
ملاحظة: تم توزيع سلسلة التخفيف من محلول siGL4 ومعلقات LNP المخففة في أربعة آبار صغيرة لكل حالة. - ماصة 100 ميكرولتر من محلول الكشف (TritonX-100 (+) أو Triton (-)) في الآبار.
ملاحظة: تم توزيع محلول الكشف (TritonX-100 (+)) في بئرين لكل عينة لكل حالة، وتم توزيع محلول TritonX-100 (-) في البئرين المتبقيين لكل حالة عينة. - احتضان الصفيحة الدقيقة لمدة 5 دقائق في درجة حرارة الغرفة.
- قم بقياس شدة التألق باستخدام قارئ الصفائح الدقيقة بطول موجي يبلغ 475 نانومتر.
- احسب كفاءة تغليف siRNA من المعادلة التالية19.
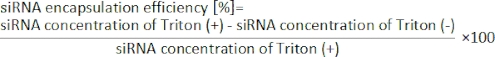
9. زراعة الخلايا
- قم بإعداد وسط نمو يحتوي على DMEM ، و 10٪ FBS معطل بالحرارة ، و 100 U / mL البنسلين ، و 100 ميكروغرام / مل الستربتومايسين ، و 400 ميكروغرام / مل G418.
- خلايا HeLa المستنبتة التي تعبر بثبات عن اليراع ورينيلا لوسيفيراز (HeLa-dluc) في طبق زراعة الخلايا المعالجة بتقنية TC مقاس 100 مم والذي يحتوي على وسط النمو عند 37 درجة مئوية في حاضنة CO2 بنسبة 5٪.
10. فحص صلاحية الخلية
- بذور 100 ميكرولتر من تعليق خلايا HeLa في وسط النمو (6 × 103 خلية / بئر) في صفيحة صغيرة من 96 بئرا.
ملاحظة: تم حساب الخلايا باستخدام صفيحة مضادة للخلايا ومجهر. - احتضن الصفيحة الدقيقة لمدة 24 ساعة عند 37 درجة مئوية في حاضنة CO2 بنسبة 5٪.
- تمييع LNPs المحملة ب siRNA مع DMEM (FBS (-)) بتركيزات 10 و 100 نانومتر siRNAs.
- استغني عن 100 ميكرولتر من تعليق LNP المخفف المحمل ب siRNA لكل بئر.
- احتضن الصفيحة الدقيقة لمدة 4 ساعات عند 37 درجة مئوية في حاضنة CO2 بنسبة 5٪.
- قم بإزالة تعليق LNP وأضف 100 ميكرولتر من DMEM (FBS (+)).
- احتضن الصفيحة الدقيقة لمدة 20 ساعة عند 37 درجة مئوية في حاضنة CO2 بنسبة 5٪.
- قم بقياس صلاحية الخلية باستخدام مجموعة أدوات متاحة تجاريا وفقا لبروتوكول الشركة المصنعة.
ملاحظة: تم استخدام D-PBS (-) كعنصر تحكم سلبي.
11. فحص ضربة قاضية جين لوسيفيراز
- بذور 75 ميكرولتر من تعليق خلايا HeLa في وسط النمو (4.5 × 103 خلية / بئر) في صفيحة صغيرة من 96 بئرا.
- احتضن الصفيحة الدقيقة لمدة 24 ساعة عند 37 درجة مئوية في حاضنة CO2 بنسبة 5٪.
- تمييع LNPs المحملة ب siRNA مع DMEM (FBS (-)) بتركيزات 10 و 100 نانومتر siRNAs.
- استغني عن 75 ميكرولتر من تعليق LNP المخفف المحمل ب siRNA لكل بئر واحد.
- احتضن الصفيحة الدقيقة لمدة 4 ساعات عند 37 درجة مئوية في حاضنة CO2 بنسبة 5٪.
- قم بإزالة تعليق LNP وأضف 75 ميكرولتر من DMEM (FBS (+)).
- احتضن الصفيحة الدقيقة لمدة 20 ساعة عند 37 درجة مئوية في حاضنة CO2 بنسبة 5٪.
- قم بقياس تعبير luciferase باستخدام مجموعة أدوات متاحة تجاريا وفقا لبروتوكول الشركة المصنعة.
ملاحظة: استخدمنا D-PBS (-) كعنصر تحكم سلبي.
النتائج
ويبين الشكل 2A,B توزيع حجم POPC LNP المنتج في ظروف تدفق مختلفة. يمكن لطريقة إعداد LNP القائمة على الموائع الدقيقة التحكم في حجم LNPs من خلال ظروف التدفق مثل معدل التدفق الكلي (TFR) و FRR. بالمقارنة مع أجهزة الموائع الدقيقة النموذجية ، بما في ذلك جهاز الخلاط الفوضوي وجهاز الموائع الدقيقة الذي يركز على التدفق ، مكن جهاز iLiNP من التحكم الدقيق في حجم LNP الذي يتراوح من 20 إلى 100 نانومتر (الشكل 2). تشكلت LNPs صغيرة الحجم في ظروف معدل تدفق إجمالي مرتفع. وبالإضافة إلى ذلك، كانت أحجام LNP التي تشكلت عند FRR من 5 أصغر من تلك الموجودة في FRR من 3، بغض النظر عن معدل التدفق الكلي13.
كما تم إعداد LNPs المحملة ب siRNA باستخدام جهاز iLiNP (الشكل 3A). بالنسبة لإعداد LNP المحمل ب siRNA ، تم استخدام DOTAP ، وهو دهون كاتيونية ، لتغليف siRNA في LNPs بشكل فعال. أنتج جهاز iLiNP 90 نانومتر من LNPs الكاتيونية المحملة ب siRNA مع توزيع ضيق (الشكل 3A ، B). كانت كفاءة تغليف siRNA 95٪ بسبب التفاعل الكهروستاتيكي بين الدهون الكاتيونية و siRNAs سالبة الشحنة (الشكل 3C).
تم تقييم السمية الخلوية ونشاط إسكات الجينات ل 90 نانومتر من LNPs المحملة بالحمض النووي الريبوزي المرسال كما هو موضح في الشكل 4 والشكل 5. أظهرت LNPs المحملة ب siRNA سمية خلوية بجرعة 10 و 100 نانومتر siRNA. أكدنا أيضا أن مستوى التعبير عن luciferase قد انخفض اعتمادا على تركيز siRNA. قامت LNPs المحملة ب siRNA بقمع تعبير luciferase بنسبة 80٪ بجرعة 100 نانومتر siRNA. تم الإبلاغ عن تأثير حجم LNP على نشاط إسكات الجينات سابقا6,13,17.
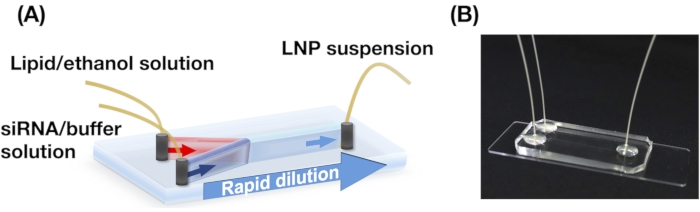
الشكل 1: (أ) رسم تخطيطي و (ب) صورة فوتوغرافية لجهاز iLiNP. يتكون جهاز iLiNP من PDMS وركائز زجاجية. يتم توصيل جهاز iLiNP بالشعيرات الدموية PEEK باستخدام غراء فائق. يتم إدخال محاليل الدهون و siRNA / العازلة بشكل منفصل في جهاز iLiNP باستخدام مضخات المحاقن. يتم جمع تعليق LNP في أنبوب صغير. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
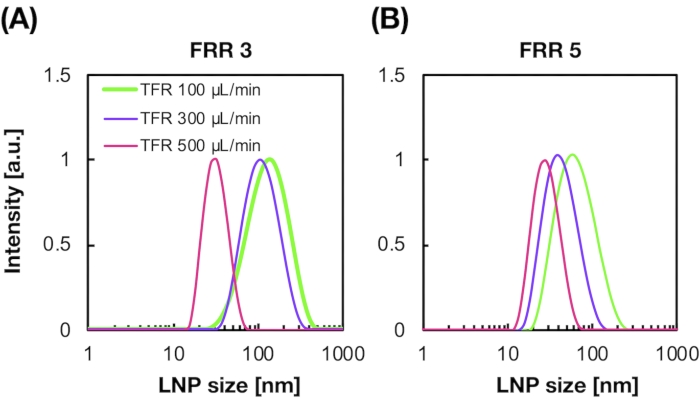
الشكل 2: توزيعات حجم POPC LNP التي ينتجها جهاز iLiNP بنسب معدل تدفق مختلفة (FRR). يتم قياس حجم POPC LNP عن طريق تشتت الضوء الديناميكي (DLS). يتم إعداد POPC LNPs عن طريق تغيير معدل التدفق الكلي و FRR: (A) 3 FRR و (B) 5 FRR. يتم تشكيل LNPs صغيرة الحجم في ظروف معدل تدفق إجمالي مرتفع. وبالإضافة إلى ذلك، كانت أحجام LNP التي تشكلت عند FRR من 5 أصغر من تلك الموجودة في FRR من 3. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
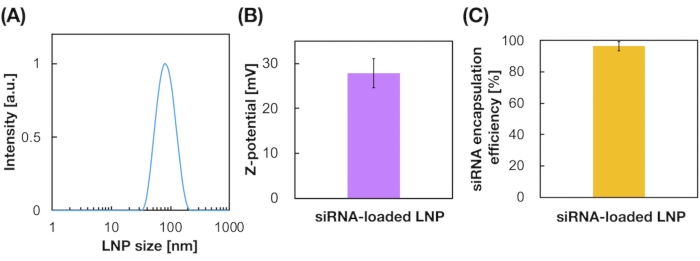
الشكل 3: توصيف LNPs المحملة ب siRNA. (A) توزيع حجم LNPs المحملة ب siRNA. يتم تغليف siRNAs (siGL4) في LNPs عن طريق التفاعل الكهروستاتيكي بين الدهون الكاتيونية (DOTAP) و siRNAs المشحونة سالبا. (ب) إمكانات Z لل LNPs المحملة بالحمض النووي الريبوزي المرسال (siRNA). تم تخفيف تعليق LNP باستخدام مخزن مؤقت HEPES 10 mM (الرقم الهيدروجيني 7.4) قبل القياس. يتم تمثيل البيانات كمتوسط ± SD (الانحراف المعياري). ن = 3. (ج) كفاءة تغليف الحمض النووي الريبوزي المرسال (siRNA) للشبكات المحلية المحورية القائمة على DOTAP. تم تحديد كفاءة التغليف بواسطة فحص RiboGreen. يتم تمثيل البيانات كمتوسط ± SD. n = 3. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
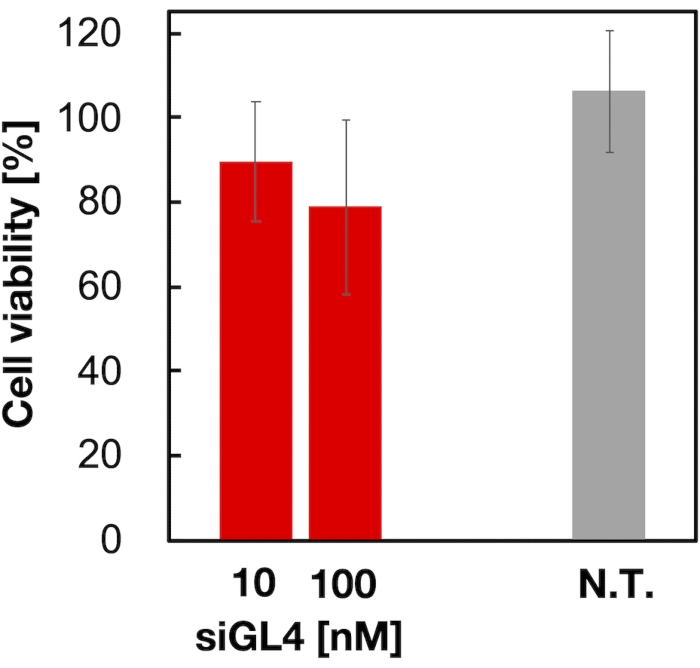
الشكل 4: السمية الخلوية لل LNPs المحملة بالحمض النووي الريبوزي المرسال (siRNA). تم تخفيف LNPs المحملة ب siRNA باستخدام DMEM (FBS (-)) للحصول على تركيزات siGL4 من 10 و 100 نانومتر. تضاف معلقات LNP إلى خلايا HeLa-dLuc ويتم احتضانها لمدة 4 ساعات عند 37 درجة مئوية في حاضنة CO2 بنسبة 5٪. N.T.: غير معالج (D-PBS(-)). يتم تمثيل البيانات كمتوسط ± SD. n = 3. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
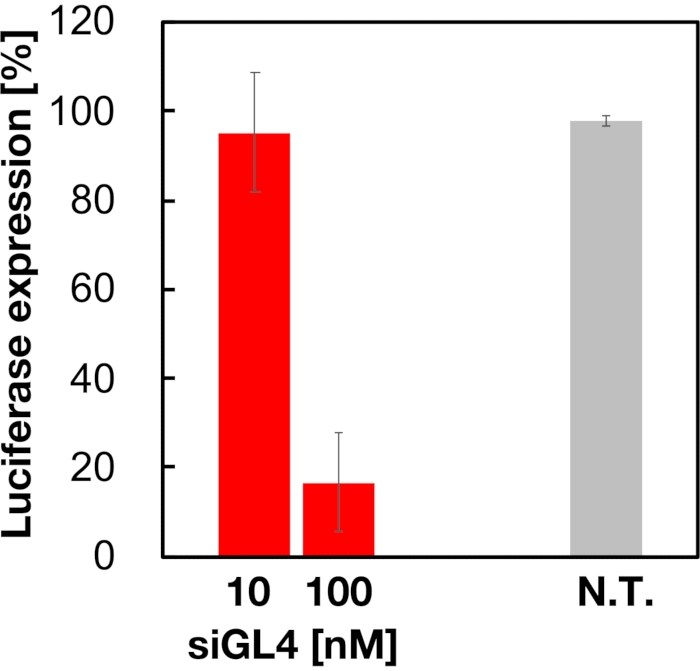
الشكل 5: نشاط الضربة القاضية لجين Luciferase المعالج باستخدام LNPs المحملة ب siRNA. يتم إعداد LNPs المحملة ب siRNA بنفس طريقة فحص صلاحية الخلية. يتم قياس مستوى تعبير luciferase باستخدام نظام فحص Dual-Glo Luciferase. N.T.: غير معالج (D-PBS(-)). يتم تمثيل البيانات كمتوسط ± SD. n = 3. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يؤثر حجم LNP على التوزيع الحيوي LNP ، والتأثير المضاد للورم ، وأداء إسكات الجينات. لذلك ، فإن طريقة التحكم في حجم LNP هي تقنية مهمة لإنتاج الأدوية النانوية DDS ، بما في ذلك أنظمة توصيل الحمض النووي الريبي. الهدف من هذه الورقة هو تقديم جهاز iLiNP لضبط الحجم الدقيق ل LNPs وتطبيقه على إنتاج LNPs المحملة ب siRNA. كان جهاز iLiNP قادرا على التحكم في حجم LNP تراوح من 20 إلى 100 نانومتر (الشكل 2)13. عندما يتم تغيير ظروف التدفق ، مثل معدل التدفق الكلي و FRR للتحكم في حجم LNP ، يجب جمع تعليق LNP بعد حوالي 5 إلى 10 ثوان لتحقيق الاستقرار في تدفق المحلول. تم وضع تعليق LNP الذي تم جمعه من مخرج جهاز iLiNP على الفور مقابل محلول المخزن المؤقت لإزالة الإيثانول ومنع تجميع LNP.
يعد التحكم في حجم LNP أحد التحديات الرئيسية في مجال DDS. بشكل عام ، تحتاج عملية إنتاج LNP التقليدية ، مثل طريقة ترطيب فيلم الدهون ، إلى عملية ضبط الحجم بعد إنتاج LNP 20. من ناحية أخرى ، يمكن لطريقة إنتاج LNPs القائمة على الموائع الدقيقة إنتاج LNPs التي يتم التحكم فيها بالحجم عن طريق إدخال المحاليل الدهنية والمائية في جهاز الموائع الدقيقة6،11،13. على الرغم من أن عملية غسيل الكلى مطلوبة لإزالة الإيثانول من تعليق LNP ، إلا أن العملية المستمرة بواسطة جهاز الموائع الدقيقة إلى جانب نظام التدفق العرضي تعد بأتمتة عملية إنتاج LNP 14. وفقا للأدبيات ، كانت أحجام POPC LNP 50-60 نانومتر و 30-60 نانومتر ، لجهاز الموائع الدقيقة الذي يركز على التدفق 21 وجهاز الخلاط الفوضوي ، على التوالي 10. بالمقارنة مع أجهزة الموائع الدقيقة الأخرى ، يتيح جهاز iLiNP التحكم في حجم POPC LNP في نطاق واسع من 20 إلى 100 نانومتر.
كانت عملية تصنيع جهاز iLiNP المستخدمة هي الطباعة الحجرية الناعمة القياسية. وبالتالي ، يمكن إنتاج جهاز iLiNP بكميات كبيرة بواسطة تقنية النماذج الأولية السريعة ومنع التلوث المتبادل للحلول باستخدام جهاز يمكن التخلص منه. يمكن لجهاز iLiNP إنتاج LNPs المحملة ب siRNA بنفس طريقة إنتاج POPC LNP. بالنسبة لطريقة إنتاج LNP باستخدام جهاز iLiNP ، لا يحتاج المستخدم إلى أي إجراءات معقدة. لهذه الأسباب ، من المتوقع استخدام طريقة إنتاج LNP القائمة على الموائع الدقيقة ، بما في ذلك جهاز iLiNP ، كطريقة إنتاج LNP القياسية. يمكن تكييف بروتوكول هذه الورقة مع أجهزة الموائع الدقيقة الأخرى لإنتاج LNP. بالإضافة إلى ذلك ، يتم أيضا تمكين إنتاج LNPs المحملة بالحمض النووي الريبوزي المرسال عن طريق تغيير حل siRNA / المخزن المؤقت إلى محلول عازل يحتوي على mRNAs.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل JST و CREST Grant Number JPMJCR17H1 و Japan و JST و PRESTO Grant Number JPMJPR19K8 و Japan و JST و SCORE واليابان ونفقات التعليم الخاص والبحث من وزارة التعليم والثقافة والرياضة والعلوم والتكنولوجيا و JSPS KAKENHI Grant Number JP19KK0140 ومؤسسة Iketani للعلوم والتكنولوجيا.
Materials
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine (POPC) | NOF Corp. | MC-6081 | |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (DMG-PEG2K) | NOF Corp. | GM-020 | |
| 1,2-dioleoyloxy-3-trimethylammonium propane (DOTAP) | NOF Corp. | CL-8181TA | |
| 1,2-Distearoyl-sn-glycero-3-phosphocholinev (DSPC) | NOF Corp. | MC-8080 | |
| 10 x D-PBS (-) | FUJIFILM Wako Pure Chemical Corp. | 048-29805 | |
| Acetic acid | FUJIFILM Wako Pure Chemical Corp. | 017-00251 | |
| CellTiter-Blue Cell Viability Assay | Promega | G8081 | |
| cholesterol | Sigma-Aldrich | C8667-5G | |
| Desktop maskless lithography system | NEOARK CORPORATION | DDB-701-DL4 | |
| Dialysis membrane | Repligen | 132697 | |
| Dual-Glo Luciferase Assay System | Promega | E2940 | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific | Lot: 42G6587K | |
| G418 | Nacalai Tesque | 08973-14 | |
| Glass substrate | Matsunami Glass Ind., Ltd. | S1111 | |
| Glass syringe | Hamilton | GASSTIGHT 1002 | |
| HeLa cell | HeLa-dluc cells were provided from Dr. Yusuke Sato at Hokkaido University | ||
| HEPES | FUJIFILM Wako Pure Chemical Corp. | 342-01375 | |
| Low-glucose Dulbecco’s modified Eagle medium (DMEM) | Sigma-Aldrich | D6046-500ML | |
| Oxygen plasma cleaner | Femto Science | CUTE-1MP/R | |
| Penicillin–streptomycin, trypsin (2.5%) | Thermo Fisher Scientific | 15140122 | |
| Quant-iT RiboGreen RNA Reagent | Thermo Fisher Scientific | R11491 | |
| siGL4 | Hokkaido System Science Co., Ltd | The sense and antisense strand sequences of siGL4 are 5'-CCGUCGUAUUCGUGAGCAATsT -3' and 5'-UUGCUCACGAAUACGACGGTsT -3', respectively. | |
| Silicon wafer | GTC | ||
| SILPOT 184 W/C (PDMS) | Dow Corning Toray Co., Ltd. | silicone base and curing agent are included | |
| Sodium acetate | FUJIFILM Wako Pure Chemical Corp. | 192-01075 | |
| Sodium chloride | FUJIFILM Wako Pure Chemical Corp. | 191-01665 | |
| SU-8 3050 | Nippon Kyaku Co., Ltd. | ||
| Syringe connector | Institute of microchemical Technology Co., Ltd. | ISC-011 | |
| Syringe pump | Chemyx | CX07200 | |
| trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma-Aldrich | 448931-10G | |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| UltraPure DNase/RNase-Free Distilled Water | Thermo Fisher Scientific | 10977015 | |
| Zetasizer Nano ZS | Malvern Instruments | ZEN3600 |
References
- Schoenmaker, L., et al. mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability. International Journal of Pharmaceutics. 601, 120586 (2021).
- Chung, Y. H., Beiss, V., Fiering, S. N., Steinmetz, N. F. COVID-19 Vaccine frontrunners and their nanotechnology design. ACS Nano. 14 (10), 12522-12537 (2020).
- Dong, Y., et al. A systematic review of SARS-CoV-2 vaccine candidates. Signal Transduction and Targeted Therapy. 5 (1), 237 (2020).
- Cabral, H., et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size. Nature Nanotechnology. 6 (12), 815-823 (2011).
- Sato, Y., et al. Elucidation of the physicochemical properties and potency of siRNA-loaded small-sized lipid nanoparticles for siRNA delivery. Journal of Controlled Release. 229, 48-57 (2016).
- Kimura, N., et al. Three-dimensional, symmetrically assembled microfluidic device for lipid nanoparticle production. RSC Advances. 11 (3), 1430-1439 (2021).
- Maeki, M., Kimura, N., Sato, Y., Harashima, H., Tokeshi, M. Advances in microfluidics for lipid nanoparticles and extracellular vesicles and applications in drug delivery systems. Advanced Drug Delivery Reviews. 128, 84-100 (2018).
- Akinc, A., et al. The Onpattro story and the clinical translation of nanomedicines containing nucleic acid-based drugs. Nature Nanotechnology. 14 (12), 1084-1087 (2019).
- Kulkarni, J. A., Witzigmann, D., Chen, S., Cullis, P. R., vander Meel, R. Lipid nanoparticle technology for clinical translation of siRNA therapeutics. Accounts of Chemical Research. 52 (9), 2435-2444 (2019).
- Maeki, M., et al. Understanding the formation mechanism of lipid nanoparticles in microfluidic devices with chaotic micromixers. PLoS One. 12 (11), 0187962 (2017).
- Maeki, M., et al. A strategy for synthesis of lipid nanoparticles using microfluidic devices with a mixer structure. RSC Advances. 5 (57), 46181-46185 (2015).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1, 37 (2012).
- Kimura, N., et al. Development of the iLiNP Device: Fine Tuning the Lipid Nanoparticle Size within 10 nm for Drug Delivery. ACS Omega. 3 (5), 5044-5051 (2018).
- Kimura, N., et al. Development of a microfluidic-based post-treatment process for size-controlled lipid nanoparticles and application to siRNA delivery. ACS Applied Materials & Interfaces. 12 (30), 34011-34020 (2020).
- Hashiba, A., et al. The use of design of experiments with multiple responses to determine optimal formulations for in vivo hepatic mRNA delivery. Journal of Controlled Release. 327, 467-476 (2020).
- Suzuki, Y., et al. Lipid nanoparticles loaded with ribonucleoprotein-oligonucleotide complexes synthesized using a microfluidic device exhibit robust genome editing and hepatitis B virus inhibition. Journal of Controlled Release. 330, 61-71 (2020).
- Kimura, N., Maeki, M., Ishida, A., Tani, H., Tokeshi, M. One-step production using a microfluidic device of highly biocompatible size-controlled noncationic exosome-like nanoparticles for RNA delivery. ACS Applied Bio Materials. 4 (2), 1783-1793 (2021).
- Deng, T., Wu, H., Brittain, S. T., Whitesides, G. M. Prototyping of masks, masters, and stamps/molds for soft lithography using an office printer and photographic reduction. Analytical Chemistry. 72 (14), 3176-3180 (2000).
- Sato, Y., et al. A pH-sensitive cationic lipid facilitates the delivery of liposomal siRNA and gene silencing activity in vitro and in vivo. Journal of Controlled Release. 163 (3), 267-276 (2012).
- Ong, S. G., Chitneni, M., Lee, K. S., Ming, L. C., Yuen, K. H. Evaluation of extrusion technique for nanosizing liposomes. Pharmaceutics. 8 (4), (2016).
- Mijajlovic, M., Wright, D., Zivkovic, V., Bi, J. X., Biggs, M. J. Microfluidic hydrodynamic focusing based synthesis of POPC liposomes for model biological systems. Colloids and Surfaces B: Biointerfaces. 104, 276-281 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved