Method Article
Producción de nanopartículas lipídicas cargadas de siRNA utilizando un dispositivo microfluídico
En este artículo
Resumen
Los métodos de producción de nanopartículas lipídicas (LNP) basados en microfluídicas han atraído la atención en los sistemas de administración de fármacos (DDS), incluida la administración de ARN. Este protocolo describe la fabricación, la producción de LNP (LNP cargado de siRNA) y los procesos de evaluación de LNP utilizando nuestro dispositivo microfluídico original llamado iLiNP.
Resumen
El desarrollo de nanopartículas lipídicas funcionales (LNPs) es uno de los principales desafíos en el campo de los sistemas de administración de fármacos (DDS). Recientemente, los sistemas de administración de ARN basados en LNP, es decir, los LNP cargados de ARN han atraído la atención para la terapia de ARN. En particular, se aprobaron vacunas LNP cargadas de ARNm para prevenir la COVID-19, lo que llevó al cambio de paradigma hacia el desarrollo de nanomedicamentos de próxima generación. Para las nanomedicamentos basadas en LNP, el tamaño de LNP es un factor significativo en el control de la biodistribución de LNP y el rendimiento de LNP. Por lo tanto, una técnica precisa de control de tamaño LNP es indispensable para el proceso de producción LNP. Aquí, informamos un protocolo para la producción de LNP de tamaño controlado utilizando un dispositivo microfluídico, llamado iLiNP. Los LNP cargados con siRNA también se producen utilizando el dispositivo iLiNP y se evalúan mediante un experimento in vitro . Se muestran resultados representativos para el tamaño de LNP, incluidos los LNP cargados de siRNA, el potencial Z, la eficiencia de encapsulación de siRNA, la citotoxicidad y la actividad de silenciamiento de genes objetivo.
Introducción
La nanopartícula lipídica (LNP) es uno de los nanoportadores más utilizados para los sistemas de administración de ARN. Recientemente, los LNP cargados de ARNm han sido aprobados como vacunas para la prevención de COVID-191,2,3. En general, el tamaño de la LNP juega un papel crucial en el rendimiento de los sistemas de biodistribución y administración de fármacos (DDS), incluido el silenciamiento génico o la expresión de proteínas4,5,6. Por lo tanto, se requiere un método preciso de control de tamaño LNP para el proceso de producción LNP.
Para la producción de LNPs de tamaño controlado, los dispositivos microfluídicos han atraído la atención a lo largo de los años7. En 2018, los primeros LNPs cargados de siRNA aprobados por la Administración de Alimentos y Medicamentos (FDA) (por ejemplo, Onpattro) se desarrollaron utilizando el dispositivo microfluídico8,9. En el método de producción de LNP basado en microfluídica, una solución lipídica y una solución acuosa se introducen por separado en el dispositivo microfluídico y luego se mezclan en el microcanal. Para mejorar la eficiencia de la mezcla, el dispositivo mezclador caótico se ha utilizado para la producción de LNP10,11,12. El dispositivo mezclador caótico permite producir LNP de tamaño específico.
Se ha desarrollado un dispositivo microfluídico simple, llamado producción invasiva de nanopartículas lipídicas (iLiNP), equipado con estructuras deflectoras, para controlar el tamaño de LNP con precisión13,14. En comparación con el dispositivo mezclador caótico, el dispositivo iLiNP pudo controlar el tamaño LNP que oscilaba entre 20 y 100 nm a intervalos de 10 nm. Además, el dispositivo iLiNP produjo LNPs6 cargados con siRNA, LNPs15 cargados con ARNm, LNPs cargados con ribonucleoproteínas16 y LNPs similares a exosomas17. El objetivo de este artículo es presentar el proceso de fabricación y producción de LNP cargado con iRNA del dispositivo iLiNP y describir el proceso de evaluación de LNP producido por el dispositivo iLiNP.
Protocolo
1. Fabricación del dispositivo iLiNP
NOTA: El dispositivo iLiNP se fabrica utilizando el método estándar de litografía blanda18. El protocolo de fabricación detallado fue reportado previamente10,13.
- Fabricación de moldes SU-8
- Vierta SU-8 3050 sobre una oblea de silicio de 3 pulgadas. Recubrimiento de centrifugado de la oblea de silicio para obtener una capa su-8 de 100 μm de espesor.
- Hornea la oblea de silicio colocándola en una placa caliente a 65 °C durante 5 min y a 95 °C durante 45 min.
- Después de hornear, coloque la oblea de silicio en el escenario de un sistema de litografía sin máscara de escritorio.
- Exponga la oblea de silicio a la luz UV a 365 nm durante 1,5 s por una posición.
NOTA: En este experimento se utilizó un sistema de litografía sin máscara de escritorio. El sistema expone automáticamente la luz UV en un área de irradiación dividida (una posición) del microcanal. - Después de la irradiación UV, hornee la oblea de silicio en la placa caliente a 65 °C durante 1 min y a 95 °C durante 5 min.
- Enfríe la oblea de silicio y luego sumérjala en un revelador SU-8 durante 15 minutos para eliminar el SU-8 no expuesto.
- Tratar el moho SU-8 con vacío de tricloro(1H,1H,2H,2H-perfluorooctil)silano usando un desecador y una bomba de vacío.
- Fabricación del dispositivo iLiNP
- Mezcle la base de silicona y el agente de curado de polidimetilsiloxano (PDMS) en una proporción de 10:1 (p/p).
- Desgasifica la mezcla utilizando una bomba de vacío y un desecador.
NOTA: PDMS se desgasificó utilizando una bomba de vacío durante 10 minutos a temperatura ambiente. - Vierta el PDMS desgasificado en el molde SU-8 en una placa de Petri de 100 mm de hasta 0,5 a 1 cm de espesor, seguido de hornear en un horno a 80 °C durante 1 h.
- Enfríe el molde y luego pele el sustrato PDMS del molde SU-8 con una pinza.
- Perfora tres orificios (0,5 mm) en el sustrato PDMS. Unir el sustrato PDMS y un portaobjetos de vidrio utilizando un limpiador de plasma de oxígeno para construir un dispositivo iLiNP (ver Figura 1)13.
- Conecte tres capilares PEEK (I.D. 0,3 mm, O.D. 0,5 mm) a las entradas y salidas del dispositivo iLiNP y cure con un superpegamento.
NOTA: La longitud de los capilares PEEK es ajustable y depende del experimento.
2. Preparación de soluciones lipídicas
- Preparar soluciones lipídicas/etanol: 13,4 mM 1-palmitoil-2-oleoil-sn-glicero-3-fosfocolina (POPC), 10 mM 1,2-Distearoyl-sn-glycero-3-phosphocholine (DSPC), 20 mM 1,2-dioleoyloxy-3-trimethylammonium propane (DOTAP), 5 mM 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (DMG-PEG2k), y 20 mM de colesterol. Almacene las soluciones de stock a -20 °C antes del experimento.
- Para producir los LNPs cargados de siRNA, mezcle las soluciones DOTAP, DSPC, colesterol y DMG-PEG2k en una proporción molar de 50/10/38.5/1.5. La concentración total de lípidos se ajusta a 8 mM.
3. Preparación de soluciones acuosas
- Preparar soluciones acuosas: 154 mM NaCl (solución salina), tampón de acetato de 25 mM a pH 4.0 utilizando agua destilada sin DNasa/RNasa.
- Filtre las soluciones a través de filtros de membrana de 0,2 μm o filtros de jeringa.
4. Preparación de la solución tampón de siRNA/tampón
- Disolver 70 μg de siGL4 en 1 ml de tampón de acetato de 25 mM (pH 4.0).
NOTA: siGL4 se utiliza para la eliminación del gen luciferasa.
5. Configuración del dispositivo iLiNP y producción de LNP
NOTA: Consulte la Figura 1 para ver los esquemas.
- Llene las jeringas de vidrio de 1 ml con soluciones lipídicas y acuosas (de los pasos 3.1 y 4.1 en jeringas individuales), respectivamente.
NOTA: Ajuste el volumen de lípidos y solución acuosa dependiendo de la cantidad requerida para el experimento de evaluación de LNP. - Conecte las jeringas de vidrio a los capilares PEEK mediante conectores de jeringa.
- Establezca el caudal de las soluciones lipídicas y acuosas.
NOTA: La relación de caudal (FRR) de la fase acuosa a la fase lipídica oscila entre 3:1 y 9:1. - Introduzca las soluciones lipídicas y acuosas por separado en el dispositivo iLiNP utilizando bombas de jeringa.
- Recoger suspensiones LNP en un microtubo desde la salida del dispositivo iLiNP (Figura 1).
6. Diálisis de la suspensión LNP y medición del tamaño LNP
- Dializar la suspensión de LNP utilizando una membrana de diálisis (cortes de 12-14 kDa MW) a 4 °C durante la noche contra solución salina o D-PBS para LNPs POPC y LNPs cargados de siRNA, respectivamente.
NOTA: EL POPC no se disuelve en solución salina (véase 2.1). La solución de POPC/etanol se diluye con solución salina en el dispositivo iLiNP. - Recoge las suspensiones LNP dializadas en microtubos.
- Pipetear 20-30 μL de la suspensión LNP a una celda de micro cuarzo.
- Mida el tamaño de LNP, la distribución de tamaño de LNP y el índice de polidispersidad mediante dispersión dinámica de luz (DLS).
7. Medición del potencial Z del LNP
NOTA: Para la medición del potencial Z, se utilizó un analizador de partículas (ver Tabla de Materiales) siguiendo las instrucciones del fabricante.
- Diluir la suspensión LNP obtenida a partir del paso 6.1, 35 veces con tampón HEPES de 10 mM (pH 7.4).
- Pipetear de 700 a 1000 μL de la suspensión de LNP diluida a una célula capilar.
- Mida el potencial Z según las instrucciones del fabricante.
8. eficiencia de encapsulación de siRNA mediante ensayo RiboGreen
NOTA: El ensayo de ribogreen se realiza para evaluar la encapsulación de siRNA en LNPs19. El ensayo de ribogreen puede medir la cantidad de ARN dentro y fuera de los LNPs con/sin surfactante (por ejemplo, TritonX-100).
- Diluir 2 mg/ml de siGL4 con 10 mM de tampón HEPES (pH 7.4) a 500 ng/ml de solución de siGL4.
- Preparar la serie de dilución (0, 12.5, 25, 50, 100, 200 ng/mL) de solución de siGL4 para hacer una curva de calibración para muestras de Tritón (+) y Tritón (-).
- Diluir la suspensión LNP 100 veces con tampón HEPES de 10 mM (pH 7.4).
- Mezclar lo siguiente para la solución de Tritón (+): 980 μL de 10 mM HEPES (pH 7.4), 20 μL de 10% p/v TritonX-100 y 1.25 μL de RiboGreen para 10 pocillos de una microplaca de 96 pocillos.
- Mezclar lo siguiente para la solución de Tritón (-): 1000 μL de 10 mM HEPES (pH 7.4) y 1.25 μL de RiboGreen para 10 pocillos de una microplaca de 96 pocillos.
- Pipetear 100 μL de la serie de dilución de solución de siGL4 y suspensiones de LNP diluidas en los pocillos de una microplaca negra de 96 pocillos.
NOTA: La serie de dilución de solución de siGL4 y suspensiones de LNP diluidas se dispensaron en cuatro micropocillos por condición. - Pipetear 100 μL de la solución de detección (TritonX-100 (+) o Tritón (-)) en los pozos.
NOTA: La solución de detección (TritonX-100 (+)) se dispensó en dos pocillos por muestra por condición, y la solución TritonX-100 (-) se dispensó en los dos pocillos restantes por condición de muestra. - Incubar la microplaca durante 5 min a temperatura ambiente.
- Mida la intensidad de fluorescencia utilizando un lector de microplacas a una longitud de onda de 475 nm.
- Calcule la eficiencia de encapsulación de siRNA a partir de la siguiente ecuación19.
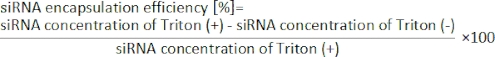
9. Cultivo celular
- Prepare un medio de crecimiento que contenga DMEM, FBS al 10% inactivado por calor, penicilina de 100 U/ml, estreptomicina de 100 μg/ml y 400 μg/ml de G418.
- Cultive células HeLa que expresan de manera estable luciérnagas y Renilla luciferasa (HeLa-dluc) en una placa de cultivo celular tratada con TC de 100 mm que contiene el medio de crecimiento a 37 °C en una incubadora de CO2 al 5%.
10. Ensayo de viabilidad celular
- Sembrar 100 μL de una suspensión de células HeLa en el medio de crecimiento (6 x 103 células/pozo) en una microplaca de 96 pocillos.
NOTA: Las células se contaron utilizando una placa de contador celular y un microscopio. - Incubar la microplaca durante 24 h a 37 °C en una incubadora de CO2 al 5%.
- Diluir los LNPs cargados de siRNA con DMEM (FBS (-)) a las concentraciones de 10 y 100 nM siRNAs.
- Dispensar 100 μL de la suspensión de LNP diluida cargada de siRNA por pocillo.
- Incubar la microplaca durante 4 h a 37 °C en una incubadora de CO2 al 5%.
- Retire la suspensión LNP y agregue 100 μL de DMEM (FBS (+)).
- Incubar la microplaca durante 20 h a 37 °C en una incubadora de CO2 al 5%.
- Mida la viabilidad de la celda utilizando un kit disponible comercialmente de acuerdo con el protocolo del fabricante.
NOTA: Se utilizó D-PBS (-) como control negativo.
11. Ensayo de derribo del gen de la luciferasa
- Sembrar 75 μL de una suspensión de células HeLa en el medio de crecimiento (4,5 x 103 células/pozo) en una microplaca de 96 pocillos.
- Incubar la microplaca durante 24 h a 37 °C en una incubadora de CO2 al 5%.
- Diluir los LNPs cargados de siRNA con DMEM (FBS (-)) a las concentraciones de 10 y 100 nM siRNAs.
- Dispensar 75 μL de la suspensión de LNP diluida cargada de siRNA por cada pocillo.
- Incubar la microplaca durante 4 h a 37 °C en una incubadora de CO2 al 5%.
- Retire la suspensión LNP y agregue 75 μL de DMEM (FBS (+)).
- Incubar la microplaca durante 20 h a 37 °C en una incubadora de CO2 al 5%.
- Mida la expresión de luciferasa utilizando un kit disponible comercialmente de acuerdo con el protocolo del fabricante.
NOTA: Utilizamos D-PBS (-) como control negativo.
Resultados
La Figura 2A,B muestra la distribución de tamaño POPC LNP producida en diferentes condiciones de flujo. El método de preparación de LNP basado en microfluídica puede controlar el tamaño de los LNP por las condiciones de flujo, como el caudal total (TFR) y el FRR. En comparación con los dispositivos microfluídicos típicos, incluido el dispositivo mezclador caótico y el dispositivo microfluídico de enfoque de flujo, el dispositivo iLiNP permitió un control preciso del tamaño de LNP que va de 20 a 100 nm (Figura 2). Los LNP de tamaño pequeño se formaron en condiciones de alto caudal total. Además, los tamaños de PNL formados en el FRR de 5 fueron más pequeños que los del FRR de 3, independientemente del caudal total13.
También se prepararon LNP cargados con siRNA utilizando el dispositivo iLiNP (Figura 3A). Para la preparación de LNP cargado de siRNA, se utilizó DOTAP, un lípido catiónico, para encapsular el siRNA en los LNP de manera efectiva. El dispositivo iLiNP produjo LNPs catiónicos cargados con siRNA de 90 nm con distribución estrecha (Figura 3A, B). La eficiencia de encapsulación de siRNA fue del 95% debido a la interacción electrostática entre el lípido catiónico y los siRNAs cargados negativamente (Figura 3C).
Se evaluó la citotoxicidad y la actividad de silenciamiento génico de LNPs cargados de siRNA de 90 nm como se muestra en la Figura 4 y la Figura 5. Los LNP cargados de siRNA mostraron citotoxicidad a una dosis de 10 y 100 nM de siRNA. También confirmamos que el nivel de expresión de luciferasa disminuyó dependiendo de la concentración de siRNA. Los LNP cargados de siRNA suprimieron el 80% de la expresión de luciferasa a una dosis de 100 nM de siRNA. El efecto del tamaño de la LNP sobre la actividad silenciadora de genes se informó previamente6,13,17.
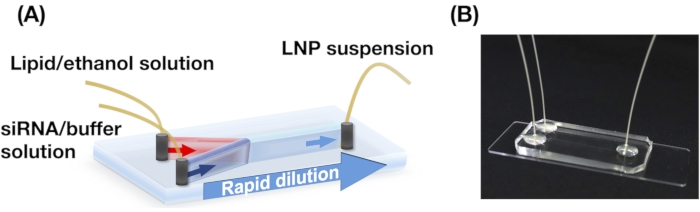
Figura 1: (A) Ilustración esquemática y (B) fotografía del dispositivo iLiNP. El dispositivo iLiNP comprende PDMS y sustratos de vidrio. El dispositivo iLiNP está conectado a los capilares PEEK con un superpegamento. Las soluciones lipídicas y siRNA/tampón se introducen por separado en el dispositivo iLiNP mediante bombas de jeringa. La suspensión LNP se recoge en un microtubo. Haga clic aquí para ver una versión más grande de esta figura.
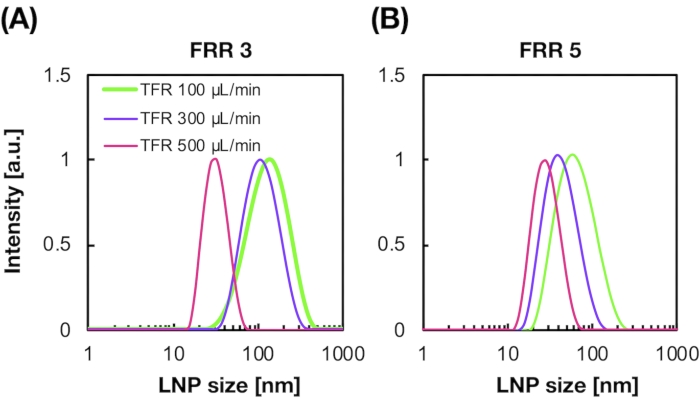
Figura 2: Distribuciones de tamaño POPC LNP producidas por el dispositivo iLiNP en las diferentes relaciones de caudal (FRR). El tamaño popc LNP se mide mediante dispersión dinámica de luz (DLS). Los LNPs POPC se preparan cambiando el caudal total y el FRR: (A) 3 FRR y (B) 5 FRR. Los LNP de tamaño pequeño se forman en condiciones de alto caudal total. Además, los tamaños de LNP formados en el FRR de 5 fueron más pequeños que los del FRR de 3. Haga clic aquí para ver una versión más grande de esta figura.
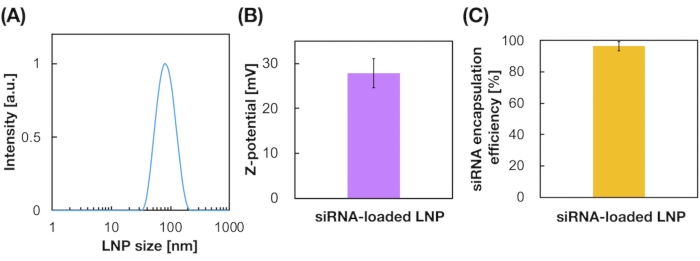
Figura 3: Caracterización de los LNPs cargados de siRNA. (A) Distribución de tamaño de los LNPs cargados de siRNA. los siRNAs (siGL4) se encapsulan en los LNPs por interacción electrostática entre el lípido catiónico (DOTAP) y los siRNAs cargados negativamente. (B) Potencial Z de los LNPs cargados de siRNA. La suspensión de LNP se diluyó con un tampón HEPES de 10 mM (pH 7.4) antes de la medición. Los datos se representan como media ± DE (desviación estándar). n = 3. (C) eficiencia de encapsulación de siRNA de los LNPs basados en DOTAP. La eficiencia de encapsulación se determinó mediante el ensayo RiboGreen. Los datos se representan como media ± SD. n = 3. Haga clic aquí para ver una versión más grande de esta figura.
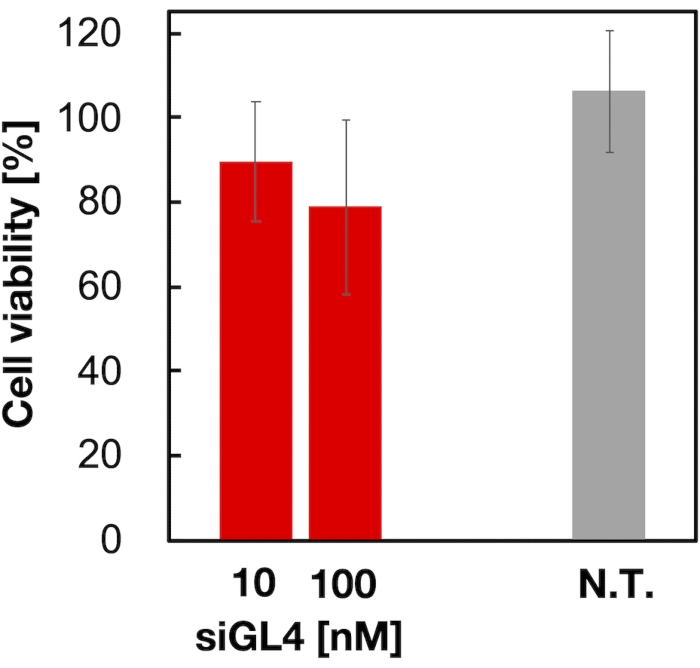
Figura 4: Citotoxicidad de los LNPs cargados de siRNA. Los LNPs cargados de siRNA se diluyeron con DMEM (FBS (-)) para obtener las concentraciones de siGL4 de 10 y 100 nM. Las suspensiones de LNP se añaden a las células HeLa-dLuc y se incuban durante 4 h a 37 °C en una incubadora de CO2 al 5%. N.T.: No tratado (D-PBS(-)). Los datos se representan como la media ± SD. n = 3. Haga clic aquí para ver una versión más grande de esta figura.
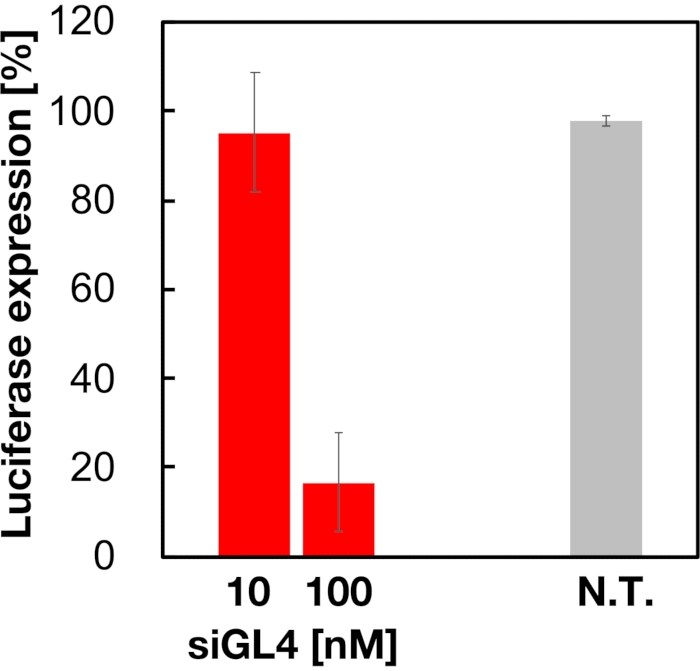
Figura 5: Actividad de derribo del gen de la luciferasa tratada con LNPs cargados de siRNA. Los LNPs cargados de siRNA se preparan de la misma manera que el ensayo de viabilidad celular. El nivel de expresión de luciferasa se mide utilizando el sistema de ensayo de luciferasa de doble glo. N.T.: No tratado (D-PBS(-)). Los datos se representan como media ± SD. n = 3. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El tamaño de la LNP afecta la biodistribución de la LNP, el efecto antitumoral y el rendimiento de silenciamiento génico. Por lo tanto, el método de control de tamaño LNP es una técnica importante para producir nanomedicamentos DDS, incluidos los sistemas de administración de ARN. El objetivo de este artículo es presentar el dispositivo iLiNP para el ajuste preciso del tamaño de los LNP y su aplicación a la producción de LNP cargados con siRNA. El dispositivo iLiNP fue capaz de controlar el tamaño LNP oscilado entre 20 y 100 nm (Figura 2)13. Cuando las condiciones de flujo, como el caudal total y el FRR se cambian para controlar el tamaño de LNP, la suspensión de LNP debe recogerse después de aproximadamente 5 a 10 s para estabilizar el flujo de solución. La suspensión de LNP recogida de la salida del dispositivo iLiNP se dializó inmediatamente contra la solución tampón para eliminar el etanol y evitar la agregación de LNP.
El control de tamaño LNP es uno de los principales desafíos en el campo de DDS. En general, el proceso de producción convencional de LNP, como el método de hidratación de la película lipídica, necesita un proceso de ajuste de tamaño después de la producción de LNP20. Por otro lado, el método de producción de LNPs basado en microfluídica puede producir los LNPs de tamaño controlado mediante la introducción de las soluciones lipídicas y acuosas en el dispositivo microfluídico6,11,13. Aunque se requiere el proceso de diálisis para eliminar el etanol de la suspensión de LNP, un proceso continuo por el dispositivo microfluídico junto con el sistema de flujo tangencial promete la automatización del proceso de producción de LNP14. Según la literatura, los tamaños POPC LNP fueron de 50-60 nm y 30-60 nm, para el dispositivo microfluídico de enfoque de flujo21 y el dispositivo mezclador caótico, respectivamente10. En comparación con otros dispositivos microfluídicos, el dispositivo iLiNP permite el control de tamaño POPC LNP en un amplio rango de 20 a 100 nm.
El proceso de fabricación del dispositivo iLiNP empleado fue la litografía blanda estándar. Por lo tanto, el dispositivo iLiNP puede ser producido en masa mediante la técnica de prototipado rápido y evitar la contaminación cruzada de las soluciones mediante el uso de un dispositivo desechable. El dispositivo iLiNP puede producir LNP cargados de siRNA de la misma manera que el método de producción popc LNP. Para el método de producción LNP que utiliza el dispositivo iLiNP, el usuario no requiere ningún procedimiento complicado. Por estas razones, se espera que el método de producción de LNP basado en microfluídica, incluido el dispositivo iLiNP, se emplee como el método de producción LNP estándar. El protocolo de este trabajo se puede adaptar a otros dispositivos microfluídicos para la producción de LNP. Además, la producción de LNPs cargados de ARNm también se habilita cambiando la solución de siRNA/tampón a una solución tampón que contiene ARNm.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por JST, CREST Grant Number JPMJCR17H1, Japan, JST, PRESTO Grant Number JPMJPR19K8, Japan, JST, SCORE, Japan, the Special Education and Research Expenses from the Ministry of Education, Culture, Sports, Science and Technology, JSPS KAKENHI Grant Number JP19KK0140, y Iketani Science and Technology Foundation.
Materiales
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine (POPC) | NOF Corp. | MC-6081 | |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (DMG-PEG2K) | NOF Corp. | GM-020 | |
| 1,2-dioleoyloxy-3-trimethylammonium propane (DOTAP) | NOF Corp. | CL-8181TA | |
| 1,2-Distearoyl-sn-glycero-3-phosphocholinev (DSPC) | NOF Corp. | MC-8080 | |
| 10 x D-PBS (-) | FUJIFILM Wako Pure Chemical Corp. | 048-29805 | |
| Acetic acid | FUJIFILM Wako Pure Chemical Corp. | 017-00251 | |
| CellTiter-Blue Cell Viability Assay | Promega | G8081 | |
| cholesterol | Sigma-Aldrich | C8667-5G | |
| Desktop maskless lithography system | NEOARK CORPORATION | DDB-701-DL4 | |
| Dialysis membrane | Repligen | 132697 | |
| Dual-Glo Luciferase Assay System | Promega | E2940 | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific | Lot: 42G6587K | |
| G418 | Nacalai Tesque | 08973-14 | |
| Glass substrate | Matsunami Glass Ind., Ltd. | S1111 | |
| Glass syringe | Hamilton | GASSTIGHT 1002 | |
| HeLa cell | HeLa-dluc cells were provided from Dr. Yusuke Sato at Hokkaido University | ||
| HEPES | FUJIFILM Wako Pure Chemical Corp. | 342-01375 | |
| Low-glucose Dulbecco’s modified Eagle medium (DMEM) | Sigma-Aldrich | D6046-500ML | |
| Oxygen plasma cleaner | Femto Science | CUTE-1MP/R | |
| Penicillin–streptomycin, trypsin (2.5%) | Thermo Fisher Scientific | 15140122 | |
| Quant-iT RiboGreen RNA Reagent | Thermo Fisher Scientific | R11491 | |
| siGL4 | Hokkaido System Science Co., Ltd | The sense and antisense strand sequences of siGL4 are 5'-CCGUCGUAUUCGUGAGCAATsT -3' and 5'-UUGCUCACGAAUACGACGGTsT -3', respectively. | |
| Silicon wafer | GTC | ||
| SILPOT 184 W/C (PDMS) | Dow Corning Toray Co., Ltd. | silicone base and curing agent are included | |
| Sodium acetate | FUJIFILM Wako Pure Chemical Corp. | 192-01075 | |
| Sodium chloride | FUJIFILM Wako Pure Chemical Corp. | 191-01665 | |
| SU-8 3050 | Nippon Kyaku Co., Ltd. | ||
| Syringe connector | Institute of microchemical Technology Co., Ltd. | ISC-011 | |
| Syringe pump | Chemyx | CX07200 | |
| trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma-Aldrich | 448931-10G | |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| UltraPure DNase/RNase-Free Distilled Water | Thermo Fisher Scientific | 10977015 | |
| Zetasizer Nano ZS | Malvern Instruments | ZEN3600 |
Referencias
- Schoenmaker, L., et al. mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability. International Journal of Pharmaceutics. 601, 120586 (2021).
- Chung, Y. H., Beiss, V., Fiering, S. N., Steinmetz, N. F. COVID-19 Vaccine frontrunners and their nanotechnology design. ACS Nano. 14 (10), 12522-12537 (2020).
- Dong, Y., et al. A systematic review of SARS-CoV-2 vaccine candidates. Signal Transduction and Targeted Therapy. 5 (1), 237 (2020).
- Cabral, H., et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size. Nature Nanotechnology. 6 (12), 815-823 (2011).
- Sato, Y., et al. Elucidation of the physicochemical properties and potency of siRNA-loaded small-sized lipid nanoparticles for siRNA delivery. Journal of Controlled Release. 229, 48-57 (2016).
- Kimura, N., et al. Three-dimensional, symmetrically assembled microfluidic device for lipid nanoparticle production. RSC Advances. 11 (3), 1430-1439 (2021).
- Maeki, M., Kimura, N., Sato, Y., Harashima, H., Tokeshi, M. Advances in microfluidics for lipid nanoparticles and extracellular vesicles and applications in drug delivery systems. Advanced Drug Delivery Reviews. 128, 84-100 (2018).
- Akinc, A., et al. The Onpattro story and the clinical translation of nanomedicines containing nucleic acid-based drugs. Nature Nanotechnology. 14 (12), 1084-1087 (2019).
- Kulkarni, J. A., Witzigmann, D., Chen, S., Cullis, P. R., vander Meel, R. Lipid nanoparticle technology for clinical translation of siRNA therapeutics. Accounts of Chemical Research. 52 (9), 2435-2444 (2019).
- Maeki, M., et al. Understanding the formation mechanism of lipid nanoparticles in microfluidic devices with chaotic micromixers. PLoS One. 12 (11), 0187962 (2017).
- Maeki, M., et al. A strategy for synthesis of lipid nanoparticles using microfluidic devices with a mixer structure. RSC Advances. 5 (57), 46181-46185 (2015).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1, 37 (2012).
- Kimura, N., et al. Development of the iLiNP Device: Fine Tuning the Lipid Nanoparticle Size within 10 nm for Drug Delivery. ACS Omega. 3 (5), 5044-5051 (2018).
- Kimura, N., et al. Development of a microfluidic-based post-treatment process for size-controlled lipid nanoparticles and application to siRNA delivery. ACS Applied Materials & Interfaces. 12 (30), 34011-34020 (2020).
- Hashiba, A., et al. The use of design of experiments with multiple responses to determine optimal formulations for in vivo hepatic mRNA delivery. Journal of Controlled Release. 327, 467-476 (2020).
- Suzuki, Y., et al. Lipid nanoparticles loaded with ribonucleoprotein-oligonucleotide complexes synthesized using a microfluidic device exhibit robust genome editing and hepatitis B virus inhibition. Journal of Controlled Release. 330, 61-71 (2020).
- Kimura, N., Maeki, M., Ishida, A., Tani, H., Tokeshi, M. One-step production using a microfluidic device of highly biocompatible size-controlled noncationic exosome-like nanoparticles for RNA delivery. ACS Applied Bio Materials. 4 (2), 1783-1793 (2021).
- Deng, T., Wu, H., Brittain, S. T., Whitesides, G. M. Prototyping of masks, masters, and stamps/molds for soft lithography using an office printer and photographic reduction. Analytical Chemistry. 72 (14), 3176-3180 (2000).
- Sato, Y., et al. A pH-sensitive cationic lipid facilitates the delivery of liposomal siRNA and gene silencing activity in vitro and in vivo. Journal of Controlled Release. 163 (3), 267-276 (2012).
- Ong, S. G., Chitneni, M., Lee, K. S., Ming, L. C., Yuen, K. H. Evaluation of extrusion technique for nanosizing liposomes. Pharmaceutics. 8 (4), (2016).
- Mijajlovic, M., Wright, D., Zivkovic, V., Bi, J. X., Biggs, M. J. Microfluidic hydrodynamic focusing based synthesis of POPC liposomes for model biological systems. Colloids and Surfaces B: Biointerfaces. 104, 276-281 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados