Method Article
マイクロ流体デバイスを用いたsiRNA搭載脂質ナノ粒子の製造
要約
マイクロ流体ベースの脂質ナノ粒子(LNP)生産方法は、RNA送達を含む薬物送達システム(DDS)において注目されている。このプロトコルは、iLiNPという名前の当社独自のマイクロ流体デバイスを使用した製造、LNP(siRNA搭載LNP)生産、およびLNP評価プロセスを記述しています。
要約
機能性脂質ナノ粒子(LNP)の開発は、ドラッグデリバリーシステム(DDS)の分野における大きな課題の1つです。近年、LNPベースのRNA送達系、すなわちRNA負荷LNPがRNA治療に注目されている。特に、COVID-19を予防するmRNA搭載LNPワクチンが承認され、次世代ナノ医薬品の開発へのパラダイムシフトが生まれました。LNPベースのナノ医薬品にとって、LNPサイズはLNPの生体分布とLNP性能を制御する上で重要な要素です。そのため、LNPの生産工程には精密なLNPサイズ制御技術が不可欠です。ここでは、iLiNPという名前のマイクロ流体装置を使用してサイズ制御されたLNP生産のためのプロトコルを報告する。siRNA負荷LNPsもiLiNPデバイスを用いて産生され、 インビトロ 実験によって評価される。siRNA搭載LNP、Z電位、siRNA封入効率、細胞毒性、および標的遺伝子サイレンシング活性を含むLNPサイズについて代表的な結果が示されている。
概要
脂質ナノ粒子(LNP)は、RNA送達系に最も広く使用されているナノ担体の1つである。最近、mRNAをロードしたLNPは、COVID-191、2、3の予防のためのワクチンとして承認されました。一般に、LNPのサイズは、遺伝子サイレンシングまたはタンパク質発現を含む生体分布および薬物送達システム(DDS)性能において重要な役割を果たしている4,5,6。そのため、LNP生産プロセスには精密なLNPサイズ制御方法が必要です。
サイズ制御されたLNPの製造のために、マイクロ流体デバイスは長年にわたって注目を集めてきました7。2018年、食品医薬品局(FDA)が承認した最初のsiRNA搭載LNP(オンパトロなど)がマイクロ流体デバイスを使用して開発されました8,9。マイクロ流体ベースのLNP製造方法では、脂質溶液と水溶液とを別々にマイクロ流体デバイスに導入し、次いでマイクロ流路内で混合する。混合効率を高めるために、LNP生産にはカオスミキサー装置が用いられている10、11、12。カオスミキサー装置により、特定のサイズのLNPを製造することができます。
バッフル構造を備えた侵襲性脂質ナノ粒子生産(iLiNP)と呼ばれる単純なマイクロ流体装置が開発され、LNPサイズを正確に制御しています13,14。カオスミキサー装置と比較して、iLiNP装置は、10nm間隔で20〜100nmの範囲のLNPサイズを制御することができた。さらに、iLiNPデバイスは、siRNA負荷LNPs6、mRNA負荷LNPs15、リボヌクレオタンパク質負荷LNPs16、およびエキソソーム様LNPs17を産生した。本稿の目的は,iLiNPデバイスの作製およびsiRNA搭載LNP生産プロセスを紹介し,iLiNPデバイスによって製造されるLNP評価プロセスを説明することである.
プロトコル
1. iLiNPデバイスの作製
注:iLiNPデバイスは、標準的なソフトリソグラフィ法18を使用して製造されています。詳細な製造プロトコルは以前に報告されました10,13。
- SU-8金型製作
- SU-8 3050を3インチシリコンウェーハに注ぎます。シリコンウエハーをスピンコートし、厚さ100μmのSU-8層を得た。
- シリコンウェーハをホットプレート上に65°Cで5分間、95°Cで45分間置いて焼きます。
- ベーク後、シリコンウェーハをデスクトップマスクレスリソグラフィシステムのステージに置きます。
- シリコンウェーハを365nmのUV光に1位置あたり1.5秒間露光します。
注:この実験では、デスクトップマスクレスリソグラフィシステムが使用されました。このシステムは、マイクロ流路の分割された照射領域(1箇所)でUV光を自動的に露光する。 - UV照射後、ホットプレート上のシリコンウェーハを65°Cで1分間、95°Cで5分間ベークする。
- シリコンウェーハを冷却し、SU-8現像液に15分間浸して露出していないSU-8を除去します。
- セシケーターと真空ポンプを使用して、トリクロロ(1H,1H,2H,2H-パーフルオロオクチル)シランの蒸気でSU-8金型を処理します。
- iLiNPデバイスの作製
- シリコーン基剤とポリジメチルシロキサン(PDMS)硬化剤を10:1(w/w)の比率で混合する。
- 真空ポンプおよびデシケーターを用いて混合物を脱気する。
注:PDMSは、真空ポンプを使用して室温で10分間脱気した。 - 脱気したPDMSを厚さ0.5〜1cmまでの100mmペトリ皿のSU-8金型に注ぎ、続いて80°Cのオーブンで1時間焼成する。
- 金型を冷却し、ピンセットを用いてPDMS基板をSU-8金型から剥離します。
- PDMS基板に3つの穴(0.5 mm)を打ち抜きます。酸素プラズマクリーナーを用いてPDMS基板とスライドガラスを貼り合わせ、iLiNP素子( 図1参照)13を構築します。
- 3つのPEEK毛細血管(内径0.3mm、外径0.5mm)をiLiNPデバイスの入口および出口に接続し、スーパーグルーで硬化させる。
注:PEEK毛細血管の長さは調整可能であり、実験に依存する。
脂質溶液の調製
- 脂質/エタノール溶液を調製する:13.4mM 1-パルミトイル-2-オレオイル-sn-グリセロ-3-ホスホコリン(POPC)、10mM 1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン(DSPC)、20mM 1,2-ジオレオイルオキシ-3-トリメチルアンモニウムプロパン(DOTAP)、5mM 1,2-ジミリストイル-rac-グリセロ-3-メトキシポリエチレングリコール-2000(DMG-PEG2k)、および20mMコレステロール。実験前にストック溶液を-20°Cで保存する。
- siRNAをロードしたLNPを製造するには、DOTAP、DSPC、コレステロール、DMG-PEG2k溶液をモル比50/10/38.5/1.5で混合します。総脂質濃度は8mMに調整される。
水溶液の調製
- 水溶液を調製する:DNase/RNaseを含まない蒸留水を使用して、154 mM NaCl(生理食塩水)、25 mM酢酸緩衝液をpH 4.0で。
- 0.2μmサイズのメンブレンフィルターまたはシリンジフィルターで溶液をろ過します。
4. siRNA/緩衝液の調製
- 70 μg の siGL4 を 1 mL の 25 mM 酢酸緩衝液 (pH 4.0) に溶解する。
注:siGL4はルシフェラーゼ遺伝子のノックダウンに使用されます。
5. iLiNP装置のセットアップとLNPの生産
メモ: 回路図については、 図 1 を参照してください。
- 1mLのガラスシリンジに脂質および水溶液をそれぞれ充填する(個々のシリンジのステップ3.1および4.1から)。
注:LNP評価実験に必要な量に応じて脂質および水溶液量を調整してください。 - シリンジコネクタを使用して、ガラスシリンジをPEEKキャピラリーに接続します。
- 脂質および水溶液の流量を設定する。
注:水相と脂質相の流量比(FRR)は、3:1〜9:1の範囲である。 - シリンジポンプを使用して、脂質と水溶液を別々にiLiNPデバイスに導入する。
- LNP懸濁液をiLiNPデバイスの出口からマイクロチューブに集めます(図1)。
6. LNP懸濁液の透析とLNPサイズ測定
- POPC LNPおよびsiRNA搭載LNPについて、それぞれ生理食塩水またはD-PBSに対して透析膜(12−14kDa MWカットオフ)を用いて一晩透析膜(12−14kDa MWカットオフ)を用いてLNP懸濁液を透析する。
注:POPCは生理食塩水に溶解しません(2.1参照)。POPC/エタノール溶液は、iLiNP装置内で生理食塩水で希釈される。 - 透析したLNP懸濁液をマイクロチューブに集める。
- LNP懸濁液20〜30μLをマイクロ石英セルにピペットする。
- 動的光散乱(DLS)によってLNPサイズ、LNPサイズ分布、および多分散度指数を測定します。
7. LNPのZポテンシャルの測定
注:Z電位の測定には、製造元の指示に従って粒子分析装置( 材料表を参照)を使用しました。
- 工程6.1から得られたLNP懸濁液を、10mM HEPES緩衝液(pH7.4)で35倍に希釈する。
- 希釈したLNP懸濁液のピペット700〜1000 μLを毛細血管細胞に。
- 製造元の指示に従ってZ電位を測定します。
8. リボグリーンアッセイによるsiRNA封入効率
注:LNPs19へのsiRNA封入を評価するためにリボグリーンアッセイが行われる。リボグリーンアッセイは、界面活性剤(例えば、TritonX-100)の有無にかかわらず、LNPの内外のRNAの量を測定することができる。
- 2 mg/mL の siGL4 を 10 mM HEPES緩衝液 (pH 7.4) で 500 ng/mL の siGL4 溶液に希釈します。
- siGL4溶液の希釈系列(0, 12.5, 25, 50, 100, 200 ng/mL)を調製し、Triton(+)およびTriton(-)サンプルの検量線を作成します。
- LNP懸濁液を10mM HEPES緩衝液(pH7.4)で100倍に希釈する。
- Triton(+)溶液について、980 μLの10 mM HEPES(pH 7.4)、20 μLの10% w/v TritonX-100、および1.25 μLのRiboGreenを96ウェルマイクロプレートの10ウェルに混合する。
- Triton(-)溶液について、1000 μLの10 mM HEPES(pH 7.4)と1.25 μLのRiboGreenを96ウェルマイクロプレートの10ウェルに混合する。
- 希釈系列のsiGL4溶液および希釈LNP懸濁液のピペット100 μLを黒色96ウェルマイクロプレートのウェルに入れた。
注:siGL4溶液および希釈LNP懸濁液の希釈シリーズを、条件ごとに4つのマイクロウェルに分注した。 - 検出溶液(TritonX-100(+)またはTriton(-))のピペット100 μLをウェルに入れます。
注:検出溶液(TritonX-100(+))を条件ごとにサンプルごとに2つのウェルに分注し、TritonX-100(-)溶液をサンプル条件ごとに残りの2つのウェルに分注しました。 - マイクロプレートを室温で5分間インキュベートする。
- マイクロプレートリーダーを用いて波長475nmで蛍光強度を測定する。
- 下記式19からsiRNA封入率を算出する。
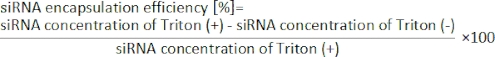
9. 細胞培養
- DMEM、熱失活10%FBS、100U/mLペニシリン、100μg/mLストレプトマイシン、および400μg/mL G418を含む増殖培地を調製する。
- ホタルとウミシイタケルシフェラーゼ(HeLa-dluc)を安定に発現するHeLa細胞を、増殖培地を入れた100mmTC処理細胞培養皿中で37°Cで5%CO2 インキュベーター内で培養した。
10. 細胞生存率アッセイ
- 増殖培地(6 x 103 細胞/ウェル)中のHeLa細胞懸濁液100 μLを96ウェルマイクロプレートにシードする。
注:細胞は、細胞カウンタープレートおよび顕微鏡を用いて計数した。 - マイクロプレートを5%CO2インキュベーター内で37°Cで24 時間インキュベートする。
- siRNA 搭載 LNP を DMEM (FBS (-)) で 10 nM および 100 nM siRNA の濃度で希釈します。
- 希釈したsiRNA搭載LNP懸濁液を1ウェルあたり100 μL分注する。
- マイクロプレートを5%CO2 インキュベーター内で37°Cで4時間インキュベートする。
- LNP懸濁液を取り出し、100μLのDMEM(FBS(+))を添加する。
- マイクロプレートを5%CO2インキュベーター内で37°Cで20 時間インキュベートする。
- 製造業者のプロトコールに従って市販のキットを用いて細胞生存率を測定する。
注:D-PBS(-)を陰性対照として用いた。
ルシフェラーゼ遺伝子ノックダウンアッセイ
- 増殖培地(4.5 x 103 細胞/ウェル)中のHeLa細胞懸濁液75 μLを96ウェルマイクロプレートにシードする。
- マイクロプレートを5%CO2インキュベーター内で37°Cで24 時間インキュベートする。
- siRNA 搭載 LNP を DMEM (FBS (-)) で 10 nM および 100 nM siRNA の濃度で希釈します。
- 希釈したsiRNA搭載LNP懸濁液を1ウェルあたり75 μL分注します。
- マイクロプレートを5%CO2 インキュベーター内で37°Cで4時間インキュベートする。
- LNP懸濁液を取り出し、75μLのDMEM(FBS(+))を添加する。
- マイクロプレートを5%CO2インキュベーター内で37°Cで20 時間インキュベートする。
- 製造者のプロトコールに従って市販のキットを用いてルシフェラーゼ発現を測定する。
注:ネガティブコントロールとしてD-PBS(-)を使用しました。
結果
図2A,Bは、異なる流動条件で生成されたPOPC LNPサイズ分布を示しています。マイクロ流体ベースのLNP調製方法は、総流量(TFR)やFRRなどの流動条件によってLNPのサイズを制御することができます。カオスミキサー装置やフローフォーカシングマイクロ流体装置などの一般的なマイクロ流体装置と比較して、iLiNP装置は20~100nmの範囲の正確なLNPサイズ制御を可能にしました(図2)。小型LNPは、高い総流量条件で形成されます。さらに、FRR5で形成されたLNPサイズは、総流量にかかわらず、FRR3のLNPサイズよりも小さかった13。
siRNA搭載LNPもiLiNPデバイスを用いて調製した(図3A)。siRNA搭載LNP調製物では、カチオン性脂質であるDOTAPを使用して、siRNAをLNPに効果的に封入した。iLiNPデバイスは、狭い分布で90nmサイズのsiRNA搭載カチオン性LNPを作製した(図3A、B)。siRNAの封入効率は、カチオン性脂質と負に荷電したsiRNAとの間の静電的相互作用のために95%であった(図3C)。
90nmサイズのsiRNA搭載LNPsの細胞毒性および遺伝子サイレンシング活性を、図4および図5に示すように評価した。siRNAをロードしたLNPは、10および100nM siRNAの用量で細胞毒性を示した。また、siRNA濃度に依存してルシフェラーゼの発現量が低下することも確認した。siRNA搭載LNPは、100nM siRNAの用量で80%のルシフェラーゼ発現を抑制した。遺伝子サイレンシング活性に対するLNPサイズの影響は以前に報告されていた6,13,17。
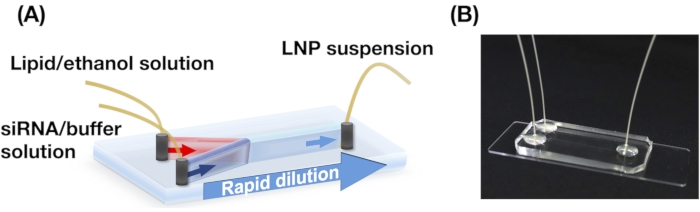
図1:(A)iLiNPデバイスの概略説明図および(B)写真。 iLiNPデバイスは、PDMSおよびガラス基板を含む。iLiNPデバイスは、スーパーグルーでPEEK毛細血管に接続されています。脂質溶液とsiRNA/バッファー溶液は、シリンジポンプを使用してiLiNPデバイスに別々に導入されます。LNP懸濁液はマイクロチューブに集められる。この図の拡大版を表示するには、ここをクリックしてください。
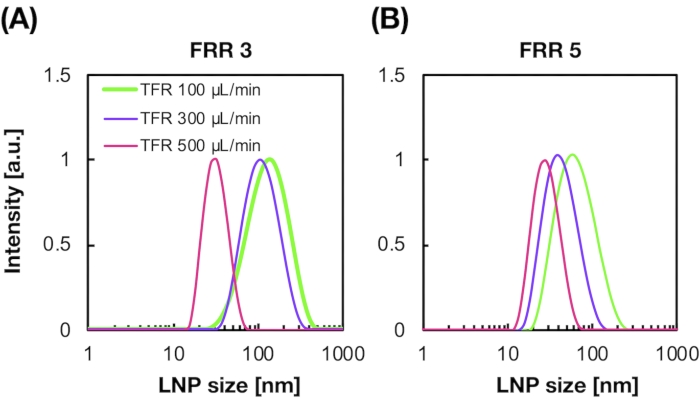
図2:異なる流量比(FRR)でiLiNPデバイスによって生成されたPOPC LNPサイズ分布。 POPC LNP サイズは、動的光散乱 (DLS) によって測定されます。POPC LNPは、総流量とFRR((A)3FRRおよび(B)5FRRを変更することによって調製される。小型LNPは、高い総流量条件で形成されます。さらに、FRR5で形成されたLNPサイズは、FRR3で形成されたLNPサイズよりも小さかった。 この図の拡大版を表示するには、ここをクリックしてください。
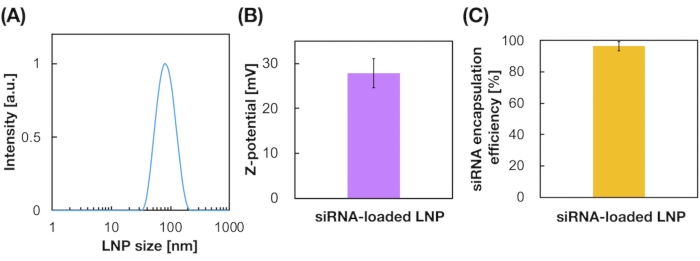
図3:siRNA搭載LNPの特性評価(A)siRNA搭載LNPのサイズ分布siRNA(siGL4)は、カチオン性脂質(DOTAP)と負に荷電したsiRNAとの間の静電相互作用によってLNPに封入される。(B)siRNA搭載LNPsのZ電位。LNP懸濁液を測定前に10 mM HEPES緩衝液(pH 7.4)で希釈した。データは平均±SD(標準偏差)として表されます。n = 3。(c)DOTAPベースのLNPsのsiRNA封入効率。封入効率は、リボグリーンアッセイにより決定した。データは、平均±SDとして表され、n=3である。この図の拡大版を表示するには、ここをクリックしてください。
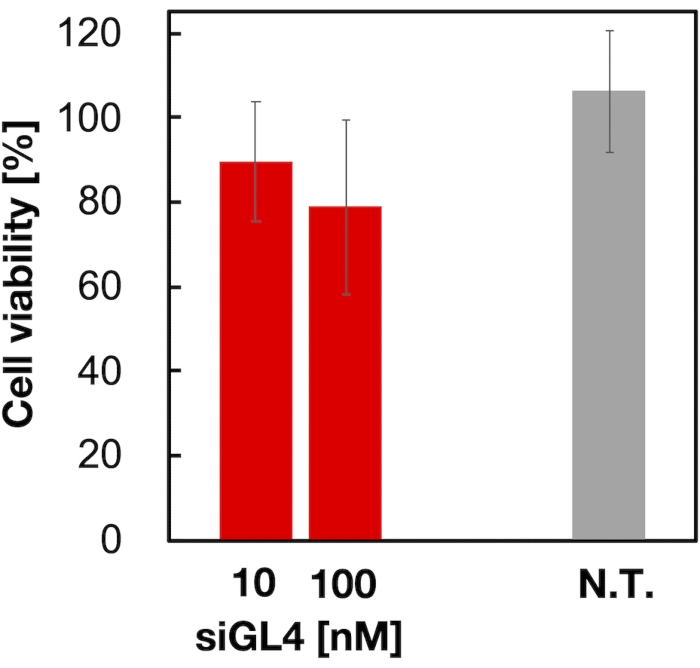
図4:siRNA搭載LNPの細胞毒性 siRNA搭載LNPsをDMEM(FBS(-))で希釈し、10および100nMのsiGL4濃度を得た。LNP懸濁液をHeLa-dLuc細胞に添加し、5%CO2インキュベーター内で37°Cで4時間インキュベートする。N.T.:未処理(D-PBS(-))。データは、SD±平均として表されます。この図の拡大版を表示するには、ここをクリックしてください。
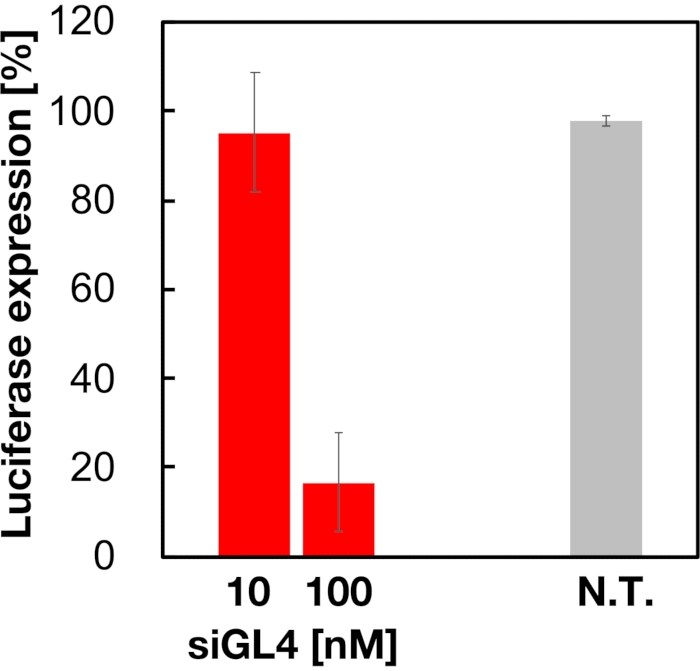
図5:siRNA搭載LNPsで処理したルシフェラーゼ遺伝子ノックダウン活性。 ルシフェラーゼ発現量は、デュアルグロルシフェラーゼアッセイシステムを用いて測定される。N.T.:未処理(D-PBS(-))。データは、平均±SDとして表され 、n =3である。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
LNPサイズは、LNPの生体分布、抗腫瘍効果、および遺伝子サイレンシング性能に影響します。したがって、LNPサイズ制御法は、RNA送達系を含むDDSナノ医薬品を製造するための重要な技術である。本稿の目的は、LNPsの正確なサイズチューニングのためのiLiNPデバイスと、siRNA搭載LNPs生産への応用を紹介することである。iLiNPデバイスは、20~100nmの範囲のLNPサイズを制御することができました(図2)13。LNPサイズを制御するために総流量やFRRなどの流量条件を変更する場合は、溶液の流れを安定させるために、LNP懸濁液を約5〜10秒後に収集する必要があります。iLiNP装置の出口から回収したLNP懸濁液を直ちに緩衝液に対して透析し、エタノールを除去し、LNP凝集を防止した。
LNPサイズ制御は、DDS分野における大きな課題の1つです。一般に、脂質膜水和法などの従来のLNP生産工程では、LNP製造後にサイズ同調工程を必要とする20。一方、マイクロ流体系LNPs製造方法は、マイクロ流体デバイス6,11,13に脂質及び水溶液を導入することにより、サイズ制御されたLNPsを製造することができる。透析プロセスはLNP懸濁液からエタノールを除去するために必要とされるが、接線流システムと結合されたマイクロ流体装置による連続プロセスは、LNP生産プロセスの自動化を約束する14。文献によると、POPCのLNPサイズは、流量集束マイクロ流体装置21およびカオスミキサー装置について、それぞれ50〜60nmおよび30〜60nmであった10。他のマイクロ流体デバイスと比較して、iLiNPデバイスは、20〜100nmの広い範囲でPOPC LNPサイズ制御を可能にします。
採用したiLiNPデバイスの作製プロセスは、標準的なソフトリソグラフィー法であった。したがって、iLiNPデバイスは、ラピッドプロトタイピング技術によって大量生産することができ、使い捨てデバイスを使用することによって溶液の交差汚染を防止することができる。iLiNPデバイスは、POPC LNP生産法と同様にしてsiRNA搭載LNPを製造することができる。iLiNP装置を用いたLNP生産方式は、煩雑な手順が不要です。これらのことから、iLiNP装置を含むマイクロ流体ベースのLNP生産方式が、標準的なLNP生産方法として採用されることが期待されます。この論文のプロトコルは、LNP生産のための他のマイクロ流体装置に適合させることができる。また、siRNA/緩衝液をmRNAを含む緩衝液に変更することで、mRNA搭載LNPの生産も可能になります。
開示事項
著者らは開示するものは何もありません。
謝辞
本研究は、JST、CREST助成番号JPMJCR17H1、日本、JST、さきがけ助成番号JPMJPR19K8、日本、JST、SCORE、文部科学省の特別支援教育研究費、日本学術振興会科学研究費補助金JP19KK0140、池谷科学技術振興財団の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine (POPC) | NOF Corp. | MC-6081 | |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (DMG-PEG2K) | NOF Corp. | GM-020 | |
| 1,2-dioleoyloxy-3-trimethylammonium propane (DOTAP) | NOF Corp. | CL-8181TA | |
| 1,2-Distearoyl-sn-glycero-3-phosphocholinev (DSPC) | NOF Corp. | MC-8080 | |
| 10 x D-PBS (-) | FUJIFILM Wako Pure Chemical Corp. | 048-29805 | |
| Acetic acid | FUJIFILM Wako Pure Chemical Corp. | 017-00251 | |
| CellTiter-Blue Cell Viability Assay | Promega | G8081 | |
| cholesterol | Sigma-Aldrich | C8667-5G | |
| Desktop maskless lithography system | NEOARK CORPORATION | DDB-701-DL4 | |
| Dialysis membrane | Repligen | 132697 | |
| Dual-Glo Luciferase Assay System | Promega | E2940 | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific | Lot: 42G6587K | |
| G418 | Nacalai Tesque | 08973-14 | |
| Glass substrate | Matsunami Glass Ind., Ltd. | S1111 | |
| Glass syringe | Hamilton | GASSTIGHT 1002 | |
| HeLa cell | HeLa-dluc cells were provided from Dr. Yusuke Sato at Hokkaido University | ||
| HEPES | FUJIFILM Wako Pure Chemical Corp. | 342-01375 | |
| Low-glucose Dulbecco’s modified Eagle medium (DMEM) | Sigma-Aldrich | D6046-500ML | |
| Oxygen plasma cleaner | Femto Science | CUTE-1MP/R | |
| Penicillin–streptomycin, trypsin (2.5%) | Thermo Fisher Scientific | 15140122 | |
| Quant-iT RiboGreen RNA Reagent | Thermo Fisher Scientific | R11491 | |
| siGL4 | Hokkaido System Science Co., Ltd | The sense and antisense strand sequences of siGL4 are 5'-CCGUCGUAUUCGUGAGCAATsT -3' and 5'-UUGCUCACGAAUACGACGGTsT -3', respectively. | |
| Silicon wafer | GTC | ||
| SILPOT 184 W/C (PDMS) | Dow Corning Toray Co., Ltd. | silicone base and curing agent are included | |
| Sodium acetate | FUJIFILM Wako Pure Chemical Corp. | 192-01075 | |
| Sodium chloride | FUJIFILM Wako Pure Chemical Corp. | 191-01665 | |
| SU-8 3050 | Nippon Kyaku Co., Ltd. | ||
| Syringe connector | Institute of microchemical Technology Co., Ltd. | ISC-011 | |
| Syringe pump | Chemyx | CX07200 | |
| trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma-Aldrich | 448931-10G | |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| UltraPure DNase/RNase-Free Distilled Water | Thermo Fisher Scientific | 10977015 | |
| Zetasizer Nano ZS | Malvern Instruments | ZEN3600 |
参考文献
- Schoenmaker, L., et al. mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability. International Journal of Pharmaceutics. 601, 120586 (2021).
- Chung, Y. H., Beiss, V., Fiering, S. N., Steinmetz, N. F. COVID-19 Vaccine frontrunners and their nanotechnology design. ACS Nano. 14 (10), 12522-12537 (2020).
- Dong, Y., et al. A systematic review of SARS-CoV-2 vaccine candidates. Signal Transduction and Targeted Therapy. 5 (1), 237 (2020).
- Cabral, H., et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size. Nature Nanotechnology. 6 (12), 815-823 (2011).
- Sato, Y., et al. Elucidation of the physicochemical properties and potency of siRNA-loaded small-sized lipid nanoparticles for siRNA delivery. Journal of Controlled Release. 229, 48-57 (2016).
- Kimura, N., et al. Three-dimensional, symmetrically assembled microfluidic device for lipid nanoparticle production. RSC Advances. 11 (3), 1430-1439 (2021).
- Maeki, M., Kimura, N., Sato, Y., Harashima, H., Tokeshi, M. Advances in microfluidics for lipid nanoparticles and extracellular vesicles and applications in drug delivery systems. Advanced Drug Delivery Reviews. 128, 84-100 (2018).
- Akinc, A., et al. The Onpattro story and the clinical translation of nanomedicines containing nucleic acid-based drugs. Nature Nanotechnology. 14 (12), 1084-1087 (2019).
- Kulkarni, J. A., Witzigmann, D., Chen, S., Cullis, P. R., vander Meel, R. Lipid nanoparticle technology for clinical translation of siRNA therapeutics. Accounts of Chemical Research. 52 (9), 2435-2444 (2019).
- Maeki, M., et al. Understanding the formation mechanism of lipid nanoparticles in microfluidic devices with chaotic micromixers. PLoS One. 12 (11), 0187962 (2017).
- Maeki, M., et al. A strategy for synthesis of lipid nanoparticles using microfluidic devices with a mixer structure. RSC Advances. 5 (57), 46181-46185 (2015).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1, 37 (2012).
- Kimura, N., et al. Development of the iLiNP Device: Fine Tuning the Lipid Nanoparticle Size within 10 nm for Drug Delivery. ACS Omega. 3 (5), 5044-5051 (2018).
- Kimura, N., et al. Development of a microfluidic-based post-treatment process for size-controlled lipid nanoparticles and application to siRNA delivery. ACS Applied Materials & Interfaces. 12 (30), 34011-34020 (2020).
- Hashiba, A., et al. The use of design of experiments with multiple responses to determine optimal formulations for in vivo hepatic mRNA delivery. Journal of Controlled Release. 327, 467-476 (2020).
- Suzuki, Y., et al. Lipid nanoparticles loaded with ribonucleoprotein-oligonucleotide complexes synthesized using a microfluidic device exhibit robust genome editing and hepatitis B virus inhibition. Journal of Controlled Release. 330, 61-71 (2020).
- Kimura, N., Maeki, M., Ishida, A., Tani, H., Tokeshi, M. One-step production using a microfluidic device of highly biocompatible size-controlled noncationic exosome-like nanoparticles for RNA delivery. ACS Applied Bio Materials. 4 (2), 1783-1793 (2021).
- Deng, T., Wu, H., Brittain, S. T., Whitesides, G. M. Prototyping of masks, masters, and stamps/molds for soft lithography using an office printer and photographic reduction. Analytical Chemistry. 72 (14), 3176-3180 (2000).
- Sato, Y., et al. A pH-sensitive cationic lipid facilitates the delivery of liposomal siRNA and gene silencing activity in vitro and in vivo. Journal of Controlled Release. 163 (3), 267-276 (2012).
- Ong, S. G., Chitneni, M., Lee, K. S., Ming, L. C., Yuen, K. H. Evaluation of extrusion technique for nanosizing liposomes. Pharmaceutics. 8 (4), (2016).
- Mijajlovic, M., Wright, D., Zivkovic, V., Bi, J. X., Biggs, M. J. Microfluidic hydrodynamic focusing based synthesis of POPC liposomes for model biological systems. Colloids and Surfaces B: Biointerfaces. 104, 276-281 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved