Method Article
Produção de nanopartículas lipídicas carregadas de siRNA usando um dispositivo microfluido
Neste Artigo
Resumo
Os métodos de produção de nanopartículas lipídicas à base de microfluídica (LNP) têm atraído atenção em sistemas de entrega de medicamentos (DDSs), incluindo a entrega de RNA. Este protocolo descreve os processos de fabricação, produção de LNP (LNP carregado de siRNA) e processos de avaliação do LNP usando nosso dispositivo microfluido original chamado iLiNP.
Resumo
O desenvolvimento de nanopartículas lipídicas funcionais (LNPs) é um dos grandes desafios no campo dos sistemas de entrega de medicamentos (DDS). Recentemente, os sistemas de entrega de RNA baseados em LNP, ou seja, LNPs carregados de RNA têm atraído atenção para a terapia de RNA. Em particular, as vacinas LNP carregadas de mRNA foram aprovadas para prevenir o COVID-19, levando assim à mudança de paradigma para o desenvolvimento de nanomedicinas de próxima geração. Para as nanomedicinas baseadas no LNP, o tamanho do LNP é um fator significativo no controle da biodistribução do LNP e do desempenho do LNP. Portanto, uma técnica precisa de controle de tamanho do LNP é indispensável para o processo de produção do LNP. Aqui, relatamos um protocolo para a produção de LNP controlado por tamanho usando um dispositivo microfluido, chamado iLiNP. LNPs carregados de siRNA também são produzidos usando o dispositivo iLiNP e avaliados por experimento in vitro . Os resultados representativos são mostrados para o tamanho do LNP, incluindo LNPs carregados de siRNA, potencial Z, eficiência de encapsulamento de siRNA, citotoxicidade e atividade de silenciamento genético alvo.
Introdução
A nanopartícula lipídica (LNP) é um dos nanocarriers mais utilizados para sistemas de entrega de RNA. Recentemente, os LNPs carregados de mRNA foram aprovados como vacinas para a prevenção do COVID-191,2,3. Geralmente, o tamanho do LNP desempenha um papel crucial no desempenho dos sistemas de biodistribuição e distribuição de medicamentos (DDS), incluindo silenciamento genético ou expressão proteica4,5,6. Portanto, é necessário um método preciso de controle de tamanho do LNP para o processo de produção do LNP.
Para a produção de LNPs controlados de tamanho, dispositivos microfluidos têm atraído atenção ao longo dos anos7. Em 2018, a primeira LNPs de SiRNA com siRNA (por exemplo, Onpattro) aprovada pela Food and Drug Administration (FDA) foi desenvolvida usando o dispositivo microfluido8,9. No método de produção de LNP baseado em microfluidic, uma solução lipídica e uma solução aquosa são introduzidas separadamente no dispositivo microfluido e, em seguida, misturadas no microcanal. Para aumentar a eficiência da mistura, o dispositivo de misturador caótico tem sido usado para a produção do LNP10,11,12. O dispositivo de misturador caótico permite produzir LNPs de tamanho específico.
Um simples dispositivo microfluido, chamado de produção invasiva de nanopartículas lipídicas (iLiNP), equipado com estruturas de defletor, foi desenvolvido para controlar o tamanho do LNP precisamente13,14. Em comparação com o dispositivo de misturador caótico, o dispositivo iLiNP foi capaz de controlar o tamanho do LNP variou de 20 a 100 nm em intervalos de 10 nm. Além disso, o dispositivo iLiNP produziu LNPs6 carregados de siRNA, LNPs 15 carregados de mRNA, LNPs 16 carregados de ribonucleoproteína e LNPs17 exossomo. O objetivo deste artigo é introduzir o processo de produção de LNP carregado de iLiNP e descrever o processo de avaliação do LNP produzido pelo dispositivo iLiNP.
Protocolo
1. Fabricação do dispositivo iLiNP
NOTA: O dispositivo iLiNP é fabricado usando o método de litografia suave padrão18. O protocolo de fabricação detalhado foi relatado anteriormente10,13.
- Fabricação de molde SU-8
- Despeje SU-8 3050 em um wafer de silício de 3 polegadas. Gire o wafer de silício para obter uma camada SU-8 de 100 μm de espessura.
- Asse o wafer de silício colocando em uma placa quente a 65 °C por 5 min e 95 °C por 45 min.
- Depois de assar, coloque o wafer de silício no palco de um sistema de litografia sem máscara de desktop.
- Exponha o wafer de silício à luz UV a 365 nm por 1,5 s por uma posição.
NOTA: Um sistema de litografia sem máscara de desktop foi usado neste experimento. O sistema expõe automaticamente a luz UV em uma área de irradiação dividida (uma posição) do microcanal. - Após a irradiação UV, asse o wafer de silício na placa quente a 65 °C por 1 min e 95 °C por 5 min.
- Esfrie o wafer de silício e, em seguida, mergulhe em um desenvolvedor SU-8 por 15 minutos para remover su-8 não exposto.
- Trate o molde SU-8 withvapor de Trichloro(1H,1H,2H,2H-perfluorooctil)silane usando um dessecador e uma bomba de vácuo.
- Fabricação do dispositivo iLiNP
- Misture a base de silicone e o agente de cura polidimetilsiloxano (PDMS) em uma proporção de 10:1 (w/w).
- Desgas a mistura usando uma bomba de vácuo e um desiccador.
NOTA: O PDMS foi desgaseado usando uma bomba de vácuo por 10 minutos a temperatura ambiente. - Despeje o PDMS desgasegasecido no molde SU-8 em uma placa de Petri de 100 mm até 0,5 a 1 cm de espessura, seguido de cozimento em um forno a 80 °C por 1 h.
- Esfrie o molde e, em seguida, descasque o substrato PDMS do molde SU-8 usando uma pinça.
- Faça três furos (0,5 mm) no substrato PDMS. Conecte o substrato PDMS e uma lâmina de vidro usando um limpador de plasma de oxigênio para construir um dispositivo iLiNP (ver Figura 1)13.
- Conecte três capilares PEEK (I.D. 0,3 mm, O.D. 0,5 mm) às entradas e saída do dispositivo iLiNP e cure com uma supercola.
NOTA: O comprimento dos capilares PEEK é ajustável e depende do experimento.
2. Preparação de soluções lipídicas
- Preparar soluções lipídicas/etanol: 13,4 mM 1-palmitoyl-2-oleoyl-sn-glycero-3-fosfocholina (POPC), 10 mM 1,2-Distearoyl-sn-glycero-3-phosphocholine (DSPC), 2 0 mM 1,2-dioleoyloxy-3-trimethylammonium propano (DOTAP), 5 mM 1,2-dimyristoyl-rac-glycero-3-metoxipoethylene glicol-2000 (DMG-PEG2k) e 20 mM de colesterol. Armazene as soluções de estoque a -20 °C antes do experimento.
- Para produzir as LNPs carregadas de sirna, misture as soluções DOTAP, DSPC, colesterol e DMG-PEG2k a uma razão molar de 50/10/38,5/1,5. A concentração lipídica total é ajustada para 8 mM.
3. Preparação de soluções aquosas
- Prepare soluções aquosas: 154 mM NaCl (soro fisiológico), tampão de acetato de 25 mM no pH 4.0 usando água destilada sem DNase/RNase.
- Filtre as soluções através de filtros de membrana de tamanho de 0,2 μm ou filtros de seringa.
4. Preparação da solução siRNA/tampão
- Dissolva 70 μg de siGL4 em 1 mL de tampão de acetato de 25 mM (pH 4.0).
NOTA: siGL4 é usado para o knockdown do gene luciferase.
5. Configuração do dispositivo iLiNP e produção de LNPs
NOTA: Consulte a Figura 1 para os esquemas.
- Encha 1 mL de seringas de vidro com soluções lipídicas e aquosas (das etapas 3.1 e 4.1 em seringas individuais), respectivamente.
NOTA: Ajuste o volume lipídide e aqueoso da solução, dependendo da quantidade necessária para o experimento de avaliação do LNP. - Conecte as seringas de vidro aos capilares PEEK usando conectores de seringa.
- Defina a vazão das soluções lipídicas e aquosas.
NOTA: A relação de fluxo (FRR) da fase aquosa até a fase lipídica varia de 3:1 a 9:1. - Introduza as soluções lipídicas e aquosas separadamente no dispositivo iLiNP usando bombas de seringa.
- Colete suspensões LNP em um microtubo da tomada do dispositivo iLiNP (Figura 1).
6. Diálise da suspensão do LNP e medição do tamanho do LNP
- Dique a suspensão do LNP usando uma membrana de diálise (cortes de 12-14 kDa MW) a 4 °C durante a noite contra soro fisiológico ou D-PBS para LNPs POPC e LNPs carregados de siRNA, respectivamente.
NOTA: O POPC não é dissolvido em soro fisiológico (consulte 2.1). A solução POPC/etanol é diluída com soro fisiológico no dispositivo iLiNP. - Colete as suspensões dialisada do LNP em microtubos.
- Pipeta 20-30 μL da suspensão LNP para uma célula de micro quartzo.
- Meça o tamanho do LNP, a distribuição do tamanho do LNP e o índice de polidispersidade por dispersão dinâmica de luz (DLS).
7. Medição do potencial Z do LNP
NOTA: Para a medição do potencial Z, foi utilizado um analisador de partículas (ver Tabela de Materiais) seguindo a instrução do fabricante.
- Diluir a suspensão LNP obtida a partir da etapa 6.1, 35 vezes com tampão HEPES de 10 mM (pH 7.4).
- Pipeta 700 a 1000 μL da suspensão diluída do LNP para uma célula capilar.
- Meça o potencial Z de acordo com a instrução do fabricante.
8. eficiência de encapsulamento siRNA por ensaio RiboGreen
NOTA: O ensaio ribogreen é realizado para avaliar o encapsulamento de siRNA em LNPs19. O ensaio ribogreen pode medir a quantidade de RNAs dentro e fora de LNPs com/sem um surfactante (por exemplo, TritonX-100).
- Diluir 2 mg/mL de siGL4 com tampão HEPES de 10 mM (pH 7.4) a 500 ng/mL siGL4 solução.
- Prepare a série de diluição (0, 12,5, 25, 50, 100, 200 ng/mL) da solução siGL4 para fazer uma curva de calibração para amostras de Triton (+) e Triton (-).
- Diluir a suspensão LNP 100 vezes com tampão HEPES de 10 mM (pH 7.4).
- Misture a seguinte solução para Triton (+) solução: 980 μL de 10 mM HEPES (pH 7.4), 20 μL de 10% w/v TritonX-100 e 1,25 μL de RiboGreen para 10 poços de uma microplaca de 96 poços.
- Misture a seguinte solução para Triton (-) solução: 1000 μL de 10 mM HEPES (pH 7.4) e 1,25 μL de RiboGreen para 10 poços de uma microplaca de 96 poços.
- Pipeta 100 μL da série de diluição da solução siGL4 e suspensões DE LNP diluídas nos poços de uma microplaca preta de 96 poços.
NOTA: A série de diluição da solução siGL4 e as suspensões diluídas do LNP foram distribuídas em quatro microwells por condição. - Pipeta 100 μL da solução de detecção (TritonX-100 (+) ou Triton (-)) nos poços.
NOTA: A solução de detecção (TritonX-100 (+)) foi distribuída em dois poços por amostra por condição, e a solução TritonX-100 (-) foi dispensada nos dois poços restantes por condição amostral. - Incubar a microplacão por 5 minutos em temperatura ambiente.
- Meça a intensidade da fluorescência usando um leitor de microplaca em um comprimento de onda de 475 nm.
- Calcule a eficiência de encapsulamento do siRNA a partir da seguinte equação19.
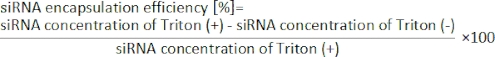
9. Cultura celular
- Prepare um meio de crescimento contendo DMEM, 10% FBS inativado por calor, penicilina de 100 U/mL, estreptomicina de 100 μg/mL e 400 μg/mL G418.
- Cultura Células HeLa expressando stably firefly e renilla luciferase (HeLa-dluc) em um prato de cultura celular tc de 100 mm contendo o meio de crescimento a 37 °C em uma incubadora de CO2 de 5%.
10. Ensaio de viabilidade celular
- Semente 100 μL de uma suspensão de células HeLa no meio de crescimento (6 x 103 células/bem) em uma microplato de 96 poços.
NOTA: As células foram contadas usando uma placa de contador celular e um microscópio. - Incubar a microplaca por 24 h a 37 °C em uma incubadora de CO2 de 5%.
- Diluir os LNPs carregados de siRNA com DMEM (-)) nas concentrações de 10 e 100 nM siRNAs.
- Dispense 100 μL da suspensão LNP diluída carregada de siRNA por poço.
- Incubar a microplaca por 4h a 37 °C em uma incubadora de CO2 de 5%.
- Remova a suspensão do LNP e adicione 100 μL de DMEM (FBS (+)).
- Incubar a microplaca por 20 h a 37 °C em uma incubadora de CO2 de 5%.
- Meça a viabilidade celular usando um kit comercialmente disponível de acordo com o protocolo do fabricante.
NOTA: D-PBS (-) foi utilizado como controle negativo.
11. Ensaio de knockdown genético luciferase
- Semente 75 μL de uma suspensão de células HeLa no meio de crescimento (4,5 x 103 células/bem) em uma microplapá de 96 poços.
- Incubar a microplaca por 24 h a 37 °C em uma incubadora de CO2 de 5%.
- Diluir os LNPs carregados de siRNA com DMEM (-)) nas concentrações de 10 e 100 nM siRNAs.
- Dispense 75 μL da suspensão LNP diluída carregada de siRNA por um poço.
- Incubar a microplaca por 4h a 37 °C em uma incubadora de CO2 de 5%.
- Remova a suspensão do LNP e adicione 75 μL de DMEM (FBS (+)).
- Incubar a microplaca por 20 h a 37 °C em uma incubadora de CO2 de 5%.
- Meça a expressão da luciferase usando um kit comercialmente disponível de acordo com o protocolo do fabricante.
NOTA: Usamos D-PBS (-) como controle negativo.
Resultados
A Figura 2A,B mostra a distribuição do tamanho do LNP POPC produzida em diferentes condições de fluxo. O método de preparação do LNP baseado em microfluidic pode controlar o tamanho dos LNPs pelas condições de fluxo, como a taxa de fluxo total (TFR) e a FRR. Comparado com os dispositivos microfluidos típicos, incluindo o dispositivo de misturador caótico e o dispositivo microfluido com foco de fluxo, o dispositivo iLiNP permitiu um controle preciso do tamanho do LNP variando de 20 a 100 nm (Figura 2). LNPs de pequeno porte formados em altas condições de fluxo total. Além disso, os tamanhos do LNP formados na RR de 5 foram menores do que os da RSR de 3, independentemente da taxa de fluxo total13.
LNPs carregados de siRNA também foram preparados usando o dispositivo iLiNP (Figura 3A). Para a preparação do LNP carregado de siRNA, DOTAP, um lipídio cônico, foi usado para encapsular o siRNA nos LNPs efetivamente. O dispositivo iLiNP produziu LNPs casáticos carregados de siRNA de 90 nm com distribuição estreita (Figura 3A,B). A eficiência de encapsulamento do siRNA foi de 95% devido à interação eletrostática entre o lipídico tóctico e siRNAs carregados negativamente (Figura 3C).
A citotoxicidade e a atividade de silenciamento genético de LNPs carregados de siRNA de 90 nm foram avaliados como mostrados na Figura 4 e Figura 5. LNPs carregados de siRNA mostraram citotoxicidade em uma dose de 10 e 100 nM siRNA. Também confirmamos que o nível de expressão da luciferase foi diminuído dependendo da concentração de sirna. Os LNPs carregados de siRNA suprimiram 80% de expressão de luciferase em uma dose de siRNA de 100 nM. O efeito do tamanho do LNP na atividade de silenciamento genético foi relatado anteriormente6,13,17.
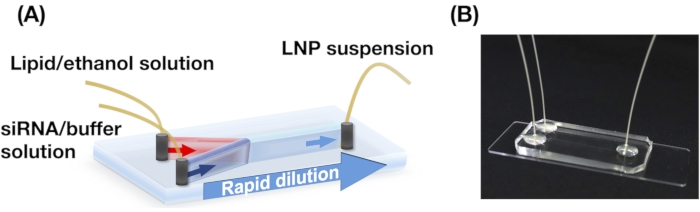
Figura 1: (A) Ilustração esquemática e (B) fotografia do dispositivo iLiNP. O dispositivo iLiNP é composto por PDMS e substratos de vidro. O dispositivo iLiNP está conectado aos capilares PEEK com uma supercola. As soluções lipídicas e siRNA/buffer são introduzidas separadamente no dispositivo iLiNP usando bombas de seringa. A suspensão do LNP é coletada em um microtubo. Clique aqui para ver uma versão maior desta figura.
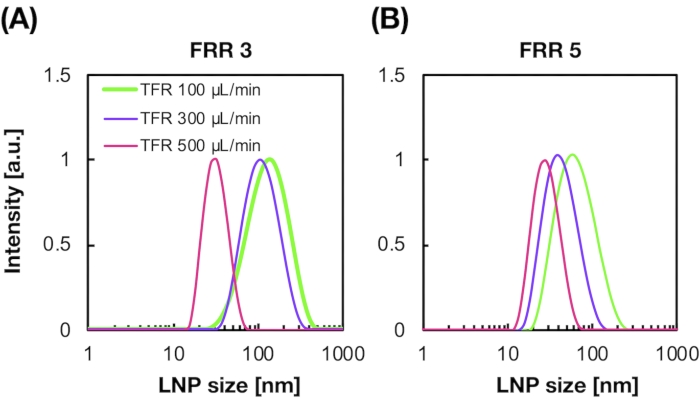
Figura 2: Distribuições de tamanho POPC LNP produzidas pelo dispositivo iLiNP nas diferentes taxas de fluxo (FRR). O tamanho do LNP POPC é medido pela dispersão dinâmica de luz (DLS). Os LNPs POPC são preparados alterando a taxa de fluxo total e a FRR: (A) 3 FRR e (B) 5 FRR. Os LNPs de pequeno porte são formados em altas condições de fluxo total. Além disso, os tamanhos do LNP formados na RS foram menores do que os da RS 3. Clique aqui para ver uma versão maior desta figura.
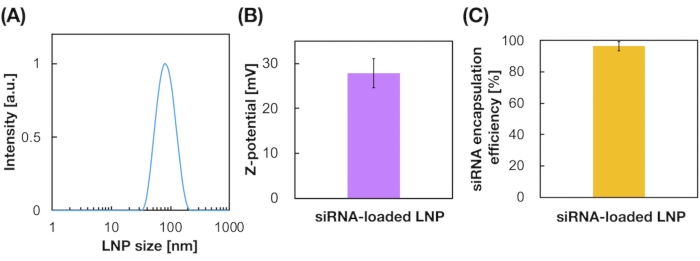
Figura 3: Caracterização dos LNPs carregados de siRNA. (A) A distribuição de tamanho dos LNPs carregados de siRNA. siRNAs (siGL4) são encapsulados nos LNPs por interação eletrostática entre o lipídio cationico (DOTAP) e siRNAs carregados negativamente. (B) Potencial Z dos LNPs carregados de siRNA. A suspensão do LNP foi diluída com tampão HEPES de 10 mM (pH 7.4) antes da medição. Os dados são representados como ± média SD (Desvio Padrão). n = 3. (C) eficiência de encapsulamento siRNA dos LNPs baseados em DOTAP. A eficiência de encapsulamento foi determinada pelo ensaio RiboGreen. Os dados são representados como média ± SD. n = 3. Clique aqui para ver uma versão maior desta figura.
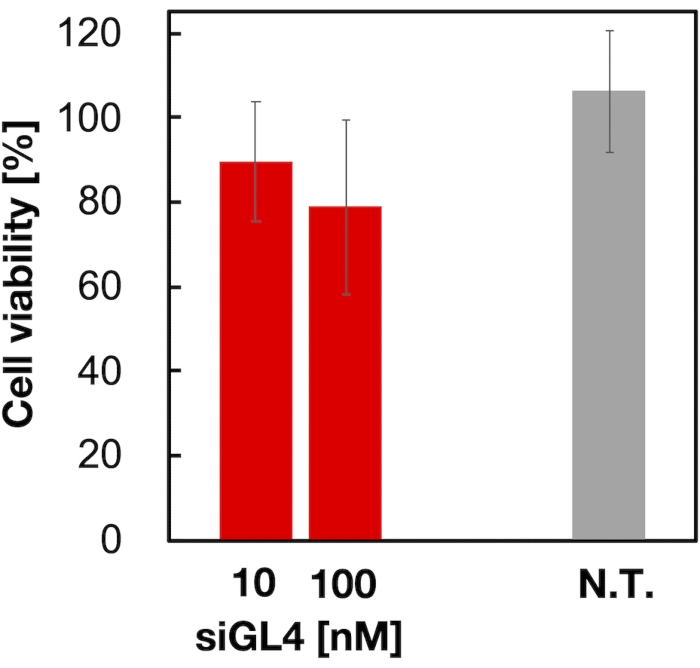
Figura 4: Citotoxicidade dos LNPs carregados de siRNA. Os LNPs carregados de siRNA foram diluídos com DMEM (-)) para obter as concentrações siGL4 de 10 e 100 nM. As suspensões do LNP são adicionadas às células HeLa-dLuc e incubadas por 4 h a 37 °C em uma incubadora de CO2 de 5%. N.T.: Não tratado (D-PBS(-)). Os dados são representados como a média ± SD. n = 3. Clique aqui para ver uma versão maior desta figura.
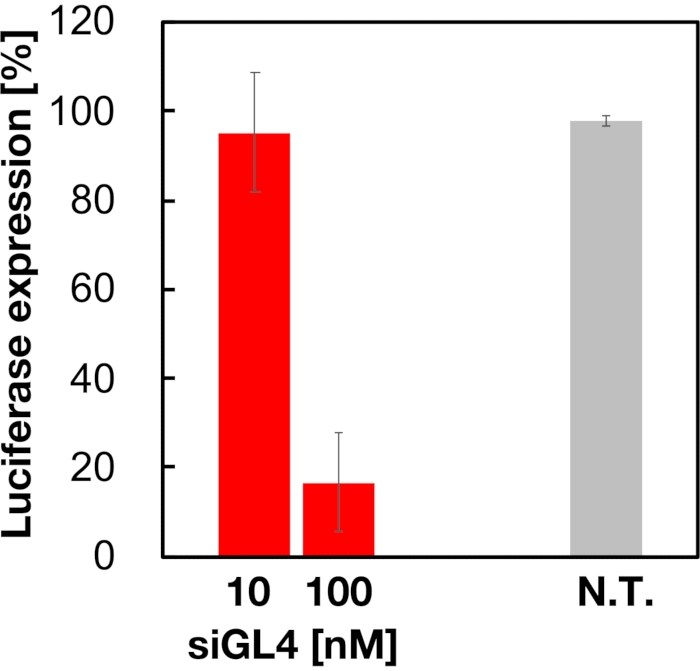
Figura 5: A atividade de knockdown genético luciferase tratada com LNPs carregados de siRNA. LNPs carregados de siRNA são preparados da mesma forma que o ensaio de viabilidade celular. O nível de expressão da luciferase é medido usando o Sistema de Ensaio Luciferase Dual-Glo. N.T.: Não tratado (D-PBS(-)). Os dados são representados como média ± SD. n = 3. Clique aqui para ver uma versão maior desta figura.
Discussão
O tamanho do LNP afeta a biodistribução do LNP, o efeito anti-tumor e o desempenho do silenciamento genético. Portanto, o método de controle de tamanho lnp é uma técnica significativa para a produção de nanomedicinas DDS, incluindo sistemas de entrega de RNA. O objetivo deste artigo é introduzir o dispositivo iLiNP para ajuste de tamanho preciso de LNPs e sua aplicação à produção de LNPs carregados de siRNA. O dispositivo iLiNP foi capaz de controlar o tamanho do LNP que variou de 20 a 100 nm (Figura 2)13. Quando as condições de fluxo, como a taxa de fluxo total e a FRR são alteradas para controlar o tamanho do LNP, a suspensão do LNP deve ser coletada após cerca de 5 a 10 s para estabilizar o fluxo da solução. A suspensão do LNP coletada da tomada do dispositivo iLiNP foi diátria imediatamente contra a solução tampão para remover o etanol e evitar a agregação do LNP.
O controle de tamanho do LNP é um dos grandes desafios no campo do DDS. Geralmente, o processo convencional de produção do LNP, como o método de hidratação de filme lipídeído, precisa de um processo de ajuste de tamanho após a produção do LNP20. Por outro lado, o método de produção de LNPs baseado em microfluidic pode produzir os LNPs controlados pelo tamanho, introduzindo as soluções lipídicas e aquosas no dispositivo microfluido6,11,13. Embora o processo de diálise seja necessário para remover o etanol da suspensão do LNP, um processo contínuo pelo dispositivo microfluido aliado ao sistema de fluxo tangencial promete a automação do processo de produção do LNP14. De acordo com a literatura, os tamanhos do POPC LNP foram de 50-60 nm e 30-60 nm, para o dispositivo microfluido com foco de fluxo21 e o dispositivo de batedeira caótico, respectivamente10. Comparado com outros dispositivos microfluidos, o dispositivo iLiNP permite o controle de tamanho popc LNP em uma ampla gama de 20 a 100 nm.
O processo de fabricação do dispositivo iLiNP empregado foi a litografia suave padrão. Assim, o dispositivo iLiNP pode ser produzido em massa pela técnica de prototipagem rápida e evitar a contaminação cruzada de soluções usando um dispositivo descartável. O dispositivo iLiNP pode produzir LNPs carregados de siRNA da mesma forma que o método de produção do POPC LNP. Para o método de produção do LNP usando o dispositivo iLiNP, o usuário não requer procedimentos complicados. Por essas razões, espera-se que o método de produção de LNP baseado em microfluidic, incluindo o dispositivo iLiNP, seja empregado como o método padrão de produção do LNP. O protocolo deste artigo pode ser adaptado a outros dispositivos microfluidos para produção de LNP. Além disso, a produção de LNPs carregados de mRNA também é habilitada alterando a solução siRNA/buffer para uma solução tampão contendo mRNAs.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelo JST, CREST Grant Number JPMJCR17H1, Japão, JST, PRESTO Grant Number JPMJPR19K8, Japão, JST, SCORE, Japan, the Special Education and Research Expenses do Ministério da Educação, Cultura, Esportes, Ciência e Tecnologia, JSPS KAKENHI Grant Number JP19KK0140, e Iketani Science and Technology Foundation.
Materiais
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine (POPC) | NOF Corp. | MC-6081 | |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (DMG-PEG2K) | NOF Corp. | GM-020 | |
| 1,2-dioleoyloxy-3-trimethylammonium propane (DOTAP) | NOF Corp. | CL-8181TA | |
| 1,2-Distearoyl-sn-glycero-3-phosphocholinev (DSPC) | NOF Corp. | MC-8080 | |
| 10 x D-PBS (-) | FUJIFILM Wako Pure Chemical Corp. | 048-29805 | |
| Acetic acid | FUJIFILM Wako Pure Chemical Corp. | 017-00251 | |
| CellTiter-Blue Cell Viability Assay | Promega | G8081 | |
| cholesterol | Sigma-Aldrich | C8667-5G | |
| Desktop maskless lithography system | NEOARK CORPORATION | DDB-701-DL4 | |
| Dialysis membrane | Repligen | 132697 | |
| Dual-Glo Luciferase Assay System | Promega | E2940 | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific | Lot: 42G6587K | |
| G418 | Nacalai Tesque | 08973-14 | |
| Glass substrate | Matsunami Glass Ind., Ltd. | S1111 | |
| Glass syringe | Hamilton | GASSTIGHT 1002 | |
| HeLa cell | HeLa-dluc cells were provided from Dr. Yusuke Sato at Hokkaido University | ||
| HEPES | FUJIFILM Wako Pure Chemical Corp. | 342-01375 | |
| Low-glucose Dulbecco’s modified Eagle medium (DMEM) | Sigma-Aldrich | D6046-500ML | |
| Oxygen plasma cleaner | Femto Science | CUTE-1MP/R | |
| Penicillin–streptomycin, trypsin (2.5%) | Thermo Fisher Scientific | 15140122 | |
| Quant-iT RiboGreen RNA Reagent | Thermo Fisher Scientific | R11491 | |
| siGL4 | Hokkaido System Science Co., Ltd | The sense and antisense strand sequences of siGL4 are 5'-CCGUCGUAUUCGUGAGCAATsT -3' and 5'-UUGCUCACGAAUACGACGGTsT -3', respectively. | |
| Silicon wafer | GTC | ||
| SILPOT 184 W/C (PDMS) | Dow Corning Toray Co., Ltd. | silicone base and curing agent are included | |
| Sodium acetate | FUJIFILM Wako Pure Chemical Corp. | 192-01075 | |
| Sodium chloride | FUJIFILM Wako Pure Chemical Corp. | 191-01665 | |
| SU-8 3050 | Nippon Kyaku Co., Ltd. | ||
| Syringe connector | Institute of microchemical Technology Co., Ltd. | ISC-011 | |
| Syringe pump | Chemyx | CX07200 | |
| trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma-Aldrich | 448931-10G | |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| UltraPure DNase/RNase-Free Distilled Water | Thermo Fisher Scientific | 10977015 | |
| Zetasizer Nano ZS | Malvern Instruments | ZEN3600 |
Referências
- Schoenmaker, L., et al. mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability. International Journal of Pharmaceutics. 601, 120586 (2021).
- Chung, Y. H., Beiss, V., Fiering, S. N., Steinmetz, N. F. COVID-19 Vaccine frontrunners and their nanotechnology design. ACS Nano. 14 (10), 12522-12537 (2020).
- Dong, Y., et al. A systematic review of SARS-CoV-2 vaccine candidates. Signal Transduction and Targeted Therapy. 5 (1), 237 (2020).
- Cabral, H., et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size. Nature Nanotechnology. 6 (12), 815-823 (2011).
- Sato, Y., et al. Elucidation of the physicochemical properties and potency of siRNA-loaded small-sized lipid nanoparticles for siRNA delivery. Journal of Controlled Release. 229, 48-57 (2016).
- Kimura, N., et al. Three-dimensional, symmetrically assembled microfluidic device for lipid nanoparticle production. RSC Advances. 11 (3), 1430-1439 (2021).
- Maeki, M., Kimura, N., Sato, Y., Harashima, H., Tokeshi, M. Advances in microfluidics for lipid nanoparticles and extracellular vesicles and applications in drug delivery systems. Advanced Drug Delivery Reviews. 128, 84-100 (2018).
- Akinc, A., et al. The Onpattro story and the clinical translation of nanomedicines containing nucleic acid-based drugs. Nature Nanotechnology. 14 (12), 1084-1087 (2019).
- Kulkarni, J. A., Witzigmann, D., Chen, S., Cullis, P. R., vander Meel, R. Lipid nanoparticle technology for clinical translation of siRNA therapeutics. Accounts of Chemical Research. 52 (9), 2435-2444 (2019).
- Maeki, M., et al. Understanding the formation mechanism of lipid nanoparticles in microfluidic devices with chaotic micromixers. PLoS One. 12 (11), 0187962 (2017).
- Maeki, M., et al. A strategy for synthesis of lipid nanoparticles using microfluidic devices with a mixer structure. RSC Advances. 5 (57), 46181-46185 (2015).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1, 37 (2012).
- Kimura, N., et al. Development of the iLiNP Device: Fine Tuning the Lipid Nanoparticle Size within 10 nm for Drug Delivery. ACS Omega. 3 (5), 5044-5051 (2018).
- Kimura, N., et al. Development of a microfluidic-based post-treatment process for size-controlled lipid nanoparticles and application to siRNA delivery. ACS Applied Materials & Interfaces. 12 (30), 34011-34020 (2020).
- Hashiba, A., et al. The use of design of experiments with multiple responses to determine optimal formulations for in vivo hepatic mRNA delivery. Journal of Controlled Release. 327, 467-476 (2020).
- Suzuki, Y., et al. Lipid nanoparticles loaded with ribonucleoprotein-oligonucleotide complexes synthesized using a microfluidic device exhibit robust genome editing and hepatitis B virus inhibition. Journal of Controlled Release. 330, 61-71 (2020).
- Kimura, N., Maeki, M., Ishida, A., Tani, H., Tokeshi, M. One-step production using a microfluidic device of highly biocompatible size-controlled noncationic exosome-like nanoparticles for RNA delivery. ACS Applied Bio Materials. 4 (2), 1783-1793 (2021).
- Deng, T., Wu, H., Brittain, S. T., Whitesides, G. M. Prototyping of masks, masters, and stamps/molds for soft lithography using an office printer and photographic reduction. Analytical Chemistry. 72 (14), 3176-3180 (2000).
- Sato, Y., et al. A pH-sensitive cationic lipid facilitates the delivery of liposomal siRNA and gene silencing activity in vitro and in vivo. Journal of Controlled Release. 163 (3), 267-276 (2012).
- Ong, S. G., Chitneni, M., Lee, K. S., Ming, L. C., Yuen, K. H. Evaluation of extrusion technique for nanosizing liposomes. Pharmaceutics. 8 (4), (2016).
- Mijajlovic, M., Wright, D., Zivkovic, V., Bi, J. X., Biggs, M. J. Microfluidic hydrodynamic focusing based synthesis of POPC liposomes for model biological systems. Colloids and Surfaces B: Biointerfaces. 104, 276-281 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados