Method Article
Production de nanoparticules lipidiques chargées de siRNA à l’aide d’un dispositif microfluidique
Dans cet article
Résumé
Les méthodes de production de nanoparticules lipidiques (LNP) à base de microfluidique ont attiré l’attention dans les systèmes d’administration de médicaments (DDS), y compris l’administration d’ARN. Ce protocole décrit les processus de fabrication, de production de LNP (LNP chargé de siRNA) et d’évaluation LNP à l’aide de notre dispositif microfluidique original nommé iLiNP.
Résumé
Le développement de nanoparticules lipidiques fonctionnelles (LNP) est l’un des défis majeurs dans le domaine des systèmes d’administration de médicaments (DDS). Récemment, les systèmes d’administration d’ARN basés sur LNP, à savoir les LNP chargés d’ARN, ont attiré l’attention pour la thérapie par ARN. En particulier, les vaccins LNP chargés d’ARNm ont été approuvés pour prévenir la COVID-19, ce qui a conduit au changement de paradigme vers le développement de nanomédicaments de nouvelle génération. Pour les nanomédicaments à base de LNP, la taille du LNP est un facteur important dans le contrôle de la biodistribution LNP et des performances LNP. Par conséquent, une technique précise de contrôle de la taille du LNP est indispensable pour le processus de production du LNP. Ici, nous rapportons un protocole pour la production de LNP à taille contrôlée à l’aide d’un dispositif microfluidique, nommé iLiNP. Les LNP chargés en siRNA sont également produits à l’aide du dispositif iLiNP et évalués par expérience in vitro . Des résultats représentatifs sont présentés pour la taille du LNP, y compris les LNP chargés en siRNA, le potentiel Z, l’efficacité de l’encapsulation du siRNA, la cytotoxicité et l’activité de silençage du gène cible.
Introduction
La nanoparticule lipidique (LNP) est l’un des nanotransporteurs les plus utilisés pour les systèmes d’administration d’ARN. Récemment, les LNP chargés d’ARNm ont été approuvés comme vaccins pour la prévention de la COVID-191,2,3. En général, la taille du LNP joue un rôle crucial dans la performance des systèmes de biodistribution et d’administration de médicaments (DDS), y compris le silençage génique ou l’expression des protéines4,5,6. Par conséquent, une méthode précise de contrôle de la taille du LNP est nécessaire pour le processus de production du LNP.
Pour la production de LNP à taille contrôlée, les dispositifs microfluidiques ont attiré l’attention au fil des ans7. En 2018, le premier LNP chargé de siRNA approuvé par la Food and Drug Administration (FDA) (par exemple, Onpattro) a été développé à l’aide du dispositif microfluidique8,9. Dans la méthode de production de LNP à base de microfluidique, une solution lipidique et une solution aqueuse sont introduites séparément dans le dispositif microfluidique, puis mélangées dans le microcanal. Pour améliorer l’efficacité du mélange, le mélangeur chaotique a été utilisé pour la production LNP10,11,12. Le mélangeur chaotique permet de produire des LNP de taille spécifique.
Un dispositif microfluidique simple, appelé production invasive de nanoparticules lipidiques (iLiNP), équipé de structures de déflecteurs, a été développé pour contrôler la taille du LNP avec précision13,14. En comparaison avec le mélangeur chaotique, le dispositif iLiNP était capable de contrôler la taille LNP allant de 20 à 100 nm à des intervalles de 10 nm. En outre, le dispositif iLiNP a produit des LNP6 chargés en siRNA, des LNP15 chargés en ARNm, des LNP16 chargés en ribonucléoprotéines16 et des LNP de type exosome17. L’objectif de cet article est d’introduire le processus de fabrication et de production de LNP chargé d’ARN du dispositif iLiNP et de décrire le processus d’évaluation du LNP produit par le dispositif iLiNP.
Protocole
1. Fabrication de l’appareil iLiNP
REMARQUE: Le dispositif iLiNP est fabriqué à l’aide de la méthode de lithographie logicielle standard18. Le protocole de fabrication détaillé a été signalé précédemment10,13.
- Fabrication de moules SU-8
- Versez le SU-8 3050 sur une plaquette de silicium de 3 pouces. Spin coat la plaquette de silicium pour obtenir une couche SU-8 de 100 μm d’épaisseur.
- Cuire la plaquette de silicium en la plaçant sur une plaque chauffante à 65 °C pendant 5 min et à 95 °C pendant 45 min.
- Après la cuisson, placez la plaquette de silicium sur la scène d’un système de lithographie sans masque de bureau.
- Exposez la plaquette de silicium à la lumière UV à 365 nm pendant 1,5 s par position.
REMARQUE: Un système de lithographie sans masque de bureau a été utilisé dans cette expérience. Le système expose automatiquement la lumière UV dans une zone d’irradiation divisée (une position) du microcanal. - Après irradiation UV, cuire la plaquette de silicium sur la plaque chauffante à 65 °C pendant 1 min et à 95 °C pendant 5 min.
- Refroidir la plaquette de silicium, puis faire tremper dans un révélateur SU-8 pendant 15 minutes pour éliminer le SU-8 non exposé.
- Traiter le moule SU-8 avec du fumigène de Trichloro(1H,1H,2H,2H-perfluorooctyl)silane à l’aide d’un dessiccateur et d’une pompe à vide.
- Fabrication de l’appareil iLiNP
- Mélanger la base de silicone et l’agent de durcissement du polydiméthylsiloxane (PDMS) dans un rapport de 10:1 (p / p).
- Dégazez le mélange à l’aide d’une pompe à vide et d’un dessiccateur.
REMARQUE: Le PDMS a été dégazé à l’aide d’une pompe à vide pendant 10 minutes à température ambiante. - Versez le PDMS dégazé sur le moule SU-8 dans une boîte de Petri de 100 mm jusqu’à 0,5 à 1 cm d’épaisseur, puis faites cuire au four à 80 °C pendant 1 h.
- Refroidissez le moule, puis pelez le substrat PDMS du moule SU-8 à l’aide d’une pince à épiler.
- Perforez trois trous (0,5 mm) dans le substrat PDMS. Collez le substrat PDMS et une lame de verre à l’aide d’un nettoyeur à plasma à oxygène pour construire un dispositif iLiNP (voir Figure 1)13.
- Connectez trois capillaires PEEK (I.D. 0,3 mm, O.D. 0,5 mm) aux entrées et sorties du dispositif iLiNP et durcissez avec une superglue.
REMARQUE: La longueur des capillaires PEEK est réglable et dépend de l’expérience.
2. Préparation de solutions lipidiques
- Préparer des solutions lipidiques/éthanol : 13,4 mM de 1-palmitoyl-2-oléoyl-sn-glycéro-3-phosphocholine (POPC), 10 mM de 1,2-Distearoyl-sn-glycero-3-phosphocholine (DSPC), 20 mM de 1,2-dioléoyloxy-3-triméthylammonium propane (DOTAP), 5 mM de 1,2-dimyristoyl-rac-glycero-3-méthoxypolyéthylène glycol-2000 (DMG-PEG2k) et 20 mM de cholestérol. Conservez les solutions mères à -20 °C avant l’expérience.
- Pour produire les LNP chargés de siRNA, mélanger les solutions DOTAP, DSPC, cholestérol et DMG-PEG2k à un rapport molaire de 50/10/38,5/1,5. La concentration totale de lipides est ajustée à 8 mM.
3. Préparation de solutions aqueuses
- Préparer des solutions aqueuses : 154 mM de NaCl (solution saline), 25 mM de tampon d’acétate à pH 4,0 à l’aide d’eau distillée sans DNase/RNase.
- Filtrer les solutions à travers des filtres à membrane ou des filtres à seringue de 0,2 μm.
4. Préparation de la solution siRNA/tampon
- Dissoudre 70 μg de siGL4 dans 1 mL de tampon d’acétate de 25 mM (pH 4,0).
REMARQUE: siGL4 est utilisé pour l’élimination du gène de la luciférase.
5. Configuration de l’appareil iLiNP et production de LNP
REMARQUE : Voir la figure 1 pour les schémas.
- Remplissez les seringues en verre de 1 mL avec des solutions lipidiques et aqueuses (des étapes 3.1 et 4.1 dans des seringues individuelles), respectivement.
REMARQUE: Ajuster le volume lipidique et aqueux de la solution en fonction de la quantité requise pour l’expérience d’évaluation LNP. - Connectez les seringues en verre aux capillaires EN PEEK à l’aide de connecteurs de seringue.
- Réglez le débit des solutions lipidiques et aqueuses.
REMARQUE: Le rapport de débit (FRR) de la phase aqueuse à la phase lipidique varie de 3: 1 à 9: 1. - Introduisez les solutions lipidiques et aqueuses séparément dans le dispositif iLiNP à l’aide de pompes à seringues.
- Collectez les suspensions LNP dans un microtube à partir de la sortie du dispositif iLiNP (Figure 1).
6. Dialyse de la suspension LNP et mesure de la taille LNP
- Dialysez la suspension LNP à l’aide d’une membrane de dialyse (coupures de 12−14 kDa MW) à 4 °C pendant la nuit contre une solution saline ou D-PBS pour les LNP POPC et les LNP chargés en siRNA, respectivement.
REMARQUE: PopC n’est pas dissous dans une solution saline (voir 2.1). La solution de POPC/éthanol est diluée avec une solution saline dans le dispositif iLiNP. - Collectez les suspensions LNP dialysées dans des microtubes.
- Pipette 20-30 μL de la suspension LNP vers une cellule de micro quartz.
- Mesurez la taille LNP, la distribution de taille LNP et l’indice de polydispersité par diffusion dynamique de la lumière (DLS).
7. Mesure du potentiel Z du LNP
REMARQUE: Pour la mesure du potentiel Z, un analyseur de particules (voir tableau des matériaux) a été utilisé conformément aux instructions du fabricant.
- Diluer la suspension LNP obtenue à partir de l’étape 6.1, 35 fois avec un tampon HEPES de 10 mM (pH 7.4).
- Pipette 700 à 1000 μL de la suspension LNP diluée dans une cellule capillaire.
- Mesurez le potentiel Z conformément aux instructions du fabricant.
8. Efficacité de l’encapsulation du siRNA par le test RiboGreen
REMARQUE: Le test Ribogreen est effectué pour évaluer l’encapsulation du siRNA dans les LNP19. Le test Ribogreen peut mesurer la quantité d’ARN à l’intérieur et à l’extérieur des SNP avec / sans tensioactif (par exemple, TritonX-100).
- Diluer 2 mg/mL de siGL4 avec 10 mM de tampon HEPES (pH 7,4) à 500 ng/mL de solution de siGL4.
- Préparer la série de dilution (0, 12,5, 25, 50, 100, 200 ng/mL) de la solution de siGL4 pour obtenir une courbe d’étalonnage pour les échantillons triton (+) et triton (-).
- Diluer la suspension LNP 100 fois avec un tampon HEPES de 10 mM (pH 7,4).
- Mélanger ce qui suit pour la solution Triton (+) : 980 μL de 10 mM HEPES (pH 7,4), 20 μL de TritonX-100 à 10 % p/v et 1,25 μL de RiboGreen pour 10 puits d’une microplaque de 96 puits.
- Mélanger ce qui suit pour la solution Triton (-): 1000 μL de 10 mM HEPES (pH 7,4) et 1,25 μL de RiboGreen pour 10 puits d’une microplaque de 96 puits.
- Pipette 100 μL de la série de dilution de la solution siGL4 et des suspensions LNP diluées dans les puits d’une microplaque noire de 96 puits.
REMARQUE: La série de dilution de la solution de siGL4 et des suspensions de LNP diluées a été distribuée dans quatre micropuits par condition. - Pipette 100 μL de la solution de détection (TritonX-100 (+) ou Triton (-)) dans les puits.
REMARQUE: La solution de détection (TritonX-100 (+)) a été distribuée dans deux puits par échantillon et par condition, et la solution TritonX-100 (-) a été distribuée dans les deux puits restants par condition d’échantillon. - Incuber la microplaque pendant 5 min à température ambiante.
- Mesurez l’intensité de fluorescence à l’aide d’un lecteur de microplaques à une longueur d’onde de 475 nm.
- Calculez l’efficacité d’encapsulation du siRNA à partir de l’équation suivante19.
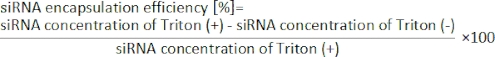
9. Culture cellulaire
- Préparer un milieu de croissance contenant du DMEM, du FBS inactivé par la chaleur, 100 U/mL de pénicilline, 100 μg/mL de streptomycine et 400 μg/mL de G418.
- Cultiver des cellules HeLa exprimant de manière stable la luciole et la renilla luciférase (HeLa-dluc) dans une boîte de culture cellulaire traitée tc de 100 mm contenant le milieu de croissance à 37 °C dans un incubateur à CO2 à 5 %.
10. Essai de viabilité cellulaire
- Ensemencer 100 μL d’une suspension de cellules HeLa dans le milieu de croissance (6 x 103 cellules/puits) dans une microplaque de 96 puits.
REMARQUE: Les cellules ont été comptées à l’aide d’une plaque de compteur de cellules et d’un microscope. - Incuber la microplaque pendant 24 h à 37 °C dans un incubateur à 5 % de CO2 .
- Diluer les LNP chargés de siRNA avec du DMEM (FBS (-)) aux concentrations de 10 et 100 nM siRNA.
- Distribuer 100 μL de la suspension LNP diluée chargée de siRNA par puits.
- Incuber la microplaque pendant 4 h à 37 °C dans un incubateur à 5 % de CO2 .
- Retirez la suspension LNP et ajoutez 100 μL de DMEM (FBS (+)).
- Incuber la microplaque pendant 20 h à 37 °C dans un incubateur à 5 % de CO2 .
- Mesurez la viabilité de la cellule à l’aide d’un kit disponible dans le commerce selon le protocole du fabricant.
REMARQUE : Le D-PBS (-) a été utilisé comme témoin négatif.
11. Test d’élimination du gène de la luciférase
- Ensemencez 75 μL d’une suspension de cellules HeLa dans le milieu de croissance (4,5 x 103 cellules/puits) dans une microplaque de 96 puits.
- Incuber la microplaque pendant 24 h à 37 °C dans un incubateur à 5 % de CO2 .
- Diluer les LNP chargés de siRNA avec du DMEM (FBS (-)) aux concentrations de 10 et 100 nM siRNA.
- Distribuer 75 μL de la suspension LNP diluée chargée de siRNA par puits.
- Incuber la microplaque pendant 4 h à 37 °C dans un incubateur à 5 % de CO2 .
- Retirez la suspension LNP et ajoutez 75 μL de DMEM (FBS (+)).
- Incuber la microplaque pendant 20 h à 37 °C dans un incubateur à 5 % de CO2 .
- Mesurez l’expression de la luciférase à l’aide d’un kit disponible dans le commerce selon le protocole du fabricant.
REMARQUE: Nous avons utilisé D-PBS (-) comme contrôle négatif.
Résultats
La figure 2A,B montre la distribution de la taille du PNL POPC produite dans différentes conditions d’écoulement. La méthode de préparation de LNP à base de microfluidique peut contrôler la taille des LNP par les conditions d’écoulement telles que le débit total (TFR) et le FRR. Par rapport aux dispositifs microfluidiques typiques, y compris le mélangeur chaotique et le dispositif microfluidique focalisant le flux, le dispositif iLiNP a permis un contrôle précis de la taille du LNP allant de 20 à 100 nm (Figure 2). Des LNP de petite taille se sont formés dans des conditions de débit total élevé. De plus, les tailles de LNP formées au FRR de 5 étaient plus petites que celles du FRR de 3, quel que soit le débit total13.
Les LNP chargés en siRNA ont également été préparés à l’aide du dispositif iLiNP (Figure 3A). Pour la préparation de LNP chargée de siRNA, DOTAP, un lipide cationique, a été utilisé pour encapsuler efficacement le siRNA dans les LNP. Le dispositif iLiNP a produit des LNP cationiques chargés en siRNA de taille 90 nm avec une distribution étroite (Figure 3A,B). L’efficacité d’encapsulation du siRNA était de 95 % en raison de l’interaction électrostatique entre le lipide cationique et les siRNA chargés négativement (Figure 3C).
La cytotoxicité et l’activité de silençage génique des SNP chargés en siRNA de taille 90 nm ont été évaluées, comme le montrent les figures 4 et 5. Les LNP chargés de siRNA ont montré une cytotoxicité à une dose de 10 et 100 nM siRNA. Nous avons également confirmé que le niveau d’expression de la luciférase était diminué en fonction de la concentration de siRNA. Les LNP chargés de siRNA ont supprimé l’expression de la luciférase à 80% à une dose de 100 nM siRNA. L’effet de la taille de la LNP sur l’activité de silençage génique a été rapporté précédemment6,13,17.
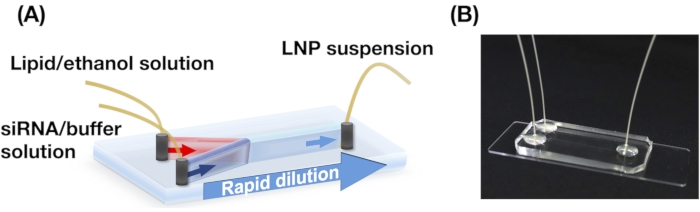
Figure 1 : (A) Illustration schématique et (B) photographie du dispositif iLiNP. Le dispositif iLiNP comprend des substrats PDMS et en verre. L’appareil iLiNP est connecté aux capillaires PEEK avec une supercolle. Les solutions lipidiques et siRNA/tampon sont introduites séparément dans le dispositif iLiNP à l’aide de pompes à seringues. La suspension LNP est collectée dans un microtube. Veuillez cliquer ici pour voir une version agrandie de cette figure.
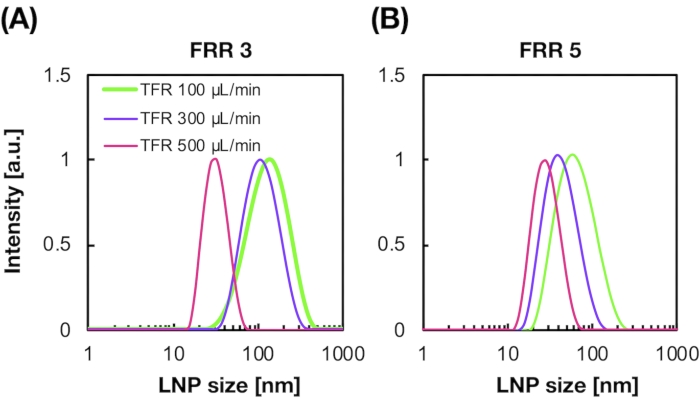
Figure 2 : Distributions de taille LNP POPC produites par le dispositif iLiNP aux différents rapports de débit (FRR). La taille du LNP POPC est mesurée par diffusion dynamique de la lumière (DLS). Les SNP POPC sont préparés en modifiant le débit total et le FRR: (A) 3 FRR et (B) 5 FRR. Les LNP de petite taille sont formés dans des conditions de débit total élevé. De plus, les tailles de LNP formées au FRR de 5 étaient plus petites que celles du FRR de 3. Veuillez cliquer ici pour voir une version agrandie de cette figure.
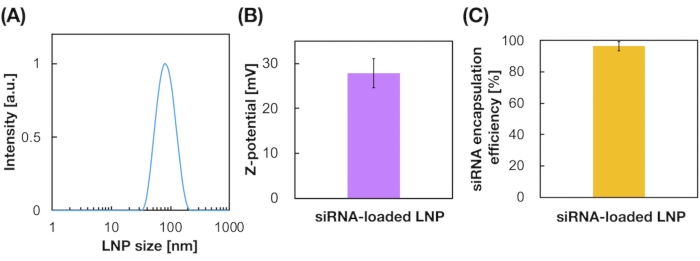
Figure 3 : Caractérisation des SNP chargés en siRNA. (A) Distribution granulométrique des LNP chargés en siRNA. Les siRNA (siGL4) sont encapsulés dans les LNP par interaction électrostatique entre le lipide cationique (DOTAP) et les siRNA chargés négativement. (B) Potentiel Z des LNP chargés en siRNA. La suspension LNP a été diluée avec un tampon HEPES de 10 mM (pH 7,4) avant la mesure. Les données sont représentées sous forme de moyenne ± et de développement durable (écart-type). n = 3. (C) efficacité d’encapsulation du siRNA des LNP à base de DOTAP. L’efficacité d’encapsulation a été déterminée par le test RiboGreen. Les données sont représentées sous forme de moyenne ± SD. n = 3. Veuillez cliquer ici pour voir une version agrandie de cette figure.
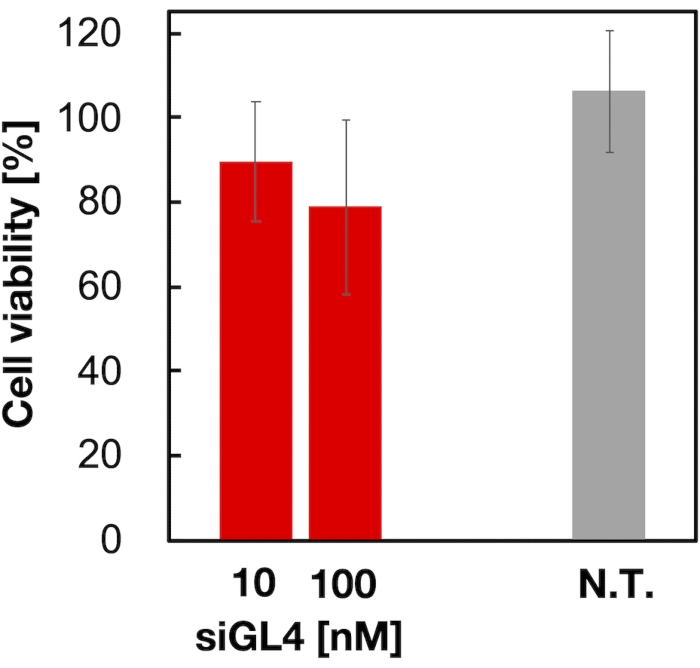
Figure 4 : Cytotoxicité des LNP chargés en siRNA. Les LNP chargés de siRNA ont été dilués avec du DMEM (FBS (-)) pour obtenir les concentrations de siGL4 de 10 et 100 nM. Les suspensions LNP sont ajoutées aux cellules HeLa-dLuc et incubées pendant 4 h à 37 °C dans un incubateur à 5 % de CO2. N.T. : Non traité (D-PBS(-)). Les données sont représentées comme la moyenne ± ET. n = 3. Veuillez cliquer ici pour voir une version agrandie de cette figure.
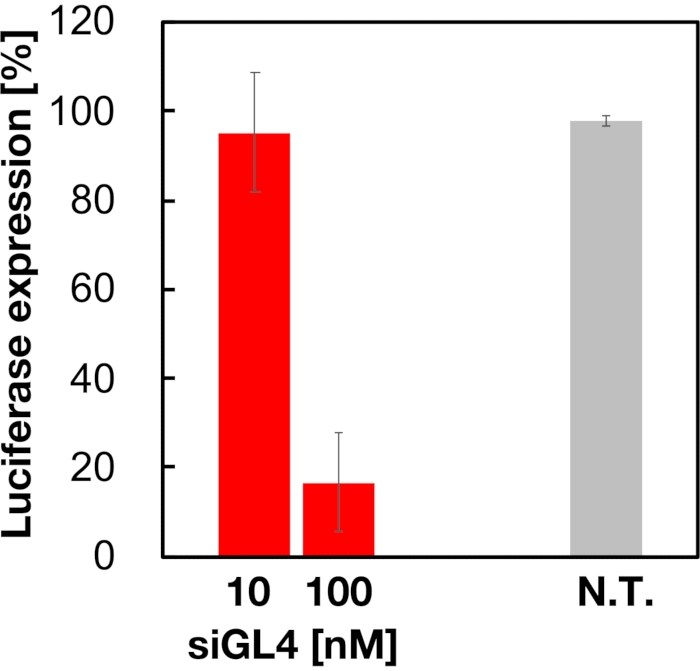
Figure 5 : Activité d’élimination du gène de la luciférase traitée avec des LNP chargés de siRNA. Les LNP chargés de siRNA sont préparés de la même manière que le test de viabilité cellulaire. Le niveau d’expression de la luciférase est mesuré à l’aide du système de dosage de la luciférase Dual-Glo. N.T. : Non traité (D-PBS(-)). Les données sont représentées comme moyenne ± ET N= 3. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La taille du LNP affecte la biodistribution du LNP, l’effet anti-tumoral et les performances de silençage génique. Par conséquent, la méthode de contrôle de la taille LNP est une technique importante pour la production de nanomédicaments DDS, y compris les systèmes d’administration d’ARN. L’objectif de cet article est de présenter le dispositif iLiNP pour un réglage précis de la taille des LNP et son application à la production de LNP chargés de siRNA. L’appareil iLiNP était capable de contrôler la taille LNP comprise entre 20 et 100 nm (Figure 2)13. Lorsque les conditions d’écoulement, telles que le débit total et le FRR, sont modifiées pour contrôler la taille du LNP, la suspension LNP doit être collectée après environ 5 à 10 s pour stabiliser le débit de la solution. La suspension LNP recueillie à la sortie du dispositif iLiNP a été dialysée immédiatement contre la solution tampon pour éliminer l’éthanol et empêcher l’agrégation de LNP.
Le contrôle de la taille du LNP est l’un des défis majeurs dans le domaine de la DDS. Généralement, le processus de production LNP conventionnel, tel que la méthode d’hydratation du film lipidique, nécessite un processus de réglage de la taille après la production LNP20. D’autre part, la méthode de production de LNP à base de microfluidique peut produire les LNP à taille contrôlée en introduisant les solutions lipidiques et aqueuses dans le dispositif microfluidique6,11,13. Bien que le processus de dialyse soit nécessaire pour éliminer l’éthanol de la suspension LNP, un processus continu par le dispositif microfluidique couplé au système de flux tangentiel promet l’automatisation du processus de production LNP14. Selon la littérature, les tailles POPC LNP étaient de 50-60 nm et 30-60 nm, respectivement pour le dispositif microfluidique focalisant le débit21 et le dispositif mélangeur chaotique10. Comparé à d’autres dispositifs microfluidiques, le dispositif iLiNP permet le contrôle de la taille du POPC LNP dans une large plage de 20 à 100 nm.
Le processus de fabrication du dispositif iLiNP utilisé était la lithographie douce standard. Ainsi, le dispositif iLiNP peut être produit en série par une technique de prototypage rapide et prévenir la contamination croisée des solutions à l’aide d’un dispositif jetable. Le dispositif iLiNP peut produire des LNP chargés en siRNA de la même manière que la méthode de production POPC LNP. Pour la méthode de production LNP utilisant le périphérique iLiNP, l’utilisateur n’a pas besoin de procédures compliquées. Pour ces raisons, la méthode de production LNP à base microfluidique, y compris le dispositif iLiNP, devrait être utilisée comme méthode de production LNP standard. Le protocole de cet article peut être adapté à d’autres dispositifs microfluidiques pour la production de LNP. En outre, la production de LNP chargés d’ARNm est également activée en changeant la solution siRNA/tampon en une solution tampon contenant des ARNm.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par JST, CREST Grant Number JPMJCR17H1, Japon, JST, PRESTO Grant Number JPMJPR19K8, Japon, JST, SCORE, Japon, les dépenses d’éducation spéciale et de recherche du ministère de l’Éducation, de la Culture, des Sports, des Sciences et de la Technologie, JSPS KAKENHI Grant Number JP19KK0140 et Iketani Science and Technology Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine (POPC) | NOF Corp. | MC-6081 | |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (DMG-PEG2K) | NOF Corp. | GM-020 | |
| 1,2-dioleoyloxy-3-trimethylammonium propane (DOTAP) | NOF Corp. | CL-8181TA | |
| 1,2-Distearoyl-sn-glycero-3-phosphocholinev (DSPC) | NOF Corp. | MC-8080 | |
| 10 x D-PBS (-) | FUJIFILM Wako Pure Chemical Corp. | 048-29805 | |
| Acetic acid | FUJIFILM Wako Pure Chemical Corp. | 017-00251 | |
| CellTiter-Blue Cell Viability Assay | Promega | G8081 | |
| cholesterol | Sigma-Aldrich | C8667-5G | |
| Desktop maskless lithography system | NEOARK CORPORATION | DDB-701-DL4 | |
| Dialysis membrane | Repligen | 132697 | |
| Dual-Glo Luciferase Assay System | Promega | E2940 | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific | Lot: 42G6587K | |
| G418 | Nacalai Tesque | 08973-14 | |
| Glass substrate | Matsunami Glass Ind., Ltd. | S1111 | |
| Glass syringe | Hamilton | GASSTIGHT 1002 | |
| HeLa cell | HeLa-dluc cells were provided from Dr. Yusuke Sato at Hokkaido University | ||
| HEPES | FUJIFILM Wako Pure Chemical Corp. | 342-01375 | |
| Low-glucose Dulbecco’s modified Eagle medium (DMEM) | Sigma-Aldrich | D6046-500ML | |
| Oxygen plasma cleaner | Femto Science | CUTE-1MP/R | |
| Penicillin–streptomycin, trypsin (2.5%) | Thermo Fisher Scientific | 15140122 | |
| Quant-iT RiboGreen RNA Reagent | Thermo Fisher Scientific | R11491 | |
| siGL4 | Hokkaido System Science Co., Ltd | The sense and antisense strand sequences of siGL4 are 5'-CCGUCGUAUUCGUGAGCAATsT -3' and 5'-UUGCUCACGAAUACGACGGTsT -3', respectively. | |
| Silicon wafer | GTC | ||
| SILPOT 184 W/C (PDMS) | Dow Corning Toray Co., Ltd. | silicone base and curing agent are included | |
| Sodium acetate | FUJIFILM Wako Pure Chemical Corp. | 192-01075 | |
| Sodium chloride | FUJIFILM Wako Pure Chemical Corp. | 191-01665 | |
| SU-8 3050 | Nippon Kyaku Co., Ltd. | ||
| Syringe connector | Institute of microchemical Technology Co., Ltd. | ISC-011 | |
| Syringe pump | Chemyx | CX07200 | |
| trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma-Aldrich | 448931-10G | |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| UltraPure DNase/RNase-Free Distilled Water | Thermo Fisher Scientific | 10977015 | |
| Zetasizer Nano ZS | Malvern Instruments | ZEN3600 |
Références
- Schoenmaker, L., et al. mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability. International Journal of Pharmaceutics. 601, 120586 (2021).
- Chung, Y. H., Beiss, V., Fiering, S. N., Steinmetz, N. F. COVID-19 Vaccine frontrunners and their nanotechnology design. ACS Nano. 14 (10), 12522-12537 (2020).
- Dong, Y., et al. A systematic review of SARS-CoV-2 vaccine candidates. Signal Transduction and Targeted Therapy. 5 (1), 237 (2020).
- Cabral, H., et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size. Nature Nanotechnology. 6 (12), 815-823 (2011).
- Sato, Y., et al. Elucidation of the physicochemical properties and potency of siRNA-loaded small-sized lipid nanoparticles for siRNA delivery. Journal of Controlled Release. 229, 48-57 (2016).
- Kimura, N., et al. Three-dimensional, symmetrically assembled microfluidic device for lipid nanoparticle production. RSC Advances. 11 (3), 1430-1439 (2021).
- Maeki, M., Kimura, N., Sato, Y., Harashima, H., Tokeshi, M. Advances in microfluidics for lipid nanoparticles and extracellular vesicles and applications in drug delivery systems. Advanced Drug Delivery Reviews. 128, 84-100 (2018).
- Akinc, A., et al. The Onpattro story and the clinical translation of nanomedicines containing nucleic acid-based drugs. Nature Nanotechnology. 14 (12), 1084-1087 (2019).
- Kulkarni, J. A., Witzigmann, D., Chen, S., Cullis, P. R., vander Meel, R. Lipid nanoparticle technology for clinical translation of siRNA therapeutics. Accounts of Chemical Research. 52 (9), 2435-2444 (2019).
- Maeki, M., et al. Understanding the formation mechanism of lipid nanoparticles in microfluidic devices with chaotic micromixers. PLoS One. 12 (11), 0187962 (2017).
- Maeki, M., et al. A strategy for synthesis of lipid nanoparticles using microfluidic devices with a mixer structure. RSC Advances. 5 (57), 46181-46185 (2015).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1, 37 (2012).
- Kimura, N., et al. Development of the iLiNP Device: Fine Tuning the Lipid Nanoparticle Size within 10 nm for Drug Delivery. ACS Omega. 3 (5), 5044-5051 (2018).
- Kimura, N., et al. Development of a microfluidic-based post-treatment process for size-controlled lipid nanoparticles and application to siRNA delivery. ACS Applied Materials & Interfaces. 12 (30), 34011-34020 (2020).
- Hashiba, A., et al. The use of design of experiments with multiple responses to determine optimal formulations for in vivo hepatic mRNA delivery. Journal of Controlled Release. 327, 467-476 (2020).
- Suzuki, Y., et al. Lipid nanoparticles loaded with ribonucleoprotein-oligonucleotide complexes synthesized using a microfluidic device exhibit robust genome editing and hepatitis B virus inhibition. Journal of Controlled Release. 330, 61-71 (2020).
- Kimura, N., Maeki, M., Ishida, A., Tani, H., Tokeshi, M. One-step production using a microfluidic device of highly biocompatible size-controlled noncationic exosome-like nanoparticles for RNA delivery. ACS Applied Bio Materials. 4 (2), 1783-1793 (2021).
- Deng, T., Wu, H., Brittain, S. T., Whitesides, G. M. Prototyping of masks, masters, and stamps/molds for soft lithography using an office printer and photographic reduction. Analytical Chemistry. 72 (14), 3176-3180 (2000).
- Sato, Y., et al. A pH-sensitive cationic lipid facilitates the delivery of liposomal siRNA and gene silencing activity in vitro and in vivo. Journal of Controlled Release. 163 (3), 267-276 (2012).
- Ong, S. G., Chitneni, M., Lee, K. S., Ming, L. C., Yuen, K. H. Evaluation of extrusion technique for nanosizing liposomes. Pharmaceutics. 8 (4), (2016).
- Mijajlovic, M., Wright, D., Zivkovic, V., Bi, J. X., Biggs, M. J. Microfluidic hydrodynamic focusing based synthesis of POPC liposomes for model biological systems. Colloids and Surfaces B: Biointerfaces. 104, 276-281 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon