Method Article
Производство липидных наночастиц, нагруженных siRNA, с помощью микрофлюидного устройства
В этой статье
Резюме
Методы производства липидных наночастиц на микрофлюидной основе (LNP) привлекли внимание в системах доставки лекарств (DDS), включая доставку РНК. Этот протокол описывает процессы изготовления, производства LNP (lNP-loaded lNP) и оценки LNP с использованием нашего оригинального микрофлюидного устройства под названием iLiNP.
Аннотация
Разработка функциональных липидных наночастиц (LNP) является одной из основных проблем в области систем доставки лекарств (DDS). В последнее время системы доставки РНК на основе LNP, а именно РНК-нагруженные LNP, привлекли внимание к РНК-терапии. В частности, для профилактики COVID-19 были одобрены вакцины LNP с нагруженной мРНК, что привело к сдвигу парадигмы в сторону разработки нанолекарств следующего поколения. Для нанолекарств на основе LNP размер LNP является важным фактором в контроле биораспределения LNP и производительности LNP. Поэтому точный метод контроля размера LNP незаменим для процесса производства LNP. Здесь мы сообщаем о протоколе для производства LNP с контролируемым размером с использованием микрофлюидного устройства под названием iLiNP. LNP, нагруженные siRNA, также производятся с использованием устройства iLiNP и оцениваются экспериментом in vitro . Репрезентативные результаты показаны для размера LNP, включая LNP-нагруженные siRNA, Z-потенциал, эффективность инкапсуляции siRNA, цитотоксичность и активность глушения генов-мишеней.
Введение
Липидные наночастицы (LNP) являются одним из наиболее широко используемых наноносителей для систем доставки РНК. Недавно мРНК-нагруженные ЛНП были одобрены в качестве вакцин для профилактики COVID-191,2,3. Как правило, размер LNP играет решающую роль в работе систем биораспределения и доставки лекарств (DDS), включая глушение генов или экспрессию белка4,5,6. Поэтому для производственного процесса LNP требуется точный метод контроля размера LNP.
Для производства контролируемых по размеру LNP микрофлюидные устройства привлекали внимание на протяжении многих лет7. В 2018 году с использованием микрофлюидного устройства8,9 были разработаны первые одобренные Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) LNP, загруженные siRNA (например, Onpattro). В методе получения LNP на основе микрофлюидов липидный раствор и водный раствор вводят отдельно в микрофлюидное устройство, а затем смешивают в микроканале. Для повышения эффективности смешивания для производства LNP10,11,12 было использовано хаотическое смесительное устройство. Хаотичное смесительное устройство позволяет производить LNP определенного размера.
Простое микрофлюидное устройство, названное инвазивным производством липидных наночастиц (iLiNP), оснащенное перегородочными структурами, было разработано для точного контроля размера LNP13,14. По сравнению с хаотичным смесителем, устройство iLiNP смогло управлять размерами LNP в диапазоне от 20 до 100 нм с интервалами 10 нм. Кроме того, устройство iLiNP производило siRNA-нагруженные LNPs6, mRNA-нагруженные LNPs15, ribonucleoprotein-load LNPs16 и экзосомоподобные LNPs17. Целью данной работы является введение процесса изготовления и производства LNP-нагруженного СРНК устройства iLiNP и описание процесса оценки LNP, производимого устройством iLiNP.
протокол
1. Изготовление устройства iLiNP
ПРИМЕЧАНИЕ: Устройство iLiNP изготовлено с использованием стандартного метода мягкой литографии18. Подробный протокол изготовления был сообщен ранее10,13.
- Изготовление пресс-формы СУ-8
- Налейте SU-8 3050 на 3-дюймовую кремниевую пластину. Спиновое покрытие кремниевой пластины для получения слоя SU-8 толщиной 100 мкм.
- Выпекайте кремниевую пластину, поместив на конфорку при 65 °C в течение 5 мин и 95 °C в течение 45 мин.
- После выпечки поместите кремниевую на сцену настольной безмаскировочной литографической системы.
- Подвергайте кремниевую пластину воздействию ультрафиолетового излучения при 365 нм в течение 1,5 с на одно положение.
ПРИМЕЧАНИЕ: В этом эксперименте использовалась настольная бесмаскировочная литографическая система. Система автоматически выставляет ультрафиолетовый свет на разделенную область облучения (одно положение) микроканала. - После УФ-облучения выпекайте кремниевую пластину на конфорке при 65 °C в течение 1 мин и 95 °C в течение 5 мин.
- Охладите кремниевую пластину, а затем замочите в СУ-8 разработчика на 15 минут, чтобы удалить неэкспонированный СУ-8.
- Обработайте форму SU-8 свапором трихлора (1H,1H,2H,2H-перфтороктил)силана с помощью адсорбатора и вакуумного насоса.
- Изготовление устройства iLiNP
- Смешайте силиконовую основу и полидиметилсилоксан (PDMS) в соотношении 10:1 (мас./мас.).
- Дегазация смеси с помощью вакуумного насоса и осушителя.
ПРИМЕЧАНИЕ: PDMS дегазировали с помощью вакуумного насоса в течение 10 мин при комнатной температуре. - Вылейте дегазированную ПДМС на форму СУ-8 в чашке Петри толщиной 100 мм толщиной до 0,5-1 см с последующей выпечкой в духовке при 80 °C в течение 1 ч.
- Охладите форму, а затем очистите подложку PDMS от формы SU-8 с помощью пинцета.
- Пробьете три отверстия (0,5 мм) в подложке PDMS. Свяжите подложку PDMS и стеклянный слайд с помощью кислородного плазменного очистителя для создания устройства iLiNP (см. Рисунок 1)13.
- Подключите три капилляра PEEK (I.D. 0,3 мм, O.D. 0,5 мм) к входным и выходным отверстиям устройства iLiNP и отвержьте суперклеем.
ПРИМЕЧАНИЕ: Длина капилляров PEEK регулируется и зависит от эксперимента.
2. Приготовление растворов липидов
- Готовят растворы липидов/этанола: 13,4 мМ 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин (POPC), 10 мМ 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC), 20 мМ 1,2-диолеоилокси-3-триметиламмонийпропан (DOTAP), 5 мМ 1,2-димиристоил-рак-глицеро-3-метоксиполиэтиленгликоль-2000 (DMG-PEG2k) и 20 мМ холестерина. Храните готовые растворы при температуре -20 °C до начала эксперимента.
- Для получения LNP, нагруженных siRNA, смешивают растворы DOTAP, DSPC, холестерина и DMG-PEG2k с молярным соотношением 50/10/38,5/1,5. Общая концентрация липидов регулируется до 8 мМ.
3. Приготовление водных растворов
- Готовят водные растворы: 154 мМ NaCl (физиологический раствор), 25 мМ ацетатного буфера при рН 4,0 с использованием дистиллированной воды без ДНКазы/РНКазы.
- Фильтруйте растворы с помощью мембранных фильтров размером 0,2 мкм или шприцевых фильтров.
4. Получение siRNA/буферного раствора
- Растворить 70 мкг siGL4 в 1 мл ацетатного буфера 25 мМ (рН 4,0).
ПРИМЕЧАНИЕ: siGL4 используется для нокдауна гена люциферазы.
5. Настройка устройства iLiNP и производство LNP
ПРИМЕЧАНИЕ: Схемы см. на рисунке 1 .
- Наполните 1 мл стеклянных шприцев липидными и водными растворами (из стадий 3.1 и 4.1 в отдельных шприцах) соответственно.
ПРИМЕЧАНИЕ: Отрегулируйте объем липидного и водного раствора в зависимости от количества, необходимого для эксперимента по оценке LNP. - Подключите стеклянные шприцы к капиллярам PEEK с помощью шприцевых разъемов.
- Устанавливают скорость потока липидных и водных растворов.
ПРИМЕЧАНИЕ: Отношение расхода (FRR) водной фазы к липидной фазе колеблется от 3:1 до 9:1. - Вводите липидные и водные растворы отдельно в устройство iLiNP с помощью шприцевых насосов.
- Соберите суспензии LNP в микротрубку с выходного отверстия устройства iLiNP (рисунок 1).
6. Диализ суспензии LNP и измерение размера LNP
- Диализуйте суспензию LNP с использованием диализной мембраны (отсечки 12−14 кДа MW) при 4 °C в течение ночи против физиологического раствора или D-PBS для POPC LNP и LNP, нагруженных siRNA, соответственно.
ПРИМЕЧАНИЕ: POPC не растворяется в физиологическом растворе (см. 2.1). Раствор POPC/этанола разбавляют физиологическим раствором в устройстве iLiNP. - Соберите диализированные суспензии LNP в микропробирки.
- Пипетка 20-30 мкл суспензии LNP в микрокварцевую ячейку.
- Измерьте размер LNP, распределение LNP по размерам и индекс полидисперсности с помощью динамического рассеяния света (DLS).
7. Измерение Z-потенциала LNP
ПРИМЕЧАНИЕ: Для измерения Z-потенциала использовался анализатор частиц (см. Таблицу материалов) в соответствии с инструкцией завода-изготовителя.
- Разбавляют суспензию LNP, полученную на стадии 6,1, в 35 раз с буфером HEPES 10 мМ (рН 7,4).
- Пипетка от 700 до 1000 мкл разбавленной суспензии LNP в капиллярную клетку.
- Измерьте Z-потенциал в соответствии с инструкцией производителя.
8. Эффективность инкапсуляции siRNA методом анализа RiboGreen
ПРИМЕЧАНИЕ: Рибогриновый анализ проводится для оценки инкапсуляции siRNA в LNPs19. Рибогриновый анализ может измерять количество РНК внутри и снаружи ЛНП с/без поверхностно-активного вещества (например, TritonX-100).
- Разбавить 2 мг/мл siGL4 буфером HEPES 10 мМ (рН 7,4) до 500 нг/мл раствора siGL4.
- Подготовьте серию разбавления (0, 12,5, 25, 50, 100, 200 нг/мл) раствора siGL4 для получения калибровочной кривой для образцов Triton (+) и Triton (-).
- Разбавить суспензию LNP 100 раз с буфером HEPES 10 мМ (рН 7,4).
- Смешайте для раствора Тритона (+): 980 мкл 10 мМ HEPES (рН 7,4), 20 мкл 10% мас./об.ТритонХ-100 и 1,25 мкл RiboGreen для 10 лунок 96-луночной микропластины.
- Для раствора тритона (-) смешайте следующее: 1000 мкл 10 мМ HEPES (рН 7,4) и 1,25 мкл RiboGreen для 10 скважин 96-луночной микропластины.
- Пипетка 100 мкл серии разбавления раствора siGL4 и разбавленных суспензий LNP в лунки черной 96-луночной микропластины.
ПРИМЕЧАНИЕ: Серию разбавления раствора siGL4 и разбавленных суспензий LNP дозировали в четыре микролунки для каждого состояния. - Пипетка 100 мкл детектирующего раствора (TritonX-100 (+) или Triton (-)) в скважины.
ПРИМЕЧАНИЕ: Раствор для детектирования (TritonX-100 (+)) дозировали в две скважины на образец на каждое условие, а раствор TritonX-100 (-) дозировали в оставшиеся две скважины на каждое состояние пробы. - Инкубировать микропластинку в течение 5 мин при комнатной температуре.
- Измерьте интенсивность флуоресценции с помощью считывателя микропластин на длине волны 475 нм.
- Рассчитайте эффективность инкапсуляции siRNA из следующего уравнения19.
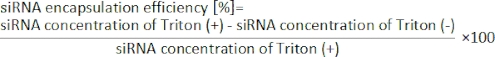
9. Клеточная культура
- Готовят питательную среду, содержащую DMEM, термоинактивированную 10% FBS, 100 Ед/мл пенициллина, 100 мкг/мл стрептомицина и 400 мкг/мл G418.
- Культивирование клеток HeLa стабильно экспрессирует светлячка и люциферазу Renilla (HeLa-dluc) в 100 мм TC-обработанной чашке для клеточной культуры, содержащей питательную среду при 37 °C в 5% CO2 инкубаторе.
10. Анализ жизнеспособности клеток
- Посейте 100 мкл суспензии клеток HeLa в питательной среде (6 х 103 клетки/лунка) в 96-луночной микропластине.
ПРИМЕЧАНИЕ: Клетки подсчитывались с помощью пластины счетчика клеток и микроскопа. - Инкубируйте микропластинку в течение 24 ч при 37 °C в 5% CO2 инкубаторе.
- Разбавлять LNP, нагруженные siRNA, DMEM (FBS (-)) в концентрациях 10 и 100 нМ siRNAs.
- Дозировать 100 мкл разбавленной суспензии LNP, нагруженной сиРНК, на лунку.
- Инкубируйте микропластинку в течение 4 ч при 37 °C в 5% CO2 инкубаторе.
- Удалите суспензию LNP и добавьте 100 мкл DMEM (FBS (+)).
- Инкубируйте микропластинку в течение 20 ч при 37 °C в 5% CO2 инкубаторе.
- Измерьте жизнеспособность ячейки с помощью коммерчески доступного комплекта в соответствии с протоколом производителя.
ПРИМЕЧАНИЕ: D-PBS (-) использовался в качестве отрицательного элемента управления.
11. Анализ на нокдаун гена люциферазы
- Семена 75 мкл суспензии клеток HeLa в питательной среде (4,5 х 103 клетки/лунка) в 96-луночной микропластине.
- Инкубируйте микропластинку в течение 24 ч при 37 °C в 5% CO2 инкубаторе.
- Разбавлять LNP, нагруженные siRNA, DMEM (FBS (-)) в концентрациях 10 и 100 нМ siRNAs.
- Дозировать 75 мкл разбавленной сиРНК-нагруженной суспензии LNP на одну лунку.
- Инкубируйте микропластинку в течение 4 ч при 37 °C в 5% CO2 инкубаторе.
- Удалите суспензию LNP и добавьте 75 мкл DMEM (FBS (+)).
- Инкубируйте микропластинку в течение 20 ч при 37 °C в 5% CO2 инкубаторе.
- Измерьте экспрессию люциферазы с помощью коммерчески доступного комплекта в соответствии с протоколом производителя.
ПРИМЕЧАНИЕ: Мы использовали D-PBS (-) в качестве отрицательного элемента управления.
Результаты
На рисунке 2A,B показано распределение по размерам POPC LNP, полученное при различных условиях потока. Метод получения LNP на основе микрофлюидов может контролировать размер LNP в условиях потока, таких как общий расход (TFR) и FRR. По сравнению с типичными микрофлюидными устройствами, включая хаотическое смесительное устройство и микрофлюидное устройство, фокусирующее поток, устройство iLiNP обеспечивало точное управление размером LNP в диапазоне от 20 до 100 нм (рисунок 2). Малогабаритные ЛНП формируются в условиях высокого суммарного расхода. Кроме того, размеры LNP, сформированные при FRR 5, были меньше, чем у FRR 3, независимо от общего расхода13.
LNP, нагруженные siRNA, также были получены с использованием устройства iLiNP (рисунок 3A). Для препарата LNP, нагруженного siRNA, DOTAP, катионный липид, использовался для эффективной инкапсуляции siRNA в LNP. Устройство iLiNP производило катионные LNP с нагруженными siRNA размером 90 нм с узким распределением (рисунок 3A,B). Эффективность инкапсуляции siRNA составила 95% из-за электростатического взаимодействия между катионным липидом и отрицательно заряженными siRNAs (рисунок 3C).
Оценивали цитотоксичность и активность глушения генов 90 нм LNP, нагруженных зиРНК, как показано на рисунках 4 и 5. LNP, нагруженные siRNA, показали цитотоксичность в дозе 10 и 100 нМ siRNA. Мы также подтвердили, что уровень экспрессии люциферазы снижался в зависимости от концентрации siRNA. LNP, нагруженные siRNA, подавляли 80% экспрессию люциферазы в дозе 100 нМ siRNA. Влияние размера LNP на активность глушения генов сообщалось ранее6,13,17.
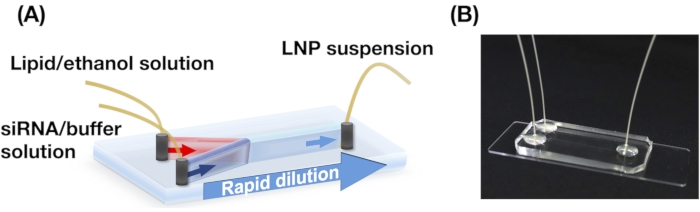
Рисунок 1: (A) Схематическая иллюстрация и (B) фотография устройства iLiNP. Устройство iLiNP содержит PDMS и стеклянные подложки. Устройство iLiNP соединено с капиллярами PEEK с помощью суперклея. Липидные и siRNA/буферные растворы отдельно вводят в устройство iLiNP с помощью шприцевых насосов. Суспензия LNP собирается в микропробирку. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
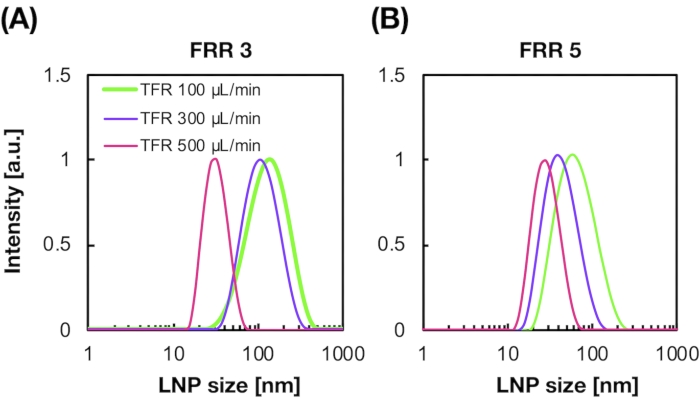
Рисунок 2: Распределение размеров POPC LNP, получаемое устройством iLiNP при различных коэффициентах расхода (FRR). Размер POPC LNP измеряется динамическим рассеянием света (DLS). POPC LNP получаются путем изменения общего расхода и FRR: (A) 3 FRR и (B) 5 FRR. Малогабаритные LNP формируются в условиях высокого общего расхода. Кроме того, размеры LNP, сформированные при FRR 5, были меньше, чем при FRR 3. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
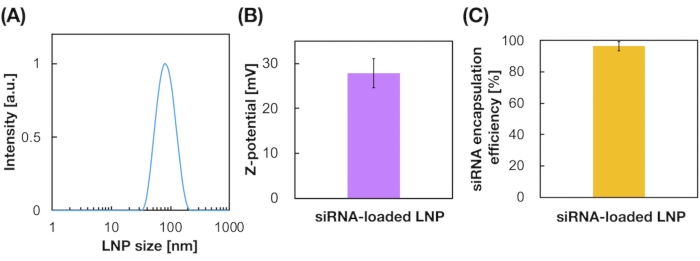
Рисунок 3: Характеристика нагруженных siRNA LNP. (A) Распределение по размерам LNP, нагруженных siRNA. siRNAs (siGL4) инкапсулируются в LNP путем электростатического взаимодействия между катионным липидом (DOTAP) и отрицательно заряженными siRNAs. (B) Z-потенциал LNP, нагруженных siRNA. Суспензию LNP разбавляли 10 мМ буфером HEPES (рН 7,4) перед измерением. Данные представлены в виде среднего ± SD (стандартное отклонение). n = 3. (C) эффективность инкапсуляции siRNA LNP на основе DOTAP. Эффективность инкапсуляции определяли с помощью анализа RiboGreen. Данные представлены в виде среднего ± SD. n = 3. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
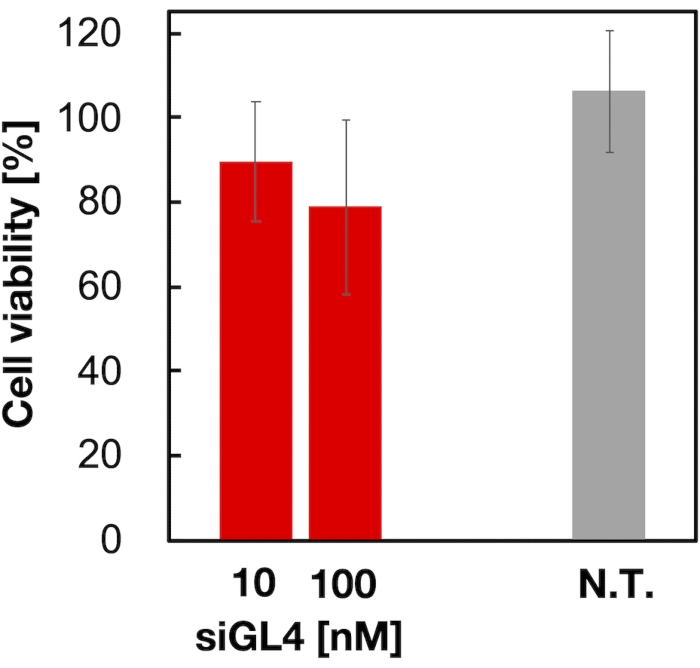
Рисунок 4: Цитотоксичность зиРНК-нагруженных LNP. LNP, нагруженные siRNA, разбавляли DMEM (FBS (-)) для получения концентраций siGL4 10 и 100 нМ. Суспензии LNP добавляют в клетки HeLa-dLuc и инкубируют в течение 4 ч при 37 °C в 5% CO2 инкубаторе. Н.Т.: Необработанный (D-PBS(-)). Данные представлены как среднее ± SD. n = 3. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
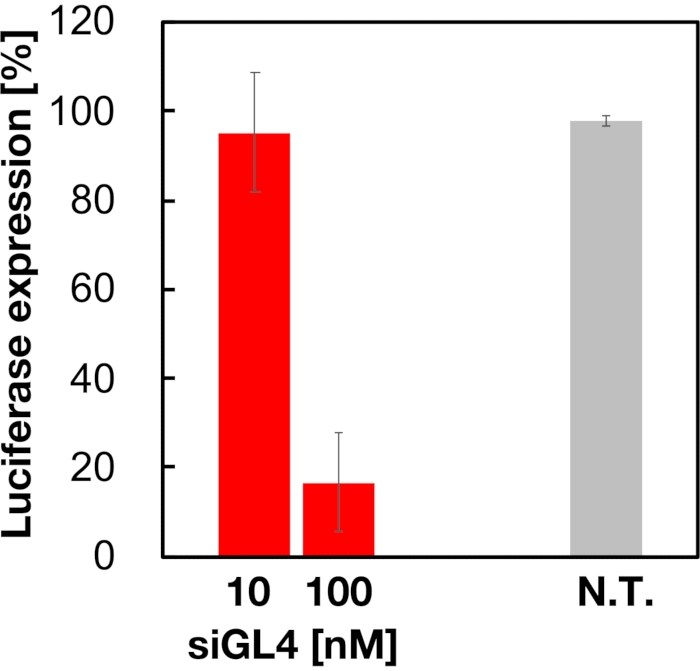
Рисунок 5: Активность нокдауна гена люциферазы, обработанная LNP, нагруженными siRNA. LNP, загруженные siRNA, получают таким же образом, как и анализ жизнеспособности клеток. Уровень экспрессии люциферазы измеряется с помощью системы анализа люциферазы Dual-Glo. Н.Т.: Необработанный (D-PBS(-)). Данные представлены в виде среднего ± SD. n = 3. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Размер LNP влияет на биораспределение LNP, противоопухолевый эффект и эффективность глушения генов. Таким образом, метод контроля размера LNP является важным методом для получения нанолекарств DDS, включая системы доставки РНК. Целью данной работы является внедрение устройства iLiNP для точной настройки размеров LNP и его применение к производству LNP, нагруженных siRNA. Устройство iLiNP смогло управлять размером LNP в диапазоне от 20 до 100 нм (рисунок 2)13. Когда условия потока, такие как общий расход и FRR, изменяются для контроля размера LNP, суспензия LNP должна быть собрана примерно через 5-10 с для стабилизации потока раствора. Суспензию LNP, собранную с выходного отверстия устройства iLiNP, немедленно диализовали против буферного раствора для удаления этанола и предотвращения агрегации LNP.
Контроль размера LNP является одной из основных проблем в области DDS. Как правило, обычный процесс производства LNP, такой как метод гидратации липидной пленки, нуждается в процессе настройки размера после производства LNP20. С другой стороны, метод производства LNP на основе микрофлюидов может производить контролируемые по размеру LNP путем введения липидных и водных растворов в микрофлюидное устройство6,11,13. Хотя процесс диализа необходим для удаления этанола из суспензии LNP, непрерывный процесс микрофлюидного устройства в сочетании с системой тангенциального потока обещает автоматизацию процесса производства LNP14. Согласно литературе, размеры POPC LNP составляли 50-60 нм и 30-60 нм, для ориентированного на поток микрофлюидного устройства21 и хаотического смесителя соответственно10. По сравнению с другими микрофлюидными устройствами, устройство iLiNP позволяет контролировать размер POPC LNP в широком диапазоне от 20 до 100 нм.
Процесс изготовления используемого устройства iLiNP представлял собой стандартную мягкую литографию. Таким образом, устройство iLiNP может быть массово произведено методом быстрого прототипирования и предотвращать перекрестное загрязнение растворов с помощью одноразового устройства. Устройство iLiNP может производить lnp, нагруженные siRNA, таким же образом, как и метод производства POPC LNP. Для способа производства LNP с использованием устройства iLiNP пользователю не требуются какие-либо сложные процедуры. По этим причинам ожидается, что метод производства LNP на основе микрофлюидов, включая устройство iLiNP, будет использоваться в качестве стандартного метода производства LNP. Протокол данной работы может быть адаптирован к другим микрофлюидным устройствам для производства LNP. Кроме того, производство мРНК-нагруженных LNP также обеспечивается путем изменения раствора siRNA/буфера на буферный раствор, содержащий мРНК.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана JST, CREST Grant Number JPMJCR17H1, Japan, JST, PRESTO Grant Number JPMJPR19K8, Japan, JST, SCORE, Japan, Special Education and Research Costs from the Ministry of Education, Culture, Sports, Science and Technology, JSPS KAKENHI Grant Number JP19KK0140 и Iketani Science and Technology Foundation.
Материалы
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine (POPC) | NOF Corp. | MC-6081 | |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (DMG-PEG2K) | NOF Corp. | GM-020 | |
| 1,2-dioleoyloxy-3-trimethylammonium propane (DOTAP) | NOF Corp. | CL-8181TA | |
| 1,2-Distearoyl-sn-glycero-3-phosphocholinev (DSPC) | NOF Corp. | MC-8080 | |
| 10 x D-PBS (-) | FUJIFILM Wako Pure Chemical Corp. | 048-29805 | |
| Acetic acid | FUJIFILM Wako Pure Chemical Corp. | 017-00251 | |
| CellTiter-Blue Cell Viability Assay | Promega | G8081 | |
| cholesterol | Sigma-Aldrich | C8667-5G | |
| Desktop maskless lithography system | NEOARK CORPORATION | DDB-701-DL4 | |
| Dialysis membrane | Repligen | 132697 | |
| Dual-Glo Luciferase Assay System | Promega | E2940 | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific | Lot: 42G6587K | |
| G418 | Nacalai Tesque | 08973-14 | |
| Glass substrate | Matsunami Glass Ind., Ltd. | S1111 | |
| Glass syringe | Hamilton | GASSTIGHT 1002 | |
| HeLa cell | HeLa-dluc cells were provided from Dr. Yusuke Sato at Hokkaido University | ||
| HEPES | FUJIFILM Wako Pure Chemical Corp. | 342-01375 | |
| Low-glucose Dulbecco’s modified Eagle medium (DMEM) | Sigma-Aldrich | D6046-500ML | |
| Oxygen plasma cleaner | Femto Science | CUTE-1MP/R | |
| Penicillin–streptomycin, trypsin (2.5%) | Thermo Fisher Scientific | 15140122 | |
| Quant-iT RiboGreen RNA Reagent | Thermo Fisher Scientific | R11491 | |
| siGL4 | Hokkaido System Science Co., Ltd | The sense and antisense strand sequences of siGL4 are 5'-CCGUCGUAUUCGUGAGCAATsT -3' and 5'-UUGCUCACGAAUACGACGGTsT -3', respectively. | |
| Silicon wafer | GTC | ||
| SILPOT 184 W/C (PDMS) | Dow Corning Toray Co., Ltd. | silicone base and curing agent are included | |
| Sodium acetate | FUJIFILM Wako Pure Chemical Corp. | 192-01075 | |
| Sodium chloride | FUJIFILM Wako Pure Chemical Corp. | 191-01665 | |
| SU-8 3050 | Nippon Kyaku Co., Ltd. | ||
| Syringe connector | Institute of microchemical Technology Co., Ltd. | ISC-011 | |
| Syringe pump | Chemyx | CX07200 | |
| trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma-Aldrich | 448931-10G | |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| UltraPure DNase/RNase-Free Distilled Water | Thermo Fisher Scientific | 10977015 | |
| Zetasizer Nano ZS | Malvern Instruments | ZEN3600 |
Ссылки
- Schoenmaker, L., et al. mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability. International Journal of Pharmaceutics. 601, 120586 (2021).
- Chung, Y. H., Beiss, V., Fiering, S. N., Steinmetz, N. F. COVID-19 Vaccine frontrunners and their nanotechnology design. ACS Nano. 14 (10), 12522-12537 (2020).
- Dong, Y., et al. A systematic review of SARS-CoV-2 vaccine candidates. Signal Transduction and Targeted Therapy. 5 (1), 237 (2020).
- Cabral, H., et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size. Nature Nanotechnology. 6 (12), 815-823 (2011).
- Sato, Y., et al. Elucidation of the physicochemical properties and potency of siRNA-loaded small-sized lipid nanoparticles for siRNA delivery. Journal of Controlled Release. 229, 48-57 (2016).
- Kimura, N., et al. Three-dimensional, symmetrically assembled microfluidic device for lipid nanoparticle production. RSC Advances. 11 (3), 1430-1439 (2021).
- Maeki, M., Kimura, N., Sato, Y., Harashima, H., Tokeshi, M. Advances in microfluidics for lipid nanoparticles and extracellular vesicles and applications in drug delivery systems. Advanced Drug Delivery Reviews. 128, 84-100 (2018).
- Akinc, A., et al. The Onpattro story and the clinical translation of nanomedicines containing nucleic acid-based drugs. Nature Nanotechnology. 14 (12), 1084-1087 (2019).
- Kulkarni, J. A., Witzigmann, D., Chen, S., Cullis, P. R., vander Meel, R. Lipid nanoparticle technology for clinical translation of siRNA therapeutics. Accounts of Chemical Research. 52 (9), 2435-2444 (2019).
- Maeki, M., et al. Understanding the formation mechanism of lipid nanoparticles in microfluidic devices with chaotic micromixers. PLoS One. 12 (11), 0187962 (2017).
- Maeki, M., et al. A strategy for synthesis of lipid nanoparticles using microfluidic devices with a mixer structure. RSC Advances. 5 (57), 46181-46185 (2015).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1, 37 (2012).
- Kimura, N., et al. Development of the iLiNP Device: Fine Tuning the Lipid Nanoparticle Size within 10 nm for Drug Delivery. ACS Omega. 3 (5), 5044-5051 (2018).
- Kimura, N., et al. Development of a microfluidic-based post-treatment process for size-controlled lipid nanoparticles and application to siRNA delivery. ACS Applied Materials & Interfaces. 12 (30), 34011-34020 (2020).
- Hashiba, A., et al. The use of design of experiments with multiple responses to determine optimal formulations for in vivo hepatic mRNA delivery. Journal of Controlled Release. 327, 467-476 (2020).
- Suzuki, Y., et al. Lipid nanoparticles loaded with ribonucleoprotein-oligonucleotide complexes synthesized using a microfluidic device exhibit robust genome editing and hepatitis B virus inhibition. Journal of Controlled Release. 330, 61-71 (2020).
- Kimura, N., Maeki, M., Ishida, A., Tani, H., Tokeshi, M. One-step production using a microfluidic device of highly biocompatible size-controlled noncationic exosome-like nanoparticles for RNA delivery. ACS Applied Bio Materials. 4 (2), 1783-1793 (2021).
- Deng, T., Wu, H., Brittain, S. T., Whitesides, G. M. Prototyping of masks, masters, and stamps/molds for soft lithography using an office printer and photographic reduction. Analytical Chemistry. 72 (14), 3176-3180 (2000).
- Sato, Y., et al. A pH-sensitive cationic lipid facilitates the delivery of liposomal siRNA and gene silencing activity in vitro and in vivo. Journal of Controlled Release. 163 (3), 267-276 (2012).
- Ong, S. G., Chitneni, M., Lee, K. S., Ming, L. C., Yuen, K. H. Evaluation of extrusion technique for nanosizing liposomes. Pharmaceutics. 8 (4), (2016).
- Mijajlovic, M., Wright, D., Zivkovic, V., Bi, J. X., Biggs, M. J. Microfluidic hydrodynamic focusing based synthesis of POPC liposomes for model biological systems. Colloids and Surfaces B: Biointerfaces. 104, 276-281 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены