Method Article
حساسية التنميط للعلاجات المستهدفة في المواد العضوية المشتقة من المريض NSCLC المتحورة EGFR
In This Article
Summary
يصف هذا البروتوكول تقييما موحدا لحساسيات الأدوية لمثبطات الإشارات المستهدفة في النماذج العضوية المشتقة من المريض NSCLC.
Abstract
تمثل الثقافات العضوية الجديدة للسرطان 3D المستمدة من عينات المرضى السريرية نظاما نموذجيا مهما لتقييم عدم التجانس داخل الورم واستجابة العلاج للمثبطات المستهدفة في السرطان. سلط العمل الرائد في مجال سرطانات الجهاز الهضمي والبنكرياس الضوء على وعد المواد العضوية المشتقة من المريض (PDOs) كنظام ثقافة قريب من المريض ، مع ظهور عدد متزايد من النماذج. وبالمثل ، ركز العمل في أنواع السرطان الأخرى على إنشاء نماذج عضوية وتحسين بروتوكولات الثقافة. والجدير بالذكر أن النماذج العضوية للسرطان 3D تحافظ على التعقيد الجيني لعينات الورم الأصلية وبالتالي تترجم بيانات التسلسل المشتقة من الورم إلى علاج باستخدام علاجات مستهدفة مستنيرة وراثيا في بيئة تجريبية. وعلاوة على ذلك، قد تعزز شركات تنمية نفط عمان تقييم العلاجات المركبة العقلانية للتغلب على التكيف المرتبط بالمقاومة للأورام في المستقبل. يركز هذا الأخير على الجهود البحثية المكثفة في سرطان الرئة غير صغير الخلايا (NSCLC) ، حيث أن تطوير المقاومة يحد في النهاية من نجاح علاج المثبطات المستهدفة. يمكن أن يساعد التقييم المبكر للآليات القابلة للاستهداف علاجيا باستخدام NSCLC PDOs في إثراء العلاجات المركبة العقلانية. تصف هذه المخطوطة بروتوكولا موحدا للتقييم القائم على لوحة زراعة الخلايا لحساسيات الأدوية للمثبطات المستهدفة في PDOs 3D المشتقة من NSCLC ، مع القدرة المحتملة على التكيف مع العلاجات التوليفية وطرائق العلاج الأخرى.
Introduction
أحدثت العلاجات الشخصية ضد السائقين المصابين بالأورام ثورة في علاج السرطان، مما أدى إلى تحسين بقاء المريض على قيد الحياة والحد من الآثار الجانبية بوساطة العلاج1. وقد سلطت التطورات الحديثة في التشخيص الجزيئي وتقنيات التسلسل الضوء على تعقيد الأورام البشرية، مع عدم التجانس المكاني والزماني الذي يؤثر على الاستجابة للعلاج2. لطالما اقتصر تلخيص هذه الاختلافات تحت النسيلية في نماذج زراعة الخلايا على التحقيق في التغييرات المختارة ذات الأهمية في خطوط الخلايا الموحدة. تسمح نماذج شركة تنمية نفط عمان ثلاثية الأبعاد المطورة حديثا الناتجة عن خزعات الورم أو عمليات استئصال الورم الجراحية بتحسين تمثيل التعقيد الخلوي والتحدث المتبادل داخل أنسجة الورم المشتقة من المريض3. على هذا النحو ، تم بنجاح توليد الأورام العضوية المشتقة من سرطان الجهاز الهضمي والبنكرياس وتلخيص التنوع الجيني ومحددات استجابة العلاج4،5،6. في سرطان الرئة ذو الخلايا غير الصغيرة (NSCLC) ، يتم الاعتراف بتحديات التطوير والتأسيس العضوية ، وهناك حاجة إلى تحسين تقنيات الزراعة وعوامل الوسائط الانتقائية لتمكين الاستخدام الأوسع والأكثر منهجية ل NSCLC PDOs في المستقبل7,8.
يعد تطوير علاجات توافقية تستهدف الخلايا السرطانية المتبقية التي تتحمل العلاج الدوائي الأولي أمرا ضروريا لمنع تطور المقاومة وفي نهاية المطاف لتحسين بقاء المريض على قيد الحياة9. ونظرا للتعقيد المعماري للثقافات العضوية، يلزم تحسين بارامترات الاستجابة للعقاقير الكلاسيكية للسماح بإجراء اختبارات دقيقة وقابلة للتكرار لحساسيات العقاقير. تتوفر القراءات القائمة على التصوير10,11 واختبارات جدوى الخلايا الكلاسيكية التي تقيس وفرة ATP الخلوية6,12، من بين تقنيات أخرى، لتحديد ملامح الاستجابات الدوائية في مزارع شركة تنمية نفط عمان. هنا ، نقوم بتطوير ووصف بروتوكول موحد لتقييم الحساسية الدوائية للعلاج المستهدف ضد الدوافع السريرية المعروفة في نماذج NSCLC PDO.
Protocol
بالنسبة لأبحاث الأشخاص البشريين ، تم الحصول على الموافقة المستنيرة وتم جمع الأنسجة بموجب البروتوكولات المعتمدة من مجلس المراجعة الداخلية UCSF (IRB ، البروتوكول رقم: # 13-12492 ، أو CC # 17-23309). تم إنشاء مزارع عضوية من عينات سريرية غير محددة بالتعاون مع شركاء البحث وفقا للطرق المنشورة سابقا13،14،15،16. تم استرداد الثقافات العضوية لتجارب الصيانة وتصعيد الأدوية عند المرور الثالث أو اللاحق. تم تنفيذ جميع البروتوكولات التالية في ظل ظروف معقمة في بيئة مختبر زراعة أنسجة الثدييات.
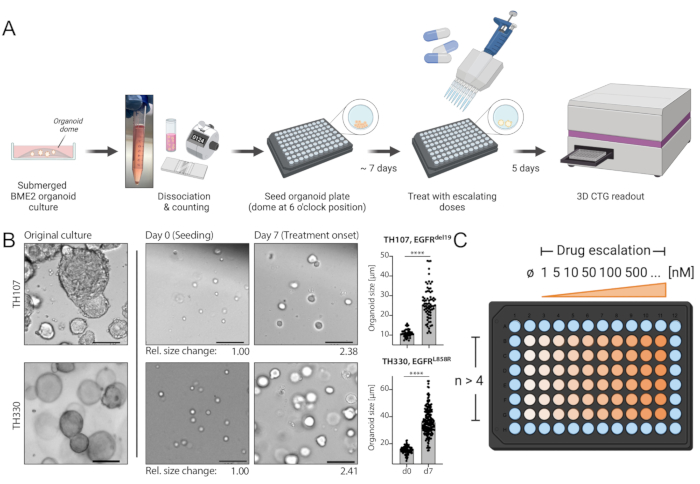
الشكل 1: مخطط بروتوكول سير العمل والخطوات الحاسمة في هذه التقنية. (أ) سير العمل التجريبي بما في ذلك بذر المواد العضوية في شكل 96 بئرا ، والعلاج بتصعيد الدواء في 7 أيام بعد البذر ، وقراءة بقاء الخلايا القائمة على التلألؤ بعد 5 أيام من العلاج باستخدام قارئ لوحة ELISA. (ب) صورة مثال للمزارع العضوية الموجبة EGFRdel19 TH107 و EGFRL858R الموجبة TH330 NSCLC. يتم عرض الثقافات الأصلية والخلايا في وقت البذر (اليوم 0) ، والمواد العضوية في العلاج تبدأ بعد 7 أيام من البذر (اليوم 7). شريط المقياس = 100 ميكرومتر. يتم تحديد التغيرات في قطر العضوية خلال فترة الثقافة الأولية لمدة 7 أيام كميا وتشير إلى زيادة >2 أضعاف في حجم العضوي. يتم عرض التغيرات النسبية في الأحجام في اليوم 7 مقارنة بمتوسط الحجم في اليوم 0 أسفل الصور التمثيلية. بالنسبة ل TH107 ، لوحظ تغير أضعاف 2.38 على مدار 7 أيام ، مما يشير إلى وقت مضاعف قدره 5.88 أيام (141.12 ساعة). بالنسبة ل TH330 ، لوحظ تغير أضعاف 2.41 على مدار 7 أيام ، مما يشير إلى وقت مضاعف قدره 5.81 أيام (139.42 ساعة). يتم تقديم تحديد كمي للتغيرات في حجم العضوية والتقييم الإحصائي (يمين). يتم حساب الدلالة الإحصائية بواسطة اختبار t غير المقترن ، p < 0.0001. (ج) تخطيط العلاج لتصعيد الدواء في شكل لوحة عضوية 96 بئرا. يشار إلى عدد النسخ المتماثلة التقنية والجرعات المثالية ، بما في ذلك التحكم السلبي. يتم إنشاء المخططات باستخدام BioRender ، وهي أداة توضيح مستندة إلى الويب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. الاستعدادات التجريبية
- تحضير وسط النمو (GM) كما ذكر سابقا15: خليط المغذيات F12 (DMEM/F-12) من Dulbecco المعدل F12 (DMEM/F-12) مع L-alanyl-L-glutamine، مع 100 U/mL البنسلين / الستربتومايسين، 10 mM HEPES، 25 نانومتر hRspondin، 1x B27، 5 mM نيكوتيناميد، 1.25 mM N-أسيتيل سيستئين، 500 نانومتر A-8301، 500 نانومتر SB202190، 50 ميكروغرام/مل بريموسين، 100 نانوغرام/مل هنوجين، 100 نانوغرام/مل hFGF-10، 25 نانوغرام/مل hFGF-7 (انظر جدول المواد).
ملاحظة: اخلطي بلطف لتجنب الرغوة وقم بالتصفية من خلال نظام تصفية 0.22 ميكرومتر. تسخين الوسائط إلى 37 درجة مئوية خلال 1 ساعة قبل الاستخدام. - تحضير وسائط منخفضة النمو (LGM) كما ذكر سابقا16 دون إضافة عامل نمو البشرة (EGF): خليط المغذيات المتقدم من Dulbecco Modified Eagle's Medium / Ham F12 (DMEM / F-12) ، مكمل ب 1 mM HEPES ، 1x L-alanyl-L-glutamine ، 1x Penicillin-Streptomycin-Glutamine ، 10 mM Nicotinamide ، 1 mM N-Acetylcysteine ، 1x B27 ، 500 nM A-8301 ، 100 نانوغرام / مل hNoggin.
ملاحظة: اخلطي بلطف لتجنب الرغوة وقم بالتصفية من خلال مرشح 0.22 ميكرومتر. تسخين الوسائط إلى 37 درجة مئوية خلال 1 ساعة قبل الاستخدام. - ذوبان BME2 (مستخلص الغشاء السفلي لعامل النمو المنخفض ، النوع 2 ، انظر جدول المواد) على الجليد ، عند 4 درجات مئوية ، بين عشية وضحاها.
2. توليد تعليق خلية واحدة وبذر الخلايا
- فصل ثقافة BME2 العضوية المغمورة كما هو موضح في الخطوات التالية (2.1.1-2.1.6).
- استنشق الوسائط بعناية من لوحات الثقافة. تجنب لمس ثقافة BME2 العضوية المغمورة.
ملاحظة: يمكن إجراء طموح الوسائط كما يفضل الباحث ، على سبيل المثال ، باستخدام نظام شفط السوائل الأساسي أو باستخدام ماصة. تجنب لمس المواد العضوية المضمنة في BME2 لأن هذا قد يؤدي إلى فقدان الكتلة الحيوية العضوية. - التربسين ثقافة BME2 العضوية المغمورة بإنزيم مؤتلف مناسب (انظر جدول المواد). في شكل لوحة 6 آبار ، أضف 2 مل لكل بئر. كسر ميكانيكيا BME2 عن طريق السحب مرارا وتكرارا لأعلى ولأسفل. احتضان لوحات عند 37 درجة مئوية في حاضنة زراعة الخلايا لمدة 5 دقائق.
- انقل التعليق إلى أنبوب طرد مركزي سعة 15 مل وأجهزة طرد مركزي بسرعة 600 × جم لمدة 5 دقائق في درجة حرارة الغرفة.
- شفط الإنزيم المؤتلف بعناية دون لمس الكريات العضوية.
ملاحظة: قد يكون BME2 المتبقي موجودا. كرر هضم الإنزيم إذا لزم الأمر. - أعد تعليق الكريات العضوية في GM (الخطوة 1.1). أضف DNase I 1x 100 U / mL واحتضنه لمدة 5 دقائق في درجة حرارة الغرفة (انظر جدول المواد).
- جهاز طرد مركزي عند 600 × جم لمدة 3 دقائق في درجة حرارة الغرفة. ماصة من وسائل الإعلام بعناية دون لمس بيليه العضوية والتخلص منها. إعادة التعليق في جنرال موتورز جديدة.
- استنشق الوسائط بعناية من لوحات الثقافة. تجنب لمس ثقافة BME2 العضوية المغمورة.
- بذر تعليق العضوية أحادية الخلية
- قم بتسخين صفيحة 96 بئر سوداء جديدة ذات قاع صاف عند 37 درجة مئوية في حاضنة زراعة الخلايا لمدة 10 دقائق.
ملاحظة: يعد استخدام الألواح السفلية الشفافة أمرا ضروريا لمراقبة نمو المواد العضوية والاستجابة للأدوية. - للعد ، قم بإعداد تخفيف 1: 5 لتعليق الخلية في PBS (الحجم الإجمالي: 500 ميكرولتر) وحساب تعليق الخلية باستخدام محلل الخلايا (انظر جدول المواد).
ملاحظة: تأكد من الضرب في عامل التخفيف (x 5) لتلقي تركيز الخلية النهائي. يمكن استخدام طرق عد بديلة مثل مقياس الدم. يجب مراقبة صلاحية الخلية باستخدام اختبار تلطيخ الجدوى (على سبيل المثال ، باستخدام Trypan Blue17). باستخدام محلل الخلايا ، يتم تقييم الجدوى تلقائيا. يجب أن تكون صلاحية المعلقات العضوية أحادية الخلية كما تم تقييمها بواسطة محلل الخلايا ≥95٪ (الشكل التكميلي 1). - احسب حجم تعليق الخلية اللازم للبذر للتجربة.
ملاحظة: تركيز البذر هو 1500 خلية / ميكرولتر BME2 ، مع حاجة إلى 5 ميكرولتر BME2 لكل بئر (العدد الإجمالي: 7500 خلية / بئر). بالنسبة للوحة واحدة من 96 بئرا ، يلزم وجود خلايا 6 × 10E5. ويشمل ذلك بذر 60 بئرا بقباب عضوية (4.5 × 10E5) والفائض التجريبي (حساب ما مجموعه 80 بئرا). - قم بإعداد أليكوت واحد من تعليق الخلية في أنبوب طرد مركزي دقيق سعة 1.5 مل لكل صفيحة من 96 بئرا من المخطط أن يتم زرعها إذا تم تضمين ألواح متعددة من 96 بئرا في التجربة.
ملاحظة: هناك حاجة إلى فائض تجريبي وأليكوتات منفصلة لكل صفيحة 96 بئرا مبذرة لتفسير التحيز التجريبي المتزايد بسبب التعامل مع BME2. - خلايا Aliquot من التعليق أحادي الخلية كما هو محسوب (الخطوة 2.2.3) بعد إعادة التعليق الدقيق عن طريق السحب لأعلى ولأسفل. خلايا الكريات في 600 × غرام لمدة 5 دقائق في درجة حرارة الغرفة. قم بإزالة الوسائط بعناية باستخدام ماصة P200 دون لمس حبيبات الخلية. ضع حبيبات الخلية على الجليد قريبا (~ 1 دقيقة) وأعد تعليق حبيبة الخلية في BME2.
ملاحظة: قد تعرض الوسائط المتبقية بنية BME2 وصلابتها للخطر. ماصة من جميع وسائل الإعلام بعناية. ضع الخلايا على الجليد قريبا لتأقلم حبيبات الخلايا والسماح بإعادة تعليق الخلايا في BME2 دون تكتل. حافظ على BME2 على الجليد باستمرار حتى يبقى في الحالة السائلة. بالنسبة لصفيحة واحدة من 96 بئرا ، هناك حاجة إلى 400 ميكرولتر BME2 لإعادة تعليق حبيبات الخلية. أعد تعليق كريات الخلايا بعناية ، وتجنب إدخال الفقاعات. - قم بإمالة صفيحة 96 بئر ذات القاع الصافي الدافئة مسبقا نحوك. خلايا صفيحية تستخدم 5 ميكرولتر من تعليق الخلايا لكل بئر وقباب خلية البذر في موضع الساعة 6 لكل بئر (الشكل 1A). زرع قباب الخلية في الآبار الداخلية المتبقية (الأعمدة 2-10 والصفوف B-G من لوحة 96 بئرا).
ملاحظة: يوصى بالسحب العكسي18 عند التعامل مع BME2. - لا تحرك الصفيحة المكونة من 96 بئرا وتحضن قباب الخلايا ذات البذور الطازجة في غطاء التدفق الرقائقي لزراعة الخلايا لمدة 5 دقائق في درجة حرارة الغرفة. ثم حرك اللوحة إلى حاضنة زراعة الخلايا واحتضنها لمدة 10 دقائق عند 37 درجة مئوية.
- أضف بعناية 100 ميكرولتر من الكائنات المعدلة وراثيا لكل بئر إلى جميع الآبار التي تحتوي على عضويات (الأعمدة 2-10 والصفوف B-G من لوحة 96 بئرا). أضف 100 ميكرولتر من PBS إلى الآبار الخارجية عند حافة اللوحة.
- زراعة BME2 المواد العضوية المضمنة في وسائط المعدلة وراثيا عند 37 درجة مئوية في حاضنة زراعة الخلايا لمدة 7 أيام. فحص نمو المواد العضوية تحت المجهر الضوئي بانتظام.
ملاحظة: يرجى الرجوع إلى الشكل 1 باء والجدول التكميلي 1 للحصول على مثال على التقدم المتوقع في النمو من البذر إلى يوم العلاج. - قم بتغيير الوسائط مرة واحدة بعد 3-4 أيام من الثقافة: قم بتدوير اللوحة في اتجاه عقارب الساعة بمقدار 180 درجة (المواد العضوية الآن في وضع الساعة 12) ، وقم بشفط GM بعناية من الموضع المعاكس إلى القبة العضوية باستخدام جهاز متعدد القنوات إذا كان ذلك متاحا ، ثم أضف GM طازجا.
- قم بتسخين صفيحة 96 بئر سوداء جديدة ذات قاع صاف عند 37 درجة مئوية في حاضنة زراعة الخلايا لمدة 10 دقائق.
3. العلاج من تعاطي المخدرات
- قم بإعداد تخفيف دوائي تسلسلي في LGM للدواء المفضل ، على سبيل المثال ، osimertinib ، لعلاج المواد العضوية NSCLC المتحولة EGFR. قم بتضمين عنصر تحكم سلبي (وسائط LGM + 0.1٪ DMSO). إعداد ما يكفي من الأدوية لجميع الجرعات وفقا لعدد الآبار المزروعة بالإضافة إلى الفائض التجريبي.
ملاحظة: يوصى باستخدام سلسلة تخفيف تتضمن جرعات ≥8 وتتراوح من 1 نانومتر-10 ميكرومتر للمثبطات المستهدفة. - قم بتدوير اللوحة العضوية في اتجاه عقارب الساعة بمقدار 180 درجة (المواد العضوية الآن في وضع الساعة 12). شفط جنرال موتورز بعناية باستخدام جهاز متعدد القنوات يفضل.
ملاحظة: تجنب لمس القبة العضوية أثناء شفط الكائنات المعدلة وراثيا لأن هذا قد يؤدي إلى فقدان الكتلة الحيوية العضوية ونتائج التأثير. - أضف 100 ميكرولتر من التحكم (على سبيل المثال ، وسائط LGM + 0.1٪ DMSO) أو محلول دوائي لكل بئر.
ملاحظة: يرجى الرجوع إلى الشكل 1C للحصول على مخطط علاج تصعيد الدواء في شكل لوحة 96 بئرا. - احتضان المواد العضوية المعالجة عند 37 درجة مئوية في حاضنة زراعة الخلايا لمدة 5 أيام.
4. قراءة عن طريق اختبار البقاء على قيد الحياة القائم على التلألؤ
- قراءة الحصاد والبقاء على قيد الحياة
- قم بإجراء فحص البقاء على قيد الحياة وفقا ل Reference19.
- كواشف الذوبان (انظر جدول المواد) بين عشية وضحاها عند 4 درجات مئوية. قم بموازنة الكاشف في حمام مائي في درجة حرارة الغرفة لمدة 30 دقيقة قبل الاستخدام واخلطه عن طريق الانعكاس.
- أضف حجما متساويا من الكاشف إلى كل بئر (100 ميكرولتر لكل بئر). اخلطي جيدا عن طريق السحب لأعلى ولأسفل ، مع وضع طرف الماصة في موضع القبة العضوية. احتضان لمدة 5 دقائق في درجة حرارة الغرفة في الظلام.
- باستخدام ماصة متعددة القنوات ، انقل حوالي 75٪ (150 ميكرولتر) من الليزات (الخطوة 4.1.1.2) إلى لوحة بيضاء جديدة ذات قاع غير شفاف 96 بئرا.
ملاحظة: يضمن نقل 75٪ من الليزات إلى لوحة جديدة عدم وجود فقاعات في القراءة اللاحقة دون التأثير على حساسية المقايسة. - احتضان لمدة 25 دقيقة إضافية في درجة حرارة الغرفة في الظلام.
- سجل التلألؤ باستخدام قارئ لوحات ELISA (وقت التكامل 0.25-1 ثانية / لكل بئر) (انظر جدول المواد).
- احفظ البيانات بتنسيق مناسب، على سبيل المثال، جدول بيانات يحتوي على جميع القراءات الخام وتسجيل تخطيط اللوحة والأدوية المستخدمة.
- قم بإجراء فحص البقاء على قيد الحياة وفقا ل Reference19.
- تحليل البيانات باستخدام برنامج التحليل الإحصائي (انظر جدول المواد)
- قم بإنشاء جدول XY جديد وأدخل البيانات بتنسيق XY: الصفوف (X) هي عنصر تحكم سلبي متبوعا بجرعات دوائية متصاعدة ، مع جرعات كسجل [مثبط] في تركيز مولار. الأعمدة (Y) هي قيم قراءة تتضمن نسخا متماثلة مكدسة مع أعمدة.
ملاحظة: ينبغي الإشارة إلى تركيز عنصر التحكم السلبي كقيمة دنيا (بالنظر إلى أن 0 غير ممكن في مقياس السجل)، على سبيل المثال، سجل [مثبط]، M = -10. - تطبيع القيم عن طريق تحديد تحليل > تطبيع واستخدام المعلمات التالية: تطبيع كل عمود فرعي على حدة، Y = 0 ك 0٪، "القيمة الأخيرة في كل عمود فرعي (أو الأول، أيهما أكبر)" كنسبة 100٪، النتائج بالنسب المئوية ، الرسم البياني للنتائج.
- تناسب منحنى الانحدار غير الخطي على البيانات العادية عن طريق تحديد تحليل > تحليلات XY > الانحدار غير الخطي > استجابة الجرعة - سجل > التثبيط (المثبط) مقابل الاستجابة الطبيعية - الميل المتغير.
- نتائج التقرير كجدول لقيم IC50 الناتجة بعد تحليل الانحدار غير الخطي والرسم البياني لمنحنى الاستجابة بما في ذلك نقاط البيانات العادية كمتوسط +/- الانحراف المعياري ومنحنى الانحدار المجهز.
- قم بإنشاء جدول XY جديد وأدخل البيانات بتنسيق XY: الصفوف (X) هي عنصر تحكم سلبي متبوعا بجرعات دوائية متصاعدة ، مع جرعات كسجل [مثبط] في تركيز مولار. الأعمدة (Y) هي قيم قراءة تتضمن نسخا متماثلة مكدسة مع أعمدة.
النتائج
وقد لوحظت تحديات كبيرة في إنشاء المواد العضوية NSCLC 7. وبالتالي ، من المثير أن نرى العمل الأخير على إنشاء عضويات سرطان الرئة واستخدامها في فحوصات العلاج من تعاطي المخدرات 20،21،22. تمثل طفرات EGFR 11.3٪ من حالات NSCLC 23. يمثل العلاج المستهدف باستخدام مثبطات EGFR خيار علاج الخط الأول في NSCLC المتحور EGFR وقد حسن من سلامة البقاء على قيد الحياة والعلاج بشكل عام لدى المرضى24. حدد هذا العمل الحساسية لمثبط التيروزين كيناز EGFR المعتمد من إدارة الأغذية والعقاقير osimertinib24,25 في المواد العضوية NSCLC المتحولة EGFR. تم توليد المواد العضوية NSCLC المتحولة EGFR من الاستئصال الجراحي أو عينات خزعة الورم لمرضى NSCLC وتم تأكيدها لإيواء الطفرة الورمية المشار إليها عن طريق تسلسل الحمض النووي. كما هو موضح أعلاه ، تمت معالجة نماذج NSCLC العضوية المتحورة EGFR بجرعات متصاعدة من قابلية osimertinib و PDO للاستمرار التي تم تقييمها من خلال قراءة بقاء الخلايا القائمة على التلألؤ بعد خمسة أيام من بدء العلاج. في حين أظهرت المواد العضوية الموجبة TH107 الموجبة EGFR (EGFRdel19) حساسية لعلاج أوزيمرتينيب مع تركيز مثبط نصف أقصى (IC50) يبلغ 56 نانومتر (الشكل 2A) ، كانت عضويات EGFR-mutant (EGFRL858R) الإيجابية TH116 مقاومة للعلاج osimertinib مع IC50 أكبر من 1 ميكرومتر (الشكل 2B). ترافقت حساسية TH107 NSCLC الإيجابية EGFRdel19 مع تغييرات كبيرة في النسخ ، بما في ذلك انخفاض في التعبير عن التوقيعات الجينية المرتبطة بدورة الخلية وزيادة في التعبير عن التوقيعات الجينية المرتبطة بموت الخلايا المبرمج (الشكل التكميلي 2A ، B). كمرجع ، يتم تقديم بيانات الاستجابة لخط خلية NSCLC الإيجابي EGFRdel19 الحساس PC9 (الشكل 3A ، B). ويشمل هذا الأخير تحليل البقاء على قيد الحياة لجرعات متصاعدة من osimertinib بواسطة اختبار البقاء على قيد الحياة القائم على التلألؤ ثنائي الأبعاد (الشكل 3A) ودراسة قمع الإشارات على مستوى إشارات EGFR-MAPK بواسطة اللطخة الغربية (الشكل 3B). وبشكل عام، تسلط هذه البيانات الضوء على دقة البروتوكول الحالي لتحديد الاستجابة للأدوية والتمييز بين نماذج NSCLC PDO الحساسة والمقاومة. هناك حاجة إلى مزيد من التحليلات للعينات العضوية الإيجابية EGFRL858R TH116 والعينات السريرية المتاحة لتحديد التغييرات المحتملة المرتبطة بالمقاومة.
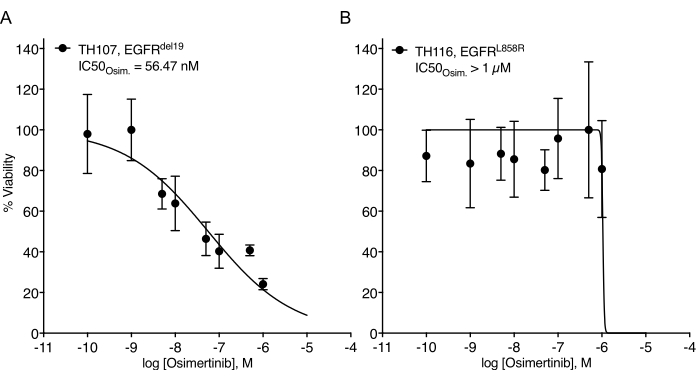
الشكل 2: منحنى استجابة العلاج لنماذج NSCLC العضوية المتحورة EGFR لتصعيد osimertinib. (أ) استجابة Osimertinib في النموذج العضوي الحساس ل EGFRdel19 TH107 NSCLC. (ب) استجابة Osimertinib في نموذج EGFRL858R الإيجابي TH116 NSCLC العضوي المقاوم. يتم عرض نقاط البيانات كقيم طبيعية توضح متوسط الانحراف المعياري +/- ، مع منحنى انحدار غير خطي يتم تركيبه من خلال البيانات. TH107، n = 6 نسخ متماثلة تقنية لكل نقطة بيانات. TH116, n = 4 نسخ متماثلة تقنية لكل نقطة بيانات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
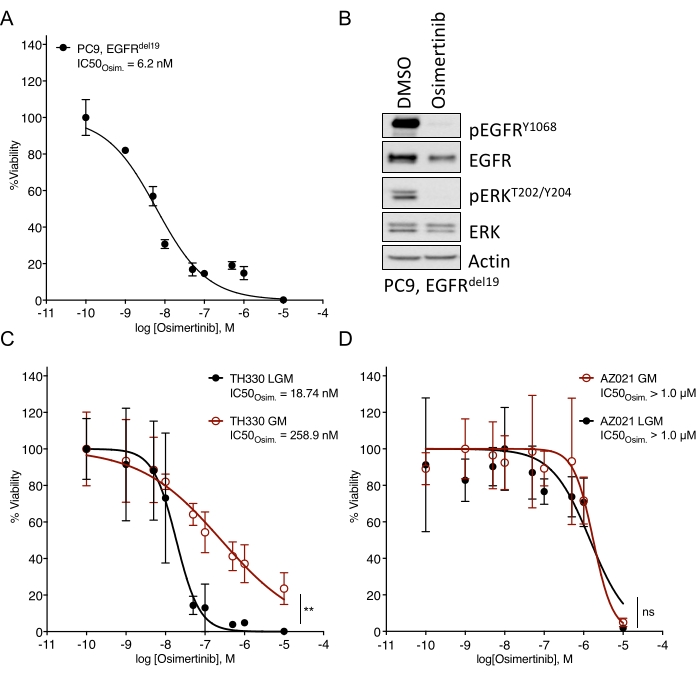
الشكل 3: بيانات مقارنة لاستجابة العلاج ل osimertinib في خط خلية NSCLC متحور EGFR حساس ونماذج عضوية مزروعة في وسائط مختلفة. (أ) استجابة Osimertinib في خط خلية NSCLC الإيجابي EGFRdel19 الحساس PC9 ، الذي تحدده المقايسة القياسية 2D-CTG. (ب) قمع الإشارات في خلايا PC9 عند العلاج لمدة يومين باستخدام osimertinib (2 ميكرومتر). (ج) استجابة Osimertinib في ثقافة النموذج العضوي الحساسة EGFRL858R الإيجابية TH330 NSCLC في وسائط LGM و GM. (د) استجابة Osimertinib في نموذج AZ021 NSCLC العضوي المقاوم في وسائط LGM و GM. فشل تأكيد طفرة EGFRL858R المولدة للأورام في AZ021 وقد يكون سببا لعدم وجود استجابة osimertinib. بالنسبة ل A و C-D ، يتم تقديم نقاط البيانات كقيم طبيعية توضح متوسط الانحراف المعياري +/- ، مع منحنى انحدار غير خطي يتم تركيبه من خلال البيانات. PC9 ، n = 3 نسخ متماثلة تقنية لكل نقطة بيانات. TH330, n = 5 نسخ متماثلة تقنية لكل نقطة بيانات. AZ021, n = 6 نسخ طبق الأصل التقنية لكل نقطة بيانات. تم إجراء اختبار رتبة ويلكوكسون على البيانات العادية لتحديد الدلالة الإحصائية. بالنسبة ل TH330 (C) ، LGM مقابل GM ، ** p = 0.0078. بالنسبة ل AZ021 (D) ، LGM مقابل GM, ns p = 0.0742. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: نتائج محلل الخلايا التمثيلية للعد وتقييم الجدوى لنماذج العضوية المتحولة EGFR. يشير TH107 و TH107BC إلى نماذج عضوية مختلفة و A و B إلى النسخ المتماثلة البيولوجية. لكل نموذج وتكرار بيولوجي ، يتم حساب ثلاث نسخ متماثلة تقنية. كل تظهر ≥95٪ الجدوى. يتم عرض صورة تمثيلية أثناء عد الخلايا على اليمين ، مما يدل على قابلية البقاء القوية وتفكك الخلية الواحدة. يرجى النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 2: تحليل إثراء مجموعة الجينات (GSEA) باستخدام بيانات تسلسل الحمض النووي الريبي السائبة التي تم الحصول عليها للعضويات TH107 NSCLC المتحورة EGFR ، مقارنة التحكم غير المعالج (DMSO) والخلايا المعالجة باستخدام Osimertinib لمدة 3 أيام (OSI_D3). (أ-ب) عند العلاج المستهدف ، ستخضع الخلايا الحساسة لدورة الخلية G1 للاعتقال وتتوقف عن الانتشار النشط. نظرا لأن التعبير عن جينات دورة الخلية G2M يرتبط بالانتشار النشط ، فمن المتوقع حدوث إثراء اسمي للتعبير في التحكم غير المعالج (DMSO). بالنسبة للجينات المرتبطة بموت الخلايا المبرمج ، من المتوقع حدوث إثراء اسمي في الخلايا المعالجة (OSI_D3). تم تأكيد كلاهما في نموذج العضوية TH107 NSCLC المتحور EGFR المعالج باستخدام Osimertinib: (A) GSEA لتوقيع تعبير Hallmark G2M (يسار) يظهر التخصيب في الخلايا المعالجة DMSO. درجة التخصيب الاسمية (NES): +1.708 ، FDR < 0.0001. (B) GSEA لتوقيع تعبير موت الخلايا المبرمج (يمين) يظهر التخصيب في الخلايا المعالجة ب Osimertinib. NES: -1.075 ، FDR: ns ، 0.3275. يرجى النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 3: العلاج الدوائي التوافقي في النموذج العضوي TH330 المتحور EGFR المعالج بتصعيد Osimertinib في وجود مثبط مضاف ثان بتركيز ثابت. كانت التعديلات المرتبطة بالمقاومة في NSCLC المتحور EGFR ، أي تنشيط SRC و AXL 26,27,28 ، مستهدفة دوائيا بواسطة العلاج التوافقي باستخدام مثبط SRC Saracatinib (100 nM) أو مثبط AXL R428 (500 nM) ، n = 6 نسخ متماثلة تقنية لكل نقطة بيانات. أدى كلا العلاجين التوافقيين إلى زيادة استجابة العلاج ، مع أهمية لمزيج Osimertinib مع مثبط SRC Saracatinib. تم تقييم الدلالة الإحصائية من خلال اختبار رتبة ويلكوكسون: Osimertinib مقابل Osimertinib + Saracatinib ، * p = 0.0195 ؛ أوسيمرتينيب vs. Osimertinib + R428, ns, p = 0.2500. يرجى النقر هنا لتنزيل هذا الملف.
الجدول التكميلي 1: تغيير حجم العضوية من البذر (d0) إلى 7 أيام بعد المعالجة (d7). (أ) تطور النمو في EGFRdel19-إيجابي NSCLC العضوية TH107. (ب) تطور النمو في EGFRL858R إيجابي NSCLC العضوية TH330. يرجى النقر هنا لتنزيل هذا الجدول.
Discussion
تطور هذه المخطوطة وتصف بروتوكولا موحدا لتقييم حساسية الدواء في نماذج 3D PDO المشتقة من NSCLC. بالإضافة إلى دراسات حساسية الدواء ، هناك حاجة إلى مزيد من التوصيف للنماذج العضوية المتاحة لتحديد الأسباب الكامنة وراء الاختلافات في حساسية الدواء. وقد يشمل ذلك التنميط الجيني للعضويات وعينات المرضى وغيرها من التحليلات المتاحة للعضويات، مثل تلطيخ الكيمياء النسيجية المناعية لعلامات التمايز والمؤشرات الحيوية العامة للإشارات الخلوية وعلم وظائف الأعضاء13،29.
الخطوات الحاسمة في البروتوكول
يوفر البروتوكول الموضح هنا سير عمل موحدا يسمح بإجراء تحليلات دقيقة وقابلة للتكرار لحساسية الدواء عند اتباعها بعناية. يجب توخي الحذر بشكل خاص في الخطوات التالية: هضم TrypLE و DNAse I أثناء توليد معلقات أحادية الخلية ، وبذر معلقات الخلية الواحدة في BME2 ، ومراقبة نمو الأعضاء حتى العلاج ، وتغيرات الوسائط ، وتعطيل وتحلل المواد العضوية المضمنة BME2 أثناء قراءة بقاء الخلايا القائمة على التلألؤ. (1) في حين أن الهضم الإضافي للحمض النووي I بعد التفكك القائم على التربيل للعضويات ليس ضروريا لتوسيع النماذج العضوية أثناء الصيانة المنتظمة للزراعة ، لا ينبغي حذف هضم الحمض النووي I عند البذر لتجارب تصعيد الأدوية لأنه يضمن فصلا أفضل للمجموعات العضوية إلى معلقات أحادية الخلية وإحصاء دقيق للخلايا. (2) يمثل بذر التعليق أحادي الخلية في BME2 خطوة حاسمة بالنظر إلى تصلب BME2 في درجة حرارة الغرفة. وبالتالي ، يجب زرع 1-2 صفوف كحد أقصى في وقت واحد ، ويجب وضع العينات على الجليد قبل زرع صفوف إضافية. تجدر الإشارة إلى أن الخلايا تحتاج إلى ماصة لأعلى ولأسفل عند استمرار البذر للسماح بتعليق الخلايا المتجانسة. (3) يجب مراقبة النمو العضوي بعناية أثناء التوسع لمدة 7 أيام من البذر إلى العلاج. ويرد مثال على التطور المتوقع في الشكل 1 باء والجدول التكميلي 1. وتجدر الإشارة إلى أن تقييم التغيرات في حجم العضوية بواسطة الفحص المجهري الساطع وتحليل الصور كما هو موضح في الشكل 1B قد يسمح بإجراء تقييم دقيق للاختلافات في نمو الأعضاء ومضاعفة الأوقات. ويمكن أن يكون لمضاعفة الأوقات تأثير على الاستجابات للأدوية، كما نوقش مؤخرا في الأدبيات30. إذا تجاوز معدل النمو العضوي المثال المقدم بشكل كبير ، فيمكن النظر في وقت توسع أقصر حتى بدء العلاج ومدة علاج أقصر. (4) بالإضافة إلى ذلك ، ينبغي توخي الحذر بشكل خاص عند تغيير الوسائط لتجنب شفط المواد العضوية. يسمح موضع البذر للعضويات المدمجة BME2 في موضع الساعة 6 بطموح آمن للوسائط عندما يتم تدوير الألواح في اتجاه عقارب الساعة بمقدار 180 درجة ويتم شفط الوسائط في الموضع المعاكس للعضويات. (5) أخيرا ، يعد التحلل الشامل للعضويات المضمنة في BME2 أثناء قراءة البقاء على قيد الحياة أمرا ضروريا لتسجيل نتائج دقيقة. وفقا لتعليمات الشركة المصنعة ، يجب سحب العينات لأعلى ولأسفل بشكل متكرر ، من الناحية المثالية باستخدام نصائح غير مفلترة ، لضمان التحلل المناسب. يجب اتباع أوقات الحضانة كما هو موضح. علاوة على ذلك ، فإن نقل 75٪ من الليزات (بدلا من الحجم الكلي) إلى لوحة 96 بئرا بيضاء غير شفافة القاع للقراءة النهائية باستخدام قارئ لوحة ELISA يسمح بإجراء تقييم مناسب ، لأن هذا يضمن نفس الحجم في كل بئر وعدم وجود فقاعات هواء يمكن إدخالها عن طريق السحب القوي.
وتجدر الإشارة إلى أن توصيف الاستجابات الدوائية في المزارع العضوية المضمنة في BME2 قد يظهر انحرافا معياريا أعلى مما لوحظ في مزارع خطوط الخلايا العادية (الشكل 2، الشكل 3A). يعتمد الانحراف المعياري الأعلى على عدة عوامل ، بما في ذلك زيادة احتمال حدوث اختلافات طفيفة في البذر عند العمل مع BME2 والاختلافات في معدلات النمو العضوية الفردية عبر الآبار خلال فترة النمو الأولية لمدة 7 أيام. وبالتالي ، ينبغي زرع ما يساوي أو يزيد عن أربعة تكرارات تقنية لكل تركيز دوائي.
الأهم من ذلك ، يجب تقييم وجود خلايا خبيثة تحمل طفرة المحرك الورمي والتلوث المحدود بالخلايا الظهارية الطبيعية في مجرى الهواء بعناية. يمكن للتحديات في إنشاء NSCLC أن تفضل نمو الخلايا الظهارية الطبيعية في مجرى الهواء 7. إن تحديد ملامح رقم النسخ أو النهج القائمة على PCR والتسلسل لتأكيد وجود طفرات المحرك الورمي هي الطرق المفضلة لضمان جودة ثقافات NSCLC العضوية.
التعديلات واستكشاف الأخطاء وإصلاحها في الطريقة
يمكن أن تؤثر وسائل الإعلام وعوامل النمو ذات الصلة المضافة إلى حلول الوسائط الأساسية بشكل كبير على استجابة الدواء للمثبطات المستهدفة. فهي تنشط مستقبلات الالتفافية ومسارات الإشارات التي تؤثر على الاستجابة للأدوية وتحد منها (على سبيل المثال، FGF، HGF، EGF)26. في حين أن الوسائط الغنية بعوامل النمو والمصممة خصيصا قد تكون مثالية لتوسيع الثقافة العضوية ، يجب إجراء تقييمات تصعيد الأدوية والحساسية في وسائط منخفضة عوامل النمو ، كما هو موضح أعلاه. ويستند ذلك إلى الخبرة الداخلية التي تقارن بين مختلف تركيبات الوسائط وبيانات الاستجابة للعقاقير (الشكل 3 جيم). في حين أن حلول الوسائط يمكن أن تؤثر على درجة الحساسية لبعض العلاجات الدوائية ويمكن أن تغير قيم IC50 ، فإن الأنماط الظاهرية القوية للحساسية أو المقاومة واضحة بغض النظر عن تركيبة الوسائط (الشكل 3C ، D). وبالإضافة إلى ذلك، يوصى بالاتساق العام في صياغة وسائط الإعلام وتحديد ملامح الاستجابات الدوائية عبر الثقافات العضوية، ويلزم زرع ما يعادل أو يزيد عن أربعة تكرارات تقنية لكل تركيز. هذا مهم بشكل خاص لقياس النطاقات في الحساسية مقابل. مقاومة لمثبط الفائدة.
قيود الطريقة
يصف البروتوكول المعروض هنا حساسية نماذج NSCLC 3D العضوية للسرطان للمثبطات المستهدفة عند زراعة الخلايا السرطانية المشتقة من المريض. وهناك حاجة إلى تجارب إضافية، بما في ذلك التحليل الدوائي الديناميكي فيما يتعلق بتثبيط المسار وتحليل التسلسل لوجود الجين الورمي المحرك والطفرات الثانوية، من أجل توصيف مفصل لمقاومة الأدوية وحساسيتها. علاوة على ذلك ، لا يتم حساب العوامل المتفرجة مثل المحفزات البيئية الدقيقة المشتقة من التفاعلات أو العوامل المفرزة من قبل الخلايا المتفرجة غير السرطانية في البيئة الدقيقة للورم ، وهناك حاجة إلى بروتوكولات جديدة عند محاولة نماذج العضوية المشتركة مع الخلايا المناعية أو اللحمية . وقد سلط العمل الأخير الضوء على استخدام النماذج العضوية لتلخيص تفاعلات البيئة الدقيقة للورم واستجابات الملف الشخصي لمثبطات نقاط التفتيش المناعية ، مثل العلاج المضاد ل PD-L1 13,31.
أهمية الطريقة فيما يتعلق بالطرق الحالية / البديلة
تلخص النماذج العضوية للسرطان ثلاثي الأبعاد التنوع الجيني ومحددات استجابة العلاج الموجودة في الورم الأصلي4,5,6. ومن الجدير بالذكر أن عدم التجانس المكاني والزماني يمكن أن يعزز تطور الورم، ويمكن أن يحدث ظهور مواز وتطور متسلسل للنسخ الفرعية للورم32,33. عدم التجانس داخل الورم مهم لاختيار الخلايا السرطانية الأكثر مرونة تحت الضغط العلاجي9،34،35. يسمح البروتوكول المقدم هنا بإجراء تقييم سريع للحساسيات للعلاج باستخدام مثبطات مستهدفة في عينات قريبة من المريض. وبالتالي ، فإن النماذج العضوية لها مزايا على نماذج خطوط الخلايا المتجانسة التقليدية التي تفتقر إلى التنوع الجيني أو الدراسات طويلة الأجل باستخدام خطوط الخلايا أو xenografts المشتقة من المريض. وعلاوة على ذلك، يسمح هذا البروتوكول بالتوسع إلى أذرع متعددة من العلاج ونهج العلاج المختلط مع قيود قليلة فيما يتعلق بالتكلفة والقدرة التحليلية. وعلى هذا النحو، فإن إضافة دواء ثان ذي أهمية بجرعة ثابتة مع تصعيد المثبط المستهدف في المقام الأول ومقارنته بتصعيد المثبط المستهدف في المقام الأول وحده يسمح بتقييم الآثار التوافقية المحتملة بكفاءة مع الحد الأدنى من الكتلة الحيوية الإضافية المطلوبة (الشكل التكميلي 3). بالمقارنة مع التقييمات القائمة على التصوير المستخدمة لمراقبة تطور المواد العضوية والاستجابة للعقاقير ، فإن اختبار بقاء الخلايا القائم على التلألؤ الموصوف هنا له حساسية مماثلة مع الحد الأدنى من المعدات والتدريب المطلوب.
أهمية والتطبيقات المحتملة للطريقة في مجالات بحثية محددة
إن تطوير خط أنابيب موحد يسمح بإنشاء نماذج عضوية للسرطان من عينات المرضى ، ويحمل التنميط الحساس للأدوية اللاحقة إمكانات تطبيق سريرية كبيرة. اكتسب التنميط الدوائي خارج الجسم الحي اعترافا في الكشف عن نقاط الضعف والميزات المرتبطة بالمقاومة في الأورام ، والتي ترتبط باستجابة العلاج لدى المرضى36,37. ومن الجدير بالذكر أن التنميط خارج الجسم الحي لحساسيات الأدوية قد يساعد في اختيار العلاج في العيادة وتصميم علاجات توليفية عقلانية تعالج آليات المقاومة. بشكل عام ، يمكن أن يساعد هذا النهج في تمكين استراتيجيات شخصية محسنة للعلاج الجزيئي أو أنظمة العلاج التوافقي. وقد يساعد هذا الأخير في استهداف آليات تحمل الأدوية ومقاومتها في وقت مبكر وتعميق الاستجابة السريرية لتحسين نتائج المرضى في المستقبل.
Disclosures
T.G.B. هو مستشار ل Array Biopharma و Revolution Medicines و Novartis و AstraZeneca و Takeda و Springworks و Jazz Pharmaceuticals و Relay Therapeutics و Rain Therapeutics و Engine Biosciences ويتلقى تمويلا بحثيا من Novartis و Strategia و Kinnate و Revolution Medicines.
Acknowledgements
نشكر مختبرات Jeroen P Roose (UCSF) و Calvin J Kuo (Stanford) على مدخلاتهم فيما يتعلق بالثقافة العضوية وتطوير البروتوكول. كما نشكر Oghenekevwe M. Gbenedio (مختبر Roose ، UCSF) على البروتوكولات ومدخلات إنشاء العينات. تم إجراء هذا المشروع البحثي بدعم من المعاهد الوطنية للصحة [U54CA224081]. حصل F. Haderk على دعم زمالة Mildred Scheel لما بعد الدكتوراه من المعونة الألمانية للسرطان.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | |||
| 15 mL centrifuge tubes | |||
| 500 mL Vacuum Filter/Storage Bottle System, 0.2 µm Pore 33.2 cm2 Nylon Membrane | Corning | 430773 | for both media |
| 96-Well, Cell Culture-Treated, Flat Clear Bottom Black Microplate | Corning | 3904 | |
| 96-Well, Cell Culture-Treated, Solid White Flat-Bottom Microplate | Corning | 3917 | |
| A-8301 | Tocris Bioscience | 293910 | for both media |
| Advanced DMEM/F-12 | Gibco | 12634010 | for LGM |
| B27 | Life Technologies | 12587010 | for both media |
| BioRender 2021 | https://biorender.com/ | online scientific illustration software | |
| BME2 (Cultrex RGF Basement Membrane Extract, Type 2) | R&D Systems | 353301002 | |
| Cell culture incubator (37 °C, 5% CO2) | |||
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9682 | 3D-CTG readout reagent |
| Centrifuge holding 15 mL centrifuge tubes | |||
| Deoxyribonuclease I (DNAse I) | ThermoFisher Scientific | 18047019 | |
| Dulbecco's Phosphate-Buffered Salt Solution | Corning | MT21031CV | |
| DMEM/F-12, GlutaMAX supplement | Gibco | 10565018 | for GM |
| GlutaMax | Gibco | 35050061 | for LGM |
| GraphPad Prism software (version 9.2.0) | GraphPad | statistical analysis software | |
| HEPES | Gibco | 15630080 | for both media |
| hFGF-10 | PeproTech | 100-26-100ug | for GM |
| hFGF-7 | PeproTech | 100-19-50ug | for GM |
| hNoggin | PeproTech | 120-10C-100ug | for both media |
| hRspondin | PeproTech | 120-38-100ug | for GM |
| Low retention pipette tips, 20 µL (P20) | ThermoFisher Scientific | 2149P-05-HR | |
| Low retention pipette tips, 200 µL (P200) | ThermoFisher Scientific | 2069-05-HR | |
| Regular length pipette tips, 1000 µL (P1000) | ThermoFisher Scientific | 2179-HR | |
| Multichannel pipette | |||
| N-Acetylcysteine | Fisher Scientific | 50-424-777 | for both media |
| Nicotinamide | Sigma Aldrich | N0636-100G | for both media |
| Osimertinib | Selleck Checm | S7297 | |
| Penicillin-Streptomycin-Glutamine | Gibco | 10378016 | for LGM |
| Penicillin/Streptomycin | Cytiva HyClone | SV30010 | for GM |
| Pipettes (different sizes) | |||
| Plate reader | Molecular Devices | SpectraMax M5 | equipment, alternative readers may be used |
| Primocin | Invivogen | ant-pm-1 | for GM |
| SB202190 | Selleck Chem | S1077 | for GM |
| TrypLE Express Enzyme | Gibco | 12604021 | |
| Vacuum pump and tubing | |||
| Vi-CELL XR Cell Analyzer | Beckman Coulter | Vi-CELL XR | cell analyzer / counter |
References
- de Bono, J. S., Ashworth, A. Translating cancer research into targeted therapeutics. Nature. 467 (7315), 543-549 (2010).
- Dagogo-Jack, I., Shaw, A. T. Tumour heterogeneity and resistance to cancer therapies. Nature Reviews Clinical Oncology. 15 (2), 81-94 (2018).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Dijkstra, K. K., et al. Challenges in establishing pure lung cancer organoids limit their utility for personalized medicine. Cell Reports. 31 (5), 107588(2020).
- Lo, Y. -H., Karlsson, K., Kuo, C. J. Applications of organoids for cancer biology and precision medicine. Nature Cancer. 1 (8), 761-773 (2020).
- Bivona, T. G., Doebele, R. C. A framework for understanding and targeting residual disease in oncogene-driven solid cancers. Nature Medicine. 22 (5), 472-478 (2016).
- Jabs, J., et al. Screening drug effects in patient-derived cancer cells links organoid responses to genome alterations. Molecular Systems Biology. 13 (11), 955(2017).
- Tashiro, T., et al. In vivo and ex vivo cetuximab sensitivity assay using three-dimensional primary culture system to stratify KRAS mutant colorectal cancer. PLoS One. 12 (3), 0174151(2017).
- van de Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Neal, J. T., et al. Organoid Modeling of the Tumor Immune Microenvironment. Cell. 175 (7), 1972-1988 (2018).
- Hysenaj, L., et al. SARS-CoV-2 infection studies in lung organoids identify TSPAN8 as novel mediator. bioRxiv. , (2021).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300(2019).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocol in Immunology. , Appendix 3, Appendix 3B (2001).
- Pushparaj, P. N. Revisiting the micropipetting techniques in biomedical sciences: A fundamental prerequisite in good laboratory practice. Bioinformation. 16 (1), 8-12 (2020).
- Promega Corporation. CellTiter-Glo 3D Cell Viability Assay. Promega Corporation. , (2021).
- Kim, M., et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nature Communication. 10 (1), 3991(2019).
- Hu, Y., et al. Lung cancer organoids analyzed on microwell arrays predict drug responses of patients within a week. Nature Communication. 12 (1), 2581(2021).
- Shi, R., et al. Organoid cultures as preclinical models of non-small cell lung cancer. Clinical Cancer Research. 26 (5), 1162-1174 (2020).
- Collisson, E. A., et al. Comprehensive molecular profiling of lung adenocarcinoma. Nature. 511 (7511), 543-550 (2014).
- Ramalingam, S. S., et al. Overall Survival with Osimertinib in untreated, EGFR-mutated advanced NSCLC. New England Journal of Medicine. 382 (1), 41-50 (2019).
- Soria, J. -C., et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. New England Journal of Medicine. 378 (2), 113-125 (2017).
- Rotow, J., Bivona, T. G. Understanding and targeting resistance mechanisms in NSCLC. Nature Reviews Cancer. 17 (11), 637-658 (2017).
- Zhang, Z., et al. Activation of the AXL kinase causes resistance to EGFR-targeted therapy in lung cancer. Nature Genetics. 44 (8), 852-860 (2012).
- Kanda, R., et al. Erlotinib resistance in lung cancer cells mediated by integrin β1/Src/Akt-driven bypass signaling. Cancer Research. 73 (20), 6243-6253 (2013).
- Bruun, J., et al. Patient-derived organoids from multiple colorectal cancer liver metastases reveal moderate intra-patient pharmacotranscriptomic heterogeneity. Clinical Cancer Research. 26 (15), 4107-4119 (2020).
- Hafner, M., Niepel, M., Chung, M., Sorger, P. K. Growth rate inhibition metrics correct for confounders in measuring sensitivity to cancer drugs. Nature methods. 13 (6), 521-527 (2016).
- Yuki, K., Cheng, N., Nakano, M., Kuo, C. J. Organoid models of tumor immunology. Trends in Immunology. 41 (8), 652-664 (2020).
- Gerlinger, M., et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. New England Journal of Medicine. 366 (10), 883-892 (2012).
- McGranahan, N., Swanton, C. Biological and therapeutic impact of intratumor heterogeneity in cancer evolution. Cancer Cell. 27 (1), 15-26 (2015).
- Rambow, F., et al. Toward minimal residual disease-directed therapy in melanoma. Cell. 174 (4), 843-855 (2018).
- Marine, J. C., Dawson, S. J., Dawson, M. A. Non-genetic mechanisms of therapeutic resistance in cancer. Nature Reviews Cancer. 20 (12), 743-756 (2020).
- Frismantas, V., et al. Ex vivo drug response profiling detects recurrent sensitivity patterns in drug-resistant acute lymphoblastic leukemia. Blood. 129 (11), 26-37 (2017).
- Drusbosky, L. M., et al. Predicting response to BET inhibitors using computational modeling: A BEAT AML project study. Leukemia Research. 77, 42-50 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved