Method Article
Profiling der Sensitivität gegenüber zielgerichteten Therapien in EGFR-mutierten NSCLC-patientenabgeleiteten Organoiden
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine standardisierte Bewertung von Arzneimittelsensitivitäten gegenüber zielgerichteten Signalinhibitoren in NSCLC-patientenabgeleiteten Organoidmodellen.
Zusammenfassung
Neuartige 3D-Krebsorganoidkulturen, die aus klinischen Patientenproben gewonnen werden, stellen ein wichtiges Modellsystem zur Bewertung der Intratumorheterogenität und des Ansprechens auf gezielte Inhibitoren bei Krebs dar. Pionierarbeit bei Magen-Darm- und Bauchspeicheldrüsenkrebs hat das Versprechen von patientenabgeleiteten Organoiden (PDOs) als patientennahes Kultursystem hervorgehoben, wobei immer mehr Modelle entstehen. In ähnlicher Weise hat sich die Arbeit in anderen Krebsarten auf die Etablierung von Organoidmodellen und die Optimierung von Kulturprotokollen konzentriert. Insbesondere 3D-Krebsorganoid-Modelle behalten die genetische Komplexität ursprünglicher Tumorproben bei und übersetzen so tumorabgeleitete Sequenzierungsdaten in die Behandlung mit genetisch informierten zielgerichteten Therapien in einem experimentellen Umfeld. Darüber hinaus könnten PDOs die Bewertung rationaler Kombinationsbehandlungen fördern, um die resistenzassoziierte Anpassung von Tumoren in der Zukunft zu überwinden. Letzteres konzentriert sich auf intensive Forschungsanstrengungen bei nicht-kleinzelligem Lungenkrebs (NSCLC), da die Resistenzentwicklung letztendlich den Behandlungserfolg gezielter Inhibitoren einschränkt. Eine frühzeitige Bewertung therapeutisch zielgerichteter Mechanismen unter Verwendung von NSCLC-PDOs könnte dazu beitragen, rationale Kombinationsbehandlungen zu informieren. Dieses Manuskript beschreibt ein standardisiertes Protokoll für die zellkulturplattenbasierte Bewertung von Arzneimittelempfindlichkeiten gegenüber zielgerichteten Inhibitoren in NSCLC-abgeleiteten 3D-PDOs mit potenzieller Anpassungsfähigkeit an Kombinationsbehandlungen und andere Behandlungsmodalitäten.
Einleitung
Personalisierte Therapien gegen onkogene Treiber haben die Krebsbehandlung revolutioniert, das Überleben der Patienten verbessert und behandlungsvermittelte Nebenwirkungen reduziert1. Jüngste Fortschritte in der molekularen Diagnostik und Sequenzierungstechnologie haben die Komplexität menschlicher Tumore deutlich gemacht, wobei sich die räumliche und zeitliche Heterogenität auf das Ansprechen auf die Behandlung auswirkt2. Die Rekapitulation dieser subklonalen Unterschiede in Zellkulturmodellen beschränkte sich lange Zeit auf die Untersuchung ausgewählter Veränderungen des Interesses in ansonsten einheitlichen Zelllinien. Neu entwickelte 3D-PDO-Modelle, die aus Tumorbiopsien oder chirurgischen Tumorresektionen generiert werden, ermöglichen eine verbesserte Darstellung der zellulären Komplexität und Signalübersprechen innerhalb von patientenabgeleitetem Tumorgewebe3. So wurden Tumororganoide aus Magen-Darm- und Bauchspeicheldrüsenkrebs erfolgreich erzeugt und rekapitulieren die genetische Vielfalt und Determinanten des Behandlungsansprechens4,5,6. Bei nicht-kleinzelligem Lungenkrebs (NSCLC) werden Herausforderungen bei der Entwicklung und Etablierung von Organoiden anerkannt, und es ist eine Optimierung von Kulturtechniken und selektiven Medienfaktoren erforderlich, um in Zukunft eine breitere und systematischere Verwendung von NSCLC-PDOs zu ermöglichen7,8.
Die Entwicklung kombinatorischer Therapien, die auf Resttumorzellen abzielen, die einer medikamentösen Erstbehandlung standhalten, ist unerlässlich, um die Resistenzentwicklung zu hemmen und letztendlich das Überleben der Patienten zu verbessern9. Angesichts der architektonischen Komplexität von Organoidkulturen müssen klassische Arzneimittelreaktionsparameter optimiert werden, um genaue und reproduzierbare Tests von Arzneimittelempfindlichkeiten zu ermöglichen. Bildgebende Auslesungen10,11 und klassische Zelllebensfähigkeitsassays zur Messung der zellulären ATP-Abundanz6,12 stehen neben anderen Techniken zur Profilierung von Arzneimittelreaktionen in PDO-Kulturen zur Verfügung. Hier entwickeln und beschreiben wir ein standardisiertes Protokoll zur Bewertung von Arzneimittelempfindlichkeiten gegenüber einer zielgerichteten Therapie gegen bekannte klinische Treiber in NSCLC-PDO-Modellen.
Protokoll
Für die Forschung am Menschen wurde die Einwilligung nach Aufklärung eingeholt und die Gewebeentnahme nach den vom UCSF Internal Review Board genehmigten Protokollen (IRB, Protokollnummer: # 13-12492 oder CC # 17-23309) durchgeführt. Die Etablierung von Organoidkulturen aus de-identifizierten klinischen Proben erfolgte in Zusammenarbeit mit Forschungspartnern nach bisher veröffentlichten Methoden13,14,15,16. Organoidkulturen wurden für Erhaltungs- und Arzneimitteleskalationsexperimente in der Passage drei oder später gewonnen. Alle folgenden Protokolle wurden unter aseptischen Bedingungen in einer Gewebekulturumgebung für Säugetiere durchgeführt.
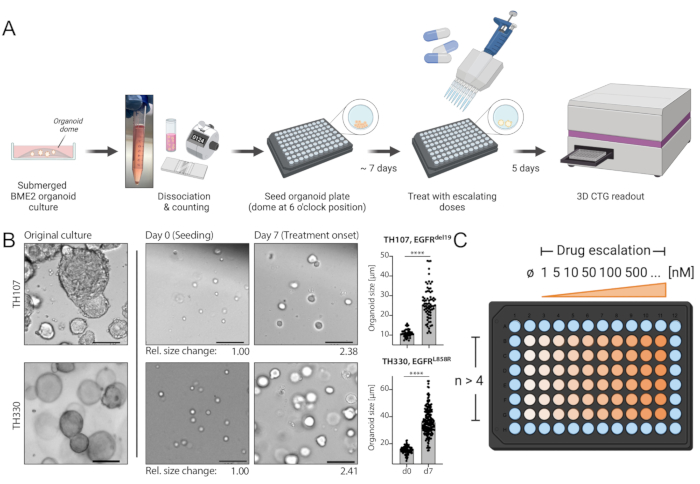
Abbildung 1: Protokollschema des Workflows und der kritischen Schritte in der Technik. (A) Experimenteller Arbeitsablauf einschließlich der Aussaat von Organoiden im 96-Well-Format, der Behandlung mit Arzneimitteleskalation 7 Tage nach der Aussaat und der lumineszenzbasierten Zellüberlebensanzeige 5 Tage nach der Behandlung mit einem ELISA-Plattenleser. (B) Ein Beispielbild der EGFRdel19-positiven TH107- und EGFRL858R-positiven TH330 NSCLC-Organoidkulturen. Originalkulturen, Zellen zum Zeitpunkt der Aussaat (Tag 0) und Organoide bei der Behandlung beginnen 7 Tage nach der Aussaat (Tag 7). Maßstabsleiste = 100 μm. Änderungen des Organoiddurchmessers während der anfänglichen 7-tägigen Kulturperiode werden quantifiziert und deuten auf >2-fache Zunahme der Organoidgröße hin. Relative Faltenänderungen der Größen an Tag 7 im Vergleich zur Durchschnittsgröße an Tag 0 sind unter den repräsentativen Bildern dargestellt. Für TH107 wird eine Faltungsänderung von 2,38 über 7 Tage beobachtet, was auf eine Verdopplungszeit von 5,88 Tagen (141,12 h) hinweist. Für TH330 wird eine Faltenänderung von 2,41 über 7 Tage beobachtet, was auf eine Verdopplungszeit von 5,81 Tagen (139,42 h) hinweist. Die Quantifizierung von Änderungen der Organoidgröße und die statistische Auswertung werden vorgestellt (rechts). Die statistische Signifikanz wird durch ungepaarten t-Test, p < 0,0001 berechnet. (C) Behandlungslayout für die Arzneimitteleskalation im Organoid-96-Well-Plattenformat. Die Anzahl der technischen Replikate und beispielhaften Dosen sind angegeben, einschließlich einer Negativkontrolle. Die Schaltpläne werden mit BioRender, einem webbasierten Illustrationswerkzeug, erstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
1. Versuchspräparate
- Bereiten Sie das Wachstumsmedium (GM) wie zuvor berichtet vor15: Dulbecco's Modified Eagle's Medium/Ham's Nährstoffmischung F12 (DMEM/F-12) mit L-Alanyl-L-Glutamin, ergänzt mit 100 U/ml Penicillin/Streptomycin, 10 mM HEPES, 25 nM hRspondin, 1x B27, 5 mM Nicotinamid, 1,25 mM N-Acetylcystein, 500 nM A-8301, 500 nM SB202190, 50 μg/mL Primocin, 100 ng/mL hNoggin, 100 ng/mL hFGF-10, 25 ng/ml hFGF-7 (siehe Materialtabelle).
HINWEIS: Mischen Sie vorsichtig, um Schaumbildung zu vermeiden, und filtern Sie durch ein 0,22-μm-Filtersystem. Medien vor Gebrauch innerhalb von 1 h auf 37 °C erwärmen. - Herstellung von Medien mit niedrigem Wachstumsfaktor (LGM) wie bereits berichtet16 ohne Zusatz von epidermalem Wachstumsfaktor (EGF): Advanced Dulbecco's Modified Eagle's Medium/Ham's Nährstoffmischung F12 (DMEM/F-12), ergänzt mit 1 mM HEPES, 1x L-Alanyl-L-Glutamin, 1x Penicillin-Streptomycin-Glutamin, 10 mM Nicotinamid, 1 mM N-Acetylcystein, 1x B27, 500 nM A-8301, 100 ng/mL hNoggin.
HINWEIS: Mischen Sie vorsichtig, um Schaumbildung zu vermeiden, und filtern Sie durch einen 0,22-μm-Filter. Medien vor Gebrauch innerhalb von 1 h auf 37 °C erwärmen. - Auftauen von BME2 (Reduced Growth Factor Basement Membrane Extract, Typ 2, siehe Materialtabelle) auf Eis, bei 4 °C, über Nacht.
2. Erzeugung von Einzelzellsuspension und Aussaat von Zellen
- Dissoziation der eingetauchte BME2-Organoidkultur wie in den folgenden Schritten beschrieben (2.1.1-2.1.6).
- Saugen Sie die Medien vorsichtig von den Kulturplatten ab. Vermeiden Sie es, die untergetauchte BME2-Organoidkultur zu berühren.
HINWEIS: Die Medienaspiration kann nach Belieben durchgeführt werden, z. B. mit einem grundlegenden Flüssigkeitsaspirationssystem oder mit einer Pipette. Vermeiden Sie es, die eingebetteten BME2-Organoide zu berühren, da dies zum Verlust von Organoid-Biomasse führen könnte. - Trypsinisieren Sie die untergetauchte BME2-Organoidkultur mit einem geeigneten rekombinanten Enzym (siehe Materialtabelle). Im 6-Well-Plate-Format 2 ml pro Well. Brechen Sie den BME2 mechanisch auf, indem Sie wiederholt auf und ab pipettieren. Inkubieren Sie Platten bei 37 °C im Zellkultur-Inkubator für 5 min.
- Übertragen Sie die Suspension in ein 15 ml Zentrifugenröhrchen und eine Zentrifuge bei 600 x g für 5 min bei Raumtemperatur.
- Saugen Sie das rekombinante Enzym vorsichtig ab, ohne das Organoidpellet zu berühren.
HINWEIS: Rest-BME2 kann vorhanden sein. Wiederholen Sie bei Bedarf die Enzymverdauung. - Resuspendiert das Organoid-Pellet in GM (Schritt 1.1). DNase I 1x 100 U/ml hinzufügen und 5 min bei Raumtemperatur inkubieren (siehe Materialtabelle).
- Zentrifuge bei 600 x g für 3 min bei Raumtemperatur. Das Medium vorsichtig abperlen, ohne das Organoidpellet zu berühren, und entsorgen. Resuspend in frischem GM.
- Saugen Sie die Medien vorsichtig von den Kulturplatten ab. Vermeiden Sie es, die untergetauchte BME2-Organoidkultur zu berühren.
- Aussaat von Organoid-Einzelzellsuspension
- Eine neue schwarze, durchsichtige 96-Well-Platte bei 37 °C im Zellkultur-Inkubator für 10 min vorheizen.
HINWEIS: Die Verwendung klarer Bodenplatten ist wichtig, um das Organoidwachstum und die Arzneimittelreaktion zu überwachen. - Für die Zählung bereiten Sie eine 1:5-Verdünnung der Zellsuspension in PBS (Gesamtvolumen: 500 μL) vor und zählen Sie die Zellsuspension mit einem Zellanalysator (siehe Materialtabelle).
HINWEIS: Stellen Sie sicher, dass Sie mit dem Verdünnungsfaktor (x 5) multiplizieren, um die endgültige Zellkonzentration zu erhalten. Alternative Zählmethoden wie ein Hämozytometer können verwendet werden. Die Zelllebensfähigkeit sollte mit einem Riziabilitäts-Färbeassay überwacht werden (z. B. mit Trypan Blue17). Mit einem Zellanalysator wird die Lebensfähigkeit automatisch bewertet. Die Lebensfähigkeit von Organoid-Einzelzellsuspensionen, wie sie vom Zellanalysator bewertet werden, sollte ≥95% betragen (Ergänzende Abbildung 1). - Berechnen Sie das Volumen der Zellsuspension, die für das Seed für das Experiment benötigt wird.
HINWEIS: Die Seeding-Konzentration beträgt 1500 Zellen/μL BME2, wobei 5 μL BME2 pro Vertiefung benötigt werden (Gesamtzahl: 7500 Zellen/Well). Für eine 96-Well-Platte werden 6 x 10E5-Zellen benötigt. Dazu gehören die Aussaat von 60 Bohrungen mit Organoidkuppeln (4,5 x 10E5) und experimenteller Überschuss (Berechnung für insgesamt 80 Bohrungen). - Bereiten Sie ein Aliquot Zellsuspension in einem 1,5-ml-Mikrozentrifugenröhrchen pro 96-Well-Platte vor, die ausgesät werden soll, wenn mehrere 96-Well-Platten in das Experiment einbezogen werden.
HINWEIS: Experimenteller Überschuss und separate Aliquots pro ausgesäter 96-Well-Platte sind erforderlich, um die erhöhte experimentelle Verzerrung aufgrund der Handhabung von BME2 zu berücksichtigen. - Aliquot-Zellen aus der Einzelzellsuspension wie berechnet (Schritt 2.2.3) nach vorsichtiger Neususpension durch Pipettieren nach oben und unten. Pelletzellen bei 600 x g für 5 min bei Raumtemperatur. Entfernen Sie Medien vorsichtig mit einer P200-Pipette, ohne das Zellpellet zu berühren. Zellpellet kurz (~1 min) auf Eis legen und das Zellpellet in BME2 resuspendieren.
HINWEIS: Restmedien können die BME2-Struktur und -Steifigkeit beeinträchtigen. Pipette alle Medien sorgfältig. Stellen Sie Zellen kurz auf Eis, um das Zellpellet zu akklimatisieren und Zellen in BME2 zu resuspendieren, ohne zu verklumpen. Halten Sie BME2 ständig auf Eis, damit es im flüssigen Zustand bleibt. Für eine 96-Well-Platte werden 400 μL BME2 für die Resuspension des Zellpellets benötigt. Suspendieren Sie die Zellpellets vorsichtig und vermeiden Sie die Einführung von Blasen. - Kippen Sie Ihre vorgewärmte schwarze, durchsichtige 96-Well-Platte zu sich. Plattenzellen mit 5 μL Zellsuspension pro Vertiefung und Aussaat von Zellkuppeln an der 6-Uhr-Position jedes Bohrlochs (Abbildung 1A). Säen Sie die Zellkuppeln in den verbleibenden inneren Vertiefungen (Spalten 2-10 und Reihen B-G einer 96-Well-Platte).
HINWEIS: Beim Umgang mit BME2 wird Reverse Pipetting18 empfohlen. - Bewegen Sie die 96-Well-Platte nicht und inkubieren Sie frisch ausgesäte Zellkuppeln in der Zellkultur-Laminar-Flow-Haube für 5 min bei Raumtemperatur. Bewegen Sie dann die Platte in den Zellkultur-Inkubator und inkubieren Sie sie für 10 min bei 37 ° C.
- Fügen Sie vorsichtig 100 μL GM pro Vertiefung zu allen Vertiefungen hinzu, die Organoide enthalten (Spalten 2-10 und Reihen B-G einer 96-Well-Platte). 100 μL PBS in die äußeren Vertiefungen am Rand der Platte geben.
- Kultur BME2 eingebettete Organoide in gentechnisch veränderte Medien bei 37 °C im Zellkultur-Inkubator für insgesamt 7 Tage. Untersuchen Sie das Wachstum von Organoiden regelmäßig unter dem Lichtmikroskop.
HINWEIS: Ein Beispiel für den erwarteten Wachstumsfortschritt von der Aussaat bis zum Behandlungstag finden Sie in Abbildung 1B und in der ergänzenden Tabelle 1. - Wechseln Sie das Medium einmal nach 3-4 Tagen Kultur: Drehen Sie die Platte im Uhrzeigersinn um 180 ° (Organoide jetzt in 12-Uhr-Position), saugen Sie GM vorsichtig von der gegenüberliegenden Position zur Organoidkuppel mit einer Mehrkanalvorrichtung, falls verfügbar, und fügen Sie dann frisches GM hinzu.
- Eine neue schwarze, durchsichtige 96-Well-Platte bei 37 °C im Zellkultur-Inkubator für 10 min vorheizen.
3. Medikamentöse Behandlung
- Bereiten Sie eine serielle Arzneimittelverdünnung in LGM für das Medikament Ihrer Wahl, z. B. Osimertinib, zur Behandlung von EGFR-mutierten NSCLC-Organoiden vor. Schließen Sie eine Negativkontrolle ein (LGM-Medien + 0,1% DMSO). Bereiten Sie ausreichende Arzneimittelaliquoten aller Dosen entsprechend der Anzahl der ausgesäten Brunnen plus experimentellem Überschuss vor.
HINWEIS: Für gezielte Inhibitoren wird eine Verdünnungsserie mit ≥8 Dosen im Bereich von 1 nM-10 μM empfohlen. - Drehen Sie die Organoidplatte im Uhrzeigersinn um 180° (Organoide jetzt bei 12 Uhr). Aspirieren Sie GM vorzugsweise vorsichtig mit einer Mehrkanalvorrichtung.
HINWEIS: Vermeiden Sie es, die Organoidkuppel zu berühren, während Sie den GV absaugen, da dies zum Verlust von Organoidbiomasse und Aufprallergebnissen führen kann. - Fügen Sie 100 μL Kontrolle (z. B. LGM-Medien + 0,1% DMSO) oder Arzneimittellösung pro Vertiefung hinzu.
HINWEIS: Bitte beachten Sie Abbildung 1C für den Behandlungsschema der Arzneimitteleskalation im 96-Well-Plate-Format. - Inkubieren Sie behandelte Organoide bei 37 °C im Zellkultur-Inkubator für 5 Tage.
4. Auslesung durch lumineszenzbasierten Überlebensassay
- Ernte- und Überlebensanzeige
- Führen Sie den Überlebensassay gemäß Referenz19 durch.
- Auftaureagenz (siehe Materialtabelle) über Nacht bei 4 °C. Gleichgewichtsreagenz in einem Wasserbad bei Raumtemperatur für 30 min vor Gebrauch und Mischen durch Umkehren.
- Fügen Sie jedem Vertiefungsloch ein gleiches Volumen des Reagenzes hinzu (100 μL pro Well). Gründlich mischen, indem Sie auf und ab pipettieren, wobei die Pipettenspitze an der Position der Organoidkuppel platziert wird. 5 min bei Raumtemperatur im Dunkeln inkubieren.
- Mit einer Mehrkanalpipette werden etwa 75 % (150 μL) des Lysats (Schritt 4.1.1.2) auf eine neue weiße, undurchsichtige 96-Well-Platte übertragen.
HINWEIS: Das Übertragen von 75% der Lysate auf eine neue Platte stellt sicher, dass beim späteren Auslesen keine Blasen vorhanden sind, ohne die Assay-Empfindlichkeit zu beeinträchtigen. - Inkubieren Sie für weitere 25 Minuten bei Raumtemperatur im Dunkeln.
- Erfassen Sie die Lumineszenz mit einem ELISA-Plattenleser (Integrationszeit 0,25-1 s/pro Well) (siehe Materialtabelle).
- Speichern Sie Daten in einem geeigneten Format, z. B. eine Datentabelle, die alle Rohlesevorgänge und die Aufzeichnung des Plattenlayouts und der verwendeten Medikamente enthält.
- Führen Sie den Überlebensassay gemäß Referenz19 durch.
- Datenanalyse mittels statistischer Analysesoftware (siehe Materialverzeichnis)
- Erstellen Sie eine neue XY-Tabelle und fügen Sie Daten im XY-Format ein: Zeilen (X) sind Negativkontrolle, gefolgt von eskalierenden Medikamentendosen, mit Dosen als log [Inhibitor] in Molarkonzentration. Spalten (Y) sind Auslesewerte, die Replikate enthalten, die zusammen mit Spalten gestapelt sind.
HINWEIS: Die Konzentration der Negativkontrolle sollte als Mindestwert angegeben werden (bei Angabe von 0 ist in der Log-Skala nicht möglich), z. B. log [Inhibitor], M = -10. - Normalisieren Sie Werte, indem Sie Analysieren > Normalisieren auswählen und die folgenden Parameter verwenden: Normalisieren Sie jede Unterspalte separat, Y = 0 als 0 %, "letzter Wert in jeder Unterspalte (oder erster, je nachdem, welcher Wert größer ist)" als 100 %, was zu Prozentsätzen führt, stellen Sie die Ergebnisse grafisch dar.
- Passen Sie die nichtlineare Regressionskurve an normalisierte Daten an, indem Sie > XY-Analysen analysieren > Nichtlineare Regression > Dosis-Wirkungs-Verhältnis - Hemmung > log (inhibitor) vs . Normalisierte Antwort – Variable Steigung.
- Berichtsergebnisse als Tabelle der IC50-Werte , die nach der nichtlinearen Regressionsanalyse ausgegeben wurden, und als Diagramm der Antwortkurve, einschließlich normalisierter Datenpunkte als Mittelwert +/- Standardabweichung und angepasster Regressionskurve.
- Erstellen Sie eine neue XY-Tabelle und fügen Sie Daten im XY-Format ein: Zeilen (X) sind Negativkontrolle, gefolgt von eskalierenden Medikamentendosen, mit Dosen als log [Inhibitor] in Molarkonzentration. Spalten (Y) sind Auslesewerte, die Replikate enthalten, die zusammen mit Spalten gestapelt sind.
Ergebnisse
Es wurden erhebliche Herausforderungen bei der Etablierung von NSCLC-Organoiden festgestellt7. Daher ist es spannend zu sehen, wie kürzlich Lungenkrebs-Organoide etabliert und für medikamentöse Behandlungsassays verwendet werden20,21,22. EGFR-Mutationen machen 11,3% der NSCLC-Fälle aus23. Die gezielte Behandlung mit EGFR-Inhibitoren stellt die Erstlinienbehandlungsoption bei EGFR-mutiertem NSCLC dar und hat das Gesamtüberleben und die Behandlungssicherheit bei Patienten verbessert24. Diese Arbeit bestimmte die Empfindlichkeit gegenüber dem von der FDA zugelassenen EGFR-Tyrosinkinase-Inhibitor Osimertinib24,25 in EGFR-mutierten NSCLC-Organoiden. EGFR-mutierte NSCLC-Organoide wurden aus chirurgischen Resektions- oder Tumorbiopsieproben von NSCLC-Patienten erzeugt und durch DNA-Sequenzierung bestätigt, dass sie die angegebene onkogene Mutation beherbergen. Wie oben beschrieben, wurden EGFR-mutierte NSCLC-Organoidmodelle mit eskalierenden Dosen von Osimertinib und PDO-Lebensfähigkeit behandelt, die fünf Tage nach Beginn der Behandlung durch lumineszenzbasierte Zellüberlebensanzeige bewertet wurden. Während EGFR-mutierte (EGFRdel19)-positive TH107-Organoide eine Empfindlichkeit gegenüber einer Osimertinib-Behandlung mit einer halbmaximalen inhibitorischen Konzentration (IC50) von 56 nM zeigten (Abbildung 2A), waren EGFR-mutierte (EGFRL858R)-positive TH116-Organoide resistent gegen eine Osimertinib-Behandlung mit einem IC50 von mehr als 1 μM (Abbildung 2B). Die Sensitivität von EGFRdel19-positivem TH107 NSCLC wurde von signifikanten transkriptionellen Veränderungen begleitet, einschließlich einer Verringerung der Expression von Zellzyklus-assoziierten Gensignaturen und einer Zunahme der Expression von Apoptose-assoziierten Gensignaturen (Ergänzende Abbildung 2A,B). Als Referenz werden Ansprechdaten für die empfindliche EGFRdel19-positive NSCLC-Zelllinie PC9 dargestellt (Abbildung 3A,B). Letzteres umfasst die Überlebensanalyse zu eskalierenden Dosen von Osimertinib durch einen 2D-Lumineszenz-basierten Überlebensassay (Abbildung 3A) und die Untersuchung der Signalunterdrückung auf der Ebene der EGFR-MAPK-Signalgebung durch Western Blot (Abbildung 3B). Insgesamt unterstreichen diese Daten die Genauigkeit des vorliegenden Protokolls zur Bestimmung des Arzneimittelansprechens und zur Unterscheidung zwischen sensitiven und resistenten NSCLC-PDO-Modellen. Weitere Analysen des EGFRL858R-positiven TH116-Organoids und verfügbarer klinischer Proben sind erforderlich, um mögliche resistenzassoziierte Veränderungen zu bestimmen.
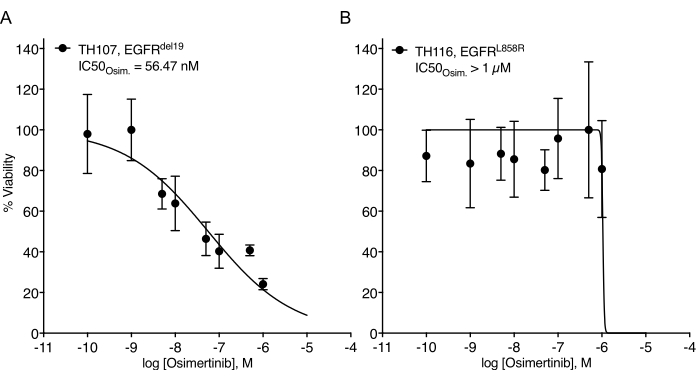
Abbildung 2: Behandlungs-Response-Kurve von EGFR-mutierten NSCLC-Organoidmodellen auf die Osimertinib-Eskalation. (A) Osimertinib-Reaktion im sensitiven EGFRdel19-positiven TH107-NSCLC-Organoidmodell. (B) Osimertinib-Antwort im resistenten EGFRL858R-positiven TH116 NSCLC-Organoidmodell. Datenpunkte werden als normalisierte Werte dargestellt, die die mittlere +/- Standardabweichung zeigen, wobei eine nichtlineare Regressionskurve durch die Daten angepasst wird. TH107, n = 6 technische Replikate pro Datenpunkt. TH116, n = 4 technische Replikate pro Datenpunkt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
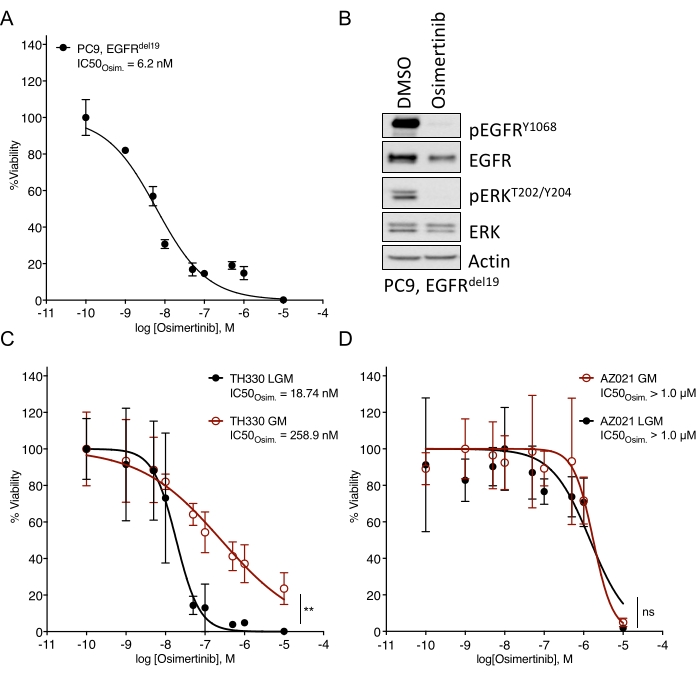
Abbildung 3: Vergleichsdaten für das Behandlungsansprechen auf Osimertinib in einer sensitiven EGFR-mutierten NSCLC-Zelllinie und Organoidmodellen, die in verschiedenen Medien kultiviert wurden. (A) Osimertinib-Ansprechen in der sensitiven EGFRdel19-positiven NSCLC-Zelllinie PC9, bestimmt durch Standard-2D-CTG-Assay. (B) Signalsuppression in den PC9-Zellen nach zweitägiger Behandlung mit Osimertinib (2 μM). (C) Osimertinib-Reaktion in der empfindlichen EGFRL858R-positiven TH330 NSCLC-Organoid-Modellkultur in LGM- und GM-Medien. (D) Osimertinib-Reaktion im resistenten NSCLC-Organoidmodell AZ021 in LGM- und GM-Medien. Die Bestätigung der onkogenen EGFRL858R-Mutation in AZ021 schlug fehl und kann für das Fehlen einer Osimertinib-Reaktion ursächlich sein. Für A und C-D werden Datenpunkte als normalisierte Werte dargestellt, die die mittlere +/- Standardabweichung zeigen, wobei eine nichtlineare Regressionskurve durch die Daten angepasst wird. PC9, n = 3 technische Replikate pro Datenpunkt. TH330, n = 5 technische Replikate pro Datenpunkt. AZ021, n = 6 technische Replikate pro Datenpunkt. Ein Wilcoxon-Rangtest wurde mit normalisierten Daten durchgeführt, um die statistische Signifikanz zu bestimmen. Für TH330 (C), LGM vs. GM, ** p = 0,0078. Für AZ021 (D), LGM vs. GM, ns p = 0,0742. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Abbildung 1: Repräsentative Zellanalysatorergebnisse für die Zählung und Viabilitätsbewertung von EGFR-mutierten Organoidmodellen. TH107 und TH107BC beziehen sich auf verschiedene Organoidmodelle und A und B auf biologische Replikate. Für jedes Modell und jede biologische Replik werden drei technische Replikate gezählt; alle zeigen ≥95% Lebensfähigkeit. Auf der rechten Seite ist ein repräsentatives Bild während der Zellzählung dargestellt, das eine robuste Lebensfähigkeit und Einzelzelldissoziation zeigt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Gen-Set-Enrichment-Analyse (GSEA) unter Verwendung von Bulk-RNA-Sequenzierungsdaten, die für EGFR-mutierte TH107-NSCLC-Organoide erhalten wurden, unter Vergleich der unbehandelten Kontrolle (DMSO) und der mit Osimertinib behandelten Zellen für 3 Tage (OSI_D3). (A-B) Bei gezielter Behandlung werden empfindliche Zellen dem Zellzyklus G1 zum Stillstand gebracht und die aktive Proliferation eingestellt. Da eine Expression von G2M-Zellzyklusgenen mit aktiver Proliferation assoziiert ist, wird eine nominale Anreicherung der Expression in der unbehandelten Kontrolle (DMSO) erwartet. Für Apoptose-verwandte Gene wird eine nominale Anreicherung in behandelten Zellen (OSI_D3) erwartet. Beide wurden im EGFR-mutierten NSCLC-Organoidmodell, das mit Osimertinib behandelt wurde, bestätigt: (A) GSEA für Hallmark G2M-Expressionssignatur (links) zeigt eine Anreicherung in DMSO-behandelten Zellen. Nominaler Anreicherungswert (NES): +1,708, FDR < 0,0001. (B) GSEA for Hallmark Apoptosis expression signature (rechts) zeigt eine Anreicherung in Osimertinib-behandelten Zellen. NES: -1.075, FDR: ns, 0.3275. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 3: Kombinatorische medikamentöse Behandlung im EGFR-mutierten TH330-Organoidmodell, das mit Osimertinib-Eskalation in Gegenwart eines zweiten additiven Inhibitors in einer festen Konzentration behandelt wurde. Resistenzassoziierte Veränderungen in EGFR-mutiertem NSCLC, d.h. SRC- und AXL-Aktivierung26,27,28, waren pharmakologisch zielgerichtet durch kombinatorische Behandlung mit SRC-Inhibitor Saracatinib (100 nM) oder AXL-Inhibitor R428 (500 nM), n = 6 technische Replikate pro Datenpunkt. Beide kombinatorischen Behandlungen führten zu einem erhöhten Ansprechen auf die Behandlung, mit Bedeutung für die Kombination von Osimertinib mit dem SRC-Inhibitor Saracatinib. Die statistische Signifikanz wurde durch den Wilcoxon-Rangtest bewertet: Osimertinib versus Osimertinib + Saracatinib, *p = 0,0195; Osimertinib gegen Osimertinib + R428, ns, p = 0,2500. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle 1: Änderung der Organoidgröße von der Aussaat (d0) zu 7 Tagen nach der Behandlung (d7). (A) Wachstumsentwicklung des EGFRdel19-positiven NSCLC-Organoids TH107. (B) Wachstumsentwicklung bei EGFRL858R-positivem NSCLC-Organoid TH330. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Dieses Manuskript entwickelt und beschreibt ein standardisiertes Protokoll zur Bewertung der Arzneimittelsensitivität in NSCLC-abgeleiteten 3D-PDO-Modellen. Zusätzlich zu Arzneimittelsensitivitätsstudien ist eine weitere Charakterisierung verfügbarer Organoidmodelle erforderlich, um die zugrunde liegenden Ursachen für Unterschiede in der Arzneimittelsensitivität zu bestimmen. Dies kann die genetische Profilerstellung von Organoiden und Patientenproben und andere Analysen umfassen, die für Organoide verfügbar sind, wie z. B. die immunhistochemische Färbung für Differenzierungsmarker und allgemeine zelluläre Signalbiomarker und Physiologie13,29.
Kritische Schritte im Protokoll
Das hierin beschriebene Protokoll bietet einen standardisierten Workflow, der bei sorgfältiger Befolgung genaue und reproduzierbare Analysen der Arzneimittelsensitivität ermöglicht. Besondere Vorsicht ist bei den folgenden Schritten geboten: TrypLE- und DNAse-I-Verdauung während der Erzeugung von Einzelzellsuspensionen, Aussaat von Einzelzellsuspensionen in BME2, Überwachung des Organoidwachstums bis zur Behandlung, Medienveränderungen sowie Unterbrechung und Lyse von eingebetteten BME2-Organoiden während des lumineszenzbasierten Zellüberlebens-Readouts. (1) Während eine zusätzliche DNAse-I-Verdauung nach der TrypLE-basierten Dissoziation von Organoiden für die Erweiterung von Organoidmodellen während der regelmäßigen Kulturpflege nicht wesentlich ist, sollte die DNAse-I-Verdauung bei der Aussaat für Arzneimitteleskalationsexperimente nicht ausgelassen werden, da sie eine bessere Trennung von Organoidclustern in Einzelzellsuspensionen und eine genaue Zellzählung gewährleistet. (2) Die Aussaat von Einzelzellsuspension in BME2 stellt angesichts der Erstarrung von BME2 bei Raumtemperatur einen kritischen Schritt dar. Daher müssen maximal 1-2 Reihen gleichzeitig ausgesät werden, und Proben sollten auf Eis gelegt werden, bevor zusätzliche Reihen ausgesät werden. Bemerkenswert ist, dass Zellen nach oben und unten pipettiert werden müssen, wenn die Aussaat fortgesetzt wird, um eine homogene Zellsuspension zu ermöglichen. (3) Das Organoidwachstum muss während der 7-tägigen Expansion von der Aussaat bis zur Behandlung sorgfältig überwacht werden. Ein Beispiel für die erwartete Entwicklung ist in Abbildung 1B und der ergänzenden Tabelle 1 dargestellt. Bemerkenswert ist, dass die Beurteilung von Änderungen der Organoidgröße durch Hellfeldmikroskopie und Bildanalyse, wie in Abbildung 1B dargestellt, eine genaue Bewertung der Unterschiede im Organoidwachstum und in den Verdopplungszeiten ermöglichen kann. Verdoppelungszeiten können sich auf das Ansprechen von Medikamenten auswirken, wie kürzlich in der Literatur diskutiert wurde30. Übersteigt die Organoid-Wachstumsrate das vorgestellte Beispiel deutlich, kann eine kürzere Expansionszeit bis zum Behandlungsbeginn und eine kürzere Behandlungsdauer in Betracht gezogen werden. (4) Darüber hinaus ist beim Medienwechsel besonders darauf zu achten, dass Organoide abgesaugt werden. Die Seeding-Position der eingebetteten BME2-Organoide in der 6-Uhr-Position ermöglicht eine sichere Ansaugung von Medien, wenn die Platten um 180° im Uhrzeigersinn gedreht und die Medien an der entgegengesetzten Position der Organoide abgesaugt werden. (5) Schließlich ist eine gründliche Lyse der in BME2 eingebetteten Organoide während der Überlebensanzeige unerlässlich, um genaue Ergebnisse aufzuzeichnen. Gemäß den Anweisungen des Herstellers sollten die Proben wiederholt auf und ab pipettiert werden, idealerweise mit ungefilterten Spitzen, um eine ordnungsgemäße Lyse zu gewährleisten. Die Inkubationszeiten sollten wie beschrieben eingehalten werden. Darüber hinaus ermöglicht die Übertragung von 75% des Lysats (anstelle des Gesamtvolumens) auf eine weiße, undurchsichtige 96-Well-Platte für die endgültige Anzeige mit einem ELISA-Plattenleser eine angemessene Bewertung, da dies das gleiche Volumen in jedem Bohrloch und das Fehlen von Luftblasen gewährleistet, die durch kräftiges Pipettieren eingeführt werden können.
Bemerkenswert ist, dass die Profilierung von Arzneimittelreaktionen in BME2-eingebetteten Organoidkulturen eine höhere Standardabweichung aufweisen kann als in regulären Zelllinienkulturen beobachtet (Abbildung 2, Abbildung 3A). Die höhere Standardabweichung basiert auf mehreren Faktoren, einschließlich einer erhöhten Wahrscheinlichkeit geringfügiger Schwankungen bei der Aussaat bei der Arbeit mit BME2 und Unterschieden in den einzelnen Organoid-Wachstumsraten zwischen Bohrlöchern während der anfänglichen 7-tägigen Wachstumsperiode. Daher sollten gleich oder mehr als vier technische Replikate pro Arzneimittelkonzentration ausgesät werden.
Am wichtigsten ist, dass das Vorhandensein von bösartigen Zellen, die die onkogene Treibermutation tragen, und die begrenzte Kontamination durch normale Atemwegsepithelzellen sorgfältig bewertet werden müssen. Herausforderungen bei der NSCLC-Etablierung können das Auswachsen normaler Atemwegsepithelzellen begünstigen7. Copy Number Profiling oder PCR- und Sequencing-basierte Ansätze zur Bestätigung des Vorhandenseins der onkogenen Treibermutationen sind die Methoden der Wahl, um die Qualität von NSCLC-Organoidkulturen sicherzustellen.
Modifikationen und Fehlerbehebung der Methode
Medien und entsprechende Wachstumsfaktoren, die zu grundlegenden Medienlösungen hinzugefügt werden, können die Arzneimittelreaktion auf gezielte Inhibitoren erheblich beeinflussen. Sie aktivieren Bypass-Rezeptoren und Signalwege, die die Arzneimittelreaktion beeinflussen und begrenzen (z. B. FGF, HGF, EGF)26. Während ein wachstumsfaktorreiches und maßgeschneidertes Medium optimal für die Erweiterung der Organoidkultur sein kann, sollten Arzneimitteleskalations- und Sensitivitätsbewertungen in einem Medien mit reduziertem Wachstumsfaktor durchgeführt werden, wie oben beschrieben. Dies basiert auf internen Erfahrungen beim Vergleich verschiedener Medienformulierungen und Arzneimittelreaktionsdaten (Abbildung 3C). Während Medienlösungen den Grad der Empfindlichkeit gegenüber bestimmten Arzneimittelbehandlungen beeinflussen und die IC50-Werte verschieben können, sind robuste Phänotypen der Empfindlichkeit oder Resistenz unabhängig von der Medienformulierung erkennbar (Abbildung 3C, D). Darüber hinaus wird eine allgemeine Konsistenz in der Medienformulierung und Profilierung der Arzneimittelreaktionen über Organoidkulturen hinweg empfohlen, und es müssen gleiche oder mehr als vier technische Replikate pro Konzentration ausgesät werden. Dies ist besonders wichtig, um Bereiche in Sensitivität vs. Resistenz für den Inhibitor von Interesse.
Einschränkungen der Methode
Das hier vorgestellte Protokoll beschreibt die Empfindlichkeit von NSCLC 3D-Krebsorganoidmodellen gegenüber gezielten Inhibitoren, wenn von Patienten stammende Krebszellen kultiviert werden. Für eine detaillierte Charakterisierung der Arzneimittelresistenz und -sensitivität sind zusätzliche Experimente erforderlich, einschließlich pharmakodynamischer Analysen zur Signalwegshemmung und Sequenzierungsanalyse auf das Vorhandensein des Treiberonkogens und sekundärer Mutationen. Darüber hinaus werden Bystander-Faktoren wie Mikroumweltreize, die aus Interaktionen abgeleitet werden, oder sezernierte Faktoren von Nicht-Krebs-Bystander-Zellen in der Tumormikroumgebung nicht berücksichtigt, und neue Protokolle werden benötigt, wenn Co-Kultur-Organoid-Modelle mit Immun- oder Stromazellen versucht werden. Jüngste Arbeiten haben die Verwendung von Organoidmodellen zur Rekapitulation von Tumor-Mikroumgebungsinteraktionen und Profilreaktionen auf Immun-Checkpoint-Inhibitoren, wie z.B. Anti-PD-L1-Behandlung13,31, hervorgehoben.
Die Bedeutung der Methode in Bezug auf bestehende/alternative Methoden
3D-Krebsorganoidmodelle rekapitulieren die genetische Vielfalt und die Determinanten des Behandlungsansprechens im ursprünglichen Tumor4,5,6. Insbesondere kann räumliche und zeitliche Heterogenität die Tumorevolution fördern, und parallele Entstehung und die sequentielle Entwicklung von Tumorsubklonen können auftreten32,33. Die intratumorale Heterogenität ist signifikant für die Auswahl widerstandsfähigerer Tumorzellen unter therapeutischem Druck9,34,35. Das hier bereitgestellte Protokoll ermöglicht eine schnelle Beurteilung der Empfindlichkeit gegenüber der Behandlung mit gezielten Inhibitoren in patientennahen Proben. Daher haben Organoidmodelle Vorteile gegenüber konventionelleren homogenen Zelllinienmodellen, denen die genetische Vielfalt fehlt, oder Langzeitstudien mit Zelllinien oder von Patienten abgeleiteten Xenotransplantaten. Darüber hinaus ermöglicht das vorliegende Protokoll die Skalierung auf mehrere Behandlungsarme und Kombinationsbehandlungsansätze mit wenigen Einschränkungen in Bezug auf Kosten und analytische Kapazität. Daher ermöglicht die Zugabe eines zweiten Medikaments von Interesse bei einer festen Dosis bei gleichzeitiger Eskalation des primär zielgerichteten Inhibitors und der Vergleich mit der Eskalation des primär zielgerichteten Inhibitors allein, die potenziellen kombinatorischen Effekte effizient zu bewerten und mit minimaler zusätzlicher Biomasse erforderlich (Ergänzende Abbildung 3). Im Vergleich zu bildgebenden Bewertungen, die zur Überwachung der Organoidentwicklung und des Arzneimittelansprechens verwendet werden, weist der hier beschriebene lumineszenzbasierte Zellüberlebensassay eine ähnliche Empfindlichkeit mit minimaler Ausrüstung und minimalem Schulungsaufwand auf.
Bedeutung und Anwendungsmöglichkeiten der Methode in spezifischen Forschungsbereichen
Die Entwicklung einer standardisierten Pipeline, die die Etablierung von Krebsorganoidmodellen aus Patientenproben und die anschließende Erstellung von Arzneimittelsensitivitätsprofilen ermöglicht, birgt ein erhebliches klinisches Anwendbarkeitspotenzial. Die pharmakologische Ex-vivo-Profilerstellung hat bei der Erkennung von Schwachstellen und resistentenassoziierten Merkmalen in Tumoren, die mit dem Ansprechen auf die Behandlung bei Patienten korrelieren, Anerkennung gefunden36,37. Bezeichnenderweise kann die Ex-vivo-Profilierung von Arzneimittelsensitivitäten bei der Behandlungsauswahl in der Klinik und bei der Gestaltung rationaler Kombinationsbehandlungen helfen, die sich mit Resistenzmechanismen befassen. Insgesamt könnte dieser Ansatz dazu beitragen, verbesserte personalisierte Strategien für die molekulare Therapie oder kombinatorische Behandlungsschemata zu ermöglichen. Letzteres kann dazu beitragen, Arzneimitteltoleranz- und Resistenzmechanismen frühzeitig ins Visier zu nehmen und die klinische Reaktion zu vertiefen, um die Patientenergebnisse in Zukunft zu verbessern.
Offenlegungen
T.G.B. ist Berater für Array Biopharma, Revolution Medicines, Novartis, AstraZeneca, Takeda, Springworks, Jazz Pharmaceuticals, Relay Therapeutics, Rain Therapeutics, Engine Biosciences und erhält Forschungsgelder von Novartis, Strategia, Kinnate und Revolution Medicines.
Danksagungen
Wir danken den Labors von Jeroen P Roose (UCSF) und Calvin J Kuo (Stanford) für ihren Beitrag zur Organoidkultur und Protokollentwicklung. Wir danken außerdem Oghenekevwe M. Gbenedio (Roose lab, UCSF) für Protokolle und Input zur Probeneinrichtung. Dieses Forschungsprojekt wurde mit Unterstützung des NIH [U54CA224081] durchgeführt. F. Haderk wurde durch das Mildred Scheel Postdoc-Stipendium der Deutschen Krebshilfe gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | |||
| 15 mL centrifuge tubes | |||
| 500 mL Vacuum Filter/Storage Bottle System, 0.2 µm Pore 33.2 cm2 Nylon Membrane | Corning | 430773 | for both media |
| 96-Well, Cell Culture-Treated, Flat Clear Bottom Black Microplate | Corning | 3904 | |
| 96-Well, Cell Culture-Treated, Solid White Flat-Bottom Microplate | Corning | 3917 | |
| A-8301 | Tocris Bioscience | 293910 | for both media |
| Advanced DMEM/F-12 | Gibco | 12634010 | for LGM |
| B27 | Life Technologies | 12587010 | for both media |
| BioRender 2021 | https://biorender.com/ | online scientific illustration software | |
| BME2 (Cultrex RGF Basement Membrane Extract, Type 2) | R&D Systems | 353301002 | |
| Cell culture incubator (37 °C, 5% CO2) | |||
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9682 | 3D-CTG readout reagent |
| Centrifuge holding 15 mL centrifuge tubes | |||
| Deoxyribonuclease I (DNAse I) | ThermoFisher Scientific | 18047019 | |
| Dulbecco's Phosphate-Buffered Salt Solution | Corning | MT21031CV | |
| DMEM/F-12, GlutaMAX supplement | Gibco | 10565018 | for GM |
| GlutaMax | Gibco | 35050061 | for LGM |
| GraphPad Prism software (version 9.2.0) | GraphPad | statistical analysis software | |
| HEPES | Gibco | 15630080 | for both media |
| hFGF-10 | PeproTech | 100-26-100ug | for GM |
| hFGF-7 | PeproTech | 100-19-50ug | for GM |
| hNoggin | PeproTech | 120-10C-100ug | for both media |
| hRspondin | PeproTech | 120-38-100ug | for GM |
| Low retention pipette tips, 20 µL (P20) | ThermoFisher Scientific | 2149P-05-HR | |
| Low retention pipette tips, 200 µL (P200) | ThermoFisher Scientific | 2069-05-HR | |
| Regular length pipette tips, 1000 µL (P1000) | ThermoFisher Scientific | 2179-HR | |
| Multichannel pipette | |||
| N-Acetylcysteine | Fisher Scientific | 50-424-777 | for both media |
| Nicotinamide | Sigma Aldrich | N0636-100G | for both media |
| Osimertinib | Selleck Checm | S7297 | |
| Penicillin-Streptomycin-Glutamine | Gibco | 10378016 | for LGM |
| Penicillin/Streptomycin | Cytiva HyClone | SV30010 | for GM |
| Pipettes (different sizes) | |||
| Plate reader | Molecular Devices | SpectraMax M5 | equipment, alternative readers may be used |
| Primocin | Invivogen | ant-pm-1 | for GM |
| SB202190 | Selleck Chem | S1077 | for GM |
| TrypLE Express Enzyme | Gibco | 12604021 | |
| Vacuum pump and tubing | |||
| Vi-CELL XR Cell Analyzer | Beckman Coulter | Vi-CELL XR | cell analyzer / counter |
Referenzen
- de Bono, J. S., Ashworth, A. Translating cancer research into targeted therapeutics. Nature. 467 (7315), 543-549 (2010).
- Dagogo-Jack, I., Shaw, A. T. Tumour heterogeneity and resistance to cancer therapies. Nature Reviews Clinical Oncology. 15 (2), 81-94 (2018).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Dijkstra, K. K., et al. Challenges in establishing pure lung cancer organoids limit their utility for personalized medicine. Cell Reports. 31 (5), 107588(2020).
- Lo, Y. -H., Karlsson, K., Kuo, C. J. Applications of organoids for cancer biology and precision medicine. Nature Cancer. 1 (8), 761-773 (2020).
- Bivona, T. G., Doebele, R. C. A framework for understanding and targeting residual disease in oncogene-driven solid cancers. Nature Medicine. 22 (5), 472-478 (2016).
- Jabs, J., et al. Screening drug effects in patient-derived cancer cells links organoid responses to genome alterations. Molecular Systems Biology. 13 (11), 955(2017).
- Tashiro, T., et al. In vivo and ex vivo cetuximab sensitivity assay using three-dimensional primary culture system to stratify KRAS mutant colorectal cancer. PLoS One. 12 (3), 0174151(2017).
- van de Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Neal, J. T., et al. Organoid Modeling of the Tumor Immune Microenvironment. Cell. 175 (7), 1972-1988 (2018).
- Hysenaj, L., et al. SARS-CoV-2 infection studies in lung organoids identify TSPAN8 as novel mediator. bioRxiv. , (2021).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300(2019).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocol in Immunology. , Appendix 3, Appendix 3B (2001).
- Pushparaj, P. N. Revisiting the micropipetting techniques in biomedical sciences: A fundamental prerequisite in good laboratory practice. Bioinformation. 16 (1), 8-12 (2020).
- Promega Corporation. CellTiter-Glo 3D Cell Viability Assay. Promega Corporation. , (2021).
- Kim, M., et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nature Communication. 10 (1), 3991(2019).
- Hu, Y., et al. Lung cancer organoids analyzed on microwell arrays predict drug responses of patients within a week. Nature Communication. 12 (1), 2581(2021).
- Shi, R., et al. Organoid cultures as preclinical models of non-small cell lung cancer. Clinical Cancer Research. 26 (5), 1162-1174 (2020).
- Collisson, E. A., et al. Comprehensive molecular profiling of lung adenocarcinoma. Nature. 511 (7511), 543-550 (2014).
- Ramalingam, S. S., et al. Overall Survival with Osimertinib in untreated, EGFR-mutated advanced NSCLC. New England Journal of Medicine. 382 (1), 41-50 (2019).
- Soria, J. -C., et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. New England Journal of Medicine. 378 (2), 113-125 (2017).
- Rotow, J., Bivona, T. G. Understanding and targeting resistance mechanisms in NSCLC. Nature Reviews Cancer. 17 (11), 637-658 (2017).
- Zhang, Z., et al. Activation of the AXL kinase causes resistance to EGFR-targeted therapy in lung cancer. Nature Genetics. 44 (8), 852-860 (2012).
- Kanda, R., et al. Erlotinib resistance in lung cancer cells mediated by integrin β1/Src/Akt-driven bypass signaling. Cancer Research. 73 (20), 6243-6253 (2013).
- Bruun, J., et al. Patient-derived organoids from multiple colorectal cancer liver metastases reveal moderate intra-patient pharmacotranscriptomic heterogeneity. Clinical Cancer Research. 26 (15), 4107-4119 (2020).
- Hafner, M., Niepel, M., Chung, M., Sorger, P. K. Growth rate inhibition metrics correct for confounders in measuring sensitivity to cancer drugs. Nature methods. 13 (6), 521-527 (2016).
- Yuki, K., Cheng, N., Nakano, M., Kuo, C. J. Organoid models of tumor immunology. Trends in Immunology. 41 (8), 652-664 (2020).
- Gerlinger, M., et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. New England Journal of Medicine. 366 (10), 883-892 (2012).
- McGranahan, N., Swanton, C. Biological and therapeutic impact of intratumor heterogeneity in cancer evolution. Cancer Cell. 27 (1), 15-26 (2015).
- Rambow, F., et al. Toward minimal residual disease-directed therapy in melanoma. Cell. 174 (4), 843-855 (2018).
- Marine, J. C., Dawson, S. J., Dawson, M. A. Non-genetic mechanisms of therapeutic resistance in cancer. Nature Reviews Cancer. 20 (12), 743-756 (2020).
- Frismantas, V., et al. Ex vivo drug response profiling detects recurrent sensitivity patterns in drug-resistant acute lymphoblastic leukemia. Blood. 129 (11), 26-37 (2017).
- Drusbosky, L. M., et al. Predicting response to BET inhibitors using computational modeling: A BEAT AML project study. Leukemia Research. 77, 42-50 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten