Method Article
EGFR-Mutant NSCLC Hasta Kaynaklı Organoidlerde Hedefe Yönelik Tedavilere Duyarlılığın Profillenmesi
Bu Makalede
Özet
Bu protokol, NSCLC hasta kaynaklı organoid modellerde hedeflenen sinyal inhibitörlerine karşı ilaç duyarlılıklarının standartlaştırılmış bir değerlendirmesini açıklamaktadır.
Özet
Klinik hasta örneklerinden türetilen yeni 3D kanser organoid kültürleri, kanserde intratümör heterojenitesini ve hedeflenen inhibitörlere tedavi yanıtını değerlendirmek için önemli bir model sistemi temsil etmektedir. Gastrointestinal ve pankreas kanserlerinde öncü çalışmalar, hasta kaynaklı organoidlerin (PDO'lar) hastaya yakın bir kültür sistemi olarak vaat edildiğini ve artan sayıda modelin ortaya çıktığını vurgulamıştır. Benzer şekilde, diğer kanser türlerindeki çalışmalar organoid modeller oluşturmaya ve kültür protokollerini optimize etmeye odaklanmıştır. Özellikle, 3D kanser organoid modelleri, orijinal tümör örneklerinin genetik karmaşıklığını korur ve böylece tümör kaynaklı dizileme verilerini, deneysel bir ortamda genetik olarak bilgilendirilmiş hedefli tedavilerle tedaviye dönüştürür. Ayrıca, PDO'lar gelecekte tümörlerin dirençle ilişkili adaptasyonunun üstesinden gelmek için rasyonel kombinasyon tedavilerinin değerlendirilmesini teşvik edebilir. İkincisi, küçük hücreli olmayan akciğer kanserinde (NSCLC) yoğun araştırma çabalarına odaklanmaktadır, çünkü direnç gelişimi sonuçta hedeflenen inhibitörlerin tedavi başarısını sınırlamaktadır. NSCLC PDO'ları kullanılarak terapötik olarak hedeflenebilir mekanizmaların erken bir değerlendirmesi, rasyonel kombinasyon tedavilerini bilgilendirmeye yardımcı olabilir. Bu yazıda, NSCLC türevi 3D PDO'larda hedeflenen inhibitörlere karşı ilaç duyarlılıklarının hücre kültürü plakasına dayalı değerlendirilmesi için, kombinasyonel tedavilere ve diğer tedavi modalitelerine potansiyel adaptasyon ile standartlaştırılmış bir protokol açıklanmaktadır.
Giriş
Onkojenik faktörlere karşı kişiselleştirilmiş tedaviler kanser tedavisinde devrim yaratmış, hastanın sağkalımını iyileştirmiş ve tedavi aracılı yan etkileri azaltmıştır1. Moleküler tanılama ve dizileme teknolojilerindeki son gelişmeler, insan tümörlerinin karmaşıklığını, mekansal ve zamansal heterojenliğin tedavi yanıtını etkilediğini vurgulamıştır2. Hücre kültürü modellerindeki bu subklonal farklılıkları özetlemek, uzun zamandır aksi takdirde tekdüze hücre hatlarındaki seçilmiş değişiklikleri araştırmakla sınırlı kalmıştır. Tümör biyopsilerinden veya cerrahi tümör rezeksiyonlarından üretilen yeni geliştirilen 3D PDO modelleri, hasta kaynaklı tümör dokusunda hücresel karmaşıklığın ve sinyal çapraz konuşmasının daha iyi temsil edilmesini sağlar3. Bu nedenle, gastrointestinal ve pankreas kanserinden türetilen tümör organoidleri başarıyla üretilmiş ve genetik çeşitliliği ve tedavi yanıtının belirleyicilerini özetlemektedir4,5,6. Küçük hücreli dışı akciğer kanserinde (KHDAK), organoid gelişim ve kuruluş zorlukları kabul edilmekte ve gelecekte KHDAK PDO'larının daha geniş ve sistematik kullanımını sağlamak için kültür tekniklerinin ve seçici medya faktörlerinin optimizasyonuna ihtiyaç duyulmaktadır7,8.
İlk ilaç tedavisine dayanan rezidüel tümör hücrelerini hedef alan kombinatoryal tedavilerin geliştirilmesi, direnç gelişimini inhibe etmek ve nihayetinde hastanın sağkalımını iyileştirmek için esastır9. Organoid kültürlerin mimari karmaşıklığı göz önüne alındığında, klasik ilaç yanıt parametrelerinin, ilaç hassasiyetlerinin doğru ve tekrarlanabilir bir şekilde test edilmesini sağlamak için optimize edilmesi gerekir. Görüntüleme tabanlı okumalar10,11 ve hücresel ATP bolluğunu ölçen klasik hücre canlılığı testleri6,12, diğer tekniklerin yanı sıra, PDO kültürlerinde ilaç yanıtlarının profilini çıkarmak için mevcuttur. Burada, NSCLC PDO modellerinde bilinen klinik sürücülere karşı hedefe yönelik tedaviye yönelik ilaç duyarlılıklarını değerlendirmek için standartlaştırılmış bir protokol geliştiriyor ve açıklıyoruz.
Protokol
İnsan deneklerin araştırılması için bilgilendirilmiş onam alınmış ve doku toplama UCSF İç İnceleme Kurulu onaylı protokoller (IRB, protokol no.: #13-12492 veya CC#17-23309) kapsamında gerçekleştirilmiştir. Tanımlanmamış klinik örneklerden organoid kültürlerin oluşturulması, daha önce yayınlanmış yöntemlere göre araştırma ortaklarıyla işbirliği içinde gerçekleştirilmiştir13,14,15,16. Organoid kültürler, üçüncü veya daha sonraki pasajlarda bakım ve ilaç yükseltme deneyleri için alındı. Aşağıdaki protokollerin tümü memeli doku kültürü laboratuvar ortamında aseptik koşullar altında gerçekleştirilmiştir.
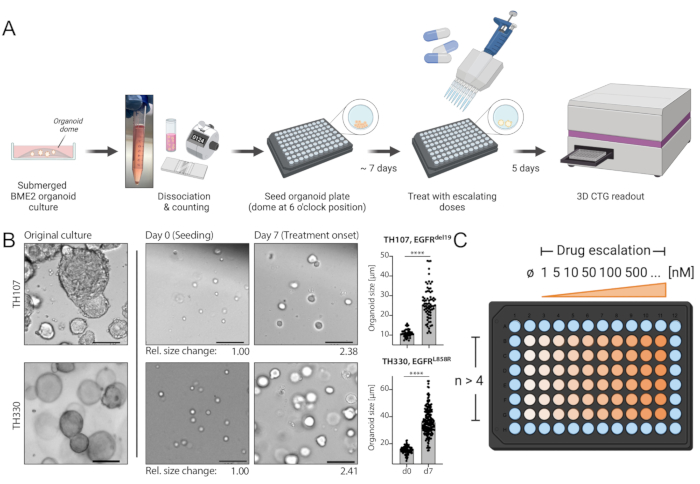
Şekil 1: İş akışının protokol şeması ve teknikteki kritik adımlar. (A) Organoidlerin 96 kuyucuklu formatta tohumlanması, tohumlamadan 7 gün sonra ilaç tırmanışı ile tedavi ve ELISA plaka okuyucu kullanılarak tedaviden 5 gün sonra lüminesans bazlı hücre sağkalım okuması dahil olmak üzere deneysel iş akışı. (B) EGFRdel19-pozitif TH107 ve EGFRL858R-pozitif TH330 NSCLC organoid kültürlerinin örnek görüntüsü. Orijinal kültürler, tohumlama sırasındaki hücreler (0. gün) ve tedavideki organoidler tohumlamadan 7 gün sonra (7. gün) başlar. Ölçek çubuğu = 100 μm. İlk 7 günlük kültür periyodu boyunca organoid çaptaki değişiklikler ölçülür ve organoid boyutunda >2 kat artış olduğunu gösterir. 7. gündeki boyutlardaki nispi kıvrım değişiklikleri, 0. gündeki ortalama boyuta kıyasla, temsili görüntülerin altında sunulmaktadır. TH107 için, 7 gün boyunca 2.38'lik bir katlama değişimi gözlenir ve bu da 5.88 günlük (141.12 saat) iki katına çıkma süresini gösterir. TH330 için, 7 gün boyunca 2.41'lik bir katlama değişimi gözlenir ve bu da 5.81 günlük (139.42 saat) iki katına çıkma süresini gösterir. Organoid boyuttaki değişikliklerin nicelleştirilmesi ve istatistiksel değerlendirme sunulmaktadır (sağda). İstatistiksel anlamlılık, eşlenmemiş t-testi, p < 0.0001 ile hesaplanır. (C) Organoid 96 delikli plaka formatında ilaç tırmanışı için tedavi düzeni. Negatif kontrol de dahil olmak üzere teknik kopyaların ve örnek dozların sayısı belirtilmiştir. Şemalar, web tabanlı bir illüstrasyon aracı olan BioRender ile oluşturulur. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
1. Deneysel hazırlıklar
- Daha önce bildirildiği gibi büyüme ortamını (GM) hazırlayın15: Dulbecco'nun Modifiye Kartal'ın Orta / Ham'ın L-alanil-L-glutamin ile besin karışımı F12 (DMEM / F-12), 100 U / mL penisilin / streptomisin, 10 mM HEPES, 25 nM hRspondin, 1x B27, 5 mM Nikotinamid, 1.25 mM N-Asetilsistein, 500 nM A-8301, 500 nM SB202190, 50 μg / mL Primocin, 100 ng / mL hNoggin, 100 ng / mL hFGF-10 ile desteklenmiştir. 25 ng/mL hFGF-7 (bkz.
NOT: Köpüklenmeyi önlemek için hafifçe karıştırın ve 0,22 μm filtreleme sisteminden süzün. Kullanmadan önce 1 saat içinde 37 °C'ye kadar ılık ortam. - Epidermal büyüme faktörü (EGF) eklenmeden daha önce bildirildiği gibi düşük büyüme faktörü medyası (LGM) hazırlayın16 : Gelişmiş Dulbecco'nun Modifiye Kartal Orta / Ham'ın besin karışımı F12 (DMEM / F-12), 1 mM HEPES, 1x L-alanil-L-glutamin, 1x Penisilin-Streptomisin-Glutamin, 10 mM Nikotinamid, 1 mM N-Asetilsistein, 1x B27, 500 nM A-8301, 100 ng / mL hNoggin ile desteklenir.
NOT: Köpüklenmeyi önlemek için hafifçe karıştırın ve 0,22 μm'lik bir filtreden süzün. Kullanmadan önce 1 saat içinde 37 °C'ye kadar ılık ortam. - BME2'yi (İndirgenmiş Büyüme Faktörü Bodrum Membran Ekstresi, Tip 2, Malzeme Tablosuna bakınız) buz üzerinde, 4 ° C'de, gece boyunca çözün.
2. Tek hücreli süspansiyonun oluşturulması ve hücrelerin tohumlanması
- Aşağıdaki adımlarda açıklandığı gibi batık BME2 organoid kültürünü ayırın (2.1.1-2.1.6).
- Medyayı kültür plakalarından dikkatlice aspire edin. Batık BME2 organoid kültürüne dokunmaktan kaçının.
NOT: Medya Aspirasyonu, araştırmacının tercih ettiği şekilde, örneğin temel bir sıvı aspirasyon sistemi ile veya bir pipet kullanılarak yapılabilir. BME2 gömülü organoidlere dokunmaktan kaçının, çünkü bu organoid biyokütle kaybına neden olabilir. - Batık BME2 organoid kültürünü uygun bir rekombinant enzimle tripsinize edin (bakınız Malzeme Tablosu). 6 delikli plaka formatında, kuyu başına 2 mL ekleyin. BME2'yi tekrar tekrar yukarı ve aşağı pipetleyerek, mekanik olarak kırın. Plakaları hücre kültürü inkübatöründe 37 °C'de 5 dakika boyunca inkübe edin.
- Süspansiyonu 15 mL'lik bir santrifüj tüpüne aktarın ve oda sıcaklığında 5 dakika boyunca 600 x g'da santrifüj yapın.
- Rekombinant enzimi organoid pelete dokunmadan dikkatlice aspire edin.
NOT: Artık BME2 mevcut olabilir. Gerekirse enzim sindirimini tekrarlayın. - GM'deki organoid peleti yeniden askıya alın (adım 1.1). DNase I 1x 100 U/mL ekleyin ve oda sıcaklığında 5 dakika kuluçkaya yatırın (bkz.
- Oda sıcaklığında 3 dakika boyunca 600 x g'de santrifüj. Organoid pelet üzerinde durmadan ortamdan dikkatlice pipet alın ve atın. Taze GM'de yeniden askıya alın.
- Medyayı kültür plakalarından dikkatlice aspire edin. Batık BME2 organoid kültürüne dokunmaktan kaçının.
- Organoid tek hücreli süspansiyonun tohumlanması
- Yeni siyah, şeffaf tabanlı 96 delikli plakayı hücre kültürü inkübatöründe 37 °C'de 10 dakika önceden ısıtın.
NOT: Şeffaf alt plakaların kullanılması, organoid büyümesini ve ilaç yanıtını izlemek için gereklidir. - Saymak için, PBS'deki hücre süspansiyonunun 1:5 seyreltilmesini hazırlayın (toplam hacim: 500 μL) ve bir hücre analizörü kullanarak hücre süspansiyonunu sayın (bkz.
NOT: Son hücre konsantrasyonunu almak için seyreltme faktörü (x 5) ile çarptığınızdan emin olun. Hemositometre gibi alternatif sayma yöntemleri kullanılabilir. Hücre canlılığı, bir canlılık boyama testi kullanılarak izlenmelidir (örneğin, Trypan Blue17 ile). Bir hücre analizörü kullanılarak canlılık otomatik olarak değerlendirilir. Hücre analizörü tarafından değerlendirilen organoid tek hücreli süspansiyonların canlılığı %≥95 olmalıdır (Ek Şekil 1). - Deney için tohum atmak için gereken hücre süspansiyonunun hacmini hesaplayın.
NOT: Tohumlama konsantrasyonu 1500 hücre/μL BME2'dir ve kuyu başına 5 μL BME2 gereklidir (Toplam sayı: 7500 hücre/kuyu). 96 delikli bir plaka için 6 x 10E5 hücre gereklidir. Bu, organoid kubbelerle (4.5 x 10E5) 60 kuyunun tohumlanmasını ve deneysel fazlalığı (toplam 80 kuyu için hesaplama) içerir. - Deneye birden fazla 96 delikli plaka dahil edilirse, tohumlanması planlanan her 96 kuyucuklu plaka başına 1,5 mL'lik bir mikrosantrifüj tüpünde bir hücre süspansiyonu aliquot hazırlayın.
NOT: BME2'nin işlenmesinden kaynaklanan artan deneysel önyargıyı hesaba katmak için tohumlanmış 96 kuyucuklu plaka başına deneysel fazlalık ve ayrı alikotlara ihtiyaç vardır. - Aliquot hücreleri, tek hücreli süspansiyondan hesaplandığı gibi (adım 2.2.3) dikkatli bir şekilde yeniden süspansiyondan sonra yukarı ve aşağı pipetleme yaparak. Oda sıcaklığında 5 dakika boyunca 600 x g'da pelet hücreleri. P200 pipet kullanarak hücre peletine dokunmadan ortamları dikkatlice çıkarın. Hücre peletini kısa bir süre (~ 1 dakika) buz üzerine yerleştirin ve hücre peletini BME2'de yeniden askıya alın.
NOT: Artık ortam BME2 yapısını ve sertliğini tehlikeye atabilir. Pipetle tüm ortamları dikkatlice kapatın. Hücre peletini alıştırmak için hücreleri kısa sürede buzun üzerine yerleştirin ve hücrelerin kümelenmeden BME2'de yeniden askıya alınmasına izin verin. BME2'yi sıvı halde kalması için sürekli buz üzerinde tutun. 96 delikli bir plaka için, hücre peletinin yeniden süspansiyonu için 400 μL BME2 gereklidir. Hücre peletlerini dikkatlice askıya alın, kabarcıkların sokulmasını önleyin. - Önceden ısıtılmış siyah, şeffaf tabanlı 96 kuyucuklu plakanızı kendinize doğru eğin. Kuyu başına 5 μL hücre süspansiyonu kullanan plaka hücreleri ve her bir kuyucuğun saat 6 pozisyonunda hücre kubbelerini tohumlama (Şekil 1A). Hücre kubbelerini kalan iç kuyucuklara tohumlayın (sütun 2-10 ve 96 kuyucuklu bir plakanın B-G sıraları).
NOT: BME2 ile çalışırken ters pipetleme18 önerilir. - 96 delikli plakayı hareket ettirmeyin ve taze tohumlanmış hücre kubbelerini hücre kültürü laminer akış başlığında oda sıcaklığında 5 dakika boyunca inkübe edin. Daha sonra plakayı hücre kültürü inkübatörüne taşıyın ve 37 ° C'de 10 dakika boyunca inkübe edin.
- Organoidler içeren tüm kuyucuklara kuyucuk başına 100 μL GM'yi dikkatlice ekleyin (sütun 2-10 ve 96 kuyucuklu bir plakanın B-G sıraları). Plakanın kenarındaki dış kuyucuklara 100 μL PBS ekleyin.
- Kültür BME2, GM ortamına hücre kültürü inkübatöründe toplam 7 gün boyunca 37 ° C'de gömülü organoidlerdir. Organoidlerin büyümesini ışık mikroskobu altında düzenli olarak kontrol edin.
NOT: Tohumlamadan tedavi gününe kadar beklenen büyüme ilerlemesinin bir örneği için lütfen Şekil 1B ve Ek Tablo 1'e bakınız. - 3-4 günlük kültürden sonra ortamı bir kez değiştirin: plakayı saat yönünde 180° döndürün (organoidler şimdi saat 12 pozisyonunda), varsa çok kanallı bir aparat kullanarak GM'yi ters konumdan organoid kubbeye dikkatlice aspire edin ve ardından taze GM ekleyin.
- Yeni siyah, şeffaf tabanlı 96 delikli plakayı hücre kültürü inkübatöründe 37 °C'de 10 dakika önceden ısıtın.
3. İlaç tedavisi
- EGFR-mutant NSCLC organoidlerini tedavi etmek için tercih edilen ilaç için, örneğin osimertinib için LGM'de seri bir ilaç seyreltmesi hazırlayın. Negatif bir kontrol ekleyin (LGM medya + %0,1 DMSO). Tohumlanan kuyu sayısına ve deneysel fazlalığa göre tüm dozlarda yeterli ilaç alikotları hazırlayın.
NOT: Hedeflenen inhibitörler için ≥8 dozlarını içeren ve 1 nM-10 μM arasında değişen bir seyreltme serisi önerilir. - Organoid plakayı saat yönünde 180° döndürün (organoidler artık saat 12 konumunda). GM'yi tercihen çok kanallı bir aparat kullanarak dikkatlice aspire edin.
NOT: GM'yi aspire ederken organoid kubbeye dokunmaktan kaçının, çünkü bu organoid biyokütle kaybına ve darbe sonuçlarına neden olabilir. - Kuyu başına 100 μL kontrol (örneğin, LGM ortamı +% 0,1 DMSO) veya ilaç çözeltisi ekleyin.
NOT: 96 delikli plaka formatında ilaç eskalasyon tedavisi şeması için lütfen Şekil 1C'ye bakınız. - Tedavi edilen organoidleri hücre kültürü inkübatöründe 5 gün boyunca 37 ° C'de inkübe edin.
4. Lüminesans temelli hayatta kalma testi ile okuma
- Hasat ve hayatta kalma okuması
- Hayatta kalma testini Referans19'a göre yapın.
- Çözülme reaktifi (bakınız Malzeme Tablosu) gece boyunca 4 °C'de. Reaktifi oda sıcaklığında bir su banyosunda kullanmadan önce 30 dakika boyunca dengeleyin ve ters çevirerek karıştırın.
- Her bir oyuğa eşit miktarda reaktif ekleyin (kuyu başına 100 μL). Pipet ucu organoid kubbe konumuna yerleştirilecek şekilde yukarı ve aşağı pipetle çekerek iyice karıştırın. Karanlıkta oda sıcaklığında 5 dakika kuluçkaya yatırın.
- Çok kanallı pipet kullanarak lizatın yaklaşık %75'ini (150 μL) (adım 4.1.1.2) yeni beyaz, opak tabanlı 96 delikli bir plakaya aktarın.
NOT: Lisatların% 75'inin yeni bir plakaya aktarılması, tahlil hassasiyetini etkilemeden sonraki okumalarda kabarcıkların olmamasını sağlar. - Karanlıkta oda sıcaklığında 25 dakika daha inkübe edin.
- Bir ELISA plaka okuyucu kullanarak ışıltıyı kaydedin (kuyu başına entegrasyon süresi 0,25-1 s) (bkz.
- Verileri uygun bir formatta, örneğin tüm ham okumaları ve plaka düzeninin ve kullanılan ilaçların kaydını içeren bir veri tablosu gibi kaydedin.
- Hayatta kalma testini Referans19'a göre yapın.
- İstatistiksel analiz yazılımı kullanarak veri analizi (bakınız Malzeme Tablosu)
- Yeni bir XY tablosu oluşturun ve verileri XY formatında ekleyin: Satırlar (X) negatif kontroldür ve ardından Molar konsantrasyonunda log [İnhibitör] olarak dozlarla artan ilaç dozlarıdır. Sütunlar (Y), sütunlarla birlikte yığılmış çoğaltmaları içeren okuma değerleridir.
NOT: Negatif kontrolün konsantrasyonu minimum bir değer olarak belirtilmelidir (log ölçeğinde 0 mümkün değildir), örneğin, log [İnhibitör], M = -10. - Analiz > Normalleştir'i seçerek ve aşağıdaki parametreleri kullanarak değerleri normalleştirin: her alt sütunu ayrı ayrı normalleştirin, Y = 0 %0 olarak, "her alt sütundaki son değer (veya ilk, hangisi daha büyükse)" %100 olarak, yüzdelerle sonuçlanır, sonuçların grafiğini çizin.
- Doğrusal olmayan regresyon eğrisini normalleştirilmiş verilere Analiz > XY analizlerini > Doz yanıtı - İnhibisyon > günlüğü (inhibitör) ve normalleştirilmiş yanıt - Değişken eğimi seçerek normalleştirilmiş verilere > regresyon eğrisini sığdırın.
- Sonuçları, doğrusal olmayan regresyon analizinden sonra çıkarılan IC50 değerlerinin bir tablosu ve ortalama +/- standart sapma ve takılı regresyon eğrisi olarak normalleştirilmiş veri noktalarını içeren yanıt eğrisi grafiği olarak raporlayın.
- Yeni bir XY tablosu oluşturun ve verileri XY formatında ekleyin: Satırlar (X) negatif kontroldür ve ardından Molar konsantrasyonunda log [İnhibitör] olarak dozlarla artan ilaç dozlarıdır. Sütunlar (Y), sütunlarla birlikte yığılmış çoğaltmaları içeren okuma değerleridir.
Sonuçlar
NSCLC organoidlerinin oluşturulmasında önemli zorluklara dikkat çekilmiştir7. Bu nedenle, akciğer kanseri organoidlerini kuran ve bunları ilaç tedavisi tahlilleri için kullanan son çalışmaları görmek heyecan vericidir20,21,22. EGFR mutasyonları NSCLC vakalarının %11,3'ünü oluşturur23. EGFR inhibitörleri ile hedefe yönelik tedavi, EGFR-mutant KHDAK'da birinci basamak tedavi seçeneğini temsil eder ve hastalarda genel sağkalımı ve tedavi güvenliğini artırmıştır24. Bu çalışma, EGFR-mutant NSCLC organoidlerinde FDA onaylı EGFR tirozin kinaz inhibitörü osimertinib24,25'e duyarlılığı belirledi. EGFR-mutant NSCLC organoidleri, KHDAK hastalarının cerrahi rezeksiyon veya tümör biyopsi örneklerinden üretildi ve DNA dizilimi ile belirtilen onkojenik mutasyonu barındırdığı doğrulandı. Yukarıda özetlendiği gibi, EGFR-mutant NSCLC organoid modelleri, tedavinin başlamasından beş gün sonra lüminesans bazlı hücre sağkalımı okuması ile değerlendirilen artan dozlarda osimertinib ve PDO canlılığı ile tedavi edildi. EGFR mutantı (EGFRdel19)-pozitif TH107 organoidleri, 56 nM'lik yarı maksimal inhibitör konsantrasyonu (IC50) ile osimertinib tedavisine duyarlılık gösterirken (Şekil 2A), EGFR-mutant (EGFRL858R)-pozitif TH116 organoidleri, 1 μM'den büyük bir IC50 ile osimertinib tedavisine dirençliydi (Şekil 2B). EGFRdel19-pozitif TH107 NSCLC'nin duyarlılığına, hücre döngüsü ile ilişkili gen imzalarının ekspresyonunda bir azalma ve apoptoz ile ilişkili gen imzalarının ekspresyonunda bir artış da dahil olmak üzere önemli transkripsiyonel değişiklikler eşlik etti (Ek Şekil 2A, B). Referans olarak, hassas EGFRdel19-pozitif NSCLC hücre hattı PC9 için yanıt verileri sunulmuştur (Şekil 3A,B). İkincisi, 2D lüminesans bazlı sağkalım testi (Şekil 3A) ile osimertinib dozlarının arttırılmasına sağkalım analizini ve Western blot ile EGFR-MAPK sinyalleme düzeyinde sinyal baskılama çalışmasını içerir (Şekil 3B). Genel olarak, bu veriler ilaç yanıtını belirlemek ve hassas ve dirençli NSCLC PDO modelleri arasında ayrım yapmak için mevcut protokolün doğruluğunu vurgulamaktadır. Dirençle ilişkili olası değişiklikleri belirlemek için EGFRL858R-pozitif TH116 organoidinin ve mevcut klinik örneklerin daha ileri analizlerine ihtiyaç vardır.
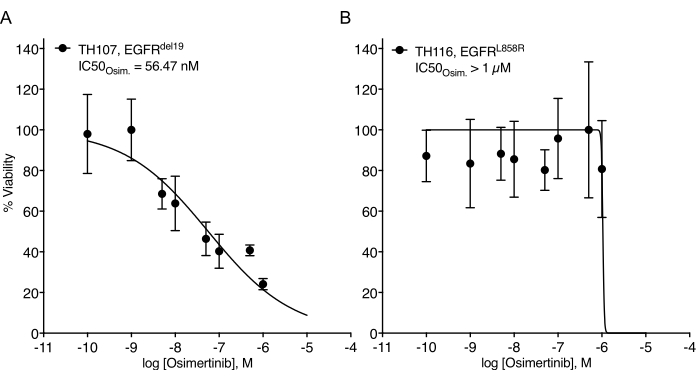
Şekil 2: EGFR-mutant NSCLC organoid modellerinin osimertinib eskalasyonuna tedaviye yanıt eğrisi. (A) Duyarlı EGFRdel19-pozitif TH107 NSCLC organoid modelinde Osimertinib yanıtı. (B) Dirençli EGFRL858R-pozitif TH116 NSCLC organoid modelinde Osimertinib yanıtı. Veri noktaları, ortalama +/- standart sapmayı gösteren normalleştirilmiş değerler olarak sunulur ve verilere doğrusal olmayan bir regresyon eğrisi takılır. TH107, n = veri noktası başına 6 teknik çoğaltma. TH116, n = veri noktası başına 4 teknik çoğaltma. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
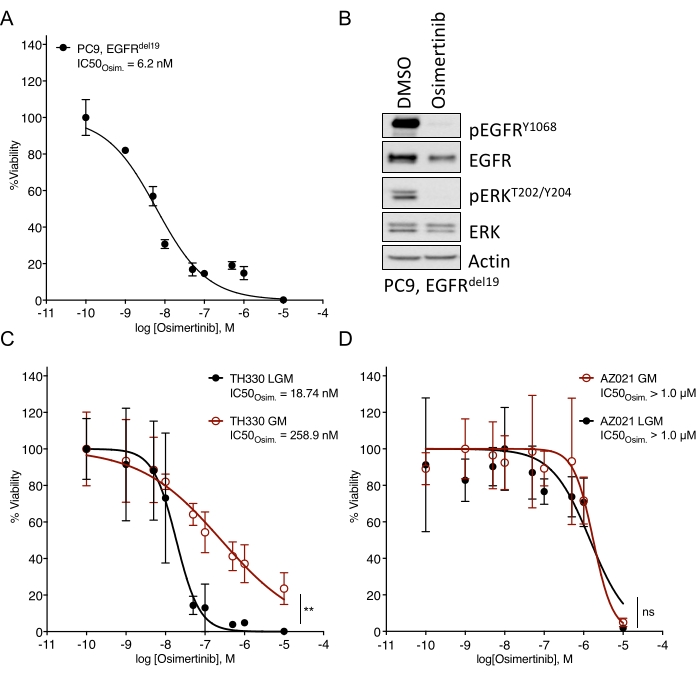
Şekil 3: Duyarlı bir EGFR-mutant NSCLC hücre hattında osimertinib tedavisine yanıt için karşılaştırmalı veriler ve farklı ortamlarda kültürlenmiş organoid modelleri. (A) Standart 2D-CTG testi ile belirlenen hassas EGFRdel19-pozitif NSCLC hücre hattı PC9'daki Osimertinib yanıtı. (B) Osimertinib (2 μM) ile iki günlük tedavi üzerine PC9 hücrelerinde sinyal baskılanması. (C) LGM ve GM ortamlarında hassas EGFRL858R-pozitif TH330 NSCLC organoid model kültüründe Osimertinib yanıtı. (D) LGM ve GM ortamlarında dirençli AZ021 NSCLC organoid modelinde Osimertinib yanıtı. AZ021'deki onkojenik EGFRL858R mutasyonunun doğrulanması başarısız oldu ve osimertinib yanıtının eksikliğine neden olabilir. A ve C-D için veri noktaları, ortalama +/- standart sapmayı gösteren normalleştirilmiş değerler olarak sunulur ve verilere doğrusal olmayan bir regresyon eğrisi takılır. PC9, n = veri noktası başına 3 teknik çoğaltma. TH330, n = veri noktası başına 5 teknik çoğaltma. AZ021, n = veri noktası başına 6 teknik çoğaltma. İstatistiksel anlamlılığı belirlemek için normalleştirilmiş veriler üzerinde Wilcoxon rütbe testi yapıldı. TH330 (C) için, LGM ve GM, ** p = 0,0078. AZ021 (D) için, LGM ve GM, ns p = 0.0742. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: EGFR-mutant organoid modellerinin sayımı ve canlılık değerlendirmesi için temsili hücre analizörü sonuçları. TH107 ve TH107BC farklı organoid modellerine, A ve B ise biyolojik replikasyonlara atıfta bulunur. Her model ve biyolojik replikasyon için üç teknik replikasyon sayılır; hepsi ≥95% canlılık gösterir. Hücre sayımı sırasında temsili bir görüntü sağda, sağlam canlılık ve tek hücreli ayrışmayı gösteren bir görüntü sunulmaktadır. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil 2: EGFR-mutant TH107 NSCLC organoidleri için elde edilen toplu RNA dizileme verilerini kullanarak, tedavi edilmemiş kontrolü (DMSO) ve Osimertinib ile 3 gün boyunca tedavi edilen hücreleri karşılaştırarak (OSI_D3) gen seti zenginleştirme analizi (GSEA). (A-B) Hedefe yönelik tedavi üzerine, hassas hücreler hücre döngüsü G1 tutuklamasına uğrayacak ve aktif proliferasyonu durduracaktır. G2M hücre döngüsü genlerinin bir ekspresyonu aktif proliferasyon ile ilişkili olduğundan, tedavi edilmemiş kontrolde (DMSO) ekspresyonun nominal olarak zenginleşmesi beklenir. Apoptozla ilişkili genler için, tedavi edilen hücrelerde (OSI_D3) nominal bir zenginleşme beklenir. Her ikisi de Osimertinib ile tedavi edilen EGFR-mutant TH107 NSCLC organoid modelinde doğrulanmıştır: (A) Hallmark G2M ekspresyon imzası için GSEA (solda) DMSO ile tedavi edilen hücrelerde zenginleştirme göstermektedir. Nominal zenginleştirme puanı (NES): +1.708, FDR < 0.0001. (B) Hallmark Apoptoz ekspresyon imzası için GSEA (sağda), Osimertinib ile tedavi edilen hücrelerde zenginleştirme gösterir. NES: -1.075, FDR: ns, 0.3275. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil 3: Sabit konsantrasyonda ikinci bir katkı inhibitörü varlığında Osimertinib yükselmesi ile tedavi edilen EGFR-mutant TH330 organoid modelinde kombinatoryal ilaç tedavisi. EGFR-mutant NSCLC'deki dirençle ilişkili değişiklikler, yani SRC ve AXL aktivasyonu26,27,28, SRC inhibitörü Saracatinib (100 nM) veya AXL inhibitörü R428 (500 nM), n = 6 veri noktası başına 6 teknik replikasyon ile kombinatoryal tedavi ile farmakolojik olarak hedeflenmiştir. Her iki kombinatoryal tedavi de Osimertinib ile SRC inhibitörü Saracatinib kombinasyonu için önemi olan artmış tedavi yanıtı ile sonuçlanmıştır. İstatistiksel anlamlılık Wilcoxon sıralama testi ile değerlendirildi: Osimertinib versus Osimertinib + Saracatinib, *p = 0.0195; Osimertinib vs Osimertinib + R428, ns, p = 0.2500. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Tablo 1: Organoid boyutunun tohumlamadan (d0) tedaviden 7 gün sonrasına (d7) değiştirilmesi. (A) EGFRdel19-pozitif NSCLC organoid TH107'de büyüme gelişimi. (B) EGFRL858R-pozitif NSCLC organoid TH330'da büyüme gelişimi. Bu tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
Bu makale, NSCLC türevi 3D PDO modellerinde ilaç duyarlılığını değerlendirmek için standartlaştırılmış bir protokol geliştirmekte ve açıklamaktadır. İlaç duyarlılığı çalışmalarına ek olarak, ilaç duyarlılığındaki farklılıkların altında yatan nedenleri belirlemek için mevcut organoid modellerin daha fazla karakterizasyonuna ihtiyaç vardır. Bu, organoidlerin ve hasta örneklerinin genetik profillemesini ve farklılaşma belirteçleri için immünohistokimya boyama ve genel hücresel sinyal biyobelirteçleri ve fizyolojisi gibi organoidler için mevcut diğer analizleri içerebilir13,29.
Protokoldeki kritik adımlar
Burada özetlenen protokol, dikkatle takip edildiğinde doğru ve tekrarlanabilir ilaç duyarlılığı analizlerine izin veren standartlaştırılmış bir iş akışı sağlar. Aşağıdaki adımlarda özel dikkat gösterilmelidir: Tek hücreli süspansiyonların oluşturulması sırasında TripLE ve DNAse I sindirimi, BME2'de tek hücreli süspansiyonların tohumlanması, tedaviye kadar organoid büyümenin izlenmesi, ortam değişiklikleri ve lüminesans bazlı hücre sağkalım okuması sırasında BME2 gömülü organoidlerin bozulması ve lizisi. (1) Organoidlerin Triple bazlı ayrışmasından sonra ek DNAse I sindirimi, düzenli kültür bakımı sırasında organoid modellerinin genişletilmesi için gerekli olmasa da, DNAse I sindirimi, organoid kümelerin tek hücreli süspansiyonlara daha iyi ayrılmasını ve doğru hücre sayımını sağladığı için ilaç yükseltme deneyleri için tohumlama yaparken ihmal edilmemelidir. (2) BME2'de tek hücreli süspansiyonun tohumlanması, BME2'nin oda sıcaklığında katılaşması göz önüne alındığında kritik bir adımı temsil eder. Bu nedenle, bir kerede en fazla 1-2 sıra tohumlanmalı ve ek sıralar tohumlanmadan önce örnekler buz üzerine yerleştirilmelidir. Not olarak, homojen bir hücre süspansiyonuna izin vermek için tohumlamaya devam edildiğinde hücrelerin yukarı ve aşağı pipetlenmesi gerekir. (3) Tohumlamadan tedaviye kadar 7 günlük genişleme sırasında organoid büyümenin dikkatle izlenmesi gerekir. Beklenen gelişime bir örnek Şekil 1B ve Ek Tablo 1'de verilmiştir. Not olarak, Şekil 1B'de gösterildiği gibi parlak alan mikroskobu ve görüntü analizi ile organoid boyutundaki değişikliklerin değerlendirilmesi, organoid büyümesindeki farklılıkların ve iki katına çıkma sürelerinin kesin bir şekilde değerlendirilmesine izin verebilir. İki katına çıkma süreleri, literatürde yakın zamanda tartışıldığı gibi, ilaç yanıtları üzerinde etkili olabilir30. Organoid büyüme hızı sunulan örneği önemli ölçüde aşarsa, tedavinin başlamasına kadar daha kısa bir genişleme süresi ve daha kısa tedavi süresi düşünülebilir. (4) Ek olarak, aspire edici organoidleri önlemek için ortam değiştirirken özel dikkat gösterilmelidir. BME2 gömülü organoidlerin saat 6 pozisyonundaki tohumlama konumu, plakalar saat yönünde 180 ° döndürüldüğünde ve ortam organoidlerin zıt konumunda aspire edildiğinde ortamın güvenli bir şekilde aspire edilmesini sağlar. (5) Son olarak, sağkalım okuması sırasında BME2 gömülü organoidlerin kapsamlı bir şekilde analiz edilmesi, doğru sonuçların kaydedilmesi için esastır. Üreticinin talimatlarına göre, uygun lizizi sağlamak için numuneler tekrar tekrar, ideal olarak filtrelenmemiş uçlar kullanılarak yukarı ve aşağı pipetlenmelidir. Kuluçka süreleri tarif edildiği gibi takip edilmelidir. Ayrıca, bir ELISA plaka okuyucu kullanarak son okuma için lizatın% 75'inin (toplam hacim yerine) beyaz, opak tabanlı 96 kuyucuklu bir plakaya aktarılması, her bir kuyuda aynı hacmi ve kuvvetli pipetleme ile ortaya çıkabilecek hava kabarcıklarının bulunmamasını sağladığından, uygun bir değerlendirmeye izin verir.
BME2-gömülü organoid kültürlerde ilaç yanıtlarının profillenmesi, normal hücre hattı kültürlerinde gözlenenden daha yüksek bir standart sapma gösterebilir (Şekil 2, Şekil 3A). Daha yüksek standart sapma, BME2 ile çalışırken tohumlamada küçük değişikliklerin artma olasılığının artması ve ilk 7 günlük büyüme süresi boyunca kuyular arasında bireysel organoid büyüme oranlarındaki farklılıklar da dahil olmak üzere çeşitli faktörlere dayanmaktadır. Bu nedenle, ilaç konsantrasyonu başına eşit veya dörtten fazla teknik kopya tohumlanmalıdır.
En önemlisi, onkojenik sürücü mutasyonu taşıyan malign hücrelerin varlığı ve normal hava yolu epitel hücreleri tarafından sınırlı kontaminasyon dikkatle değerlendirilmelidir. NSCLC oluşumundaki zorluklar normal hava yolu epitel hücrelerinin büyümesini destekleyebilir7. Onkojenik sürücü mutasyonlarının varlığını doğrulamak için kopya numarası profilleme veya PCR ve dizileme tabanlı yaklaşımlar, NSCLC organoid kültürlerinin kalitesini sağlamak için tercih edilen yöntemlerdir.
Yöntemin değiştirilmesi ve sorun giderme
Temel medya çözümlerine eklenen medya ve ilgili büyüme faktörleri, hedeflenen inhibitörlere ilaç yanıtını önemli ölçüde etkileyebilir. İlaç yanıtını etkileyen ve sınırlayan bypass reseptörlerini ve sinyal yollarını aktive ederler (örneğin, FGF, HGF, EGF)26. Büyüme faktörü açısından zengin ve uyarlanmış bir ortam, organoid kültürünün genişletilmesi için en uygun olsa da, yukarıda belirtildiği gibi, ilaç tırmanışı ve duyarlılık değerlendirmeleri, azaltılmış bir büyüme faktörü ortamında yapılmalıdır. Bu, farklı ortam formülasyonlarını ve ilaç yanıt verilerini karşılaştıran dahili deneyime dayanmaktadır (Şekil 3C). Medya çözeltileri belirli ilaç tedavisine duyarlılık derecesini etkileyebilir ve IC50 değerlerini değiştirebilirken, ortam formülasyonundan bağımsız olarak sağlam duyarlılık veya direnç fenotipleri belirgindir (Şekil 3C, D). Ek olarak, organoid kültürler arasında medya formülasyonunda ve ilaç yanıtlarının profillenmesinde genel tutarlılık önerilir ve konsantrasyon başına eşit veya dörtten fazla teknik kopyanın tohumlanması gerekir. Bu , özellikle hassasiyet aralıklarını karşılaştırmak için önemlidir. İlgilenilen İnhibitör için direnç.
Yöntemin sınırlamaları
Burada sunulan protokol, hasta kaynaklı kanser hücreleri kültürlendiğinde NSCLC 3D kanser organoid modellerinin hedeflenen inhibitörlere duyarlılığını açıklamaktadır. İlaç direnci ve duyarlılığının ayrıntılı bir karakterizasyonu için yol inhibisyonu ve sürücü onkogen ve sekonder mutasyonların varlığı için sekanslama analizi ile ilgili farmakodinamik analiz de dahil olmak üzere ek deneylere ihtiyaç vardır. Ayrıca, etkileşimlerden türetilen mikroçevresel uyaranlar veya tümör mikro ortamındaki kanser dışı seyirci hücreler tarafından salgılanan faktörler gibi seyirci faktörler hesaba katılmaz ve immün veya stromal hücrelere sahip ko-kültür organoid modelleri denendiğinde yeni protokollere ihtiyaç duyulur. Son zamanlarda yapılan çalışmalar, tümör mikroçevre etkileşimlerini özetlemek ve anti-PD-L1 tedavisi gibi immün kontrol noktası inhibitörlerine verilen yanıtları profillemek için organoid modellerin kullanımını vurgulamıştır13,31.
Yöntemin mevcut/alternatif yöntemler açısından önemi
3D kanser organoid modelleri, orijinal tümörde mevcut olan genetik çeşitliliği ve tedavi yanıtının belirleyicilerini özetlemektedir4,5,6. Özellikle, mekansal ve zamansal heterojenite tümör evrimini destekleyebilir ve tümör alt klonlarının paralel ortaya çıkışı ve sıralı gelişimi meydana gelebilir32,33. İntratümör heterojenite, terapötik basınç altında daha dirençli tümör hücrelerinin seçimi için önemlidir9,34,35. Burada sağlanan protokol, hastaya yakın örneklerde hedefe yönelik inhibitörlerle tedaviye duyarlılıkların hızlı bir şekilde değerlendirilmesini sağlar. Bu nedenle, organoid modeller, genetik çeşitliliğe sahip olmayan daha geleneksel homojen hücre hattı modellerine veya hücre hatları veya hasta kaynaklı ksenograftları kullanan uzun süreli çalışmalara göre avantajlara sahiptir. Ayrıca, mevcut protokol, maliyet ve analitik kapasite ile ilgili birkaç sınırlama ile tedavinin ve kombinasyonel tedavi yaklaşımlarının çoklu kollarına ölçeklendirilmesine izin vermektedir. Bu nedenle, birincil olarak hedeflenen İnhibitörün tırmandırılmasında sabit bir dozda ikinci bir ilgi çekici ilacın eklenmesi ve yalnızca birincil olarak hedeflenen İnhibitörün tırmandırılmasıyla karşılaştırılması, potansiyel kombinatoryal etkilerin verimli bir şekilde değerlendirilmesine ve minimum ek biyokütle gereksinimine izin verir (Ek Şekil 3). Organoid gelişimini ve ilaç yanıtını izlemek için kullanılan görüntüleme tabanlı değerlendirmelerle karşılaştırıldığında, burada açıklanan lüminesans bazlı hücre sağkalım testi, gerekli minimum ekipman ve eğitim ile benzer duyarlılığa sahiptir.
Yöntemin belirli araştırma alanlarındaki önemi ve potansiyel uygulamaları
Hasta örneklerinden kanser organoid modellerinin oluşturulmasına izin veren standartlaştırılmış bir boru hattının geliştirilmesi ve ardından ilaç duyarlılıkları profillemesi önemli klinik uygulanabilirlik potansiyeline sahiptir. Ex vivo farmakolojik profilleme, tümörlerdeki kırılganlıkların ve dirençli ilişkili özelliklerin saptanmasında tanınmış, hastalarda tedaviye yanıtla korelasyon kazanmıştır36,37. İlaç duyarlılıklarının ex vivo profillenmesi, klinikte tedavi seçiminde ve direnç mekanizmalarını ele alan rasyonel kombinasyonel tedavilerin tasarımında önemli ölçüde yardımcı olabilir. Genel olarak, bu yaklaşım moleküler terapi veya kombinatoryal tedavi rejimleri için geliştirilmiş kişiselleştirilmiş stratejilerin sağlanmasına yardımcı olabilir. İkincisi, ilaç toleransını ve direnç mekanizmalarını erken hedeflemeye yardımcı olabilir ve gelecekte hasta sonuçlarını iyileştirmek için klinik yanıtı derinleştirebilir.
Açıklamalar
T.G.B., Array Biopharma, Revolution Medicines, Novartis, AstraZeneca, Takeda, Springworks, Jazz Pharmaceuticals, Relay Therapeutics, Rain Therapeutics, Engine Biosciences şirketlerinin danışmanıdır ve Novartis, Strategia, Kinnate ve Revolution Medicines'den araştırma fonu almaktadır.
Teşekkürler
Jeroen P Roose (UCSF) ve Calvin J Kuo (Stanford) laboratuvarlarına organoid kültürü ve protokol geliştirme konusundaki katkıları için teşekkür ederiz. Ayrıca protokoller ve örnek kuruluş girdileri için Oghenekevwe M. Gbenedio'ya (Roose laboratuvarı, UCSF) teşekkür ederiz. Bu araştırma projesi NIH'nin [U54CA224081] desteğiyle yürütülmüştür. F. Haderk, Alman Kanser Yardımı'ndan Mildred Scheel doktora sonrası bursu tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | |||
| 15 mL centrifuge tubes | |||
| 500 mL Vacuum Filter/Storage Bottle System, 0.2 µm Pore 33.2 cm2 Nylon Membrane | Corning | 430773 | for both media |
| 96-Well, Cell Culture-Treated, Flat Clear Bottom Black Microplate | Corning | 3904 | |
| 96-Well, Cell Culture-Treated, Solid White Flat-Bottom Microplate | Corning | 3917 | |
| A-8301 | Tocris Bioscience | 293910 | for both media |
| Advanced DMEM/F-12 | Gibco | 12634010 | for LGM |
| B27 | Life Technologies | 12587010 | for both media |
| BioRender 2021 | https://biorender.com/ | online scientific illustration software | |
| BME2 (Cultrex RGF Basement Membrane Extract, Type 2) | R&D Systems | 353301002 | |
| Cell culture incubator (37 °C, 5% CO2) | |||
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9682 | 3D-CTG readout reagent |
| Centrifuge holding 15 mL centrifuge tubes | |||
| Deoxyribonuclease I (DNAse I) | ThermoFisher Scientific | 18047019 | |
| Dulbecco's Phosphate-Buffered Salt Solution | Corning | MT21031CV | |
| DMEM/F-12, GlutaMAX supplement | Gibco | 10565018 | for GM |
| GlutaMax | Gibco | 35050061 | for LGM |
| GraphPad Prism software (version 9.2.0) | GraphPad | statistical analysis software | |
| HEPES | Gibco | 15630080 | for both media |
| hFGF-10 | PeproTech | 100-26-100ug | for GM |
| hFGF-7 | PeproTech | 100-19-50ug | for GM |
| hNoggin | PeproTech | 120-10C-100ug | for both media |
| hRspondin | PeproTech | 120-38-100ug | for GM |
| Low retention pipette tips, 20 µL (P20) | ThermoFisher Scientific | 2149P-05-HR | |
| Low retention pipette tips, 200 µL (P200) | ThermoFisher Scientific | 2069-05-HR | |
| Regular length pipette tips, 1000 µL (P1000) | ThermoFisher Scientific | 2179-HR | |
| Multichannel pipette | |||
| N-Acetylcysteine | Fisher Scientific | 50-424-777 | for both media |
| Nicotinamide | Sigma Aldrich | N0636-100G | for both media |
| Osimertinib | Selleck Checm | S7297 | |
| Penicillin-Streptomycin-Glutamine | Gibco | 10378016 | for LGM |
| Penicillin/Streptomycin | Cytiva HyClone | SV30010 | for GM |
| Pipettes (different sizes) | |||
| Plate reader | Molecular Devices | SpectraMax M5 | equipment, alternative readers may be used |
| Primocin | Invivogen | ant-pm-1 | for GM |
| SB202190 | Selleck Chem | S1077 | for GM |
| TrypLE Express Enzyme | Gibco | 12604021 | |
| Vacuum pump and tubing | |||
| Vi-CELL XR Cell Analyzer | Beckman Coulter | Vi-CELL XR | cell analyzer / counter |
Referanslar
- de Bono, J. S., Ashworth, A. Translating cancer research into targeted therapeutics. Nature. 467 (7315), 543-549 (2010).
- Dagogo-Jack, I., Shaw, A. T. Tumour heterogeneity and resistance to cancer therapies. Nature Reviews Clinical Oncology. 15 (2), 81-94 (2018).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Dijkstra, K. K., et al. Challenges in establishing pure lung cancer organoids limit their utility for personalized medicine. Cell Reports. 31 (5), 107588 (2020).
- Lo, Y. -. H., Karlsson, K., Kuo, C. J. Applications of organoids for cancer biology and precision medicine. Nature Cancer. 1 (8), 761-773 (2020).
- Bivona, T. G., Doebele, R. C. A framework for understanding and targeting residual disease in oncogene-driven solid cancers. Nature Medicine. 22 (5), 472-478 (2016).
- Jabs, J., et al. Screening drug effects in patient-derived cancer cells links organoid responses to genome alterations. Molecular Systems Biology. 13 (11), 955 (2017).
- Tashiro, T., et al. In vivo and ex vivo cetuximab sensitivity assay using three-dimensional primary culture system to stratify KRAS mutant colorectal cancer. PLoS One. 12 (3), 0174151 (2017).
- van de Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Neal, J. T., et al. Organoid Modeling of the Tumor Immune Microenvironment. Cell. 175 (7), 1972-1988 (2018).
- Hysenaj, L., et al. SARS-CoV-2 infection studies in lung organoids identify TSPAN8 as novel mediator. bioRxiv. , (2021).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300 (2019).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocol in Immunology. , (2001).
- Pushparaj, P. N. Revisiting the micropipetting techniques in biomedical sciences: A fundamental prerequisite in good laboratory practice. Bioinformation. 16 (1), 8-12 (2020).
- Promega Corporation. CellTiter-Glo 3D Cell Viability Assay. Promega Corporation. , (2021).
- Kim, M., et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nature Communication. 10 (1), 3991 (2019).
- Hu, Y., et al. Lung cancer organoids analyzed on microwell arrays predict drug responses of patients within a week. Nature Communication. 12 (1), 2581 (2021).
- Shi, R., et al. Organoid cultures as preclinical models of non-small cell lung cancer. Clinical Cancer Research. 26 (5), 1162-1174 (2020).
- Collisson, E. A., et al. Comprehensive molecular profiling of lung adenocarcinoma. Nature. 511 (7511), 543-550 (2014).
- Ramalingam, S. S., et al. Overall Survival with Osimertinib in untreated, EGFR-mutated advanced NSCLC. New England Journal of Medicine. 382 (1), 41-50 (2019).
- Soria, J. -. C., et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. New England Journal of Medicine. 378 (2), 113-125 (2017).
- Rotow, J., Bivona, T. G. Understanding and targeting resistance mechanisms in NSCLC. Nature Reviews Cancer. 17 (11), 637-658 (2017).
- Zhang, Z., et al. Activation of the AXL kinase causes resistance to EGFR-targeted therapy in lung cancer. Nature Genetics. 44 (8), 852-860 (2012).
- Kanda, R., et al. Erlotinib resistance in lung cancer cells mediated by integrin β1/Src/Akt-driven bypass signaling. Cancer Research. 73 (20), 6243-6253 (2013).
- Bruun, J., et al. Patient-derived organoids from multiple colorectal cancer liver metastases reveal moderate intra-patient pharmacotranscriptomic heterogeneity. Clinical Cancer Research. 26 (15), 4107-4119 (2020).
- Hafner, M., Niepel, M., Chung, M., Sorger, P. K. Growth rate inhibition metrics correct for confounders in measuring sensitivity to cancer drugs. Nature methods. 13 (6), 521-527 (2016).
- Yuki, K., Cheng, N., Nakano, M., Kuo, C. J. Organoid models of tumor immunology. Trends in Immunology. 41 (8), 652-664 (2020).
- Gerlinger, M., et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. New England Journal of Medicine. 366 (10), 883-892 (2012).
- McGranahan, N., Swanton, C. Biological and therapeutic impact of intratumor heterogeneity in cancer evolution. Cancer Cell. 27 (1), 15-26 (2015).
- Rambow, F., et al. Toward minimal residual disease-directed therapy in melanoma. Cell. 174 (4), 843-855 (2018).
- Marine, J. C., Dawson, S. J., Dawson, M. A. Non-genetic mechanisms of therapeutic resistance in cancer. Nature Reviews Cancer. 20 (12), 743-756 (2020).
- Frismantas, V., et al. Ex vivo drug response profiling detects recurrent sensitivity patterns in drug-resistant acute lymphoblastic leukemia. Blood. 129 (11), 26-37 (2017).
- Drusbosky, L. M., et al. Predicting response to BET inhibitors using computational modeling: A BEAT AML project study. Leukemia Research. 77, 42-50 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır