Method Article
Perfil de la sensibilidad a las terapias dirigidas en organoides derivados de pacientes con NSCLC con mutación de EGFR
En este artículo
Resumen
Este protocolo describe una evaluación estandarizada de las sensibilidades de los medicamentos a los inhibidores de señalización dirigidos en modelos organoides derivados de pacientes con NSCLC.
Resumen
Los nuevos cultivos organoides de cáncer en 3D derivados de muestras de pacientes clínicos representan un sistema modelo importante para evaluar la heterogeneidad intratumoral y la respuesta al tratamiento a los inhibidores dirigidos en el cáncer. El trabajo pionero en cánceres gastrointestinales y pancreáticos ha puesto de relieve la promesa de los organoides derivados de pacientes (PDO) como un sistema de cultivo cercano al paciente, con un número creciente de modelos emergentes. Del mismo modo, el trabajo en otros tipos de cáncer se ha centrado en establecer modelos organoides y optimizar los protocolos de cultivo. En particular, los modelos organoides de cáncer 3D mantienen la complejidad genética de las muestras tumorales originales y, por lo tanto, traducen los datos de secuenciación derivados del tumor en tratamiento con terapias dirigidas genéticamente informadas en un entorno experimental. Además, las DOP podrían fomentar la evaluación de tratamientos combinados racionales para superar la adaptación asociada a la resistencia de los tumores en el futuro. Este último se centra en intensos esfuerzos de investigación en cáncer de pulmón de células no pequeñas (NSCLC), ya que el desarrollo de resistencia en última instancia limita el éxito del tratamiento de los inhibidores dirigidos. Una evaluación temprana de los mecanismos terapéuticamente dirigidos utilizando las DOP de NSCLC podría ayudar a informar los tratamientos de combinación racionales. Este manuscrito describe un protocolo estandarizado para la evaluación basada en placas de cultivo celular de las sensibilidades de los fármacos a los inhibidores dirigidos en las DOP 3D derivadas del NSCLC, con una posible adaptabilidad a los tratamientos combinados y otras modalidades de tratamiento.
Introducción
Las terapias personalizadas contra los impulsores oncogénicos han revolucionado el tratamiento del cáncer, mejorando la supervivencia del paciente y reduciendo los efectos secundarios mediados por el tratamiento1. Los recientes avances en el diagnóstico molecular y las tecnologías de secuenciación han puesto de relieve la complejidad de los tumores humanos, con una heterogeneidad espacial y temporal que afecta a la respuesta al tratamiento2. La recapitulación de estas diferencias subclonales en los modelos de cultivo celular se ha limitado durante mucho tiempo a investigar alteraciones seleccionadas de interés en líneas celulares que de otro modo serían uniformes. Los modelos de DOP 3D recientemente desarrollados generados a partir de biopsias tumorales o resecciones tumorales quirúrgicas permiten una mejor representación de la complejidad celular y la diafonía de señalización dentro del tejido tumoral derivado del paciente3. Como tal, los organoides tumorales derivados del cáncer gastrointestinal y pancreático se han generado con éxito y recapitulan la diversidad genética y los determinantes de la respuesta al tratamiento4,5,6. En el cáncer de pulmón de células no pequeñas (CPCNP), se reconocen los desafíos de desarrollo y establecimiento de organoides, y se necesita la optimización de las técnicas de cultivo y los factores de medios selectivos para permitir un uso más amplio y sistemático de las DOP de NSCLC en el futuro7,8.
El desarrollo de terapias combinatorias dirigidas a células tumorales residuales que resistan el tratamiento farmacológico inicial es esencial para inhibir el desarrollo de resistencias y, en última instancia, para mejorar la supervivencia del paciente9. Dada la complejidad arquitectónica de los cultivos de organoides, los parámetros clásicos de respuesta a los fármacos deben optimizarse para permitir pruebas precisas y reproducibles de las sensibilidades a los medicamentos. Se dispone de lecturas basadas en imágenes10,11 y ensayos clásicos de viabilidad celular que miden la abundancia de ATP celular6,12, entre otras técnicas, para perfilar las respuestas farmacológicas en cultivos de DOP. Aquí, desarrollamos y describimos un protocolo estandarizado para evaluar las sensibilidades de los medicamentos a la terapia dirigida contra los impulsores clínicos conocidos en los modelos de DOP de NSCLC.
Protocolo
Para la investigación en sujetos humanos, se obtuvo el consentimiento informado y se llevó a cabo la recolección de tejidos bajo los protocolos aprobados por la Junta de Revisión Interna de la UCSF (IRB, protocolo no.: # 13-12492, o CC # 17-23309). El establecimiento de cultivos organoides a partir de especímenes clínicos no identificados se realizó en colaboración con socios de investigación de acuerdo con métodos publicados previamente13,14,15,16. Los cultivos de organoides se recuperaron para experimentos de mantenimiento y escalada de fármacos en el paso tres o más tarde. Todos los siguientes protocolos se realizaron en condiciones asépticas en un entorno de laboratorio de cultivo de tejidos de mamíferos.
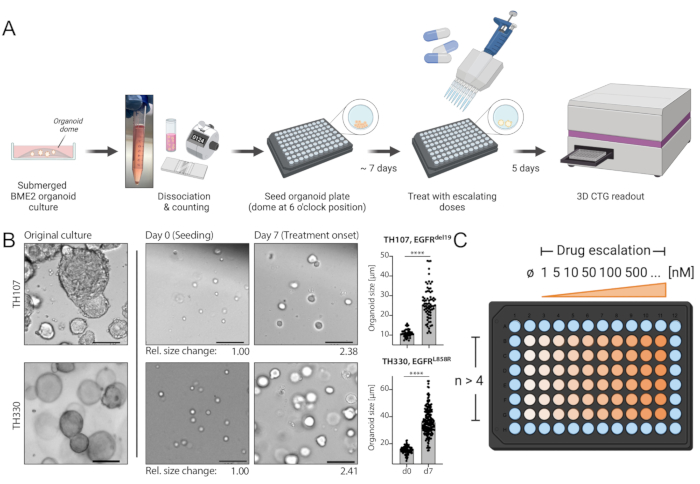
Figura 1: Esquema de protocolo del flujo de trabajo y pasos críticos en la técnica. (A) Flujo de trabajo experimental que incluye la siembra de organoides en formato de 96 pocillos, el tratamiento con escalada de fármacos a los 7 días después de la siembra y la lectura de supervivencia celular basada en luminiscencia 5 días después del tratamiento utilizando un lector de placas ELISA. (B) Una imagen de ejemplo de los cultivos organoides NSCLC TH107 positivo para EGFRdel19 y TH330 positivo para EGFRL858R. Se muestran los cultivos originales, las células en el momento de la siembra (día 0) y los organoides en el inicio del tratamiento 7 días después de la siembra (día 7). Barra de escala = 100 μm. Los cambios en el diámetro de los organoides durante el período de cultivo inicial de 7 días se cuantifican e indican un aumento de >2 veces en el tamaño de los organoides. Los cambios relativos de pliegue en los tamaños en el día 7 en comparación con el tamaño promedio en el día 0 se presentan a continuación de las imágenes representativas. Para TH107, se observa un cambio de pliegue de 2,38 durante 7 días, lo que indica un tiempo de duplicación de 5,88 días (141,12 h). Para TH330, se observa un cambio de pliegue de 2,41 durante 7 días, lo que indica un tiempo de duplicación de 5,81 días (139,42 h). Se presenta la cuantificación de los cambios en el tamaño de los organoides y la evaluación estadística (derecha). La significación estadística se calcula mediante prueba t no apareada, p < 0,0001. (C) Diseño del tratamiento para la escalada de drogas en formato de placa organoide de 96 pocillos. Se indica el número de réplicas técnicas y dosis ejemplares, incluyendo un control negativo. Los esquemas se crean con BioRender, una herramienta de ilustración basada en la web. Haga clic aquí para ver una versión más grande de esta figura.
1. Preparativos experimentales
- Prepare el medio de crecimiento (GM) como se informó anteriormente15: Dulbecco's Modified Eagle's Medium/Ham's nutrient mix F12 (DMEM/F-12) con L-alanil-L-glutamina, suplementado con 100 U/mL de penicilina/estreptomicina, 10 mM HEPES, 25 nM hRspondin, 1x B27, 5 mM nicotinamida, 1,25 mM N-acetilcisteína, 500 nM A-8301, 500 nM SB202190, 50 μg/mL primocina, 100 ng/mL hNoggin, 100 ng/mL hFGF-10, 25 ng/mL hFGF-7 (ver Tabla de Materiales).
NOTA: Mezclar suavemente para evitar la formación de espuma y filtrar a través de un sistema de filtrado de 0,22 μm. Caliente el medio a 37 °C dentro de 1 h antes de su uso. - Preparar medios de bajo factor de crecimiento (LGM) como se informó anteriormente16 sin la adición de factor de crecimiento epidérmico (EGF): Advanced Dulbecco's Modified Eagle's Medium/Ham's nutrient mix F12 (DMEM/F-12), suplementado con 1 mM HEPES, 1x L-alanil-L-glutamina, 1x Penicilina-Estreptomicina-Glutamina, 10 mM Nicotinamida, 1 mM N-Acetilcisteína, 1x B27, 500 nM A-8301, 100 ng/mL hNoggin.
NOTA: Mezclar suavemente para evitar la formación de espuma y filtrar a través de un filtro de 0,22 μm. Caliente el medio a 37 °C dentro de 1 h antes de su uso. - Descongelar BME2 (Reduced Growth Factor Basement Membrane Extract, Tipo 2, ver Tabla de Materiales) sobre hielo, a 4 °C, durante la noche.
2. Generación de suspensión unicelular y siembra de células
- Disociar el cultivo de organoides BME2 sumergido como se describe en los siguientes pasos (2.1.1-2.1.6).
- Aspirar cuidadosamente los medios de las placas de cultivo. Evite tocar el cultivo de organoides BME2 sumergido.
NOTA: La aspiración de medios se puede hacer como el investigador prefiera, por ejemplo, con un sistema básico de aspiración de fluidos o usando una pipeta. Evite tocar los organoides incrustados en BME2, ya que esto podría resultar en la pérdida de biomasa de organoides. - Tripsinizar el cultivo de organoides BME2 sumergido con una enzima recombinante adecuada (ver Tabla de Materiales). En formato de placa de 6 pocillos, agregue 2 ml por pozo. Rompa mecánicamente el BME2 canalizando repetidamente hacia arriba y hacia abajo. Incubar placas a 37 °C en la incubadora de cultivo celular durante 5 min.
- Transfiera la suspensión a un tubo centrífugo de 15 ml y centrífuga a 600 x g durante 5 minutos a temperatura ambiente.
- Aspire la enzima recombinante con cuidado sin tocar la bolita organoide.
NOTA: BME2 residual puede estar presente. Repita la digestión de la enzima si es necesario. - Resuspendir el pellet organoide en GM (paso 1.1). Añadir DNasa I 1x 100 U/mL e incubar durante 5 min a temperatura ambiente (ver Tabla de Materiales).
- Centrifugadora a 600 x g durante 3 min a temperatura ambiente. Retire los medios con cuidado sin tocar el gránulo organoide y deséchelo. Resuspend en GM fresco.
- Aspirar cuidadosamente los medios de las placas de cultivo. Evite tocar el cultivo de organoides BME2 sumergido.
- Siembra de suspensión organoide unicelular
- Precalentar una nueva placa negra de fondo transparente de 96 pocillos a 37 °C en la incubadora de cultivo celular durante 10 min.
NOTA: El uso de placas inferiores transparentes es esencial para controlar el crecimiento de los organoides y la respuesta a los medicamentos. - Para el conteo, prepare una dilución 1:5 de la suspensión celular en PBS (volumen total: 500 μL) y cuente la suspensión celular usando un analizador celular (ver Tabla de Materiales).
NOTA: Asegúrese de multiplicar por el factor de dilución (x 5) para recibir la concentración celular final. Se pueden utilizar métodos de conteo alternativos, como un hemocitómetro. La viabilidad celular debe ser monitoreada mediante un ensayo de tinción de viabilidad (por ejemplo, con Trypan Blue17). Utilizando un analizador celular, la viabilidad se evalúa automáticamente. La viabilidad de las suspensiones organoides unicelulares evaluadas por el analizador celular debe ser ≥95% (Figura suplementaria 1). - Calcule el volumen de la suspensión celular necesaria para sembrar para el experimento.
NOTA: La concentración de siembra es de 1500 células/μL BME2, con 5 μL BME2 necesarios por pozo (Número total: 7500 células/pozo). Para una placa de 96 pocillos, se requieren 6 x 10E5 celdas. Esto incluye la siembra de 60 pozos con cúpulas organoides (4.5 x 10E5) y excedente experimental (cálculo para un total de 80 pozos). - Prepare una alícuota de suspensión celular en un tubo de microcentrífuga de 1,5 ml por cada placa de 96 pocillos que se planea sembrar si se incluyen varias placas de 96 pocillos en el experimento.
NOTA: Se necesitan excedentes experimentales y alícuotas separadas por placa sembrada de 96 pocillos para tener en cuenta el aumento del sesgo experimental debido al manejo de BME2. - Células alícuotas de la suspensión unicelular calculadas (paso 2.2.3) después de una cuidadosa resuspensión mediante pipeteo hacia arriba y hacia abajo. Células de pellet a 600 x g durante 5 min a temperatura ambiente. Retire cuidadosamente el medio con una pipeta P200 sin tocar el pellet de la celda. Coloque el pellet celular en hielo en breve (~ 1 min) y vuelva a suspender el pellet celular en BME2.
NOTA: Los medios residuales pueden comprometer la estructura y rigidez de BME2. Pipetee todos los medios con cuidado. Coloque las células en hielo en breve para aclimatar el pellet celular y permitir que las células se resuspendan en BME2 sin aglutinarse. Mantenga BME2 en hielo constantemente para que permanezca en estado líquido. Para una placa de 96 pocillos, se necesitan 400 μL de BME2 para la resuspensión del pellet celular. Resuspenda los gránulos celulares con cuidado, evitando la introducción de burbujas. - Incline su placa negra precalentada de 96 pocillos hacia usted. Células de placa utilizando 5 μL de suspensión celular por pozo y domos de células de siembra en la posición de las 6 en punto de cada pozo (Figura 1A). Separe las cúpulas de la celda en los pozos interiores restantes (columnas 2-10 y filas B-G de una placa de 96 pocillos).
NOTA: Se recomienda el pipeteo inverso18 cuando se manipula BME2. - No mueva la placa de 96 pocillos e incube las cúpulas celulares recién sembradas en la campana de flujo laminar de cultivo celular durante 5 minutos a temperatura ambiente. Luego mueva la placa a la incubadora de cultivo celular e incube durante 10 minutos a 37 ° C.
- Agregue cuidadosamente 100 μL de GM por pozo a todos los pocillos que contengan organoides (columnas 2-10 y filas B-G de una placa de 96 pocillos). Agregue 100 μL de PBS a los pozos exteriores en el borde de la placa.
- Cultivo de organoides incrustados BME2 en medios GM a 37 °C en la incubadora de cultivo celular durante un total de 7 días. Inspeccione el crecimiento de organoides bajo el microscopio de luz regularmente.
NOTA: Consulte la Figura 1B y la Tabla Suplementaria 1 para obtener un ejemplo del progreso esperado del crecimiento desde la siembra hasta el día del tratamiento. - Cambie el medio una vez después de 3-4 días de cultivo: gire la placa en el sentido de las agujas del reloj en 180 ° (organoides ahora en la posición de las 12 en punto), aspire cuidadosamente GM desde la posición opuesta a la cúpula organoide utilizando un aparato multicanal si está disponible, y luego agregue GM fresco.
- Precalentar una nueva placa negra de fondo transparente de 96 pocillos a 37 °C en la incubadora de cultivo celular durante 10 min.
3. Tratamiento farmacológico
- Preparar una dilución seriada del fármaco en LGM para el fármaco de elección, por ejemplo, osimertinib, para tratar los organoides del CPCNP mutante EGFR. Incluye un control negativo (medios LGM + 0,1% DMSO). Preparar suficientes alícuotas de medicamentos de todas las dosis de acuerdo con el número de pocillos sembrados más el excedente experimental.
NOTA: Se recomienda una serie de dilución que incluya dosis de ≥8 y que oscile entre 1 nM-10 μM para los inhibidores dirigidos. - Gire la placa organoide en el sentido de las agujas del reloj en 180 ° (organoides ahora en la posición de las 12 en punto). Aspirar cuidadosamente GM usando un aparato multicanal preferiblemente.
NOTA: Evite tocar la cúpula organoide mientras aspira el GM, ya que esto puede resultar en la pérdida de biomasa organoide y los resultados de impacto. - Agregue 100 μL de control (por ejemplo, medios LGM + DMSO al 0,1%) o solución de medicamento por pocillo.
NOTA: Consulte la Figura 1C para el esquema de tratamiento de escalada de drogas en formato de placa de 96 pocillos. - Incubar organoides tratados a 37 °C en la incubadora de cultivo celular durante 5 días.
4. Lectura mediante ensayo de supervivencia basado en luminiscencia
- Lectura de cosecha y supervivencia
- Realizar el ensayo de supervivencia según Referencia19.
- Descongelar el reactivo (ver Tabla de Materiales) durante la noche a 4 °C. Equilibre el reactivo en un baño de agua a temperatura ambiente durante 30 minutos antes de su uso y mezcle invirtiendo.
- Añadir un volumen igual del reactivo a cada pocillo (100 μL por pocillo). Mezclar bien mediante pipeteo hacia arriba y hacia abajo, con la punta de la pipeta colocada en la posición de la cúpula organoide. Incubar durante 5 min a temperatura ambiente en la oscuridad.
- Usando una pipeta multicanal, transfiera aproximadamente el 75% (150 μL) del lisado (paso 4.1.1.2) a una nueva placa blanca de 96 pocillos de fondo opaco.
NOTA: La transferencia del 75% de los lisados a una nueva placa garantiza la ausencia de burbujas en la lectura posterior sin afectar la sensibilidad del ensayo. - Incubar durante 25 minutos adicionales a temperatura ambiente en la oscuridad.
- Registre la luminiscencia utilizando un lector de placas ELISA (tiempo de integración 0.25-1 s/por pozo) (consulte la Tabla de Materiales).
- Guarde los datos en un formato apropiado, por ejemplo, una tabla de datos que contenga todas las lecturas en bruto y el registro del diseño de la placa y los medicamentos utilizados.
- Realizar el ensayo de supervivencia según Referencia19.
- Análisis de datos mediante software de análisis estadístico (ver Tabla de Materiales)
- Cree una nueva tabla XY e inserte datos en un formato XY: Las filas (X) son control negativo seguido de dosis de medicamentos crecientes, con dosis como log [Inhibidor] en concentración molar. Las columnas (Y) son valores de lectura que incluyen réplicas apiladas junto con columnas.
NOTA: La concentración del control negativo debe indicarse como un valor mínimo (dado 0 no es posible en la escala logarítmica), por ejemplo, log [Inhibidor], M = -10. - Normalice los valores seleccionando Analizar > Normalizar y utilizando los siguientes parámetros: normalice cada subcolumna por separado, Y = 0 como 0 %, "último valor en cada subcolumna (o primero, lo que sea mayor)" como 100 %, da como resultado porcentajes, grafique los resultados.
- Ajuste la curva de regresión no lineal en datos normalizados seleccionando Analizar > análisis XY > Regresión no lineal > Respuesta a la dosis - Inhibición > registro (inhibidor) vs . respuesta normalizada - Pendiente variable.
- Informe los resultados como una tabla de valores de IC50 obtenidos después del análisis de regresión no lineal y el gráfico de la curva de respuesta, incluidos los puntos de datos normalizados como media +/- desviación estándar y curva de regresión ajustada.
- Cree una nueva tabla XY e inserte datos en un formato XY: Las filas (X) son control negativo seguido de dosis de medicamentos crecientes, con dosis como log [Inhibidor] en concentración molar. Las columnas (Y) son valores de lectura que incluyen réplicas apiladas junto con columnas.
Resultados
Se han observado desafíos considerables en el establecimiento de organoides NSCLC7. Por lo tanto, es emocionante ver trabajos recientes que establecen organoides de cáncer de pulmón y los utilizan para ensayos de tratamiento farmacológico20,21,22. Las mutaciones de EGFR representan el 11,3% de los casos de NSCLC23. El tratamiento dirigido con inhibidores del EGFR representa la opción de tratamiento de primera línea en el CPCNP con mutación del EGFR y ha mejorado la supervivencia global y la seguridad del tratamiento en los pacientes24. Este trabajo determinó la sensibilidad al inhibidor de la tirosina cinasa EGFR aprobado por la FDA osimertinib24,25 en organoides NSCLC con mutación EGFR. Los organoides NSCLC mutantes de EGFR se generaron a partir de muestras de resección quirúrgica o biopsia tumoral de pacientes con NSCLC y se confirmó que albergaban la mutación oncogénica indicada mediante secuenciación de ADN. Como se describió anteriormente, los modelos organoides de NSCLC con mutación de EGFR se trataron con dosis crecientes de osimertinib y viabilidad de la DOP evaluada mediante lectura de supervivencia celular basada en luminiscencia cinco días después del inicio del tratamiento. Mientras que los organoides TH107 mutantes (EGFRdel19) positivos mostraron sensibilidad al tratamiento con osimertinib con una concentración inhibitoria medio máxima (IC50) de 56 nM (Figura 2A), los organoides TH116 positivos con mutación DE EGFR (EGFRL858R) fueron resistentes al tratamiento con osimertinib con un IC50 superior a 1 μM (Figura 2B). La sensibilidad del NSCLC TH107 EGFRdel19 positivo se acompañó de cambios transcripcionales significativos, incluida una reducción en la expresión de firmas génicas asociadas al ciclo celular y un aumento en la expresión de firmas génicas asociadas a la apoptosis (Figura suplementaria 2A, B). Como referencia, se presentan los datos de respuesta para la línea celular sensible de NSCLC EGFRdel19 positivo PC9 (Figura 3A, B). Este último incluye el análisis de supervivencia a dosis crecientes de osimertinib mediante un ensayo de supervivencia basado en luminiscencia 2D (Figura 3A) y el estudio de la supresión de la señalización en el nivel de señalización EGFR-MAPK por Western blot (Figura 3B). En general, estos datos destacan la precisión del protocolo actual para determinar la respuesta a los medicamentos y distinguir entre modelos de DOP NSCLC sensibles y resistentes. Se necesitan análisis adicionales del organoide TH116 EGFRL858R positivo y muestras clínicas disponibles para determinar posibles alteraciones asociadas a la resistencia.
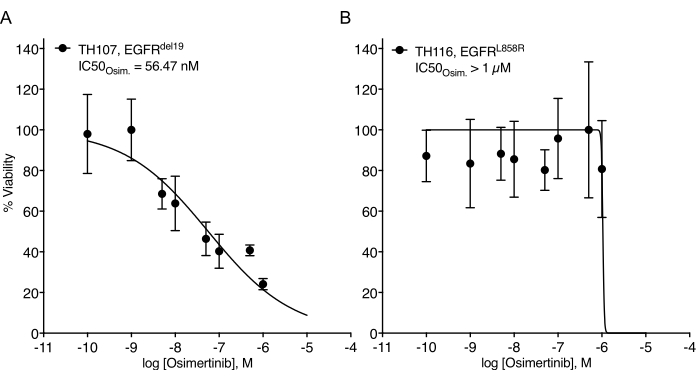
Figura 2: Curva de respuesta al tratamiento de modelos organoides de NSCLC mutante con EGFR a la escalada de osimertinib. (A) Respuesta de osimertinib en el modelo organoide sensible de NSCLC TH107 TH107 positivo para EGFRdel19. (B) Respuesta de osimertinib en el modelo organoide NSCLC TH116 TH116 positivo para EGFRL858R resistente. Los puntos de datos se presentan como valores normalizados que muestran la media +/- desviación estándar, con una curva de regresión no lineal ajustada a través de los datos. TH107, n = 6 réplicas técnicas por punto de datos. TH116, n = 4 réplicas técnicas por punto de datos. Haga clic aquí para ver una versión más grande de esta figura.
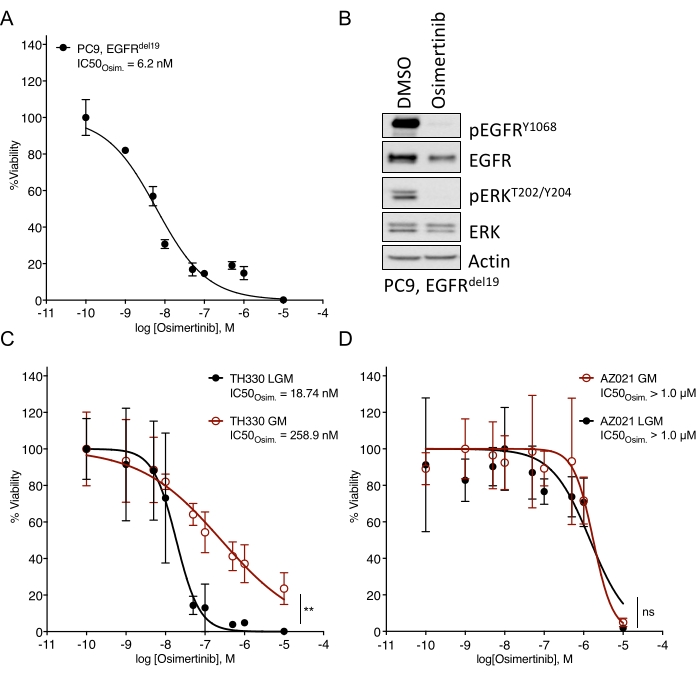
Figura 3: Datos comparativos para la respuesta al tratamiento con osimertinib en una línea celular de NSCLC con mutación de EGFR sensible y modelos organoides cultivados en diferentes medios. (A) Respuesta de osimertinib en la línea celular sensible de NSCLC NSCLC POSITIVO para EGFRdel19 PC9, determinada por el ensayo estándar 2D-CTG. (B) Supresión de la señalización en las células PC9 tras el tratamiento de dos días con osimertinib (2 μM). (C) Respuesta de osimertinib en el cultivo sensible del modelo organoide TH330 NSCLC TH330 positivo para EGFRL858R en medios LGM y GM. (D) Respuesta de osimertinib en el modelo organoide resistente AZ021 NSCLC en medios LGM y GM. La confirmación de la mutación oncogénica EGFRL858R en AZ021 falló y puede ser causal de la falta de respuesta a osimertinib. Para A y C-D, los puntos de datos se presentan como valores normalizados que muestran la media +/- desviación estándar, con una curva de regresión no lineal ajustada a través de los datos. PC9, n = 3 réplicas técnicas por punto de datos. TH330, n = 5 réplicas técnicas por punto de datos. AZ021, n = 6 réplicas técnicas por punto de datos. Se realizó una prueba de rango de Wilcoxon con datos normalizados para determinar la significación estadística. Para TH330 (C), LGM vs. GM, ** p = 0.0078. Para AZ021 (D), LGM vs. GM, ns p = 0,0742. Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: Resultados representativos del analizador celular para el conteo y la evaluación de la viabilidad de modelos organoides mutantes de EGFR. TH107 y TH107BC se refieren a diferentes modelos organoides y A y B a réplicas biológicas. Para cada modelo y réplica biológica, se cuentan tres réplicas técnicas; todos muestran ≥95% de viabilidad. A la derecha se presenta una imagen representativa durante el recuento celular, que muestra una viabilidad robusta y una disociación unicelular. Haga clic aquí para descargar este archivo.
Figura complementaria 2: Análisis de enriquecimiento de conjuntos de genes (GSEA) utilizando datos de secuenciación de ARN a granel obtenidos para organoides NSCLC TH107 mutantes de EGFR, comparando el control no tratado (DMSO) y las células tratadas con Osimertinib durante 3 días (OSI_D3).. (A-B) Tras un tratamiento dirigido, las células sensibles se someterán a la detención G1 del ciclo celular y cesarán la proliferación activa. Como una expresión de genes del ciclo celular G2M se asocia con la proliferación activa, se espera un enriquecimiento nominal de la expresión en el control no tratado (DMSO). Para los genes relacionados con la apoptosis, se espera un enriquecimiento nominal en las células tratadas (OSI_D3). Ambos se han confirmado en el modelo organoide TH107 NSCLC mutante EGFR tratado con Osimertinib: (A) GSEA para la firma de expresión Hallmark G2M (izquierda) muestra enriquecimiento en células tratadas con DMSO. Puntuación de enriquecimiento nominal (NES): +1,708, FDR < 0,0001. (B) GSEA para la firma de expresión de Hallmark Apoptosis (derecha) muestra enriquecimiento en células tratadas con osimertinib. NES: -1.075, FDR: ns, 0.3275. Haga clic aquí para descargar este archivo.
Figura complementaria 3: Tratamiento farmacológico combinatorio en modelo organoide TH330 con mutación EGFR tratado con escalada de Osimertinib en presencia de un segundo inhibidor aditivo a una concentración fija. Las alteraciones asociadas a la resistencia en el NSCLC mutante egFR, es decir, la activación de SRC y AXL26,27,28, fueron farmacológicas dirigidas por tratamiento combinatorio con inhibidor de SRC Saracatinib (100 nM) o inhibidor de AXL R428 (500 nM), n = 6 réplicas técnicas por punto de datos. Ambos tratamientos combinatorios dieron lugar a un aumento de la respuesta al tratamiento, con importancia para la combinación de Osimertinib con el inhibidor de la SRC Saracatinib. La significación estadística se evaluó mediante la prueba de rango de Wilcoxon: Osimertinib versus Osimertinib + Saracatinib, *p = 0,0195; Osimertinib vs. Osimertinib + R428, ns, p = 0,2500. Haga clic aquí para descargar este archivo.
Tabla suplementaria 1: Cambio del tamaño de los organoides de la siembra (d0) a los 7 días posteriores al tratamiento (d7). (A) Desarrollo del crecimiento en el organoide EGFRdel19-positivo NSCLC TH107. (B) Desarrollo del crecimiento en el organoide TH330 NSCLC TH330 positivo para EGFRL858R. Haga clic aquí para descargar esta tabla.
Discusión
Este manuscrito desarrolla y describe un protocolo estandarizado para evaluar la sensibilidad a los medicamentos en modelos de DOP 3D derivados de NSCLC. Además de los estudios de sensibilidad a los medicamentos, se necesita una mayor caracterización de los modelos organoides disponibles para determinar las causas subyacentes de las diferencias en la sensibilidad a los medicamentos. Esto puede incluir perfiles genéticos de organoides y muestras de pacientes y otros análisis disponibles para organoides, como la tinción inmunohistoquímica para marcadores de diferenciación y biomarcadores generales de señalización celular y fisiología13,29.
Pasos críticos en el protocolo
El protocolo descrito en este documento proporciona un flujo de trabajo estandarizado que permite análisis de sensibilidad a medicamentos precisos y reproducibles cuando se siguen cuidadosamente. Se debe tener especial cuidado en los siguientes pasos: digestión de TrypLE y DNAse I durante la generación de suspensiones unicelulares, siembra de suspensiones unicelulares en BME2, monitoreo del crecimiento de organoides hasta el tratamiento, cambios en los medios y alteración y lisis de organoides incrustados en BME2 durante la lectura de supervivencia celular basada en luminiscencia. (1) Si bien la digestión adicional de DNAse I después de la disociación de organoides basada en TrypLE no es esencial para expandir los modelos de organoides durante el mantenimiento regular del cultivo, la digestión de DNAse I no debe omitirse al sembrar para experimentos de escalada de fármacos, ya que garantiza una mejor separación de los grupos de organoides en suspensiones unicelulares y un recuento celular preciso. (2) La siembra de suspensión unicelular en BME2 representa un paso crítico dada la solidificación de BME2 a temperatura ambiente. Por lo tanto, se debe sembrar un máximo de 1-2 filas a la vez, y las muestras deben colocarse en hielo antes de sembrar filas adicionales. Cabe destacar que las células deben pipetearse hacia arriba y hacia abajo cuando se continúa la siembra para permitir una suspensión celular homogénea. (3) El crecimiento de los organoides debe ser monitoreado cuidadosamente durante la expansión de 7 días desde la siembra hasta el tratamiento. Un ejemplo de la evolución prevista figura en la figura 1B y en el cuadro complementario 1. Cabe destacar que la evaluación de los cambios en el tamaño de los organoides mediante microscopía de campo brillante y análisis de imágenes como se presenta en la Figura 1B puede permitir una evaluación precisa de las diferencias en el crecimiento de los organoides y los tiempos de duplicación. Los tiempos de duplicación pueden tener un impacto en las respuestas a los fármacos, como se discutió recientemente en la literatura30. Si la tasa de crecimiento de organoides excede significativamente el ejemplo presentado, se puede considerar un tiempo de expansión más corto hasta el inicio del tratamiento y una duración del tratamiento más corta. (4) Además, se debe tener especial cuidado al cambiar de medio para evitar aspirar organoides. La posición de siembra de los organoides incrustados BME2 en la posición de las 6 en punto permite una aspiración segura de los medios cuando las placas se giran en el sentido de las agujas del reloj en 180 ° y los medios se aspiran en la posición opuesta de los organoides. (5) Finalmente, la lisis exhaustiva de los organoides incrustados en BME2 durante la lectura de supervivencia es esencial para registrar resultados precisos. De acuerdo con las instrucciones del fabricante, las muestras deben canalizarse hacia arriba y hacia abajo repetidamente, idealmente utilizando puntas sin filtrar, para garantizar una lisis adecuada. Los tiempos de incubación deben seguirse como se describe. Además, transferir el 75% del lisado (en lugar del volumen total) a una placa blanca de 96 pocillos de fondo opaco para la lectura final utilizando un lector de placas ELISA permite una evaluación adecuada, ya que esto asegura el mismo volumen en cada pozo y la ausencia de burbujas de aire que se pueden introducir mediante pipeteos vigorosos.
Cabe destacar que el perfil de las respuestas farmacológicas en cultivos organoides incrustados en BME2 puede mostrar una desviación estándar más alta que la observada en cultivos de líneas celulares regulares (Figura 2, Figura 3A). La desviación estándar más alta se basa en varios factores, incluida una mayor probabilidad de variaciones menores en la siembra cuando se trabaja con BME2 y diferencias en las tasas de crecimiento de organoides individuales en los pozos durante el período de crecimiento inicial de 7 días. Por lo tanto, se deben sembrar iguales o más de cuatro réplicas técnicas por concentración de fármaco.
Lo más importante es que la presencia de células malignas portadoras de la mutación conductora oncogénica y la contaminación limitada por células epiteliales normales de las vías respiratorias deben evaluarse cuidadosamente. Los desafíos en el establecimiento del CPCNP pueden favorecer el crecimiento de las células epiteliales normales de las vías respiratorias7. El perfil del número de copias o los enfoques basados en PCR y secuenciación para confirmar la presencia de las mutaciones impulsoras oncogénicas son los métodos de elección para garantizar la calidad de los cultivos organoides de NSCLC.
Modificaciones y solución de problemas del método
Los medios y los factores de crecimiento respectivos agregados a las soluciones de medios básicos pueden afectar significativamente la respuesta de los medicamentos a los inhibidores dirigidos. Activan los receptores de derivación y las vías de señalización que influyen y limitan la respuesta al fármaco (por ejemplo, FGF, HGF, EGF)26. Si bien un medio rico en factores de crecimiento y adaptado puede ser óptimo para expandir el cultivo de organoides, las evaluaciones de la escalada de drogas y la sensibilidad deben realizarse en un medio de factor de crecimiento reducido, como se describió anteriormente. Esto se basa en la experiencia interna comparando diferentes formulaciones de medios y datos de respuesta a medicamentos (Figura 3C). Si bien las soluciones de medios pueden afectar el grado de sensibilidad a cierto tratamiento farmacológico y pueden cambiar los valores de IC50 , los fenotipos robustos de sensibilidad o resistencia son evidentes independientemente de la formulación del medio (Figura 3C, D). Además, se recomienda la consistencia general en la formulación de medios y el perfil de las respuestas farmacológicas en todos los cultivos de organoides, y se debe sembrar una igual o más de cuatro réplicas técnicas por concentración. Esto es particularmente importante para comparar los rangos en sensibilidad vs. resistencia para el Inhibidor de interés.
Limitaciones del método
El protocolo presentado aquí describe la sensibilidad de los modelos organoides de cáncer 3D NSCLC a los inhibidores dirigidos cuando se cultivan células cancerosas derivadas del paciente. Se necesitan experimentos adicionales, incluido el análisis farmacodinámico con respecto a la inhibición de la vía y el análisis de secuenciación para la presencia del oncogén impulsor y las mutaciones secundarias, para una caracterización detallada de la resistencia a los medicamentos y la sensibilidad. Además, los factores de los espectadores, como los estímulos microambientales derivados de interacciones o factores secretados por células espectadoras no cancerosas en el microambiente tumoral, no se tienen en cuenta, y se necesitan protocolos novedosos cuando se intentan modelos organoides de cocultivo con células inmunes o estromales. Trabajos recientes han destacado el uso de modelos organoides para recapitular las interacciones del microambiente tumoral y perfilar las respuestas a los inhibidores del punto de control inmunitario, como el tratamiento anti-PD-L113,31.
La importancia del método con respecto a los métodos existentes / alternativos
Los modelos organoides de cáncer 3D recapitulan la diversidad genética y los determinantes de la respuesta al tratamiento presentes en el tumor original4,5,6. En particular, la heterogeneidad espacial y temporal puede promover la evolución tumoral, y puede ocurrir la aparición paralela y el desarrollo secuencial de subclones tumorales32,33. La heterogeneidad intratumoral es significativa para la selección de células tumorales más resistentes bajo presión terapéutica9,34,35. El protocolo proporcionado aquí permite una evaluación rápida de las sensibilidades al tratamiento con inhibidores dirigidos en muestras próximas al paciente. Por lo tanto, los modelos organoides tienen ventajas sobre los modelos de líneas celulares homogéneas más convencionales que carecen de diversidad genética o estudios a largo plazo que utilizan líneas celulares o xenoinjertos derivados de pacientes. Además, el presente protocolo permite ampliar a múltiples brazos de tratamiento y enfoques de tratamiento combinado con pocas limitaciones con respecto al costo y la capacidad analítica. Como tal, agregar un segundo fármaco de interés a una dosis fija mientras se escala el inhibidor dirigido principalmente y se compara con la escalada del inhibidor dirigido principalmente solo permite evaluar de manera eficiente los posibles efectos combinatorios y con una biomasa adicional mínima requerida (Figura suplementaria 3). En comparación con las evaluaciones basadas en imágenes utilizadas para monitorear el desarrollo de organoides y la respuesta a los medicamentos, el ensayo de supervivencia celular basado en luminiscencia descrito aquí tiene una sensibilidad similar con un equipo y capacitación mínimos requeridos.
Importancia y aplicaciones potenciales del método en áreas de investigación específicas
El desarrollo de una tubería estandarizada que permita establecer modelos de organoides cancerígenos a partir de muestras de pacientes y el posterior perfil de sensibilidades a los medicamentos tiene un potencial de aplicabilidad clínica significativo. El perfil farmacológico ex vivo ha ganado reconocimiento en la detección de vulnerabilidades y características asociadas a la resistencia en tumores, correlacionándose con la respuesta al tratamiento en pacientes36,37. Significativamente, el perfil ex vivo de las sensibilidades a los medicamentos puede ayudar en la selección del tratamiento en la clínica y el diseño de tratamientos combinados racionales que aborden los mecanismos de resistencia. En general, este enfoque podría ayudar a permitir estrategias personalizadas mejoradas para la terapia molecular o los regímenes de tratamiento combinatorio. Este último puede ayudar a atacar los mecanismos de tolerancia y resistencia a los medicamentos de manera temprana y profundizar la respuesta clínica para mejorar los resultados de los pacientes en el futuro.
Divulgaciones
T.G.B. es asesor de Array Biopharma, Revolution Medicines, Novartis, AstraZeneca, Takeda, Springworks, Jazz Pharmaceuticals, Relay Therapeutics, Rain Therapeutics, Engine Biosciences, y recibe fondos de investigación de Novartis, Strategia, Kinnate y Revolution Medicines.
Agradecimientos
Agradecemos a los laboratorios de Jeroen P Roose (UCSF) y Calvin J Kuo (Stanford) por sus aportes con respecto al cultivo de organoides y el desarrollo de protocolos. Además, agradecemos a Oghenekevwe M. Gbenedio (Roose lab, UCSF) por los protocolos y la entrada del establecimiento de muestras. Este proyecto de investigación se llevó a cabo con el apoyo de los NIH [U54CA224081]. F. Haderk fue apoyado por la beca postdoctoral Mildred Scheel de la Ayuda Alemana contra el Cáncer.
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | |||
| 15 mL centrifuge tubes | |||
| 500 mL Vacuum Filter/Storage Bottle System, 0.2 µm Pore 33.2 cm2 Nylon Membrane | Corning | 430773 | for both media |
| 96-Well, Cell Culture-Treated, Flat Clear Bottom Black Microplate | Corning | 3904 | |
| 96-Well, Cell Culture-Treated, Solid White Flat-Bottom Microplate | Corning | 3917 | |
| A-8301 | Tocris Bioscience | 293910 | for both media |
| Advanced DMEM/F-12 | Gibco | 12634010 | for LGM |
| B27 | Life Technologies | 12587010 | for both media |
| BioRender 2021 | https://biorender.com/ | online scientific illustration software | |
| BME2 (Cultrex RGF Basement Membrane Extract, Type 2) | R&D Systems | 353301002 | |
| Cell culture incubator (37 °C, 5% CO2) | |||
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9682 | 3D-CTG readout reagent |
| Centrifuge holding 15 mL centrifuge tubes | |||
| Deoxyribonuclease I (DNAse I) | ThermoFisher Scientific | 18047019 | |
| Dulbecco's Phosphate-Buffered Salt Solution | Corning | MT21031CV | |
| DMEM/F-12, GlutaMAX supplement | Gibco | 10565018 | for GM |
| GlutaMax | Gibco | 35050061 | for LGM |
| GraphPad Prism software (version 9.2.0) | GraphPad | statistical analysis software | |
| HEPES | Gibco | 15630080 | for both media |
| hFGF-10 | PeproTech | 100-26-100ug | for GM |
| hFGF-7 | PeproTech | 100-19-50ug | for GM |
| hNoggin | PeproTech | 120-10C-100ug | for both media |
| hRspondin | PeproTech | 120-38-100ug | for GM |
| Low retention pipette tips, 20 µL (P20) | ThermoFisher Scientific | 2149P-05-HR | |
| Low retention pipette tips, 200 µL (P200) | ThermoFisher Scientific | 2069-05-HR | |
| Regular length pipette tips, 1000 µL (P1000) | ThermoFisher Scientific | 2179-HR | |
| Multichannel pipette | |||
| N-Acetylcysteine | Fisher Scientific | 50-424-777 | for both media |
| Nicotinamide | Sigma Aldrich | N0636-100G | for both media |
| Osimertinib | Selleck Checm | S7297 | |
| Penicillin-Streptomycin-Glutamine | Gibco | 10378016 | for LGM |
| Penicillin/Streptomycin | Cytiva HyClone | SV30010 | for GM |
| Pipettes (different sizes) | |||
| Plate reader | Molecular Devices | SpectraMax M5 | equipment, alternative readers may be used |
| Primocin | Invivogen | ant-pm-1 | for GM |
| SB202190 | Selleck Chem | S1077 | for GM |
| TrypLE Express Enzyme | Gibco | 12604021 | |
| Vacuum pump and tubing | |||
| Vi-CELL XR Cell Analyzer | Beckman Coulter | Vi-CELL XR | cell analyzer / counter |
Referencias
- de Bono, J. S., Ashworth, A. Translating cancer research into targeted therapeutics. Nature. 467 (7315), 543-549 (2010).
- Dagogo-Jack, I., Shaw, A. T. Tumour heterogeneity and resistance to cancer therapies. Nature Reviews Clinical Oncology. 15 (2), 81-94 (2018).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Dijkstra, K. K., et al. Challenges in establishing pure lung cancer organoids limit their utility for personalized medicine. Cell Reports. 31 (5), 107588(2020).
- Lo, Y. -H., Karlsson, K., Kuo, C. J. Applications of organoids for cancer biology and precision medicine. Nature Cancer. 1 (8), 761-773 (2020).
- Bivona, T. G., Doebele, R. C. A framework for understanding and targeting residual disease in oncogene-driven solid cancers. Nature Medicine. 22 (5), 472-478 (2016).
- Jabs, J., et al. Screening drug effects in patient-derived cancer cells links organoid responses to genome alterations. Molecular Systems Biology. 13 (11), 955(2017).
- Tashiro, T., et al. In vivo and ex vivo cetuximab sensitivity assay using three-dimensional primary culture system to stratify KRAS mutant colorectal cancer. PLoS One. 12 (3), 0174151(2017).
- van de Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Neal, J. T., et al. Organoid Modeling of the Tumor Immune Microenvironment. Cell. 175 (7), 1972-1988 (2018).
- Hysenaj, L., et al. SARS-CoV-2 infection studies in lung organoids identify TSPAN8 as novel mediator. bioRxiv. , (2021).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300(2019).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocol in Immunology. , Appendix 3, Appendix 3B (2001).
- Pushparaj, P. N. Revisiting the micropipetting techniques in biomedical sciences: A fundamental prerequisite in good laboratory practice. Bioinformation. 16 (1), 8-12 (2020).
- Promega Corporation. CellTiter-Glo 3D Cell Viability Assay. Promega Corporation. , (2021).
- Kim, M., et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nature Communication. 10 (1), 3991(2019).
- Hu, Y., et al. Lung cancer organoids analyzed on microwell arrays predict drug responses of patients within a week. Nature Communication. 12 (1), 2581(2021).
- Shi, R., et al. Organoid cultures as preclinical models of non-small cell lung cancer. Clinical Cancer Research. 26 (5), 1162-1174 (2020).
- Collisson, E. A., et al. Comprehensive molecular profiling of lung adenocarcinoma. Nature. 511 (7511), 543-550 (2014).
- Ramalingam, S. S., et al. Overall Survival with Osimertinib in untreated, EGFR-mutated advanced NSCLC. New England Journal of Medicine. 382 (1), 41-50 (2019).
- Soria, J. -C., et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. New England Journal of Medicine. 378 (2), 113-125 (2017).
- Rotow, J., Bivona, T. G. Understanding and targeting resistance mechanisms in NSCLC. Nature Reviews Cancer. 17 (11), 637-658 (2017).
- Zhang, Z., et al. Activation of the AXL kinase causes resistance to EGFR-targeted therapy in lung cancer. Nature Genetics. 44 (8), 852-860 (2012).
- Kanda, R., et al. Erlotinib resistance in lung cancer cells mediated by integrin β1/Src/Akt-driven bypass signaling. Cancer Research. 73 (20), 6243-6253 (2013).
- Bruun, J., et al. Patient-derived organoids from multiple colorectal cancer liver metastases reveal moderate intra-patient pharmacotranscriptomic heterogeneity. Clinical Cancer Research. 26 (15), 4107-4119 (2020).
- Hafner, M., Niepel, M., Chung, M., Sorger, P. K. Growth rate inhibition metrics correct for confounders in measuring sensitivity to cancer drugs. Nature methods. 13 (6), 521-527 (2016).
- Yuki, K., Cheng, N., Nakano, M., Kuo, C. J. Organoid models of tumor immunology. Trends in Immunology. 41 (8), 652-664 (2020).
- Gerlinger, M., et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. New England Journal of Medicine. 366 (10), 883-892 (2012).
- McGranahan, N., Swanton, C. Biological and therapeutic impact of intratumor heterogeneity in cancer evolution. Cancer Cell. 27 (1), 15-26 (2015).
- Rambow, F., et al. Toward minimal residual disease-directed therapy in melanoma. Cell. 174 (4), 843-855 (2018).
- Marine, J. C., Dawson, S. J., Dawson, M. A. Non-genetic mechanisms of therapeutic resistance in cancer. Nature Reviews Cancer. 20 (12), 743-756 (2020).
- Frismantas, V., et al. Ex vivo drug response profiling detects recurrent sensitivity patterns in drug-resistant acute lymphoblastic leukemia. Blood. 129 (11), 26-37 (2017).
- Drusbosky, L. M., et al. Predicting response to BET inhibitors using computational modeling: A BEAT AML project study. Leukemia Research. 77, 42-50 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados