Method Article
EGFR変異型NSCLC患者由来オルガノイドにおける標的療法に対する感受性のプロファイリング
要約
このプロトコールは、NSCLC患者由来オルガノイドモデルにおける標的シグナル伝達阻害剤に対する薬物感受性の標準化された評価を記載している。
要約
臨床患者検体に由来する新規な3Dがんオルガノイド培養物は、がんにおける標的阻害剤に対する腫瘍内の不均一性および治療応答を評価するための重要なモデル系を表す。胃腸がんおよび膵臓がんにおける先駆的な研究は、患者近接培養システムとしての患者由来オルガノイド(PDO)の有望さを強調しており、モデルの数が増えています。同様に、他のがんタイプにおける研究は、オルガノイドモデルの確立と培養プロトコルの最適化に焦点を当てている。特に、3Dがんオルガノイドモデルは、元の腫瘍標本の遺伝的複雑さを維持し、腫瘍由来のシーケンシングデータを実験環境での遺伝的に情報に基づいた標的療法による治療に変換します。さらに、PDOは、将来的に腫瘍の耐性関連適応を克服するための合理的な併用治療の評価を促進する可能性がある。後者は、耐性の発達が最終的に標的阻害剤の治療成功を制限するため、非小細胞肺癌(NSCLC)における集中的な研究努力に焦点を当てている。NSCLC PDOを用いた治療的に標的化可能なメカニズムの早期評価は、合理的な併用治療の情報提供に役立つ可能性がある。この原稿は、NSCLC由来の3D PDOにおける標的阻害剤に対する薬物感受性の細胞培養プレートベースの評価のための標準化されたプロトコルを記載しており、併用治療および他の治療様式への潜在的な適応性を有する。
概要
発癌性ドライバーに対する個別化療法は、がん治療に革命をもたらし、患者の生存率を向上させ、治療を媒介する副作用を軽減しました1。分子診断およびシーケンシング技術における最近の進歩は、ヒト腫瘍の複雑さを浮き彫りにし、空間的および時間的不均一性が治療応答に影響を与えている2。細胞培養モデルにおけるこれらのサブクローナルの違いを繰り返すことは、長い間、そうでなければ均一な細胞株における関心のある選択された変化を調査することに限られてきた。腫瘍生検または外科的腫瘍切除から生成された新しく開発された3D PDOモデルにより、患者由来の腫瘍組織における細胞の複雑さとシグナル伝達クロストークの表現が改善されます3。このように、胃腸がんおよび膵臓がんに由来する腫瘍オルガノイドが首尾よく生成され、治療応答の遺伝的多様性および決定要因を再現している4,5,6。非小細胞肺がん(NSCLC)では、オルガノイドの開発と樹立の課題が認識されており、将来的にNSCLC PDOをより広範かつ体系的に使用できるようにするためには、培養技術と選択的培地因子の最適化が必要です7,8。
初期の薬物治療に耐える残存腫瘍細胞を標的とする組み合わせ療法の開発は、耐性の発達を阻害し、最終的には患者の生存率を改善するために不可欠です9。オルガノイド培養のアーキテクチャの複雑さを考えると、古典的な薬物応答パラメータを最適化して、薬物感受性の正確で再現性のある試験を可能にする必要があります。イメージングベースの読み出し10,11および細胞ATP存在量を測定する古典的な細胞生存率アッセイ6,12は、とりわけ、PDO培養における薬物応答をプロファイルするために利用可能である。ここでは、NSCLC PDOモデルにおける既知の臨床ドライバーに対する標的療法に対する薬物感受性を評価するための標準化されたプロトコルを開発し、記述する。
プロトコル
ヒト被験者研究については、インフォームドコンセントが得られ、UCSF内部審査委員会が承認したプロトコル(IRB、プロトコル番号:#13-12492、またはCC#17-23309)の下で組織採取が行われた。非同定された臨床検体からのオルガノイド培養物の確立は、以前に発表された方法に従って研究パートナーと共同で実施された13,14,15,16。オルガノイド培養物を、継代3以降での維持および薬物漸増実験のために回収した。以下の全てのプロトコールを、哺乳動物組織培養実験室環境において無菌条件下で実施した。
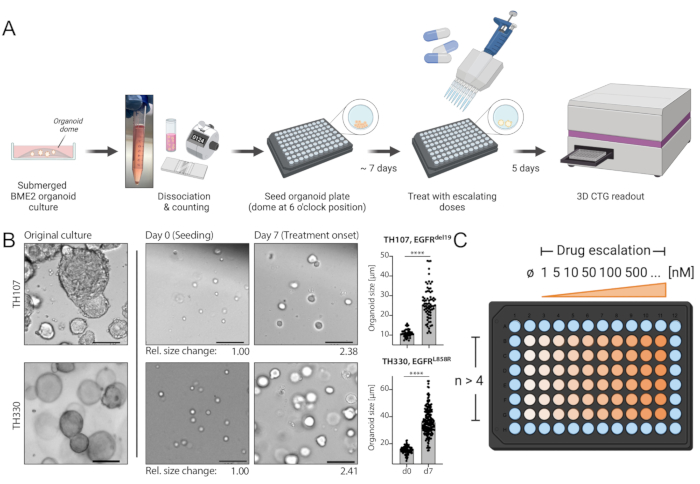
図1:ワークフローのプロトコル回路図と、この手法の重要なステップ。(A)オルガノイドの96ウェルフォーマットでの播種、播種後7日目の薬物漸増による処理、およびELISAプレートリーダーを用いた処理5日後の発光ベースの細胞生存率の読み出しを含む実験ワークフロー。(b)EGFRdel19陽性TH107およびEGFRL858R陽性TH330 NSCLCオルガノイド培養物の一例の画像。元の培養物、播種時(0日目)の細胞、及び播種後7日目(7日目)の処理開始時のオルガノイドが示されている。スケールバー = 100 μm。最初の7日間の培養期間にわたるオルガノイド直径の変化が定量化され、オルガノイドサイズの>2倍の増加を示す。0日目の平均サイズと比較した7日目のサイズの相対的な折り畳み変化を、代表的な画像の下に示します。TH107では、7日間にわたって2.38のフォールド変化が観察され、5.88日(141.12時間)の倍加時間を示す。TH330では、7日間にわたって2.41のフォールド変化が観察され、5.81日(139.42時間)の倍加時間を示す。オルガノイドサイズの変化の定量化と統計的評価(右)。統計的有意性は、不対応t検定p<0.0001によって計算されます。(C)オルガノイド96ウェルプレートフォーマットにおける薬物漸増のための治療レイアウト。ネガティブコントロールを含む技術的反復および例示的な用量の数が示される。回路図は、WebベースのイラストレーションツールであるBioRenderで作成されます。この図の拡大版を表示するには、ここをクリックしてください。
1. 実験準備
- 既報のように増殖培地(GM)を調製する15:ダルベッコの改変イーグル培地/ハムの栄養混合物F12(DMEM/F-12)とL-アラニル-L-グルタミン、100 U/mLペニシリン/ストレプトマイシン、10 mM HEPES、25 nM hRspondin、1x B27、5 mM ニコチンアミド、1.25 mM N-アセチルシステイン、500 nM A-8301、500 nM SB202190、50 μg/mLプリモシン、100 ng/mL hNoggin、100 ng/mL hFGF-10、 25 ng/mL hFGF-7 ( 材料表を参照)。
メモ:泡立たないように慎重に混合し、0.22 μmのろ過システムでろ過してください。使用前に1時間以内に37°Cに温めてください。 - 上皮成長因子(EGF)を添加せずに、既報のように低成長因子培地(LGM)を調製する16 :アドバンストダルベッコの改変イーグル培地/ハムの栄養混合物F12(DMEM/F-12)、1mM HEPES、1x L-アラニル-L-グルタミン、1xペニシリン-ストレプトマイシン-グルタミン、10mMニコチンアミド、1mM N-アセチルシステイン、1x B27、500nM A-8301、100ng/mLhNogginを添加した。
注:泡立たないように慎重に混合し、0.22 μmのフィルターでろ過してください。使用前に1時間以内に37°Cに温めてください。 - BME2(還元成長因子基底膜抽出物、タイプ2、 材料表を参照)を氷上で、4°Cで、一晩解凍する。
2. 単一細胞懸濁液の生成と細胞の播種
- 以下のステップ(2.1.1-2.1.6)で説明されるように、水中のBME2オルガノイド培養物を解離させる。
- 培養プレートから培地を慎重に吸引する。水没したBME2オルガノイド培養物に触れないでください。
注:メディア吸引は、研究者が好むように、例えば、基本的な流体吸引システムまたはピペットを使用して行うことができます。BME2埋め込みオルガノイドに触れると、オルガノイドバイオマスが失われる可能性があるため、触れないでください。 - 水中のBME2オルガノイド培養物を適切な組換え酵素でトリプシン処理する( 材料表を参照)。6ウェルプレートフォーマットで、ウェルあたり2mLを加える。BME2を上下に繰り返しピペッティングして機械的に破る。プレートを細胞培養インキュベーター内で37°Cで5分間インキュベートする。
- 懸濁液を15mL遠沈管に移し、600 x g で室温で5分間遠心分離する。
- オルガノイドペレットに触れることなく組換え酵素を注意深く吸引する。
メモ: 残留 BME2 が存在する可能性があります。必要に応じて酵素消化を繰り返します。 - オルガノイドペレットをGMに再懸濁する(ステップ1.1)。DNase I 1x 100 U/mL を加え、室温で 5 分間インキュベートします ( 材料表を参照)。
- 600 x g で室温で3分間遠心分離する。オルガノイドペレットに触れることなく慎重に媒体をピペットで落とし、廃棄する。新鮮なGMで再サスペンド。
- 培養プレートから培地を慎重に吸引する。水没したBME2オルガノイド培養物に触れないでください。
- オルガノイド単一細胞懸濁液の播種
- 新しい黒色の透明な底部96ウェルプレートを細胞培養インキュベーター内で37°Cで10分間予熱した。
注:透明なボトムプレートを使用することは、オルガノイドの成長と薬物反応を監視するために不可欠です。 - 計数のために、細胞懸濁液をPBS中で1:5希釈液(総容量:500μL)に調製し、細胞分析装置を用いて細胞懸濁液を計数する( 材料表参照)。
注: 希釈倍率 (x 5) を掛けて、最終的な細胞濃度を受け取るようにしてください。血球計数器などの代替計数方法を使用することができる。細胞生存率は、生存率染色アッセイ(例えば、トリパンBlue17を用いて)を用いてモニターされるべきである。細胞分析装置を使用して、生存率が自動的に評価される。細胞分析装置によって評価されるオルガノイド単一細胞懸濁液の生存率は≥95%であるべきである(補足図1)。 - 実験のために播種するのに必要な細胞懸濁液の体積を計算する。
注:播種濃度は1500細胞/μL BME2で、1ウェルあたり5μL BME2が必要です(総数:7500細胞/ウェル)。1つの96ウェルプレートの場合、6 x 10E5細胞が必要です。これには、オルガノイドドーム(4.5 x 10E5)と実験的余剰(合計80ウェルの計算)を備えた60ウェルの播種が含まれます。 - 複数の96ウェルプレートが実験に含まれる場合、播種する予定の各96ウェルプレートごとに1.5mLマイクロ遠心チューブに細胞懸濁液のアリコートを1つ用意する。
注:播種された96ウェルプレートあたりの実験的余剰および別々のアリコートは、BME2の取り扱いによる実験バイアスの増加を説明するために必要である。 - 計算されたように単一細胞懸濁液から細胞をアリコートし(ステップ2.2.3)、慎重に再懸濁した後、上下にピペッティングする。ペレット細胞を600 x g で室温で5分間。P200ピペットを使用して、細胞ペレットに触れずに慎重に培地を除去します。細胞ペレットを氷上に短時間(〜1分間)置き、細胞ペレットをBME2に再懸濁する。
メモ:残留メディアはBME2の構造と剛性を損なう可能性があります。すべてのメディアを慎重にピペットで拭き取ってください。細胞を氷の上に短時間置いて細胞ペレットを順応させ、細胞が凝集することなくBME2に再懸濁されるようにする。BME2を液体状態に保つために、常に氷の上に保管してください。1つの96ウェルプレートの場合、細胞ペレットの再懸濁に400μL BME2が必要である。気泡の導入を避けて、細胞ペレットを慎重に再懸濁する。 - あらかじめ温めた黒く、底の透明な96ウェルプレートを手前に傾けます。プレート細胞は1ウェルあたり5μLの細胞懸濁液を使用し、各ウェルの6時位置に細胞ドームを播種した(図1A)。 残りの内側ウェル(96ウェルプレートの列2〜10および行B〜G)に細胞ドームを播種する。
メモ: BME2 を取り扱うときは、逆ピペッティング18 をお勧めします。 - 96ウェルプレートを動かさず、播種したばかりの細胞ドームを細胞培養層流フードに室温で5分間インキュベートする。その後、プレートを細胞培養インキュベーターに移動し、37°Cで10分間インキュベートした。
- オルガノイドを含むすべてのウェル(96ウェルプレートの列2~10およびB-G行)に、ウェルあたり100μLのGMを慎重に加えます。100 μLのPBSをプレートの縁の外側のウェルに加える。
- BME2包埋オルガノイドをGM培地に培養し、細胞培養インキュベーター内で37°Cで計7日間培養した。オルガノイドの増殖を光学顕微鏡下で定期的に検査する。
注:播種から処理日までの予想される成長進行の例については、 図1B および 補足表1 を参照されたい。 - 培養の3〜4日後に培地を1回交換する:プレートを時計回りに180°回転させ(オルガノイドは現在12時位置にある)、マルチチャネル装置を使用してGMをオルガノイドドームに慎重に吸引し、新鮮なGMを加える。
- 新しい黒色の透明な底部96ウェルプレートを細胞培養インキュベーター内で37°Cで10分間予熱した。
3. 薬物治療
- EGFR変異型NSCLCオルガノイドを治療するために、選択した薬物、例えばオシメルチニブのためにLGM中の連続薬物希釈物を調製する。陰性対照(LGM培地+0.1%DMSO)を含む。播種されたウェルの数に加えて実験的余剰に応じて、すべての用量の十分な薬物アリコートを調製する。
注:標的阻害剤には、≥8用量および1nM〜10μMの範囲の希釈系列が推奨される。 - オルガノイドプレートを時計回りに180°回転させます(オルガノイドは現在12時の位置にあります)。好ましくはマルチチャネル装置を用いてGMを注意深く吸引する。
注:GMを吸引しながらオルガノイドドームに触れることは、オルガノイドバイオマスの損失と結果への影響につながる可能性があるため、避けてください。 - 1ウェルあたり100 μLのコントロール(例えば、LGM培地+ 0.1% DMSO)または薬物溶液を添加する。
注:96ウェルプレートフォーマットの薬物エスカレーション治療回路図については、 図1C を参照してください。 - 処理したオルガノイドを細胞培養インキュベーター内で37°Cで5日間インキュベートする。
4. 発光ベースの生存アッセイによる読み出し
- 収穫と生存の読み出し
- 参考文献19に従って生存アッセイを行う。
- 試薬( 材料表参照)を4°Cで一晩解凍する。 使用前に室温のウォーターバス中で30分間試薬を平衡化し、反転させて混合する。
- 等量の試薬を各ウェルに加える(1ウェルあたり100 μL)。ピペットチップをオルガノイドドームの位置に置き、上下にピペッティングして十分に混合します。暗所で室温で5分間インキュベートする。
- マルチチャンネルピペットを使用して、溶解液の約75%(150 μL)を新しい白色の不透明な底部96ウェルプレートに移します(ステップ4.1.1.2)。
注: 溶解液の 75% を新しいプレートに移すことで、アッセイ感度に影響を与えることなく、後の読み出しに気泡がないことが保証されます。 - 暗所で室温でさらに25分間インキュベートする。
- ELISAプレートリーダー(積算時間0.25-1 s/ウェル)を用いて発光を記録する( 材料表を参照)。
- 適切なフォーマット、例えば、使用されるプレートレイアウトおよび薬物のすべての生の読み取りおよび記録を含むデータテーブルでデータを保存する。
- 参考文献19に従って生存アッセイを行う。
- 統計解析ソフトを用いたデータ解析( 資料表参照)
- 新しいXYテーブルを作成し、XY形式でデータを挿入します:行(X)はネガティブコントロールであり、その後に薬物用量がエスカレートし、用量はモル濃度のログ[阻害剤]として使用されます。列 (Y) は、列と共に積み重ねられた反復を含む読み出し値です。
注:陰性対照の濃度は、最小値(対数スケールでは0は不可能である)として示すべきである(例えば、対数[阻害剤]、M = -10)。 - [ 分析] > [正規化] を選択し、次のパラメーターを使用して値を正規化します。各サブ列を個別に正規化し、Y = 0 を 0%、"各サブ列の最後の値 (または最初のうち大きい方)" を 100% として、結果をパーセンテージでグラフ化します。
- 非線形回帰>線量反応 - 対数(阻害剤)対数(阻害剤)対数阻害 - 変数勾配>>非線形回帰を選択して、正規化されたデータに非線形回帰曲線を当てはめる - >
- 結果を非線形回帰分析後に出力されたIC50 値の表として報告し、正規化されたデータ点を平均+/-標準偏差および適合回帰曲線として含む応答曲線のグラフとして報告する。
- 新しいXYテーブルを作成し、XY形式でデータを挿入します:行(X)はネガティブコントロールであり、その後に薬物用量がエスカレートし、用量はモル濃度のログ[阻害剤]として使用されます。列 (Y) は、列と共に積み重ねられた反復を含む読み出し値です。
結果
NSCLCオルガノイドの樹立においてかなりの課題が指摘されている7。したがって、肺癌オルガノイドを確立し、それらを薬物治療アッセイに使用する最近の研究を見ることはエキサイティングです20,21,22。EGFR変異はNSCLC症例の11.3%を占める23。EGFR阻害剤による標的治療は、EGFR変異型NSCLCにおける第一選択の治療選択肢であり、患者の全生存期間および治療安全性を改善している24。この研究は、EGFR変異NSCLCオルガノイドにおけるFDA承認のEGFRチロシンキナーゼ阻害剤osimertinib24,25に対する感受性を決定した。EGFR変異型NSCLCオルガノイドは、NSCLC患者の外科的切除または腫瘍生検標本から生成され、DNAシークエンシングによって示された発癌性変異を有することが確認された。上記で概説したように、EGFR変異NSCLCオルガノイドモデルは、治療開始の5日後に発光ベースの細胞生存率読み出しによって評価されたオシメルチニブおよびPDO生存率の漸増用量で処理された。EGFR変異体(EGFRdel19)陽性TH107オルガノイドは、最大阻害濃度(IC50)の半分が56nMのオシメルチニブ処理に対して感受性を示したが(図2A)、EGFR変異体(EGFRL858R)陽性TH116オルガノイドは、1μMを超えるIC50によるオシメルチニブ処理に対して耐性であった(図2B)。EGFRdel19陽性TH107 NSCLCの感受性は、細胞周期関連遺伝子シグネチャの発現の低下およびアポトーシス関連遺伝子シグネチャの発現の増加を含む、有意な転写変化を伴った(補足図2A、B)。参考として、感受性EGFRdel19陽性NSCLC細胞株PC9に対する応答データが提示される(図3A、B)。後者には、2D発光ベースの生存アッセイによる用量の増大するオシメルチニブの生存解析(図3A)およびウェスタンブロットによるEGFR-MAPKシグナル伝達のレベルにおけるシグナル伝達抑制の研究(図3B)が含まれる。全体として、このデータは、薬物応答を決定し、感受性NSCLC PDOモデルと耐性NSCLC PDOモデルを区別するための本プロトコールの精度を強調している。EGFRL858R陽性TH116オルガノイドおよび利用可能な臨床検体のさらなる分析は、可能な耐性関連変化を決定するために必要である。
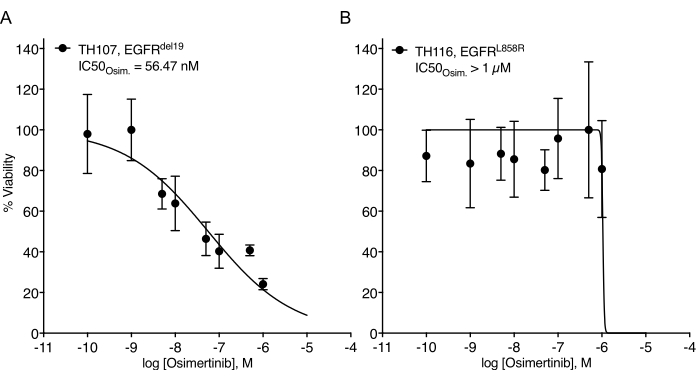
図2:オシメルチニブエスカレーションに対するEGFR変異型NSCLCオルガノイドモデルの治療応答曲線。 (a)感受性EGFRdel19陽性TH107 NSCLCオルガノイドモデルにおけるオシメルチニブ応答。(b)耐性EGFRL858R陽性TH116 NSCLCオルガノイドモデルにおけるオシメルチニブ応答。データポイントは、平均+/-標準偏差を示す正規化された値として表され、非線形回帰曲線がデータに適合されます。TH107, n = データポイントあたり6つのテクニカル反復。TH116, n = データポイントあたり4つのテクニカル反復。この図の拡大版を表示するには、ここをクリックしてください。
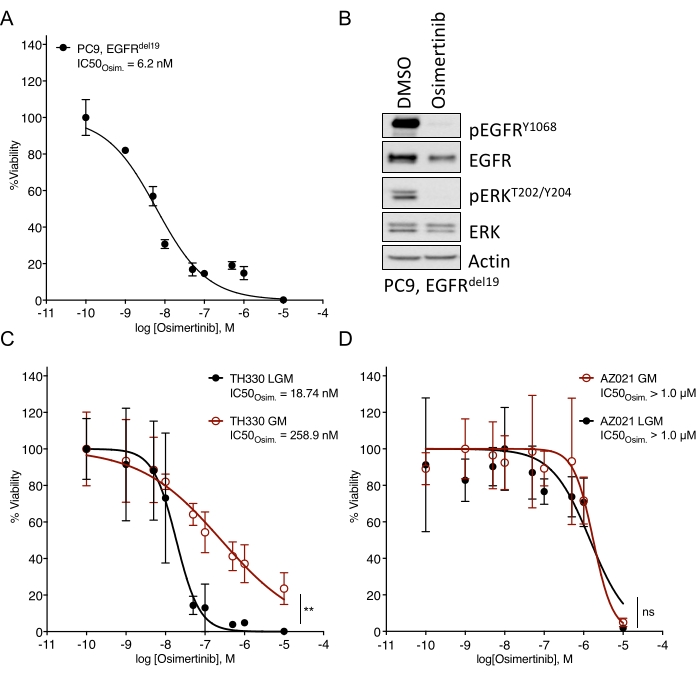
図3:異なる培地で培養した感受性EGFR変異型NSCLC細胞株およびオルガノイドモデルにおけるオシメルチニブに対する治療応答についての比較データ。 (a)感受性EGFRdel19陽性NSCLC細胞株PC9におけるオシメルチニブ応答を、標準的な2D−CTGアッセイによって決定する。(b)オシメルチニブ(2μM)による2日間処理時のPC9細胞におけるシグナル伝達抑制。(c)LGMおよびGM培地における感受性EGFRL858R陽性TH330 NSCLCオルガノイドモデル培養におけるオシメルチニブ応答。(d)LGMおよびGM培地における耐性AZ021 NSCLCオルガノイドモデルにおけるオシメルチニブ応答。AZ021における発癌性EGFRL858R変異の確認は失敗し、オシメルチニブ応答の欠如の原因となり得る。A および C-D の場合、データ ポイントは平均 +/- 標準偏差を示す正規化された値として表され、非線形回帰曲線がデータに適合します。PC9, n = データポイントあたり3つの技術反復。TH330, n = データポイントあたり5テクニカル反復。AZ021、n = データポイントあたり6回のテクニカル反復。正規化されたデータに対してウィルコクソン順位検定を実施し、統計的有意性を決定しました。TH330 (C) の場合、LGM 対 GM の場合、** p = 0.0078 です。AZ021 (D) の場合、LGM vs.GM, ns p = 0.0742.この図の拡大版を表示するには、ここをクリックしてください。
補足図1:EGFR変異オルガノイドモデルの計数および生存率評価のための代表的な細胞分析結果。 TH107およびTH107BCは、異なるオルガノイドモデルを指し、AおよびBは生物学的複製を指す。各モデルおよび生物学的反復について、3つの技術的反復がカウントされる。すべて≥95%の生存率を示しています。細胞計数中の代表的な画像が右側に提示され、堅牢な生存率および単一細胞解離を示す。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2: EGFR変異体TH107 NSCLCオルガノイドについて得られたバルクRNAシークエンシングデータを用いた遺伝子セットエンリッチメント解析(GSEA)を、未処理対照(DMSO)およびオシメルチニブで3日間処理した細胞(OSI_D3)と比較する。(A-B)標的治療により、感受性細胞は細胞周期G1停止を受け、活性増殖を停止する。G2M細胞周期遺伝子の発現が能動的増殖に関連するように、未処理対照(DMSO)における発現の名目上の富化が期待される。アポトーシス関連遺伝子については、処理細胞(OSI_D3)における名目上の富化が期待される。いずれも、オシメルチニブで処理したEGFR変異体TH107 NSCLCオルガノイドモデルにおいて確認されている:(A)ホールマークG2M発現シグネチャーに対するGSEAは、DMSO−処理細胞における富化を示す。公称エンリッチメントスコア(ファミコン):+1.708、FDR<0.0001。(b)ホールマークアポトーシス発現シグネチャーに対するGSEAは、オシメルチニブ処理細胞における富化を示す。ファミコン: -1.075, FDR: ns, 0.3275. このファイルをダウンロードするには、ここをクリックしてください。
補足図3:固定濃度の第2の添加剤阻害剤の存在下でのオシメルチニブ漸増で処置したEGFR変異体TH330オルガノイドモデルにおける組合せ薬処置。 EGFR変異NSCLCにおける耐性関連変化、すなわち、SRCおよびAXL活性化26、27、28は、SRC阻害剤サラカチニブ(100nM)またはAXL阻害剤R428(500nM)による組合せ治療によって薬理学的標的とされ、データポイント当たりn=6の技術的反復を行った。両方のコンビナトリアル治療は、治療応答の増加をもたらし、オシメルチニブとSRC阻害剤サラカチニブとの併用に有意性を有する。統計的有意性はウィルコクソン順位検定によって評価された:オシメルチニブ対オシメルチニブ+サラカチニブ、*p = 0.0195;オシメルチニブ対オシメルチニブ + R428, ns, p = 0.2500.このファイルをダウンロードするには、ここをクリックしてください。
補足表1:播種(d0)から処理7日後(d7)までのオルガノイドサイズの変化。 (A)EGFRdel19陽性NSCLCオルガノイドTH107における増殖発現。(B)EGFRL858R陽性NSCLCオルガノイドTH330における増殖発現。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
この原稿は、NSCLC由来の3D PDOモデルにおける薬物感受性を評価するための標準化されたプロトコルを開発し、記述する。薬物感受性試験に加えて、薬物感受性の違いの根底にある原因を特定するために、利用可能なオルガノイドモデルのさらなる特性評価が必要である。これには、オルガノイドおよび患者検体の遺伝子プロファイリング、ならびにオルガノイドに利用可能な他の分析、例えば、分化マーカーおよび一般的な細胞シグナル伝達バイオマーカーおよび生理学のための免疫組織化学染色などが含まれ得る13,29。
プロトコルの重要なステップ
本明細書に概説するプロトコールは、注意深く従えば正確で再現性のある薬物感受性分析を可能にする標準化されたワークフローを提供する。単一細胞懸濁液の生成中のTrypLEおよびDNAse I消化、BME2における単一細胞懸濁液の播種、治療までのオルガノイド増殖のモニタリング、培地変化、および発光ベースの細胞生存率読み出し中のBME2包埋オルガノイドの破壊および溶解。(1)オルガノイドのTrypLEベースの解離後の追加のDNAse I消化は、定期的な培養メンテナンス中にオルガノイドモデルを拡大するために必須ではないが、DNAse I消化は、オルガノイドクラスターの単一細胞懸濁液へのより良い分離および正確な細胞計数を保証するので、薬物エスカレーション実験のために播種する際に省略すべきではない。(2)BME2における単一細胞懸濁液の播種は、室温でのBME2の固化を考えると重要な工程を表す。したがって、一度に最大 1 ~ 2 行を播種する必要があり、追加の行を播種する前にサンプルを氷の上に置く必要があります。注目すべきは、均質な細胞懸濁液を可能にするために、播種を継続する際に細胞を上下にピペットで固定する必要があることである。(3)オルガノイドの増殖は、播種から施術までの7日間、注意深く観察する必要がある。予想される開発の例を 図 1B および 補足表 1 に示します。注目すべきは、 図1B に示されているように、明視野顕微鏡および画像解析によってオルガノイドサイズの変化を評価することによって、オルガノイドの成長および倍加時間の違いの正確な評価を可能にする可能性がある。倍増時間は、最近文献で議論されているように、薬物反応に影響を与える可能性があります30。オルガノイド増殖速度が提示された例を有意に超える場合、治療開始までのより短い拡張時間およびより短い治療期間が考慮され得る。(4)また、培地を交換する際には、オルガノイドを吸引しないように特別な注意を払わなければなりません。BME2埋め込みオルガノイドの播種位置は6時位置で、プレートを時計回りに180°回転させ、オルガノイドの反対位置で培地を吸引すると、メディアの安全な吸引を可能にします。(5)最後に、生存中のBME2埋め込みオルガノイドの徹底的な溶解は、正確な結果を記録するために不可欠である。メーカーの指示に従って、サンプルは、適切な溶解を確実にするために、理想的には濾過されていない先端を使用して、繰り返し上下にピペットで固定する必要があります。インキュベーション時間は、記載されているように従う必要があります。さらに、ELISAプレートリーダーを使用した最終読み出しのために溶解液の75%を(総容量の代わりに)白色の不透明な底部96ウェルプレートに移すことで、各ウェルに同じ体積が保証され、激しいピペッティングによって導入できる気泡がないことが保証されるため、適切な評価が可能になります。
注目すべきは、BME2包埋オルガノイド培養における薬物応答のプロファイリングは、通常の細胞株培養で観察されるよりも高い標準偏差を示す可能性がある(図2、 図3A)。より高い標準偏差は、BME2を扱う際の播種におけるわずかな変動の可能性の増加、および最初の7日間の成長期間にわたるウェル間の個々のオルガノイド増殖速度の違いを含むいくつかの要因に基づいている。したがって、薬物濃度あたり4つ以上の技術的反復が播種されるべきである。
最も重要なのは、発癌性ドライバー変異および正常な気道上皮細胞による限定的な汚染を有する悪性細胞の存在を注意深く評価しなければならないことである。NSCLC樹立における課題は、正常な気道上皮細胞の伸長に有利に働く可能性があります7。発癌性ドライバー変異の存在を確認するためのコピー数プロファイリングまたはPCRおよびシーケンシングベースのアプローチは、NSCLCオルガノイド培養物の品質を保証するために選択される方法である。
メソッドの変更とトラブルシューティング
基本培地溶液に添加された培地およびそれぞれの成長因子は、標的阻害剤に対する薬物応答に有意に影響を及ぼす可能性がある。それらは、薬物応答に影響を与え制限するバイパス受容体およびシグナル伝達経路(例えば、FGF、HGF、EGF)を活性化する26。成長因子が豊富でカスタマイズされた培地はオルガノイド培養の拡大に最適かもしれないが、薬物のエスカレーションおよび感受性評価は、上で概説したように、減少した成長因子培地で実施されるべきである。これは、異なる媒体製剤と薬物応答データを比較した内部経験に基づいています(図3C)。培地溶液は、特定の薬物処理に対する感受性の程度に影響を与え、IC50 値をシフトさせる可能性がありますが、培地の配合に関係なく、感度または耐性の堅牢な表現型は明らかです(図3C、D)。さらに、培地製剤における一般的な一貫性と、オルガノイド培養物全体にわたる薬物応答のプロファイリングが推奨され、濃度あたり4つ以上の技術的反復を播種する必要があります。これは、感度 対感度の範囲をベンチマークするために特に重要です。対象の阻害剤に対する耐性。
方法の制限事項
ここで提示されたプロトコールは、患者由来の癌細胞が培養されるときの標的阻害剤に対するNSCLC 3D癌オルガノイドモデルの感受性を記載する。経路阻害に関する薬力学的分析、およびドライバー癌遺伝子および二次変異の存在に関するシーケンシング分析を含む追加の実験は、薬剤耐性および感受性の詳細な特性評価のために必要である。また、腫瘍微小環境における非癌傍観細胞による相互作用や分泌因子に由来する微小環境刺激などの傍観因子は考慮されておらず、免疫細胞や間質細胞との共培養オルガノイドモデルを試みる際には新規なプロトコールが必要である。最近の研究は、腫瘍微小環境相互作用を再現し、抗PD-L1治療などの免疫チェックポイント阻害剤に対する応答をプロファイルするためのオルガノイドモデルの使用を強調しています13,31。
既存/代替方法に対する本方法の重要性
3Dがんオルガノイドモデルは、元の腫瘍に存在する治療応答の遺伝的多様性と決定要因を再現しています4,5,6。特に、空間的および時間的不均一性は腫瘍の進化を促進し、腫瘍サブクローンの出現と逐次的発生が並行して起こり得る32,33。腫瘍内の不均一性は、治療圧力下でのより弾力性のある腫瘍細胞の選択にとって有意である9、34、35。ここで提供されるプロトコルは、患者と近接するサンプル中の標的阻害剤による治療に対する感受性の迅速な評価を可能にする。したがって、オルガノイドモデルは、遺伝的多様性を欠くより従来の均質な細胞株モデル、または細胞株または患者由来異種移植片を用いた長期研究よりも利点を有する。さらに、現在のプロトコルは、コストおよび分析能力に関する制限をほとんど伴わずに、複数の治療アームおよび組み合わせ治療アプローチにスケールアップすることを可能にする。そのため、主標的阻害剤をエスカレーションしながら、目的の第2の薬剤を一定用量で添加し、それを主標的阻害剤単独のエスカレーションと比較することで、必要な追加バイオマスを最小限に抑えながら、潜在的な組み合わせ効果を効率的に評価することができます(補足図3)。オルガノイドの発生および薬物応答をモニターするために使用されるイメージングベースの評価と比較して、ここで説明する発光ベースの細胞生存アッセイは、最小限の装置およびトレーニングで同様の感度を有する。
特定の研究分野におけるこの方法の重要性と潜在的な応用
患者検体からがんオルガノイドモデルを確立し、その後の薬剤感受性プロファイリングを可能にする標準化されたパイプラインを開発することは、臨床応用可能性の高い可能性を秘めています。エクスビボ薬理学的プロファイリングは、腫瘍の脆弱性および耐性関連特徴を検出する際に認識されており、患者の治療応答と相関している36,37。重要なことに、薬物感受性のエクスビボプロファイリングは、診療所における治療選択および耐性メカニズムに対処する合理的な併用治療の設計に役立つ可能性がある。全体として、このアプローチは、分子療法または組み合わせ治療レジメンのための改善されたパーソナライズされた戦略を可能にするのに役立つ可能性がある。後者は、薬物耐性および耐性メカニズムを早期に標的化し、臨床反応を深めて将来の患者の転帰を改善するのに役立つ可能性がある。
開示事項
T.G..B.は、Array Biopharma、Revolution Medicines、Novartis、AstraZeneca、Takeda、Springworks、Jazz Pharmaceuticals、Relay Therapeutics、Rain Therapeutics、Engine Biosciencesのアドバイザーであり、Novartis、Strategia、Kinnate、Revolution Medicinesから研究資金を受けています。
謝辞
我々は、オルガノイド培養及びプロトコル開発に関する彼らの意見について、Jeroen P Roose(UCSF)及びCalvin J Kuo(スタンフォード)の研究室に感謝する。我々はさらに、Oghenekevwe M. Gbenedio(Roose lab, UCSF)のプロトコル及びサンプル確立のインプットに感謝する。本研究プロジェクトは、NIH [U54CA224081]の支援を受けて実施されました。F. Haderkは、German Cancer AidのMildred Scheelポスドクフェローシップの支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | |||
| 15 mL centrifuge tubes | |||
| 500 mL Vacuum Filter/Storage Bottle System, 0.2 µm Pore 33.2 cm2 Nylon Membrane | Corning | 430773 | for both media |
| 96-Well, Cell Culture-Treated, Flat Clear Bottom Black Microplate | Corning | 3904 | |
| 96-Well, Cell Culture-Treated, Solid White Flat-Bottom Microplate | Corning | 3917 | |
| A-8301 | Tocris Bioscience | 293910 | for both media |
| Advanced DMEM/F-12 | Gibco | 12634010 | for LGM |
| B27 | Life Technologies | 12587010 | for both media |
| BioRender 2021 | https://biorender.com/ | online scientific illustration software | |
| BME2 (Cultrex RGF Basement Membrane Extract, Type 2) | R&D Systems | 353301002 | |
| Cell culture incubator (37 °C, 5% CO2) | |||
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9682 | 3D-CTG readout reagent |
| Centrifuge holding 15 mL centrifuge tubes | |||
| Deoxyribonuclease I (DNAse I) | ThermoFisher Scientific | 18047019 | |
| Dulbecco's Phosphate-Buffered Salt Solution | Corning | MT21031CV | |
| DMEM/F-12, GlutaMAX supplement | Gibco | 10565018 | for GM |
| GlutaMax | Gibco | 35050061 | for LGM |
| GraphPad Prism software (version 9.2.0) | GraphPad | statistical analysis software | |
| HEPES | Gibco | 15630080 | for both media |
| hFGF-10 | PeproTech | 100-26-100ug | for GM |
| hFGF-7 | PeproTech | 100-19-50ug | for GM |
| hNoggin | PeproTech | 120-10C-100ug | for both media |
| hRspondin | PeproTech | 120-38-100ug | for GM |
| Low retention pipette tips, 20 µL (P20) | ThermoFisher Scientific | 2149P-05-HR | |
| Low retention pipette tips, 200 µL (P200) | ThermoFisher Scientific | 2069-05-HR | |
| Regular length pipette tips, 1000 µL (P1000) | ThermoFisher Scientific | 2179-HR | |
| Multichannel pipette | |||
| N-Acetylcysteine | Fisher Scientific | 50-424-777 | for both media |
| Nicotinamide | Sigma Aldrich | N0636-100G | for both media |
| Osimertinib | Selleck Checm | S7297 | |
| Penicillin-Streptomycin-Glutamine | Gibco | 10378016 | for LGM |
| Penicillin/Streptomycin | Cytiva HyClone | SV30010 | for GM |
| Pipettes (different sizes) | |||
| Plate reader | Molecular Devices | SpectraMax M5 | equipment, alternative readers may be used |
| Primocin | Invivogen | ant-pm-1 | for GM |
| SB202190 | Selleck Chem | S1077 | for GM |
| TrypLE Express Enzyme | Gibco | 12604021 | |
| Vacuum pump and tubing | |||
| Vi-CELL XR Cell Analyzer | Beckman Coulter | Vi-CELL XR | cell analyzer / counter |
参考文献
- de Bono, J. S., Ashworth, A. Translating cancer research into targeted therapeutics. Nature. 467 (7315), 543-549 (2010).
- Dagogo-Jack, I., Shaw, A. T. Tumour heterogeneity and resistance to cancer therapies. Nature Reviews Clinical Oncology. 15 (2), 81-94 (2018).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Dijkstra, K. K., et al. Challenges in establishing pure lung cancer organoids limit their utility for personalized medicine. Cell Reports. 31 (5), 107588 (2020).
- Lo, Y. -. H., Karlsson, K., Kuo, C. J. Applications of organoids for cancer biology and precision medicine. Nature Cancer. 1 (8), 761-773 (2020).
- Bivona, T. G., Doebele, R. C. A framework for understanding and targeting residual disease in oncogene-driven solid cancers. Nature Medicine. 22 (5), 472-478 (2016).
- Jabs, J., et al. Screening drug effects in patient-derived cancer cells links organoid responses to genome alterations. Molecular Systems Biology. 13 (11), 955 (2017).
- Tashiro, T., et al. In vivo and ex vivo cetuximab sensitivity assay using three-dimensional primary culture system to stratify KRAS mutant colorectal cancer. PLoS One. 12 (3), 0174151 (2017).
- van de Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Neal, J. T., et al. Organoid Modeling of the Tumor Immune Microenvironment. Cell. 175 (7), 1972-1988 (2018).
- Hysenaj, L., et al. SARS-CoV-2 infection studies in lung organoids identify TSPAN8 as novel mediator. bioRxiv. , (2021).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300 (2019).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocol in Immunology. , (2001).
- Pushparaj, P. N. Revisiting the micropipetting techniques in biomedical sciences: A fundamental prerequisite in good laboratory practice. Bioinformation. 16 (1), 8-12 (2020).
- Promega Corporation. CellTiter-Glo 3D Cell Viability Assay. Promega Corporation. , (2021).
- Kim, M., et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nature Communication. 10 (1), 3991 (2019).
- Hu, Y., et al. Lung cancer organoids analyzed on microwell arrays predict drug responses of patients within a week. Nature Communication. 12 (1), 2581 (2021).
- Shi, R., et al. Organoid cultures as preclinical models of non-small cell lung cancer. Clinical Cancer Research. 26 (5), 1162-1174 (2020).
- Collisson, E. A., et al. Comprehensive molecular profiling of lung adenocarcinoma. Nature. 511 (7511), 543-550 (2014).
- Ramalingam, S. S., et al. Overall Survival with Osimertinib in untreated, EGFR-mutated advanced NSCLC. New England Journal of Medicine. 382 (1), 41-50 (2019).
- Soria, J. -. C., et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. New England Journal of Medicine. 378 (2), 113-125 (2017).
- Rotow, J., Bivona, T. G. Understanding and targeting resistance mechanisms in NSCLC. Nature Reviews Cancer. 17 (11), 637-658 (2017).
- Zhang, Z., et al. Activation of the AXL kinase causes resistance to EGFR-targeted therapy in lung cancer. Nature Genetics. 44 (8), 852-860 (2012).
- Kanda, R., et al. Erlotinib resistance in lung cancer cells mediated by integrin β1/Src/Akt-driven bypass signaling. Cancer Research. 73 (20), 6243-6253 (2013).
- Bruun, J., et al. Patient-derived organoids from multiple colorectal cancer liver metastases reveal moderate intra-patient pharmacotranscriptomic heterogeneity. Clinical Cancer Research. 26 (15), 4107-4119 (2020).
- Hafner, M., Niepel, M., Chung, M., Sorger, P. K. Growth rate inhibition metrics correct for confounders in measuring sensitivity to cancer drugs. Nature methods. 13 (6), 521-527 (2016).
- Yuki, K., Cheng, N., Nakano, M., Kuo, C. J. Organoid models of tumor immunology. Trends in Immunology. 41 (8), 652-664 (2020).
- Gerlinger, M., et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. New England Journal of Medicine. 366 (10), 883-892 (2012).
- McGranahan, N., Swanton, C. Biological and therapeutic impact of intratumor heterogeneity in cancer evolution. Cancer Cell. 27 (1), 15-26 (2015).
- Rambow, F., et al. Toward minimal residual disease-directed therapy in melanoma. Cell. 174 (4), 843-855 (2018).
- Marine, J. C., Dawson, S. J., Dawson, M. A. Non-genetic mechanisms of therapeutic resistance in cancer. Nature Reviews Cancer. 20 (12), 743-756 (2020).
- Frismantas, V., et al. Ex vivo drug response profiling detects recurrent sensitivity patterns in drug-resistant acute lymphoblastic leukemia. Blood. 129 (11), 26-37 (2017).
- Drusbosky, L. M., et al. Predicting response to BET inhibitors using computational modeling: A BEAT AML project study. Leukemia Research. 77, 42-50 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved