Method Article
Профилирование чувствительности к таргетной терапии в органоидах EGFR-мутантного НМРЛ, полученных из пациента
В этой статье
Резюме
Этот протокол описывает стандартизированную оценку чувствительности лекарственного средства к целевым сигнальным ингибиторам в органоидных моделях, полученных от пациентов с НМРЛ.
Аннотация
Новые 3D-культуры органоидов рака, полученные из клинических образцов пациентов, представляют собой важную модельную систему для оценки внутриопухолевой гетерогенности и реакции лечения на целевые ингибиторы при раке. Новаторская работа в области рака желудочно-кишечного тракта и поджелудочной железы подчеркнула перспективность органоидов, полученных от пациента (PDO), в качестве системы культуры, близкой к пациенту, с появлением все большего числа моделей. Аналогичным образом, работа в других типах рака была сосредоточена на создании органоидных моделей и оптимизации протоколов культивирования. Примечательно, что 3D-модели органоидов рака поддерживают генетическую сложность оригинальных образцов опухолей и, таким образом, переводят данные секвенирования опухоли в лечение генетически информированными целевыми методами лечения в экспериментальных условиях. Кроме того, PDO могут способствовать оценке рациональных комбинированных методов лечения для преодоления резистентной адаптации опухолей в будущем. Последний фокусируется на интенсивных исследовательских усилиях при немелкоклеточном раке легкого (НМРЛ), поскольку развитие резистентности в конечном итоге ограничивает успех лечения целевыми ингибиторами. Ранняя оценка терапевтически целенаправленных механизмов с использованием ФДО НМРЛ может помочь в рациональном комбинированном лечении. В этой рукописи описывается стандартизированный протокол оценки чувствительности препарата к целевым ингибиторам в 3D-PDO, полученных из НМРЛ, с потенциальной адаптивностью к комбинированному лечению и другим методам лечения.
Введение
Персонализированные методы лечения онкогенных факторов произвели революцию в лечении рака, улучшив выживаемость пациентов и уменьшив побочные эффекты, опосредованные лечением1. Последние достижения в области молекулярной диагностики и технологий секвенирования подчеркнули сложность опухолей человека, причем пространственная и временная гетерогенность влияет на реакцию на лечение2. Повторение этих субклональных различий в моделях клеточных культур уже давно ограничивается исследованием отдельных изменений, представляющих интерес в однородных клеточных линиях. Недавно разработанные 3D-модели PDO, полученные из биопсии опухоли или хирургических резекций опухоли, позволяют улучшить представление клеточной сложности и передачу перекрестных помех в опухолевой ткани, полученной от пациента3. Таким образом, опухолевые органоиды, полученные из рака желудочно-кишечного тракта и поджелудочной железы, были успешно сгенерированы и повторяют генетическое разнообразие и детерминанты ответа на лечение4,5,6. При немелкоклеточном раке легкого (НМРЛ) признаются проблемы развития и становления органоидов, а также оптимизация методов культивирования и селективных медиа-факторов для обеспечения более широкого и систематического использования ПДО НМРЛ в будущем7,8.
Разработка комбинаторной терапии, нацеленной на остаточные опухолевые клетки, которые выдерживают первоначальное медикаментозное лечение, имеет важное значение для ингибирования развития резистентности и, в конечном счете, для улучшения выживаемости пациентов9. Учитывая архитектурную сложность органоидных культур, классические параметры лекарственного ответа должны быть оптимизированы, чтобы обеспечить точное и воспроизводимое тестирование чувствительности к лекарственным средствам. Показания на основе визуализации10,11 и классические анализы жизнеспособности клеток, измеряющие содержание клеточного АТФ6,12, среди других методов, доступны для профилирования реакций на лекарства в культурах PDO. Здесь мы разрабатываем и описываем стандартизированный протокол для оценки чувствительности лекарств к таргетной терапии против известных клинических факторов в моделях НМРЛ PDO.
протокол
Для исследований на людях было получено информированное согласие и проведен сбор тканей в соответствии с протоколами, утвержденными Советом по внутреннему обзору UCSF (IRB, протокол No: #13-12492 или CC#17-23309). Создание органоидных культур из деидентифицированных клинических образцов проводилось в сотрудничестве с партнерами по исследованию по ранее опубликованным методам13,14,15,16. Органоидные культуры были извлечены для экспериментов по поддержанию и эскалации наркотиков в проходе три или позже. Все следующие протоколы выполнялись в асептических условиях в лабораторной среде культивирования тканей млекопитающих.
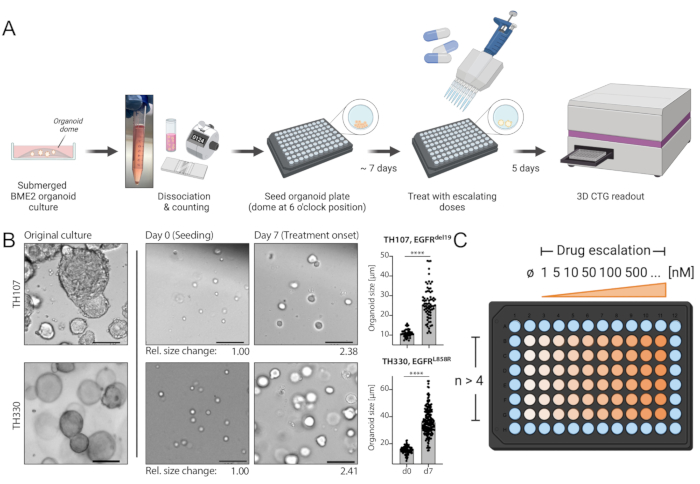
Рисунок 1: Схема протокола рабочего процесса и критические шаги в технике. (A) Экспериментальный рабочий процесс, включающий посев органоидов в формате 96 лунок, лечение эскалацией препарата через 7 дней после посева и считывание выживаемости клеток на основе люминесценции через 5 дней после обработки с использованием считывателя пластин ИФА. (B) Пример изображения EGFRdel19-положительных TH107 и EGFRL858R-положительных TH330 NSCLC органоидных культур. Показаны оригинальные культуры, клетки в момент посева (день 0) и органоиды при начале обработки через 7 дней после посева (7 день). Шкала шкалы = 100 мкм. Изменения диаметра органоидов в течение начального 7-дневного периода культивирования количественно оцениваются и указывают на > 2-кратное увеличение размера органоида. Относительные изменения размеров в 7-й день по сравнению со средним размером в день 0 представлены ниже репрезентативных изображений. Для TH107 наблюдается кратное изменение на 2,38 в течение 7 дней, что указывает на время удвоения 5,88 дня (141,12 ч). Для TH330 наблюдается сдвиговое изменение на 2,41 в течение 7 дней, что указывает на время удвоения 5,81 дня (139,42 ч). Представлена количественная оценка изменений размеров органоидов и статистическая оценка (справа). Статистическая значимость рассчитывается методом непарного t-теста, p < 0,0001. (C) Схема лечения для эскалации наркотиков в органоидном формате 96-луночной пластины. Указано количество технических реплик и примерных доз, включая отрицательный контроль. Схемы создаются с помощью BioRender, веб-инструмента иллюстрации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Экспериментальные препараты
- Приготовьте питательную среду (ГМ), как сообщалось ранее15: питательную смесь F12 (DMEM/F-12) С L-аланил-L-глютамином, дополненной 100 ЕД/мл пенициллина/стрептомицина, 10 мМ HEPES, 25 нМ гРспондином, 1x B27, 5 мМ никотинамида, 1,25 мМ N-ацетилцистеина, 500 нМ A-8301, 500 нМ SB202190, 50 мкг/мл Примоцина, 100 нг/мл гНоггина, 100 нг/мл hFGF-10, 25 нг/мл hFGF-7 (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Осторожно перемешайте, чтобы избежать вспенивания, и фильтруйте через систему фильтрации 0,22 мкм. Нагревайте среду до 37 °C в течение 1 ч перед использованием. - Приготовьте среду с низким фактором роста (LGM), как сообщалось ранее16 , без добавления эпидермального фактора роста (EGF): питательная смесь F12 (DMEM/F-12), дополненная 1 мМ HEPES, 1x L-аланил-L-глутамином, 1x пенициллин-стрептомицин-глутамин, 10 мМ никотинамида, 1 мМ N-ацетилцистеина, 1x B27, 500 нМ A-8301, 100 нг/мл hNoggin.
ПРИМЕЧАНИЕ: Осторожно перемешайте, чтобы избежать вспенивания, и процедите через фильтр 0,22 мкм. Нагревайте среду до 37 °C в течение 1 ч перед использованием. - Оттаивание BME2 (экстракт базальной мембраны с пониженным фактором роста, тип 2, см. Таблицу материалов) на льду при 4 °C в течение ночи.
2. Генерация одноклеточной суспензии и посев клеток
- Диссоциировать погруженную органоидную культуру BME2, как описано на следующих этапах (2.1.1-2.1.6).
- Тщательно аспирируйте среды из культуральных пластин. Избегайте прикосновения к погруженной в воду органоидной культуре BME2.
ПРИМЕЧАНИЕ: Аспирация среды может быть выполнена так, как предпочитает исследователь, например, с помощью базовой системы аспирации жидкости или с использованием пипетки. Избегайте прикосновения к органоидам, встроенным в BME2, так как это может привести к потере органоидной биомассы. - Трипсинизировать погруженную органоидную культуру BME2 подходящим рекомбинантным ферментом (см. Таблицу материалов). В формате плиты с 6 лунками добавьте 2 мл на лунку. Механически разрушайте BME2 путем многократного пипетирования вверх и вниз. Инкубировать пластины при 37 °C в инкубаторе клеточных культур в течение 5 мин.
- Переложите суспензию в 15 мл центрифужной трубки и центрифугу при 600 х г в течение 5 мин при комнатной температуре.
- Аспирировать рекомбинантный фермент осторожно, не прикасаясь к органоидной грануле.
ПРИМЕЧАНИЕ: Остаточный BME2 может присутствовать. При необходимости повторите переваривание фермента. - Повторное суспендирование органоидной гранулы в ГМ (стадия 1.1). Добавьте ДНКазу I 1x 100 Ед/мл и инкубируйте в течение 5 мин при комнатной температуре (см. Таблицу материалов).
- Центрифуга при 600 х г в течение 3 мин при комнатной температуре. Пипетку аккуратно снять со среды, не касаясь органоидной гранулы и выбросить. Повторное суспендирование в свежем ГМ.
- Тщательно аспирируйте среды из культуральных пластин. Избегайте прикосновения к погруженной в воду органоидной культуре BME2.
- Посев органоидной одноклеточной суспензии
- Предварительно нагрейте новую черную 96-луночную пластину с прозрачным дном при 37 °C в инкубаторе клеточных культур в течение 10 мин.
ПРИМЕЧАНИЕ: Использование прозрачных нижних пластин имеет важное значение для мониторинга роста органоидов и лекарственной реакции. - Для подсчета подготовьте разбавление клеточной суспензии 1:5 в PBS (общий объем: 500 мкл) и подсчитайте клеточную суспензию с помощью клеточного анализатора (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Обязательно умножьте на коэффициент разбавления (х 5), чтобы получить конечную концентрацию клетки. Могут быть использованы альтернативные методы подсчета, такие как гемоцитометр. Жизнеспособность клеток следует контролировать с помощью анализа жизнеспособности окрашивания (например, с помощью Trypan Blue17). С помощью клеточного анализатора жизнеспособность оценивается автоматически. Жизнеспособность органоидных одноклеточных суспензий, оцениваемых клеточным анализатором, должна составлять ≥95% (дополнительный рисунок 1). - Рассчитайте объем клеточной суспензии, необходимой для посева для эксперимента.
ПРИМЕЧАНИЕ: Концентрация посева составляет 1500 клеток/мкл BME2, при этом на скважину необходимо 5 мкл BME2 (Общее количество: 7500 клеток/лунка). Для одной 96-луночной пластины требуется 6 x 10E5 ячеек. Это включает в себя посев 60 скважин с органоидными куполами (4,5 х 10E5) и экспериментальным излишком (расчет в общей сложности 80 скважин). - Подготовьте одну аликвоту клеточной суспензии в микроцентрифужной трубке объемом 1,5 мл на каждую 96-луночную пластину, которую планируется засеять, если в эксперимент включено несколько пластин из 96 скважин.
ПРИМЕЧАНИЕ: Экспериментальные излишки и отдельные аликвоты на посеянную 96-луночную пластину необходимы для учета повышенного экспериментального смещения из-за обработки BME2. - Ячейки аликвоты из одноэлементной суспензии, рассчитанной (этап 2.2.3) после тщательного повторного суспендирования путем пипетирования вверх и вниз. Пеллетные ячейки по 600 х г в течение 5 мин при комнатной температуре. Осторожно удалите среду с помощью пипетки P200, не касаясь ячейки гранулы. Поместите ячейку гранулы на лед в ближайшее время (~1 мин) и повторно суспендируйте ячейку гранулы в BME2.
ПРИМЕЧАНИЕ: Остаточные среды могут поставить под угрозу структуру и жесткость BME2. Пипетка осторожно снимает все СМИ. Поместите клетки на лед в ближайшее время, чтобы акклиматизировать гранулу клетки и позволить ячейкам быть повторно суспендированными в BME2 без слипания. Держите BME2 на льду постоянно, чтобы он оставался в жидком состоянии. Для одной 96-луночной пластины необходимо 400 мкл BME2 для повторного суспендирования гранулы ячейки. Тщательно повторно суспендируйте клеточные гранулы, избегая введения пузырьков. - Наклоните к себе предварительно нагретую черную 96-луночную пластину с прозрачным дном. Пластинчатые ячейки, использующие 5 мкл клеточной суспензии на скважину и посевные клеточные купола в положении «6 часов» каждой скважины (рисунок 1А). Засейте клеточные купола в оставшихся внутренних колодцах (колонны 2-10 и ряды B-G плиты из 96 скважин).
ПРИМЕЧАНИЕ: При обращении с BME2 рекомендуется обратная пипетка18 . - Не перемещайте 96-луночную пластину и инкубируйте свежепосеянные клеточные купола в ламинарной вытяжке клеточной культуры в течение 5 мин при комнатной температуре. Затем переместите пластину в инкубатор клеточной культуры и инкубируйте ее в течение 10 мин при 37 °C.
- Осторожно добавляйте 100 мкл ГМ на скважину ко всем скважинам, содержащим органоиды (колонки 2-10 и ряды B-G 96-луночной пластины). Добавьте 100 мкл PBS к наружным колодцам на краю пластины.
- Культивирование встроенных органоидов BME2 в ГМ-средах при 37 °C в инкубаторе клеточной культуры в общей сложности 7 дней. Регулярно осматривайте рост органоидов под световым микроскопом.
ПРИМЕЧАНИЕ: Пожалуйста, обратитесь к рисунку 1B и дополнительной таблице 1 для примера ожидаемого прогресса роста от посева до дня обработки. - Смените среду один раз после 3-4 дней посева: поверните пластину по часовой стрелке на 180° (органоиды теперь в положении «12 часов»), осторожно аспирируйте ГМ из противоположного положения в органоидный купол с помощью многоканального аппарата, если таковой имеется, а затем добавьте свежий ГМ.
- Предварительно нагрейте новую черную 96-луночную пластину с прозрачным дном при 37 °C в инкубаторе клеточных культур в течение 10 мин.
3. Медикаментозное лечение
- Приготовьте серийное разведение препарата в ЛГМ для препарата выбора, например, осимертиниба, для лечения EGFR-мутантных органоидов НМРЛ. Включите отрицательный контроль (LGM носитель + 0,1% DMSO). Подготовьте достаточное количество лекарственных аликвот всех доз в соответствии с количеством засеянных лунок плюс экспериментальный избыток.
ПРИМЕЧАНИЕ: Для целевых ингибиторов рекомендуется серия разведения, включающая дозы ≥8 и в диапазоне от 1 нМ-10 мкМ. - Поверните органоидную пластину по часовой стрелке на 180° (органоиды теперь в положении «12 часов»). Осторожно аспирировать ГМ с помощью многоканального аппарата предпочтительно.
ПРИМЕЧАНИЕ: Избегайте прикосновения к органоидному куполу во время аспирации ГМ, так как это может привести к потере органоидной биомассы и результатам воздействия. - Добавляют 100 мкл контрольного (например, среды LGM + 0,1% ДМСО) или раствора препарата на лунку.
ПРИМЕЧАНИЕ: Пожалуйста, обратитесь к рисунку 1С для схемы лечения эскалации наркотиков в формате 96-луночной пластины. - Инкубировать обработанные органоиды при 37 °C в инкубаторе клеточной культуры в течение 5 дней.
4. Считывание с помощью анализа выживания на основе люминесценции
- Считывание урожая и выживания
- Выполните анализ на выживание в соответствии с Reference19.
- Реагент размораживания (см. Таблицу материалов) в течение ночи при 4 °C. Уравновешивают реагент на водяной бане комнатной температуры за 30 мин перед применением и перемешивают путем инвертирования.
- Добавьте равный объем реагента в каждую лунку (100 мкл на лунку). Тщательно перемешайте путем пипетки вверх и вниз, с наконечником пипетки, расположенным в положении купола органоида. Инкубировать в течение 5 мин при комнатной температуре в темное время суток.
- Используя многоканальную пипетку, перенесите приблизительно 75% (150 мкл) лизата (шаг 4.1.1.2) на новую белую непрозрачную 96-луночную пластину.
ПРИМЕЧАНИЕ: Перенос 75% лизатов на новую пластину обеспечивает отсутствие пузырьков в более позднем считывании без влияния на чувствительность анализа. - Инкубировать еще 25 мин при комнатной температуре в темное время суток.
- Запись люминесценции с помощью считывателя пластин ИФА (время интеграции 0,25-1 с/на лунку) (см. Таблицу материалов).
- Сохранять данные в соответствующем формате, например, таблицу данных, содержащую все необработанные считывания и записи макета пластины и используемых лекарств.
- Выполните анализ на выживание в соответствии с Reference19.
- Анализ данных с помощью программного обеспечения для статистического анализа (см. Таблицу материалов)
- Создайте новую XY-таблицу и вставьте данные в формате XY: строки (X) являются отрицательным контролем, за которым следуют возрастающие дозы лекарств, с дозами в качестве логарифма [ингибитора] в молярной концентрации. Столбцы (Y) — это значения считывания, которые включают реплики, сложенные вместе со столбцами.
ПРИМЕЧАНИЕ: Концентрация отрицательного контрольного элемента должна быть указана как минимальное значение (заданное значение 0 невозможно в логарифмической шкале), например, log [Ингибитор], M = -10. - Нормализуйте значения, выбрав Анализ > Нормализовать и используя следующие параметры: нормализуйте каждую подколонку отдельно, Y = 0 как 0 %, «последнее значение в каждой подколонке (или первое, в зависимости от того, что больше)» как 100 %, приводит в процентах, график результатов.
- Подогнать кривую нелинейной регрессии к нормализованным данным, выбрав Анализ анализов > XY > Нелинейная регрессия > Реакция на дозу - Ингибирование > log (ингибитор) vs . нормализованный ответ -- Переменный наклон.
- Отчет о результатах в виде таблицы значений IC50 , полученных после нелинейного регрессионного анализа, и графика кривой отклика, включая нормализованные точки данных в виде среднего +/- стандартного отклонения и подходящей кривой регрессии.
- Создайте новую XY-таблицу и вставьте данные в формате XY: строки (X) являются отрицательным контролем, за которым следуют возрастающие дозы лекарств, с дозами в качестве логарифма [ингибитора] в молярной концентрации. Столбцы (Y) — это значения считывания, которые включают реплики, сложенные вместе со столбцами.
Результаты
Отмечены значительные проблемы в создании органоидов НМРЛ7. Таким образом, интересно наблюдать за недавней работой по созданию органоидов рака легких и использованию их для анализов лечения наркомании20,21,22. Мутации EGFR составляют 11,3% случаев НМРЛ23. Таргетное лечение ингибиторами EGFR представляет собой вариант лечения первой линии при EGFR-мутантном НМРЛ и улучшило общую выживаемость и безопасность лечения у пациентов24. Эта работа определила чувствительность к одобренному FDA ингибитору тирозинкиназы EGFR osimertinib24,25 в EGFR-мутантных органоидах НМРЛ. EGFR-мутантные органоиды НМРЛ были получены из образцов хирургической резекции или биопсии опухоли пациентов с НМРЛ и подтвердили наличие указанной онкогенной мутации путем секвенирования ДНК. Как указано выше, EGFR-мутантные модели органоидов НМРЛ обрабатывали возрастающими дозами осимертиниба и жизнеспособности PDO, оцениваемыми по показаниям выживаемости клеток на основе люминесценции через пять дней после начала лечения. В то время как EGFR мутантные (EGFRdel19)-положительные органоиды TH107 показали чувствительность к лечению осимертинибом с половинной максимальной ингибирующей концентрацией (IC50) 56 нМ (Рисунок 2A), EGFR-мутантные (EGFRL858R)-положительные органоиды TH116 были устойчивы к лечению осимертинибом с IC50 более 1 мкМ (Рисунок 2B). Чувствительность EGFRdel19-положительного TH107 НМРЛ сопровождалась значительными транскрипционными изменениями, включая снижение экспрессии сигнатур генов, связанных с клеточным циклом, и увеличение экспрессии сигнатур генов, ассоциированных с апоптозом (дополнительный рисунок 2A,B). В качестве справочной информации представлены данные ответа для чувствительной EGFRdel19-положительной линии NSCLC PC9 (рисунок 3A,B). Последний включает анализ выживаемости до возрастающих доз осимертиниба методом 2D люминесцентного анализа выживаемости (рисунок 3A) и изучение подавления сигнализации на уровне сигнализации EGFR-MAPK западным пятном (рисунок 3B). В целом, эти данные подчеркивают точность настоящего протокола для определения лекарственного ответа и разграничения чувствительных и устойчивых моделей PDO НМРЛ. Для определения возможных изменений, связанных с резистентностью, необходимы дальнейшие анализы EGFRL858R-положительного органоида TH116 и доступных клинических образцов.
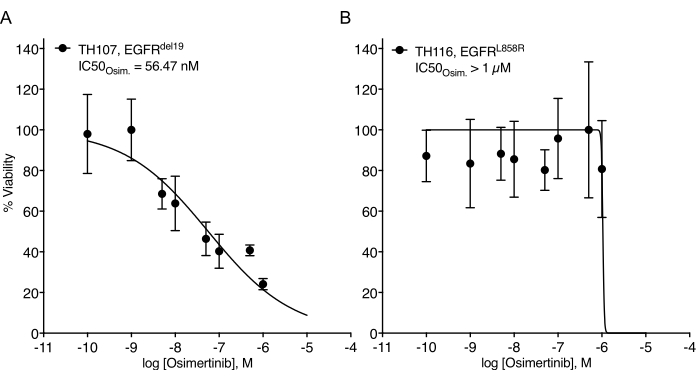
Рисунок 2: Кривая ответа на лечение EGFR-мутантных органоидных моделей НМРЛ к эскалации осимертиниба. (A) Реакция осимертиниба в чувствительной органоидной модели TH107 TH107 NSCLC. (B) Реакция осимертиниба в резистентной EGFRL858R-положительной TH116 NSCLC органоидной модели. Точки данных представлены в виде нормализованных значений, показывающих среднее стандартное отклонение +/- со встроенной кривой нелинейной регрессии через данные. TH107, n = 6 технических реплик на точку данных. TH116, n = 4 технические реплики на точку данных. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
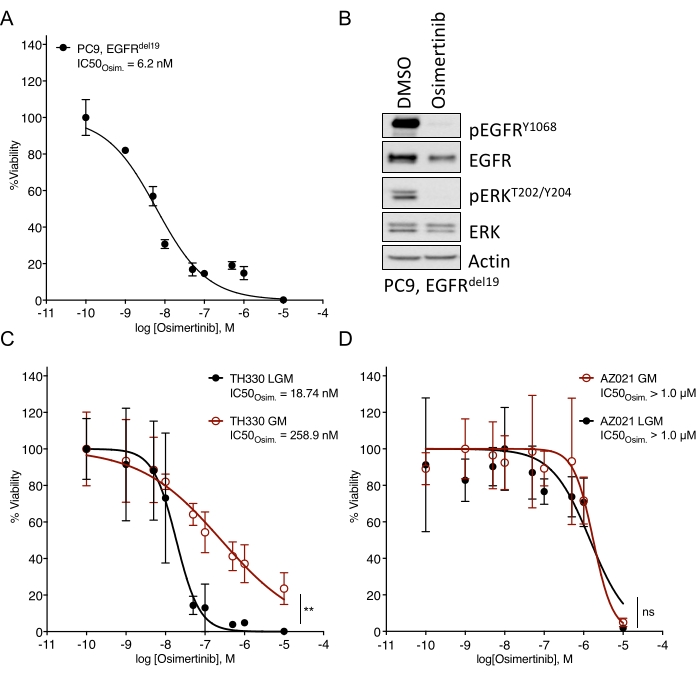
Рисунок 3: Сравнительные данные для ответа на лечение осимертинибом в чувствительной EGFR-мутантной клеточной линии НМРЛ и органоидных моделях, культивируемых в различных средах. (A) Реакция осимертиниба в чувствительной EGFRdel19-положительной клеточной линии НМРЛ PC9, определяемая стандартным анализом 2D-CTG. (B) Подавление сигнализации в клетках PC9 при двухдневном лечении осимертинибом (2 мкМ). (C) Реакция осимертиниба в чувствительной EGFRL858R-положительной TH330 NSCLC органоидной модельной культуре в LGM и ГМ-средах. (D) Реакция осимертиниба в резистентной органоидной модели AZ021 NSCLC в ЛГМ и ГМ-средах. Подтверждение онкогенной мутации EGFRL858R в AZ021 не удалось и может быть причиной отсутствия ответа осимертиниба. Для A и C-D точки данных представляются в виде нормализованных значений, показывающих среднее стандартное отклонение +/- с нелинейной кривой регрессии, проходящей через данные. PC9, n = 3 технические реплики на точку данных. TH330, n = 5 технических реплик на точку данных. AZ021, n = 6 технических реплик на точку данных. Тест на ранг Уилкоксона был выполнен на нормализованных данных для определения статистической значимости. Для TH330 (C), LGM против GM, ** p = 0,0078. Для AZ021 (D), LGM vs. GM, ns p = 0,0742. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Результаты репрезентативного клеточного анализатора для подсчета и оценки жизнеспособности EGFR-мутантных органоидных моделей. TH107 и TH107BC относятся к различным органоидным моделям, а A и B - к биологическим репликатам. Для каждой модели и биологической реплики подсчитываются три технические реплики; все они показывают жизнеспособность ≥95%. Справа представлено репрезентативное изображение во время подсчета клеток, показывающее устойчивую жизнеспособность и диссоциацию одиночных клеток. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Анализ обогащения генного набора (GSEA) с использованием объемных данных секвенирования РНК, полученных для EGFR-мутантных органоидов TH107 NSCLC, сравнение необработанного контроля (DMSO) и клеток, получавших осимертиниб в течение 3 дней (OSI_D3). (А-Б) При целенаправленном лечении чувствительные клетки подвергаются остановке клеточного цикла G1 и прекращают активную пролиферацию. Поскольку экспрессия генов клеточного цикла G2M связана с активной пролиферацией, ожидается номинальное обогащение экспрессии в необработанном контроле (DMSO). Для генов, связанных с апоптозом, ожидается номинальное обогащение в обработанных клетках (OSI_D3). Оба были подтверждены в EGFR-мутантной TH107 NSCLC органоидной модели, обработанной Осимертинибом: (A) GSEA для сигнатуры экспрессии Hallmark G2M (слева) показывает обогащение в клетках, обработанных DMSO. Номинальный показатель обогащения (NES): +1.708, FDR < 0.0001. (B) GSEA для сигнатуры экспрессии апоптоза Hallmark (справа) показывает обогащение в клетках, обработанных осимертинибом. NES: -1.075, FDR: ns, 0.3275. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 3: Комбинаторное лекарственное лечение в EGFR-мутантной органоидной модели TH330, обработанной эскалацией осимертиниба в присутствии второго ингибитора добавки в фиксированной концентрации. Резистентно-ассоциированные изменения в EGFR-мутантном НМРЛ, т.е. активация SRC и AXL26,27,28, были фармакологически нацелены на комбинаторное лечение ингибитором SRC Saracatinib (100 нМ) или ингибитором AXL R428 (500 нМ), n = 6 технических реплик на точку данных. Оба комбинаторных лечения привели к увеличению ответа на лечение, что имело значение для комбинации Осимертиниба с ингибитором SRC Саракатинибом. Статистическая значимость оценивалась с помощью рангового теста Уилкоксона: Осимертиниб против Осимертиниба + Саракатиниба, *p = 0,0195; Осимертиниб vs. Осимертиниб + R428, нс, p = 0,2500. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительная таблица 1: Изменение размера органоида с посева (d0) на 7 дней после обработки (d7). (A) Развитие роста EGFRdel19-положительного органоида НМРЛ TH107. (B) Развитие роста EGFRL858R-положительного органоида НМРЛ TH330. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Эта рукопись разрабатывает и описывает стандартизированный протокол оценки чувствительности к лекарственным средствам в 3D-моделях PDO, полученных из НМРЛ. В дополнение к исследованиям чувствительности к лекарственным средствам необходима дальнейшая характеристика доступных органоидных моделей для определения основных причин различий в чувствительности к лекарственным средствам. Это может включать генетическое профилирование органоидов и образцов пациентов и другие анализы, доступные для органоидов, такие как иммуногистохимическое окрашивание для маркеров дифференцировки и общих клеточных сигнальных биомаркеров и физиологии13,29.
Критические шаги в протоколе
Протокол, описанный в настоящем документе, обеспечивает стандартизированный рабочий процесс, который позволяет проводить точный и воспроизводимый анализ чувствительности к лекарственным средствам при тщательном соблюдении. Особую осторожность следует проявлять на следующих этапах: пищеварение TrypLE и DNAse I во время генерации одноклеточных суспензий, посев одноклеточных суспензий в BME2, мониторинг роста органоидов до лечения, изменения среды, а также нарушение и лизис встроенных органоидов BME2 во время считывания выживаемости клеток на основе люминесценции. (1) В то время как дополнительное переваривание DNAse I после диссоциации органоидов на основе TrypLE не является необходимым для расширения моделей органоидов во время регулярного поддержания культуры, пищеварение DNAse I не следует пропускать при посеве для экспериментов по эскалации лекарств, поскольку оно обеспечивает лучшее разделение кластеров органоидов на одноклеточные суспензии и точный подсчет клеток. (2) Посев одноэлементной суспензии в BME2 представляет собой критический этап с учетом затвердевания BME2 при комнатной температуре. Таким образом, необходимо сразу посеять максимум 1-2 ряда, а образцы поместить на лед перед посевом дополнительных рядов. Следует отметить, что клетки должны быть пипетированы вверх и вниз, когда посев продолжается, чтобы обеспечить однородную клеточную суспензию. (3) Рост органоидов необходимо тщательно контролировать в течение 7-дневного расширения от посева до обработки. Пример ожидаемого развития приведен на рисунке 1В и в дополнительной таблице 1. Следует отметить, что оценка изменений в размерах органоидов с помощью микроскопии с ярким полем и анализа изображений, как представлено на рисунке 1B , может позволить точно оценить различия в росте органоидов и удвоении времени. Удвоение времени может повлиять на реакцию на наркотики, как недавно обсуждалось в литературе30. Если скорость роста органоидов значительно превышает представленный пример, можно рассмотреть возможность более короткого времени расширения до начала лечения и более короткой продолжительности лечения. (4) Кроме того, при смене среды следует проявлять особую осторожность, чтобы избежать аспирации органоидов. Посевное положение встроенных органоидов BME2 в положении «6 часов» обеспечивает безопасное аспирирование среды, когда пластины поворачиваются по часовой стрелке на 180°, а среда аспирируется в противоположном положении органоидов. (5) Наконец, тщательный лизис встроенных органоидов BME2 во время считывания выживаемости имеет важное значение для записи точных результатов. В соответствии с инструкциями производителя, образцы должны быть несколько раз пипетированы вверх и вниз, в идеале с использованием нефильтрованных наконечников, чтобы обеспечить надлежащий лизис. Время инкубации должно соблюдаться, как описано. Кроме того, перенос 75% лизата (вместо общего объема) на белую, непрозрачную нижнюю 96-луночную пластину для окончательного считывания с использованием считывателя пластин ИФА позволяет провести соответствующую оценку, поскольку это обеспечивает одинаковый объем в каждой скважине и отсутствие пузырьков воздуха, которые могут быть введены путем энергичного пипетирования.
Следует отметить, что профилирование реакций на лекарственные средства в органоидных культурах, встроенных в BME2, может показать более высокое стандартное отклонение, чем наблюдаемое в обычных культурах клеточных линий (рисунок 2, рисунок 3A). Более высокое стандартное отклонение основано на нескольких факторах, включая повышенную вероятность незначительных изменений в посеве при работе с BME2 и различия в отдельных темпах роста органоидов в скважинах в течение начального 7-дневного периода роста. Таким образом, должно быть посеяно равное или более четырех технических реплик на концентрацию лекарственного средства.
Самое главное, наличие злокачественных клеток, несущих онкогенную мутацию драйвера и ограниченное загрязнение нормальными эпителиальными клетками дыхательных путей, должно быть тщательно оценено. Проблемы в установлении НМРЛ могут способствовать росту нормальных эпителиальных клеток дыхательных путей7. Профилирование номеров копий или подходы на основе ПЦР и секвенирования для подтверждения наличия онкогенных мутаций драйвера являются методами выбора для обеспечения качества органоидных культур НМРЛ.
Модификации и устранение неполадок метода
Среды и соответствующие факторы роста, добавляемые к базовым медиа-решениям, могут значительно влиять на реакцию препарата на целевые ингибиторы. Они активируют байпасные рецепторы и сигнальные пути, которые влияют и ограничивают реакцию на препарат (например, FGF, HGF, EGF)26. В то время как богатая и адаптированная среда с фактором роста может быть оптимальной для расширения органоидной культуры, оценки эскалации и чувствительности к лекарственным средствам должны проводиться в средах с пониженным фактором роста, как описано выше. Это основано на внутреннем опыте сравнения различных составов сред и данных о реакции на лекарства (рисунок 3C). В то время как медиа-растворы могут влиять на степень чувствительности к определенному лекарственному лечению и могут смещать значения IC50 , устойчивые фенотипы чувствительности или резистентности очевидны независимо от состава среды (рисунок 3C, D). Кроме того, рекомендуется общая согласованность в составе среды и профилировании реакций на лекарства в органоидных культурах, и необходимо посеять равную или более четырех технических реплик на концентрацию. Это особенно важно для контрольных диапазонов чувствительности и чувствительности. резистентность к интересующему ингибитору.
Ограничения метода
Протокол, представленный здесь, описывает чувствительность 3D-моделей органоидов рака НМРЛ к целевым ингибиторам при культивировании раковых клеток, полученных от пациента. Дополнительные эксперименты, включая фармакодинамический анализ в отношении ингибирования путей и анализа секвенирования на наличие онкогена драйвера и вторичных мутаций, необходимы для детальной характеристики лекарственной устойчивости и чувствительности. Кроме того, побочные факторы, такие как стимулы микроокружения, полученные в результате взаимодействий или секретируемые нераковыми клетками-сторонними клетками в микроокружении опухоли, не учитываются, и необходимы новые протоколы, когда предпринимаются попытки кокультурных органоидных моделей с иммунными или стромальными клетками. Недавняя работа подчеркнула использование органоидных моделей для рекапитуляции взаимодействий микроокружения опухоли и профилирования ответов на ингибиторы иммунных контрольных точек, такие как лечение анти-PD-L1113,31.
Значимость метода по отношению к существующим/альтернативным методам
3D раковые органоидные модели рекапитулируют генетическое разнообразие и детерминанты ответа на лечение, присутствующие в исходной опухоли4,5,6. Примечательно, что пространственная и временная гетерогенность может способствовать эволюции опухоли, а параллельное возникновение и последовательное развитие субклонов опухоли может происходить32,33. Внутриопухолевая гетерогенность значительна для отбора более устойчивых опухолевых клеток под терапевтическим давлением9,34,35. Протокол, представленный здесь, позволяет быстро оценить чувствительность к лечению таргетными ингибиторами в образцах, близких к пациенту. Таким образом, органоидные модели имеют преимущества перед более традиционными гомогенными моделями клеточных линий, лишенными генетического разнообразия, или долгосрочными исследованиями с использованием клеточных линий или ксенотрансплантатов, полученных от пациента. Кроме того, настоящий протокол позволяет расширить масштаб до нескольких направлений лечения и комбинированных подходов к лечению с небольшими ограничениями в отношении стоимости и аналитического потенциала. Таким образом, добавление второго лекарственного средства, представляющего интерес, в фиксированной дозе при одновременном увеличении в первую очередь целевого ингибитора и сравнение его с эскалацией только основного целевого ингибитора позволяет эффективно оценивать потенциальные комбинаторные эффекты и с минимальной дополнительной биомассой, требуемой (дополнительный рисунок 3). По сравнению с оценками на основе визуализации, используемыми для мониторинга развития органоидов и реакции на лекарства, анализ выживаемости клеток на основе люминесценции, описанный здесь, имеет аналогичную чувствительность с минимальным оборудованием и требуемой подготовкой.
Важность и потенциал применения метода в конкретных областях исследований
Разработка стандартизированного конвейера, который позволяет устанавливать модели органоидов рака из образцов пациентов и последующее профилирование чувствительности к лекарственным средствам, обладает значительным потенциалом клинической применимости. Фармакологическое профилирование ex vivo получило признание при обнаружении уязвимостей и резистентных признаков в опухолях, коррелирующих с ответом на лечение у пациентов36,37. Примечательно, что профилирование чувствительности к лекарственным средствам ex vivo может помочь в выборе лечения в клинике и разработке рациональных комбинированных методов лечения, направленных на механизмы резистентности. В целом, этот подход может помочь обеспечить улучшенные персонализированные стратегии для молекулярной терапии или комбинаторных схем лечения. Последнее может помочь на раннем этапе нацелиться на механизмы лекарственной толерантности и резистентности и углубить клинический ответ для улучшения результатов лечения пациентов в будущем.
Раскрытие информации
T.G.B. является консультантом Array Biopharma, Revolution Medicines, Novartis, AstraZeneca, Takeda, Springworks, Jazz Pharmaceuticals, Relay Therapeutics, Rain Therapeutics, Engine Biosciences и получает финансирование исследований от Novartis, Strategia, Kinnate и Revolution Medicines.
Благодарности
Мы благодарим лаборатории Jeroen P Roose (UCSF) и Calvin J Kuo (Стэнфорд) за их вклад в развитие органоидной культуры и протокола. Мы также благодарим Огенекевве М. Гбендио (Лаборатория Руза, UCSF) за протоколы и ввод образцов. Этот исследовательский проект был проведен при поддержке NIH [U54CA224081]. Ф. Хадерк был поддержан постдокторской стипендией Милдред Шеель от Немецкой онкологической помощи.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | |||
| 15 mL centrifuge tubes | |||
| 500 mL Vacuum Filter/Storage Bottle System, 0.2 µm Pore 33.2 cm2 Nylon Membrane | Corning | 430773 | for both media |
| 96-Well, Cell Culture-Treated, Flat Clear Bottom Black Microplate | Corning | 3904 | |
| 96-Well, Cell Culture-Treated, Solid White Flat-Bottom Microplate | Corning | 3917 | |
| A-8301 | Tocris Bioscience | 293910 | for both media |
| Advanced DMEM/F-12 | Gibco | 12634010 | for LGM |
| B27 | Life Technologies | 12587010 | for both media |
| BioRender 2021 | https://biorender.com/ | online scientific illustration software | |
| BME2 (Cultrex RGF Basement Membrane Extract, Type 2) | R&D Systems | 353301002 | |
| Cell culture incubator (37 °C, 5% CO2) | |||
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9682 | 3D-CTG readout reagent |
| Centrifuge holding 15 mL centrifuge tubes | |||
| Deoxyribonuclease I (DNAse I) | ThermoFisher Scientific | 18047019 | |
| Dulbecco's Phosphate-Buffered Salt Solution | Corning | MT21031CV | |
| DMEM/F-12, GlutaMAX supplement | Gibco | 10565018 | for GM |
| GlutaMax | Gibco | 35050061 | for LGM |
| GraphPad Prism software (version 9.2.0) | GraphPad | statistical analysis software | |
| HEPES | Gibco | 15630080 | for both media |
| hFGF-10 | PeproTech | 100-26-100ug | for GM |
| hFGF-7 | PeproTech | 100-19-50ug | for GM |
| hNoggin | PeproTech | 120-10C-100ug | for both media |
| hRspondin | PeproTech | 120-38-100ug | for GM |
| Low retention pipette tips, 20 µL (P20) | ThermoFisher Scientific | 2149P-05-HR | |
| Low retention pipette tips, 200 µL (P200) | ThermoFisher Scientific | 2069-05-HR | |
| Regular length pipette tips, 1000 µL (P1000) | ThermoFisher Scientific | 2179-HR | |
| Multichannel pipette | |||
| N-Acetylcysteine | Fisher Scientific | 50-424-777 | for both media |
| Nicotinamide | Sigma Aldrich | N0636-100G | for both media |
| Osimertinib | Selleck Checm | S7297 | |
| Penicillin-Streptomycin-Glutamine | Gibco | 10378016 | for LGM |
| Penicillin/Streptomycin | Cytiva HyClone | SV30010 | for GM |
| Pipettes (different sizes) | |||
| Plate reader | Molecular Devices | SpectraMax M5 | equipment, alternative readers may be used |
| Primocin | Invivogen | ant-pm-1 | for GM |
| SB202190 | Selleck Chem | S1077 | for GM |
| TrypLE Express Enzyme | Gibco | 12604021 | |
| Vacuum pump and tubing | |||
| Vi-CELL XR Cell Analyzer | Beckman Coulter | Vi-CELL XR | cell analyzer / counter |
Ссылки
- de Bono, J. S., Ashworth, A. Translating cancer research into targeted therapeutics. Nature. 467 (7315), 543-549 (2010).
- Dagogo-Jack, I., Shaw, A. T. Tumour heterogeneity and resistance to cancer therapies. Nature Reviews Clinical Oncology. 15 (2), 81-94 (2018).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Tiriac, H., et al. Organoid profiling identifies common responders to chemotherapy in pancreatic cancer. Cancer Discovery. 8 (9), 1112-1129 (2018).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Vlachogiannis, G., et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 359 (6378), 920-926 (2018).
- Dijkstra, K. K., et al. Challenges in establishing pure lung cancer organoids limit their utility for personalized medicine. Cell Reports. 31 (5), 107588(2020).
- Lo, Y. -H., Karlsson, K., Kuo, C. J. Applications of organoids for cancer biology and precision medicine. Nature Cancer. 1 (8), 761-773 (2020).
- Bivona, T. G., Doebele, R. C. A framework for understanding and targeting residual disease in oncogene-driven solid cancers. Nature Medicine. 22 (5), 472-478 (2016).
- Jabs, J., et al. Screening drug effects in patient-derived cancer cells links organoid responses to genome alterations. Molecular Systems Biology. 13 (11), 955(2017).
- Tashiro, T., et al. In vivo and ex vivo cetuximab sensitivity assay using three-dimensional primary culture system to stratify KRAS mutant colorectal cancer. PLoS One. 12 (3), 0174151(2017).
- van de Wetering, M., et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 161 (4), 933-945 (2015).
- Neal, J. T., et al. Organoid Modeling of the Tumor Immune Microenvironment. Cell. 175 (7), 1972-1988 (2018).
- Hysenaj, L., et al. SARS-CoV-2 infection studies in lung organoids identify TSPAN8 as novel mediator. bioRxiv. , (2021).
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300(2019).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocol in Immunology. , Appendix 3, Appendix 3B (2001).
- Pushparaj, P. N. Revisiting the micropipetting techniques in biomedical sciences: A fundamental prerequisite in good laboratory practice. Bioinformation. 16 (1), 8-12 (2020).
- Promega Corporation. CellTiter-Glo 3D Cell Viability Assay. Promega Corporation. , (2021).
- Kim, M., et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nature Communication. 10 (1), 3991(2019).
- Hu, Y., et al. Lung cancer organoids analyzed on microwell arrays predict drug responses of patients within a week. Nature Communication. 12 (1), 2581(2021).
- Shi, R., et al. Organoid cultures as preclinical models of non-small cell lung cancer. Clinical Cancer Research. 26 (5), 1162-1174 (2020).
- Collisson, E. A., et al. Comprehensive molecular profiling of lung adenocarcinoma. Nature. 511 (7511), 543-550 (2014).
- Ramalingam, S. S., et al. Overall Survival with Osimertinib in untreated, EGFR-mutated advanced NSCLC. New England Journal of Medicine. 382 (1), 41-50 (2019).
- Soria, J. -C., et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. New England Journal of Medicine. 378 (2), 113-125 (2017).
- Rotow, J., Bivona, T. G. Understanding and targeting resistance mechanisms in NSCLC. Nature Reviews Cancer. 17 (11), 637-658 (2017).
- Zhang, Z., et al. Activation of the AXL kinase causes resistance to EGFR-targeted therapy in lung cancer. Nature Genetics. 44 (8), 852-860 (2012).
- Kanda, R., et al. Erlotinib resistance in lung cancer cells mediated by integrin β1/Src/Akt-driven bypass signaling. Cancer Research. 73 (20), 6243-6253 (2013).
- Bruun, J., et al. Patient-derived organoids from multiple colorectal cancer liver metastases reveal moderate intra-patient pharmacotranscriptomic heterogeneity. Clinical Cancer Research. 26 (15), 4107-4119 (2020).
- Hafner, M., Niepel, M., Chung, M., Sorger, P. K. Growth rate inhibition metrics correct for confounders in measuring sensitivity to cancer drugs. Nature methods. 13 (6), 521-527 (2016).
- Yuki, K., Cheng, N., Nakano, M., Kuo, C. J. Organoid models of tumor immunology. Trends in Immunology. 41 (8), 652-664 (2020).
- Gerlinger, M., et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. New England Journal of Medicine. 366 (10), 883-892 (2012).
- McGranahan, N., Swanton, C. Biological and therapeutic impact of intratumor heterogeneity in cancer evolution. Cancer Cell. 27 (1), 15-26 (2015).
- Rambow, F., et al. Toward minimal residual disease-directed therapy in melanoma. Cell. 174 (4), 843-855 (2018).
- Marine, J. C., Dawson, S. J., Dawson, M. A. Non-genetic mechanisms of therapeutic resistance in cancer. Nature Reviews Cancer. 20 (12), 743-756 (2020).
- Frismantas, V., et al. Ex vivo drug response profiling detects recurrent sensitivity patterns in drug-resistant acute lymphoblastic leukemia. Blood. 129 (11), 26-37 (2017).
- Drusbosky, L. M., et al. Predicting response to BET inhibitors using computational modeling: A BEAT AML project study. Leukemia Research. 77, 42-50 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены