A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التحقيق في استقلاب القلب في قلب الفأر المعزول مع التحليل الطيفي للتصوير بالرنين المغناطيسي النووي [1-13 C] و 13C / 31P NMR
In This Article
Summary
نحن نصف إعدادا تجريبيا لإدارة مستقلبات 13ذات علامة C شديدة الاستقطاب في وضع التروية المستمرة إلى قلب فأر معزول. مكن نهج اكتساب 13C-NMR المخصص من القياس الكمي لنشاط الإنزيم الأيضي في الوقت الفعلي ، ومكن تحليل 31P-NMR متعدد المعلمات من تحديد محتوى ATP في الأنسجة ودرجة الحموضة.
Abstract
الأيض هو أساس العمليات الهامة في الحياة الخلوية. يوفر توصيف كيفية عمل الشبكات الأيضية في الأنسجة الحية معلومات مهمة لفهم آلية الأمراض وتصميم العلاجات. في هذا العمل ، نصف الإجراءات والمنهجيات لدراسة النشاط الأيضي داخل الخلية في قلب فأر معطر بأثر رجعي في الوقت الفعلي. تم عزل القلب في الموقع ، بالتزامن مع السكتة القلبية لتقليل نقص تروية عضلة القلب وتم اختراقه داخل مطياف الرنين المغناطيسي النووي (NMR). أثناء وجوده في مقياس الطيف وتحت التروية المستمرة ، تم إعطاء البيروفات مفرط الاستقطاب [1-13 درجة مئوية] للقلب ، وعملت معدلات إنتاج اللاكتات و [13C] البيكربونات اللاحقة على تحديد ، في الوقت الفعلي ، معدلات إنتاج نازعة هيدروجين اللاكتات وبيروفات ديهيدروجيناز. تم قياس هذا النشاط الأيضي لبيروفات فرط الاستقطاب [1-13C] باستخدام التحليل الطيفي بالرنين المغناطيسي النووي في نموذج بطريقة حرة باستخدام نهج اكتساب الإثارة المشبعة الانتقائية للمنتج. 31 تم تطبيق التحليل الطيفي P بين عمليات الاستحواذ شديدة الاستقطاب لمراقبة طاقة القلب ودرجة الحموضة. هذا النظام مفيد بشكل فريد لدراسة النشاط الأيضي في قلب الفأر الصحي والمريض.
Introduction
ترتبط التغيرات في استقلاب القلب بمجموعة متنوعة من اعتلالات عضلة القلب وغالبا ما تشكل أساس الآليات الفيزيولوجية المرضية الأساسية1. ومع ذلك ، هناك العديد من العقبات التي تحول دون دراسة التمثيل الغذائي في الأنسجة الحية ، حيث تتطلب معظم المقايسات الكيميائية الحيوية تجانس تحلل الأنسجة والخلايا و / أو التتبع الإشعاعي. لذلك ، هناك حاجة ملحة لأدوات جديدة للتحقيق في استقلاب عضلة القلب في الأنسجة الحية. يسمح الرنين المغناطيسي (MR) للركائز ذات العلامات C 13شديدة الاستقطاب بإجراء قياسات في الوقت الفعلي لعملية التمثيل الغذائي في الأنسجة الحية2 ، دون استخدام الإشعاع المؤين ، عن طريق زيادة نسبة إشارة MR إلى الضوضاء (SNR) للموقع (المواقع) المسمى بعدة أوامر من الحجم3. هنا ، نصف الإعداد التجريبي ، ونهج الاستحواذ ، والنهج التحليلي لدراسة التمثيل الغذائي السريع في قلب الفأر المعزول ، وبالتوازي مع ذلك ، نقدم مؤشرات لطاقة الأنسجة العامة والحموضة. يعد الرقم الهيدروجيني للقلب مؤشرا قيما ، حيث يتعطل التوازن الحمضي القاعدي في المراحل المبكرة من أمراض القلب وظروفها مثل نقص تروية عضلة القلب وتضخم غير قادر على التكيف وفشل القلب6.
يساعد إنتاج اللاكتات [1-13 C] lactate و [13 C] بيكربونات من فرط الاستقطاب [1-13C] البيروفات في تحديد معدلات إنتاج نازعة هيدروجين اللاكتات (LDH) ونازعة هيدروجين البيروفات (PDH). معظم الدراسات السابقة التي أجريت باستخدام ركائز مفرطة الاستقطاب في قلب القوارض المعزول إما استخدمت نماذج حركية معقدة لاشتقاق النشاط الأنزيمي ل LDH و PDH ، أو أبلغت عن نسب شدة الإشارة للمنتج مفرط الاستقطاب إلى الركيزة دون حساب معدلات نشاط الإنزيم الفعلية2،4،5،6،7،8،9،10 ، 11،12،13،14. هنا ، استخدمنا نهج الإثارة المشبعة الانتقائية للمنتج 15 ، والذي يسمح بمراقبة نشاط الإنزيم بطريقة خالية من النموذج15,16. بهذه الطريقة ، تم تحديد المعدلات الأنزيمية المطلقة (أي عدد مولات المنتج المنتج لكل وحدة زمنية). 31 تم استخدام التحليل الطيفي P لمراقبة إشارات الفوسفات غير العضوي (Pi) والفوسفوكرياتين (PCr) والأدينوسين ثلاثي الفوسفات (ATP). تم استخدام تحليل متعدد المعلمات لتوصيف توزيع الأس الهيدروجيني للقلب ، كما يتضح من التحول الكيميائي غير المتجانس في إشارة Pi للأنسجة.
قلب الفأر المثقوب بأثر رجعي (قلب Langendorff)17،18،19 هو نموذج خارج الجسم الحي للقلب النابض السليم. في هذا النموذج ، يتم الحفاظ على صلاحية القلب ودرجة الحموضة لمدة 80 دقيقةعلى الأقل 20 ، وقد أظهرت إمكانية الشفاء بعد إصابة إقفارية طويلة21,22. ومع ذلك ، قد يؤدي التباين غير المقصود أثناء الجراحة المجهرية إلى تباين في صلاحية الأنسجة عبر القلوب. وقد ذكرت الدراسات السابقة عن تدهور هذا القلب مع مرور الوقت19; على سبيل المثال ، لوحظ انخفاض في وظيفة انقباض بنسبة 5٪ -10٪ في الساعة18. وقد ثبت سابقا أن إشارة أدينوسين ثلاثي الفوسفات (ATP) تبلغ عن حالة طاقة عضلة القلب وصلاحيتها23. هنا ، لاحظنا أن القلب المفعم بالإرهاق قد يظهر أحيانا تباينا غير مقصود في مستويات الصلاحية ، كما يتضح من محتوى ATP ، على الرغم من حقيقة أن لدينا نضحا متواصلا وإمدادا بالأكسجين. نوضح هنا أن تطبيع معدلات LDH و PDH لمحتوى ATP للقلب يقلل من التباين بين القلب في هذه المعدلات.
في البروتوكول التالي ، نصف الإجراء الجراحي المستخدم لقنية القلب وعزله وما يترتب على ذلك من تروية في مطياف الرنين المغناطيسي النووي. من الجدير بالذكر أن الأساليب الجراحية الأخرى التي تهدف إلى عزل وتعطير قلب الفأر قد تم وصفها قبل24,25.
كما تم وصف المنهجيات المستخدمة للحصول على البيانات المتعلقة بالمعدلات الأنزيمية في القلب النابض (باستخدام التحليل الطيفي 13 C والبيروفات مفرط الاستقطاب [1-13C]) وصلاحية القلب وحموضته (باستخدام التحليل الطيفي 31P NMR). أخيرا ، يتم شرح المنهجيات التحليلية لتحديد أنشطة الإنزيم الأيضي وصلاحية الأنسجة والحموضة.
Protocol
وافقت لجنة الأخلاقيات المشتركة (IACUC) في الجامعة العبرية ومركز هداسا الطبي على بروتوكول دراسة الرفق بالحيوان (MD-19-15827-1).
1. إعداد العازلة كريبس هينسليت
- قبل يوم واحد من التجربة ، قم بإعداد نسخة معدلة من المخزن المؤقت Krebs-Henseleit (KHB)26. في البداية ، قم بإذابة 118 mM NaCl ، 4.7 mM KCl ، 0.5 mM pyruvate ، 1.2 mM MgSO 4 ، 25 mM NaHCO3 ، و 1.2 mM KH 2 PO4 في H2O المقطر المزدوج.
- ضع هذا الخليط في فقاعة بنسبة 95٪ / 5٪ O 2 / CO2 لمدة 20 دقيقة ، ثم أضف 1.2 mM CaCl2.
- اضبط الرقم الهيدروجيني للمخزن المؤقت على 7.4 باستخدام حمض الهيدروكلوريك أو هيدروكسيد الصوديوم.
- في يوم التجربة، أضف 10 مللي مول من الجلوكوز و72 وحدة / لتر من الأنسولين إلى KHB المحضر في الخطوة 1.2.
ملاحظة: يضاف الأنسولين إلى مخزن التروية كما هو موضح في عمل Kolwicz et al.26 وبالاتفاق مع الدراسات السابقة التي تفيد بأن الأنسولين يزيد من وظيفة الانقباض27 وشدة إشارة بيكربونات مفرطة الاستقطاب [13C] 28.
2. إعداد نظام التروية
- احتفظ بخزان سعة 200 مل من KHB في حمام مائي عند 40 درجة مئوية ، وفقاعة بنسبة 95٪ / 5٪ O 2 / CO2 بمعدل تدفق 4 لتر / دقيقة لمدة 1 ساعة قبل التروية القلبية. حافظ على فقاعات المخزن المؤقت باستمرار مع خليط الغاز هذا طوال التجربة.
- أولا ، اضبط حمام الماء على 40 درجة مئوية. أدخل خزان KHB. استخدم مضخة تمعجية (انظر جدول المواد) وأنابيب تمديد طبية لإعادة تدوير KHB بين الخزان العازل وأنبوب الرنين المغناطيسي النووي 10 مم بمعدل تدفق ثابت يبلغ 7.5 مل / دقيقة.
- قم بتوصيل ثلاثة أنابيب سيليكون معالجة بالبلاتين (معرف 3 مم) بالمضخة (أنبوب تدفق واحد وأنبوبان للتدفق الخارجي للمخزن المؤقت KH). أدخل خطوط التدفق والتدفق في المخزن المؤقت KH الساخن. ثم أدخل خط الأكسجين في المخزن المؤقت KH الساخن.
- استخدم خطوط كيتون الأثير الرقيقة من البولي إيثر (نظرة خاطفة ، انظر جدول المواد) حتى يتدفق المخزن المؤقت والعامل مفرط الاستقطاب من وإلى أنبوب الرنين المغناطيسي النووي داخل تجويف مقياس الطيف.
- تأكد من الحفاظ على درجة الحرارة عند 37-37.5 درجة مئوية. اتبع الخطوات أدناه.
- لف خط التدفق (من الخزان العازل إلى أنبوب الرنين المغناطيسي النووي) بشريط تسخين مضبوط على 42 درجة مئوية.
- قم بتسخين أنبوب الرنين المغناطيسي النووي داخل مقياس الطيف بتدفق هواء دافئ ينظمه مقياس الطيف.
- استخدم مستشعر درجة حرارة متوافق مع الرنين المغناطيسي النووي (انظر جدول المواد) لقياس درجة الحرارة داخل أنبوب الرنين المغناطيسي النووي. يتم ضبط درجة الحرارة إلى 37-37.5 درجة مئوية.
3. معايرة وإعداد مطياف الرنين المغناطيسي النووي للاقتناء
- في يوم التجربة ، أدخل عينة قياسية 13 درجة مئوية تحتوي على 1،4-ديوكسان (جدول المواد) في مقياس الطيف ، وقم بضبط ومطابقة مسبار الرنين المغناطيسي النووي ل 13درجة مئوية. بعد ذلك ، احصل على طيف يوضح إشارة التوازن الحراري ل 1,4-dioxane بزاوية تحويل 90 درجة.
- الآن استبدل العينة القياسية 13C بعينة قياسية 31 P (جدول المواد) ، والتي تحتوي على 105 mM من ATP في D2O. ضبط ومطابقة مسبار الرنين المغناطيسي النووي ل 31P.
ملاحظة: يتم الحصول على طيف يوضح إشارات فوسفات التوازن الحراري بزاوية دوران تبلغ 50 درجة. - أدخل خط التدفق وخط التدفق الخارجي ومسبار درجة الحرارة في أنبوب NMR مقاس 10 مم ، ثم أدخل الأنبوب في التجويف المغناطيسي. اضبط شريط التسخين على 42 درجة مئوية.
- الحصول على طيف 31P NMR من المخزن المؤقت KH المتداول لاستخدامه في تلك التجربة لمدة 30 دقيقة ، بزاوية تشويق تبلغ 50 درجة و TR تبلغ 1.1 ثانية (1,640 عملية استحواذ).
4. إعداد الحيوان ، والإجراء الجراحي ، وتروية القلب في أنبوب الرنين المغناطيسي النووي
- تخدير ذكر فأر HSD: ICR (CD-1) مع 3.3٪ إيزوفلوران في هواء الغرفة (جدول المواد) عند 340 مل / دقيقة لمدة 5 دقائق باستخدام نظام تخدير الغاز (جدول المواد) في غرفة الحث.
- استخدام التخدير الأنفي للحفاظ على التخدير العام مع 2.9 ٪ إيزوفلوران.
ملاحظة: يتم توخي الحذر لتقليل الألم وعدم الراحة للحيوان. - تأمين أطراف الحيوان مع الشريط ، وضمان منعكس الألم دواسة سلبية ، ثم حقن 300 وحدة دولية من الهيبارين الصوديوم داخل الصفاق.
- بلل جدار صدر الفأر وبطنه جيدا بنسبة 70٪ كحول لضمان النظافة وتجنب تلوث الشعر أو انسداده أثناء العملية الجراحية.
- في 1 دقيقة بعد حقن الهيبارين ، وقطع الجلد والعضلات من تجويف البطن مع مقص صغير.
- ضع مشبك البعوض الصغير ذو الفك المنحني الذي يقفل مرقئ بين عملية الخنجري وجلد الصدر لرفع الصدر وكشف الحجاب الحاجز. ثقب وقطع الفص الأيمن من الحجاب الحاجز.
- قطع الصدر عبر خط الوسط ، وتراجع إلى الجانبين ، ثم إزالتها.
- حقن البطين الأيسر للقلب مع 200 وحدة دولية من هيبارين الصوديوم لمنع تخثر الدم. ثم ، حقن 0.1 مل من الثلج البارد 0.5 مول / لتر KCl لتحقيق السكتة القلبية ، كما هو موضح سابقا25. السكتة القلبية ضرورية لتكون قادرة على قنية القلب.
- تحديد الغدة الصعترية ، وإزالتها باستخدام مقص لكشف الشريان الأورطي. إزالة أنسجة القفص الصدري المتبقية.
- حدد قوس الأبهر ، واستخدم ملقط منحني لوضع عقدة فضفاضة بخياطة حريرية 3-0 (جدول المواد) حول الشريان الأورطي الصاعد. حقن 3 مل من KHB في البطين الأيسر لإزالة جلطات الدم من الشريان الأورطي.
- استخدم ملقط منحني لسحب القلب بشكل سفلي للحصول على تصور أفضل للشريان الأورطي الصاعد.
- إجراء القنية في الموقع باستخدام قسطرة وريدية 22 G (جدول المواد). ضع لاصق cyanoacrylate في المنطقة المقناة ، ثم قم بإجراء ربط خياطة مزدوجة. حقن مخزن مؤقت إضافي من KH في القلب ، وتحقق من أنه يتدفق عبر أنبوب القنية.
- قم بإزالة الملقط المنحني. افصل القلب عن الأحشاء المحيطة ، وقم بتعطيره بأثر رجعي باستخدام KHB المثلج (4 درجات مئوية) من خلال القسطرة الوريدية.
- قم بتوصيل القلب بخط تدفق نظام التروية عبر القسطرة الوريدية. عند بدء التروية مع عازلة دافئة (37-37.5 درجة مئوية) عند 7.5 مل / دقيقة ، يبدأ القلب في النبض تلقائيا.
- ثبت أنبوب الرنين المغناطيسي النووي بالقلب النابض وخطوط التدفق الخارجي ومسبار درجة الحرارة ، وأدخله في تجويف مقياس الطيف ، مع التأكد من أن القلب في مركز مسبار الرنين المغناطيسي النووي.
5. الحصول على بيانات لطاقة القلب ودرجة الحموضة
- الحصول على 31أطياف P لحوالي 1 ساعة بزاوية قلب 50 درجة و TR من 1.1 ثانية.
6. DNP تدور الاستقطاب والحل
- تحضير تركيبة 28.5 ملغ من [1-13C] البيروفات. تتكون هذه التركيبة من 11.1 mM إلى 14.0 mM OX063 جذري في الحمض الأنيق.
- تحضير 4 مل من وسط الذوبان. يتكون وسط الذوبان من محلول TRIS-phosphate ، والذي يحتوي على 11.2 mM NaH 2 PO 4 ، و 38.8 mM Na 2 HPO4 ، و 33 mM TRIS ، و2mM HCl. يتم ضبط هذه التركيبة المتوسطة بحيث عند إضافة 28.5 ملغ من [1-13C] تركيبة حمض البيروفيك إلى 4 مل من هذا المخزن المؤقت (في مرحلة الذوبان) ، سيكون الرقم الهيدروجيني للمحلول الناتج 7.4.
- قم بإجراء استقطاب الدوران والذوبان السريع في جهاز استقطاب الدوران - DNP (dDNP) وفقا لتعليمات الشركة المصنعة (جدول المواد). تطبيق تشعيع الميكروويف على تردد 94.110 GHz لاستقطاب تركيبة حمض البيروفيك [1-13C] عند 1.45 K إلى 1.55 K لحوالي 1.5 ساعة.
- امزج بسرعة 4 مل من الوسط مفرط الاستقطاب من جهاز dDNP بمحلول مؤكسج جيدا يكمل وسط الذوبان المفرط الاستقطاب للحصول على تركيبة تتطابق بشكل وثيق مع وسط التروية.
ملاحظة: الحجم النهائي للوسط الذي يتدفق على القلب أثناء الحقن شديدة الاستقطاب مع 14 مللي مول مفرط الاستقطاب [1-13درجة مئوية] البيروفات هو 26 مل. يحتوي التركيب النهائي للوسط المحقون (بعد الخلط) على 4.7 mM KCl و 1.2 mM MgSO 4 و 70 mM NaCl و 25 mM NaHCO 3 و 1.2 mM KH 2 PO4 و 10 mM glucose و1.2mM CaCl2 و 72 U / L من الأنسولين. - إدارة الوسط المحتوي على البيروفات مفرط الاستقطاب [1-13درجة مئوية] للقلب المعزول باستخدام إعداد التدفق المستمر29.
ملاحظة: يتم ذلك لضمان عدم اضطراب نضح القلب في أي وقت أثناء التجربة وأن الوسط المفرط الاستقطاب يتم إعطاؤه بمعدل معروف ولمدة معروفة.
7. التحليل الطيفي 13C مفرط الاستقطاب
- احصل على بيانات 13 C شديدة الاستقطاب باستخدام نبضات التشبع والإثارة الانتقائية للمنتج 15 من خلال تطبيق نبضات جيبية أساسية (Sinc) تبلغ 2.5 مللي ثانية ، كما هو موضح سابقا15,16. إثارة انتقائية [1-13 C] لاكتات و [13C] بيكربونات على التوالي على فترات 6 ثوان للحصول على فاصل زمني 12ثانية لكل مستقلب.
- للكشف عن [1-13 C] اللاكتات ، قم بتوسيط نبضة Sinc الانتقائية عند تردد هيدرات البيروفات [1-13 C] (179.4 جزء في المليون) ، مما ينتج عنه نسبة شدة الإشارة (lac) من 0.113 لإشارات C 1 من [1-13 C] البيروفات إلى [1-13C] اللاكتات.
- للكشف عن [13 C] بيكربونات ، قم بتوسيط نبضة Sinc الانتقائية عند 157.7 جزء في المليون ، وهو 214 هرتز أسفل المجال لإشارة [13C] بيكربونات (161.1 جزء في المليون) ؛ ينتج عن هذا نسبة شدة إشارة (BIC) تبلغ 0.139 لإشارة C 1 من [1-13C] بيروفات إلى [13C] بيكربونات.
8. تحديد الوزن الرطب للأنسجة وحجمها
- في نهاية التجربة ، افصل القلب عن نظام التروية ، وجففه برفق باستخدام المناديل الورقية. في وقت لاحق ، تزن القلب للحصول على الوزن الرطب الأنسجة.
- أوجد حجم القلب باستخدام عامل كثافة مقداره 1.05 g/cm3، كما حدد سابقا لقلب الفأر30.
9. قياس محتوى ATP
- دمج إشارة γ-ATP لعملية اكتساب واحدة لعينة ATP القياسية واكتساب 30 دقيقة (TR من 1.1 ثانية و 1640 عملية اكتساب) للقلب المعزول.
- تحديد محتوى ATP للقلب من خلال مقارنة تكامل إشارة γ-ATP للقلب بتلك الخاصة بالمعيار (جدول المواد) ، حيث يكون للأخير تركيز معروف (105 mM) ، وتصحيح عدد عمليات الاستحواذ وتأثيرات الاسترخاء.
10. حل إشارة Pi للقلب
ملاحظة: من أجل تقييم درجة الحموضة في الأنسجة ، من الضروري أولا فصل إشارة Pi للقلب عن إشارة Pi الكلية (Pit). يتم ذلك عن طريق حذف إشارة KHB Pi (PiKH) من إشارة Pit.
- في طيف 31P من KHB الذي يظهر إشارة Pi واحدة (Pi KH ، الشكل 1A) ، قم بتركيب إشارة PiKH مع دالة Lorentzian باستخدام Excel (جدول المواد).
- يحتوي الحجم المرئي لمسبار الرنين المغناطيسي النووي (Vp ، 1.375 mL) على المزيد من KHB عندما لا يحتوي أنبوب العينة على القلب. لتصحيح تأثير التعبئة هذا ، احسب إشارة المخزن المؤقت الموهن (Pib) باستخدام Eq. 1A.
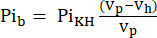 مكافئ 1 أ
مكافئ 1 أ
حيث Vh هو حجم القلب ، كما هو محدد في الخطوة 8. - اطرح هذه الإشارة من Pit وفقا ل Eq. 1B للحصول على إشارة Pi الناشئة فقط من القلب المثقوب (Pih ، الشكل 1B).
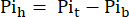 مكافئ 1 ب
مكافئ 1 ب
11. تحليل الأس الهيدروجيني متعدد المعلمات
- قم بإجراء تحويل توزيع التحول الكيميائي لإشارة Pih إلى الأس الهيدروجيني بالرجوع إلى الإزاحة الكيميائية ل PCr باستخدام Eq. 231.
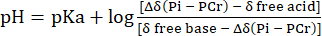 مكافئ 2
مكافئ 2
حيث Δδ هو فرق التحول الكيميائي ، pKa هو 6.72 ، δ القاعدة الحرة هي 5.69 ، والحمض الحر δ هو 3.27 ، كما هو موضح سابقا31. - صحح منحنى توزيع الأس الهيدروجيني الناتج لعدم الخطية بين مقياس التحول الكيميائي Pih ومقياس الأس الهيدروجيني وفقا ل Lutz et al.32. يتم عرض توزيع الأس الهيدروجيني النموذجي الناتج عن هذا الحساب في الشكل 1C.
- تحليل توزيع الأس الهيدروجيني للأنسجة باستخدام نهج متعدد المعلمات باستخدام سبعة معلمات إحصائية بعد عمل Lutz et al. 32. يتم عرض أربعة من هذه المعلمات هنا لأنها تبدو الأكثر وصفا لدرجة الحموضة في الأنسجة: 1) الحد الأقصى العالمي لدرجة الحموضة. 2) متوسط درجة الحموضة المرجحة ؛ 3) متوسط درجة الحموضة المرجحة ؛ و 4) انحراف مخطط الأس الهيدروجيني (الشكل 1C).
12. حساب أنشطة LDH و PDH
ملاحظة: تستخدم معدلات إنتاج المستقلبات شديدة الاستقطاب [1-13 C] اللاكتات و [13C] بيكربونات لحساب أنشطة LDH و PDH ، على التوالي. في نهج التشبع والإثارة الانتقائيللمنتج 15 ، يتم اكتشاف المستقلبات المفرطة الاستقطاب المركبة حديثا فقط بواسطة كل إثارة انتقائية.
- استخدم إشارة البيروفات شديدة الاستقطاب [1-13C] كمرجع لتحديد مستوى إنتاج الأيض المقابل.
- أثناء التروية مع الوسط مفرط الاستقطاب ، يزداد تركيز البيروفات [1-13 C] في أنبوب الرنين المغناطيسي النووي (غسل) ، ثم هضاب (بتركيز أقصى يبلغ 14مللي مول) ، ثم ينخفض (غسل).
- لتحديد النقاط الزمنية التي وصل فيها تركيز البيروفات إلى مستوى ثابت (هضبة) ، قم بتصحيح إشارة البيروفات [1-13C] لاضمحلال الإشارة الناتج عن استرخاء T1 ونبض التردد اللاسلكي باستخدام ثابت الاسترخاء الفعال ، Teff.
- لكل حقنة ، حددT eff بناء على قدرته على تصحيح منحنى اضمحلال البيروفات [1-13 C] لإظهار ديناميكيات التدفق هذه (Eq.3).
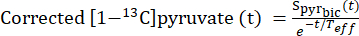 مكافئ 3
مكافئ 3
حيث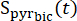 هي إشارة البيروفات [1-13 C] التي تم الحصول عليها أثناء اكتساب [13C] بيكربونات. تم العثور على متوسطT eff في التجارب الموصوفة هنا ليكون 35.8 ثانية ± 2.3 ثانية (ن = 5 قلوب).
هي إشارة البيروفات [1-13 C] التي تم الحصول عليها أثناء اكتساب [13C] بيكربونات. تم العثور على متوسطT eff في التجارب الموصوفة هنا ليكون 35.8 ثانية ± 2.3 ثانية (ن = 5 قلوب). - حدد نقاط البيانات التي يكون فيها التركيز في حدود 10٪ من إشارة البيروفات القصوى المصححة [1-13درجة مئوية] لمزيد من التحليل.
- استخدم البيانات المقابلة لإنتاج [1-13 C] lactate و [13C] بيكربونات للنقاط الزمنية المحددة في الخطوة 12.1لحساب معدلات إنتاج المستقلب باستخدام Eq. 4A و Eq. 4B ، بشرط أن يكون SNR لإشارة المستقلب أكبر من 2 (عتبة التحليل). يظهر مثال نموذجي لمثل هذا الاختيار من النقاط الزمنية في الشكل 2B (النافذة الزمنية المميزة).
- احسب معدلات الإنتاج لكل نقطة من نقاط البيانات المحددة باستخدام مكافئ 4A ومكافئ 4B:
 مكافئ 4 أ
مكافئ 4 أ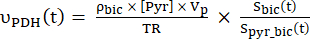 مكافئ 4 ب
مكافئ 4 ب
حيث ومعدلات
ومعدلات 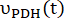 إنتاج [1-13 C] اللاكتات أو [13 C] بيكربونات في كل نقطة زمنية ، على التوالي. وهي
إنتاج [1-13 C] اللاكتات أو [13 C] بيكربونات في كل نقطة زمنية ، على التوالي. وهي 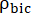 عوامل تمثل الإثارة النسبية ل [1-13 C] البيروفات والمنتجات [1-13 C] اللاكتات أو [13C] بيكربونات ، على التوالي.
عوامل تمثل الإثارة النسبية ل [1-13 C] البيروفات والمنتجات [1-13 C] اللاكتات أو [13C] بيكربونات ، على التوالي. تم تحديد هذه العوامل سابقا لتكون 0.113 و 0.139 ،على التوالي 29. Vp هو الحجم الذي يتم اكتشافه بواسطة مسبار الرنين المغناطيسي النووي (1.375 مل) ، يشير TR إلى الفاصل الزمني بين إثارتين متتاليتين للتشبع الانتقائي للمنتج (12 ثانية لكل منتج) ، وهي
تم تحديد هذه العوامل سابقا لتكون 0.113 و 0.139 ،على التوالي 29. Vp هو الحجم الذي يتم اكتشافه بواسطة مسبار الرنين المغناطيسي النووي (1.375 مل) ، يشير TR إلى الفاصل الزمني بين إثارتين متتاليتين للتشبع الانتقائي للمنتج (12 ثانية لكل منتج) ، وهي 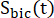 إشارات [1-13 C] lactate و [13 C] بيكربونات ، على التوالي ،
إشارات [1-13 C] lactate و [13 C] بيكربونات ، على التوالي ، 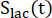 وهي
وهي 
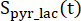 إشارات [1-13 C] البيروفات التي تم الحصول عليها خلال [1-13 C] اللاكتات و [13 ج] إثارة البيكربونات ، على التوالي. [Pyr] هو تركيز البيروفات [1-13 C] ، والذي كان 14mM خلال مرحلة الهضبة.
إشارات [1-13 C] البيروفات التي تم الحصول عليها خلال [1-13 C] اللاكتات و [13 ج] إثارة البيكربونات ، على التوالي. [Pyr] هو تركيز البيروفات [1-13 C] ، والذي كان 14mM خلال مرحلة الهضبة.- حدد معدل كل نقطة ثم المتوسط لكل حقنة مفرطة الاستقطاب.
النتائج
يظهر الشكل 1 أ أطياف 31P المسجلة من قلب فأر ممزوج ب KHB ومن المخزن المؤقت وحده. لوحظت إشارات α و β و γ-ATP و PCr و Pi في القلب. تتكون إشارة Pi من مكونين رئيسيين: في المجال الأعلى (الجانب الأيسر من الإشارة) ، كانت إشارة Pi في الغالب بسبب KHB عند درجة حموضة 7.4 ؛ في المجال السفلي (الجانب ا?...
Discussion
نعرض إعدادا تجريبيا مصمما للتحقيق في استقلاب البيروفات المفرط الاستقطاب [1-13C] ، وطاقة الأنسجة ، ودرجة الحموضة في نموذج قلب فأر معزول.
الخطوات الحاسمة داخل البروتوكول هي كما يلي: 1) التأكد من أن الرقم الهيدروجيني للمخزن المؤقت هو 7.4 ؛ 2) التأكد من تضمين جميع مكونات المخزن ...
Disclosures
لا توجد إفصاحات.
Acknowledgements
وتلقى هذا المشروع تمويلا من مؤسسة العلوم الإسرائيلية بموجب اتفاق المنحة رقم 1379/18؛ منحة جابوتنسكي من وزارة العلوم والتكنولوجيا الإسرائيلية للعلوم التطبيقية والهندسية لطلاب الدكتوراه المباشرة رقم 3-15892 ل DS ؛ وبرنامج البحث والابتكار Horizon 2020 التابع للاتحاد الأوروبي بموجب اتفاقية المنحة رقم 858149 (AlternativesToGd).
Materials
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| HyperSense DNP Polariser | Oxford Instruments | 52-ZNP91000 | HyperSense, 3.35 T, preclinical dissolution-DNP hyperpolarizer |
| NMR spectrometer | RS2D | NMR Cube, 5.8 T, equipped with a 10 mm broad-band probe | |
| Peristaltic pump | Cole-Parmer | 07554-95 | |
| Temperature probe | Osensa | FTX-100-LUX+ | NMR compatible temprature probe |
| Somnosuite low-flow anesthesia system | Kent Scientific | ||
| Lines, tubings, suture | |||
| Platinum cured silicone tubes | Cole-Parmer | HV-96119-16 | L/S 16 I.D. 3.1 mm |
| Thin polyether ether ketone (PEEK) lines | Upchurch Scientific | id. 0.040” | |
| Intravenous catheter | BD Medical | 381323 | 22 G |
| Silk suture | Ethicon | W577H | Wire diameter of 3-0 |
| Chemicals and pharmaceuticals | |||
| [1-13C]pyruvic acid | Cambridge Isotope Laboratories | CLM-8077-1 | |
| Calcium chloride | Sigma-Aldrich | 21074 | CAS: 10043-52-4 |
| D-(+)-Glucose | Sigma-Aldrich | G7528 | CAS: 50-99-77 |
| Heparin sodium | Rotexmedica | HEP5A0130C0160 | |
| Hydrochloric acid 37% | Sigma-Aldrich | 258148 | CAS: 7647-01-0 |
| Insulin aspart (NovoLog) | Novo Nordisk | ||
| Isoflurane | Terrel | ||
| Magnesium Sulfate | Sigma-Aldrich | 793612 | CAS: 7487-88-9 |
| Potassium chloride | Sigma-Aldrich | P4504 | CAS: 7447-40-7 |
| Potassium phosphate monobasic | Sigma-Aldrich | P9791 | CAS: 7778-77-0 |
| Sodium bicarbonate | Gadot Group | CAS: 144-55-8 | |
| Sodium chloride | Sigma-Aldrich | S9625 | CAS: 7647-14-5 |
| Sodium hydroxide | Sigma-Aldrich | 655104 | CAS: 1310-73-2 |
| Sodium phosphate dibasic | Sigma-Aldrich | S7907 | CAS: 7558-79-4 |
| Sodium phosphate monobasic dihydrate | Merck | 6345 | CAS: 13472-35-0 |
| TRIS (biotechnology grade) | Amresco | 0826 | CAS: 77-86-1 |
| Trityl radical OX063 | GE Healthcare AS | NC100136 | OX063 |
| NMR standards | |||
| 13C standard sample | Cambridge Isotope Laboratories | DLM-72A | 40% p-dioxane in benzene-D6 |
| 31P standard sample | Made in house | 105 mM ATP and 120 mM phenylphosphonic acid in D2O | |
| Software | |||
| Excel 2016 | Microsoft | ||
| MNova | Mestrelab Research |
References
- Aquaro, G. D., Menichetti, L. Hyperpolarized 13C-magnetic resonance spectroscopy: Are we ready for metabolic imaging. Circulation. Cardiovascular Imaging. 7 (6), 854-856 (2014).
- Schroeder, M. A., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB Journal. 23 (8), 2529-2538 (2009).
- Ardenkjaer-Larsen, J. H., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proceedings of the National Academy of Sciences of the United States of America. 100 (18), 10158-10163 (2003).
- Merritt, M. E., et al. Hyperpolarized C-13 allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proceedings of the National Academy of Sciences of the United States of America. 104 (50), 19773-19777 (2007).
- Ball, D. R., et al. Hyperpolarized butyrate: A metabolic probe of short chain fatty acid metabolism in the heart. Magn Reson Med. (5), 1663-1669 (2014).
- Khemtong, C., Carpenter, N. R., Lumata, L. L., et al. Hyperpolarized 13C NMR detects rapid drug-induced changes in cardiac metabolism. Magnetic Resonance in Medicine. 74 (2), 312-319 (2015).
- Mariotti, E., et al. Modeling non-linear kinetics of hyperpolarized [1-13C] pyruvate in the crystalloid-perfused rat heart. NMR in Biomedicine. 29 (4), 377-386 (2016).
- Moreno, K. X., Sabelhaus, S. M., Merritt, M. E., Sherry, A. D., Malloy, C. R. Competition of pyruvate with physiological substrates for oxidation by the heart: implications for studies with hyperpolarized [1-13C]pyruvate. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), H1556-H1564 (2010).
- Purmal, C., et al. Propionate stimulates pyruvate oxidation in the presence of acetate. American Journal of Physiology-Heart and Circulatory Physiology. 307 (8), H1134-H1141 (2014).
- Weiss, K., et al. Developing hyperpolarized 13C spectroscopy and imaging for metabolic studies in the isolated perfused rat heart. Applied Magnetic Resonance. 43 (1), 275-288 (2012).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia: NMR detection of hyperpolarized 13CO2and H13CO3. Magnetic Resonance in Medicine. 60 (5), 1029-1036 (2008).
- Schroeder, M. A., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovascular Research. 86 (1), 82-91 (2010).
- Ball, D. R., et al. Metabolic imaging of acute and chronic infarction in the perfused rat heart using hyperpolarised [1-13C]pyruvate. NMR in Biomedicine. 26 (11), 1441-1450 (2013).
- Atherton, H. J., et al. Role of PDH inhibition in the development of hypertrophy in the hyperthyroid rat heart: a combined magnetic resonance imaging and hyperpolarized magnetic resonance spectroscopy study. Circulation. 123 (22), 2552-2561 (2011).
- Harris, T., et al. Hyperpolarized product selective saturating-excitations for determination of changes in metabolic reaction rates in real-time. NMR in Biomedicine. 33 (2), e4189 (2020).
- Shaul, D., et al. Correlation between lactate dehydrogenase/pyruvate dehydrogenase activities ratio and tissue pH in the perfused mouse heart: A potential noninvasive indicator of cardiac pH provided by hyperpolarized magnetic resonance. NMR in Biomedicine. 34 (2), e4444 (2021).
- Jian, Z., et al. In vivo cannulation methods for cardiomyocytes isolation from heart disease models. PLoS One. 11 (8), e0160605 (2016).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacological Research. 41 (6), 613-627 (2000).
- Lateef, R., Al-Masri, A., Alyahya, A. Langendorff's isolated perfused rat heart technique: A review. International Journal of Basic and Clinical Pharmacology. 4, 1314-1322 (2015).
- Cross, H. R., Radda, G. K., Clarke, K. The role of Na+/K+ ATPase activity during low-flow ischemia in preventing myocardial injury - A 31P, 23Na and 87Rb NMR spectroscopic study. Magnetic Resonance in Medicine. 34 (5), 673-685 (1995).
- Cross, H. R., Clarke, K., Opie, L. H., Radda, G. K. Is lactate-induced myocardial ischaemic injury mediated by decreased pH or increased intracellular lactate. Journal of Molecular and Cellular Cardiology. 27 (7), 1369-1381 (1995).
- Clarke, K., O'Connor, A. J., Willis, R. J. Temporal relation between energy metabolism and myocardial function during ischemia and reperfusion. American Journal of Physiology. 253 (2), H412-H421 (1987).
- Yabe, T., Mitsunami, K., Inubushi, T., Kinoshita, M. Quantitative measurements of cardiac phosphorus metabolites in coronary artery disease by 31P magnetic resonance spectroscopy. Circulation. 92 (1), 15-23 (1995).
- Bakrania, B., Granger, J. P., Harmancey, R. Methods for the determination of rates of glucose and fatty acid oxidation in the isolated working rat heart. Journal of Visualized Experiments. (115), e54497 (2016).
- Cordeiro, B., Clements, R. Murine isolated heart model of myocardial stunning associated with cardioplegic arrest. Journal of Visualized Experiments. (102), e52433 (2015).
- Kolwicz, S. C., Tian, R. Assessment of cardiac function and energetics in isolated mouse hearts using 31P NMR spectroscopy. Journal of Visualized Experiments. (42), e2069 (2010).
- Nakadate, Y., et al. Glycemia and the cardioprotective effects of insulin pre-conditioning in the isolated rat heart. Cardiovascular Diabetology. 16 (1), 43 (2017).
- Lauritzen, M. H., et al. Enhancing the C-13 bicarbonate signal in cardiac hyperpolarized 1-C-13 pyruvate MRS studies by infusion of glucose, insulin and potassium. NMR in Biomedicine. 26 (11), 1496-1500 (2013).
- Adler-Levy, Y., et al. In-cell determination of lactate dehydrogenase activity in a luminal breast cancer model - ex vivo investigation of excised xenograft tumor slices using dDNP hyperpolarized [1-13C]pyruvate. Sensors. 19 (9), 2089 (2019).
- Young, A. A., Barnes, H., Davison, D., Neubauer, S., Schneider, J. E. Fast left ventricular mass and volume assessment in mice with three-dimensional guide-point modeling. Journal of Magnetic Resonance Imaging. 30 (3), 514-520 (2009).
- Bailey, I. A., Williams, S. R., Radda, G. K., Gadian, D. G. Activity of phosphorylase in total global ischaemia in the rat heart. A phosphorus-31 nuclear-magnetic-resonance study. Biochemical Journal. 196 (1), 171-178 (1981).
- Lutz, N. W., Le Fur, Y., Chiche, J., Pouyssegur, J., Cozzone, P. J. Quantitative in vivo characterization of intracellular and extracellular pH profiles in heterogeneous tumors: A novel method enabling multiparametric pH analysis. Cancer Research. 7 (15), 4616-4628 (2013).
- Harris, T., Gamliel, A., Sosna, J., Gomori, J. M., Katz-Brull, R. Impurities of [1-13C]pyruvic acid and a method to minimize their signals for hyperpolarized pyruvate metabolism studies. Applied Magnetic Resonance. 49 (10), 1085-1098 (2018).
- Cunningham, C. H., et al. Hyperpolarized 13C metabolic MRI of the human heart initial experience. Circulation Research. 119 (11), 1177-1182 (2016).
- Kurhanewicz, J., et al. Hyperpolarized 13C MRI: Path to clinical translation in oncology. Neoplasia. 21 (1), 1-16 (2019).
- Miloushev, V. Z., et al. Metabolic imaging of the human brain with hyperpolarized 13C pyruvate demonstrates 13C lactate production in brain tumor patients. Cancer Research. 78 (14), 3755-3760 (2018).
- Park, I., et al. Development of methods and feasibility of using hyperpolarized carbon-13 imaging data for evaluating brain metabolism in patient studies. Magnetic Resonance in Medicine. 80 (3), 864-873 (2018).
- Grist, J. T., et al. Quantifying normal human brain metabolism using hyperpolarized [1-13C]pyruvate and magnetic resonance imaging. Neuroimage. 189, 171-179 (2019).
- Nelson, S. J., et al. Metabolic imaging of patients with prostate cancer using hyperpolarized [1-C]pyruvate. Science Translational Medicine. 5 (198), (2013).
- Stødkilde-Jørgensen, H., et al. Pilot study experiences with hyperpolarized [1-13C]pyruvate MRI in pancreatic cancer patients. Journal of Magnetic Resonance Imaging. 51 (3), 961-963 (2019).
- Autry, A. W., et al. Measuring tumor metabolism in pediatric diffuse intrinsic pontine glioma using hyperpolarized carbon-13 MR metabolic imaging. Contrast Media and Molecular Imaging. 2018, 3215658 (2018).
- Chung, B. T., et al. First hyperpolarized [2-13C]pyruvate MR studies of human brain metabolism. Journal of Magnetic Resonance. 309, 106617 (2019).
- Rider, O. J., et al. Noninvasive in vivo assessment of cardiac metabolism in the healthy and diabetic human heart using hyperpolarized 13C MRI. Circulation Research. 126 (6), 725-736 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved