Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hiperpolarize [1-13 C] Piruvat ve13 C/31P NMR Spektroskopisi ile İzole Perfüze Fare Kalbinde Kardiyak Metabolizmanın İncelenmesi
Bu Makalede
Özet
Sürekli perfüzyon modunda hiperpolarize 13C etiketli metabolitin izole perfüze edilmiş bir fare kalbine uygulanması için deneysel bir kurulum tanımladık. Özel bir 13C-NMR edinme yaklaşımı, metabolik enzim aktivitesinin gerçek zamanlı olarak nicelleştirilmesini sağladı ve multiparametrik 31P-NMR analizi, doku ATP içeriğinin ve pH'ının belirlenmesini sağladı.
Özet
Metabolizma, hücresel yaşamdaki önemli süreçlerin temelidir. Metabolik ağların canlı dokularda nasıl işlediğini karakterize etmek, hastalıkların mekanizmasını anlamak ve tedavileri tasarlamak için çok önemli bilgiler sağlar. Bu çalışmada, geriye dönük olarak perfüze edilmiş bir fare kalbindeki hücre içi metabolik aktiviteyi gerçek zamanlı olarak incelemek için prosedürleri ve metodolojileri açıklıyoruz. Kalp, miyokard iskemisini en aza indirmek için kalp durması ile birlikte in situ olarak izole edildi ve bir nükleer manyetik rezonans (NMR) spektrometresi içinde perfüze edildi. Spektrometrede ve sürekli perfüzyon altındayken, kalbe hiperpolarize [1-13 C] piruvat verildi ve sonraki hiperpolarize [1-13 C] laktat ve [13C] bikarbonat üretim hızları, gerçek zamanlı olarak, laktat dehidrogenaz ve piruvat dehidrogenaz üretim oranlarını belirlemeye hizmet etti. Hiperpolarize [1-13C] piruvat'ın bu metabolik aktivitesi, ürün seçici doygunluk-uyarma edinimi yaklaşımı kullanılarak NMR spektroskopisi ile modelsiz bir şekilde ölçüldü. 31 adet P spektroskopisi, kardiyak enerjileri ve pH'ı izlemek için hiperpolarize edinimler arasında uygulandı. Bu sistem, sağlıklı ve hastalıklı fare kalbindeki metabolik aktiviteyi incelemek için benzersiz bir şekilde yararlıdır.
Giriş
Kardiyak metabolizmadaki değişiklikler çeşitli kardiyomiyopatilerle ilişkilidir ve sıklıkla altta yatan patofizyolojik mekanizmaların temelini oluşturur1. Bununla birlikte, canlı dokulardaki metabolizmayı incelemenin önünde çok sayıda engel vardır, çünkü çoğu biyokimyasal tahlil doku ve hücre lizisinin homojenizasyonunu ve / veya radyoaktif izlemeyi gerektirir. Bu nedenle, canlı dokulardaki miyokard metabolizmasını araştırmak için yeni araçlara acil bir ihtiyaç vardır. Hiperpolarize 13C etiketli substratların manyetik rezonansı (MR), iyonlaştırıcı radyasyon kullanılmadan, etiketli bölgelerin MR sinyal-gürültü (SNR) oranını3 büyüklüğünde birkaç sıra artırarak, canlı dokularda metabolizmanın gerçek zamanlı ölçümlerine izin verir2. Burada, izole edilmiş fare kalbindeki hızlı metabolizmayı incelemek için bir deney düzeneği, bir edinme yaklaşımı ve analitik bir yaklaşım ve paralel olarak genel doku enerjilerinin ve asitliğinin göstergelerini açıklıyoruz. Kardiyak pH değerli bir göstergedir, çünkü asit-baz dengesi kalp hastalıklarının ve miyokard iskemisi, uyumsuz hipertrofi ve kalp yetmezliği gibi durumların erken evrelerinde bozulur6.
Hiperpolarize [1-13 C] laktat ve [13C] hiperpolarize [1-13C] piruvattan bikarbonat üretimi, laktat dehidrogenaz (LDH) ve piruvat dehidrogenaz (PDH) üretim oranlarının belirlenmesinde yardımcı olur. İzole kemirgen kalbindeki hiperpolarize substratlar kullanılarak yapılan önceki çalışmaların çoğu, LDH ve PDH'nin enzimatik aktivitesini elde etmek için karmaşık kinetik modeller kullandı ya da gerçek enzim aktivite oranlarını hesaplamadan hiperpolarize ürünün sinyal yoğunluğu oranlarını bir substrata bildirdi 2,4,5,6,7,8,9,10, 11,12,13,14. Burada, enzim aktivitesinin modelsiz bir şekilde izlenmesini sağlayan ürün seçici doygunluk-uyarım yaklaşımı 15'i kullandık15,16. Bu şekilde, mutlak enzimatik oranlar (yani, birim zaman başına üretilen ürün mol sayısı) belirlendi. 31 adet P spektroskopisi, inorganik fosfat (Pi), fosfokreatin (PCr) ve adenozin trifosfat (ATP) sinyallerini gözlemlemek için kullanıldı. Kalbin pH dağılımını karakterize etmek için, dokunun Pi sinyalindeki heterojen kimyasal kayma ile gösterildiği gibi, multi-parametrik bir analiz kullanılmıştır.
Geriye dönük olarak perfüze edilmiş fare kalbi (Langendorff kalbi)17,18,19, sağlam atan kalp için ex vivo bir modeldir. Bu modelde, kalp canlılığı ve pH en az 80 dakika 20 boyunca korunur ve uzun süreli iskemik yaralanma21,22 sonrasında iyileşme potansiyeli göstermiştir. Bununla birlikte, mikro-cerrahi sırasında yanlışlıkla değişkenlik, kalpler arasında doku canlılığında değişkenliğe yol açabilir. Önceki çalışmalar, bu kalbin zamanla bozulması hakkında rapor vermiştir19; örneğin, kontraktil fonksiyonda saatte %5-%10'luk bir azalma gözlenmiştir18. Adenozin trifosfat (ATP) sinyalinin daha önce miyokard enerjik durumu ve canlılığı hakkında rapor verdiği gösterilmiştir23. Burada, perfüze edilmiş kalbin, kesintisiz bir perfüzyon ve oksijen kaynağına sahip olmamıza rağmen, ATP içeriğinin gösterdiği gibi, canlılık seviyelerinde bazen kasıtsız değişkenlik gösterebileceğini belirttik. Burada LDH ve PDH oranlarının kalbin ATP içeriğine normalleştirilmesinin, bu oranlardaki kalpler arası değişkenliği azalttığını gösteriyoruz.
Aşağıdaki protokolde, NMR spektrometresinde kalp kanülasyonu, izolasyonu ve bunun sonucunda perfüzyon için kullanılan cerrahi prosedürü açıklamaktayız. Not olarak, fare kalbini izole etmeyi ve perfüzyonu amaçlayan diğer cerrahi yaklaşımlar 24,25'ten önce tanımlanmıştır.
Atan kalpteki enzimatik oranlar (13 C spektroskopisi ve hiperpolarize [1-13C] piruvat kullanılarak) ve kalbin canlılığı ve asitliği (31P NMR spektroskopisi kullanılarak) ile ilgili verileri elde etmek için kullanılan metodolojiler de tanımlanmıştır. Son olarak, metabolik enzim aktivitelerinin ve doku canlılığının ve asitliğinin belirlenmesi için analitik metodolojiler açıklanmaktadır.
Protokol
İbrani Üniversitesi ve Hadassah Tıp Merkezi'nin ortak etik komitesi (IACUC), hayvan refahı için çalışma protokolünü onayladı (MD-19-15827-1).
1. Krebs-Henseleit tampon hazırlama
- Deneyden bir gün önce, Krebs-Henseleit tamponunun (KHB)26'nın değiştirilmiş bir versiyonunu hazırlayın. Başlangıçta, 118 mM NaCl, 4.7 mM KCl, 0.5 mM piruvat, 1.2 mM MgSO 4, 25 mM NaHCO3 ve 1.2 mM KH2PO4'ü çift damıtılmış H2O'da çözün.
- Bu karışımı 20 dakika boyunca %95/%5 O2/CO 2 ile kabarcıklayın ve ardından 1,2 mM CaCl2 ekleyin.
- HCl veya NaOH ile tamponun pH'ını 7,4'e ayarlayın.
- Deney gününde, adım 1.2'de hazırlanan KHB'ye 10 mM glikoz ve 72 U / L insülin ekleyin.
NOT: İnsülin, Kolwicz ve ark.26'nın çalışmasında açıklandığı gibi perfüzyon tamponuna eklenir ve insülinin kontraktil fonksiyon27'yi ve hiperpolarize [13C] bikarbonat sinyalinin yoğunluğunu arttırdığını bildiren önceki çalışmalarla uyumlu olarak28.
2. Perfüzyon sistemi hazırlığı
- 40 ° C'de bir su banyosunda 200 mL'lik bir KHB rezervuarı tutun ve kardiyak perfüzyondan önce 1 saat boyunca 4 L / dak akış hızında% 95 / 5% O2 / CO 2 ile kabarcık tutun. Tamponun deney boyunca bu gaz karışımı ile sürekli köpürmesini sağlayın.
- İlk önce su banyosunu 40 °C'ye ayarlayın. KHB rezervuarını yerleştirin. KHB'yi tampon rezervuarı ile 10 mm NMR tüpü arasında 7,5 mL / dak'lık sabit bir akış hızında yeniden dolaştırmak için peristaltik bir pompa ( Malzeme Tablosuna bakınız) ve tıbbi sınıf uzatma tüpleri kullanın.
- Pompaya üç platin kürlü silikon tüp (3 mm i.d.) bağlayın (KH tamponu için bir giriş borusu ve iki çıkış borusu). Çıkış ve giriş hatlarını ısıtılmış KH tamponuna yerleştirin. Ardından, oksijen hattını ısıtılmış KH tamponuna yerleştirin.
- Tampon ve hiperpolarize ajanın spektrometrenin deliği içindeki NMR tüpüne ve tüpünden akması için ince polieter eter keton (PEEK, Malzeme Tablosuna bakınız) çizgileri kullanın.
- Sıcaklığın 37-37,5 °C'de tutulduğundan emin olun. Aşağıdaki adımları izleyin.
- Giriş hattını (tampon rezervuarından NMR tüpüne) 42 ° C'ye ayarlanmış bir ısıtma bandı ile sarın.
- Spektrometrenin içindeki NMR tüpünü, spektrometre tarafından düzenlenen sıcak bir hava akımıyla ısıtın.
- NMR tüpünün içindeki sıcaklığı ölçmek için NMR uyumlu bir sıcaklık sensörü kullanın (bkz. Sıcaklık 37-37.5 ° C'ye ayarlanır.
3. NMR spektrometresinin kalibrasyonu ve edinimi için hazırlanması
- Deney gününde, spektrometreye 1,4-dioksan (Malzeme Tablosu) içeren 13 C standart bir numune yerleştirin ve NMR probunu 13C için ayarlayın ve eşleştirin. Ardından, 90 ° 'lik bir somun açısına sahip 1,4-dioksanın termal denge sinyalini gösteren bir spektrum elde edin.
- Şimdi 13C standart numuneyi, D2O. Tune'da 105 mM ATP içeren 31P standart numune (Malzeme Tablosu) ile değiştirin ve NMR probunu 31P ile eşleştirin.
NOT: Isıl denge fosfat sinyallerini gösteren bir spektrum, 50°'lik bir nutasyon açısı ile elde edilir. - Giriş hattını, çıkış hattını ve sıcaklık probunu 10 mm'lik bir NMR tüpüne yerleştirin ve ardından tüpü manyetik deliğe yerleştirin. Isıtma bandını 42 °C'ye ayarlayın.
- Bu deneyde 30 dakika boyunca kullanılacak dolaşımdaki KH tamponunun 31P NMR spektrumunu, 50 ° 'lik bir somunasyon açısı ve 1.1 s'lik bir TR (1.640 kazanım) elde edin.
4. Hayvan hazırlığı, cerrahi prosedür ve NMR tüpünde kalbin perfüzyonu
- Bir erkek HSD:ICR (CD-1) faresini, bir indüksiyon odasında bir gaz anestezi sistemi (Malzeme Tablosu) kullanarak 5 dakika boyunca 340 mL/dk'da oda havasında (Malzeme Tablosu) %3,3 izofluran ile anestezi altına alın.
- % 2.9 izofluran ile genel anestezinin sürdürülmesi için burun anestezisi kullanın.
NOT: Hayvana ağrı ve rahatsızlığı en aza indirmek için özen gösterilir. - Hayvanın uzuvlarını bantla sabitleyin, negatif pedal ağrısı refleksi sağlayın ve ardından intraperitoneal olarak 300 IU sodyum heparin enjekte edin.
- Temizliği sağlamak ve cerrahi işlem sırasında saç kontaminasyonunu veya tıkanıklığını önlemek için farenin göğüs duvarını ve karnını %70 alkolle iyice ıslatın.
- Heparin enjeksiyonundan 1 dakika sonra, karın boşluğunun derisini ve kasını küçük makasla kesin.
- Göğsü kaldırmak ve diyaframı ortaya çıkarmak için küçük kavisli çene hemostat kilitleme sivrisinek kelepçesini ksifoid süreç ile göğüs derisi arasına yerleştirin. Diyaframın sağ lobunu delin ve kesin.
- Göğsü orta hat boyunca kesin, yanlara geri çekin ve sonra çıkarın.
- Kanın pıhtılaşmasını önlemek için kalbin sol ventrikülüne 200 IU sodyum heparin enjekte edin. Daha sonra, daha önce tarif edildiği gibi kalp durması elde etmek için 0.1 mL buz gibi soğuk 0.5 mol / L KCl enjekte edin25. Kardiyak arrest, kalbi kanüle edebilmek için şarttır.
- Timüsü tanımlayın ve aortu açığa çıkarmak için makas kullanarak çıkarın. Artık göğüs kafesi dokusunu çıkarın.
- Aort kemerini tanımlayın ve yükselen aortun etrafına 3-0 ipek sütür (Malzeme Tablosu) ile gevşek bir düğüm yerleştirmek için kavisli forseps kullanın. Aorttan kan pıhtılarını çıkarmak için sol ventriküle 3 mL KHB enjekte edin.
- Yükselen aortun daha iyi görselleştirilmesi için kalbi aşağı doğru geri çekmek için kavisli forseps kullanın.
- 22 G intravenöz kateter ile yerinde kanülasyon yapın (Malzeme Tablosu). Kanüllenmiş bölgeye siyanoakrilat yapıştırıcı uygulayın ve ardından çift dikiş bağlama işlemi gerçekleştirin. Kalbe ek KH tamponu enjekte edin ve kanülasyon tüpünden aktığını doğrulayın.
- Kavisli forsepsleri çıkarın. Kalbi çevreleyen iç organlardan ayırın ve intravenöz kateter boyunca buz gibi soğuk KHB (4 ° C) ile geriye doğru perfüze edin.
- İntravenöz kateter aracılığıyla kalbi perfüzyon sisteminin giriş hattına bağlayın. 7.5 mL/dk'da ılık tamponla (37-37.5 °C) perfüzyonun başlaması üzerine, kalp kendiliğinden atmaya başlar.
- NMR tüpünü atan kalp, çıkış hatları ve sıcaklık probu ile sabitleyin ve kalbin NMR probunun merkezinde olduğundan emin olarak spektrometrenin deliğine yerleştirin.
5. Kardiyak enerjiler ve pH için veri edinme
- 50 ° 'lik bir çevirme açısı ve 1.1 s'lik bir TR ile yaklaşık 1 saat boyunca 31P spektrumu elde edin.
6. DNP spin polarizasyonu ve çözünmesi
- 28.5 mg'lık bir [1-13C] piruvat formülasyonu hazırlayın. Bu formülasyon, temiz asit içinde 11.1 mM ila 14.0 mM OX063 radikalinden oluşur.
- 4 mL çözünme ortamı hazırlayın. Çözünme ortamı, 11.2 mM NaH 2 PO4, 38.8 mMNa 2HPO4, 33 mM TRIS ve2mM HCl içeren TRIS-fosfat tamponundan oluşur. Bu ortam bileşimi, bu tamponun 4 mL'sine (çözünme fazında) 28.5 mg [1-13C] piruvik asit formülasyonu eklendiğinde, elde edilen çözeltinin pH'ı 7.4 olacak şekilde ayarlanır.
- Üreticinin talimatlarına göre bir çözünme-DNP (dDNP) spin polarizasyon cihazında spin polarizasyonu ve hızlı çözünme gerçekleştirin (Malzeme Tablosu). Yaklaşık 1,5 saat boyunca 1,45 K ila 1,55 K'da [1-13C] piruvik asit formülasyonunun polarizasyonu için 94,110 GHz frekansında mikrodalga ışınlaması uygulayın.
- Perfüzyon ortamıyla yakından eşleşen bir bileşim elde etmek için dDNP cihazından 4 mL'lik hiperpolarize ortamın hiperpolarize çözünme ortamını tamamlayan iyi oksijenli bir çözelti ile hızlı bir şekilde karıştırın.
NOT: 14 mM hiperpolarize [1-13C] piruvat ile hiperpolarize enjeksiyonlar sırasında kalbi perfüze eden ortamın son hacmi 26 mL'dir. Enjekte edilen ortamın son bileşimi (karıştırıldıktan sonra) 4.7 mM KCl, 1.2 mM MgSO 4, 70 mM NaCl, 25 mM NaHCO3, 1.2 mM KH 2 PO4, 10 mM glikoz, 1.2 mM CaCl2ve 72 U / L insülin içerir. - Hiperpolarize [1-13C] piruvat içeren ortamı, sürekli bir akış düzeni kullanarak izole edilmiş kalbe uygulayın29.
NOT: Bu, deney sırasında kalp perfüzyonunun herhangi bir noktada bozulmamasını ve hiperpolarize ortamın bilinen bir hızda ve bilinen bir süre boyunca uygulanmasını sağlamak için yapılır.
7. Hiperpolarize 13C spektroskopisi
- Daha önce açıklandığı gibi 2,5 ms kardinal sinüs (Sinc) darbeleri uygulayarak ürün seçici doygunluk-uyarma darbeleri 15'i kullanarak hiperpolarize 13C verilerini elde edin. Her metabolit için 12s'lik bir aralık elde etmek için seçici olarak [1-13 C] laktat ve [13C] bikarbonatı art arda 6 s aralıklarla uyarın.
- [1-13C] laktat tespiti için, seçici Sinc darbesini [1-13 C] piruvat hidrat frekansında (179.4 ppm) ortalayın, bu da [1-13 C] piruvat'ın C1 sinyalleri için 0.113'lük sinyal yoğunluğu oranı (lak) ile sonuçlanır [1-13C] laktat.
- [13C] bikarbonat tespiti için, seçici Sinc darbesini 157,7 ppm'de ortalayın, bu da [13C] bikarbonat sinyalinin (161,1 ppm) 214 Hz aşağı alanıdır; bu, [1-13 C] piruvatın [13 C] bikarbonatın C1sinyali için 0.139'lukbir sinyal yoğunluğu oranı (bic) ile sonuçlanır.
8. Dokunun ıslak ağırlık ve hacminin belirlenmesi
- Deneyin sonunda, kalbi perfüzyon sisteminden ayırın ve kağıt mendille hafifçe kurulayın. Daha sonra, doku ıslak ağırlığını elde etmek için kalbi tartın.
- Daha önce fare kalbi30 için belirlenen 1,05 g/cm3'lük bir yoğunluk faktörü kullanarak kalbin hacmini belirleyin.
9. ATP içerik ölçümü
- ATP standart numunesinin tek bir alımının γ-ATP sinyalini ve izole kalbin 30 dakikalık bir alımını (TR 1.1 s ve 1.640 alım) entegre edin.
- Kalbin γ-ATP sinyalinin integralini, ikincisinin bilinen bir konsantrasyona (105 mM) sahip olduğu standartla (Malzeme Tablosu) karşılaştırarak kalbin ATP içeriğini ölçün ve edinim sayısı ve gevşeme etkileri için düzeltin.
10. Kalbin Pi sinyalini çözmek
NOT: Doku pH'ını değerlendirmek için, öncelikle kalbin Pi sinyalini toplam Pi sinyalinden (Pit) ayırmak gerekir. Bu, KHB Pi'nin (PiKH) sinyalini Pit'ninkinden çıkararak yapılır.
- Tek bir Pi sinyali gösteren 31P'lik bir KHB spektrumunda (Pi KH, Şekil 1A), PiKH sinyalini Excel (Malzeme Tablosu) kullanarak bir Lorentzian işlevine sığdırın.
- NMR probu tarafından görülebilen hacim (Vp, 1.375 mL), numune tüpü kalbi içermediğinde daha fazla KHB içerir. Bu doldurma etkisini düzeltmek için, Eq. 1A'yı kullanarak zayıflatılmış tampon sinyalini (Pib) hesaplayın.
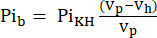 Eq 1A
Eq 1A
burada Vh , adım 8'de belirlendiği gibi kalbin hacmidir. - Sadece perfüze edilmiş kalpten kaynaklanan Pi sinyalini elde etmek için bu sinyali Eq. 1B'ye göre Pit'den çıkarın (Pih, Şekil 1B).
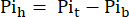 Ek. 1B
Ek. 1B
11. Çok parametrik pH analizi
- Pih sinyali kimyasal kayma dağılımının, PCr'nin kimyasal kaymasına atıfta bulunarak pH'a dönüştürülmesini Eq. 231 kullanarak gerçekleştirin.
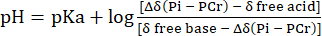 Eq 2
Eq 2
burada Δδ kimyasal kayma farkıdır, pKa 6.72, serbest baz δ 5.69 ve δ serbest asit 3.27'dir, daha önce açıklandığı gibi31'dir. - Lutz ve ark.32'ye göre, Pih kimyasal kayma ölçeği ile pH ölçeği arasındaki doğrusal olmayan için ortaya çıkan pH dağılım eğrisini düzeltin. Bu hesaplamadan kaynaklanan tipik bir pH dağılımı Şekil 1C'de sunulmuştur.
- Lutz ve ark.'nın çalışmalarını takiben yedi istatistiksel parametre kullanarak doku pH dağılımını multi-parametrik bir yaklaşımla analiz edin. 32. Bu parametrelerden dördü, doku pH'ının en tanımlayıcısı gibi göründükleri için burada sunulmuştur: 1) global maksimum pH; 2) ağırlıklı ortalama pH; 3) ağırlıklı medyan pH; ve 4) pH grafiğinin çarpıklığı (Şekil 1C).
12. LDH ve PDH faaliyetlerinin hesaplanması
NOT: Hiperpolarize metabolitlerin [1-13C] laktat ve [13C] bikarbonatın üretim hızları, sırasıyla LDH ve PDH aktivitelerini hesaplamak için kullanılır. Ürün seçici doygunluk-uyarma yaklaşımı15'te, her seçici uyarma ile sadece yeni sentezlenmiş hiperpolarize metabolitler tespit edilir.
- Karşılık gelen metabolit üretim seviyesini belirlemek için hiperpolarize [1-13C] piruvat sinyalini referans olarak kullanın.
- Hiperpolarize ortam ile perfüzyon sırasında, NMR tüpündeki [1-13C] piruvat konsantrasyonu artar (yıkama), daha sonra platolar (maksimum 14 mM konsantrasyonda) ve sonra azalır (yıkama).
- Piruvat konsantrasyonunun sabit bir seviyeye (plato) ulaştığı zaman noktalarını belirlemek için, etkili gevşeme sabiti Teff'yi kullanarak T 1 gevşemesi ve RF titreşiminden kaynaklanan sinyal bozunumu için [1-13 C] piruvat sinyalini düzeltin.
- Her enjeksiyon için, Teff'yi bu akış dinamiklerini göstermek için [1-13C] piruvat bozunma eğrisini düzeltme yeteneğine dayanarak tanımlayın (Eq.3).
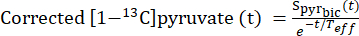 Ek 3
Ek 3
[13C]bikarbonat edinimi sırasında elde edilen [1-13C]piruvat sinyali nerededir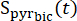 ? Burada açıklanan deneylerde ortalama Teff 35.8 s ± 2.3 s (n = 5 kalp) olarak bulunmuştur.
? Burada açıklanan deneylerde ortalama Teff 35.8 s ± 2.3 s (n = 5 kalp) olarak bulunmuştur. - Daha fazla analiz için konsantrasyonun maksimum düzeltilmiş [1-13 C] piruvat sinyalinin% 10'uiçinde olduğu veri noktalarını seçin.
- Metabolit sinyalinin SNR'sinin 2'den (analiz eşiği) büyük olması koşuluyla, Eq. 4A ve Eq. 4B kullanılarak metabolit üretim hızlarının hesaplanması için adım 12.1'de seçilen zaman noktaları için [1-13C] laktat ve [13C] bikarbonat üretiminin karşılık gelen verilerini kullanın. Böyle bir zaman noktası seçiminin tipik bir örneği Şekil 2B'de (vurgulanan zamansal pencere) gösterilmiştir.
- Seçilen veri noktalarının her birinin üretim oranlarını Eq 4A ve Eq. 4B kullanarak hesaplayın:
 Ek 4A
Ek 4A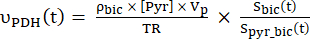 Ek. 4B
Ek. 4B
sırasıyla her zaman noktasında [1-13 C]laktat veya [13 C]bikarbonat üretim hızları nerede ve nerede ve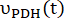 nerede
nerede  ve [13 C]bikarbonat sırasıyla [1-13 C]piruvat ve
ve [13 C]bikarbonat sırasıyla [1-13 C]piruvat ve 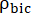 ürünlerin [1-13C]laktat veya [
ürünlerin [1-13C]laktat veya [ 13C]bikarbonatın nispi uyarılmasını temsil eden faktörlerdir. Bu faktörler daha önce sırasıyla 0.113 ve 0.139,29 olarak belirlendi. V p, NMR probu (1.375 mL) tarafından tespit edilen hacimdir, TR, iki ardışık ürün seçici doygunluk uyarımı arasındaki zaman aralığını (her
13C]bikarbonatın nispi uyarılmasını temsil eden faktörlerdir. Bu faktörler daha önce sırasıyla 0.113 ve 0.139,29 olarak belirlendi. V p, NMR probu (1.375 mL) tarafından tespit edilen hacimdir, TR, iki ardışık ürün seçici doygunluk uyarımı arasındaki zaman aralığını (her 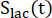 ürün için 12 s) gösterir ve sırasıyla [1-13 C] laktat ve [13 C] bikarbonat sinyalleridir ve
ürün için 12 s) gösterir ve sırasıyla [1-13 C] laktat ve [13 C] bikarbonat sinyalleridir ve 
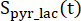 [1-13 C] laktat ve
[1-13 C] laktat ve 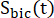 [13 C] sırasında elde edilen [1-13 C] piruvat sinyalleridir. C] bikarbonat uyarımları, sırasıyla. [Pyr], plato fazında 14 mM olan [1-13C] piruvat konsantrasyonudur.
[13 C] sırasında elde edilen [1-13 C] piruvat sinyalleridir. C] bikarbonat uyarımları, sırasıyla. [Pyr], plato fazında 14 mM olan [1-13C] piruvat konsantrasyonudur.- Her nokta için hızı ve ardından hiperpolarize enjeksiyon başına ortalamayı belirleyin.
Sonuçlar
KHB ile perfüze edilmiş bir fare kalbinden ve yalnızca tampondan kaydedilen 31P spektrumları Şekil 1A'da gösterilmiştir. Kalpte α, β ve γ-ATP, PCr ve Pi sinyalleri gözlendi. Pi sinyali iki ana bileşenden oluşuyordu: daha yüksek alanda (sinyalin sol tarafında), Pi sinyali çoğunlukla 7.4'lük bir pH'taki KHB'den kaynaklanıyordu; alt alanda (sinyalin sağ tarafında), Pi sinyali daha asidik ortam nedeniyle daha geniş ve daha az homojendi. İkinci model kalp dokusun...
Tartışmalar
İzole bir fare kalp modelinde hiperpolarize [1-13C] piruvat metabolizmasını, doku enerjilerini ve pH'ı araştırmak için tasarlanmış deneysel bir kurulum gösteriyoruz.
Protokoldeki kritik adımlar şunlardır: 1) tamponun pH'ının 7.4 olmasını sağlamak; 2) tamponun tüm bileşenlerinin dahil edilmesini sağlamak; 3) heparin enjeksiyonları ile kalp damarlarında kan pıhtılaşmasının önlenmesi; 4) metabolik aktiviteyi azaltarak kalbe iskemik hasardan kaçınmak (KCl ...
Açıklamalar
Herhangi bir açıklama yoktur.
Teşekkürler
Bu proje, 1379/18 sayılı hibe anlaşması kapsamında İsrail Bilim Vakfı'ndan fon aldı; İsrail Bilim ve Teknoloji Bakanlığı'nın Doğrudan Doktora Öğrencileri için Uygulamalı ve Mühendislik Bilimleri Jabotinsky Bursu No. 3-15892 D.S. için; ve Avrupa Birliği'nin 858149 No'lu hibe anlaşması (AlternativesToGd) kapsamındaki Horizon 2020 araştırma ve inovasyon programı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| HyperSense DNP Polariser | Oxford Instruments | 52-ZNP91000 | HyperSense, 3.35 T, preclinical dissolution-DNP hyperpolarizer |
| NMR spectrometer | RS2D | NMR Cube, 5.8 T, equipped with a 10 mm broad-band probe | |
| Peristaltic pump | Cole-Parmer | 07554-95 | |
| Temperature probe | Osensa | FTX-100-LUX+ | NMR compatible temprature probe |
| Somnosuite low-flow anesthesia system | Kent Scientific | ||
| Lines, tubings, suture | |||
| Platinum cured silicone tubes | Cole-Parmer | HV-96119-16 | L/S 16 I.D. 3.1 mm |
| Thin polyether ether ketone (PEEK) lines | Upchurch Scientific | id. 0.040” | |
| Intravenous catheter | BD Medical | 381323 | 22 G |
| Silk suture | Ethicon | W577H | Wire diameter of 3-0 |
| Chemicals and pharmaceuticals | |||
| [1-13C]pyruvic acid | Cambridge Isotope Laboratories | CLM-8077-1 | |
| Calcium chloride | Sigma-Aldrich | 21074 | CAS: 10043-52-4 |
| D-(+)-Glucose | Sigma-Aldrich | G7528 | CAS: 50-99-77 |
| Heparin sodium | Rotexmedica | HEP5A0130C0160 | |
| Hydrochloric acid 37% | Sigma-Aldrich | 258148 | CAS: 7647-01-0 |
| Insulin aspart (NovoLog) | Novo Nordisk | ||
| Isoflurane | Terrel | ||
| Magnesium Sulfate | Sigma-Aldrich | 793612 | CAS: 7487-88-9 |
| Potassium chloride | Sigma-Aldrich | P4504 | CAS: 7447-40-7 |
| Potassium phosphate monobasic | Sigma-Aldrich | P9791 | CAS: 7778-77-0 |
| Sodium bicarbonate | Gadot Group | CAS: 144-55-8 | |
| Sodium chloride | Sigma-Aldrich | S9625 | CAS: 7647-14-5 |
| Sodium hydroxide | Sigma-Aldrich | 655104 | CAS: 1310-73-2 |
| Sodium phosphate dibasic | Sigma-Aldrich | S7907 | CAS: 7558-79-4 |
| Sodium phosphate monobasic dihydrate | Merck | 6345 | CAS: 13472-35-0 |
| TRIS (biotechnology grade) | Amresco | 0826 | CAS: 77-86-1 |
| Trityl radical OX063 | GE Healthcare AS | NC100136 | OX063 |
| NMR standards | |||
| 13C standard sample | Cambridge Isotope Laboratories | DLM-72A | 40% p-dioxane in benzene-D6 |
| 31P standard sample | Made in house | 105 mM ATP and 120 mM phenylphosphonic acid in D2O | |
| Software | |||
| Excel 2016 | Microsoft | ||
| MNova | Mestrelab Research |
Referanslar
- Aquaro, G. D., Menichetti, L. Hyperpolarized 13C-magnetic resonance spectroscopy: Are we ready for metabolic imaging. Circulation. Cardiovascular Imaging. 7 (6), 854-856 (2014).
- Schroeder, M. A., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB Journal. 23 (8), 2529-2538 (2009).
- Ardenkjaer-Larsen, J. H., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proceedings of the National Academy of Sciences of the United States of America. 100 (18), 10158-10163 (2003).
- Merritt, M. E., et al. Hyperpolarized C-13 allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proceedings of the National Academy of Sciences of the United States of America. 104 (50), 19773-19777 (2007).
- Ball, D. R., et al. Hyperpolarized butyrate: A metabolic probe of short chain fatty acid metabolism in the heart. Magn Reson Med. (5), 1663-1669 (2014).
- Khemtong, C., Carpenter, N. R., Lumata, L. L., et al. Hyperpolarized 13C NMR detects rapid drug-induced changes in cardiac metabolism. Magnetic Resonance in Medicine. 74 (2), 312-319 (2015).
- Mariotti, E., et al. Modeling non-linear kinetics of hyperpolarized [1-13C] pyruvate in the crystalloid-perfused rat heart. NMR in Biomedicine. 29 (4), 377-386 (2016).
- Moreno, K. X., Sabelhaus, S. M., Merritt, M. E., Sherry, A. D., Malloy, C. R. Competition of pyruvate with physiological substrates for oxidation by the heart: implications for studies with hyperpolarized [1-13C]pyruvate. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), H1556-H1564 (2010).
- Purmal, C., et al. Propionate stimulates pyruvate oxidation in the presence of acetate. American Journal of Physiology-Heart and Circulatory Physiology. 307 (8), H1134-H1141 (2014).
- Weiss, K., et al. Developing hyperpolarized 13C spectroscopy and imaging for metabolic studies in the isolated perfused rat heart. Applied Magnetic Resonance. 43 (1), 275-288 (2012).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia: NMR detection of hyperpolarized 13CO2and H13CO3. Magnetic Resonance in Medicine. 60 (5), 1029-1036 (2008).
- Schroeder, M. A., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovascular Research. 86 (1), 82-91 (2010).
- Ball, D. R., et al. Metabolic imaging of acute and chronic infarction in the perfused rat heart using hyperpolarised [1-13C]pyruvate. NMR in Biomedicine. 26 (11), 1441-1450 (2013).
- Atherton, H. J., et al. Role of PDH inhibition in the development of hypertrophy in the hyperthyroid rat heart: a combined magnetic resonance imaging and hyperpolarized magnetic resonance spectroscopy study. Circulation. 123 (22), 2552-2561 (2011).
- Harris, T., et al. Hyperpolarized product selective saturating-excitations for determination of changes in metabolic reaction rates in real-time. NMR in Biomedicine. 33 (2), e4189 (2020).
- Shaul, D., et al. Correlation between lactate dehydrogenase/pyruvate dehydrogenase activities ratio and tissue pH in the perfused mouse heart: A potential noninvasive indicator of cardiac pH provided by hyperpolarized magnetic resonance. NMR in Biomedicine. 34 (2), e4444 (2021).
- Jian, Z., et al. In vivo cannulation methods for cardiomyocytes isolation from heart disease models. PLoS One. 11 (8), e0160605 (2016).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacological Research. 41 (6), 613-627 (2000).
- Lateef, R., Al-Masri, A., Alyahya, A. Langendorff's isolated perfused rat heart technique: A review. International Journal of Basic and Clinical Pharmacology. 4, 1314-1322 (2015).
- Cross, H. R., Radda, G. K., Clarke, K. The role of Na+/K+ ATPase activity during low-flow ischemia in preventing myocardial injury - A 31P, 23Na and 87Rb NMR spectroscopic study. Magnetic Resonance in Medicine. 34 (5), 673-685 (1995).
- Cross, H. R., Clarke, K., Opie, L. H., Radda, G. K. Is lactate-induced myocardial ischaemic injury mediated by decreased pH or increased intracellular lactate. Journal of Molecular and Cellular Cardiology. 27 (7), 1369-1381 (1995).
- Clarke, K., O'Connor, A. J., Willis, R. J. Temporal relation between energy metabolism and myocardial function during ischemia and reperfusion. American Journal of Physiology. 253 (2), H412-H421 (1987).
- Yabe, T., Mitsunami, K., Inubushi, T., Kinoshita, M. Quantitative measurements of cardiac phosphorus metabolites in coronary artery disease by 31P magnetic resonance spectroscopy. Circulation. 92 (1), 15-23 (1995).
- Bakrania, B., Granger, J. P., Harmancey, R. Methods for the determination of rates of glucose and fatty acid oxidation in the isolated working rat heart. Journal of Visualized Experiments. (115), e54497 (2016).
- Cordeiro, B., Clements, R. Murine isolated heart model of myocardial stunning associated with cardioplegic arrest. Journal of Visualized Experiments. (102), e52433 (2015).
- Kolwicz, S. C., Tian, R. Assessment of cardiac function and energetics in isolated mouse hearts using 31P NMR spectroscopy. Journal of Visualized Experiments. (42), e2069 (2010).
- Nakadate, Y., et al. Glycemia and the cardioprotective effects of insulin pre-conditioning in the isolated rat heart. Cardiovascular Diabetology. 16 (1), 43 (2017).
- Lauritzen, M. H., et al. Enhancing the C-13 bicarbonate signal in cardiac hyperpolarized 1-C-13 pyruvate MRS studies by infusion of glucose, insulin and potassium. NMR in Biomedicine. 26 (11), 1496-1500 (2013).
- Adler-Levy, Y., et al. In-cell determination of lactate dehydrogenase activity in a luminal breast cancer model - ex vivo investigation of excised xenograft tumor slices using dDNP hyperpolarized [1-13C]pyruvate. Sensors. 19 (9), 2089 (2019).
- Young, A. A., Barnes, H., Davison, D., Neubauer, S., Schneider, J. E. Fast left ventricular mass and volume assessment in mice with three-dimensional guide-point modeling. Journal of Magnetic Resonance Imaging. 30 (3), 514-520 (2009).
- Bailey, I. A., Williams, S. R., Radda, G. K., Gadian, D. G. Activity of phosphorylase in total global ischaemia in the rat heart. A phosphorus-31 nuclear-magnetic-resonance study. Biochemical Journal. 196 (1), 171-178 (1981).
- Lutz, N. W., Le Fur, Y., Chiche, J., Pouyssegur, J., Cozzone, P. J. Quantitative in vivo characterization of intracellular and extracellular pH profiles in heterogeneous tumors: A novel method enabling multiparametric pH analysis. Cancer Research. 7 (15), 4616-4628 (2013).
- Harris, T., Gamliel, A., Sosna, J., Gomori, J. M., Katz-Brull, R. Impurities of [1-13C]pyruvic acid and a method to minimize their signals for hyperpolarized pyruvate metabolism studies. Applied Magnetic Resonance. 49 (10), 1085-1098 (2018).
- Cunningham, C. H., et al. Hyperpolarized 13C metabolic MRI of the human heart initial experience. Circulation Research. 119 (11), 1177-1182 (2016).
- Kurhanewicz, J., et al. Hyperpolarized 13C MRI: Path to clinical translation in oncology. Neoplasia. 21 (1), 1-16 (2019).
- Miloushev, V. Z., et al. Metabolic imaging of the human brain with hyperpolarized 13C pyruvate demonstrates 13C lactate production in brain tumor patients. Cancer Research. 78 (14), 3755-3760 (2018).
- Park, I., et al. Development of methods and feasibility of using hyperpolarized carbon-13 imaging data for evaluating brain metabolism in patient studies. Magnetic Resonance in Medicine. 80 (3), 864-873 (2018).
- Grist, J. T., et al. Quantifying normal human brain metabolism using hyperpolarized [1-13C]pyruvate and magnetic resonance imaging. Neuroimage. 189, 171-179 (2019).
- Nelson, S. J., et al. Metabolic imaging of patients with prostate cancer using hyperpolarized [1-C]pyruvate. Science Translational Medicine. 5 (198), (2013).
- Stødkilde-Jørgensen, H., et al. Pilot study experiences with hyperpolarized [1-13C]pyruvate MRI in pancreatic cancer patients. Journal of Magnetic Resonance Imaging. 51 (3), 961-963 (2019).
- Autry, A. W., et al. Measuring tumor metabolism in pediatric diffuse intrinsic pontine glioma using hyperpolarized carbon-13 MR metabolic imaging. Contrast Media and Molecular Imaging. 2018, 3215658 (2018).
- Chung, B. T., et al. First hyperpolarized [2-13C]pyruvate MR studies of human brain metabolism. Journal of Magnetic Resonance. 309, 106617 (2019).
- Rider, O. J., et al. Noninvasive in vivo assessment of cardiac metabolism in the healthy and diabetic human heart using hyperpolarized 13C MRI. Circulation Research. 126 (6), 725-736 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır