È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Studio del metabolismo cardiaco nel cuore di topo perfuso isolato con piruvato iperpolarizzato [1-13 C] e spettroscopia NMR 13C / 31P
In questo articolo
Riepilogo
Descriviamo una configurazione sperimentale per la somministrazione di metaboliti iperpolarizzati marcati con 13C in modalità di perfusione continua a un cuore di topo perfuso isolato. Un approccio di acquisizione dedicato a 13C-NMR ha permesso la quantificazione dell'attività enzimatica metabolica in tempo reale e un'analisi multiparametrica 31P-NMR ha permesso la determinazione del contenuto di ATP tissutale e del pH.
Abstract
Il metabolismo è alla base di importanti processi nella vita cellulare. Caratterizzare il funzionamento delle reti metaboliche nei tessuti viventi fornisce informazioni cruciali per comprendere il meccanismo delle malattie e progettare trattamenti. In questo lavoro, descriviamo procedure e metodologie per studiare l'attività metabolica in cellula in un cuore di topo perfuso retrogradamente in tempo reale. Il cuore è stato isolato in situ, in concomitanza con l'arresto cardiaco per ridurre al minimo l'ischemia miocardica ed è stato perfuso all'interno di uno spettrometro di risonanza magnetica nucleare (NMR). Mentre nello spettrometro e sotto perfusione continua, il [1-13 C]piruvato iperpolarizzato è stato somministrato al cuore, e i successivi tassi di produzione iperpolarizzati [1-13 C]lattato e [13C] bicarbonato sono serviti a determinare, in tempo reale, i tassi di produzione di lattato deidrogenasi e piruvato deidrogenasi. Questa attività metabolica del [1-13C]piruvato iperpolarizzato è stata quantificata con spettroscopia NMR in un modello libero utilizzando l'approccio di acquisizione selettiva di saturazione-eccitazione del prodotto. 31 La spettroscopia P è stata applicata tra le acquisizioni iperpolarizzate per monitorare l'energetica cardiaca e il pH. Questo sistema è utile in modo univoco per studiare l'attività metabolica nel cuore di topo sano e malato.
Introduzione
Le alterazioni del metabolismo cardiaco sono associate a una varietà di cardiomiopatie e spesso costituiscono la base dei meccanismi fisiopatologici sottostanti1. Tuttavia, ci sono numerosi ostacoli allo studio del metabolismo nei tessuti viventi, poiché la maggior parte dei saggi biochimici richiede l'omogeneizzazione del tessuto e la lisi cellulare e / o il tracciamento radioattivo. Pertanto, vi è una pressante necessità di nuovi strumenti per studiare il metabolismo miocardico nei tessuti viventi. La risonanza magnetica (MR) dei substrati iperpolarizzati marcati con 13C consente misurazioni in tempo reale del metabolismo nei tessuti viventi2, senza l'uso di radiazioni ionizzanti, aumentando il rapporto segnale-rumore MR (SNR) dei siti marcati di diversi ordini di grandezza3. Qui, descriviamo una configurazione sperimentale, un approccio di acquisizione e un approccio analitico per studiare il metabolismo rapido nel cuore di topo isolato e, in parallelo, presentare indicatori di energetica generale del tessuto e acidità. Il pH cardiaco è un indicatore prezioso, poiché l'equilibrio acido-base viene interrotto nelle prime fasi di malattie cardiache e condizioni come ischemia miocardica, ipertrofia disadattiva e insufficienza cardiaca6.
La produzione iperpolarizzata di [1-13 C]lattato e [13 C]bicarbonato da [1-13C]piruvato iperpolarizzato aiuta a determinare i tassi di produzione di lattato deidrogenasi (LDH) e piruvato deidrogenasi (PDH). La maggior parte degli studi precedenti condotti utilizzando substrati iperpolarizzati nel cuore isolato del roditore ha utilizzato modelli cinetici complessi per derivare l'attività enzimatica di LDH e PDH, o ha riportato i rapporti di intensità del segnale del prodotto iperpolarizzato su un substrato senza calcolare i tassi effettivi di attività enzimatica 2,4,5,6,7,8,9,10, 11,12,13,14. Qui, abbiamo utilizzato l'approccio di saturazione-eccitazione selettiva del prodotto 15, che consente il monitoraggio dell'attività enzimatica in modo privo di modelli15,16. In questo modo sono stati determinati i tassi enzimatici assoluti (cioè il numero di moli di prodotto prodotte per unità di tempo). 31 La spettroscopia P è stata utilizzata per osservare i segnali di fosfato inorganico (Pi), fosfocreatina (PCr) e adenosina trifosfato (ATP). Un'analisi multiparametrica è stata utilizzata per caratterizzare la distribuzione del pH del cuore, come dimostrato dallo spostamento chimico eterogeneo nel segnale Pi del tessuto.
Il cuore di topo perfuso retrogradamente (Langendorff heart)17,18,19 è un modello ex vivo per il cuore pulsante intatto. In questo modello, la vitalità cardiaca e il pH sono conservati per almeno 80 minuti20 e ha mostrato un potenziale di recupero dopo una lesione ischemica prolungata21,22. Tuttavia, la variabilità involontaria durante la microchirurgia può portare a variabilità nella vitalità del tessuto attraverso i cuori. Studi precedenti hanno riportato il deterioramento di questo cuore nel tempo19; Ad esempio, è stata osservata una riduzione della funzione contrattile del 5% -10% all'ora18. Il segnale dell'adenosina trifosfato (ATP) ha precedentemente dimostrato di riferire sullo stato energetico miocardico e sulla vitalità23. Qui, abbiamo notato che il cuore perfuso può occasionalmente mostrare una variabilità involontaria nei livelli di vitalità, come dimostrato dal contenuto di ATP, nonostante il fatto che abbiamo avuto una perfusione ininterrotta e un apporto di ossigeno. Dimostriamo qui che normalizzare i tassi di LDH e PDH al contenuto di ATP del cuore riduce la variabilità inter-cardiaca in questi tassi.
Nel seguente protocollo, descriviamo la procedura chirurgica utilizzata per l'incannulamento cardiaco, l'isolamento e la conseguente perfusione nello spettrometro NMR. Da notare, altri approcci chirurgici volti a isolare e perfondere il cuore di topo sono stati descritti prima di24,25.
Vengono descritte anche le metodologie utilizzate per l'acquisizione dei dati relativi ai tassi enzimatici nel cuore pulsante (utilizzando la spettroscopia 13 C e iperpolarizzato [1-13C]piruvato) e la vitalità e l'acidità del cuore (utilizzando la spettroscopia NMR 31P). Infine, vengono spiegate le metodologie analitiche per determinare le attività enzimatiche metaboliche e la vitalità e l'acidità dei tessuti.
Protocollo
Il comitato etico congiunto (IACUC) dell'Università ebraica e dell'Hadassah Medical Center ha approvato il protocollo di studio per il benessere degli animali (MD-19-15827-1).
1. Preparazione del tampone Krebs-Henseleit
- Un giorno prima dell'esperimento, preparare una versione modificata del buffer Krebs-Henseleit (KHB)26. Inizialmente, sciogliere 118 mM NaCl, 4,7 mM KCl, 0,5 mM piruvato, 1,2 mM MgSO 4, 25 mM NaHCO3 e 1,2 mM KH 2 PO4 in H2O bidistillato.
- Bollire questa miscela con 95%/5% O 2/CO 2 per 20 minuti, quindi aggiungere 1,2 mM CaCl2.
- Regolare il pH del tampone a 7,4 con HCl o NaOH.
- Il giorno dell'esperimento, aggiungere 10 mM di glucosio e 72 U / L di insulina al KHB preparato nella fase 1.2.
NOTA: L'insulina viene aggiunta al tampone di perfusione come descritto nel lavoro di Kolwicz et al.26 e in accordo con studi precedenti che riportano che l'insulina aumenta la funzione contrattile27 e l'intensità del segnale iperpolarizzato [13C] bicarbonato 28.
2. Preparazione del sistema di perfusione
- Conservare un serbatoio di 200 ml di KHB a bagnomaria a 40 °C e bollire con 95%/5% O 2/CO2 ad una portata di 4 L/min per 1 ora prima della perfusione cardiaca. Mantenere il buffer continuamente gorgogliante con questa miscela di gas per tutta la durata dell'esperimento.
- Innanzitutto, impostare il bagno d'acqua a 40 °C. Inserire il serbatoio KHB. Utilizzare una pompa peristaltica (vedere la tabella dei materiali) e tubi di prolunga di grado medico per ricircolare il KHB tra il serbatoio tampone e il tubo NMR da 10 mm a una portata costante di 7,5 ml / min.
- Collegare tre tubi in silicone polimerizzato al platino (3 mm i.d.) alla pompa (un tubo di afflusso e due tubi di deflusso per il tampone KH). Inserire le linee di deflusso e afflusso nel buffer KH riscaldato. Quindi, inserire la linea dell'ossigeno nel tampone KH riscaldato.
- Utilizzare sottili linee di polietere etere etere chetone (PEEK, vedi Tabella dei materiali) affinché il tampone e l'agente iperpolarizzato fluiscano da e verso il tubo NMR all'interno del foro dello spettrometro.
- Assicurarsi che la temperatura sia mantenuta a 37-37,5 °C. Segui i passaggi seguenti.
- Avvolgere la linea di afflusso (dal serbatoio tampone al tubo NMR) con un nastro riscaldante impostato a 42 °C.
- Riscaldare il tubo NMR all'interno dello spettrometro con un flusso d'aria calda regolato dallo spettrometro.
- Utilizzare un sensore di temperatura compatibile NMR (vedere la tabella dei materiali) per misurare la temperatura all'interno del tubo NMR. La temperatura è regolata a 37-37,5 °C.
3. Taratura e preparazione dello spettrometro NMR per l'acquisizione
- Il giorno dell'esperimento, inserire un campione standard di 13 C che contiene 1,4-diossano (tabella dei materiali) nello spettrometro e sintonizzare e abbinare la sonda NMR per 13C. Quindi, ottenere uno spettro che mostri il segnale di equilibrio termico di 1,4-diossano con un angolo di nutazione di 90°.
- Ora scambiate il campione standard di 13C con un campione standard di 31 P (Table of Materials), che contiene 105 mM di ATP in D2O. Sintonizzare e abbinare la sonda NMR per 31P.
NOTA: Uno spettro che mostra i segnali di equilibrio termico del fosfato è ottenuto con un angolo di nutazione di 50°. - Inserire la linea di afflusso, la linea di deflusso e la sonda di temperatura in un tubo NMR da 10 mm, quindi inserire il tubo nel foro magnetico. Regolare il nastro riscaldante a 42 °C.
- Acquisire uno spettro NMR 31P del buffer KH circolante da utilizzare in quell'esperimento per 30 minuti, con un angolo di nutazione di 50° e un TR di 1,1 s (1.640 acquisizioni).
4. Preparazione animale, procedura chirurgica e perfusione del cuore nel tubo NMR
- Anestetizzare un topo maschio HSD:ICR (CD-1) con isoflurano al 3,3% nell'aria ambiente (Table of Materials) a 340 mL/min per 5 minuti utilizzando un sistema di anestesia gassosa (Table of Materials) in una camera a induzione.
- Utilizzare l'anestesia nasale per il mantenimento dell'anestesia generale con isoflurano al 2,9%.
NOTA: Si presta attenzione a ridurre al minimo il dolore e il disagio per l'animale. - Fissare gli arti dell'animale con del nastro adesivo, garantire un riflesso negativo del dolore al pedale e quindi iniettare 300 UI di eparina di sodio per via intraperitoneale.
- Bagnare accuratamente la parete toracica e l'addome del topo con alcool al 70% per garantire la pulizia ed evitare la contaminazione o l'ostruzione dei capelli durante la procedura chirurgica.
- A 1 minuto dopo l'iniezione di eparina, tagliare la pelle e il muscolo della cavità addominale con piccole forbici.
- Posizionare il piccolo morsetto per zanzare che blocca l'emostato a mascella curva tra il processo xifoideo e la pelle del torace per sollevare il torace ed esporre il diaframma. Forare e tagliare il lobo destro del diaframma.
- Tagliare il petto attraverso la linea mediana, ritrarre ai lati e quindi rimuovere.
- Iniettare il ventricolo sinistro del cuore con 200 UI di eparina di sodio per prevenire la coagulazione del sangue. Quindi, iniettare 0,1 ml di 0,5 mol/L KCl ghiacciato per ottenere un arresto cardiaco, come descritto in precedenza25. L'arresto cardiaco è essenziale per poter cannulare il cuore.
- Identificare il timo e rimuoverlo usando le forbici per esporre l'aorta. Rimuovere il tessuto residuo della gabbia toracica.
- Identificare l'arco aortico e utilizzare una pinza curva per posizionare un nodo sciolto con una sutura di seta 3-0 (Table of Materials) attorno all'aorta ascendente. Iniettare 3 ml di KHB nel ventricolo sinistro per rimuovere i coaguli di sangue dall'aorta.
- Utilizzare una pinza curva per ritrarre il cuore in modo inferiore per una migliore visualizzazione dell'aorta ascendente.
- Eseguire l'incannulamento in situ con un catetere endovenoso da 22 G (Table of Materials). Applicare l'adesivo cianoacrilato nella regione cannulata, quindi eseguire la doppia sutura di legatura. Iniettare ulteriore tampone KH nel cuore e verificare che fluisca attraverso il tubo di incannulazione.
- Rimuovere la pinza curva. Scollegare il cuore dai visceri circostanti e perfonderlo retrogradamente con KHB ghiacciato (4 °C) attraverso il catetere endovenoso.
- Collegare il cuore alla linea di afflusso del sistema di perfusione tramite il catetere endovenoso. All'inizio della perfusione con tampone caldo (37-37,5 °C) a 7,5 ml/min, il cuore inizia a battere spontaneamente.
- Fissare il tubo NMR con il cuore pulsante, le linee di deflusso e la sonda di temperatura e inserirlo nel foro dello spettrometro, assicurandosi che il cuore sia al centro della sonda NMR.
5. Acquisizione dei dati per l'energetica cardiaca e il pH
- Acquisire spettri 31P per circa 1 ora con un angolo di rotazione di 50 ° e un TR di 1,1 s.
6. Polarizzazione e dissoluzione dello spin DNP
- Preparare una formulazione da 28,5 mg di [1-13C]piruvato. Questa formulazione consiste di 11,1 mM a 14,0 mM OX063 radicale nell'acido puro.
- Preparare 4 ml di mezzo di dissoluzione. Il mezzo di dissoluzione è costituito da tampone TRIS-fosfato, che contiene 11,2 mM NaH 2 PO 4, 38,8 mM Na 2 HPO4, 33 mM TRIS e2mM HCl. Questa composizione media viene regolata in modo tale che dopo l'aggiunta di 28,5 mg di [1-13C] formulazione di acido piruvico a 4 ml di questo tampone (nella fase di dissoluzione), il pH della soluzione risultante sarà 7,4.
- Eseguire la polarizzazione di spin e la dissoluzione rapida in un dispositivo di polarizzazione di spin DNP (dDNP) secondo le istruzioni del produttore (Tabella dei materiali). Applicare l'irradiazione a microonde ad una frequenza di 94,110 GHz per la polarizzazione della formulazione di acido piruvico [1-13C] da 1,45 K a 1,55 K per circa 1,5 h.
- Miscelare rapidamente i 4 mL di mezzo iperpolarizzato dal dispositivo dDNP con una soluzione ben ossigenata che integra il mezzo di dissoluzione iperpolarizzato per ottenere una composizione che corrisponda strettamente al mezzo di perfusione.
NOTA: Il volume finale del mezzo che perfonde il cuore durante le iniezioni iperpolarizzate con 14 mM iperpolarizzati [1-13C] piruvato è 26 ml. La composizione finale del mezzo iniettato (dopo miscelazione) contiene 4,7 mM KCl, 1,2 mM MgSO 4, 70 mM NaCl, 25 mM NaHCO3, 1,2 mM KH 2 PO4, 10 mM glucosio, 1,2 mM CaCl2e 72 U/L di insulina. - Somministrare il mezzo iperpolarizzato [1-13C]contenente piruvato al cuore isolato utilizzando una configurazione a flusso continuo29.
NOTA: Questo viene fatto per garantire che la perfusione cardiaca non sia disturbata in nessun momento durante l'esperimento e che il mezzo iperpolarizzato venga somministrato ad una velocità nota e per una durata nota.
7. Spettroscopia iperpolarizzata 13C
- Acquisire dati iperpolarizzati 13C utilizzando impulsi di eccitazione saturante selettivi del prodotto 15 applicando impulsi sinusoidali cardinali (Sinc) da 2,5 ms, come descritto in precedenza15,16. Eccitare selettivamente [1-13 C]lattato e [13C]bicarbonato consecutivamente ad intervalli di 6 s per ottenere un intervallo di 12s per ciascun metabolita.
- Per il rilevamento di [1-13 C]lattato, centrare l'impulso selettivo di Sinc alla frequenza [1-13 C]piruvato idrato (179,4 ppm), che si traduce in un rapporto di intensità del segnale (lac) di 0,113 per i segnali C 1 di [1-13 C]piruvato a [1-13C]lattato.
- Per il rilevamento di [13 C]bicarbonato, centrare l'impulso selettivo Sinc a 157,7 ppm, che è 214 Hz down-field del segnale [13C]bicarbonato (161,1 ppm); ciò si traduce in un rapporto di intensità del segnale (bic) di 0,139 per il segnale C 1 di [1-13C]piruvato a [13C]bicarbonato.
8. Determinazione del peso e del volume umido del tessuto
- Alla fine dell'esperimento, staccare il cuore dal sistema di perfusione e asciugarlo delicatamente con carta velina. Successivamente, pesare il cuore per ottenere il peso umido del tessuto.
- Determinare il volume del cuore utilizzando un fattore di densità di 1,05 g/cm3, come determinato in precedenza per il cuore di topo30.
9. Quantificazione del contenuto di ATP
- Integrare il segnale γ-ATP di una singola acquisizione del campione standard ATP e un'acquisizione di 30 minuti (TR di 1,1 s e 1.640 acquisizioni) del cuore isolato.
- Quantificare il contenuto di ATP del cuore confrontando l'integrale del segnale γ-ATP del cuore con quello dello standard (Table of Materials), dove quest'ultimo ha una concentrazione nota (105 mM), e correggere il numero di acquisizioni ed effetti di rilassamento.
10. Risolvere il segnale Pi del cuore
NOTA: Per valutare il pH tissutale, è necessario prima deconvolgere il segnale Pi del cuore da quello del segnale Pi totale (Pit). Questo viene fatto omettendo il segnale del KHB Pi (PiKH) da quello del Pit.
- In uno spettro 31P di KHB che mostra un singolo segnale Pi (Pi KH, Figura 1A), adattare il segnale PiKH a una funzione lorentziana usando Excel (Table of Materials).
- Il volume visibile alla sonda NMR (Vp, 1,375 ml), contiene più KHB quando la provetta non contiene il cuore. Per correggere questo effetto di riempimento, calcolare il segnale tampone attenuato (Pib) utilizzando Eq. 1A.
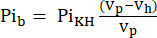 Eq. 1A
Eq. 1A
dove Vh è il volume del cuore, come determinato al punto 8. - Sottrarre questo segnale dal Pit secondo Eq. 1B per ottenere il segnale Pi derivante esclusivamente dal cuore perfuso (Pih, Figura 1B).
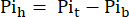 Eq. 1B
Eq. 1B
11. Analisi multiparametrica del pH
- Eseguire la conversione della distribuzione dello spostamento chimico del segnale Pih al pH con riferimento allo spostamento chimico di PCr utilizzando Eq. 231.
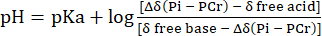 Eq. 2
Eq. 2
dove Δδ è la differenza di spostamento chimico, pKa è 6,72, δ base libera è 5,69 e δ acido libero è 3,27, come descritto in precedenza31. - Correggere la curva di distribuzione del pH risultante per la non linearità tra la scala di spostamento chimico di Pih e la scala di pH secondo Lutz et al.32. Una distribuzione tipica del pH risultante da questo calcolo è presentata nella Figura 1C.
- Analizzare la distribuzione del pH tissutale con un approccio multiparametrico utilizzando sette parametri statistici seguendo il lavoro di Lutz et al. 32. Quattro di questi parametri sono qui presentati in quanto sembrano essere i più descrittivi del pH tissutale: 1) pH massimo globale; 2) pH medio ponderato; 3) pH mediano ponderato; e 4) asimmetria del grafico del pH (Figura 1C).
12. Calcolo delle attività LDH e PDH
NOTA: I tassi di produzione dei metaboliti iperpolarizzati [1-13 C]lattato e [13C]bicarbonato sono utilizzati per calcolare le attività LDH e PDH, rispettivamente. Nell'approccio di saturazione-eccitazione selettiva del prodotto15, solo i metaboliti iperpolarizzati appena sintetizzati vengono rilevati da ciascuna eccitazione selettiva.
- Utilizzare il segnale iperpolarizzato [1-13C]piruvato come riferimento per determinare il corrispondente livello di produzione di metaboliti.
- Durante la perfusione con il mezzo iperpolarizzato, la concentrazione di [1-13 C]piruvato nel tubo NMR aumenta (wash-in), quindi si stabilizza (ad una concentrazione massima di 14mM) e quindi diminuisce (wash-out).
- Per identificare i punti temporali in cui la concentrazione di piruvato ha raggiunto un livello costante (plateau), correggere il segnale [1-13C]piruvato per il decadimento del segnale risultante dal rilassamento di T1 e dalla pulsazione RF utilizzando la costante di rilassamento effettiva, Teff.
- Per ogni iniezione, definire il Teff in base alla sua capacità di correggere la curva di decadimento del piruvato [1-13C] per mostrare questa dinamica del flusso (Eq.3).
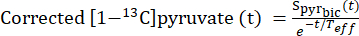 Eq. 3
Eq. 3
dove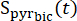 è il segnale [1-13 C]piruvato che è stato acquisito durante l'acquisizione di [13C]bicarbonato. Il Teff medio negli esperimenti qui descritti è risultato essere 35,8 s ± 2,3 s (n = 5 cuori).
è il segnale [1-13 C]piruvato che è stato acquisito durante l'acquisizione di [13C]bicarbonato. Il Teff medio negli esperimenti qui descritti è risultato essere 35,8 s ± 2,3 s (n = 5 cuori). - Selezionare i punti dati in cui la concentrazione è entro il 10% del segnale massimo corretto [1-13C]piruvato per ulteriori analisi.
- Utilizzare i dati corrispondenti della produzione di [1-13 C]lattato e [13C]bicarbonato per i punti temporali selezionati nella fase 12.1per il calcolo dei tassi di produzione dei metaboliti utilizzando Eq. 4A ed Eq. 4B, a condizione che l'SNR del segnale metabolita sia maggiore di 2 (soglia per l'analisi). Un tipico esempio di tale selezione di punti temporali è mostrato nella Figura 2B (finestra temporale evidenziata).
- Calcola i tassi di produzione di ciascuno dei punti dati selezionati utilizzando Eq. 4A ed Eq. 4B:
 Eq. 4A
Eq. 4A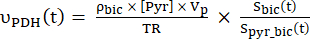 Eq. 4B
Eq. 4B
dove e sono i tassi di produzione di [1-13 C]lattato o [13 C]bicarbonato in ciascun punto temporale, rispettivamente.
e sono i tassi di produzione di [1-13 C]lattato o [13 C]bicarbonato in ciascun punto temporale, rispettivamente.  e sono fattori che rappresentano rispettivamente l'eccitazione relativa di [1-13 C]piruvato e
e sono fattori che rappresentano rispettivamente l'eccitazione relativa di [1-13 C]piruvato e 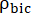
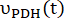 dei prodotti [1-13 C]lattato o [13C]bicarbonato. Questi fattori sono stati determinati in precedenza per essere 0,113 e 0,139, rispettivamente29. Vp è il volume rilevato dalla sonda NMR (1,375 ml), TR indica l'intervallo di tempo tra due eccitazioni consecutive di saturazione selettiva del prodotto (12 s per ciascun prodotto),
dei prodotti [1-13 C]lattato o [13C]bicarbonato. Questi fattori sono stati determinati in precedenza per essere 0,113 e 0,139, rispettivamente29. Vp è il volume rilevato dalla sonda NMR (1,375 ml), TR indica l'intervallo di tempo tra due eccitazioni consecutive di saturazione selettiva del prodotto (12 s per ciascun prodotto), 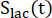 e sono i segnali di [1-13 C]lattato e [13 C]bicarbonato, rispettivamente, e e sono i segnali di [1-13C]piruvato che sono stati acquisiti durante il [1-13 C]lattato e
e sono i segnali di [1-13 C]lattato e [13 C]bicarbonato, rispettivamente, e e sono i segnali di [1-13C]piruvato che sono stati acquisiti durante il [1-13 C]lattato e 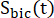
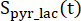
 [13 C]eccitazioni di bicarbonato, rispettivamente. [Pyr] è la concentrazione di [1-13 C]piruvato, che era di 14mM durante la fase di plateau.
[13 C]eccitazioni di bicarbonato, rispettivamente. [Pyr] è la concentrazione di [1-13 C]piruvato, che era di 14mM durante la fase di plateau.- Determinare la velocità per ciascun punto e quindi la media per iniezione iperpolarizzata.
Risultati
Gli spettri 31P registrati da un cuore di topo perfuso con KHB e dal solo tampone sono mostrati nella Figura 1A. I segnali di α-, β- e γ-ATP, PCr e Pi sono stati osservati nel cuore. Il segnale Pi era composto da due componenti principali: nel campo superiore (lato sinistro del segnale), il segnale Pi era principalmente dovuto al KHB ad un pH di 7,4; nel campo inferiore (lato destro del segnale), il segnale Pi era più ampio e meno omogeneo a causa dell'ambiente più acido. Que...
Discussione
Dimostriamo una configurazione sperimentale progettata per studiare il metabolismo iperpolarizzato [1-13C] del piruvato, l'energetica dei tessuti e il pH in un modello di cuore di topo isolato.
I passaggi critici all'interno del protocollo sono i seguenti: 1) garantire che il pH del tampone sia 7,4; 2) garantire che tutti i componenti del buffer siano inclusi; 3) evitare la coagulazione del sangue nei vasi cardiaci mediante iniezioni di eparina; 4) evitare il danno ischemico al cuor...
Divulgazioni
Non ci sono divulgazioni.
Riconoscimenti
Questo progetto ha ricevuto finanziamenti dalla Israel Science Foundation nell'ambito dell'accordo di sovvenzione n. 1379/18; la borsa di studio Jabotinsky del Ministero israeliano della scienza e della tecnologia per le scienze applicate e ingegneristiche per i dottorandi diretti n. 3-15892 per DS; e il programma di ricerca e innovazione Horizon 2020 dell'Unione europea nell'ambito dell'accordo di sovvenzione n. 858149 (AlternativesToGd).
Materiali
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| HyperSense DNP Polariser | Oxford Instruments | 52-ZNP91000 | HyperSense, 3.35 T, preclinical dissolution-DNP hyperpolarizer |
| NMR spectrometer | RS2D | NMR Cube, 5.8 T, equipped with a 10 mm broad-band probe | |
| Peristaltic pump | Cole-Parmer | 07554-95 | |
| Temperature probe | Osensa | FTX-100-LUX+ | NMR compatible temprature probe |
| Somnosuite low-flow anesthesia system | Kent Scientific | ||
| Lines, tubings, suture | |||
| Platinum cured silicone tubes | Cole-Parmer | HV-96119-16 | L/S 16 I.D. 3.1 mm |
| Thin polyether ether ketone (PEEK) lines | Upchurch Scientific | id. 0.040” | |
| Intravenous catheter | BD Medical | 381323 | 22 G |
| Silk suture | Ethicon | W577H | Wire diameter of 3-0 |
| Chemicals and pharmaceuticals | |||
| [1-13C]pyruvic acid | Cambridge Isotope Laboratories | CLM-8077-1 | |
| Calcium chloride | Sigma-Aldrich | 21074 | CAS: 10043-52-4 |
| D-(+)-Glucose | Sigma-Aldrich | G7528 | CAS: 50-99-77 |
| Heparin sodium | Rotexmedica | HEP5A0130C0160 | |
| Hydrochloric acid 37% | Sigma-Aldrich | 258148 | CAS: 7647-01-0 |
| Insulin aspart (NovoLog) | Novo Nordisk | ||
| Isoflurane | Terrel | ||
| Magnesium Sulfate | Sigma-Aldrich | 793612 | CAS: 7487-88-9 |
| Potassium chloride | Sigma-Aldrich | P4504 | CAS: 7447-40-7 |
| Potassium phosphate monobasic | Sigma-Aldrich | P9791 | CAS: 7778-77-0 |
| Sodium bicarbonate | Gadot Group | CAS: 144-55-8 | |
| Sodium chloride | Sigma-Aldrich | S9625 | CAS: 7647-14-5 |
| Sodium hydroxide | Sigma-Aldrich | 655104 | CAS: 1310-73-2 |
| Sodium phosphate dibasic | Sigma-Aldrich | S7907 | CAS: 7558-79-4 |
| Sodium phosphate monobasic dihydrate | Merck | 6345 | CAS: 13472-35-0 |
| TRIS (biotechnology grade) | Amresco | 0826 | CAS: 77-86-1 |
| Trityl radical OX063 | GE Healthcare AS | NC100136 | OX063 |
| NMR standards | |||
| 13C standard sample | Cambridge Isotope Laboratories | DLM-72A | 40% p-dioxane in benzene-D6 |
| 31P standard sample | Made in house | 105 mM ATP and 120 mM phenylphosphonic acid in D2O | |
| Software | |||
| Excel 2016 | Microsoft | ||
| MNova | Mestrelab Research |
Riferimenti
- Aquaro, G. D., Menichetti, L. Hyperpolarized 13C-magnetic resonance spectroscopy: Are we ready for metabolic imaging. Circulation. Cardiovascular Imaging. 7 (6), 854-856 (2014).
- Schroeder, M. A., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB Journal. 23 (8), 2529-2538 (2009).
- Ardenkjaer-Larsen, J. H., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proceedings of the National Academy of Sciences of the United States of America. 100 (18), 10158-10163 (2003).
- Merritt, M. E., et al. Hyperpolarized C-13 allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proceedings of the National Academy of Sciences of the United States of America. 104 (50), 19773-19777 (2007).
- Ball, D. R., et al. Hyperpolarized butyrate: A metabolic probe of short chain fatty acid metabolism in the heart. Magn Reson Med. (5), 1663-1669 (2014).
- Khemtong, C., Carpenter, N. R., Lumata, L. L., et al. Hyperpolarized 13C NMR detects rapid drug-induced changes in cardiac metabolism. Magnetic Resonance in Medicine. 74 (2), 312-319 (2015).
- Mariotti, E., et al. Modeling non-linear kinetics of hyperpolarized [1-13C] pyruvate in the crystalloid-perfused rat heart. NMR in Biomedicine. 29 (4), 377-386 (2016).
- Moreno, K. X., Sabelhaus, S. M., Merritt, M. E., Sherry, A. D., Malloy, C. R. Competition of pyruvate with physiological substrates for oxidation by the heart: implications for studies with hyperpolarized [1-13C]pyruvate. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), H1556-H1564 (2010).
- Purmal, C., et al. Propionate stimulates pyruvate oxidation in the presence of acetate. American Journal of Physiology-Heart and Circulatory Physiology. 307 (8), H1134-H1141 (2014).
- Weiss, K., et al. Developing hyperpolarized 13C spectroscopy and imaging for metabolic studies in the isolated perfused rat heart. Applied Magnetic Resonance. 43 (1), 275-288 (2012).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia: NMR detection of hyperpolarized 13CO2and H13CO3. Magnetic Resonance in Medicine. 60 (5), 1029-1036 (2008).
- Schroeder, M. A., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovascular Research. 86 (1), 82-91 (2010).
- Ball, D. R., et al. Metabolic imaging of acute and chronic infarction in the perfused rat heart using hyperpolarised [1-13C]pyruvate. NMR in Biomedicine. 26 (11), 1441-1450 (2013).
- Atherton, H. J., et al. Role of PDH inhibition in the development of hypertrophy in the hyperthyroid rat heart: a combined magnetic resonance imaging and hyperpolarized magnetic resonance spectroscopy study. Circulation. 123 (22), 2552-2561 (2011).
- Harris, T., et al. Hyperpolarized product selective saturating-excitations for determination of changes in metabolic reaction rates in real-time. NMR in Biomedicine. 33 (2), e4189 (2020).
- Shaul, D., et al. Correlation between lactate dehydrogenase/pyruvate dehydrogenase activities ratio and tissue pH in the perfused mouse heart: A potential noninvasive indicator of cardiac pH provided by hyperpolarized magnetic resonance. NMR in Biomedicine. 34 (2), e4444 (2021).
- Jian, Z., et al. In vivo cannulation methods for cardiomyocytes isolation from heart disease models. PLoS One. 11 (8), e0160605 (2016).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacological Research. 41 (6), 613-627 (2000).
- Lateef, R., Al-Masri, A., Alyahya, A. Langendorff's isolated perfused rat heart technique: A review. International Journal of Basic and Clinical Pharmacology. 4, 1314-1322 (2015).
- Cross, H. R., Radda, G. K., Clarke, K. The role of Na+/K+ ATPase activity during low-flow ischemia in preventing myocardial injury - A 31P, 23Na and 87Rb NMR spectroscopic study. Magnetic Resonance in Medicine. 34 (5), 673-685 (1995).
- Cross, H. R., Clarke, K., Opie, L. H., Radda, G. K. Is lactate-induced myocardial ischaemic injury mediated by decreased pH or increased intracellular lactate. Journal of Molecular and Cellular Cardiology. 27 (7), 1369-1381 (1995).
- Clarke, K., O'Connor, A. J., Willis, R. J. Temporal relation between energy metabolism and myocardial function during ischemia and reperfusion. American Journal of Physiology. 253 (2), H412-H421 (1987).
- Yabe, T., Mitsunami, K., Inubushi, T., Kinoshita, M. Quantitative measurements of cardiac phosphorus metabolites in coronary artery disease by 31P magnetic resonance spectroscopy. Circulation. 92 (1), 15-23 (1995).
- Bakrania, B., Granger, J. P., Harmancey, R. Methods for the determination of rates of glucose and fatty acid oxidation in the isolated working rat heart. Journal of Visualized Experiments. (115), e54497 (2016).
- Cordeiro, B., Clements, R. Murine isolated heart model of myocardial stunning associated with cardioplegic arrest. Journal of Visualized Experiments. (102), e52433 (2015).
- Kolwicz, S. C., Tian, R. Assessment of cardiac function and energetics in isolated mouse hearts using 31P NMR spectroscopy. Journal of Visualized Experiments. (42), e2069 (2010).
- Nakadate, Y., et al. Glycemia and the cardioprotective effects of insulin pre-conditioning in the isolated rat heart. Cardiovascular Diabetology. 16 (1), 43 (2017).
- Lauritzen, M. H., et al. Enhancing the C-13 bicarbonate signal in cardiac hyperpolarized 1-C-13 pyruvate MRS studies by infusion of glucose, insulin and potassium. NMR in Biomedicine. 26 (11), 1496-1500 (2013).
- Adler-Levy, Y., et al. In-cell determination of lactate dehydrogenase activity in a luminal breast cancer model - ex vivo investigation of excised xenograft tumor slices using dDNP hyperpolarized [1-13C]pyruvate. Sensors. 19 (9), 2089 (2019).
- Young, A. A., Barnes, H., Davison, D., Neubauer, S., Schneider, J. E. Fast left ventricular mass and volume assessment in mice with three-dimensional guide-point modeling. Journal of Magnetic Resonance Imaging. 30 (3), 514-520 (2009).
- Bailey, I. A., Williams, S. R., Radda, G. K., Gadian, D. G. Activity of phosphorylase in total global ischaemia in the rat heart. A phosphorus-31 nuclear-magnetic-resonance study. Biochemical Journal. 196 (1), 171-178 (1981).
- Lutz, N. W., Le Fur, Y., Chiche, J., Pouyssegur, J., Cozzone, P. J. Quantitative in vivo characterization of intracellular and extracellular pH profiles in heterogeneous tumors: A novel method enabling multiparametric pH analysis. Cancer Research. 7 (15), 4616-4628 (2013).
- Harris, T., Gamliel, A., Sosna, J., Gomori, J. M., Katz-Brull, R. Impurities of [1-13C]pyruvic acid and a method to minimize their signals for hyperpolarized pyruvate metabolism studies. Applied Magnetic Resonance. 49 (10), 1085-1098 (2018).
- Cunningham, C. H., et al. Hyperpolarized 13C metabolic MRI of the human heart initial experience. Circulation Research. 119 (11), 1177-1182 (2016).
- Kurhanewicz, J., et al. Hyperpolarized 13C MRI: Path to clinical translation in oncology. Neoplasia. 21 (1), 1-16 (2019).
- Miloushev, V. Z., et al. Metabolic imaging of the human brain with hyperpolarized 13C pyruvate demonstrates 13C lactate production in brain tumor patients. Cancer Research. 78 (14), 3755-3760 (2018).
- Park, I., et al. Development of methods and feasibility of using hyperpolarized carbon-13 imaging data for evaluating brain metabolism in patient studies. Magnetic Resonance in Medicine. 80 (3), 864-873 (2018).
- Grist, J. T., et al. Quantifying normal human brain metabolism using hyperpolarized [1-13C]pyruvate and magnetic resonance imaging. Neuroimage. 189, 171-179 (2019).
- Nelson, S. J., et al. Metabolic imaging of patients with prostate cancer using hyperpolarized [1-C]pyruvate. Science Translational Medicine. 5 (198), (2013).
- Stødkilde-Jørgensen, H., et al. Pilot study experiences with hyperpolarized [1-13C]pyruvate MRI in pancreatic cancer patients. Journal of Magnetic Resonance Imaging. 51 (3), 961-963 (2019).
- Autry, A. W., et al. Measuring tumor metabolism in pediatric diffuse intrinsic pontine glioma using hyperpolarized carbon-13 MR metabolic imaging. Contrast Media and Molecular Imaging. 2018, 3215658 (2018).
- Chung, B. T., et al. First hyperpolarized [2-13C]pyruvate MR studies of human brain metabolism. Journal of Magnetic Resonance. 309, 106617 (2019).
- Rider, O. J., et al. Noninvasive in vivo assessment of cardiac metabolism in the healthy and diabetic human heart using hyperpolarized 13C MRI. Circulation Research. 126 (6), 725-736 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon