JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
과분극 [1-13C] 피루브산 및 13C / 31P NMR 분광법을 사용하여 분리 된 관류 마우스 심장에서 심장 대사 조사
요약
우리는 연속 관류 모드에서 과분극된 13C표지 대사산물을 분리된 관류된 마우스 심장에 투여하기 위한 실험 설정을 설명합니다. 전용 13C-NMR 획득 접근법을 통해 대사 효소 활성을 실시간으로 정량화할 수 있었고, 다중모수 31P-NMR 분석을 통해 조직 ATP 함량 및 pH를 측정할 수 있었습니다.
초록
신진 대사는 세포 생활에서 중요한 과정의 기초입니다. 생체 조직에서 대사 네트워크가 어떻게 기능하는지 특성화하면 질병의 메커니즘을 이해하고 치료법을 설계하는 데 중요한 정보를 얻을 수 있습니다. 이 연구에서 우리는 역행성 관류된 마우스 심장에서 세포 내 대사 활동을 실시간으로 연구하기 위한 절차와 방법론을 설명합니다. 심장은 심근 허혈을 최소화하기 위해 심정지와 함께 현장에서 분리되었고 핵자기 공명(NMR) 분광계 내부에서 관류되었습니다. 분광계에서 그리고 연속 관류 하에서, 과분극 [1-13 C] 피루브산이 심장에 투여되었고, 후속 과분극 [1-13 C] 젖산 및 [13C] 중탄산염 생성 속도는 실시간으로 젖산 탈수소 효소 및 피루 베이트 탈수소 효소 생산 속도를 결정하는 역할을했습니다. 과분극된 [1-13C]피루브산의 이러한 대사 활성은 생성물 선택적 포화-여기 획득 접근법을 사용하여 모델 자유 방식으로 NMR 분광법으로 정량화되었습니다. 31 P 분광법은 심장 에너지 및 pH를 모니터링하기 위해 과분극 획득 사이에 적용되었습니다. 이 시스템은 건강하고 병든 쥐의 심장에서 대사 활동을 연구하는 데 매우 유용합니다.
서문
심장 대사의 변화는 다양한 심근병증과 관련이 있으며 종종 근본적인 병태생리학적 메커니즘의 기초를 형성합니다1. 그러나 대부분의 생화학적 분석에는 조직의 균질화와 세포 용해 및/또는 방사능 추적이 필요하기 때문에 살아있는 조직의 대사를 연구하는 데는 많은 장애물이 있습니다. 따라서 생체 조직에서 심근 대사를 조사하기 위한 새로운 도구가 절실히 필요합니다. 과분극된 13C-표지 기질의 자기 공명(MR)은 표지된 부위의 MR 신호 대 잡음비(SNR) 비율을 몇 배나 증가시킴으로써 이온화 방사선을 사용하지 않고 생체 조직2의 대사를 실시간으로 측정할 수있습니다. 여기에서 우리는 분리된 마우스 심장의 빠른 대사를 연구하기 위한 실험 설정, 획득 접근 방식 및 분석적 접근 방식을 설명하고 동시에 일반적인 조직 에너지 및 산도의 지표를 제시합니다. 심장 pH는 심근 허혈, 부적응 비대, 심부전과 같은 심장 질환 및 상태의 초기 단계에서 산-염기 균형이 깨지기 때문에 중요한 지표이다6.
과분극 [1-13C]젖산염 및 [13C]과분극 [1-13C]피루브산으로부터의 중탄산염 생산은 젖산 탈수소효소(LDH) 및 피루브산 탈수소효소(PDH)의 생성 속도를 결정하는 데 도움이 됩니다. 분리된 설치류 심장에서 과분극된 기질을 사용하여 수행된 대부분의 이전 연구는 LDH 및 PDH의 효소 활성을 도출하기 위해 복잡한 동역학 모델을 사용하거나, 실제 효소 활성률을 계산하지 않고 기질에 대한 과분극 생성물의 신호 강도 비율을 보고했습니다 2,4,5,6,7,8,9,10, 11,12,13,14. 여기서, 본 발명자들은 생성물 선택적 포화-여기 접근법(15)을 사용하였으며, 이는 모델-없는 방식으로 효소 활성의 모니터링을 가능하게 한다15,16. 이러한 방식으로, 절대 효소 비율 (즉, 단위 시간당 생산 된 생성물의 몰 수)이 결정되었다. 31 P 분광법은 무기 인산염(Pi), 인산(PCr) 및 아데노신 삼인산(ATP)의 신호를 관찰하는 데 사용되었습니다. 조직의 Pi 신호에서 이질적인 화학적 이동에 의해 입증된 바와 같이 심장의 pH 분포를 특성화하기 위해 다중 매개변수 분석이 사용되었습니다.
역행성 관류된 마우스 심장(Langendorff heart)17,18,19은 온전한 박동 심장에 대한 생체 외 모델입니다. 이 모델에서, 심장 생존율 및 pH는 적어도 80분 동안 보존된다20, 그리고 장기간 허혈성 손상 후 회복 가능성을 보여주었다21,22. 그럼에도 불구하고 미세 수술 중 부주의한 가변성은 심장 전체의 조직 생존력에 가변성을 초래할 수 있습니다. 이전 연구에서는 시간이 지남에 따라 이 심장의 악화에 대해 보고했습니다19; 예를 들어, 시간당 5%-10%의 수축 기능 감소가 관찰되었다18. 아데노신 삼인산(adenosine triphosphate, ATP) 신호는 이전에 심근의 에너지 상태와 생존력에 대해 보고하는 것으로 나타났다23. 여기에서 우리는 관류된 심장이 중단 없는 관류 및 산소 공급이 있었음에도 불구하고 ATP 함량에 의해 입증된 바와 같이 때때로 생존 수준에서 의도하지 않은 변동성을 보일 수 있음을 언급했습니다. 우리는 여기에서 LDH 및 PDH 비율을 심장의 ATP 함량으로 정규화하면 이러한 비율의 심장 간 변동성이 감소한다는 것을 보여줍니다.
다음 프로토콜에서는 NMR 분광계에서 심장 캐뉼라 삽입, 분리 및 그에 따른 관류에 사용되는 수술 절차를 설명합니다. 주목할 점은, 마우스 심장을 분리하고 관류하는 것을 목표로 하는 다른 외과적 접근법이 이전에 기술되었다는것이다 24,25.
박동 심장의 효소 속도(13C 분광법 및 과분극[1-13C]피루브산 사용) 및 심장의 생존력 및 산도(31PNMR 분광법 사용)와 관련된 데이터를 수집하는 데 사용되는 방법론도 설명되어 있습니다. 마지막으로, 대사 효소 활성과 조직 생존력 및 산도를 결정하기 위한 분석 방법론을 설명합니다.
프로토콜
히브리 대학교와 하다사 메디컬 센터의 공동 윤리 위원회(IACUC)는 동물 복지를 위한 연구 프로토콜(MD-19-15827-1)을 승인했습니다.
1. Krebs-Henseleit 완충액 준비
- 실험 하루 전에 Krebs-Henseleit 완충액(KHB)26의 수정된 버전을 준비합니다. 처음에, 118 mM NaCl, 4.7 mM KCl, 0.5 mM 피루브산, 1.2 mMMgSO4, 25 mM NaHCO3, 및 1.2 mM KH2PO4를 이중-증류된 H2O에 용해시킨다.
- 이 혼합물을 95%/5% O 2/CO2로 20분 동안 버블링한 다음 1.2mM CaCl2를 추가합니다.
- HCl 또는 NaOH로 완충액의 pH를 7.4로 조정합니다.
- 실험 당일 1.2단계에서 제조한 KHB에 10mM 포도당과 72U/L 인슐린을 첨가한다.
참고: 인슐린은 Kolwicz et al.26의 연구에 설명된 대로 관류 완충액에 첨가되며 인슐린이 수축 기능(27)과 과분극된 [13C]중탄산염 신호(28)의 강도를 증가시킨다고 보고한 이전 연구와 일치합니다.
2. 관류 시스템 준비
- 200°C의 수조에 40mL의 KHB 저장소를 보관하고 심장 관류 전에 95시간 동안 5L/min의 유속으로 2%/4% O2/CO1로 버블링합니다. 실험 내내 이 가스 혼합물로 버퍼가 지속적으로 버블링되도록 합니다.
- 먼저 수조를 40°C로 설정합니다. KHB 저장소를 삽입합니다. 연동 펌프( 재료 표 참조)와 의료용 확장 튜브를 사용하여 7.5mL/min의 일정한 유속으로 버퍼 저장소와 10mm NMR 튜브 사이의 KHB를 재순환시킵니다.
- 3개의 백금 경화 실리콘 튜브(내경 3mm)를 펌프에 연결합니다(KH 버퍼용 유입 튜브 1개와 유출 튜브 2개). 유출 및 유입 라인을 가열된 KH 버퍼에 삽입합니다. 그런 다음 가열된 KH 버퍼에 산소 라인을 삽입합니다.
- 얇은 폴리에테르 에테르 케톤(PEEK, 재료 표 참조) 라인을 사용하여 완충액과 과분극제가 분광계의 구멍 내에서 NMR 튜브로 흐르도록 합니다.
- 온도가 37-37.5 °C로 유지되는지 확인하십시오. 아래 단계를 따르십시오.
- 42°C로 설정된 가열 테이프로 유입 라인(버퍼 저장소에서 NMR 튜브까지)을 감쌉니다.
- 분광계에 의해 조절되는 따뜻한 공기 흐름으로 분광계 내부의 NMR 튜브를 가열합니다.
- NMR 호환 온도 센서( 재료 표 참조)를 사용하여 NMR 튜브 내부의 온도를 측정합니다. 온도는 37-37.5 °C로 조정됩니다.
3. 획득을 위한 NMR 분광계의 교정 및 준비
- 실험 당일, 1,4-디옥산(재료 표)을 함유한 13C 표준 샘플을 분광계에 삽입하고, 13C에 대한 NMR 프로브를 조정하고 일치시킨다. 그런 다음 너트화 각도가 90°인 1,4-디옥산의 열 평형 신호를 나타내는 스펙트럼을 얻습니다.
- 이제 13C표준 샘플을D2O에 105mM의 ATP를 함유하는 31P표준 샘플(재료 표)로 교환한다.
참고: 열 평형 인산염 신호를 보여주는 스펙트럼은 50°의 너트화 각도로 얻어집니다. - 유입선, 유출선, 온도 프로브를 10mm NMR 튜브에 삽입한 다음 튜브를 마그네틱 보어에 삽입합니다. 가열 테이프를 42 °C로 조정합니다.
- 50°의 너트화 각도와 1.1초(1,640 수집)의 TR로 30분 동안 해당 실험에 사용할 순환 KH 버퍼의 31PNMR 스펙트럼을 획득합니다.
4. NMR 튜브에서 동물의 준비, 수술 절차 및 심장 관류
- 유도 챔버에서 가스 마취 시스템(재료 표)을 사용하여 실내 공기(재료 표)에 3.3% 이소플루란이 있는 수컷 HSD:ICR(CD-1) 마우스를 340mL/min으로 5분 동안 마취합니다.
- 전신 마취 유지를 위해 2.9% 이소플루란으로 비강 마취를 사용하십시오.
알림: 동물의 통증과 불편함을 최소화하기 위해 주의를 기울입니다. - 테이프로 동물의 팔다리를 고정하고 부정적인 페달 통증 반사를 확인한 다음 300IU의 헤파린 나트륨을 복강 내 주사하십시오.
- 마우스의 흉벽과 복부를 70% 알코올로 완전히 적셔 청결을 유지하고 수술 중 모발 오염이나 방해를 방지합니다.
- 헤파린 주사 후 1 분에 작은 가위로 복강의 피부와 근육을 자릅니다.
- 작은 구부러진 턱 지혈제 잠금 모기 클램프를 xiphoid process와 흉부 피부 사이에 놓아 가슴을 들어 올리고 횡격막을 노출시킵니다. 다이어프램의 오른쪽 엽에 구멍을 뚫고 자릅니다.
- 정중선을 가로 질러 가슴을 자르고 측면으로 후퇴 한 다음 제거하십시오.
- 혈액 응고를 방지하기 위해 200IU의 헤파린 나트륨으로 심장의 좌심실을 주사하십시오. 그런 다음 앞서 설명한 대로 0.1mL의 얼음처럼 차가운 0.5mol/L KCl을 주입하여 심정지를 일으킵니다(25). 심장 마비는 심장을 캐뉼러 할 수 있어야합니다.
- 흉선을 확인하고 가위로 제거하여 대동맥을 노출시킵니다. 잔여 흉곽 조직을 제거합니다.
- 대동맥궁을 확인하고 구부러진 집게를 사용하여 상행 대동맥 주위에 3-0 실크 봉합사(재료 표)로 느슨한 매듭을 놓습니다. 3mL의 KHB를 좌심실에 주입하여 대동맥에서 혈전을 제거합니다.
- 상행 대동맥을 더 잘 시각화하기 위해 구부러진 집게를 사용하여 심장을 아래쪽으로 수축시킵니다.
- 22G 정맥 카테터(재료 표)로 현장 캐뉼라 삽입을 수행합니다. 캐뉼러드 영역에 시아노아크릴레이트 접착제를 도포한 다음 이중 봉합사 묶기를 수행합니다. 추가 KH 버퍼를 심장에 주입하고 캐뉼레이션 튜브를 통해 흐르는지 확인합니다.
- 구부러진 집게를 제거합니다. 심장을 주변 내장에서 분리하고 정맥 카테터를 통해 얼음처럼 차가운 KHB(4°C)로 역행합니다.
- 정맥 카테터를 통해 관류 시스템의 유입 라인에 심장을 연결합니다. 7.5mL/min의 따뜻한 완충액(37-37.5°C)으로 관류를 시작하면 심장이 자발적으로 뛰기 시작합니다.
- 박동 심장, 유출선 및 온도 프로브로 NMR 튜브를 고정하고 분광계의 구멍에 삽입하여 심장이 NMR 프로브의 중심에 있는지 확인합니다.
5. 심장 에너지 및 pH에 대한 데이터 수집
- 50°의 플립 각도와 1.1초의 TR로 약 1시간 동안 31P스펙트럼을 획득합니다.
6. DNP 스핀 분극 및 용해
- [1-13C] 피루브산의 28.5 mg 제형을 준비한다. 이러한 제제는 11.1 mM 내지 14.0 mM 산의 OX063 라디칼로 이루어진다.
- 4mL의 용해 배지를 준비합니다. 용해 매질은 11.2 mM NaH2PO4, 38.8 mMNa2HPO4, 33 mM TRIS 및 2 mM HCl을 함유하는 TRIS-포스페이트 완충액으로 구성된다. 이 배지 조성은 이 완충액 4mL에 [1-13C]피루브산 제제 28.5mg을 첨가할 때(용해 단계에서) 결과 용액의 pH가 7.4가 되도록 조정됩니다.
- 제조자의 지시에 따라 dissolution-DNP(dDNP) 스핀 편광 장치에서 스핀 분극 및 빠른 용해를 수행한다(표 of Materials). 약 1.5시간 동안 1.45K에서 1.55K의 [1-13C]피루브산 제형의 편광을 위해 94.110GHz의 주파수에서 마이크로파 조사를 적용합니다.
- dDNP 장치에서 얻은 4mL의 과분극 배지를 과분극 용해 배지를 보완하는 잘 산소화된 용액과 빠르게 혼합하여 관류 배지와 거의 일치하는 조성을 얻습니다.
참고: 14mM 과분극[1-13C]피루브산으로 과분극 주사하는 동안 심장을 관류하는 배지의 최종 부피는 26mL입니다. 주입된 배지의 최종 조성(혼합 후)은 4.7mM KCl, 1.2mM MgSO4, 70mM NaCl, 25mMNaHCO3, 1.2mM KH2PO4, 10mM 포도당, 1.2mM CaCl2 및72U/L 인슐린을 포함합니다. - 연속 흐름 설정29를 사용하여 분리된 심장에 과분극된 [1-13C]피루브산 함유 배지를 투여합니다.
참고: 이것은 실험 중 어느 시점에서든 심장 관류가 방해받지 않고 과분극 배지가 알려진 속도로 알려진 기간 동안 투여되도록 하기 위해 수행됩니다.
7. 과분극 13C분광법
- 이전에 설명된 바와 같이, 2.5 ms 카디널 사인(Sinc) 펄스를 적용하여 생성물-선택성 포화-여기 펄스(15)를 사용하여 과분극된 13C데이터를 획득한다(15,16). [1-13C]젖산물과 [13 C]중탄산염을 6초 간격으로 연속적으로 선택적으로 여기시켜 각 대사 산물에 대해 12초 간격을 얻습니다.
- [1-13C]젖산 검출의 경우, 선택적 Sinc 펄스를 [1-13 C]피루브산 수화물 주파수(179.4ppm)로 중앙에 배치하여 [1-13 C]피루브산의C1 신호에 대한 신호 강도 비율(lac)이 0.113이 됩니다.
- [13C] 중탄산염 검출의 경우 선택적 Sinc 펄스를 157.7ppm으로 중앙에 배치하며, 이는 [13C] 중탄산염 신호(161.1ppm)의 214Hz 다운필드입니다. 그 결과 [1-13C]피루브산과 [13C]중탄산염의C1신호에 대해 신호 강도비(bic)가 0.139가 됩니다.
8. 조직 습윤 중량 및 부피 측정
- 실험이 끝나면 관류 시스템에서 심장을 분리하고 티슈 페이퍼로 부드럽게 건조시킵니다. 이어서, 심장의 무게를 측정하여 조직 습윤 중량을 구한다.
- 마우스 심장(30)에 대해 이전에 결정된 바와 같이, 1.05 g/cm3의 밀도 계수를 사용하여 심장의 부피를 결정한다.
9. ATP 함량 정량화
- ATP 표준 샘플의 단일 획득과 분리된 심장의 30분 획득(TR 1.1초 및 1,640 획득)의 γ-ATP 신호를 통합합니다.
- 심장의 γ-ATP 신호의 적분을 표준(재료 표)의 적분과 비교하여 심장의 ATP 함량을 정량화하고, 후자는 알려진 농도(105mM)를 가지며, 획득 및 이완 효과의 수를 수정합니다.
10. 심장의 Pi 신호 해결
참고: 조직 pH를 평가하려면 먼저 총 Pi 신호(Pit)의 신호에서 심장의 Pi 신호를 디컨볼루션해야 합니다. 이것은 Pit의 신호에서 KHB Pi(PiKH)의 신호를 생략하여 수행됩니다.
- 단일 Pi 신호(PiKH를 보여주는 KHB의 31P스펙트럼, 그림 1A)에서 Excel(재료 표)을 사용하여 PiKH 신호를 로렌치안 함수에 맞춥니다.
- NMR 프로브에 보이는 부피(Vp, 1.375 mL)는 샘플 튜브가 심장을 포함하지 않을 때 더 많은 KHB를 함유한다. 이 충전 효과를 보정하려면 식 1A를 사용하여 감쇠 버퍼 신호(Pib)를 계산하십시오.
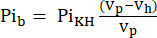 식 1A
식 1A
여기서VH 는 8단계에서 결정된 심장의 부피입니다. - 식 1B에 따라 Pit 에서 이 신호를 빼서 관류된 심장에서만 발생하는 Pi 신호를 얻습니다(Pih, 그림 1B).
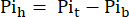 식 1B
식 1B
11. 다중 파라미터 pH 분석
- 식 231을 사용하여 PCr의 화학적 이동을 참조하여 pH로의Pih 신호 화학적 이동 분포의 변환을 수행한다.
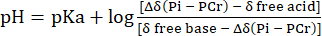 식 2
식 2
여기서 Δδ는 화학적 이동 차이이고, pKa는 6.72이고, 유리 염기는 5.69 δ, δ유리 산은 3.27이며, 앞서 설명한 바와 같이(31). - Lutz et al.32에 따라 Pih 화학적 이동 척도와 pH 척도 사이의 비선형성에 대한 결과 pH 분포 곡선을 수정합니다. 이 계산으로 인한 일반적인 pH 분포는 그림 1C에 나와 있습니다.
- Lutz et al.의 연구에 따라 7가지 통계 매개변수를 사용하여 다중 매개변수 접근 방식으로 조직 pH 분포를 분석합니다. 32. 이들 파라미터 중 4개는 조직 pH를 가장 잘 설명하는 것으로 보이기 때문에 여기에 제시되어 있다: 1) 전체 최대 pH; 2) 가중 평균 pH; 3) 가중 중간 pH; 및 4) pH 플롯의 왜도(도 1C).
12. LDH 및 PDH 활동 계산
참고: 과분극 대사 산물 [1-13C]젖산염 및 [13C]중탄산염의 생성 속도는 각각 LDH 및 PDH 활성을 계산하는 데 사용됩니다. 생성물 선택적 포화-여기 접근법(15)에서, 새로 합성된 과분극 대사산물만이 각각의 선택적 여기에 의해 검출된다.
- 과분극 [1-13C] 피루브산 신호를 참조로 사용하여 해당 대사 산물 생산 수준을 결정합니다.
- 과분극 매질로 관류하는 동안 NMR 튜브의 [1-13C]피루브산 농도가 증가하고(세척), 고원(최대 농도 14mM에서), 감소(세척)됩니다.
- 피루브산 농도가 일정한 수준(고원)에 도달한 시점을 식별하기 위해, 유효 이완 상수Teff를 사용하여T1 이완 및 RF 맥동으로 인한 신호 감쇠에 대한 [1-13C]피루브산 신호를 수정합니다.
- 각 주입에 대해 이 유동 역학을 보여주기 위해 [1-13C]피루브산 붕괴 곡선을 수정하는 능력에 기초하여 Teff를 정의합니다(Eq.3).
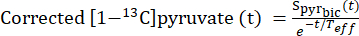 식 3
식 3
여기서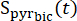 는 [1-13C]중탄산염 획득 동안 획득된 [1-13C]피루브산 신호입니다. 본원에 기재된 실험에서 평균Teff 는 35.8 s ± 2.3 s (n=5 hearts)인 것으로 밝혀졌다.
는 [1-13C]중탄산염 획득 동안 획득된 [1-13C]피루브산 신호입니다. 본원에 기재된 실험에서 평균Teff 는 35.8 s ± 2.3 s (n=5 hearts)인 것으로 밝혀졌다. - 추가 분석을 위해 농도가 최대 보정된 [1-13C]피루브산 신호의 10% 이내인 데이터 포인트를 선택합니다.
- 대사산물 신호의 SNR이 2(분석 임계값)보다 큰 경우 대사산물 생성 속도를 계산하기 위해 12.1단계에서 선택한 시점에 대한 [1-13C]젖산염 및 [13C]중탄산염 생산의 해당 데이터를 사용하십시오. 이러한 시점 선택의 전형적인 예가 도 2B (강조된 시간 윈도우)에 도시되어 있다.
- 식 4A 및 식 4B를 사용하여 선택된 각 데이터 포인트의 생산 속도를 계산합니다.
 식 4A
식 4A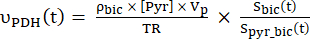 식 4B
식 4B
여기서 와 는 각각 각 시점에서 [1-13 C] 젖산 또는 [13 C] 중탄산염의 생산 속도입니다. [1-13 C] 피루 베이트와
와 는 각각 각 시점에서 [1-13 C] 젖산 또는 [13 C] 중탄산염의 생산 속도입니다. [1-13 C] 피루 베이트와 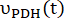 생성물 [1-13 C] 젖산 또는 [13C] 중탄산염의 상대적 여기를 나타내는 인자입니다.
생성물 [1-13 C] 젖산 또는 [13C] 중탄산염의 상대적 여기를 나타내는 인자입니다.
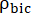 이들 인자는 이전에 각각 0.113 및 0.139로 결정되었다29. Vp는 NMR 프로브(1.375mL)에 의해 검출되는 부피이고, TR은 2개의 연속적인 생성물 선택적 포화 여기(각 생성물에 대해 12초) 사이의 시간 간격을 나타내며, 는 각각 [1-13C]젖산염 및 [13C]중탄산염의 신호이고
이들 인자는 이전에 각각 0.113 및 0.139로 결정되었다29. Vp는 NMR 프로브(1.375mL)에 의해 검출되는 부피이고, TR은 2개의 연속적인 생성물 선택적 포화 여기(각 생성물에 대해 12초) 사이의 시간 간격을 나타내며, 는 각각 [1-13C]젖산염 및 [13C]중탄산염의 신호이고 
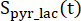 ,
, 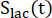
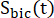 는 [1-13C]젖산염 및 [13C]젖산염 및 [13C]피루브산의 신호이다 C] 중탄산염 여기, 각각. [Pyr]은 [1-13C]피루브산 농도로, 고원기 동안 14mM이었습니다.
는 [1-13C]젖산염 및 [13C]젖산염 및 [13C]피루브산의 신호이다 C] 중탄산염 여기, 각각. [Pyr]은 [1-13C]피루브산 농도로, 고원기 동안 14mM이었습니다.- 각 지점에 대한 속도를 결정한 다음 과분극 주입당 평균을 결정합니다.
결과
KHB로 관류된 마우스 심장으로부터 그리고 완충액 단독으로부터 기록된 31P스펙트럼이 도 1A에 제시되어 있다. α-, β-, γ-ATP, PCr 및 Pi의 신호가 심장에서 관찰되었습니다. Pi 신호는 두 가지 주요 구성 요소로 구성되었습니다 : 더 높은 필드 (신호의 왼쪽)에서 Pi 신호는 대부분 pH 7.4의 KHB로 인한 것입니다. 하단 필드(신호의 오른쪽)에서 Pi 신호는 더 산성 환경으로 인해 ?...
토론
우리는 분리된 마우스 심장 모델에서 과분극된 [1-13C]피루브산 대사, 조직 에너지 및 pH를 조사하도록 설계된 실험 설정을 보여줍니다.
프로토콜 내의 중요한 단계는 다음과 같습니다: 1) 완충액의 pH가 7.4인지 확인하고; 2) 버퍼의 모든 성분이 포함되도록 하는 것; 3) 헤파린 주사에 의한 심장 혈관의 혈액 응고를 피하십시오. 4) 대사 활성을 감소시킴으로써 심장에 대한 ?...
공개
공개가 없습니다.
감사의 말
이 프로젝트는 보조금 계약 번호 1379/18에 따라 이스라엘 과학 재단으로부터 자금을 받았습니다. 직접 박사 과정 학생을위한 응용 및 공학 과학을위한 이스라엘 과학 기술부의 Jabotinsky 장학금 번호 3-15892 DS; 보조금 계약 No. 858149(AlternativesToGd)에 따른 유럽 연합의 Horizon 2020 연구 및 혁신 프로그램.
자료
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| HyperSense DNP Polariser | Oxford Instruments | 52-ZNP91000 | HyperSense, 3.35 T, preclinical dissolution-DNP hyperpolarizer |
| NMR spectrometer | RS2D | NMR Cube, 5.8 T, equipped with a 10 mm broad-band probe | |
| Peristaltic pump | Cole-Parmer | 07554-95 | |
| Temperature probe | Osensa | FTX-100-LUX+ | NMR compatible temprature probe |
| Somnosuite low-flow anesthesia system | Kent Scientific | ||
| Lines, tubings, suture | |||
| Platinum cured silicone tubes | Cole-Parmer | HV-96119-16 | L/S 16 I.D. 3.1 mm |
| Thin polyether ether ketone (PEEK) lines | Upchurch Scientific | id. 0.040” | |
| Intravenous catheter | BD Medical | 381323 | 22 G |
| Silk suture | Ethicon | W577H | Wire diameter of 3-0 |
| Chemicals and pharmaceuticals | |||
| [1-13C]pyruvic acid | Cambridge Isotope Laboratories | CLM-8077-1 | |
| Calcium chloride | Sigma-Aldrich | 21074 | CAS: 10043-52-4 |
| D-(+)-Glucose | Sigma-Aldrich | G7528 | CAS: 50-99-77 |
| Heparin sodium | Rotexmedica | HEP5A0130C0160 | |
| Hydrochloric acid 37% | Sigma-Aldrich | 258148 | CAS: 7647-01-0 |
| Insulin aspart (NovoLog) | Novo Nordisk | ||
| Isoflurane | Terrel | ||
| Magnesium Sulfate | Sigma-Aldrich | 793612 | CAS: 7487-88-9 |
| Potassium chloride | Sigma-Aldrich | P4504 | CAS: 7447-40-7 |
| Potassium phosphate monobasic | Sigma-Aldrich | P9791 | CAS: 7778-77-0 |
| Sodium bicarbonate | Gadot Group | CAS: 144-55-8 | |
| Sodium chloride | Sigma-Aldrich | S9625 | CAS: 7647-14-5 |
| Sodium hydroxide | Sigma-Aldrich | 655104 | CAS: 1310-73-2 |
| Sodium phosphate dibasic | Sigma-Aldrich | S7907 | CAS: 7558-79-4 |
| Sodium phosphate monobasic dihydrate | Merck | 6345 | CAS: 13472-35-0 |
| TRIS (biotechnology grade) | Amresco | 0826 | CAS: 77-86-1 |
| Trityl radical OX063 | GE Healthcare AS | NC100136 | OX063 |
| NMR standards | |||
| 13C standard sample | Cambridge Isotope Laboratories | DLM-72A | 40% p-dioxane in benzene-D6 |
| 31P standard sample | Made in house | 105 mM ATP and 120 mM phenylphosphonic acid in D2O | |
| Software | |||
| Excel 2016 | Microsoft | ||
| MNova | Mestrelab Research |
참고문헌
- Aquaro, G. D., Menichetti, L. Hyperpolarized 13C-magnetic resonance spectroscopy: Are we ready for metabolic imaging. Circulation. Cardiovascular Imaging. 7 (6), 854-856 (2014).
- Schroeder, M. A., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB Journal. 23 (8), 2529-2538 (2009).
- Ardenkjaer-Larsen, J. H., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proceedings of the National Academy of Sciences of the United States of America. 100 (18), 10158-10163 (2003).
- Merritt, M. E., et al. Hyperpolarized C-13 allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proceedings of the National Academy of Sciences of the United States of America. 104 (50), 19773-19777 (2007).
- Ball, D. R., et al. Hyperpolarized butyrate: A metabolic probe of short chain fatty acid metabolism in the heart. Magn Reson Med. (5), 1663-1669 (2014).
- Khemtong, C., Carpenter, N. R., Lumata, L. L., et al. Hyperpolarized 13C NMR detects rapid drug-induced changes in cardiac metabolism. Magnetic Resonance in Medicine. 74 (2), 312-319 (2015).
- Mariotti, E., et al. Modeling non-linear kinetics of hyperpolarized [1-13C] pyruvate in the crystalloid-perfused rat heart. NMR in Biomedicine. 29 (4), 377-386 (2016).
- Moreno, K. X., Sabelhaus, S. M., Merritt, M. E., Sherry, A. D., Malloy, C. R. Competition of pyruvate with physiological substrates for oxidation by the heart: implications for studies with hyperpolarized [1-13C]pyruvate. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), H1556-H1564 (2010).
- Purmal, C., et al. Propionate stimulates pyruvate oxidation in the presence of acetate. American Journal of Physiology-Heart and Circulatory Physiology. 307 (8), H1134-H1141 (2014).
- Weiss, K., et al. Developing hyperpolarized 13C spectroscopy and imaging for metabolic studies in the isolated perfused rat heart. Applied Magnetic Resonance. 43 (1), 275-288 (2012).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia: NMR detection of hyperpolarized 13CO2and H13CO3. Magnetic Resonance in Medicine. 60 (5), 1029-1036 (2008).
- Schroeder, M. A., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovascular Research. 86 (1), 82-91 (2010).
- Ball, D. R., et al. Metabolic imaging of acute and chronic infarction in the perfused rat heart using hyperpolarised [1-13C]pyruvate. NMR in Biomedicine. 26 (11), 1441-1450 (2013).
- Atherton, H. J., et al. Role of PDH inhibition in the development of hypertrophy in the hyperthyroid rat heart: a combined magnetic resonance imaging and hyperpolarized magnetic resonance spectroscopy study. Circulation. 123 (22), 2552-2561 (2011).
- Harris, T., et al. Hyperpolarized product selective saturating-excitations for determination of changes in metabolic reaction rates in real-time. NMR in Biomedicine. 33 (2), e4189 (2020).
- Shaul, D., et al. Correlation between lactate dehydrogenase/pyruvate dehydrogenase activities ratio and tissue pH in the perfused mouse heart: A potential noninvasive indicator of cardiac pH provided by hyperpolarized magnetic resonance. NMR in Biomedicine. 34 (2), e4444 (2021).
- Jian, Z., et al. In vivo cannulation methods for cardiomyocytes isolation from heart disease models. PLoS One. 11 (8), e0160605 (2016).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacological Research. 41 (6), 613-627 (2000).
- Lateef, R., Al-Masri, A., Alyahya, A. Langendorff's isolated perfused rat heart technique: A review. International Journal of Basic and Clinical Pharmacology. 4, 1314-1322 (2015).
- Cross, H. R., Radda, G. K., Clarke, K. The role of Na+/K+ ATPase activity during low-flow ischemia in preventing myocardial injury - A 31P, 23Na and 87Rb NMR spectroscopic study. Magnetic Resonance in Medicine. 34 (5), 673-685 (1995).
- Cross, H. R., Clarke, K., Opie, L. H., Radda, G. K. Is lactate-induced myocardial ischaemic injury mediated by decreased pH or increased intracellular lactate. Journal of Molecular and Cellular Cardiology. 27 (7), 1369-1381 (1995).
- Clarke, K., O'Connor, A. J., Willis, R. J. Temporal relation between energy metabolism and myocardial function during ischemia and reperfusion. American Journal of Physiology. 253 (2), H412-H421 (1987).
- Yabe, T., Mitsunami, K., Inubushi, T., Kinoshita, M. Quantitative measurements of cardiac phosphorus metabolites in coronary artery disease by 31P magnetic resonance spectroscopy. Circulation. 92 (1), 15-23 (1995).
- Bakrania, B., Granger, J. P., Harmancey, R. Methods for the determination of rates of glucose and fatty acid oxidation in the isolated working rat heart. Journal of Visualized Experiments. (115), e54497 (2016).
- Cordeiro, B., Clements, R. Murine isolated heart model of myocardial stunning associated with cardioplegic arrest. Journal of Visualized Experiments. (102), e52433 (2015).
- Kolwicz, S. C., Tian, R. Assessment of cardiac function and energetics in isolated mouse hearts using 31P NMR spectroscopy. Journal of Visualized Experiments. (42), e2069 (2010).
- Nakadate, Y., et al. Glycemia and the cardioprotective effects of insulin pre-conditioning in the isolated rat heart. Cardiovascular Diabetology. 16 (1), 43 (2017).
- Lauritzen, M. H., et al. Enhancing the C-13 bicarbonate signal in cardiac hyperpolarized 1-C-13 pyruvate MRS studies by infusion of glucose, insulin and potassium. NMR in Biomedicine. 26 (11), 1496-1500 (2013).
- Adler-Levy, Y., et al. In-cell determination of lactate dehydrogenase activity in a luminal breast cancer model - ex vivo investigation of excised xenograft tumor slices using dDNP hyperpolarized [1-13C]pyruvate. Sensors. 19 (9), 2089 (2019).
- Young, A. A., Barnes, H., Davison, D., Neubauer, S., Schneider, J. E. Fast left ventricular mass and volume assessment in mice with three-dimensional guide-point modeling. Journal of Magnetic Resonance Imaging. 30 (3), 514-520 (2009).
- Bailey, I. A., Williams, S. R., Radda, G. K., Gadian, D. G. Activity of phosphorylase in total global ischaemia in the rat heart. A phosphorus-31 nuclear-magnetic-resonance study. Biochemical Journal. 196 (1), 171-178 (1981).
- Lutz, N. W., Le Fur, Y., Chiche, J., Pouyssegur, J., Cozzone, P. J. Quantitative in vivo characterization of intracellular and extracellular pH profiles in heterogeneous tumors: A novel method enabling multiparametric pH analysis. Cancer Research. 7 (15), 4616-4628 (2013).
- Harris, T., Gamliel, A., Sosna, J., Gomori, J. M., Katz-Brull, R. Impurities of [1-13C]pyruvic acid and a method to minimize their signals for hyperpolarized pyruvate metabolism studies. Applied Magnetic Resonance. 49 (10), 1085-1098 (2018).
- Cunningham, C. H., et al. Hyperpolarized 13C metabolic MRI of the human heart initial experience. Circulation Research. 119 (11), 1177-1182 (2016).
- Kurhanewicz, J., et al. Hyperpolarized 13C MRI: Path to clinical translation in oncology. Neoplasia. 21 (1), 1-16 (2019).
- Miloushev, V. Z., et al. Metabolic imaging of the human brain with hyperpolarized 13C pyruvate demonstrates 13C lactate production in brain tumor patients. Cancer Research. 78 (14), 3755-3760 (2018).
- Park, I., et al. Development of methods and feasibility of using hyperpolarized carbon-13 imaging data for evaluating brain metabolism in patient studies. Magnetic Resonance in Medicine. 80 (3), 864-873 (2018).
- Grist, J. T., et al. Quantifying normal human brain metabolism using hyperpolarized [1-13C]pyruvate and magnetic resonance imaging. Neuroimage. 189, 171-179 (2019).
- Nelson, S. J., et al. Metabolic imaging of patients with prostate cancer using hyperpolarized [1-C]pyruvate. Science Translational Medicine. 5 (198), (2013).
- Stødkilde-Jørgensen, H., et al. Pilot study experiences with hyperpolarized [1-13C]pyruvate MRI in pancreatic cancer patients. Journal of Magnetic Resonance Imaging. 51 (3), 961-963 (2019).
- Autry, A. W., et al. Measuring tumor metabolism in pediatric diffuse intrinsic pontine glioma using hyperpolarized carbon-13 MR metabolic imaging. Contrast Media and Molecular Imaging. 2018, 3215658 (2018).
- Chung, B. T., et al. First hyperpolarized [2-13C]pyruvate MR studies of human brain metabolism. Journal of Magnetic Resonance. 309, 106617 (2019).
- Rider, O. J., et al. Noninvasive in vivo assessment of cardiac metabolism in the healthy and diabetic human heart using hyperpolarized 13C MRI. Circulation Research. 126 (6), 725-736 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유