É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Investigando o Metabolismo Cardíaco no Coração de Rato Perfundido Isolado com Piruvato Hiperpolarizado [1-13C]Piruvato e Espectroscopia de RMN 13C/31P
Neste Artigo
Resumo
Descrevemos uma configuração experimental para administrar metabólitos hiperpolarizados marcados com 13C no modo de perfusão contínua a um coração de rato perfundido isolado. Uma abordagem dedicada à aquisição de 13C-NMR permitiu a quantificação da atividade enzimática metabólica em tempo real, e uma análise multiparamétrica de 31P-NMR permitiu a determinação do conteúdo de ATP tecidual e do pH.
Resumo
O metabolismo é a base de processos importantes na vida celular. Caracterizar como as redes metabólicas funcionam nos tecidos vivos fornece informações cruciais para a compreensão do mecanismo das doenças e a concepção de tratamentos. Neste trabalho, descrevemos procedimentos e metodologias para estudar a atividade metabólica intracelular em um coração de camundongo retrógrado perfundido em tempo real. O coração foi isolado in situ, em conjunto com parada cardíaca para minimizar a isquemia miocárdica e foi perfundido dentro de um espectrômetro de ressonância magnética nuclear (RMN). Enquanto no espectrômetro e sob perfusão contínua, o [1-13 C]piruvato hiperpolarizado foi administrado ao coração, e as subsequentes taxas de produção de [1-13 C]lactato e [13C]bicarbonato hiperpolarizadas serviram para determinar, em tempo real, as taxas de produção de lactato desidrogenase e piruvato desidrogenase. Esta atividade metabólica do [1-13C]piruvato hiperpolarizado foi quantificada com espectroscopia de RMN de forma livre usando a abordagem de aquisição de saturação seletiva de excitações do produto. 31 anos A espectroscopia de P foi aplicada entre as aquisições hiperpolarizadas para monitorar a energia cardíaca e o pH. Este sistema é excepcionalmente útil para estudar a atividade metabólica no coração de rato saudável e doente.
Introdução
Alterações no metabolismo cardíaco estão associadas a uma variedade de cardiomiopatias e muitas vezes formam a base dos mecanismos fisiopatológicos subjacentes1. No entanto, existem inúmeros obstáculos para estudar o metabolismo em tecidos vivos, já que a maioria dos ensaios bioquímicos requer a homogeneização do tecido e lise celular e / ou rastreamento radioativo. Portanto, há uma necessidade premente de novas ferramentas para investigar o metabolismo miocárdico em tecidos vivos. A ressonância magnética (RM) de substratos hiperpolarizados marcados com 13C permite medições em tempo real do metabolismo em tecidos vivos2, sem o uso de radiação ionizante, aumentando a relação sinal-ruído (SNR) por RM do(s) sítio(s) marcado(s) em várias ordens de magnitude3. Aqui, descrevemos uma configuração experimental, uma abordagem de aquisição e uma abordagem analítica para estudar o metabolismo rápido no coração isolado de camundongos e, em paralelo, apresentar indicadores de energia e acidez tecidual geral. O pH cardíaco é um indicador valioso, pois o equilíbrio ácido-base é interrompido nos estágios iniciais de doenças cardíacas e condições como isquemia miocárdica, hipertrofia desadaptativa e insuficiência cardíaca6.
A produção de [1-13 C]lactato e [13 C]bicarbonato hiperpolarizados a partir do [1-13C]piruvato hiperpolarizado ajuda a determinar as taxas de produção de lactato desidrogenase (LDH) e piruvato desidrogenase (PDH). A maioria dos estudos prévios realizados utilizando substratos hiperpolarizados no coração de roedores isolados utilizou modelos cinéticos complexos para derivar a atividade enzimática da LDH e PDH, ou relatou as razões de intensidade de sinal do produto hiperpolarizado para um substrato sem calcular as taxas reais de atividade enzimática 2,4,5,6,7,8,9,10, 11,12,13,14. Aqui, utilizou-se a abordagem de saturação-excitação seletiva do produto 15, que permite o monitoramento da atividade enzimática de forma livre de modelos15,16. Desta forma, as taxas enzimáticas absolutas (ou seja, o número de moles de produto produzido por unidade de tempo) foram determinadas. 31 anos A espectroscopia P foi utilizada para observar os sinais de fosfato inorgânico (Pi), fosfocreatina (PCr) e trifosfato de adenosina (ATP). Uma análise multiparamétrica foi utilizada para caracterizar a distribuição do pH do coração, como demonstrado pelo deslocamento químico heterogêneo no sinal Pi do tecido.
O coração de rato retrógrado perfundido (coração de Langendorff)17,18,19 é um modelo ex vivo para o coração que bate intacto. Nesse modelo, a viabilidade cardíaca e o pH são preservados por pelo menos 80 min20, e tem demonstrado potencial de recuperação após lesão isquêmica prolongada21,22. No entanto, a variabilidade inadvertida durante a microcirurgia pode levar à variabilidade na viabilidade tecidual entre os corações. Estudos anteriores relataram a deterioração desse coração ao longo do tempo19; por exemplo, observou-se uma redução na função contrátil de 5%-10% por hora18. O sinal do trifosfato de adenosina (ATP) já demonstrou relatar o estado energético miocárdico e a viabilidade23. Aqui, observamos que o coração perfundido pode, ocasionalmente, apresentar variabilidade não intencional nos níveis de viabilidade, como demonstrado pelo teor de ATP, apesar de termos tido uma perfusão ininterrupta e suprimento de oxigênio. Demonstramos aqui que normalizar as taxas de LDH e PDH para o conteúdo de ATP do coração reduz a variabilidade intercardíaca nessas taxas.
No protocolo a seguir, descrevemos o procedimento cirúrgico utilizado para canulação cardíaca, isolamento e consequente perfusão no espectrômetro de RMN. Vale ressaltar que outras abordagens cirúrgicas com o objetivo de isolar e perfundir o coração de camundongos foram descritas antesde 24,25.
As metodologias utilizadas para a aquisição de dados relacionados às taxas enzimáticas no coração batendo (usando espectroscopia de 13 C e [1-13C]piruvato hiperpolarizado) e a viabilidade e acidez do coração (usando espectroscopia de RMN de 31P) também são descritas. Finalmente, as metodologias analíticas para determinar as atividades enzimáticas metabólicas e a viabilidade e acidez tecidual são explicadas.
Protocolo
O comitê conjunto de ética (IACUC) da Universidade Hebraica e do Hadassah Medical Center aprovou o protocolo de estudo para o bem-estar animal (MD-19-15827-1).
1. Preparação do tampão de Krebs-Henseleit
- Um dia antes do experimento, prepare uma versão modificada do buffer de Krebs-Henseleit (KHB)26. Inicialmente, dissolver 118 mM NaCl, 4,7 mM KCl, 0,5 mM piruvato, 1,2 mM MgSO 4, 25 mM NaHCO3 e 1,2 mM KH 2 PO4 em H2O de destilação dupla.
- Borbulhe esta mistura com 95%/5% O 2/CO 2 por 20 min e, em seguida, adicione 1,2 mM CaCl2.
- Ajuste o pH do tampão para 7,4 com HCl ou NaOH.
- No dia do experimento, adicionar 10 mM de glicose e 72 U/L de insulina ao KHB preparado na etapa 1.2.
NOTA: A insulina é adicionada ao tampão de perfusão conforme descrito no trabalho de Kolwicz et al.26 e em concordância com estudos anteriores relatando que a insulina aumenta a função contrátil27 e a intensidade do sinal de bicarbonato hiperpolarizado [13C]28.
2. Preparação do sistema de perfusão
- Manter um reservatório de 200 mL de KHB em banho-maria a 40 °C e borbulhar com 95%/5% O 2/CO2 a uma taxa de fluxo de 4 L/min por 1 h antes da perfusão cardíaca. Mantenha o tampão continuamente borbulhando com esta mistura de gases durante todo o experimento.
- Primeiro, ajuste o banho-maria para 40 °C. Insira o reservatório KHB. Use uma bomba peristáltica (ver Tabela de Materiais) e tubos de extensão de grau médico para recircular o KHB entre o reservatório tampão e o tubo de RMN de 10 mm a uma taxa de fluxo constante de 7,5 mL/min.
- Conecte três tubos de silicone curados com platina (3 mm i.d.) à bomba (um tubo de entrada e dois tubos de saída para o buffer KH). Insira as linhas de saída e de entrada no buffer KH aquecido. Em seguida, insira a linha de oxigênio no tampão KH aquecido.
- Use linhas finas de éter de poliéter cetona (PEEK, consulte Tabela de Materiais) para que o buffer e o agente hiperpolarizado fluam de e para o tubo de RMN dentro do furo do espectrômetro.
- Certifique-se de que a temperatura é mantida em 37-37,5 °C. Siga os passos abaixo.
- Envolva a linha de entrada (do reservatório tampão para o tubo de RMN) com uma fita de aquecimento ajustada para 42 °C.
- Aqueça o tubo de RMN dentro do espectrômetro com um fluxo de ar quente que é regulado pelo espectrômetro.
- Use um sensor de temperatura compatível com RMN (consulte Tabela de Materiais) para medir a temperatura dentro do tubo de RMN. A temperatura é ajustada para 37-37,5 °C.
3. Calibração e preparação do espectrômetro de RMN para aquisição
- No dia do experimento, insira uma amostra padrão de 13 C que contenha 1,4-dioxano (Tabela de Materiais) no espectrômetro e ajuste e combine a sonda de RMN para 13C. Em seguida, obtenha um espectro mostrando o sinal de equilíbrio térmico de 1,4-dioxano com um ângulo de nutação de 90°.
- Agora troque a amostra padrão de 13C por uma amostra padrão de 31 P (Tabela de Materiais), que contém 105 mM de ATP em D2O. Tune e corresponda à sonda NMR para 31P.
NOTA: Um espectro que mostra os sinais de fosfato de equilíbrio térmico é obtido com um ângulo de nutação de 50°. - Insira a linha de entrada, a linha de saída e a sonda de temperatura em um tubo de RMN de 10 mm e, em seguida, insira o tubo no furo magnético. Ajustar a fita de aquecimento a 42 °C.
- Adquira um espectro de RMN de 31 P do tampão KH circulante a ser usado nesse experimento por 30min, com um ângulo de nutação de 50° e um TR de 1,1 s (1.640 aquisições).
4. Preparação animal, procedimento cirúrgico e perfusão do coração no tubo de RMN
- Anestesiar um camundongo macho HSD:ICR (CD-1) com isoflurano a 3,3% em ar ambiente (Tabela de Materiais) a 340 mL/min por 5 min utilizando um sistema de anestesia gasosa (Tabela de Materiais) em câmara de indução.
- Utilizar anestesia nasal para a manutenção da anestesia geral com isoflurano a 2,9%.
NOTA: Cuidados são tomados para minimizar a dor e o desconforto para o animal. - Prenda os membros do animal com fita adesiva, assegure um reflexo negativo de dor no pedal e, em seguida, injete 300 UI de heparina sódica por via intraperitoneal.
- Molhe a parede torácica e o abdômen do rato completamente com álcool a 70% para garantir a limpeza e evitar a contaminação ou obstrução do cabelo durante o procedimento cirúrgico.
- Em 1 min após a injeção de heparina, corte a pele e o músculo da cavidade abdominal com uma pequena tesoura.
- Coloque o pequeno grampo de mosquito com bloqueio de hemostático de mandíbula curva entre o processo xifoide e a pele do peito para levantar o peito e expor o diafragma. Punção e corte o lobo direito do diafragma.
- Corte o peito através da linha média, retraia para os lados e, em seguida, remova.
- Injete o ventrículo esquerdo do coração com 200 UI de heparina sódica para evitar a coagulação do sangue. Em seguida, injete 0,1 mL de KCl gelado a 0,5 mol/L para atingir a parada cardíaca, conforme descrito anteriormente25. A parada cardíaca é essencial para poder canular o coração.
- Identifique o timo e remova-o usando uma tesoura para expor a aorta. Remova o tecido residual da caixa torácica.
- Identifique o arco aórtico e use pinças curvas para colocar um nó solto com uma sutura de seda 3-0 (Tabela de Materiais) ao redor da aorta ascendente. Injete 3 mL de KHB no ventrículo esquerdo para remover coágulos sanguíneos da aorta.
- Use pinça curva para retrair o coração inferiormente para melhor visualização da aorta ascendente.
- Realizar a canulação in situ com cateter intravenoso 22 G (Tabela de Materiais). Aplique adesivo de cianoacrilato na região canulada e, em seguida, realize a amarração de sutura dupla. Injete tampão KH adicional no coração e verifique se ele flui através do tubo de canulação.
- Remova a pinça curva. Desconecte o coração das vísceras circundantes e perfunda-o retrógradamente com KHB gelado (4 °C) através do cateter intravenoso.
- Conecte o coração à linha de entrada do sistema de perfusão através do cateter intravenoso. Após o início da perfusão com tampão quente (37-37,5 °C) a 7,5 mL/min, o coração começa a bater espontaneamente.
- Fixe o tubo de RMN com o coração batendo, as linhas de saída e a sonda de temperatura e insira no furo do espectrômetro, certificando-se de que o coração esteja no centro da sonda de RMN.
5. Aquisição de dados para energia cardíaca e pH
- Adquira espectros de 31P por cerca de 1 h com um ângulo de inversão de 50 ° e um TR de 1,1 s.
6. Polarização e dissolução do spin DNP
- Prepare uma formulação de 28,5 mg de [1-13C]piruvato. Esta formulação consiste em 11,1 mM a 14,0 mM OX063 radical no ácido puro.
- Preparar 4 ml de meio de dissolução. O meio de dissolução consiste em tampão TRIS-fosfato, que contém 11,2 mM NaH 2 PO 4, 38,8 mM Na 2 HPO4, 33 mM TRIS e2mM HCl. Esta composição do meio é ajustada de tal forma que, após a adição de 28,5 mg de formulação de ácido [1-13C]pirúvico a 4 mL deste tampão (na fase de dissolução), o pH da solução resultante será de 7,4.
- Execute a polarização por rotação e a dissolução rápida em um dispositivo de polarização por rotação DNP (dDNP) de acordo com as instruções do fabricante (Tabela de Materiais). Aplicar irradiação de micro-ondas a uma frequência de 94,110 GHz para a polarização da formulação de ácido [1-13C]pirúvico a 1,45 K a 1,55 K por cerca de 1,5 h.
- Misture rapidamente os 4 mL de meio hiperpolarizado do dispositivo dDNP com uma solução bem oxigenada que complemente o meio de dissolução hiperpolarizado para obter uma composição próxima ao meio de perfusão.
NOTA: O volume final do meio que perfunde o coração durante as injeções hiperpolarizadas com 14 mM hiperpolarizados [1-13C]piruvato é de 26 mL. A composição final do meio injetado (após mistura) contém 4,7 mM KCl, 1,2 mM MgSO 4, 70 mM NaCl, 25 mM NaHCO3, 1,2 mM KH 2 PO4, 10 mM de glicose, 1,2 mM CaCl2e 72 U/L de insulina. - Administrar o meio hiperpolarizado contendo [1-13C]piruvato ao coração isolado usando uma configuração de fluxo contínuo29.
NOTA: Isso é feito para garantir que a perfusão cardíaca não seja perturbada em nenhum momento durante o experimento e que o meio hiperpolarizado seja administrado a uma taxa conhecida e por uma duração conhecida.
7. Espectroscopia hiperpolarizada de 13C
- Adquirir dados hiperpolarizados de 13 C usando pulsos de saturação-excitação seletivos do produto 15 aplicando pulsos de seno cardinal (Sinc) de 2,5 ms, conforme descrito anteriormente15,16. Excitar seletivamente [1-13 C]lactato e [13C]bicarbonato consecutivamente em intervalos de 6 s para obter um intervalo de 12s para cada metabólito.
- Para a detecção de [1-13 C]lactato, centralize o pulso seletivo de Sinc na frequência de hidrato de [1-13 C]piruvato (179,4 ppm), o que resulta em razão de intensidade de sinal (lac) de 0,113 para os sinais C 1 de [1-13 C]piruvato para [1-13C]lactato.
- Para a detecção de [13 C]bicarbonato, centralize o pulso seletivo de Sinc em 157,7 ppm, que é 214 Hz de campo descendente do sinal de [13C]bicarbonato (161,1 ppm); isso resulta em uma razão de intensidade de sinal (bic) de 0,139 para o sinal C 1 de [1-13C]piruvato para [13C]bicarbonato.
8. Determinação do peso e volume húmidos do tecido
- No final do experimento, desprenda o coração do sistema de perfusão e seque-o suavemente com papel de seda. Posteriormente, pese o coração para obter o peso úmido do tecido.
- Determinar o volume do coração usando um fator de densidade de 1,05 g/cm3, conforme determinado anteriormente para o coração do rato30.
9. Quantificação do teor de ATP
- Integrar o sinal γ-ATP de uma única aquisição da amostra padrão ATP e uma aquisição de 30 min (TR de 1,1 s e 1.640 aquisições) do coração isolado.
- Quantifique o conteúdo de ATP do coração comparando a integral do sinal γ-ATP do coração com o do padrão (Tabela de Materiais), onde este último tem uma concentração conhecida (105 mM), e corrigir o número de aquisições e efeitos de relaxamento.
10. Resolvendo o sinal Pi do coração
NOTA: Para avaliar o pH tecidual, primeiro é necessário dissociar o sinal Pi do coração do sinal Pi total (Pit). Isso é feito omitindo o sinal do KHB Pi (PiKH) do sinal do Pit.
- Em um espectro de 31P de KHB que mostra um único sinal Pi (Pi KH, Figura 1A), ajuste o sinal PiKH a uma função lorentziana usando o Excel (Tabela de Materiais).
- O volume visível para a sonda de RMN (Vp, 1,375 mL), contém mais KHB quando o tubo de amostra não contém o coração. Para corrigir esse efeito de enchimento, calcule o sinal de buffer atenuado (Pib) usando a Eq. 1A.
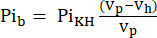 Equina 1A
Equina 1A
onde Vh é o volume do coração, conforme determinado na etapa 8. - Subtraia este sinal do Pit de acordo com a Eq. 1B para obter o sinal Pi proveniente exclusivamente do coração perfundido (Pih, Figura 1B).
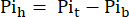 Eq. 1B
Eq. 1B
11. Análise multiparamétrica do pH
- Realizar a conversão da distribuição do deslocamento químico do sinal de Pih para o pH com referência ao deslocamento químico do PCr usando a Eq. 231.
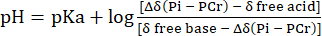 Equina 2
Equina 2
onde Δδ é a diferença de deslocamento químico, pKa é 6,72, δ base livre é 5,69 e δ ácido livre é 3,27, conforme descrito anteriormente31. - Corrigir a curva de distribuição de pH resultante para a não linearidade entre a escala de deslocamento químico de Pih e a escala de pH de acordo com Lutz et al.32. Uma distribuição típica do pH resultante desse cálculo é apresentada na Figura 1C.
- Analisar a distribuição do pH tecidual com uma abordagem multiparamétrica utilizando sete parâmetros estatísticos seguindo o trabalho de Lutz et al. 32. Quatro desses parâmetros são apresentados aqui, pois parecem ser os mais descritivos do pH tecidual: 1) pH máximo global; 2) pH médio ponderado; 3) pH mediano ponderado; e 4) distorção do gráfico de pH (Figura 1C).
12. Cálculo das atividades LDH e PDH
NOTA: As taxas de produção dos metabólitos hiperpolarizados [1-13 C]lactato e [13C]bicarbonato são utilizadas para calcular as actividades LDH e PDH, respectivamente. Na abordagem de saturação-excitação seletiva do produto15, apenas metabólitos hiperpolarizados recém-sintetizados são detectados por cada excitação seletiva.
- Use o sinal hiperpolarizado [1-13C]piruvato como referência para determinar o nível de produção de metabólitos correspondente.
- Durante a perfusão com o meio hiperpolarizado, a concentração de [1-13C]piruvato no tubo de RMN aumenta (wash-in), depois se estabiliza (a uma concentração máxima de 14 mM) e depois diminui (wash-out).
- Para identificar os pontos de tempo em que a concentração de piruvato atingiu um nível constante (platô), corrija o sinal de [1-13C]piruvato para o decaimento do sinal resultante do relaxamento de T1 e da pulsação de RF usando a constante de relaxamento efetiva, Teff.
- Para cada injeção, defina o Teff com base em sua capacidade de corrigir a curva de decaimento do [1-13C]piruvato para mostrar essa dinâmica de fluxo (Eq.3).
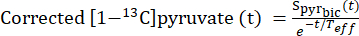 Equina 3
Equina 3
onde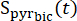 é o sinal de [1-13 C]piruvato que foi adquirido durante a aquisição de [13C]bicarbonato. A média de Teff nos experimentos aqui descritos foi de 35,8 s ± 2,3 s (n = 5 corações).
é o sinal de [1-13 C]piruvato que foi adquirido durante a aquisição de [13C]bicarbonato. A média de Teff nos experimentos aqui descritos foi de 35,8 s ± 2,3 s (n = 5 corações). - Selecione os pontos de dados em que a concentração está dentro de 10% do sinal máximo corrigido [1-13C]piruvato para análise posterior.
- Utilizar os dados correspondentes de produção de [1-13 C]lactato e [13C]bicarbonato para os pontos de tempo selecionados no passo 12.1 para o cálculo das taxas de produção de metabolitos utilizando a Eq. 4A e a Eq. 4B, desde que o SNR do sinal do metabolito seja superior a 2 (limiar para análise). Um exemplo típico de tal seleção de pontos de tempo é mostrado na Figura 2B (janela temporal realçada).
- Calcule as taxas de produção de cada um dos pontos de dados selecionados usando a Eq. 4A e a Eq. 4B:
 Equina 4A
Equina 4A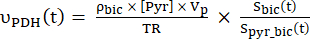 Equina 4B
Equina 4B
onde e são as taxas de produção de [1-13 C]lactato ou [13 C]bicarbonato em cada ponto de tempo, respectivamente. e são fatores que representam a excitação relativa de [1-13 C]piruvato e
e são as taxas de produção de [1-13 C]lactato ou [13 C]bicarbonato em cada ponto de tempo, respectivamente. e são fatores que representam a excitação relativa de [1-13 C]piruvato e 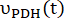
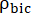 os produtos [1-13 C]lactato ou [13C]bicarbonato, respectivamente.
os produtos [1-13 C]lactato ou [13C]bicarbonato, respectivamente. Esses fatores foram determinados previamente como sendo 0,113 e 0,139, respectivamente29. Vp é o volume que é detectado pela sonda de RMN (1,375 mL), TR denota o intervalo de tempo entre duas excitações seletivas consecutivas de saturação do produto (12 s para cada produto),
Esses fatores foram determinados previamente como sendo 0,113 e 0,139, respectivamente29. Vp é o volume que é detectado pela sonda de RMN (1,375 mL), TR denota o intervalo de tempo entre duas excitações seletivas consecutivas de saturação do produto (12 s para cada produto), 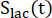 e são os sinais de [1-13 C]lactato e [13 C]bicarbonato, respectivamente, e
e são os sinais de [1-13 C]lactato e [13 C]bicarbonato, respectivamente, e 
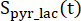 são os sinais de [1-13 C]piruvato que foram adquiridos durante o [1-13 C]lactato e
são os sinais de [1-13 C]piruvato que foram adquiridos durante o [1-13 C]lactato e 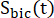 [13 Excitações de C]bicarbonato, respectivamente. [Pyr] é a concentração de [1-13C]piruvato, que foi de 14 mM durante a fase de platô.
[13 Excitações de C]bicarbonato, respectivamente. [Pyr] é a concentração de [1-13C]piruvato, que foi de 14 mM durante a fase de platô.- Determine a taxa para cada ponto e, em seguida, a média por injeção hiperpolarizada.
Resultados
Os espectros de 31P registrados a partir de um coração de rato perfundido com KHB e do tampão isolado são mostrados na Figura 1A. Os sinais de α, β e γ-ATP, PCr e Pi foram observados no coração. O sinal Pi foi composto por dois componentes principais: no campo superior (lado esquerdo do sinal), o sinal Pi foi principalmente devido ao KHB a um pH de 7,4; no campo inferior (lado direito do sinal), o sinal Pi foi mais amplo e menos homogêneo devido ao ambiente mais ácido. ...
Discussão
Demonstramos uma configuração experimental projetada para investigar o metabolismo hiperpolarizado do [1-13C]piruvato, a energia tecidual e o pH em um modelo isolado de coração de camundongo.
As etapas críticas dentro do protocolo são as seguintes: 1) garantir que o pH do tampão seja de 7,4; 2) assegurar que todos os componentes da reserva sejam incluídos; 3) evitar a coagulação do sangue nos vasos cardíacos por injeções de heparina; 4) evitar danos isquêmicos ao cora?...
Divulgações
Não há divulgações.
Agradecimentos
Este projeto recebeu financiamento da Israel Science Foundation sob o contrato de subvenção nº 1379/18; a Bolsa Jabotinsky do Ministério da Ciência e Tecnologia de Israel para Ciências Aplicadas e de Engenharia para Estudantes de Doutorado Direto No. 3-15892 para D.S.; e o programa de investigação e inovação Horizonte 2020 da União Europeia ao abrigo da convenção de subvenção n.º 858149 (AlternativesToGd).
Materiais
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| HyperSense DNP Polariser | Oxford Instruments | 52-ZNP91000 | HyperSense, 3.35 T, preclinical dissolution-DNP hyperpolarizer |
| NMR spectrometer | RS2D | NMR Cube, 5.8 T, equipped with a 10 mm broad-band probe | |
| Peristaltic pump | Cole-Parmer | 07554-95 | |
| Temperature probe | Osensa | FTX-100-LUX+ | NMR compatible temprature probe |
| Somnosuite low-flow anesthesia system | Kent Scientific | ||
| Lines, tubings, suture | |||
| Platinum cured silicone tubes | Cole-Parmer | HV-96119-16 | L/S 16 I.D. 3.1 mm |
| Thin polyether ether ketone (PEEK) lines | Upchurch Scientific | id. 0.040” | |
| Intravenous catheter | BD Medical | 381323 | 22 G |
| Silk suture | Ethicon | W577H | Wire diameter of 3-0 |
| Chemicals and pharmaceuticals | |||
| [1-13C]pyruvic acid | Cambridge Isotope Laboratories | CLM-8077-1 | |
| Calcium chloride | Sigma-Aldrich | 21074 | CAS: 10043-52-4 |
| D-(+)-Glucose | Sigma-Aldrich | G7528 | CAS: 50-99-77 |
| Heparin sodium | Rotexmedica | HEP5A0130C0160 | |
| Hydrochloric acid 37% | Sigma-Aldrich | 258148 | CAS: 7647-01-0 |
| Insulin aspart (NovoLog) | Novo Nordisk | ||
| Isoflurane | Terrel | ||
| Magnesium Sulfate | Sigma-Aldrich | 793612 | CAS: 7487-88-9 |
| Potassium chloride | Sigma-Aldrich | P4504 | CAS: 7447-40-7 |
| Potassium phosphate monobasic | Sigma-Aldrich | P9791 | CAS: 7778-77-0 |
| Sodium bicarbonate | Gadot Group | CAS: 144-55-8 | |
| Sodium chloride | Sigma-Aldrich | S9625 | CAS: 7647-14-5 |
| Sodium hydroxide | Sigma-Aldrich | 655104 | CAS: 1310-73-2 |
| Sodium phosphate dibasic | Sigma-Aldrich | S7907 | CAS: 7558-79-4 |
| Sodium phosphate monobasic dihydrate | Merck | 6345 | CAS: 13472-35-0 |
| TRIS (biotechnology grade) | Amresco | 0826 | CAS: 77-86-1 |
| Trityl radical OX063 | GE Healthcare AS | NC100136 | OX063 |
| NMR standards | |||
| 13C standard sample | Cambridge Isotope Laboratories | DLM-72A | 40% p-dioxane in benzene-D6 |
| 31P standard sample | Made in house | 105 mM ATP and 120 mM phenylphosphonic acid in D2O | |
| Software | |||
| Excel 2016 | Microsoft | ||
| MNova | Mestrelab Research |
Referências
- Aquaro, G. D., Menichetti, L. Hyperpolarized 13C-magnetic resonance spectroscopy: Are we ready for metabolic imaging. Circulation. Cardiovascular Imaging. 7 (6), 854-856 (2014).
- Schroeder, M. A., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB Journal. 23 (8), 2529-2538 (2009).
- Ardenkjaer-Larsen, J. H., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proceedings of the National Academy of Sciences of the United States of America. 100 (18), 10158-10163 (2003).
- Merritt, M. E., et al. Hyperpolarized C-13 allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proceedings of the National Academy of Sciences of the United States of America. 104 (50), 19773-19777 (2007).
- Ball, D. R., et al. Hyperpolarized butyrate: A metabolic probe of short chain fatty acid metabolism in the heart. Magn Reson Med. (5), 1663-1669 (2014).
- Khemtong, C., Carpenter, N. R., Lumata, L. L., et al. Hyperpolarized 13C NMR detects rapid drug-induced changes in cardiac metabolism. Magnetic Resonance in Medicine. 74 (2), 312-319 (2015).
- Mariotti, E., et al. Modeling non-linear kinetics of hyperpolarized [1-13C] pyruvate in the crystalloid-perfused rat heart. NMR in Biomedicine. 29 (4), 377-386 (2016).
- Moreno, K. X., Sabelhaus, S. M., Merritt, M. E., Sherry, A. D., Malloy, C. R. Competition of pyruvate with physiological substrates for oxidation by the heart: implications for studies with hyperpolarized [1-13C]pyruvate. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), H1556-H1564 (2010).
- Purmal, C., et al. Propionate stimulates pyruvate oxidation in the presence of acetate. American Journal of Physiology-Heart and Circulatory Physiology. 307 (8), H1134-H1141 (2014).
- Weiss, K., et al. Developing hyperpolarized 13C spectroscopy and imaging for metabolic studies in the isolated perfused rat heart. Applied Magnetic Resonance. 43 (1), 275-288 (2012).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia: NMR detection of hyperpolarized 13CO2and H13CO3. Magnetic Resonance in Medicine. 60 (5), 1029-1036 (2008).
- Schroeder, M. A., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovascular Research. 86 (1), 82-91 (2010).
- Ball, D. R., et al. Metabolic imaging of acute and chronic infarction in the perfused rat heart using hyperpolarised [1-13C]pyruvate. NMR in Biomedicine. 26 (11), 1441-1450 (2013).
- Atherton, H. J., et al. Role of PDH inhibition in the development of hypertrophy in the hyperthyroid rat heart: a combined magnetic resonance imaging and hyperpolarized magnetic resonance spectroscopy study. Circulation. 123 (22), 2552-2561 (2011).
- Harris, T., et al. Hyperpolarized product selective saturating-excitations for determination of changes in metabolic reaction rates in real-time. NMR in Biomedicine. 33 (2), e4189 (2020).
- Shaul, D., et al. Correlation between lactate dehydrogenase/pyruvate dehydrogenase activities ratio and tissue pH in the perfused mouse heart: A potential noninvasive indicator of cardiac pH provided by hyperpolarized magnetic resonance. NMR in Biomedicine. 34 (2), e4444 (2021).
- Jian, Z., et al. In vivo cannulation methods for cardiomyocytes isolation from heart disease models. PLoS One. 11 (8), e0160605 (2016).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacological Research. 41 (6), 613-627 (2000).
- Lateef, R., Al-Masri, A., Alyahya, A. Langendorff's isolated perfused rat heart technique: A review. International Journal of Basic and Clinical Pharmacology. 4, 1314-1322 (2015).
- Cross, H. R., Radda, G. K., Clarke, K. The role of Na+/K+ ATPase activity during low-flow ischemia in preventing myocardial injury - A 31P, 23Na and 87Rb NMR spectroscopic study. Magnetic Resonance in Medicine. 34 (5), 673-685 (1995).
- Cross, H. R., Clarke, K., Opie, L. H., Radda, G. K. Is lactate-induced myocardial ischaemic injury mediated by decreased pH or increased intracellular lactate. Journal of Molecular and Cellular Cardiology. 27 (7), 1369-1381 (1995).
- Clarke, K., O'Connor, A. J., Willis, R. J. Temporal relation between energy metabolism and myocardial function during ischemia and reperfusion. American Journal of Physiology. 253 (2), H412-H421 (1987).
- Yabe, T., Mitsunami, K., Inubushi, T., Kinoshita, M. Quantitative measurements of cardiac phosphorus metabolites in coronary artery disease by 31P magnetic resonance spectroscopy. Circulation. 92 (1), 15-23 (1995).
- Bakrania, B., Granger, J. P., Harmancey, R. Methods for the determination of rates of glucose and fatty acid oxidation in the isolated working rat heart. Journal of Visualized Experiments. (115), e54497 (2016).
- Cordeiro, B., Clements, R. Murine isolated heart model of myocardial stunning associated with cardioplegic arrest. Journal of Visualized Experiments. (102), e52433 (2015).
- Kolwicz, S. C., Tian, R. Assessment of cardiac function and energetics in isolated mouse hearts using 31P NMR spectroscopy. Journal of Visualized Experiments. (42), e2069 (2010).
- Nakadate, Y., et al. Glycemia and the cardioprotective effects of insulin pre-conditioning in the isolated rat heart. Cardiovascular Diabetology. 16 (1), 43 (2017).
- Lauritzen, M. H., et al. Enhancing the C-13 bicarbonate signal in cardiac hyperpolarized 1-C-13 pyruvate MRS studies by infusion of glucose, insulin and potassium. NMR in Biomedicine. 26 (11), 1496-1500 (2013).
- Adler-Levy, Y., et al. In-cell determination of lactate dehydrogenase activity in a luminal breast cancer model - ex vivo investigation of excised xenograft tumor slices using dDNP hyperpolarized [1-13C]pyruvate. Sensors. 19 (9), 2089 (2019).
- Young, A. A., Barnes, H., Davison, D., Neubauer, S., Schneider, J. E. Fast left ventricular mass and volume assessment in mice with three-dimensional guide-point modeling. Journal of Magnetic Resonance Imaging. 30 (3), 514-520 (2009).
- Bailey, I. A., Williams, S. R., Radda, G. K., Gadian, D. G. Activity of phosphorylase in total global ischaemia in the rat heart. A phosphorus-31 nuclear-magnetic-resonance study. Biochemical Journal. 196 (1), 171-178 (1981).
- Lutz, N. W., Le Fur, Y., Chiche, J., Pouyssegur, J., Cozzone, P. J. Quantitative in vivo characterization of intracellular and extracellular pH profiles in heterogeneous tumors: A novel method enabling multiparametric pH analysis. Cancer Research. 7 (15), 4616-4628 (2013).
- Harris, T., Gamliel, A., Sosna, J., Gomori, J. M., Katz-Brull, R. Impurities of [1-13C]pyruvic acid and a method to minimize their signals for hyperpolarized pyruvate metabolism studies. Applied Magnetic Resonance. 49 (10), 1085-1098 (2018).
- Cunningham, C. H., et al. Hyperpolarized 13C metabolic MRI of the human heart initial experience. Circulation Research. 119 (11), 1177-1182 (2016).
- Kurhanewicz, J., et al. Hyperpolarized 13C MRI: Path to clinical translation in oncology. Neoplasia. 21 (1), 1-16 (2019).
- Miloushev, V. Z., et al. Metabolic imaging of the human brain with hyperpolarized 13C pyruvate demonstrates 13C lactate production in brain tumor patients. Cancer Research. 78 (14), 3755-3760 (2018).
- Park, I., et al. Development of methods and feasibility of using hyperpolarized carbon-13 imaging data for evaluating brain metabolism in patient studies. Magnetic Resonance in Medicine. 80 (3), 864-873 (2018).
- Grist, J. T., et al. Quantifying normal human brain metabolism using hyperpolarized [1-13C]pyruvate and magnetic resonance imaging. Neuroimage. 189, 171-179 (2019).
- Nelson, S. J., et al. Metabolic imaging of patients with prostate cancer using hyperpolarized [1-C]pyruvate. Science Translational Medicine. 5 (198), (2013).
- Stødkilde-Jørgensen, H., et al. Pilot study experiences with hyperpolarized [1-13C]pyruvate MRI in pancreatic cancer patients. Journal of Magnetic Resonance Imaging. 51 (3), 961-963 (2019).
- Autry, A. W., et al. Measuring tumor metabolism in pediatric diffuse intrinsic pontine glioma using hyperpolarized carbon-13 MR metabolic imaging. Contrast Media and Molecular Imaging. 2018, 3215658 (2018).
- Chung, B. T., et al. First hyperpolarized [2-13C]pyruvate MR studies of human brain metabolism. Journal of Magnetic Resonance. 309, 106617 (2019).
- Rider, O. J., et al. Noninvasive in vivo assessment of cardiac metabolism in the healthy and diabetic human heart using hyperpolarized 13C MRI. Circulation Research. 126 (6), 725-736 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados