A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تعزيز استخراج النفط باستخدام مزيج من المواد الخافضة للتوتر السطحي الحيوي
In This Article
Summary
نوضح الطرق التي ينطوي عليها فحص وتحديد الميكروبات المنتجة للفاعل بالسطح الحيوي. كما يتم عرض طرق للتوصيف الكروماتوغرافي والتحديد الكيميائي للخافضات للتوتر السطحي الحيوي ، وتحديد التطبيق الصناعي للفاعل بالسطح الحيوي في تعزيز استخراج النفط المتبقي.
Abstract
المواد الخافضة للتوتر السطحي الحيوي هي مركبات نشطة على السطح قادرة على تقليل التوتر السطحي بين مرحلتين من الأقطاب المختلفة. وقد ظهرت المواد الخافضة للتوتر السطحي الحيوي كبدائل واعدة للمواد الكيميائية الخافضة للتوتر السطحي بسبب انخفاض السمية وارتفاع قابلية التحلل البيولوجي والتوافق البيئي والتسامح مع الظروف البيئية القاسية. هنا ، نوضح الطرق المستخدمة لفحص الميكروبات القادرة على إنتاج المواد الخافضة للتوتر السطحي الحيوي. تم تحديد الميكروبات المنتجة للفاعل بالسطح الحيوي باستخدام انهيار السقوط ، وانتشار النفط ، واختبارات مؤشر المستحلب. تم التحقق من صحة إنتاج الفاعل بالسطح الحيوي من خلال تحديد انخفاض التوتر السطحي للوسائط بسبب نمو الأعضاء الميكروبية. كما نصف الطرق التي ينطوي عليها توصيف وتحديد المواد الخافضة للتوتر السطحي الحيوي. تم إجراء كروماتوغرافيا الطبقة الرقيقة للفاعل بالسطح الحيوي المستخرج متبوعا بتلطيخ تفاضلي للألواح لتحديد طبيعة الفاعل بالسطح الحيوي. تم استخدام LCMS و 1H NMR و FT-IR لتحديد الفاعل بالسطح الحيوي كيميائيا. كما نوضح طرق تقييم تطبيق مزيج من المواد الخافضة للتوتر السطحي الحيوي المنتجة لتعزيز استخراج النفط المتبقي في عمود حزمة رملية محاكاة.
Introduction
المواد الخافضة للتوتر السطحي الحيوي هي الجزيئات الأمفيباثية النشطة على السطح التي تنتجها الكائنات الحية الدقيقة التي لديها القدرة على تقليل السطح والتوتر بين الوجوه بين مرحلتين1. يحتوي الفاعل بالسطح الحيوي النموذجي على جزء محب للماء يتكون عادة من مويتي السكر أو سلسلة الببتيد أو الأحماض الأمينية المحبة للماء وجزء مسعور يتكون من سلسلة أحماض دهنية مشبعة أو غير مشبعة2. نظرا لطبيعتها البرمائية ، تتجمع المواد الخافضة للتوتر السطحي الحيوي في الواجهة بين المرحلتين وتقلل من التوتر البيني عند الحدود ، مما يسهل تشتت مرحلة واحدة إلىالمرحلة الأخرى 1,3. تشمل الأنواع المختلفة من المواد الخافضة للتوتر السطحي الحيوي التي تم الإبلاغ عنها حتى الآن الجليكوليبيدات التي ترتبط فيها الكربوهيدرات بالأحماض الأليفاتية طويلة السلسلة أو الهيدروكسي الأليفاتيك عبر روابط الإستر (على سبيل المثال ، rhamnolipids و trehalolipids و sophorolipids) ، lipopeptides التي ترتبط فيها الدهون بسلاسل polypeptide (على سبيل المثال ، surfactin و lichenysin) ، والمواد الخافضة للتوتر السطحي الحيوي البوليمرية التي تتكون عادة من مجمعات بروتين السكريات (على سبيل المثال ، مستحلب ، ليبوسان ، ألاسان وليبومانان)4. أنواع أخرى من المواد الخافضة للتوتر السطحي الحيوي التي تنتجها الكائنات الحية الدقيقة تشمل الأحماض الدهنية والدهون الفوسفاتية والدهون المحايدة والجسيمات السطحية الحيوية5. الفئة الأكثر دراسة من المواد الخافضة للتوتر السطحي الحيوي هي glycolipids ومن بينها تم الإبلاغ عن معظم الدراسات على rhamnolipids6. تحتوي Rhamnolipids على واحد أو جزيئين من الرامنوز (الذي يشكل الجزء المحب للماء) مرتبط بواحد أو جزيئين من الأحماض الدهنية طويلة السلسلة (عادة حمض الهيدروكسي ديكانويك). Rhamnolipids هي جليكوليبيدات أولية تم الإبلاغ عنها أولا من Pseudomonas aeruginosa7.
تكتسب المواد الخافضة للتوتر السطحي الحيوي تركيزا متزايدا مقارنة بنظيراتها الكيميائية بسبب العديد من الخصائص الفريدة والمميزة التي تقدمها8. وتشمل هذه الخصائص أعلى ، وسمية أقل ، وتنوع أكبر ، وسهولة التحضير ، وقابلية أعلى للتحلل البيولوجي ، ورغوة أفضل ، والتوافق البيئي والنشاط في ظل الظروف القاسية9. التنوع الهيكلي للمواد الخافضة للتوتر السطحي الحيوي (الشكل S1) هو ميزة أخرى تمنحها ميزة على نظيراتها الكيميائية10. وهي عموما أكثر فعالية وكفاءة عند تركيزات أقل لأن تركيزها الحرج من الميسيلات (CMC) عادة ما يكون أقل بعدة مرات من المواد الكيميائية الخافضة للتوتر السطحي11. وقد أفيد بأنها مستقرة حراريا للغاية (تصل إلى 100 درجة مئوية) ويمكن أن تتحمل درجة حموضة أعلى (تصل إلى 9) وتركيزات ملح عالية (تصل إلى 50 جم / لتر)12 وبالتالي توفر العديد من المزايا في العمليات الصناعية ، والتي تتطلب التعرض للظروف القاسية13. التحلل البيولوجي وانخفاض السمية تجعلها مناسبة للتطبيقات البيئية مثل المعالجة الحيوية. بسبب المزايا التي تقدمها ، فقد تم الحصول على اهتمام متزايد في مختلف الصناعات مثل الصناعات الغذائية والزراعية والمنظفات ومستحضرات التجميل والبترولالصناعة 11. كما اكتسبت المواد الخافضة للتوتر السطحي الحيوي الكثير من الاهتمام في معالجة النفط لإزالة الملوثات النفطية والملوثات السامة14.
هنا نقوم بالإبلاغ عن إنتاج وتوصيف وتطبيق المواد الخافضة للتوتر السطحي الحيوي التي تنتجها Rhodococcus sp. IITD102 و Lysinibacillus sp. IITD104 و Paenibacillus sp. IITD108. ويوضح الشكل 1 الخطوات التي ينطوي عليها فحص وتوصيف وتطبيق مزيج من المواد الخافضة للتوتر السطحي الحيوي لتعزيز استخراج النفط.
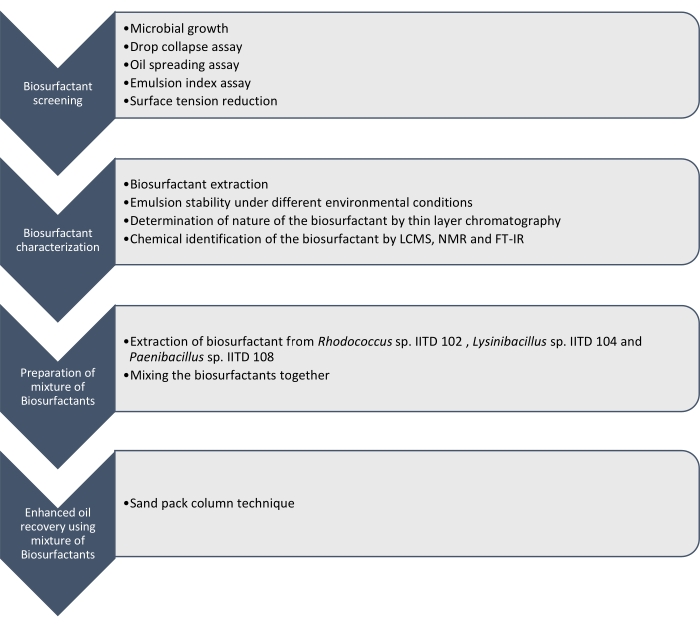
الشكل 1: طريقة لتعزيز استخراج النفط باستخدام مزيج من المواد الخافضة للتوتر السطحي الحيوي. يتم عرض تدفق العمل التدريجي. تم تنفيذ العمل في أربع خطوات. أولا ، تم استزراع السلالات الميكروبية وفحصها لإنتاج الفاعل بالسطح الحيوي بواسطة فحوصات مختلفة ، والتي شملت فحص انهيار السقوط ، وفحص انتشار الزيت ، وفحص مؤشر المستحلب ، وقياس التوتر السطحي. بعد ذلك ، تم استخراج المواد الخافضة للتوتر السطحي الحيوي من المرق الخالي من الخلايا وتم تحديد طبيعتها باستخدام كروماتوغرافيا الطبقة الرقيقة وتم تحديدها بشكل أكبر باستخدام LCMS و NMR و FT-IR. وفي الخطوة التالية، تم خلط المواد الخافضة للتوتر السطحي الحيوي المستخرجة معا وتم تحديد إمكانات الخليط الناتج لتعزيز استخراج الزيت باستخدام تقنية عمود حزمة الرمال. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تم فحص هذه السلالات الميكروبية لإنتاج المواد الخافضة للتوتر السطحي الحيوي عن طريق انهيار السقوط ، وانتشار الزيت ، وفحص مؤشر المستحلب وتحديد الحد من التوتر السطحي للوسط الخالي من الخلايا بسبب نمو الميكروبات. تم استخراج المواد الخافضة للتوتر السطحي الحيوي وتمييزها وتحديدها كيميائيا بواسطة LCMS و 1H NMR و FT-IR. وأخيرا ، تم إعداد خليط من المواد الخافضة للتوتر السطحي الحيوي التي تنتجها هذه الميكروبات وتم استخدامه لاستعادة الزيت المتبقي في عمود حزمة رملية محاكاة.
توضح هذه الدراسة فقط الأساليب المستخدمة في فحص وتحديد وتوصيف هيكلي وتطبيق مزيج الفاعل بالسطح الحيوي على تعزيز استخراج النفط المتبقي. وهو لا يوفر توصيفا وظيفيا مفصلا للمواد الخافضة للتوتر السطحي الحيوي التي تنتجها السلالات الميكروبية15,16. يتم إجراء تجارب مختلفة مثل تحديد الميسيل الحرج ، والتحليل الحراري الوزني ، وقابلية البلل السطحي ، والتحلل البيولوجي للتوصيف الوظيفي التفصيلي لأي خافض للتوتر السطحي الحيوي. ولكن بما أن هذه الورقة هي ورقة أساليب، فإن التركيز ينصب على الفحص، والتحديد، والتوصيف الهيكلي، وتطبيق مزيج الفاعل بالسطح الحيوي على تعزيز استخراج النفط المتبقي؛ لم يتم تضمين هذه التجارب في هذه الدراسة.
Protocol
1. نمو السلالات الميكروبية
- يزن 2 غرام من مسحوق مرق لوريا ويضاف إلى 50 مل من الماء المقطر في قارورة مخروطية 250 مل. امزج المحتويات حتى يذوب المسحوق تماما وقم بتكوين الحجم إلى 100 مل باستخدام الماء المقطر.
- وبالمثل ، قم بإعداد قارورتين أخريين من 100 مل من Luria Broth ووضع سدادات قطنية على عنق القوارير.
- قم بتغطية المقابس القطنية بورق الألومنيوم وقم بتعقيم القوارير لمدة 15 دقيقة عند 121 درجة مئوية و 15 رطل لكل بوصة مربعة لتعقيم الوسائط.
- بعد التعقيم ، دع الوسائط تبرد إلى درجة حرارة الغرفة.
- لإعداد الثقافة الأولية للسلالة ، اختر مستعمرة واحدة من صفيحة LA باستخدام حلقة التلقيح وقم بالتلقيح في أنبوب اختبار يحتوي على 5 مل من مرق لوريا المعقم.
- احتضن أنبوب الاختبار بين عشية وضحاها عند 30 درجة مئوية عند 180 دورة في الدقيقة.
- قم بتلقيح القوارير التي تحتوي على 100 مل من مرق لوريا المعقم عن طريق إضافة 1 مل من مزارع البذور المزروعة بين عشية وضحاها إلى القوارير داخل خزانة تدفق الهواء الرقائقي.
- احتضن القوارير في حاضنة دوارة عند 30 درجة مئوية و 180 دورة في الدقيقة لمدة 7 أيام.
- بعد الانتهاء من فترة الحضانة ، قم بحصاد القوارير ونقل مرق الثقافة إلى أنابيب الطرد المركزي. قم بالطرد المركزي للثقافة عند 4500 × g لمدة 20 دقيقة في جهاز طرد مركزي مبرد عند 4 درجات مئوية.
- بلطف ، صب supernatant خالية من الخلايا في كوب طازج واستخدامها في فحص الفحوصات لإنتاج الفاعل بالسطح الحيوي.
2. فحوصات الفحص لإنتاج الفاعل بالسطح الحيوي
ملاحظة: في الأقسام التالية، تم استخدام الفاعل بالسطح التجاري (Saponin) كعنصر تحكم إيجابي بينما تم استخدام الماء والوسائط غير الملقحة كعنصر تحكم سلبي.
- فحص انهيار الإسقاط
- خذ شريحة زجاجية نظيفة وقم بتغطية سطح الشريحة ب 200 ميكرولتر من الزيت.
- أضف 20 ميكرولتر من السوبرنات الخالي من الخلايا إلى وسط الزيت واتركه دون إزعاج لمدة 2-3 دقائق.
ملاحظة: إذا انهار الانخفاض ، فقم بتسجيل الإيجابيات الفائقة لوجود الفاعل بالسطح الحيوي.
- فحص انتشار النفط
- خذ 20 مل من الماء المقطر المزدوج في صفيحة بتري (قطرها 75 مم) وأضف 200 ميكرولتر من النفط الخام إلى سطح الماء.
- أضف 20 ميكرولتر من السوبرنات الخالي من الخلايا إلى وسط الزيت واتركه دون إزعاج لمدة 1 دقيقة.
ملاحظة: إذا تم تشكيل منطقة تطهير بسبب إزاحة النفط ، فقم بتسجيل إيجابية supernatant لوجود الفاعل بالسطح الحيوي.
- فحص مؤشر المستحلب (E24 فحص)
- أضف 4 مل من البنزين (البنزين) والسوبر نات الخالي من الخلايا إلى أنبوب اختبار زجاجي نظيف.
- دوامة الخليط بقوة لمدة 3 دقائق وتركه دون إزعاج لمدة 24 ساعة القادمة.
- بعد 24 ساعة، حدد مؤشر E24 كنسبة مئوية من ارتفاع الطبقة المستحلبة (سم) فيما يتعلق بارتفاع العمود السائل بأكمله (سم).
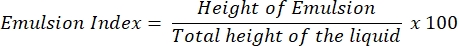
ملاحظة: إذا لوحظ مستحلب (زيت في الماء أو ماء في زيت) بعد 24 ساعة ، فمن المحتمل أن يحتوي supernatant على الفاعل بالسطح الحيوي.
- قياس التوتر السطحي
ملاحظة: تم قياس التوتر السطحي باستخدام طريقة حلقة دو نوي17. الأداة المستخدمة في هذه التجربة (انظر جدول المواد) حساسة للغاية ، لذلك تأكد من التنظيف السليم للوعاء الزجاجي والمسبار.- قم بتشغيل النظام وانقر نقرا مزدوجا فوق البرنامج المرتبط به لفتحه.
- نظف الوعاء الزجاجي بالسائل الذي سيتم تحديد توتره السطحي.
- أضف السائل (40 مل) إلى الوعاء وقم بتركيب الوعاء على حامل السفينة.
- افتح حامل المسبار وقم بتركيب المسبار عليه. الآن قم بقفل حامل المسبار عن طريق الضغط على زر القفل الموجود على وحدة التحكم اليدوية.
- باستخدام وحدة التحكم اليدوية ، اضبط ارتفاع المنصة بحيث يكون المسبار على بعد حوالي 2-3 مم من سطح السائل.
- الآن استخدم البرنامج لقياس التوتر السطحي. انقر فوق ملف موجود في اللوحة العلوية اليسرى من الشاشة. انقر فوق فتح مساحة العمل. ستظهر نافذة منبثقة.
- قم بالتمرير لأسفل وانقر نقرا مزدوجا فوق رمز التوتر السطحي والبيني K100: Surface and Interface .
- الآن ، انقر فوق رمز الملف الموجود في الزاوية العلوية اليسرى من الشاشة. انقر على قاعدة بيانات جديدة. أدخل الاسم لحفظ البيانات وانقر على موافق.
- مرة أخرى ، انقر فوق ملف > قياس جديد > SFT > Ring. أدخل اسم القياس. تأكد من أن قالب التكوين يعرض حلقة SFT.
- املأ التفاصيل في نافذة تكوين القياس عن طريق تحديد المسبار والوعاء المستخدم للقياس. أيضا ، املأ تفاصيل السائل ومرحلة الغاز.
ملاحظة: ستكون المرحلة السائلة هي الماء، في حين أن المرحلة الغازية ستكون الهواء. كثافة الطور السائل هي كثافة السوبرناتانت الحر الخلوي. يمكن تحديد ذلك عن طريق أخذ وزن 50 مل من السائل وحساب الكثافة ك كجم / م3. - الآن انقر فوق علامة التبويب الإجراء واملأ التفاصيل التالية: سرعة الكشف: 6 مم / دقيقة ، حساسية الكشف: 0.005 جم ، سرعة البحث: 6 مم / دقيقة ، حساسية البحث: 0.005 جم ، سرعة القياس: 3 مم / دقيقة ، حساسية القياس: 0.001 جم ، عمق الغمر: 3 مم ، مسافة العودة: 10٪ ، التصحيح: Harkins & Jordan ، القيم القصوى: 5. انقر فوق موافق.
- في النافذة المنبثقة ، حدد قاعدة البيانات لتخزين البيانات وانقر فوق موافق.
ملاحظة: يمكن للمرء إنشاء قاعدة بيانات جديدة هنا أو إضافة قياسات جديدة إلى البيانات الموجودة. - الآن انقر على زر التشغيل الموجود في أعلى وسط الشاشة. سيبدأ النظام في تنفيذ البرنامج النصي. بعد استقرار النظام ، سيكتشف السطح. اغمر المسبار في السائل ، وحرك المسبار ذهابا وإيابا واكتشف التوتر في الصفيحة المشكلة.
- للحصول على النتائج ، انقر فوق رمز القياس في الجانب الأوسط الأيسر من الشاشة. انقر على البيانات ولاحظ أسفل التوتر السطحي المحدد.
- بعد الانتهاء من القياس ، قم بخفض ارتفاع المنصة وفتح وإلغاء تثبيت المسبار والسفينة من الجهاز.
ملاحظة: لتحديد الانخفاض في التوتر السطحي بسبب إنتاج الفاعل بالسطح الحيوي ، يجب استخدام LB غير الملقح كعنصر تحكم.
3. استخراج الفاعل بالسطح الحيوي
- اضبط الرقم الهيدروجيني للسوبرناتانت الخالي من الخلايا إلى 2 باستخدام 2 N HCl. قم بتخزين الخليط عند 4 درجات مئوية بين عشية وضحاها.
- أضف كمية متساوية من خليط الكلوروفورم والميثانول (2: 1) إلى المادة الفائقة واخلطها بقوة لمدة 20 دقيقة.
- اترك الخليط دون إزعاج حتى يحدث فصل الطور.
- قم بإزالة المرحلة العليا التي تحتوي على الماء والميثانول واترك المرحلة السفلية التي تحتوي على الفاعل بالسطح الحيوي لتتبخر في غطاء الدخان.
- بعد تبخر المرحلة العضوية ، أعد إذابة الفاعل بالسطح الحيوي الخام بلون العسل في 3 مل من الكلوروفورم واستخدم هذا الخليط لمزيد من التحديد والتوصيف للفاعل بالسطح الحيوي.
4. دراسات استقرار المستحلب
-
استقرار المستحلب عند درجات حرارة مختلفة
- خذ 5 مل من المواد الفائقة الخالية من الخلايا في أنابيب اختبار مختلفة.
- أضف 5 مل من البنزين إلى كل أنبوب اختبار واخلطه بقوة عن طريق الدوامة لمدة 3 دقائق.
- احتضان أنابيب الاختبار بين عشية وضحاها في حمامات مائية مختلفة في درجات حرارة مختلفة (30 درجة مئوية و 40 درجة مئوية و 50 درجة مئوية و 60 درجة مئوية و 70 درجة مئوية).
- بعد 24 ساعة ، قم بتقدير مؤشرات المستحلب كما ذكرنا سابقا.
-
استقرار المستحلب عند قيم الأس الهيدروجيني المختلفة
- خذ 5 مل من supernatant خالية من الخلايا في أنابيب اختبار نظيفة.
- اضبط الرقم الهيدروجيني للسوبرناتات الخالية من الخلايا (2 و 4 و 6 و 8 و 10) باستخدام 1 N HCl و 1 N NaOH.
- أضف كمية متساوية من البنزين إلى أنابيب الاختبار واخلطها بقوة عن طريق الدوامة لمدة 3 دقائق.
- اترك أنابيب الاختبار دون إزعاج في درجة حرارة الغرفة لمدة 24 ساعة.
- تقدير مؤشر المستحلب كما ذكر سابقا.
-
استقرار المستحلب عند تركيزات الملح المختلفة
- خذ 5 مل من supernatant خالية من الخلايا في أنابيب اختبار نظيفة.
- أضف كميات مختلفة من الملح (كلوريد الصوديوم) إلى المواد الفائقة (0 جم / لتر ، 5 جم / لتر ، 10 جم / لتر ، 20 جم / لتر ، 60 جم / لتر و 80 جم / لتر).
- قم بإذابة الأملاح في السوبرناتات الخالية من الخلايا عن طريق الدوامة لمدة 3 دقائق.
- أضف كمية متساوية من البنزين إلى أنابيب الاختبار واخلطها بقوة عن طريق الدوامة لمدة 3 دقائق.
- اترك أنابيب الاختبار دون إزعاج في درجة حرارة الغرفة لمدة 24 ساعة.
- تقدير مؤشر المستحلب بعد 24 ساعة.
5. تحديد طبيعة الفاعل بالسطح الحيوي
-
TLC من الفاعل بالسطح الحيوي المستخرج
- بقعة 20 ميكرولتر من المواد الخافضة للتوتر السطحي الحيوي على لوحات TLC. بقعة 2 ميكرولتر في وقت واحد.
- حدد المواد الخافضة للتوتر السطحي الحيوي على ثلاث لوحات TLC مختلفة.
- تحضير خليط 100 مل من الشفاف الذي يحتوي على الكلوروفورم: الميثانول (2: 1) وإضافة العطر إلى غرفة TLC. أغلق غطاء الغرفة واتركه يشبع لمدة 20 دقيقة.
- بعد تجفيف الألواح ، ضع ألواح TLC داخل الغرفة المشبعة بخليط الميثانول الكلوروفورم وقم بتشغيل TLC.
- بعد أن يصل اللونت إلى الجزء العلوي من لوحة TLC (على بعد 1 سم من الأعلى) ، أخرج الألواح واتركها تجف في الهواء.
-
تلطيخ للكشف عن الدهون
- خذ غرفة TLC نظيفة وأضف بعض (5-10) حبيبات من اليود إلى الغرفة الطازجة وتشبع الغرفة لمدة 5 إلى 10 دقائق.
- ضع لوحة TLC داخل الغرفة وراقب تطور البقع الصفراء. إذا ظهرت البقع ، سجل الفاعل بالسطح الحيوي إيجابيا لوجود مكون الدهون.
-
تلطيخ للكشف عن الببتيد أو الأحماض الأمينية
- تحضير محلول النينهيدرين عن طريق إذابة 0.4 غرام من النينهيدرين في 20 مل من البيوتانول. أضف 0.6 مل من حمض الخليك الجليدي 100٪ إلى الخليط.
- رش لوحة TLC بمحلول النينهيدرين واتركها تجف في الهواء لمدة 2 دقيقة. تسخين اللوحة عند 110 درجة مئوية ومراقبة تطور اللون.
ملاحظة: إذا ظهرت البقع الزرقاء ، فقم بتسجيل الفاعل بالسطح الحيوي إيجابيا لوجود أي سلسلة ببتيد أو حمض أميني.
-
تلطيخ للكشف عن الكربوهيدرات
- تحضير محلول p-anisaldehyde عن طريق إضافة 2 مل من p-anisaldehyde إلى 48 مل من حمض الخليك الجليدي الذي يحتوي على 1 مل من H2SO4. أضف 0.6 مل من حمض الخليك إلى الخليط.
- رش الخليط بالتساوي على طبق TLC واتركه يجف في الهواء لمدة 2 دقيقة.
- احتضان اللوحة عند 110 درجة مئوية ومراقبة تطور البقع.
ملاحظة: إذا ظهرت البقع الخضراء أو البنية ، فقم بتسجيل الفاعل بالسطح الحيوي إيجابيا لوجود أي كربوهيدرات.
6. التحديد الكيميائي للفاعل بالسطح الحيوي
- LCMS من الفاعل بالسطح الحيوي
- يذوب 25 ملغ من الفاعل بالسطح الحيوي المستخرج في 1 مل من الكلوروفورم.
- قم بإجراء LCMS (في تكوين رذاذ القفل بتردد مسح مرجعي يبلغ 10 ثوان) باستخدام عمود C18.
- استخدم الكلوروفورم: الميثانول (1:1) كطور متحرك وحقن 2 ميكرولتر من العينة في العمود بمعدل تدفق 0.1 مل / دقيقة.
- اضبط المعلمات التجريبية على: القطبية: ES إيجابي ، الجهد الشعري: 3 كيلو فولت ، درجة حرارة المصدر: 80 درجة مئوية ، درجة حرارة الذوبان: 300 درجة مئوية ، معدل تدفق غاز الإذابة: 7000 لتر / ساعة ، ومعدل تدفق غاز الفخ: 0.40 مل / دقيقة.
- امسح النطاقات من 100 إلى 1200 Da خلال وقت اكتشاف مدته 20 دقيقة وامسح الأيونات في وضع ES الموجب.
- تحليل قيم m/z باستخدام أي برنامج لقياس الطيف الكتلي كميا.
- للتحليل، قم بتسجيل الدخول إلى البرنامج.
- انقر فوق البحث الدفعي وأدخل قائمة الجماهير التي تم الحصول عليها. امسح النتائج في وضع الشحنة الموجبة واستخدم M + H و M + Na كإضافات. حافظ على الدقة حتى 10 صفحات في الدقيقة وحدد بنية الشاشة.
- انقر فوق بحث ومن قائمة المركبات ، حدد المركب الذي يحتوي على أدنى مستوى PPM.
- 1 H NMR من الفاعل بالسطح الحيوي
ملاحظة: أجري الرنين المغناطيسي النووي H 1H للفاعل بالسطح الحيوي باستخدام مطياف الرنين المغناطيسي النووي 400 ميغاهرتز (انظر جدول المواد).- إذابة 5 ملغ من الفاعل بالسطح الحيوي في 1 مل من الكلوروفورم المثني (CdCl3).
- انقل الخليط إلى أنبوب الرنين المغناطيسي النووي. قم بتغطية الأنبوب بشكل صحيح وأدخل الأنبوب في مفتاح الربط. اضبط ارتفاع الأنبوب باستخدام أنبوب الضبط.
- ضع الأنبوب مع مفتاح الربط في جهاز الرنين المغناطيسي النووي واتبع الخطوات المذكورة أدناه للحصول على طيف الرنين المغناطيسي النووي.
- لتحديد نوع أنبوب العينة: sx N، حيث N هو الموضع الذي تم فيه وضع الأنبوب (على سبيل المثال، sx 13، إذا تم وضع الأنبوب فيالموضع 13) في البرامج المرتبطة به.
- اكتب edc واضغط على Enter لإنشاء مجلد جديد حيث يمكن تخزين البيانات.
- ستظهر نافذة منبثقة. حدد المذيب بالنقر فوق CdCl 3 في القائمة وأدخل اسم العينة.
- لبدء البروتوكول ، اكتب "getprosol" ؛ لقفل المذيب، اكتب "قفل cdcl3".
- اكتب "topshim" لمسح العينة ، وأخيرا اكتب "rga ؛ zgefp" للحصول على البيانات. سيؤدي ذلك إلى بدء تشغيل البروتوكول.
- بعد الحصول على الأطياف، اكتب "apk;abs n" واضغط على Enter لتصحيح الطور وخط الأساس.
- لتحديد القمم الأساسية، اكتب "pp" واضغط على Enter. لتحديد القمم المكثفة فقط، أدخل "mi" واكتب الكثافة التي يجب تحديد القمم فوقها. ستكون القيمة الافتراضية 0.2.
- لدمج القمم ، انقر فوق دمج وضع المؤشر على الجانب الأيسر من الذروة المراد دمجها وأثناء الضغط على المؤشر ، انقر واسحب المؤشر حول الذروة.
- احفظ البيانات بالنقر فوق ملف في الزاوية العلوية اليسرى ، ثم انقر فوق حفظ.
- يمكن إخراج العينة من الجهاز عن طريق كتابة "sx ej".
- تحليل القمم وتحديد بيئة ذرات H.
- فورييه تحويل التحليل الطيفي بالأشعة تحت الحمراء للفاعل بالسطح الحيوي
ملاحظة: تم إجراء FT-IR للفاعل بالسطح الحيوي المستخرج باستخدام مقياس الطيف الضوئي المتاح تجاريا في وضع ATR (انظر جدول المواد).- قم بتشغيل مقياس الطيف الضوئي وتحقق من التطهير والمجفف والكاشف.
- لجمع طيف ، قم أولا بجمع طيف الخلفية دون وجود عينة في مكانها.
- خذ الفاعل بالسطح الحيوي المستخرج وجففه تماما. ضع الفاعل بالسطح الحيوي المجفف مباشرة فوق كريستال الماس ، واضغط على نقطة اللمس ATR.
- في البرنامج ، حدد عدد عمليات الفحص (أدخل 30) وامسح الطيف من 400 سم - 1 إلى 4000 سم - 1.
- انقر فوق موافق لإضافة طيف العينة إلى النافذة الطيفية.
- انقر فوق الملفات > حفظ > حفظ باسم وأدخل اسم الملف متبوعا بامتبعا بالامتداد .spa وانقر فوق موافق.
7. تطبيق الفاعل بالسطح الحيوي (تعزيز استخراج النفط)
ملاحظة: في هذه التجربة ، تم استخدام الماء المقطر المزدوج كعنصر تحكم سلبي وتم استخدام 10٪ SDS و 10٪ Tween 80 و 10٪ saponin التجاري كعناصر تحكم إيجابية.
- خذ الزجاج وأغلق المخرج السفلي بالصوف الزجاجي والخرز الزجاجي.
- قم بتعبئة العمود بالتربة الرملية بطريقة يمكن من خلالها إضافة بعض السائل في الجزء العلوي من التربة ويمكن جمع التدفق من خلاله في الأسفل. قم بتركيب العمود على الحامل وأضف بعض الخرز الزجاجي فوق التربة.
- قم بإغراق العمود ب 50 مل من محلول ملحي وجمع التدفق لتحديد حجم المسام.
حجم المسام = حجم المحلول الملحي المضاف في الأعلى - حجم التدفق الذي تم جمعه. - قم بإزالة المحلول الملحي من العمود عن طريق إجبار النفط الخام على المرور عبره بعد إضافته من أعلى العمود. اجمع حجم المحلول الملحي والزيت الخارج من العمود لتحديد حجم تشبع الزيت الأولي. سيكون حجم المحلول الملحي المنبعث من العمود هو حجم تشبع الزيت الأولي أو الزيت الأصلي في مكانه.
- اترك العمود دون إزعاج لمدة 24 ساعة.
- بعد 24 ساعة ، قم بإغراق العمود ب 10 أحجام من المسام من المحلول الملحي وجمع الزيت الخارج من العمود لتقدير استخراج النفط الثانوي. النفط المتبقي في العمود بعد استرداد الزيت الثانوي يتوافق مع الزيت المتبقي.
- تحضير خليط من المواد الخافضة للتوتر السطحي الحيوي عن طريق إضافة كميات متساوية من الفاعل بالسطح الحيوي المستخرج (المستخرج بعد الخطوة 3.5) إلى الكأس الزجاجي. أضف المواد الخافضة للتوتر السطحي الحيوي إلى أعلى العمود واحتضن العمود لمدة 24 ساعة.
- بعد 24 ساعة، قم بقياس كمية الزيت والماء لتحديد استخلاص الزيت الإضافي أو المعزز. سوف يتوافق حجم النفط المنبعث من العمود مع النفط المتبقي المسترد.
- تقدير الاستخلاص المعزز للنفط بالمعادلة التالية:
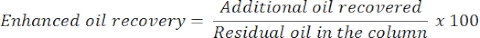
النتائج
تم فحص ثلاث سلالات بكتيرية (Rhodococcus sp. IITD102 ، Lysinibacillus sp. IITD104 ، و Paenibacillus sp. IITD108) لإنتاج المواد الخافضة للتوتر السطحي الحيوي بواسطة فحوصات مختلفة ، والتي شملت فحص انهيار السقوط ، وفحص إزاحة الزيت ، وفحص مؤشر المستحلب ، والحد من التوتر السطحي. أدت المواد الفائقة الخالية من الخلاي?...
Discussion
المواد الخافضة للتوتر السطحي الحيوي هي واحدة من المجموعة الأكثر تنوعا من المكونات النشطة بيولوجيا التي أصبحت بدائل جذابة للخافضات للتوتر السطحي الكيميائية. لديهم مجموعة واسعة من التطبيقات في العديد من الصناعات مثل المنظفات والدهانات ومستحضرات التجميل والمواد الغذائية والمستحضرات الص?...
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
ويود المؤلفان أن يشكرا إدارة التكنولوجيا الأحيائية في حكومة الهند على الدعم المالي.
Materials
| Name | Company | Catalog Number | Comments |
| 1 ml pipette | Eppendorf, Germany | G54412G | |
| 1H NMR | Bruker Avance AV-III type spectrometer,USA | ||
| 20 ul pipette | Thermo scientific, USA | H69820 | |
| Autoclave | JAISBO, India | Ser no 5923 | Jain Scientific |
| Blue flame burner | Rocker scientific, Taiwan | dragon 200 | |
| Butanol | GLR inovations, India | GLR09.022930 | |
| C18 column | Agilent Technologies, USA | 770995-902 | |
| Centrifuge | Eppendorf, Germany | 5810R | |
| Chloroform | Merck, India | 1.94506.2521 | |
| Chloroform-d | SRL, India | 57034 | |
| Falcon tubes | Tarsons, India | 546041 | Radiation sterilized polypropylene |
| FT-IR | Thermo Fisher Scientific, USA | Nicolet iS50 | |
| Fume hood | Khera, India | 47408 | Customied |
| glacial acetic acid | Merck, India | 1.93002 | |
| Glass beads | Merck, India | 104014 | |
| Glass slides | Polar industrial Corporation, USA | Blue Star | 75 mm * 25 mm |
| Glass wool | Merk, India | 104086 | |
| Hydrochloric acid | Merck, India | 1003170510 | |
| Incubator | Thermo Scientific, USA | MaxQ600 | Shaking incubator |
| Incubator | Khera, India | Sunbim | |
| Iodine resublimed | Merck, India | 231-442-4 | resublimed Granules |
| K12 –Kruss tensiometer | Kruss Scientific, Germany | K100 | |
| Laminar air flow cabnet | Thermo Scientific, China | 1300 Series A2 | |
| LCMS | Agilent Technologies, USA | 1260 Infinity II | |
| Luria Broth | HIMEDIA, India | M575-500G | Powder |
| Methanol | Merck, India | 107018 | |
| Ninhydrin | Titan Biotech Limited, India | 1608 | |
| p- anisaldehyde | Sigma, USA | 204-602-6 | |
| Petri plate | Tarsons, India | 460090-90 MM | Radiation sterilized polypropylene |
| Saponin | Merck, India | 232-462-6 | |
| Sodium chloride | Merck, India | 231-598-3 | |
| Test tubes | Borosil, India | 9800U06 | Glass tubes |
| TLC plates | Merck, India | 1055540007 | |
| Vortex | GeNei, India | 2006114318 | |
| Water Bath | Julabo, India | SW21C |
References
- Desai, J. D., Banat, I. M. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews. 61 (1), 47-64 (1997).
- Banat, I. M. Biosurfactants production and possible uses in microbial enhanced oil recovery and oil pollution remediation: a review. Bioresource Technology. 51 (1), 1-12 (1995).
- Singh, A., Van Hamme, J. D., Ward, O. P. Surfactants in microbiology and biotechnology: Part 2. Application aspects. Biotechnology Advances. 25 (1), 99-121 (2007).
- Shah, N., Nikam, R., Gaikwad, S., Sapre, V., Kaur, J. Biosurfactant: types, detection methods, importance and applications. Indian Journal of Microbiology Research. 3 (1), 5-10 (2016).
- McClements, D. J., Gumus, C. E. Natural emulsifiers-Biosurfactants, phospholipids, biopolymers, and colloidal particles: Molecular and physicochemical basis of functional performance. Advances in Colloid and Interface Science. 234, 3-26 (2016).
- Nguyen, T. T., Youssef, N. H., McInerney, M. J., Sabatini, D. A. Rhamnolipid biosurfactant mixtures for environmental remediation. Water Research. 42 (6-7), 1735-1743 (2008).
- Maier, R. M., Soberon-Chavez, G. Pseudomonas aeruginosa rhamnolipids: biosynthesis and potential applications. Applied Microbiology and Biotechnology. 54 (5), 625-633 (2000).
- Banat, I. M., Makkar, R. S., Cameotra, S. S. Potential commercial applications of microbial surfactants. Applied Microbiology and Biotechnology. 53 (5), 495-508 (2000).
- Mulugeta, K., Kamaraj, M., Tafesse, M., Aravind, J. A review on production, properties, and applications of microbial surfactants as a promising biomolecule for environmental applications. Strategies and Tools for Pollutant Mitigation: Avenues to a Cleaner Environment. , 3-28 (2021).
- Sharma, J., Sundar, D., Srivastava, P. Biosurfactants: Potential agents for controlling cellular communication, motility, and antagonism. Frontiers in Molecular Biosciences. 8, 727070 (2021).
- Vijayakumar, S., Saravanan, V. Biosurfactants-types, sources and applications. Research Journal of Microbiology. 10 (5), 181-192 (2015).
- Curiel-Maciel, N. F., et al. Characterization of enterobacter cloacae BAGM01 producing a thermostable and alkaline-tolerant rhamnolipid biosurfactant from the Gulf of Mexico. Marine Biotechnology. 23 (1), 106-126 (2021).
- Nikolova, C., Gutierrez, T. Biosurfactants and their applications in the oil and gas industry: current state of knowledge and future perspectives. Frontiers in Bioengineering and Biotechnology. 9, (2021).
- Rastogi, S., Tiwari, S., Ratna, S., Kumar, R. Utilization of agro-industrial waste for biosurfactant production under submerged fermentation and its synergistic application in biosorption of Pb2. Bioresource Technology Reports. 15, 100706 (2021).
- Zargar, A. N., Lymperatou, A., Skiadas, I., Kumar, M., Srivastava, P. Structural and functional characterization of a novel biosurfactant from Bacillus sp. IITD106. Journal of Hazardous Materials. 423, 127201 (2022).
- Adnan, M., et al. Functional and structural characterization of pediococcus pentosaceus-derived biosurfactant and its biomedical potential against bacterial adhesion, quorum sensing, and biofilm formation. Antibiotics. 10 (11), 1371 (2021).
- Du Nouy, P. L. A new apparatus for measuring surface tension. The Journal of General Physiology. 1 (5), 521-524 (1919).
- Akbari, S., Abdurahman, N. H., Yunus, R. M., Fayaz, F., Alara, O. R. Biosurfactants-a new frontier for social and environmental safety: a mini review. Biotechnology Research and Innovation. 2 (1), 81-90 (2018).
- Bicca, F. C., Fleck, L. C., Ayub, M. A. Z. Production of biosurfactant by hydrocarbon degrading Rhodococcus ruber and Rhodococcus erythropolis. Revista de Microbiologia. 30 (3), 231-236 (1999).
- Kuyukina, M. S., et al. Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction. Journal of Microbiological Methods. 46 (2), 149-156 (2001).
- Philp, J., et al. Alkanotrophic Rhodococcus ruber as a biosurfactant producer. Applied Microbiology and Biotechnology. 59 (2), 318-324 (2002).
- Mutalik, S. R., Vaidya, B. K., Joshi, R. M., Desai, K. M., Nene, S. N. Use of response surface optimization for the production of biosurfactant from Rhodococcus spp. MTCC 2574. Bioresource Technology. 99 (16), 7875-7880 (2008).
- Shavandi, M., Mohebali, G., Haddadi, A., Shakarami, H., Nuhi, A. Emulsification potential of a newly isolated biosurfactant-producing bacterium, Rhodococcus sp. strain TA6. Colloids and Surfaces B, Biointerfaces. 82 (2), 477-482 (2011).
- White, D., Hird, L., Ali, S. Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp., strain PML026. Journal of Applied Microbiology. 115 (3), 744-755 (2013).
- Najafi, A., et al. Interactive optimization of biosurfactant production by Paenibacillus alvei ARN63 isolated from an Iranian oil well. Colloids and Surfaces. B, Biointerfaces. 82 (1), 33-39 (2011).
- Bezza, F. A., Chirwa, E. M. N. Pyrene biodegradation enhancement potential of lipopeptide biosurfactant produced by Paenibacillus dendritiformis CN5 strain. Journal of Hazardous Materials. 321, 218-227 (2017).
- Jimoh, A. A., Lin, J. Biotechnological applications of Paenibacillus sp. D9 lipopeptide biosurfactant produced in low-cost substrates. Applied Biochemistry and Biotechnology. 191 (3), 921-941 (2020).
- Liang, T. -. W., et al. Exopolysaccharides and antimicrobial biosurfactants produced by Paenibacillus macerans TKU029. Applied Biochemistry and Biotechnology. 172 (2), 933-950 (2014).
- Mesbaiah, F. Z., et al. Preliminary characterization of biosurfactant produced by a PAH-degrading Paenibacillus sp. under thermophilic conditions. Environmental Science and Pollution Research. 23 (14), 14221-14230 (2016).
- Quinn, G. A., Maloy, A. P., McClean, S., Carney, B., Slater, J. W. Lipopeptide biosurfactants from Paenibacillus polymyxa inhibit single and mixed species biofilms. Biofouling. 28 (10), 1151-1166 (2012).
- Gudiña, E. J., et al. Novel bioemulsifier produced by a Paenibacillus strain isolated from crude oil. Microbial Cell Factories. 14 (1), 1-11 (2015).
- Pradhan, A. K., Pradhan, N., Sukla, L. B., Panda, P. K., Mishra, B. K. Inhibition of pathogenic bacterial biofilm by biosurfactant produced by Lysinibacillus fusiformis S9. Bioprocess and Biosystems Engineering. 37 (2), 139-149 (2014).
- Manchola, L., Dussán, J. Lysinibacillus sphaericus and Geobacillus sp biodegradation of petroleum hydrocarbons and biosurfactant production. Remediation Journal. 25 (1), 85-100 (2014).
- Bhardwaj, G., Cameotra, S. S., Chopra, H. K. Biosurfactant from Lysinibacillus chungkukjangi from rice bran oil sludge and potential applications. Journal of Surfactants and Detergents. 19 (5), 957-965 (2016).
- Gaur, V. K., et al. Rhamnolipid from a Lysinibacillus sphaericus strain IITR51 and its potential application for dissolution of hydrophobic pesticides. Bioresource Technology. 272, 19-25 (2019).
- Habib, S., et al. Production of lipopeptide biosurfactant by a hydrocarbon-degrading Antarctic Rhodococcus. International Journal of Molecular Sciences. 21 (17), 6138 (2020).
- Shao, P., Ma, H., Zhu, J., Qiu, Q. Impact of ionic strength on physicochemical stability of o/w emulsions stabilized by Ulva fasciata polysaccharide. Food Hydrocolloids. 69, 202-209 (2017).
- . Overview of DLVO theory Available from: https://archive-ouverte.unige.ch/unige:148595 (2014)
- Kazemzadeh, Y., Ismail, I., Rezvani, H., Sharifi, M., Riazi, M. Experimental investigation of stability of water in oil emulsions at reservoir conditions: Effect of ion type, ion concentration, and system pressure. Fuel. 243, 15-27 (2019).
- Chong, H., Li, Q. Microbial production of rhamnolipids: opportunities, challenges and strategies. Microbial Cell Factories. 16 (1), 1-12 (2017).
- Zeng, G., et al. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and Rhamnolipid, in liquid culture media and compost matrix. Biodegradation. 18 (3), 303-310 (2007).
- Liu, G., et al. Advances in applications of rhamnolipids biosurfactant in environmental remediation: a review. Biotechnology and Bioengineering. 115 (4), 796-814 (2018).
- John, W. C., Ogbonna, I. O., Gberikon, G. M., Iheukwumere, C. C. Evaluation of biosurfactant production potential of Lysinibacillus fusiformis MK559526 isolated from automobile-mechanic-workshop soil. Brazilian Journal of Microbiology. 52 (2), 663-674 (2021).
- Naing, K. W., et al. Isolation and characterization of an antimicrobial lipopeptide produced by Paenibacillus ehimensis MA2012. Journal of Basic Microbiology. 55 (7), 857-868 (2015).
- Wittgens, A., et al. Novel insights into biosynthesis and uptake of rhamnolipids and their precursors. Applied Microbiology and Biotechnology. 101 (7), 2865-2878 (2017).
- Rahman, K., Rahman, T. J., McClean, S., Marchant, R., Banat, I. M. Rhamnolipid biosurfactant production by strains of Pseudomonas aeruginosa using low-cost raw materials. Biotechnology Progress. 18 (6), 1277-1281 (2002).
- Bahia, F. M., et al. Rhamnolipids production from sucrose by engineered Saccharomyces cerevisiae. Scientific Reports. 8 (1), 1-10 (2018).
- Kim, C. H., et al. Desorption and solubilization of anthracene by a rhamnolipid biosurfactant from Rhodococcus fascians. Water Environment Research. 91 (8), 739-747 (2019).
- Nalini, S., Parthasarathi, R. Optimization of rhamnolipid biosurfactant production from Serratia rubidaea SNAU02 under solid-state fermentation and its biocontrol efficacy against Fusarium wilt of eggplant. Annals of Agrarian Science. 16 (2), 108-115 (2018).
- Wang, Q., et al. Engineering bacteria for production of rhamnolipid as an agent for enhanced oil recovery. Biotechnology and Bioengineering. 98 (4), 842-853 (2007).
- Câmara, J., Sousa, M., Neto, E. B., Oliveira, M. Application of rhamnolipid biosurfactant produced by Pseudomonas aeruginosa in microbial-enhanced oil recovery (MEOR). Journal of Petroleum Exploration and Production Technology. 9 (3), 2333-2341 (2019).
- Amani, H., Mehrnia, M. R., Sarrafzadeh, M. H., Haghighi, M., Soudi, M. R. Scale up and application of biosurfactant from Bacillus subtilis in enhanced oil recovery. Applied Biochemistry and Biotechnology. 162 (2), 510-523 (2010).
- Gudiña, E. J., et al. Bioconversion of agro-industrial by-products in rhamnolipids toward applications in enhanced oil recovery and bioremediation. Bioresource Technology. 177, 87-93 (2015).
- Sun, G., Hu, J., Wang, Z., Li, X., Wang, W. Dynamic investigation of microbial activity in microbial enhanced oil recovery (MEOR). Petroleum Science and Technology. 36 (16), 1265-1271 (2018).
- Jha, S. S., Joshi, S. J., SJ, G. Lipopeptide production by Bacillus subtilis R1 and its possible applications. Brazilian Journal of Microbiology. 47 (4), 955-964 (2016).
- Darvishi, P., Ayatollahi, S., Mowla, D., Niazi, A. Biosurfactant production under extreme environmental conditions by an efficient microbial consortium, ERCPPI-2. Colloids and Surfaces. B, Biointerfaces. 84 (2), 292-300 (2011).
- Al-Wahaibi, Y., et al. Biosurfactant production by Bacillus subtilis B30 and its application in enhancing oil recovery. Colloids and Surfaces. B, Biointerfaces. 114, 324-333 (2014).
- Moutinho, L. F., Moura, F. R., Silvestre, R. C., Romão-Dumaresq, A. S. Microbial biosurfactants: A broad analysis of properties, applications, biosynthesis, and techno-economical assessment of rhamnolipid production. Biotechnology Progress. 37 (2), 3093 (2021).
- Youssef, N., Simpson, D. R., McInerney, M. J., Duncan, K. E. In-situ lipopeptide biosurfactant production by Bacillus strains correlates with improved oil recovery in two oil wells approaching their economic limit of production. International Biodeterioration & Biodegradation. 81, 127-132 (2013).
- Ruckenstein, E., Nagarajan, R. Critical micelle concentration and the transition point for micellar size distribution. The Journal of Physical Chemistry. 85 (20), 3010-3014 (1981).
- de Araujo, L. L., et al. Microbial enhanced oil recovery using a biosurfactant produced by Bacillus safensis isolated from mangrove microbiota-Part I biosurfactant characterization and oil displacement test. Journal of Petroleum Science and Engineering. 180, 950-957 (2019).
- Banat, I. M., De Rienzo, M. A. D., Quinn, G. A. Microbial biofilms: biosurfactants as antibiofilm agents. Applied Microbiology and Biotechnology. 98 (24), 9915-9929 (2014).
- Klosowska-Chomiczewska, I., Medrzycka, K., Karpenko, E. Biosurfactants-biodegradability, toxicity, efficiency in comparison with synthetic surfactants. Research and Application of New Technologies in Wastewater Treatment and Municipal Solid Waste Disposal in Ukraine, Sweden, and Poland. 17, 141-149 (2013).
- Fernandes, P. A. V., et al. Antimicrobial activity of surfactants produced by Bacillus subtilis R14 against multidrug-resistant bacteria. Brazilian Journal of Microbiology. 38 (4), 704-709 (2007).
- Santos, D. K. F., Rufino, R. D., Luna, J. M., Santos, V. A., Sarubbo, L. A. Biosurfactants: multifunctional biomolecules of the 21st century. International Journal of Molecular Sciences. 17 (3), 401 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved