Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Biyosürfaktanların Kombinasyonu Kullanılarak Geliştirilmiş Yağ Geri Kazanımı
Bu Makalede
Özet
Biyosürfaktan üreten mikropların taranması ve tanımlanmasında yer alan yöntemleri gösteriyoruz. Biyosürfaktan maddelerin kromatografik karakterizasyonu ve kimyasal olarak tanımlanması, biyosürfaktan kalıntı yağ geri kazanımının arttırılmasında endüstriyel uygulanabilirliğinin belirlenmesi için yöntemler de sunulmaktadır.
Özet
Biyosürfaktanlar, farklı polaritelerin iki fazı arasındaki yüzey gerilimini azaltabilen yüzey aktif bileşiklerdir. Biyoyüzey aktif maddeler, daha az toksisite, yüksek biyolojik parçalanabilirlik, çevresel uyumluluk ve aşırı çevre koşullarına tolerans nedeniyle kimyasal yüzey aktif maddelere umut verici alternatifler olarak ortaya çıkmaktadır. Burada, biyosürfaktan üretebilen mikropların taranması için kullanılan yöntemleri gösteriyoruz. Biyosürfaktan üreten mikroplar, damla çökmesi, yağ yayılması ve emülsiyon indeksi testleri kullanılarak tanımlanmıştır. Biyosürfaktan üretimi, mikrobiyal üyelerin büyümesi nedeniyle ortamın yüzey gerilimindeki azalmanın belirlenmesiyle doğrulanmıştır. Ayrıca biyosürfaktanların karakterizasyonu ve tanımlanmasında yer alan yöntemleri de açıklıyoruz. Ekstrakte edilen biyosürfaktan ince tabaka kromatografisi ve ardından plakların diferansiyel boyanması biyosürfaktan doğasını belirlemek için yapıldı. LCMS, 1H NMR ve FT-IR, biyosürfaktan kimyasal olarak tanımlamak için kullanıldı. Ayrıca, simüle edilmiş bir kum paketi sütununda artık yağ geri kazanımını arttırmak için üretilen biyosürfaktan kombinasyonunun uygulanmasını değerlendirme yöntemlerini de gösteriyoruz.
Giriş
Biyosürfaktanlar, mikroorganizmalar tarafından üretilen ve yüzeyi ve iki faz arasındaki ara yüzey gerilimini azaltma kapasitesine sahip amfipatik yüzey aktif moleküllerdir1. Tipik bir biyosürfaktan genellikle bir şeker köstebeği veya bir peptit zinciri veya hidrofilik amino asitten oluşan hidrofilik bir kısım ve doymuş veya doymamış bir yağ asidi zincirinden oluşan hidrofobik bir kısım içerir2. Amfipatik doğaları nedeniyle, biyosürfaktanlar iki faz arasındaki arayüzde toplanır ve sınırdaki ara yüzey gerilimini azaltır, bu da bir fazın diğerine dağılmasını kolaylaştırır 1,3. Şimdiye kadar bildirilen çeşitli biyosürfaktan türleri arasında, karbonhidratların ester bağları (örneğin, rhamnolipidler, trehalolipidler ve soforolipidler) yoluyla uzun zincirli alifatik veya hidroksi-alifatik asitlere bağlandığı glikolipidler, lipitlerin polipeptit zincirlerine bağlandığı lipopeptitler (örneğin, yüzey aktif madde ve likenisin) ve genellikle polisakkarit-protein komplekslerinden oluşan polimerik biyosürfaktan maddeler (örneğin, emülsan, liposan, alasan ve lipomannan)4. Mikroorganizmalar tarafından üretilen diğer biyosürfaktan türleri arasında yağ asitleri, fosfolipitler, nötr lipitler ve partikül biyosürfaktanlarbulunur 5. En çok çalışılan biyosürfaktan sınıfı glikolipidlerdir ve bunların arasında çalışmaların çoğu rhamnolipidler üzerinde bildirilmiştir6. Rhamnolipidler, bir veya iki uzun zincirli yağ asidi molekülüne (genellikle hidroksi-dekanoik asit) bağlı bir veya iki ramnoz molekülü (hidrofilik kısmı oluşturan) içerir. Rhamnolipidler ilk olarak Pseudomonas aeruginosa7'den bildirilen primer glikolipidlerdir.
Biyosürfaktanlar, sundukları çeşitli benzersiz ve ayırt edici özellikler nedeniyle kimyasal muadillerine kıyasla artan bir odak noktası kazanmaktadır8. Bunlar arasında daha yüksek özgüllük, daha düşük toksisite, daha fazla çeşitlilik, hazırlama kolaylığı, daha yüksek biyolojik parçalanabilirlik, daha iyi köpüklenme, çevresel uyumluluk ve aşırı koşullar altında aktivite9 bulunur. Biyosürfaktan maddelerinin yapısal çeşitliliği (Şekil S1), onlara kimyasal muadillerine göre bir avantaj sağlayan bir başka avantajdır10. Kritik misel konsantrasyonları (CMC) genellikle kimyasal yüzey aktif maddelerden birkaç kat daha düşük olduğu için genellikle daha düşük konsantrasyonlarda daha etkili ve verimlidirler11. Yüksek oranda ısıl stabil oldukları (100 ° C'ye kadar) ve daha yüksek pH (9'a kadar) ve yüksek tuz konsantrasyonlarını (50 g / L'ye kadar) tolere edebildikleri bildirilmiştir12, böylece aşırı koşullara maruz kalmayı gerektiren endüstriyel proseslerde çeşitli avantajlar sunarlar13. Biyolojik olarak parçalanabilirlik ve daha düşük toksisite, onları biyoremediasyon gibi çevresel uygulamalar için uygun hale getirir. Sundukları avantajlar nedeniyle, gıda, tarım, deterjan, kozmetik ve petrol endüstrisi gibi çeşitli endüstrilerde artan ilgi görmektedirler11. Biyosürfaktanlar, petrol kirleticilerinin ve toksik kirleticilerin uzaklaştırılması için petrol ıslahında da çok dikkat çekmiştir14.
Burada Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 ve Paenibacillus sp. IITD108 tarafından üretilen biyosürfaktan maddelerinin üretimini, karakterizasyonunu ve uygulamasını sunuyoruz. Gelişmiş yağ geri kazanımı için biyosürfaktan bir kombinasyonunun taranması, karakterizasyonu ve uygulanmasında yer alan adımlar Şekil 1'de özetlenmiştir.
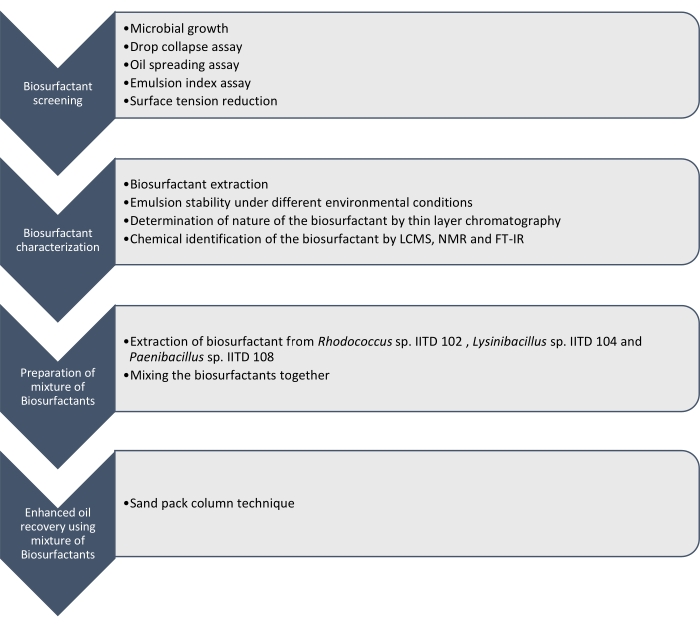
Şekil 1: Biyosürfaktanların bir kombinasyonunu kullanarak gelişmiş yağ geri kazanımı için bir yöntem. Kademeli iş akışı gösterilir. Çalışma dört adımda gerçekleştirildi. İlk önce mikrobiyal suşlar kültürlendi ve damla çökme testi, yağ yayılma testi, emülsiyon indeksi testi ve yüzey gerilimi ölçümünü içeren çeşitli tahlillerle biyosürfaktan üretimi için tarandı. Daha sonra, biyosürfaktanlar hücresiz et suyundan ekstrakte edildi ve doğaları ince tabaka kromatografisi kullanılarak tanımlandı ve LCMS, NMR ve FT-IR kullanılarak daha da tanımlandı. Bir sonraki adımda, ekstrakte edilen biyosürfaktan maddeler birlikte karıştırıldı ve elde edilen karışımın gelişmiş yağ geri kazanımı için potansiyeli, kum paketi kolon tekniği kullanılarak belirlendi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Biyosürfaktan üretmek için bu mikrobiyal suşların taranması, damla çökmesi, yağ yayılımı, emülsiyon indeksi testi ve mikropların büyümesi nedeniyle hücresiz ortamın yüzey geriliminde azalmanın belirlenmesi ile yapıldı. Biyosürfaktanlar LCMS, 1H NMR ve FT-IR ile ekstrakte edildi, karakterize edildi ve kimyasal olarak tanımlandı. Son olarak, bu mikroplar tarafından üretilen biyosürfaktan bir karışımı hazırlandı ve simüle edilmiş bir kum paketi sütununda kalan yağı geri kazanmak için kullanıldı.
Bu çalışma sadece biyosürfaktan kombinasyonunun taranması, tanımlanması, yapısal karakterizasyonu ve artık yağ geri kazanımının arttırılması üzerine uygulanmasında yer alan yöntemleri göstermektedir. Mikrobiyal suşlar tarafından üretilen biyosürfaktan maddelerinin ayrıntılı bir fonksiyonel karakterizasyonunu sağlamaz15,16. Herhangi bir biyosürfaktan ayrıntılı fonksiyonel karakterizasyonu için kritik misel tayini, termogravimetrik analiz, yüzey ıslanabilirliği ve biyolojik parçalanabilirlik gibi çeşitli deneyler gerçekleştirilir. Ancak bu makale bir yöntem makalesi olduğundan, odak noktası, artık yağ geri kazanımını arttırmak için biyosürfaktan kombinasyonunun taranması, tanımlanması, yapısal karakterizasyonu ve uygulanmasıdır; bu deneyler bu çalışmaya dahil edilmemiştir.
Protokol
1. Mikrobiyal suşların büyümesi
- 2 g Luria Suyu tozu tartın ve 250 mL'lik konik bir şişede 50 mL damıtılmış suya ekleyin. Toz tamamen çözünene kadar içeriği karıştırın ve damıtılmış su kullanarak hacmi 100 mL'ye kadar yükseltin.
- Benzer şekilde, 100 mL Luria Suyu'ndan iki şişe daha hazırlayın ve şişelerin boynuna pamuklu tapalar yerleştirin.
- Pamuklu tapaları alüminyum folyo ile örtün ve ortamı sterilize etmek için şişeleri 121 ° C'de 15 dakika ve 15 psi otoklav yapın.
- Otoklavlamadan sonra, ortamın oda sıcaklığına soğumasını bekleyin.
- Bir suşun birincil kültürünün hazırlanması için, bir aşılama döngüsü kullanarak bir LA plakasından tek bir koloni seçin ve 5 mL steril Luria suyu içeren bir test tüpünde aşılayın.
- Test tüpünü gece boyunca 30 ° C'de 180 rpm'de inkübe edin.
- 100 mL otoklavlanmış Luria Suyu içeren şişeleri, laminer hava akış kabini içindeki şişelere 1 mL gece yetiştirilen tohum kültürleri ekleyerek aşılayın.
- Şişeleri döner bir inkübatörde 7 gün boyunca 30 ° C ve 180 rpm'de inkübe edin.
- Kuluçka süresinin tamamlanmasından sonra, şişeleri hasat edin ve kültür suyunu santrifüj tüplerine aktarın. Kültürü 4 °C'de soğutulmuş bir santrifüjde 20 dakika boyunca 4.500 x g'de santrifüj yapın.
- Nazikçe, hücresiz süpernatantı taze bir beherin içine dökün ve biyosürfaktan üretimi için tarama testlerinde kullanın.
2. Biyosürfaktan üretimi için tarama tahlilleri
NOT: Aşağıdaki bölümlerde, pozitif kontrol olarak ticari yüzey aktif madde (Saponin) kullanılırken, negatif kontrol olarak su ve aşılanmamış ortam kullanılmıştır.
- Damla çökme testi
- Temiz bir cam slayt alın ve slaytın yüzeyini 200 μL yağ ile kaplayın.
- Yağın merkezine 20 μL hücresiz süpernatant ekleyin ve 2-3 dakika boyunca bozulmadan bırakın.
NOT: Damla çökerse, biyosürfaktan varlığı için süpernatantı pozitif olarak puanlayın.
- Yağ serpme testi
- Bir Petri plakasına (75 mm çapında) 20 mL çift damıtılmış su alın ve su yüzeyine 200 μL ham petrol ekleyin.
- Yağın merkezine 20 μL hücresiz süpernatant ekleyin ve 1 dakika boyunca bozulmadan bırakın.
NOT: Yağ yer değiştirmesi nedeniyle bir temizleme bölgesi oluşursa, biyosürfaktan varlığı için süpernatantı pozitif olarak puanlayın.
- Emülsiyon indeksi testi (E24 testi)
- Her biri temiz bir cam test tüpüne 4 mL benzin (benzin) ve hücresiz süpernatant ekleyin.
- Karışımı 3 dakika boyunca kuvvetlice vorteksleyin ve sonraki 24 saat boyunca bozulmadan bırakın.
- 24 saat sonra, E24 indeksini, tüm sıvı sütunun (cm) yüksekliğine göre emülsifiye tabakanın (cm) yüksekliğinin bir yüzdesi olarak belirleyin.
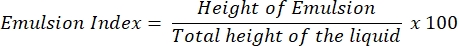
NOT: 24 saat sonra bir emülsiyon (sudaki yağ veya yağdaki su) gözlenirse, süpernatantın biyosürfaktan içermesi muhtemeldir.
- Yüzey gerilimi ölçümü
NOT: Yüzey gerilimi Du Noüy halka yöntemi17 kullanılarak ölçülmüştür. Bu deneyde kullanılan alet ( bakınız Malzeme Tablosu) çok hassastır, bu nedenle cam kabın ve probun uygun şekilde temizlenmesini sağlayın.- Sistemi açın ve açmak için ilgili yazılıma çift tıklayın.
- Cam kabı, yüzey gerilimi belirlenecek sıvı ile temizleyin.
- Sıvıyı (40 mL) kaba ekleyin ve kabı kap tutucusuna monte edin.
- Prob tutucusunun kilidini açın ve probu üzerine monte edin. Şimdi manuel kontrol cihazındaki Kilitle düğmesine basarak prob tutucuyu kilitleyin .
- Manuel kontrolörü kullanarak, platformun yüksekliğini, probun sıvı yüzeyinden yaklaşık 2-3 mm uzakta olacak şekilde ayarlayın.
- Şimdi yüzey gerilimini ölçmek için yazılımı kullanın. Ekranın sol üst panelinde bulunan Dosya'ya tıklayın. Çalışma Alanını Aç'a tıklayın. Bir açılır pencere görünecektir.
- Aşağı kaydırın ve K100: Yüzey ve Ara Yüz Gerilimi simgesine çift tıklayın.
- Şimdi, ekranın sol üst köşesinde bulunan Dosya simgesine tıklayın. Yeni Veritabanı'na tıklayın. Verileri kaydetmek için adı girin ve Tamam'a tıklayın.
- Yine, SFT > Ring> Yeni Ölçüm > Dosya'ya tıklayın. Ölçümün adını girin. Yapılandırma şablonunun SFT halkasını gösterdiğinden emin olun.
- Probu ve ölçüm için kullanılan kabı seçerek Ölçüm Yapılandırması penceresindeki ayrıntıları doldurun. Ayrıca, sıvı ve gaz fazının ayrıntılarını doldurun.
NOT: Sıvı faz su, gaz fazı ise hava olacaktır. Sıvı fazın yoğunluğu, hücresiz süpernatanın yoğunluğudur. Bu, sıvının 50 mL'lik ağırlığının alınması ve yoğunluğun Kg/m3 olarak hesaplanmasıyla belirlenebilir. - Şimdi Prosedür sekmesine tıklayın ve aşağıdaki ayrıntıları doldurun: Algılama Hızı: 6 mm / dak, Algılama Hassasiyeti: 0,005 g, Arama Hızı: 6 mm / dak, Arama Hassasiyeti: 0,005 g, Ölçüm Hızı: 3 mm / dak, Ölçüm Hassasiyeti: 0,001 g, Daldırma Derinliği: 3 mm, Geri Dönüş Mesafesi: % 10, düzeltme: Harkins & Jordan, maksimum değerler: 5. Tamam'a tıklayın.
- Açılır pencerede, verilerin depolanacağı veritabanını seçin ve Tamam'a tıklayın.
NOT: Burada yeni bir veritabanı oluşturulabilir veya mevcut verilere yeni ölçümler eklenebilir. - Şimdi ekranın üst ortasında bulunan Oynat düğmesine tıklayın. Sistem komut dosyasını yürütmeye başlayacaktır. Sistem stabilize olduktan sonra, yüzeyi algılar. Probu sıvıya batırın, probu ileri geri hareket ettirin ve oluşan lameldeki gerginliği tespit edin.
- Sonuçları elde etmek için ekranın sol orta tarafındaki Ölçüm simgesine tıklayın. Veri'ye tıklayın ve belirlenen yüzey gerilimini not edin.
- Ölçümün tamamlanmasından sonra, platformun yüksekliğini düşürün ve probun ve kabın kilidini açın ve aletten çıkarın.
NOT: Biyosürfaktan üretimi nedeniyle yüzey gerilimindeki azalmayı belirlemek için, kontrol olarak aşılanmamış LB kullanılmalıdır.
3. Biyosürfaktan ekstraksiyonu
- Hücresiz süpernatantın pH'ını 2 N HCl kullanarak 2'ye ayarlayın. karışımı gece boyunca 4 ° C'de saklayın.
- Süpernatanta eşit miktarda kloroform-metanol karışımı (2: 1) ekleyin ve 20 dakika boyunca kuvvetlice karıştırın.
- Faz ayrımının gerçekleşmesi için karışımı rahatsız etmeden bırakın.
- Su ve metanol içeren üst fazı çıkarın ve biyosürfaktan içeren alt fazı bir duman davlumbazında buharlaşmaya bırakın.
- Organik fazın buharlaştırılmasından sonra, bal rengindeki ham biyosürfaktan 3 mL kloroform içinde yeniden çözün ve bu karışımı biyosürfaktan daha fazla tanımlanması ve karakterizasyonu için kullanın.
4. Emülsiyon stabilite çalışmaları
-
Farklı sıcaklıklarda emülsiyon kararlılığı
- Farklı test tüplerinde 5 mL hücresiz süpernatant alın.
- Her test tüpüne 5 mL benzin ekleyin ve 3 dakika boyunca vorteksleme yaparak kuvvetlice karıştırın.
- Test tüplerini farklı su banyolarında farklı sıcaklıklarda (30 ° C, 40 ° C, 50 ° C, 60 ° C ve 70 ° C) gece boyunca inkübe edin.
- 24 saat sonra, daha önce de belirtildiği gibi emülsiyon endekslerini tahmin edin.
-
Farklı pH değerlerinde emülsiyon kararlılığı
- Temiz test tüplerinde hücresiz süpernatantın 5 mL'sini alın.
- 1 N HCl ve 1 N NaOH kullanarak hücresiz süpernatantların (2, 4, 6, 8 ve 10) pH'ını ayarlayın.
- Test tüplerine eşit miktarda benzin ekleyin ve 3 dakika boyunca vorteksleme yaparak kuvvetlice karıştırın.
- Test tüplerini oda sıcaklığında 24 saat boyunca rahatsız edilmeden bırakın.
- Emülsiyon indeksini daha önce de belirtildiği gibi tahmin edin.
-
Farklı tuz konsantrasyonlarında emülsiyon kararlılığı
- Temiz test tüplerinde hücresiz süpernatantın 5 mL'sini alın.
- Süpernatantlara farklı miktarlarda tuz (NaCl) ekleyin (0 g / L, 5 g / L, 10 g / L, 20 g / L, 60 g / L ve 80 g / L).
- Tuzları hücresiz süpernatantlarda 3 dakika boyunca vorteks yaparak çözün.
- Test tüplerine eşit miktarda benzin ekleyin ve 3 dakika boyunca vorteksleme yaparak kuvvetlice karıştırın.
- Test tüplerini oda sıcaklığında 24 saat boyunca rahatsız edilmeden bırakın.
- Emülsiyon indeksini 24 saat sonra tahmin edin.
5. Biyosürfaktan niteliğinin belirlenmesi
-
Ekstrakte edilen biyosürfaktan TLC'si
- TLC plakalarındaki biyosürfaktan maddelerin 20 μL'sini tespit edin. Bir seferde 2 μL nokta.
- Biyosürfaktanları üç farklı TLC plakasında tespit edin.
- Kloroform:metanol (2:1) içeren elüentin 100 mL'lik bir karışımını hazırlayın ve elüenti TLC odasına ekleyin. Odanın kapağını kapatın ve 20 dakika doygunluğa ulaşmasına izin verin.
- Plakaları kuruttuktan sonra, TLC plakalarını kloroform metanol karışımı ile doyurulmuş odanın içine yerleştirin ve TLC'yi çalıştırın.
- Eluent TLC plakasının tepesine ulaştıktan sonra (üstten 1 cm uzakta), plakaları çıkarın ve havayla kurumasını bekleyin.
-
Lipid tespiti için boyama
- Temiz bir TLC haznesi alın ve taze odaya biraz (5-10) granül iyot ekleyin ve odayı 5 ila 10 dakika doyurun.
- TLC plakasını haznenin içine yerleştirin ve sarı lekelerin gelişimini gözlemleyin. Lekeler ortaya çıkarsa, lipit bileşeninin varlığı için biyosürfaktan pozitif puan alın.
-
Peptit veya amino asit tespiti için boyama
- 20 mL bütanol içinde 0.4 g ninhidrin çözerek bir ninhidrin çözeltisi hazırlayın. Karışıma 0,6 mL% 100 buzul asetik asit ekleyin.
- TLC plakasına ninhidrin çözeltisi püskürtün ve 2 dakika boyunca havayla kurumasını bekleyin. Plakayı 110 ° C'de ısıtın ve rengin gelişimini gözlemleyin.
NOT: Mavi lekeler belirirse, herhangi bir peptit zincirinin veya amino asidin varlığı için biyosürfaktan pozitif puan alın.
-
Karbonhidrat tespiti için boyama
- 1 mL H2SO 4 içeren 48 mL buzul asetik asidine 2 mL p-anisaldehit ekleyerekbirp-anisaldehit çözeltisi hazırlayın. Karışıma 0.6 mL asetik asit ekleyin.
- Karışımı bir TLC plakasına eşit şekilde püskürtün ve 2 dakika boyunca havada kurumasını bekleyin.
- Plakayı 110 ° C'de inkübe edin ve lekelerin gelişimini izleyin.
NOT: Yeşil veya kahverengi lekeler ortaya çıkarsa, biyosürfaktan herhangi bir karbonhidratın varlığı için pozitif puan alın.
6. Biyosürfaktan kimyasal olarak tanımlanması
- Biyosürfaktan LCMS
- Ekstrakte edilen biyosürfaktan 25 mg'ı 1 mL kloroform içinde çözün.
- Bir C18 sütunu kullanarak LCMS (referans tarama frekansı 10 sn olan bir kilit sprey konfigürasyonunda) gerçekleştirin.
- Kloroform kullanın: metanol (1: 1) mobil bir faz olarak ve numunenin 2 μL'sini kolona 0.1 mL / dak akış hızında enjekte edin.
- Deneysel parametreleri şu şekilde ayarlayın: polarite: ES pozitif, kılcal gerilim: 3 kV, kaynak sıcaklığı: 80 °C, çözünme sıcaklığı: 300 °C, çözünme gazı akış hızı: 7.000 L/s ve tuzak gaz akış hızı: 0,40 mL/dak.
- 20 dakikalık bir algılama süresi boyunca 100 ila 1.200 Da arasındaki aralıkları tarayın ve iyonları pozitif ES modunda inceleyin.
- Herhangi bir kütle spektrometresi nicel yazılımı kullanarak m / z değerlerini analiz edin.
- Analiz için yazılıma giriş yapın.
- Toplu Arama'ya tıklayın ve elde edilen kütlelerin listesini girin. Sonuçları pozitif şarj modunda araştırın ve katkı olarak M + H ve M + Na kullanın. Doğruluğu 10 PPM'ye kadar koruyun ve Ekran Yapısı'nı işaretleyin.
- Ara'ya tıklayın ve bileşikler listesinden en düşük PPM seviyesine sahip olanı seçin.
- 1 adet Biyosürfaktan H NMR
NOT: Biyosürfaktan 1H NMR, 400 MHz NMR spektrometresi kullanılarak gerçekleştirilmiştir (bkz.- 5 mg biyosürfaktan 1 mL deuterated kloroform (CdCl3) içinde çözün.
- Karışımı bir NMR tüpüne aktarın. Tüpü düzgün bir şekilde kapatın ve tüpü anahtara yerleştirin. Ayarlayıcı tüpü kullanarak tüpün yüksekliğini ayarlayın.
- Tüpü anahtarla birlikte NMR makinesine yerleştirin ve bir NMR spektrumu elde etmek için aşağıda belirtilen adımları izleyin.
- Numune tüpü tipini seçmek için: sx N, burada N, ilgili yazılımda tüpün yerleştirildiği konumdur (örneğin, tüp 13. konuma yerleştirilmişse sx 13).
- Verilerin depolanabileceği yeni bir klasör oluşturmak için edc yazın ve Enter tuşuna basın.
- Bir açılır pencere görünecektir. Listede CdCl 3'e tıklayarak çözücüyü seçin ve numunenin adını girin.
- Protokolü başlatmak için "getprosol" yazın; çözücüyü kilitlemek için "cdcl3'ü kilitle" yazın.
- Örneği şime etmek için "topshim" yazın ve son olarak verileri almak için "rga;zgefp" yazın. Bu, protokolü başlatacaktır.
- Spektrumlar elde edildikten sonra, "apk;abs n" yazın ve faz ve taban çizgisi düzeltmesi için enter tuşuna basın.
- Birincil tepe noktalarını seçmek için "pp" yazın ve Enter tuşuna basın. Yalnızca yoğun zirveleri seçmek için "mi" girin ve zirvelerin seçilmesi gereken yoğunluğu yazın. Varsayılan değer 0,2 olacaktır.
- Tepe noktalarını entegre etmek için, Entegre Et'e tıklayın ve imleci entegre edilecek tepenin sol tarafına yerleştirin ve imleci basılı tutarken imleci tıklayın ve tepenin etrafına sürükleyin.
- Sol üst köşedeki Dosya'ya ve ardından Kaydet'e tıklayarak verileri kaydedin.
- Numune "sx ej" yazılarak makineden çıkarılabilir.
- Zirveleri analiz edin ve H atomlarının ortamını belirleyin.
- Fourier Dönüşümü Biyosürfaktan Kızılötesi Spektroskopisi
NOT: Ekstrakte edilen biyosürfaktan FT-IR, ATR modunda ticari olarak temin edilebilen bir spektrofotometre kullanılarak gerçekleştirilmiştir (bkz.- Spektrofotometreyi açın ve temizlemeyi, kurutucuyu ve dedektörü kontrol edin.
- Bir spektrum toplamak için, önce bir örnek olmadan arka plan spektrumunu toplayın.
- Ekstrakte edilen biyosürfaktan alın ve tamamen kurutun. Kurutulmuş biyosürfaktan doğrudan elmas kristalinin üzerine yerleştirin, basınç uygulayın ve ATR temas noktasına basın.
- Yazılımda, tarama sayısını seçin (30 girin) ve spektrumu 400 cm-1 ila 4.000 cm-1 arasında tarayın.
- Örnek spektrumu spektral pencereye eklemek için Tamam'a tıklayın.
- Dosyalar > Kaydet > Farklı Kaydet'e tıklayın ve dosya adını ve ardından .spa uzantısını girin ve Tamam'a tıklayın.
7. Biyosürfaktan uygulaması (gelişmiş yağ geri kazanımı)
NOT: Bu deneyde negatif kontrol olarak çift damıtılmış su, pozitif kontrol olarak %10 SDS, %10 Tween 80 ve %10 ticari saponin kullanılmıştır.
- Camı alın ve alt çıkışı cam yünü ve cam boncuklarla kapatın.
- Kolonu kumlu toprakla, toprağın üstüne bir miktar sıvı eklenebilecek ve içinden geçen akış altta toplanabilecek şekilde paketleyin. Kolonu tutucuya monte edin ve toprağın üstüne biraz cam boncuk ekleyin.
- Kolonu 50 mL tuzlu su çözeltisi ile doldurun ve gözenek hacmini belirlemek için akışı toplayın.
gözenek hacmi = üstüne eklenen tuzlu su hacmi - toplanan akış hacmi. - Kolonun üstünden ekledikten sonra ham petrolü içinden geçmeye zorlayarak tuzlu suyu kolondan çıkarın. İlk yağ doygunluk hacmini belirlemek için kolondan çıkan tuzlu su ve yağın hacmini toplayın. Kolondan salınan tuzlu suyun hacmi, ilk yağ doygunluğu hacmi veya yerinde orijinal yağ olacaktır.
- Sütunu 24 saat boyunca rahatsız edilmeden bırakın.
- 24 saat sonra, sütunu 10 gözenek hacmi tuzlu suyla doldurun ve ikincil yağ geri kazanımını tahmin etmek için sütundan çıkan yağı toplayın. İkincil yağ geri kazanımından sonra kolonda kalan yağ, artık yağa karşılık gelir.
- Cam beherine ekstrakte edilen biyosürfaktan (adım 3.5'ten sonra ekstrakte edilen) eşit hacimlerde ekleyerek bir biyosürfaktan karışımı hazırlayın. Biyosürfaktanları sütunun üstüne ekleyin ve sütunu 24 saat boyunca inkübe edin.
- 24 saat sonra, ek veya gelişmiş yağ geri kazanımını belirlemek için yağ ve su miktarını ölçün. Kolondan salınan yağın hacmi, geri kazanılan artık yağa karşılık gelecektir.
- Aşağıdaki denklemle gelişmiş yağ geri kazanımını tahmin edin:
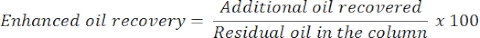
Sonuçlar
Üç bakteri suşu (Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 ve Paenibacillus sp. IITD108), düşme çökme testi, yağ yer değiştirme testi, emülsiyon indeksi testi ve yüzey gerilimi azaltmayı içeren çeşitli tahlillerle biyosürfaktan üretimi için taranmıştır. Her üç bakteri suşunun hücresiz süpernatantları ve bir kimyasal yüzey aktif madde çözeltisi bir damla çöküşe neden oldu ve bu nedenle biyosürfaktanların varlığı için pozitif puan aldı (
Tartışmalar
Biyoyüzey aktif maddeler, kimyasal yüzey aktif maddelere cazip alternatifler haline gelen biyolojik olarak aktif bileşenlerin en çok yönlü gruplarından biridir. Daha iyi ıslanabilirlikleri, düşük CMC'leri, çeşitlendirilmiş yapıları ve çevre dostu olmaları nedeniyle deterjan, boya, kozmetik, gıda, ilaç, tarım, petrol ve su arıtma gibi çok sayıda endüstride geniş bir uygulama alanına sahiptirler18. Bu, biyosürfaktan üretimi yapabilen daha fazla mikrobiyal suşun keşfedi...
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Yazarlar, finansal destek için Hindistan Hükümeti Biyoteknoloji Bakanlığı'na teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 ml pipette | Eppendorf, Germany | G54412G | |
| 1H NMR | Bruker Avance AV-III type spectrometer,USA | ||
| 20 ul pipette | Thermo scientific, USA | H69820 | |
| Autoclave | JAISBO, India | Ser no 5923 | Jain Scientific |
| Blue flame burner | Rocker scientific, Taiwan | dragon 200 | |
| Butanol | GLR inovations, India | GLR09.022930 | |
| C18 column | Agilent Technologies, USA | 770995-902 | |
| Centrifuge | Eppendorf, Germany | 5810R | |
| Chloroform | Merck, India | 1.94506.2521 | |
| Chloroform-d | SRL, India | 57034 | |
| Falcon tubes | Tarsons, India | 546041 | Radiation sterilized polypropylene |
| FT-IR | Thermo Fisher Scientific, USA | Nicolet iS50 | |
| Fume hood | Khera, India | 47408 | Customied |
| glacial acetic acid | Merck, India | 1.93002 | |
| Glass beads | Merck, India | 104014 | |
| Glass slides | Polar industrial Corporation, USA | Blue Star | 75 mm * 25 mm |
| Glass wool | Merk, India | 104086 | |
| Hydrochloric acid | Merck, India | 1003170510 | |
| Incubator | Thermo Scientific, USA | MaxQ600 | Shaking incubator |
| Incubator | Khera, India | Sunbim | |
| Iodine resublimed | Merck, India | 231-442-4 | resublimed Granules |
| K12 –Kruss tensiometer | Kruss Scientific, Germany | K100 | |
| Laminar air flow cabnet | Thermo Scientific, China | 1300 Series A2 | |
| LCMS | Agilent Technologies, USA | 1260 Infinity II | |
| Luria Broth | HIMEDIA, India | M575-500G | Powder |
| Methanol | Merck, India | 107018 | |
| Ninhydrin | Titan Biotech Limited, India | 1608 | |
| p- anisaldehyde | Sigma, USA | 204-602-6 | |
| Petri plate | Tarsons, India | 460090-90 MM | Radiation sterilized polypropylene |
| Saponin | Merck, India | 232-462-6 | |
| Sodium chloride | Merck, India | 231-598-3 | |
| Test tubes | Borosil, India | 9800U06 | Glass tubes |
| TLC plates | Merck, India | 1055540007 | |
| Vortex | GeNei, India | 2006114318 | |
| Water Bath | Julabo, India | SW21C |
Referanslar
- Desai, J. D., Banat, I. M. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews. 61 (1), 47-64 (1997).
- Banat, I. M. Biosurfactants production and possible uses in microbial enhanced oil recovery and oil pollution remediation: a review. Bioresource Technology. 51 (1), 1-12 (1995).
- Singh, A., Van Hamme, J. D., Ward, O. P. Surfactants in microbiology and biotechnology: Part 2. Application aspects. Biotechnology Advances. 25 (1), 99-121 (2007).
- Shah, N., Nikam, R., Gaikwad, S., Sapre, V., Kaur, J. Biosurfactant: types, detection methods, importance and applications. Indian Journal of Microbiology Research. 3 (1), 5-10 (2016).
- McClements, D. J., Gumus, C. E. Natural emulsifiers-Biosurfactants, phospholipids, biopolymers, and colloidal particles: Molecular and physicochemical basis of functional performance. Advances in Colloid and Interface Science. 234, 3-26 (2016).
- Nguyen, T. T., Youssef, N. H., McInerney, M. J., Sabatini, D. A. Rhamnolipid biosurfactant mixtures for environmental remediation. Water Research. 42 (6-7), 1735-1743 (2008).
- Maier, R. M., Soberon-Chavez, G. Pseudomonas aeruginosa rhamnolipids: biosynthesis and potential applications. Applied Microbiology and Biotechnology. 54 (5), 625-633 (2000).
- Banat, I. M., Makkar, R. S., Cameotra, S. S. Potential commercial applications of microbial surfactants. Applied Microbiology and Biotechnology. 53 (5), 495-508 (2000).
- Mulugeta, K., Kamaraj, M., Tafesse, M., Aravind, J. A review on production, properties, and applications of microbial surfactants as a promising biomolecule for environmental applications. Strategies and Tools for Pollutant Mitigation: Avenues to a Cleaner Environment. , 3-28 (2021).
- Sharma, J., Sundar, D., Srivastava, P. Biosurfactants: Potential agents for controlling cellular communication, motility, and antagonism. Frontiers in Molecular Biosciences. 8, 727070 (2021).
- Vijayakumar, S., Saravanan, V. Biosurfactants-types, sources and applications. Research Journal of Microbiology. 10 (5), 181-192 (2015).
- Curiel-Maciel, N. F., et al. Characterization of enterobacter cloacae BAGM01 producing a thermostable and alkaline-tolerant rhamnolipid biosurfactant from the Gulf of Mexico. Marine Biotechnology. 23 (1), 106-126 (2021).
- Nikolova, C., Gutierrez, T. Biosurfactants and their applications in the oil and gas industry: current state of knowledge and future perspectives. Frontiers in Bioengineering and Biotechnology. 9, (2021).
- Rastogi, S., Tiwari, S., Ratna, S., Kumar, R. Utilization of agro-industrial waste for biosurfactant production under submerged fermentation and its synergistic application in biosorption of Pb2. Bioresource Technology Reports. 15, 100706 (2021).
- Zargar, A. N., Lymperatou, A., Skiadas, I., Kumar, M., Srivastava, P. Structural and functional characterization of a novel biosurfactant from Bacillus sp. IITD106. Journal of Hazardous Materials. 423, 127201 (2022).
- Adnan, M., et al. Functional and structural characterization of pediococcus pentosaceus-derived biosurfactant and its biomedical potential against bacterial adhesion, quorum sensing, and biofilm formation. Antibiotics. 10 (11), 1371 (2021).
- Du Nouy, P. L. A new apparatus for measuring surface tension. The Journal of General Physiology. 1 (5), 521-524 (1919).
- Akbari, S., Abdurahman, N. H., Yunus, R. M., Fayaz, F., Alara, O. R. Biosurfactants-a new frontier for social and environmental safety: a mini review. Biotechnology Research and Innovation. 2 (1), 81-90 (2018).
- Bicca, F. C., Fleck, L. C., Ayub, M. A. Z. Production of biosurfactant by hydrocarbon degrading Rhodococcus ruber and Rhodococcus erythropolis. Revista de Microbiologia. 30 (3), 231-236 (1999).
- Kuyukina, M. S., et al. Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction. Journal of Microbiological Methods. 46 (2), 149-156 (2001).
- Philp, J., et al. Alkanotrophic Rhodococcus ruber as a biosurfactant producer. Applied Microbiology and Biotechnology. 59 (2), 318-324 (2002).
- Mutalik, S. R., Vaidya, B. K., Joshi, R. M., Desai, K. M., Nene, S. N. Use of response surface optimization for the production of biosurfactant from Rhodococcus spp. MTCC 2574. Bioresource Technology. 99 (16), 7875-7880 (2008).
- Shavandi, M., Mohebali, G., Haddadi, A., Shakarami, H., Nuhi, A. Emulsification potential of a newly isolated biosurfactant-producing bacterium, Rhodococcus sp. strain TA6. Colloids and Surfaces B, Biointerfaces. 82 (2), 477-482 (2011).
- White, D., Hird, L., Ali, S. Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp., strain PML026. Journal of Applied Microbiology. 115 (3), 744-755 (2013).
- Najafi, A., et al. Interactive optimization of biosurfactant production by Paenibacillus alvei ARN63 isolated from an Iranian oil well. Colloids and Surfaces. B, Biointerfaces. 82 (1), 33-39 (2011).
- Bezza, F. A., Chirwa, E. M. N. Pyrene biodegradation enhancement potential of lipopeptide biosurfactant produced by Paenibacillus dendritiformis CN5 strain. Journal of Hazardous Materials. 321, 218-227 (2017).
- Jimoh, A. A., Lin, J. Biotechnological applications of Paenibacillus sp. D9 lipopeptide biosurfactant produced in low-cost substrates. Applied Biochemistry and Biotechnology. 191 (3), 921-941 (2020).
- Liang, T. -. W., et al. Exopolysaccharides and antimicrobial biosurfactants produced by Paenibacillus macerans TKU029. Applied Biochemistry and Biotechnology. 172 (2), 933-950 (2014).
- Mesbaiah, F. Z., et al. Preliminary characterization of biosurfactant produced by a PAH-degrading Paenibacillus sp. under thermophilic conditions. Environmental Science and Pollution Research. 23 (14), 14221-14230 (2016).
- Quinn, G. A., Maloy, A. P., McClean, S., Carney, B., Slater, J. W. Lipopeptide biosurfactants from Paenibacillus polymyxa inhibit single and mixed species biofilms. Biofouling. 28 (10), 1151-1166 (2012).
- Gudiña, E. J., et al. Novel bioemulsifier produced by a Paenibacillus strain isolated from crude oil. Microbial Cell Factories. 14 (1), 1-11 (2015).
- Pradhan, A. K., Pradhan, N., Sukla, L. B., Panda, P. K., Mishra, B. K. Inhibition of pathogenic bacterial biofilm by biosurfactant produced by Lysinibacillus fusiformis S9. Bioprocess and Biosystems Engineering. 37 (2), 139-149 (2014).
- Manchola, L., Dussán, J. Lysinibacillus sphaericus and Geobacillus sp biodegradation of petroleum hydrocarbons and biosurfactant production. Remediation Journal. 25 (1), 85-100 (2014).
- Bhardwaj, G., Cameotra, S. S., Chopra, H. K. Biosurfactant from Lysinibacillus chungkukjangi from rice bran oil sludge and potential applications. Journal of Surfactants and Detergents. 19 (5), 957-965 (2016).
- Gaur, V. K., et al. Rhamnolipid from a Lysinibacillus sphaericus strain IITR51 and its potential application for dissolution of hydrophobic pesticides. Bioresource Technology. 272, 19-25 (2019).
- Habib, S., et al. Production of lipopeptide biosurfactant by a hydrocarbon-degrading Antarctic Rhodococcus. International Journal of Molecular Sciences. 21 (17), 6138 (2020).
- Shao, P., Ma, H., Zhu, J., Qiu, Q. Impact of ionic strength on physicochemical stability of o/w emulsions stabilized by Ulva fasciata polysaccharide. Food Hydrocolloids. 69, 202-209 (2017).
- . Overview of DLVO theory Available from: https://archive-ouverte.unige.ch/unige:148595 (2014)
- Kazemzadeh, Y., Ismail, I., Rezvani, H., Sharifi, M., Riazi, M. Experimental investigation of stability of water in oil emulsions at reservoir conditions: Effect of ion type, ion concentration, and system pressure. Fuel. 243, 15-27 (2019).
- Chong, H., Li, Q. Microbial production of rhamnolipids: opportunities, challenges and strategies. Microbial Cell Factories. 16 (1), 1-12 (2017).
- Zeng, G., et al. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and Rhamnolipid, in liquid culture media and compost matrix. Biodegradation. 18 (3), 303-310 (2007).
- Liu, G., et al. Advances in applications of rhamnolipids biosurfactant in environmental remediation: a review. Biotechnology and Bioengineering. 115 (4), 796-814 (2018).
- John, W. C., Ogbonna, I. O., Gberikon, G. M., Iheukwumere, C. C. Evaluation of biosurfactant production potential of Lysinibacillus fusiformis MK559526 isolated from automobile-mechanic-workshop soil. Brazilian Journal of Microbiology. 52 (2), 663-674 (2021).
- Naing, K. W., et al. Isolation and characterization of an antimicrobial lipopeptide produced by Paenibacillus ehimensis MA2012. Journal of Basic Microbiology. 55 (7), 857-868 (2015).
- Wittgens, A., et al. Novel insights into biosynthesis and uptake of rhamnolipids and their precursors. Applied Microbiology and Biotechnology. 101 (7), 2865-2878 (2017).
- Rahman, K., Rahman, T. J., McClean, S., Marchant, R., Banat, I. M. Rhamnolipid biosurfactant production by strains of Pseudomonas aeruginosa using low-cost raw materials. Biotechnology Progress. 18 (6), 1277-1281 (2002).
- Bahia, F. M., et al. Rhamnolipids production from sucrose by engineered Saccharomyces cerevisiae. Scientific Reports. 8 (1), 1-10 (2018).
- Kim, C. H., et al. Desorption and solubilization of anthracene by a rhamnolipid biosurfactant from Rhodococcus fascians. Water Environment Research. 91 (8), 739-747 (2019).
- Nalini, S., Parthasarathi, R. Optimization of rhamnolipid biosurfactant production from Serratia rubidaea SNAU02 under solid-state fermentation and its biocontrol efficacy against Fusarium wilt of eggplant. Annals of Agrarian Science. 16 (2), 108-115 (2018).
- Wang, Q., et al. Engineering bacteria for production of rhamnolipid as an agent for enhanced oil recovery. Biotechnology and Bioengineering. 98 (4), 842-853 (2007).
- Câmara, J., Sousa, M., Neto, E. B., Oliveira, M. Application of rhamnolipid biosurfactant produced by Pseudomonas aeruginosa in microbial-enhanced oil recovery (MEOR). Journal of Petroleum Exploration and Production Technology. 9 (3), 2333-2341 (2019).
- Amani, H., Mehrnia, M. R., Sarrafzadeh, M. H., Haghighi, M., Soudi, M. R. Scale up and application of biosurfactant from Bacillus subtilis in enhanced oil recovery. Applied Biochemistry and Biotechnology. 162 (2), 510-523 (2010).
- Gudiña, E. J., et al. Bioconversion of agro-industrial by-products in rhamnolipids toward applications in enhanced oil recovery and bioremediation. Bioresource Technology. 177, 87-93 (2015).
- Sun, G., Hu, J., Wang, Z., Li, X., Wang, W. Dynamic investigation of microbial activity in microbial enhanced oil recovery (MEOR). Petroleum Science and Technology. 36 (16), 1265-1271 (2018).
- Jha, S. S., Joshi, S. J., SJ, G. Lipopeptide production by Bacillus subtilis R1 and its possible applications. Brazilian Journal of Microbiology. 47 (4), 955-964 (2016).
- Darvishi, P., Ayatollahi, S., Mowla, D., Niazi, A. Biosurfactant production under extreme environmental conditions by an efficient microbial consortium, ERCPPI-2. Colloids and Surfaces. B, Biointerfaces. 84 (2), 292-300 (2011).
- Al-Wahaibi, Y., et al. Biosurfactant production by Bacillus subtilis B30 and its application in enhancing oil recovery. Colloids and Surfaces. B, Biointerfaces. 114, 324-333 (2014).
- Moutinho, L. F., Moura, F. R., Silvestre, R. C., Romão-Dumaresq, A. S. Microbial biosurfactants: A broad analysis of properties, applications, biosynthesis, and techno-economical assessment of rhamnolipid production. Biotechnology Progress. 37 (2), 3093 (2021).
- Youssef, N., Simpson, D. R., McInerney, M. J., Duncan, K. E. In-situ lipopeptide biosurfactant production by Bacillus strains correlates with improved oil recovery in two oil wells approaching their economic limit of production. International Biodeterioration & Biodegradation. 81, 127-132 (2013).
- Ruckenstein, E., Nagarajan, R. Critical micelle concentration and the transition point for micellar size distribution. The Journal of Physical Chemistry. 85 (20), 3010-3014 (1981).
- de Araujo, L. L., et al. Microbial enhanced oil recovery using a biosurfactant produced by Bacillus safensis isolated from mangrove microbiota-Part I biosurfactant characterization and oil displacement test. Journal of Petroleum Science and Engineering. 180, 950-957 (2019).
- Banat, I. M., De Rienzo, M. A. D., Quinn, G. A. Microbial biofilms: biosurfactants as antibiofilm agents. Applied Microbiology and Biotechnology. 98 (24), 9915-9929 (2014).
- Klosowska-Chomiczewska, I., Medrzycka, K., Karpenko, E. Biosurfactants-biodegradability, toxicity, efficiency in comparison with synthetic surfactants. Research and Application of New Technologies in Wastewater Treatment and Municipal Solid Waste Disposal in Ukraine, Sweden, and Poland. 17, 141-149 (2013).
- Fernandes, P. A. V., et al. Antimicrobial activity of surfactants produced by Bacillus subtilis R14 against multidrug-resistant bacteria. Brazilian Journal of Microbiology. 38 (4), 704-709 (2007).
- Santos, D. K. F., Rufino, R. D., Luna, J. M., Santos, V. A., Sarubbo, L. A. Biosurfactants: multifunctional biomolecules of the 21st century. International Journal of Molecular Sciences. 17 (3), 401 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır