JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
생체 계면활성제의 조합을 사용한 향상된 오일 회수
요약
우리는 미생물을 생산하는 생체 계면 활성제의 스크리닝 및 확인에 관련된 방법을 설명합니다. 크로마토그래피 특성화 및 생체계면활성제의 화학적 동정을 위한 방법, 잔류 오일 회수를 증진시키는 생체계면활성제의 산업적 응용성을 결정하기 위한 방법들 또한 제시된다.
초록
생체 계면활성제는 서로 다른 극성의 두 단계 사이의 표면 장력을 감소시킬 수 있는 표면 활성 화합물이다. 생체 계면활성제는 독성이 적고, 생분해성이 높으며, 환경 적합성 및 극한의 환경 조건에 대한 내성으로 인해 화학 계면활성제에 대한 유망한 대안으로 부상하고 있습니다. 여기에서, 우리는 생체 계면활성제를 생산할 수 있는 미생물의 스크리닝에 사용되는 방법을 예시한다. 미생물을 생산하는 생체계면활성제는 방울 붕괴, 오일 확산 및 유화 지수 분석을 사용하여 확인되었다. 생체계면활성제 생산은 미생물 부재의 성장에 의한 배지의 표면 장력의 감소를 결정함으로써 검증되었다. 우리는 또한 생체 계면 활성제의 특성화 및 확인과 관련된 방법을 설명합니다. 추출된 생체계면활성제의 박층 크로마토그래피에 이어 플레이트의 시등 염색을 수행하여 생체계면활성제의 성질을 확인하였다. LCMS, 1HNMR, 및 FT-IR을 사용하여 생체계면활성제를 화학적으로 동정하였다. 우리는 시뮬레이션된 샌드 팩 컬럼에서 잔류 오일 회수를 향상시키기 위해 생산된 바이오계면활성제의 조합의 적용을 평가하는 방법을 추가로 예시한다.
서문
생체 계면 활성제는 두 단계1 사이의 표면 및 계면 장력을 감소시킬 수있는 능력을 가진 미생물에 의해 생성 된 양친매성 표면 활성 분자입니다. 전형적인 생체계면활성제는 일반적으로 당 모이어티 또는 펩티드 사슬 또는 친수성 아미노산 및 포화 또는 불포화 지방산 사슬로 구성되는 소수성 부분2로 구성되는 친수성 부분을 함유한다. 양친매성 특성으로 인해, 생체 계면활성제는 두 상 사이의 계면에서 조립되고 경계에서 계면 장력을 감소시켜 한 상을 다른 1,3으로 분산시키는 것을 용이하게합니다. 지금까지 보고된 다양한 유형의 생체계면활성제에는 탄수화물이 에스테르 결합을 통해 장쇄 지방족 또는 히드록시지방족 산에 연결되는 당지질(예를 들어, 람놀리지질, 트레할로지질 및 소포리지질), 지질이 폴리펩티드 사슬에 부착되는 리포펩티드(예를 들어, 수록실 및 리케니신), 및 일반적으로 다당류-단백질 복합체로 구성되는 고분자 생체계면활성제(예를 들어, 에뮬산, 리포산, 알라산 및 리포만난)4. 미생물에 의해 생산된 다른 유형의 생체계면활성제는 지방산, 인지질, 중성 지질, 및 미립자 생물계면활성제(5)를 포함한다. 생체 계면 활성제의 가장 많이 연구 된 부류는 당지질이며, 그 중 대부분의 연구는 람 놀리 지질6에 대해보고되었습니다. 람놀리피드는 장쇄 지방산(보통 하이드록시데칸산)의 하나 또는 두 개의 분자에 연결된 람노스(친수성 부분을 형성하는)의 하나 또는 두 개의 분자를 함유한다. 람놀리피드는 슈도모나스 aeruginosa7로부터 처음 보고된 일차 당지질이다.
생체 계면 활성제는 그들이 제공하는 다양한 독특하고 독특한 특성으로 인해 화학 물질에 비해 점점 더 많은 관심을 얻고 있습니다8. 여기에는 더 높은 특이성, 낮은 독성, 더 큰 다양성, 준비 용이성, 더 높은 생분해성, 더 나은 발포성, 환경 적합성 및 극한 조건 하에서의 활성이포함됩니다 9. 생체계면활성제의 구조적 다양성(도 S1)은 화학적 대응물(10)에 비해 우위를 제공하는 또 다른 이점이다. 그들은 일반적으로 그들의 임계 미셀 농도 (CMC)가 일반적으로 화학 계면활성제11보다 몇 배 낮기 때문에 더 낮은 농도에서 더 효과적이고 효율적입니다. 이 제품은 매우 열안정성(최대 100°C)이며 더 높은 pH(최대 9개) 및 높은 염 농도(최대 50g/L)를 견딜 수 있는 것으로 보고되었으며12 따라서 극한 조건에 노출되어야 하는 산업 공정에서 몇 가지 이점을 제공합니다13. 생분해성과 낮은 독성으로 인해 생물 개선과 같은 환경 응용 분야에 적합합니다. 그들이 제공하는 장점 때문에, 그들은 식품, 농업, 세제, 화장품 및 석유 산업과 같은 다양한 산업에서 주목을 받고 있습니다11. 생체 계면 활성제는 또한 석유 오염 물질 및 독성 오염 물질(14)의 제거를위한 오일 개선에 많은 주목을 받았다.
여기서 우리는 Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 및 Paenibacillus sp. IITD108에 의해 생산 된 생체 계면 활성제의 생산, 특성화 및 적용을보고합니다. 향상된 오일 회수를 위한 생체계면활성제의 조합의 스크리닝, 특성화 및 적용에 관련된 단계는 도 1에 요약되어 있다.
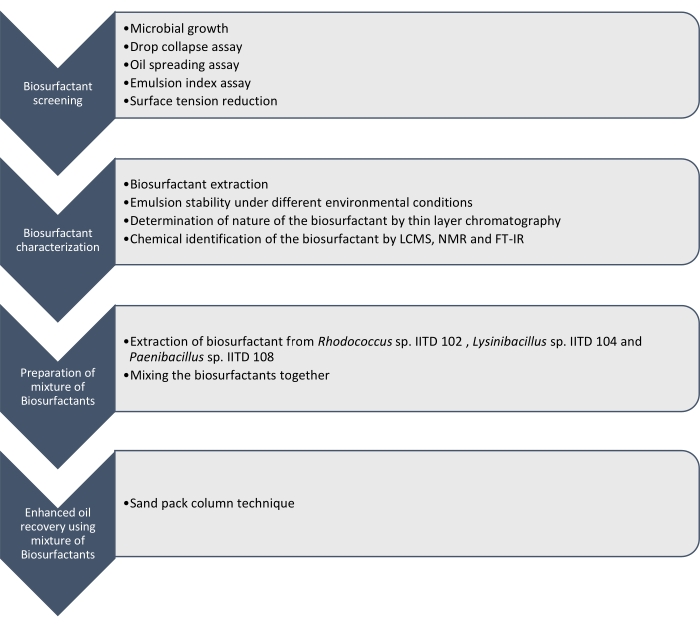
도 1: 생체계면활성제의 조합을 이용한 향상된 오일 회수를 위한 방법. 단계적 작업 흐름이 표시됩니다. 작업은 네 단계로 수행되었습니다. 먼저 미생물 균주를 배양하고 낙하 붕괴 분석, 오일 확산 분석, 유화 지수 분석 및 표면 장력 측정을 포함하는 다양한 분석법에 의해 생체 계면활성제의 생산을 스크리닝하였다. 그런 다음 무세포 배양액에서 생체 계면 활성제를 추출하고 박층 크로마토그래피를 사용하여 그 성질을 확인하고 LCMS, NMR 및 FT-IR을 사용하여 추가로 확인했습니다. 다음 단계에서, 추출된 생체계면활성제를 함께 혼합하고, 생성된 혼합물의 향상된 오일 회수를 위한 잠재성을 샌드 팩 컬럼 기술을 사용하여 결정하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
생체계면활성제를 생산하기 위한 이들 미생물 균주의 스크리닝은 방울 붕괴, 오일 확산, 에멀젼 지수 분석 및 미생물의 성장에 의한 무세포 배지의 표면 장력의 감소의 결정에 의해 수행되었다. 생체계면활성제를 추출하고, 특성화하고, LCMS, 1H NMR, 및 FT-IR에 의해 화학적으로 동정하였다. 마지막으로, 이들 미생물에 의해 생성된 생체계면활성제의 혼합물이 제조되었고, 모의 샌드 팩 컬럼에서 잔류 오일을 회수하는데 사용되었다.
본 연구는 단지 잔류 오일 회수를 증진시키기 위한 생체계면활성제 조합의 스크리닝, 동정, 구조적 특성화 및 적용에 관여하는 방법들을 예시한다. 미생물 균주(15,16)에 의해 생산된 생체계면활성제의 상세한 기능적 특성화를 제공하지 않는다. 모든 생체 계면활성제의 상세한 기능적 특성화를 위해 임계 미셀 결정, 열 중량 분석, 표면 습윤성 및 생분해성과 같은 다양한 실험이 수행됩니다. 그러나이 논문은 방법 논문이기 때문에 잔류 오일 회수 강화에 대한 생체 계면 활성제 조합의 스크리닝, 식별, 구조적 특성화 및 적용에 중점을 둡니다. 이러한 실험은 본 연구에 포함되지 않았다.
프로토콜
1. 미생물 균주의 성장
- Luria Broth 분말 2g을 재고 250mL 원뿔형 플라스크에 증류수 50mL를 첨가합니다. 분말이 완전히 용해 될 때까지 내용물을 혼합하고 증류수를 사용하여 부피를 100 mL로 구성하십시오.
- 마찬가지로, Luria Broth 100mL의 플라스크를 두 개 더 준비하고 플라스크의 목에 면봉을 놓습니다.
- 면 플러그를 알루미늄 호일로 덮고 플라스크를 121°C 및 15 psi에서 15분 동안 오토클레이브하여 매체를 멸균한다.
- 오토클레이빙 후 미디어를 실온으로 식히십시오.
- 균주의 일차 배양을 준비하기 위해, 접종 루프를 사용하여 LA 플레이트로부터 단일 콜로니를 선택하고 멸균 루리아 국물 5 mL를 함유하는 시험관에 접종한다.
- 시험관을 180 rpm에서 30°C에서 밤새 인큐베이션한다.
- 오토클레이브된 루리아 브로스 100 mL를 함유하는 플라스크에 밤새 성장한 종자 배양물 1 mL를 층류 캐비닛 내부의 플라스크에 첨가하여 접종한다.
- 플라스크를 7일 동안 30°C 및 180 rpm의 회전 인큐베이터에서 인큐베이션한다.
- 인큐베이션 기간이 완료된 후, 플라스크를 수확하고 배양액을 원심분리 튜브로 옮긴다. 배양물을 4°C에서 냉장 원심분리기에서 20분 동안 4,500 x g 에서 원심분리한다.
- 부드럽게 세포가없는 상청액을 신선한 비이커에 붓고 생체 계면 활성제 생산을위한 스크리닝 분석에 사용하십시오.
2. 생체계면활성제 생산을 위한 스크리닝 분석
참고: 다음 섹션에서는 상업용 계면활성제(Saponin)를 양성 대조군으로 사용하였고, 물과 접종되지 않은 배지를 음성 대조군으로 사용하였다.
- 낙하 붕괴 분석
- 깨끗한 유리 슬라이드를 가져 와서 슬라이드 표면을 200 μL의 오일로 코팅하십시오.
- 20 μL의 무세포 상청액을 오일의 중앙에 첨가하고 2-3 분 동안 방해받지 않고 그대로 두십시오.
참고 : 방울이 붕괴되면 생체 계면 활성제의 존재에 대해 상청액을 양성으로 평가하십시오.
- 오일 확산 분석
- 페트리 플레이트 (직경 75mm)에 이중 증류수 20mL를 취하여 물 표면에 원유 200μL를 첨가하십시오.
- 20 μL의 무세포 상청액을 오일의 중앙에 첨가하고 1 분 동안 방해받지 않고 그대로 두십시오.
참고: 오일 변위로 인해 클리어링 구역이 형성되는 경우, 생체 계면활성제의 존재에 대해 상등액을 양성으로 평가하십시오.
- 에멀젼 지수 분석 (E24 분석)
- 4 mL의 휘발유 (가솔린)와 무세포 상청액을 깨끗한 유리 시험관에 각각 넣으십시오.
- 혼합물을 3 분 동안 격렬하게 소용돌이 치게하고 다음 24 시간 동안 방해받지 않도록하십시오.
- 24시간 후, 전체 액체 컬럼(cm)의 높이에 대하여 유화층의 높이(cm)의 백분율로서E24 지수를 결정한다.
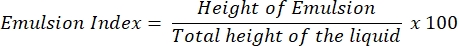
참고 : 24 시간 후에 에멀젼 (물 속의 오일 또는 오일의 물)이 관찰되면 상청액에 생체 계면 활성제가 포함될 가능성이 큽니다.
- 표면 장력 측정
주: 표면 장력은 Du Noüy 고리 방법17을 사용하여 측정하였다. 이 실험에 사용 된 장비 ( 재료 표 참조)는 매우 민감하므로 유리 용기와 프로브를 올바르게 청소하십시오.- 시스템을 켜고 관련 소프트웨어를 두 번 클릭하여 엽니 다.
- 표면 장력을 결정해야하는 액체로 유리 용기를 청소하십시오.
- 액체 (40 mL)를 용기에 넣고 용기 홀더에 용기를 장착하십시오.
- 프로브 홀더의 잠금을 해제하고 프로브를 장착합니다. 이제 수동 컨트롤러의 잠금 버튼을 눌러 프로브 홀더를 잠급니다.
- 수동 컨트롤러를 사용하여 프로브가 액체 표면에서 약 2-3mm 떨어져 있도록 플랫폼의 높이를 조정하십시오.
- 이제 소프트웨어를 사용하여 표면 장력을 측정하십시오. 화면의 왼쪽 상단 패널에있는 파일을 클릭하십시오. 작업 영역 열기를 클릭합니다. 팝업 창이 나타납니다.
- 아래로 스크롤하여 K100: 표면 및 계면 장력 아이콘을 두 번 클릭합니다.
- 이제 화면의 왼쪽 상단에있는 파일 아이콘을 클릭하십시오. 새 데이터베이스를 클릭하십시오. 데이터 저장 이름을 입력하고 확인을 클릭하십시오.
- 다시 SFT > 링> 새 측정 파일을 클릭>십시오. 측정 이름을 입력합니다. 구성 템플릿에 SFT 링이 표시되는지 확인합니다.
- 측정에 사용 중인 프로브와 용기를 선택하여 측정 구성 창에서 세부 정보를 입력합니다. 또한 액체 및 기체상의 세부 사항을 채 웁니다.
참고 : 액상은 물이되고 기상은 공기입니다. 액상의 밀도는 세포 없는 상청액의 밀도이다. 이것은 액체의 50 mL의 무게를 취하고 밀도를 Kg /m3로 계산하여 결정할 수 있습니다. - 이제 절차 탭을 클릭하고 다음 세부 정보를 입력하십시오 : 감지 속도 : 6mm / 분, 감지 감도 : 0.005g, 검색 속도 : 6mm / 분, 검색 감도 : 0.005g, 측정 속도 : 3mm / 분, 측정 감도 : 0.001g, 침수 깊이 : 3mm, 반사 거리 : 10 %, 수정 : Harkins & Jordan, 최대 값 : 5. 확인을 클릭하십시오.
- 팝업 창에서 데이터를 저장할 데이터베이스를 선택하고 확인을 클릭하십시오.
참고: 여기에서 새 데이터베이스를 만들거나 기존 데이터에 새 측정값을 추가할 수 있습니다. - 이제 화면 상단 중앙에있는 재생 버튼을 클릭하십시오. 시스템이 스크립트 실행을 시작합니다. 시스템이 안정화되면 표면을 감지합니다. 프로브를 액체에 담그고 프로브를 앞뒤로 움직여 형성된 라멜라의 장력을 감지하십시오.
- 결과를 얻으려면 화면 왼쪽 가운데에 있는 측정 아이콘을 클릭합니다. 데이터를 클릭하고 결정 된 표면 장력을 기록해 둡니다.
- 측정이 완료되면 플랫폼의 높이를 낮추고 장비에서 프로브와 선박을 잠금 해제하고 마운트 해제하십시오.
참고 : 생체 계면 활성제 생산으로 인한 표면 장력의 감소를 확인하려면 접종되지 않은 LB를 대조군으로 사용해야합니다.
3. 생체 계면활성제 추출
- 세포 유리 상청액의 pH를 2 N HCl을 사용하여 2로 조정한다. 혼합물을 밤새 4°C에서 보관한다.
- 상등액에 동일한 부피의 클로로포름-메탄올 혼합물 (2:1)을 첨가하고 20 분 동안 격렬하게 혼합하십시오.
- 상 분리가 일어나도록 혼합물을 방해받지 않고 그대로 두십시오.
- 물과 메탄올을 함유하는 상부상을 제거하고, 생체계면활성제를 함유하는 하부 상을 남겨두고 흄 후드에서 증발시킨다.
- 유기 상을 증발시킨 후, 꿀 색깔의 조 생체 계면활성제를 3 mL의 클로로포름에 재용해시키고, 이 혼합물을 생체 계면활성제의 추가 동정 및 특성화를 위해 사용한다.
4. 유화 안정성 연구
-
다른 온도에서의 에멀젼 안정성
- 5 mL의 무세포 상청액을 다른 시험관에 취하십시오.
- 각 시험관에 휘발유 5mL를 넣고 3분 동안 볼텍싱하여 격렬하게 섞는다.
- 시험관을 상이한 온도 (30°C, 40°C, 50°C, 60°C, 및 70°C)에서 상이한 수조에서 밤새 인큐베이션한다.
- 24 h 후에, 앞서 언급한 바와 같이 에멀젼 지수를 추정한다.
-
상이한 pH 값에서의 에멀젼 안정성
- 세포가 없는 상등액 5 mL를 깨끗한 시험관에 취하십시오.
- 무세포 상청액(2, 4, 6, 8, 및 10)의 pH를 1 N HCl 및 1 N NaOH를 사용하여 조정한다.
- 시험관에 같은 양의 휘발유를 넣고 3 분 동안 볼텍싱하여 격렬하게 섞으십시오.
- 시험관을 실온에서 24 시간 동안 방해받지 않고 그대로 두십시오.
- 앞에서 언급 한 바와 같이 유제 지수를 추정하십시오.
-
상이한 염 농도에서의 에멀젼 안정성
- 세포가 없는 상등액 5 mL를 깨끗한 시험관에 취하십시오.
- 상청액에 다른 양의 소금 (NaCl)을 추가하십시오 (0 g / L, 5 g / L, 10 g / L, 20 g / L, 60 g / L 및 80 g / L).
- 염을 3분 동안 볼텍싱하여 세포 유리 상청액에 용해시킨다.
- 시험관에 같은 양의 휘발유를 넣고 3 분 동안 볼텍싱하여 격렬하게 섞으십시오.
- 시험관을 실온에서 24 시간 동안 방해받지 않고 그대로 두십시오.
- 24 h 후에 에멀젼 지수를 추정하십시오.
5. 생체계면활성제의 성질 결정
-
추출된 생체계면활성제의 TLC
- 20 μL의 생체계면활성제를 TLC 플레이트 상에 스팟한다. 한 번에 2 μL를 스팟합니다.
- 세 개의 다른 TLC 플레이트에 생체 계면활성제를 스팟하십시오.
- 클로로포름:메탄올(2:1)을 함유하는 용리액의 100 mL 혼합물을 제조하고, 용리액을 TLC 챔버에 첨가한다. 챔버의 뚜껑을 닫고 20 분 동안 포화되도록하십시오.
- 플레이트를 건조시킨 후, TLC 플레이트를 클로로포름 메탄올 혼합물로 포화된 챔버 내부에 놓고 TLC를 실행한다.
- 용리액이 TLC 플레이트의 상단 (상단에서 1cm 떨어져 있음)에 도달 한 후 플레이트를 꺼내 공기 건조시킵니다.
-
지질 검출을 위한 염색
- 깨끗한 TLC 챔버를 가져 와서 신선한 챔버에 요오드 과립 (5-10)을 넣고 챔버를 5 ~ 10 분 동안 포화시킵니다.
- TLC 플레이트를 챔버 내부에 놓고 노란색 반점의 발달을 관찰하십시오. 반점이 나타나면, 지질 성분의 존재에 대해 생체계면활성제를 양성으로 점수화한다.
-
펩티드 또는 아미노산 검출을 위한 염색
- 0.4 g의 닌히드린을 부탄올 20 mL에 용해시켜 닌히드린 용액을 제조하였다. 0.6 mL의 100% 빙초산을 상기 혼합물에 첨가한다.
- TLC 플레이트를 닌히드린 용액으로 분무하고 2 분 동안 공기 건조시킵니다. 플레이트를 110°C에서 가열하고 색상의 발달을 관찰한다.
참고: 파란색 반점이 나타나면 펩티드 사슬 또는 아미노산의 존재에 대해 생체 계면활성제를 양성으로 평가하십시오.
-
탄수화물 검출을 위한 염색
- H2SO4 1 mL를 함유하는 빙초산 48 mL에 p-anisaldehyde2mL를 첨가하여 p-anisaldehyde의 용액을제조하였다. 0.6 mL의 아세트산을 혼합물에 첨가한다.
- 혼합물을 TLC 플레이트에 골고루 뿌리고 2 분 동안 공기 건조시킵니다.
- 플레이트를 110°C에서 인큐베이션하고 반점의 발생을 모니터링한다.
참고 : 녹색 또는 갈색 반점이 나타나면 탄수화물의 존재에 대해 생체 계면 활성제를 양성으로 평가하십시오.
6. 생체계면활성제의 화학적 식별
- 생체계면활성제의 LCMS
- 추출된 생체계면활성제 25 mg을 클로로포름 1 mL에 녹인다.
- C18 컬럼을 사용하여 LCMS(기준 스캔 주파수가 10초인 잠금 스프레이 구성에서)를 수행합니다.
- 클로로포름:메탄올(1:1)을 이동상으로 사용하고 시료 2μL를 0.1mL/min의 유속으로 컬럼에 주입합니다.
- 실험 파라미터를 극성: ES 포지티브, 모세관 전압: 3kV, 소스 온도: 80°C, 용해 온도: 300°C, 탈용매화 가스 유량: 7,000L/h, 트랩 가스 유량: 0.40mL/분으로 설정합니다.
- 20분의 검출 시간 동안 100 내지 1,200 Da 범위를 스캔하고 양성 ES 모드에서 이온을 조사한다.
- 질량 분광법을 정량적으로 소프트웨어를 사용하여 m/z 값을 분석합니다.
- 분석을 위해 소프트웨어에 로그인하십시오.
- 일괄 검색을 클릭하고 얻은 질량 목록을 입력하십시오. 양전하 모드에서 결과를 조사하고 M + H 및 M + Na를 부가물로 사용하십시오. 정확도를 10PPM으로 유지하고 디스플레이 구조를 체크합니다.
- 검색을 클릭하고 화합물 목록에서 PPM 수준이 가장 낮은 화합물을 선택하십시오.
- 1개 생체계면활성제의 H NMR
참고: 생체계면활성제의 1HNMR은 400 MHz NMR 분광계를 사용하여 수행되었다( 표 참조).- 5mg의 생체계면활성제를 1mL의 중수소화된 클로로포름(CdCl3)에 녹인다.
- 혼합물을 NMR 튜브로 옮깁니다. 튜브를 올바르게 캡하고 튜브를 스패너에 삽입하십시오. 조절기 튜브를 사용하여 튜브의 높이를 조정하십시오.
- 스패너와 함께 튜브를 NMR 기계에 놓고 아래 언급 된 단계에 따라 NMR 스펙트럼을 얻으십시오.
- 샘플 튜브 유형을 선택하려면: sx N, 여기서 N은 관련 소프트웨어에서 튜브가 배치된 위치(예: sx 13, 튜브가 13번째 위치에 배치된 경우)입니다.
- edc를 입력하고 Enter 키를 눌러 데이터를 저장할 수 있는 새 폴더를 만듭니다.
- 팝업이 나타납니다. 목록에서 CdCl 3 을 클릭하여 용매를 선택하고 샘플 이름을 입력합니다.
- 프로토콜을 시작하려면 "getprosol"을 입력하십시오. 용매를 잠그려면 "잠금 cdcl3"을 입력하십시오.
- "topshim"을 입력하여 샘플을 shim하고 마지막으로 "rga;zgefp"를 입력하여 데이터를 수집합니다. 그러면 프로토콜이 시작됩니다.
- 스펙트럼을 얻은 후 "apk;abs n"을 입력하고 Enter 키를 눌러 위상 및 기준선 보정을 수행합니다.
- 기본 피크를 선택하려면 "pp"를 입력하고 Enter 키를 누릅니다. 강렬한 피크만 선택하려면 "mi"를 입력하고 피크를 선택해야 하는 위의 강도를 입력합니다. 기본값은 0.2입니다.
- 피크를 통합하려면 통합을 클릭하고 통합 할 피크의 왼쪽에 커서를 놓고 커서를 누른 상태에서 커서를 클릭하고 커서를 피크 주위로 드래그하십시오.
- 왼쪽 상단의 파일을 클릭하여 데이터를 저장 한 다음 저장을 클릭하십시오.
- 샘플은 "sx ej"를 입력하여 기계에서 배출 할 수 있습니다.
- 피크를 분석하고 H 원자의 환경을 결정하십시오.
- 푸리에 변환 적외선 분광법 생체 계면활성제
주: 추출된 생체계면활성제의 FT-IR은 ATR 모드에서 시판되는 분광광도계를 사용하여 수행하였다( 표 참조).- 분광 광도계를 켜고 퍼지, 건조제 및 검출기를 확인하십시오.
- 스펙트럼을 수집하려면 먼저 샘플이 없는 배경 스펙트럼을 수집합니다.
- 추출 된 생체 계면 활성제를 가져 와서 완전히 건조시킵니다. 건조된 생체계면활성제를 다이아몬드 결정 위에 직접 놓고 압력을 가하고 ATR 터치포인트를 누릅니다.
- 소프트웨어에서 스캔 횟수 (30 입력)를 선택하고 400cm-1에서 4,000cm-1까지 스펙트럼을 스캔하십시오.
- 확인을 클릭하여 샘플 스펙트럼을 스펙트럼 창에 추가합니다.
- 파일 > 다른 이름으로 저장> 저장하고 파일 이름 뒤에 확장자 .spa를 입력하고 확인을 클릭하십시오.
7. 생체 계면 활성제 적용 (향상된 오일 회수)
참고: 이 실험에서는 이중 증류수를 음성 대조군으로 사용하였고 양성 대조군으로 10% SDS, 10% 트윈 80 및 10% 상업용 사포닌을 사용하였다.
- 유리를 가져 와서 유리 양모와 유리 구슬로 바닥 콘센트를 밀봉하십시오.
- 토양의 꼭대기에 약간의 액체가 첨가 될 수 있고 흐르는 흐름이 바닥에 수집 될 수 있도록 모래 토양으로 기둥을 포장하십시오. 홀더에 기둥을 장착하고 토양 위에 유리 구슬을 추가하십시오.
- 컬럼을 50 mL의 염수 용액으로 플러딩하고 유동을 수집하여 공극 부피를 결정한다.
기공 부피 = 상부에 첨가된 염수의 부피 - 수집된 유동관의 부피. - 컬럼 상단에서 첨가 한 후 원유가 통과하도록 강제하여 컬럼에서 염수를 제거하십시오. 열에서 나오는 염수와 오일의 부피를 수집하여 초기 오일 포화 부피를 결정하십시오. 컬럼에서 방출되는 염수의 부피는 초기 오일 포화 부피 또는 제자리에 있는 원래 오일이 될 것이다.
- 컬럼을 24 시간 동안 방해받지 않고 그대로 두십시오.
- 24 시간 후, 10 공극 부피의 염수로 컬럼을 플러드하고 컬럼에서 나오는 오일을 수집하여 이차 오일 회수를 추정하십시오. 이차 오일 회수 후 컬럼에 남아있는 오일은 잔류 오일에 해당한다.
- 추출된 생체계면활성제(단계 3.5 이후 추출)를 유리 비이커에 동량의 첨가하여 생체계면활성제의 혼합물을 제조하였다. 생체 계면 활성제를 컬럼 상단에 첨가하고 컬럼을 24 시간 동안 인큐베이션하십시오.
- 24시간 후, 오일과 물의 양을 측정하여 추가 또는 향상된 오일 회수율을 결정하십시오. 컬럼으로부터 방출된 오일의 부피는 회수된 잔류 오일에 상응할 것이다.
- 다음 방정식을 사용하여 향상된 오일 회수율을 추정합니다.
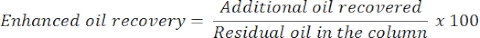
결과
세 개의 박테리아 균주(로도코커스 sp. IITD102, 리시니바실러스 sp. IITD104, 및 파이니바실러스 sp. IITD108)를 낙하 붕괴 분석, 오일 변위 분석, 에멀젼 지수 분석, 및 표면 장력 감소를 포함하는 다양한 검정에 의해 생체계면활성제의 생산을 스크리닝하였다. 세 가지 박테리아 균주 모두의 무세포 상청액 및 화학적 계면활성제의 용액은 방울 붕괴를 초래하였고, 따라서, 생체계면활성...
토론
생체 계면활성제는 화학적 계면활성제에 대한 매력적인 대안이되고있는 생물학적 활성 성분의 가장 다재다능한 그룹 중 하나입니다. 그들은 세제, 페인트, 화장품, 식품, 제약, 농업, 석유 및 수처리와 같은 수많은 산업에서 더 나은 젖음성, 낮은 CMC, 다양한 구조 및 환경 친화성으로 인해 광범위한 응용 분야를 가지고 있습니다18. 이로 인해 생체 계면 활성제 생산이 가능한 더 많...
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
저자들은 재정 지원에 대한 인도 정부의 생명 공학부에 감사하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 ml pipette | Eppendorf, Germany | G54412G | |
| 1H NMR | Bruker Avance AV-III type spectrometer,USA | ||
| 20 ul pipette | Thermo scientific, USA | H69820 | |
| Autoclave | JAISBO, India | Ser no 5923 | Jain Scientific |
| Blue flame burner | Rocker scientific, Taiwan | dragon 200 | |
| Butanol | GLR inovations, India | GLR09.022930 | |
| C18 column | Agilent Technologies, USA | 770995-902 | |
| Centrifuge | Eppendorf, Germany | 5810R | |
| Chloroform | Merck, India | 1.94506.2521 | |
| Chloroform-d | SRL, India | 57034 | |
| Falcon tubes | Tarsons, India | 546041 | Radiation sterilized polypropylene |
| FT-IR | Thermo Fisher Scientific, USA | Nicolet iS50 | |
| Fume hood | Khera, India | 47408 | Customied |
| glacial acetic acid | Merck, India | 1.93002 | |
| Glass beads | Merck, India | 104014 | |
| Glass slides | Polar industrial Corporation, USA | Blue Star | 75 mm * 25 mm |
| Glass wool | Merk, India | 104086 | |
| Hydrochloric acid | Merck, India | 1003170510 | |
| Incubator | Thermo Scientific, USA | MaxQ600 | Shaking incubator |
| Incubator | Khera, India | Sunbim | |
| Iodine resublimed | Merck, India | 231-442-4 | resublimed Granules |
| K12 –Kruss tensiometer | Kruss Scientific, Germany | K100 | |
| Laminar air flow cabnet | Thermo Scientific, China | 1300 Series A2 | |
| LCMS | Agilent Technologies, USA | 1260 Infinity II | |
| Luria Broth | HIMEDIA, India | M575-500G | Powder |
| Methanol | Merck, India | 107018 | |
| Ninhydrin | Titan Biotech Limited, India | 1608 | |
| p- anisaldehyde | Sigma, USA | 204-602-6 | |
| Petri plate | Tarsons, India | 460090-90 MM | Radiation sterilized polypropylene |
| Saponin | Merck, India | 232-462-6 | |
| Sodium chloride | Merck, India | 231-598-3 | |
| Test tubes | Borosil, India | 9800U06 | Glass tubes |
| TLC plates | Merck, India | 1055540007 | |
| Vortex | GeNei, India | 2006114318 | |
| Water Bath | Julabo, India | SW21C |
참고문헌
- Desai, J. D., Banat, I. M. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews. 61 (1), 47-64 (1997).
- Banat, I. M. Biosurfactants production and possible uses in microbial enhanced oil recovery and oil pollution remediation: a review. Bioresource Technology. 51 (1), 1-12 (1995).
- Singh, A., Van Hamme, J. D., Ward, O. P. Surfactants in microbiology and biotechnology: Part 2. Application aspects. Biotechnology Advances. 25 (1), 99-121 (2007).
- Shah, N., Nikam, R., Gaikwad, S., Sapre, V., Kaur, J. Biosurfactant: types, detection methods, importance and applications. Indian Journal of Microbiology Research. 3 (1), 5-10 (2016).
- McClements, D. J., Gumus, C. E. Natural emulsifiers-Biosurfactants, phospholipids, biopolymers, and colloidal particles: Molecular and physicochemical basis of functional performance. Advances in Colloid and Interface Science. 234, 3-26 (2016).
- Nguyen, T. T., Youssef, N. H., McInerney, M. J., Sabatini, D. A. Rhamnolipid biosurfactant mixtures for environmental remediation. Water Research. 42 (6-7), 1735-1743 (2008).
- Maier, R. M., Soberon-Chavez, G. Pseudomonas aeruginosa rhamnolipids: biosynthesis and potential applications. Applied Microbiology and Biotechnology. 54 (5), 625-633 (2000).
- Banat, I. M., Makkar, R. S., Cameotra, S. S. Potential commercial applications of microbial surfactants. Applied Microbiology and Biotechnology. 53 (5), 495-508 (2000).
- Mulugeta, K., Kamaraj, M., Tafesse, M., Aravind, J. A review on production, properties, and applications of microbial surfactants as a promising biomolecule for environmental applications. Strategies and Tools for Pollutant Mitigation: Avenues to a Cleaner Environment. , 3-28 (2021).
- Sharma, J., Sundar, D., Srivastava, P. Biosurfactants: Potential agents for controlling cellular communication, motility, and antagonism. Frontiers in Molecular Biosciences. 8, 727070 (2021).
- Vijayakumar, S., Saravanan, V. Biosurfactants-types, sources and applications. Research Journal of Microbiology. 10 (5), 181-192 (2015).
- Curiel-Maciel, N. F., et al. Characterization of enterobacter cloacae BAGM01 producing a thermostable and alkaline-tolerant rhamnolipid biosurfactant from the Gulf of Mexico. Marine Biotechnology. 23 (1), 106-126 (2021).
- Nikolova, C., Gutierrez, T. Biosurfactants and their applications in the oil and gas industry: current state of knowledge and future perspectives. Frontiers in Bioengineering and Biotechnology. 9, (2021).
- Rastogi, S., Tiwari, S., Ratna, S., Kumar, R. Utilization of agro-industrial waste for biosurfactant production under submerged fermentation and its synergistic application in biosorption of Pb2. Bioresource Technology Reports. 15, 100706 (2021).
- Zargar, A. N., Lymperatou, A., Skiadas, I., Kumar, M., Srivastava, P. Structural and functional characterization of a novel biosurfactant from Bacillus sp. IITD106. Journal of Hazardous Materials. 423, 127201 (2022).
- Adnan, M., et al. Functional and structural characterization of pediococcus pentosaceus-derived biosurfactant and its biomedical potential against bacterial adhesion, quorum sensing, and biofilm formation. Antibiotics. 10 (11), 1371 (2021).
- Du Nouy, P. L. A new apparatus for measuring surface tension. The Journal of General Physiology. 1 (5), 521-524 (1919).
- Akbari, S., Abdurahman, N. H., Yunus, R. M., Fayaz, F., Alara, O. R. Biosurfactants-a new frontier for social and environmental safety: a mini review. Biotechnology Research and Innovation. 2 (1), 81-90 (2018).
- Bicca, F. C., Fleck, L. C., Ayub, M. A. Z. Production of biosurfactant by hydrocarbon degrading Rhodococcus ruber and Rhodococcus erythropolis. Revista de Microbiologia. 30 (3), 231-236 (1999).
- Kuyukina, M. S., et al. Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction. Journal of Microbiological Methods. 46 (2), 149-156 (2001).
- Philp, J., et al. Alkanotrophic Rhodococcus ruber as a biosurfactant producer. Applied Microbiology and Biotechnology. 59 (2), 318-324 (2002).
- Mutalik, S. R., Vaidya, B. K., Joshi, R. M., Desai, K. M., Nene, S. N. Use of response surface optimization for the production of biosurfactant from Rhodococcus spp. MTCC 2574. Bioresource Technology. 99 (16), 7875-7880 (2008).
- Shavandi, M., Mohebali, G., Haddadi, A., Shakarami, H., Nuhi, A. Emulsification potential of a newly isolated biosurfactant-producing bacterium, Rhodococcus sp. strain TA6. Colloids and Surfaces B, Biointerfaces. 82 (2), 477-482 (2011).
- White, D., Hird, L., Ali, S. Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp., strain PML026. Journal of Applied Microbiology. 115 (3), 744-755 (2013).
- Najafi, A., et al. Interactive optimization of biosurfactant production by Paenibacillus alvei ARN63 isolated from an Iranian oil well. Colloids and Surfaces. B, Biointerfaces. 82 (1), 33-39 (2011).
- Bezza, F. A., Chirwa, E. M. N. Pyrene biodegradation enhancement potential of lipopeptide biosurfactant produced by Paenibacillus dendritiformis CN5 strain. Journal of Hazardous Materials. 321, 218-227 (2017).
- Jimoh, A. A., Lin, J. Biotechnological applications of Paenibacillus sp. D9 lipopeptide biosurfactant produced in low-cost substrates. Applied Biochemistry and Biotechnology. 191 (3), 921-941 (2020).
- Liang, T. -. W., et al. Exopolysaccharides and antimicrobial biosurfactants produced by Paenibacillus macerans TKU029. Applied Biochemistry and Biotechnology. 172 (2), 933-950 (2014).
- Mesbaiah, F. Z., et al. Preliminary characterization of biosurfactant produced by a PAH-degrading Paenibacillus sp. under thermophilic conditions. Environmental Science and Pollution Research. 23 (14), 14221-14230 (2016).
- Quinn, G. A., Maloy, A. P., McClean, S., Carney, B., Slater, J. W. Lipopeptide biosurfactants from Paenibacillus polymyxa inhibit single and mixed species biofilms. Biofouling. 28 (10), 1151-1166 (2012).
- Gudiña, E. J., et al. Novel bioemulsifier produced by a Paenibacillus strain isolated from crude oil. Microbial Cell Factories. 14 (1), 1-11 (2015).
- Pradhan, A. K., Pradhan, N., Sukla, L. B., Panda, P. K., Mishra, B. K. Inhibition of pathogenic bacterial biofilm by biosurfactant produced by Lysinibacillus fusiformis S9. Bioprocess and Biosystems Engineering. 37 (2), 139-149 (2014).
- Manchola, L., Dussán, J. Lysinibacillus sphaericus and Geobacillus sp biodegradation of petroleum hydrocarbons and biosurfactant production. Remediation Journal. 25 (1), 85-100 (2014).
- Bhardwaj, G., Cameotra, S. S., Chopra, H. K. Biosurfactant from Lysinibacillus chungkukjangi from rice bran oil sludge and potential applications. Journal of Surfactants and Detergents. 19 (5), 957-965 (2016).
- Gaur, V. K., et al. Rhamnolipid from a Lysinibacillus sphaericus strain IITR51 and its potential application for dissolution of hydrophobic pesticides. Bioresource Technology. 272, 19-25 (2019).
- Habib, S., et al. Production of lipopeptide biosurfactant by a hydrocarbon-degrading Antarctic Rhodococcus. International Journal of Molecular Sciences. 21 (17), 6138 (2020).
- Shao, P., Ma, H., Zhu, J., Qiu, Q. Impact of ionic strength on physicochemical stability of o/w emulsions stabilized by Ulva fasciata polysaccharide. Food Hydrocolloids. 69, 202-209 (2017).
- . Overview of DLVO theory Available from: https://archive-ouverte.unige.ch/unige:148595 (2014)
- Kazemzadeh, Y., Ismail, I., Rezvani, H., Sharifi, M., Riazi, M. Experimental investigation of stability of water in oil emulsions at reservoir conditions: Effect of ion type, ion concentration, and system pressure. Fuel. 243, 15-27 (2019).
- Chong, H., Li, Q. Microbial production of rhamnolipids: opportunities, challenges and strategies. Microbial Cell Factories. 16 (1), 1-12 (2017).
- Zeng, G., et al. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and Rhamnolipid, in liquid culture media and compost matrix. Biodegradation. 18 (3), 303-310 (2007).
- Liu, G., et al. Advances in applications of rhamnolipids biosurfactant in environmental remediation: a review. Biotechnology and Bioengineering. 115 (4), 796-814 (2018).
- John, W. C., Ogbonna, I. O., Gberikon, G. M., Iheukwumere, C. C. Evaluation of biosurfactant production potential of Lysinibacillus fusiformis MK559526 isolated from automobile-mechanic-workshop soil. Brazilian Journal of Microbiology. 52 (2), 663-674 (2021).
- Naing, K. W., et al. Isolation and characterization of an antimicrobial lipopeptide produced by Paenibacillus ehimensis MA2012. Journal of Basic Microbiology. 55 (7), 857-868 (2015).
- Wittgens, A., et al. Novel insights into biosynthesis and uptake of rhamnolipids and their precursors. Applied Microbiology and Biotechnology. 101 (7), 2865-2878 (2017).
- Rahman, K., Rahman, T. J., McClean, S., Marchant, R., Banat, I. M. Rhamnolipid biosurfactant production by strains of Pseudomonas aeruginosa using low-cost raw materials. Biotechnology Progress. 18 (6), 1277-1281 (2002).
- Bahia, F. M., et al. Rhamnolipids production from sucrose by engineered Saccharomyces cerevisiae. Scientific Reports. 8 (1), 1-10 (2018).
- Kim, C. H., et al. Desorption and solubilization of anthracene by a rhamnolipid biosurfactant from Rhodococcus fascians. Water Environment Research. 91 (8), 739-747 (2019).
- Nalini, S., Parthasarathi, R. Optimization of rhamnolipid biosurfactant production from Serratia rubidaea SNAU02 under solid-state fermentation and its biocontrol efficacy against Fusarium wilt of eggplant. Annals of Agrarian Science. 16 (2), 108-115 (2018).
- Wang, Q., et al. Engineering bacteria for production of rhamnolipid as an agent for enhanced oil recovery. Biotechnology and Bioengineering. 98 (4), 842-853 (2007).
- Câmara, J., Sousa, M., Neto, E. B., Oliveira, M. Application of rhamnolipid biosurfactant produced by Pseudomonas aeruginosa in microbial-enhanced oil recovery (MEOR). Journal of Petroleum Exploration and Production Technology. 9 (3), 2333-2341 (2019).
- Amani, H., Mehrnia, M. R., Sarrafzadeh, M. H., Haghighi, M., Soudi, M. R. Scale up and application of biosurfactant from Bacillus subtilis in enhanced oil recovery. Applied Biochemistry and Biotechnology. 162 (2), 510-523 (2010).
- Gudiña, E. J., et al. Bioconversion of agro-industrial by-products in rhamnolipids toward applications in enhanced oil recovery and bioremediation. Bioresource Technology. 177, 87-93 (2015).
- Sun, G., Hu, J., Wang, Z., Li, X., Wang, W. Dynamic investigation of microbial activity in microbial enhanced oil recovery (MEOR). Petroleum Science and Technology. 36 (16), 1265-1271 (2018).
- Jha, S. S., Joshi, S. J., SJ, G. Lipopeptide production by Bacillus subtilis R1 and its possible applications. Brazilian Journal of Microbiology. 47 (4), 955-964 (2016).
- Darvishi, P., Ayatollahi, S., Mowla, D., Niazi, A. Biosurfactant production under extreme environmental conditions by an efficient microbial consortium, ERCPPI-2. Colloids and Surfaces. B, Biointerfaces. 84 (2), 292-300 (2011).
- Al-Wahaibi, Y., et al. Biosurfactant production by Bacillus subtilis B30 and its application in enhancing oil recovery. Colloids and Surfaces. B, Biointerfaces. 114, 324-333 (2014).
- Moutinho, L. F., Moura, F. R., Silvestre, R. C., Romão-Dumaresq, A. S. Microbial biosurfactants: A broad analysis of properties, applications, biosynthesis, and techno-economical assessment of rhamnolipid production. Biotechnology Progress. 37 (2), 3093 (2021).
- Youssef, N., Simpson, D. R., McInerney, M. J., Duncan, K. E. In-situ lipopeptide biosurfactant production by Bacillus strains correlates with improved oil recovery in two oil wells approaching their economic limit of production. International Biodeterioration & Biodegradation. 81, 127-132 (2013).
- Ruckenstein, E., Nagarajan, R. Critical micelle concentration and the transition point for micellar size distribution. The Journal of Physical Chemistry. 85 (20), 3010-3014 (1981).
- de Araujo, L. L., et al. Microbial enhanced oil recovery using a biosurfactant produced by Bacillus safensis isolated from mangrove microbiota-Part I biosurfactant characterization and oil displacement test. Journal of Petroleum Science and Engineering. 180, 950-957 (2019).
- Banat, I. M., De Rienzo, M. A. D., Quinn, G. A. Microbial biofilms: biosurfactants as antibiofilm agents. Applied Microbiology and Biotechnology. 98 (24), 9915-9929 (2014).
- Klosowska-Chomiczewska, I., Medrzycka, K., Karpenko, E. Biosurfactants-biodegradability, toxicity, efficiency in comparison with synthetic surfactants. Research and Application of New Technologies in Wastewater Treatment and Municipal Solid Waste Disposal in Ukraine, Sweden, and Poland. 17, 141-149 (2013).
- Fernandes, P. A. V., et al. Antimicrobial activity of surfactants produced by Bacillus subtilis R14 against multidrug-resistant bacteria. Brazilian Journal of Microbiology. 38 (4), 704-709 (2007).
- Santos, D. K. F., Rufino, R. D., Luna, J. M., Santos, V. A., Sarubbo, L. A. Biosurfactants: multifunctional biomolecules of the 21st century. International Journal of Molecular Sciences. 17 (3), 401 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유