È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Recupero avanzato dell'olio utilizzando una combinazione di biotensioattivi
In questo articolo
Riepilogo
Illustriamo i metodi coinvolti nello screening e nell'identificazione dei microbi che producono biotensioattivi. Vengono inoltre presentati metodi per la caratterizzazione cromatografica e l'identificazione chimica dei biotensioattivi, determinando l'applicabilità industriale del biotensioattivo nel migliorare il recupero residuo dell'olio.
Abstract
I biotensioattivi sono composti tensioattivi in grado di ridurre la tensione superficiale tra due fasi di polarità diverse. I biotensioattivi stanno emergendo come alternative promettenti ai tensioattivi chimici a causa della minore tossicità, dell'elevata biodegradabilità, della compatibilità ambientale e della tolleranza a condizioni ambientali estreme. Qui illustriamo i metodi utilizzati per lo screening dei microbi in grado di produrre biotensioattivi. I microbi che producono biotensioattivi sono stati identificati utilizzando il collasso delle gocce, la diffusione dell'olio e i saggi dell'indice di emulsione. La produzione di biotensioattivi è stata convalidata determinando la riduzione della tensione superficiale del mezzo dovuta alla crescita dei membri microbici. Descriviamo anche i metodi coinvolti nella caratterizzazione e identificazione dei biotensioattivi. La cromatografia su strato sottile del biotensioattivo estratto seguita da colorazione differenziale delle piastre è stata eseguita per determinare la natura del biotensioattivo. LCMS, 1H NMR e FT-IR sono stati utilizzati per identificare chimicamente il biotensioattivo. Illustriamo inoltre i metodi per valutare l'applicazione della combinazione di biotensioattivi prodotti per migliorare il recupero dell'olio residuo in una colonna di sabbia simulata.
Introduzione
I biotensioattivi sono le molecole anfipatiche tensioattive prodotte da microrganismi che hanno la capacità di ridurre la superficie e la tensione interfacciale tra due fasi1. Un tipico biotensioattivo contiene una parte idrofila che di solito è composta da una porzione di zucchero o una catena peptidica o amminoacido idrofilo e una parte idrofobica costituita da una catena di acidi grassi saturi o insaturi2. A causa della loro natura anfipatica, i biotensioattivi si assemblano all'interfaccia tra le due fasi e riducono la tensione interfacciale al confine, il che facilita la dispersione di una fase nell'altra 1,3. Vari tipi di biotensioattivi che sono stati segnalati finora includono glicolipidi in cui i carboidrati sono legati agli acidi alifatici o idrossi-alifatici a catena lunga tramite legami estere (ad esempio, ramnolipidi, trealolipidi e soforolipidi), lipopeptidi in cui i lipidi sono attaccati a catene polipeptidiche (ad esempio, tensioattivi e lichenisina) e biotensioattivi polimerici che di solito sono composti da complessi polisaccaridici-proteici (ad esempio, emulsan, liposan, alasan e lipomannan)4. Altri tipi di biotensioattivi prodotti dai microrganismi includono acidi grassi, fosfolipidi, lipidi neutri e biotensioattivi particolati5. La classe di biotensioattivi più studiata è quella dei glicolipidi e tra questi la maggior parte degli studi sono stati riportati sui ramnolipidi6. I ramnolipidi contengono una o due molecole di ramnosio (che formano la parte idrofila) legate a una o due molecole di acido grasso a catena lunga (di solito acido idrossi-decanoico). I ramnolipidi sono glicolipidi primari riportati per primi da Pseudomonas aeruginosa7.
I biotensioattivi stanno guadagnando sempre più attenzione rispetto alle loro controparti chimiche a causa di varie proprietà uniche e distintive che offrono8. Questi includono maggiore specificità, minore tossicità, maggiore diversità, facilità di preparazione, maggiore biodegradabilità, migliore formazione di schiuma, compatibilità ambientale e attività in condizioni estreme9. La diversità strutturale dei biotensioattivi (Figura S1) è un altro vantaggio che dà loro un vantaggio rispetto alle controparti chimiche10. Sono generalmente più efficaci ed efficienti a concentrazioni più basse poiché la loro concentrazione critica di micelle (CMC) è di solito parecchie volte inferiore ai tensioattivi chimici11. È stato segnalato che sono altamente termostabili (fino a 100 °C) e possono tollerare pH più elevati (fino a 9) e alte concentrazioni di sale (fino a 50 g/L)12 offrono quindi diversi vantaggi nei processi industriali, che richiedono l'esposizione a condizioni estreme13. La biodegradabilità e la minore tossicità li rendono adatti per applicazioni ambientali come il biorisanamento. A causa dei vantaggi che offrono, hanno ricevuto maggiore attenzione in vari settori come l'industria alimentare, agricola, dei detergenti, cosmetica e petrolifera11. I biotensioattivi hanno anche guadagnato molta attenzione nella bonifica del petrolio per la rimozione di contaminanti petroliferi e inquinanti tossici14.
Qui riportiamo la produzione, la caratterizzazione e l'applicazione di biotensioattivi prodotti da Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 e Paenibacillus sp. IITD108. I passaggi coinvolti nello screening, nella caratterizzazione e nell'applicazione di una combinazione di biotensioattivi per un migliore recupero dell'olio sono descritti nella Figura 1.
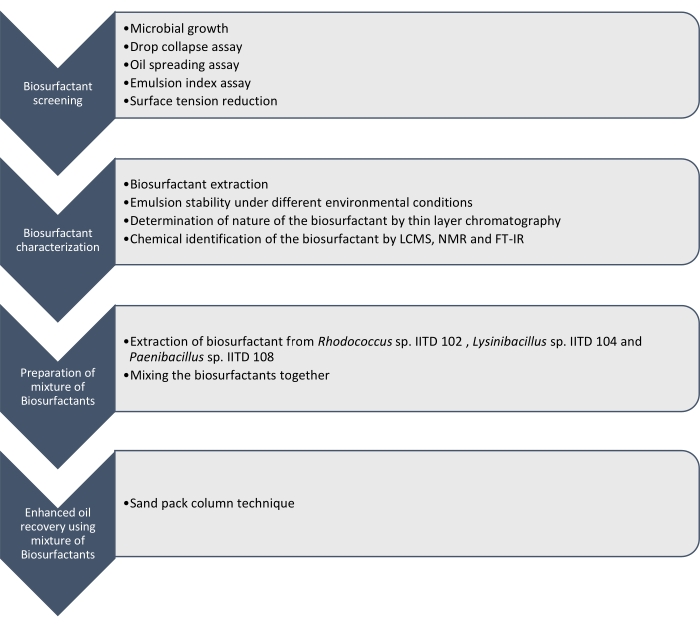
Figura 1: Un metodo per un migliore recupero dell'olio utilizzando una combinazione di biotensioattivi. Viene mostrato il flusso di lavoro graduale. Il lavoro è stato eseguito in quattro fasi. In primo luogo i ceppi microbici sono stati coltivati e sottoposti a screening per la produzione di biotensioattivi mediante vari saggi, che includevano il saggio di collasso delle gocce, il saggio di diffusione dell'olio, il saggio dell'indice di emulsione e la misurazione della tensione superficiale. Quindi, i biotensioattivi sono stati estratti dal brodo privo di cellule e la loro natura è stata identificata utilizzando la cromatografia a strato sottile e sono stati ulteriormente identificati utilizzando LCMS, NMR e FT-IR. Nella fase successiva, i biotensioattivi estratti sono stati miscelati insieme e il potenziale della miscela risultante per un migliore recupero dell'olio è stato determinato utilizzando la tecnica della colonna di sabbia. Fare clic qui per visualizzare una versione più grande di questa figura.
Lo screening di questi ceppi microbici per produrre biotensioattivi è stato effettuato mediante collasso delle gocce, diffusione dell'olio, saggio dell'indice di emulsione e determinazione della riduzione della tensione superficiale del mezzo privo di cellule a causa della crescita dei microbi. I biotensioattivi sono stati estratti, caratterizzati e identificati chimicamente da LCMS, 1H NMR e FT-IR. Infine, è stata preparata una miscela di biotensioattivi prodotti da questi microbi ed è stata utilizzata per recuperare l'olio residuo in una colonna di sabbia simulata.
Il presente studio illustra solo i metodi coinvolti nello screening, nell'identificazione, nella caratterizzazione strutturale e nell'applicazione della combinazione di biotensioattivi per migliorare il recupero dell'olio residuo. Non fornisce una caratterizzazione funzionale dettagliata dei biotensioattivi prodotti dai ceppi microbici15,16. Vari esperimenti come la determinazione critica delle micelle, l'analisi termogravimetrica, la bagnabilità superficiale e la biodegradabilità vengono eseguiti per la caratterizzazione funzionale dettagliata di qualsiasi biotensioattivo. Ma poiché questo documento è un documento di metodi, l'attenzione si concentra sullo screening, l'identificazione, la caratterizzazione strutturale e l'applicazione della combinazione di biotensioattivi per migliorare il recupero dell'olio residuo; questi esperimenti non sono stati inclusi in questo studio.
Protocollo
1. Crescita di ceppi microbici
- Pesare 2 g di Luria Brodo in polvere e aggiungere a 50 ml di acqua distillata in un matraccio conico da 250 ml. Mescolare il contenuto fino a quando la polvere si dissolve completamente e portare il volume a 100 ml utilizzando acqua distillata.
- Allo stesso modo, preparare altri due palloni da 100 ml di brodo di Luria e posizionare tappi di cotone sul collo dei palloni.
- Coprire i tappi di cotone con un foglio di alluminio e autoclave i palloni per 15 minuti a 121 °C e 15 psi per sterilizzare il supporto.
- Dopo l'autoclave, lasciare raffreddare il fluido a temperatura ambiente.
- Per la preparazione della coltura primaria di un ceppo, prelevare una singola colonia da una piastra laica utilizzando un ciclo di inoculazione e inoculare in una provetta contenente 5 ml di brodo di Luria sterile.
- Incubare la provetta durante la notte a 30 °C a 180 giri/min.
- Inoculare i palloni contenenti 100 mL di brodo di Luria autoclavato aggiungendo 1 mL di colture di semi coltivate durante la notte ai palloni all'interno dell'armadio a flusso d'aria laminare.
- Incubare i palloni in un incubatore rotativo a 30 °C e 180 giri/min per 7 giorni.
- Dopo il completamento del periodo di incubazione, raccogliere i palloni e trasferire il brodo di coltura nei tubi della centrifuga. Centrifugare la coltura a 4.500 x g per 20 min in una centrifuga refrigerata a 4 °C.
- Versare delicatamente il surnatante privo di cellule in un becher fresco e utilizzarlo nei saggi di screening per la produzione di biotensioattivi.
2. Saggi di screening per la produzione di biotensioattivi
NOTA: Nelle sezioni seguenti, il tensioattivo commerciale (Saponina) è stato utilizzato come controllo positivo mentre l'acqua e i mezzi non vaccinati sono stati utilizzati come controllo negativo.
- Analisi di compressione delle gocce
- Prendere un vetrino pulito e rivestire la superficie del vetrino con 200 μL di olio.
- Aggiungere 20 μL del surnatante libero da cellule al centro dell'olio e lasciarlo indisturbato per 2-3 minuti.
NOTA: se la goccia collassa, segnare il surnatante positivo per la presenza di biotensioattivo.
- Saggio di diffusione dell'olio
- Prendere 20 ml di acqua doppia distillata in una piastra di Petri (diametro 75 mm) e aggiungere 200 μL di petrolio greggio alla superficie dell'acqua.
- Aggiungere 20 μL di surnatante libero da cellule al centro dell'olio e lasciarlo indisturbato per 1 minuto.
NOTA: se si forma una zona di compensazione a causa dello spostamento dell'olio, assegnare un punteggio positivo al surnatante per la presenza del biotensioattivo.
- Saggio dell'indice di emulsione (saggio E24 )
- Aggiungere 4 ml di benzina (benzina) e surnatante senza celle ciascuno in una provetta di vetro pulita.
- Ruotare vigorosamente la miscela per 3 minuti e lasciarla indisturbata per le successive 24 ore.
- Dopo 24 ore, determinare l'indice E24 in percentuale dell'altezza dello strato emulsionato (cm) rispetto all'altezza dell'intera colonna liquida (cm).
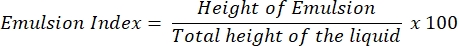
NOTA: Se si osserva un'emulsione (olio in acqua o acqua in olio) dopo 24 ore, è probabile che il surnatante contenga il biotensioattivo.
- Misurazione della tensione superficiale
NOTA: La tensione superficiale è stata misurata utilizzando il metodo dell'anello du Noüy17. Lo strumento utilizzato in questo esperimento (vedi Tabella dei materiali) è molto sensibile, quindi garantire una corretta pulizia del recipiente di vetro e della sonda.- Accendere il sistema e fare doppio clic sul software associato per aprirlo.
- Pulire il recipiente di vetro con il liquido la cui tensione superficiale deve essere determinata.
- Aggiungere il liquido (40 ml) nel recipiente e montare il recipiente sul portasciuga.
- Sblocca il supporto della sonda e monta la sonda su di esso. Ora blocca il supporto della sonda premendo il pulsante Di blocco sul controller manuale.
- Utilizzando il controller manuale, regolare l'altezza della piattaforma in modo che la sonda sia a circa 2-3 mm di distanza dalla superficie del liquido.
- Ora usa il software per misurare la tensione superficiale. Fai clic su File situato nel pannello in alto a sinistra dello schermo. Fare clic su Apri area di lavoro. Apparirà una finestra pop-up.
- Scorrere verso il basso e fare doppio clic sull'icona K100: Superficie e tensione interfacciale .
- Ora, fai clic sull'icona File situata nell'angolo in alto a sinistra dello schermo. Fare clic su Nuovo database. Immettere il nome per il salvataggio dei dati e fare clic su OK.
- Ancora una volta, fare clic su File > nuova misurazione > anello di > SFT. Immettere il nome della misurazione. Assicurarsi che il modello di configurazione mostri l'anello SFT.
- Inserire i dettagli nella finestra Configurazione misurazione selezionando la sonda e il recipiente utilizzato per la misurazione. Inoltre, inserisci i dettagli del liquido e della fase gassosa.
NOTA: La fase liquida sarà acqua, mentre la fase gassosa sarà aria. La densità della fase liquida è la densità del surnatante libero da cellule. Questo può essere determinato prendendo il peso di 50 ml del liquido e calcolando la densità come Kg/m3. - Ora fai clic sulla scheda Procedura e inserisci i seguenti dettagli: Velocità di rilevamento: 6 mm / min, Sensibilità di rilevamento: 0,005 g, Velocità di ricerca: 6 mm / min, Sensibilità di ricerca: 0,005 g, Velocità di misurazione: 3 mm / min, Sensibilità di misurazione: 0,001 g, Profondità di immersione: 3 mm, Distanza di ritorno: 10%, correzione: Harkins & Jordan, valori massimi: 5. Fare clic su OK.
- Nella finestra pop-up, selezionare il database in cui memorizzare i dati e fare clic su OK.
NOTA: è possibile creare un nuovo database qui o aggiungere nuove misurazioni ai dati esistenti. - Ora fai clic sul pulsante Riproduci situato nella parte superiore centrale dello schermo. Il sistema inizierà a eseguire lo script. Dopo che il sistema si è stabilizzato, rileverà la superficie. Immergere la sonda nel liquido, spostare la sonda avanti e indietro e rilevare la tensione nella lamella formata.
- Per ottenere i risultati, fare clic sull'icona Misurazione nella parte centrale sinistra dello schermo. Fare clic su Dati e annotare la tensione superficiale determinata.
- Dopo aver completato la misurazione, abbassare l'altezza della piattaforma e sbloccare e smontare la sonda e la nave dallo strumento.
NOTA: per determinare la diminuzione della tensione superficiale dovuta alla produzione di biotensioattivi, il LB non inoculato deve essere utilizzato come controllo.
3. Estrazione di biotensioattivi
- Regolare il pH del surnatante libero da cellule a 2 utilizzando 2 N HCl. Conservare la miscela a 4 °C durante la notte.
- Aggiungere lo stesso volume della miscela cloroformio-metanolo (2:1) al surnatante e mescolare vigorosamente per 20 minuti.
- Lasciare la miscela indisturbata affinché si verifichi la separazione di fase.
- Rimuovere la fase superiore contenente acqua e metanolo e lasciare evaporare la fase inferiore contenente il biotensioattivo in una cappa aspirante.
- Dopo l'evaporazione della fase organica, ridistribuire il biotensioattivo grezzo color miele in 3 ml di cloroformio e utilizzare questa miscela per un'ulteriore identificazione e caratterizzazione del biotensioattivo.
4. Studi di stabilità delle emulsioni
-
Stabilità dell'emulsione a diverse temperature
- Prendi 5 ml di supernatanti privi di cellule in diverse provette.
- Aggiungere 5 ml di benzina a ciascuna provetta e mescolare vigorosamente vorticosamente per 3 minuti.
- Incubare le provette durante la notte in diversi bagni d'acqua a diverse temperature (30 °C, 40 °C, 50 °C, 60 °C e 70 °C).
- Dopo 24 ore, stimare gli indici di emulsione come menzionato in precedenza.
-
Stabilità dell'emulsione a diversi valori di pH
- Prendere 5 ml di surnatante libero da cellule in provette pulite.
- Regolare il pH dei supernatanti liberi da cellule (2, 4, 6, 8 e 10) utilizzando 1 N HCl e 1 N NaOH.
- Aggiungere una quantità uguale di benzina alle provette e mescolare vigorosamente ruotando per 3 minuti.
- Lasciare le provette indisturbate a temperatura ambiente per 24 ore.
- Stimare l'indice di emulsione come accennato in precedenza.
-
Stabilità dell'emulsione a diverse concentrazioni saline
- Prendere 5 ml di surnatante libero da cellule in provette pulite.
- Aggiungere diverse quantità di sale (NaCl) ai supernatanti (0 g/L, 5 g/L, 10 g/L, 20 g/L, 60 g/L e 80 g/L).
- Sciogliere i sali nei supernatanti liberi da cellule vorticosamente per 3 minuti.
- Aggiungere una quantità uguale di benzina alle provette e mescolare vigorosamente ruotando per 3 minuti.
- Lasciare le provette indisturbate a temperatura ambiente per 24 ore.
- Stimare l'indice di emulsione dopo 24 ore.
5. Determinazione della natura del biotensioattivo
-
TLC del biotensioattivo estratto
- Spot 20 μL dei biotensioattivi su piastre TLC. Spot 2 μL contemporaneamente.
- Individua i biotensioattivi su tre diverse piastre TLC.
- Preparare una miscela da 100 ml dell'eluente contenente cloroformio:metanolo (2:1) e aggiungere l'eluente alla camera TLC. Chiudere il coperchio della camera e lasciarlo saturare per 20 minuti.
- Dopo aver asciugato le piastre, posizionare le piastre TLC all'interno della camera sature di una miscela di metanolo cloroformio ed eseguire la TLC.
- Dopo che l'eluente ha raggiunto la parte superiore della piastra TLC (1 cm di distanza dalla parte superiore), estrarre le piastre e lasciarle asciugare all'aria.
-
Colorazione per il rilevamento dei lipidi
- Prendi una camera TLC pulita e aggiungi alcuni (5-10) granuli di iodio nella camera fresca e satura la camera per 5-10 minuti.
- Posizionare la piastra TLC all'interno della camera e osservare lo sviluppo delle macchie gialle. Se compaiono le macchie, segnare il biotensioattivo positivo per la presenza della componente lipidica.
-
Colorazione per il rilevamento di peptidi o amminoacidi
- Preparare una soluzione di ninidrina sciogliendo 0,4 g di ninidrina in 20 ml di butanolo. Aggiungere 0,6 ml di acido acetico glaciale al 100% alla miscela.
- Spruzzare la piastra TLC con soluzione di ninidrina e lasciarla asciugare all'aria per 2 minuti. Riscaldare la piastra a 110 °C e osservare lo sviluppo del colore.
NOTA: Se compaiono le macchie blu, assegnare un punteggio positivo al biotensioattivo per la presenza di qualsiasi catena peptidica o amminoacido.
-
Colorazione per il rilevamento dei carboidrati
- Preparare una soluzione di p-anisaldeide aggiungendo 2 ml di p-anisaldeide a 48 ml di acido acetico glaciale contenente 1 mL di H2SO4. Aggiungere 0,6 ml di acido acetico alla miscela.
- Spruzzare uniformemente la miscela su una piastra TLC e lasciarla asciugare all'aria per 2 minuti.
- Incubare la piastra a 110 °C e monitorare lo sviluppo delle macchie.
NOTA: Se compaiono le macchie verdi o marroni, segnare il biotensioattivo positivo per la presenza di eventuali carboidrati.
6. Identificazione chimica del biotensioattivo
- LCMS del biotensioattivo
- Sciogliere 25 mg del biotensioattivo estratto in 1 mL di cloroformio.
- Eseguire LCMS (in una configurazione di blocco spray con una frequenza di scansione di riferimento di 10 s) utilizzando una colonna C18.
- Utilizzare cloroformio:metanolo (1:1) come fase mobile e iniettare 2 μL del campione nella colonna ad una portata di 0,1 ml/min.
- Impostare i parametri sperimentali su: polarità: ES positivo, tensione capillare: 3 kV, temperatura sorgente: 80 °C, temperatura di desolvazione: 300 °C, portata gas di desolvazione: 7.000 L/h e portata gas trappola: 0,40 ml/min.
- Scansiona gli intervalli da 100 a 1.200 Da durante un tempo di rilevamento di 20 minuti e osserva gli ioni in modalità ES positiva.
- Analizza i valori m/z utilizzando qualsiasi software quantitativo di spettrometria di massa.
- Per l'analisi, accedere al software.
- Clicca su Batch Search ed entra nell'elenco delle masse ottenute. Esamina i risultati in una modalità di carica positiva e usa M + H e M + Na come addotti. Mantenere la precisione a 10 PPM e spuntare su Struttura di visualizzazione.
- Clicca su Cerca e dall'elenco dei composti, seleziona quello con il livello PPM più basso.
- 1 H NMR del biotensioattivo
NOTA: 1H NMR del biotensioattivo è stato eseguito utilizzando uno spettrometro NMR a 400 MHz (vedi Tabella dei materiali).- Sciogliere 5 mg del biotensioattivo in 1 mL di cloroformio deuterato (CdCl3).
- Trasferire la miscela in un tubo NMR. Tappare correttamente il tubo e inserire il tubo nella chiave inglese. Regolare l'altezza del tubo utilizzando il tubo regolatore.
- Posizionare il tubo insieme alla chiave nella macchina NMR e seguire i passaggi indicati di seguito per ottenere uno spettro NMR.
- Per selezionare il tipo di provetta campione: sx N, dove N è la posizione in cui è stato posizionato il tubo (ad esempio, sx 13, se il tubo è stato posizionato nella13a posizione) nel software associato.
- Digitare edc e premere Invio per creare una nuova cartella in cui è possibile archiviare i dati.
- Apparirà un pop-up. Selezionare il solvente cliccando su CdCl 3 nell'elenco e inserire il nome del campione.
- Per avviare il protocollo, digitare "getprosol"; per bloccare il solvente, digitare "lock cdcl3".
- Digitare "topshim" per eseguire lo shim del campione e infine digitare "rga;zgefp" per acquisire i dati. Questo avvierà il protocollo.
- Dopo aver ottenuto gli spettri, digitare "apk;abs n" e premere invio per la correzione di fase e di base.
- Per selezionare i picchi primari, digitare "pp" e premere Invio. Per selezionare solo picchi intensi, inserisci "mi" e digita l'intensità sopra la quale devono essere selezionati i picchi. Il valore predefinito sarà 0.2.
- Per integrare i picchi, fare clic su Integra e posizionare il cursore sul lato sinistro del picco da integrare e tenendo premuto il cursore fare clic e trascinare il cursore attorno al picco.
- Salva i dati facendo clic su File nell'angolo in alto a sinistra, quindi fai clic su Salva.
- Il campione può essere espulso dalla macchina digitando "sx ej".
- Analizzare i picchi e determinare l'ambiente degli atomi H.
- Spettroscopia infrarossa a trasformata di Fourier del biotensioattivo
NOTA: FT-IR del biotensioattivo estratto è stato eseguito utilizzando uno spettrofotometro disponibile in commercio in modalità ATR (vedi Tabella dei materiali).- Accendere lo spettrofotometro e controllare lo spurgo, l'essiccante e il rilevatore.
- Per raccogliere uno spettro, prima raccogli lo spettro di fondo senza un campione in posizione.
- Prendere il biotensioattivo estratto e asciugarlo completamente. Posizionare il biotensioattivo essiccato direttamente sul cristallo diamantato, esercitare pressione e premere il punto di contatto ATR.
- Nel software, selezionare il numero delle scansioni (inserire 30) e scansionare lo spettro da 400 cm-1 a 4.000 cm-1.
- Fare clic su OK per aggiungere lo spettro del campione alla finestra spettrale.
- Fare clic su File > Salva > Salva con nome e immettere il nome del file seguito dall'estensione .spa e fare clic su OK.
7. Applicazione di biotensioattivi (recupero avanzato dell'olio)
NOTA: In questo esperimento, l'acqua a doppia distillazione è stata utilizzata come controllo negativo e il 10% di SDS, il 10% di Tween 80 e il 10% di saponina commerciale sono stati utilizzati come controlli positivi.
- Prendi il vetro e sigilla l'uscita inferiore con lana di vetro e perline di vetro.
- Imballare la colonna con terreno sabbioso in modo tale che un po 'di liquido possa essere aggiunto nella parte superiore del terreno e il flusso attraverso possa essere raccolto nella parte inferiore. Montare la colonna sul supporto e aggiungere alcune perle di vetro sulla parte superiore del terreno.
- Inondare la colonna con 50 ml di soluzione di salamoia e raccogliere il flusso per determinare il volume dei pori.
volume dei pori = volume di salamoia aggiunto sulla parte superiore - volume di flusso attraverso raccolto. - Rimuovere la salamoia dalla colonna costringendo il petrolio greggio a passarci attraverso di essa dopo averla aggiunta dalla parte superiore della colonna. Raccogliere il volume della salamoia e dell'olio che escono dalla colonna per determinare il volume iniziale di saturazione dell'olio. Il volume della salamoia rilasciato dalla colonna sarà il volume iniziale di saturazione dell'olio o l'olio originale in posizione.
- Lasciare la colonna indisturbata per 24 ore.
- Dopo 24 ore, inondare la colonna con 10 volumi di pori di salamoia e raccogliere l'olio che esce dalla colonna per stimare il recupero secondario dell'olio. L'olio lasciato nella colonna dopo il recupero secondario dell'olio corrisponde all'olio residuo.
- Preparare una miscela di biotensioattivi aggiungendo volumi uguali del biotensioattivo estratto (estratto dopo la fase 3.5) al becher di vetro. Aggiungere i biotensioattivi nella parte superiore della colonna e incubare la colonna per 24 ore.
- Dopo 24 ore, misurare la quantità di olio e acqua per determinare un recupero dell'olio aggiuntivo o migliorato. Il volume dell'olio rilasciato dalla colonna corrisponderà all'olio residuo recuperato.
- Stimare il recupero dell'olio migliorato con la seguente equazione:
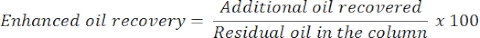
Risultati
Tre ceppi batterici (Rhodococcus sp. IITD102, Lysinibacillus sp. IITD104 e Paenibacillus sp. IITD108) sono stati sottoposti a screening per la produzione di biotensioattivi mediante vari saggi, tra cui il test di collasso delle gocce, il saggio di spostamento dell'olio, il saggio dell'indice di emulsione e la riduzione della tensione superficiale. I supernatanti privi di cellule di tutti e tre i ceppi batterici e una soluzione di tensioattivo chimico hanno provocato un collasso delle gocce e, p...
Discussione
I biotensioattivi sono uno dei gruppi più versatili di componenti biologicamente attivi che stanno diventando alternative interessanti ai tensioattivi chimici. Hanno una vasta gamma di applicazioni in numerosi settori come detergenti, vernici, cosmetici, alimenti, prodotti farmaceutici, agricoltura, petrolio e trattamento delle acque grazie alla loro migliore bagnabilità, CMC inferiore, struttura diversificata e compatibilità ambientale18. Ciò ha portato a un maggiore interesse per la scoperta...
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Gli autori desiderano ringraziare il Dipartimento di Biotecnologie, Governo dell'India, per il sostegno finanziario.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 ml pipette | Eppendorf, Germany | G54412G | |
| 1H NMR | Bruker Avance AV-III type spectrometer,USA | ||
| 20 ul pipette | Thermo scientific, USA | H69820 | |
| Autoclave | JAISBO, India | Ser no 5923 | Jain Scientific |
| Blue flame burner | Rocker scientific, Taiwan | dragon 200 | |
| Butanol | GLR inovations, India | GLR09.022930 | |
| C18 column | Agilent Technologies, USA | 770995-902 | |
| Centrifuge | Eppendorf, Germany | 5810R | |
| Chloroform | Merck, India | 1.94506.2521 | |
| Chloroform-d | SRL, India | 57034 | |
| Falcon tubes | Tarsons, India | 546041 | Radiation sterilized polypropylene |
| FT-IR | Thermo Fisher Scientific, USA | Nicolet iS50 | |
| Fume hood | Khera, India | 47408 | Customied |
| glacial acetic acid | Merck, India | 1.93002 | |
| Glass beads | Merck, India | 104014 | |
| Glass slides | Polar industrial Corporation, USA | Blue Star | 75 mm * 25 mm |
| Glass wool | Merk, India | 104086 | |
| Hydrochloric acid | Merck, India | 1003170510 | |
| Incubator | Thermo Scientific, USA | MaxQ600 | Shaking incubator |
| Incubator | Khera, India | Sunbim | |
| Iodine resublimed | Merck, India | 231-442-4 | resublimed Granules |
| K12 –Kruss tensiometer | Kruss Scientific, Germany | K100 | |
| Laminar air flow cabnet | Thermo Scientific, China | 1300 Series A2 | |
| LCMS | Agilent Technologies, USA | 1260 Infinity II | |
| Luria Broth | HIMEDIA, India | M575-500G | Powder |
| Methanol | Merck, India | 107018 | |
| Ninhydrin | Titan Biotech Limited, India | 1608 | |
| p- anisaldehyde | Sigma, USA | 204-602-6 | |
| Petri plate | Tarsons, India | 460090-90 MM | Radiation sterilized polypropylene |
| Saponin | Merck, India | 232-462-6 | |
| Sodium chloride | Merck, India | 231-598-3 | |
| Test tubes | Borosil, India | 9800U06 | Glass tubes |
| TLC plates | Merck, India | 1055540007 | |
| Vortex | GeNei, India | 2006114318 | |
| Water Bath | Julabo, India | SW21C |
Riferimenti
- Desai, J. D., Banat, I. M. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews. 61 (1), 47-64 (1997).
- Banat, I. M. Biosurfactants production and possible uses in microbial enhanced oil recovery and oil pollution remediation: a review. Bioresource Technology. 51 (1), 1-12 (1995).
- Singh, A., Van Hamme, J. D., Ward, O. P. Surfactants in microbiology and biotechnology: Part 2. Application aspects. Biotechnology Advances. 25 (1), 99-121 (2007).
- Shah, N., Nikam, R., Gaikwad, S., Sapre, V., Kaur, J. Biosurfactant: types, detection methods, importance and applications. Indian Journal of Microbiology Research. 3 (1), 5-10 (2016).
- McClements, D. J., Gumus, C. E. Natural emulsifiers-Biosurfactants, phospholipids, biopolymers, and colloidal particles: Molecular and physicochemical basis of functional performance. Advances in Colloid and Interface Science. 234, 3-26 (2016).
- Nguyen, T. T., Youssef, N. H., McInerney, M. J., Sabatini, D. A. Rhamnolipid biosurfactant mixtures for environmental remediation. Water Research. 42 (6-7), 1735-1743 (2008).
- Maier, R. M., Soberon-Chavez, G. Pseudomonas aeruginosa rhamnolipids: biosynthesis and potential applications. Applied Microbiology and Biotechnology. 54 (5), 625-633 (2000).
- Banat, I. M., Makkar, R. S., Cameotra, S. S. Potential commercial applications of microbial surfactants. Applied Microbiology and Biotechnology. 53 (5), 495-508 (2000).
- Mulugeta, K., Kamaraj, M., Tafesse, M., Aravind, J. A review on production, properties, and applications of microbial surfactants as a promising biomolecule for environmental applications. Strategies and Tools for Pollutant Mitigation: Avenues to a Cleaner Environment. , 3-28 (2021).
- Sharma, J., Sundar, D., Srivastava, P. Biosurfactants: Potential agents for controlling cellular communication, motility, and antagonism. Frontiers in Molecular Biosciences. 8, 727070 (2021).
- Vijayakumar, S., Saravanan, V. Biosurfactants-types, sources and applications. Research Journal of Microbiology. 10 (5), 181-192 (2015).
- Curiel-Maciel, N. F., et al. Characterization of enterobacter cloacae BAGM01 producing a thermostable and alkaline-tolerant rhamnolipid biosurfactant from the Gulf of Mexico. Marine Biotechnology. 23 (1), 106-126 (2021).
- Nikolova, C., Gutierrez, T. Biosurfactants and their applications in the oil and gas industry: current state of knowledge and future perspectives. Frontiers in Bioengineering and Biotechnology. 9, (2021).
- Rastogi, S., Tiwari, S., Ratna, S., Kumar, R. Utilization of agro-industrial waste for biosurfactant production under submerged fermentation and its synergistic application in biosorption of Pb2. Bioresource Technology Reports. 15, 100706 (2021).
- Zargar, A. N., Lymperatou, A., Skiadas, I., Kumar, M., Srivastava, P. Structural and functional characterization of a novel biosurfactant from Bacillus sp. IITD106. Journal of Hazardous Materials. 423, 127201 (2022).
- Adnan, M., et al. Functional and structural characterization of pediococcus pentosaceus-derived biosurfactant and its biomedical potential against bacterial adhesion, quorum sensing, and biofilm formation. Antibiotics. 10 (11), 1371 (2021).
- Du Nouy, P. L. A new apparatus for measuring surface tension. The Journal of General Physiology. 1 (5), 521-524 (1919).
- Akbari, S., Abdurahman, N. H., Yunus, R. M., Fayaz, F., Alara, O. R. Biosurfactants-a new frontier for social and environmental safety: a mini review. Biotechnology Research and Innovation. 2 (1), 81-90 (2018).
- Bicca, F. C., Fleck, L. C., Ayub, M. A. Z. Production of biosurfactant by hydrocarbon degrading Rhodococcus ruber and Rhodococcus erythropolis. Revista de Microbiologia. 30 (3), 231-236 (1999).
- Kuyukina, M. S., et al. Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction. Journal of Microbiological Methods. 46 (2), 149-156 (2001).
- Philp, J., et al. Alkanotrophic Rhodococcus ruber as a biosurfactant producer. Applied Microbiology and Biotechnology. 59 (2), 318-324 (2002).
- Mutalik, S. R., Vaidya, B. K., Joshi, R. M., Desai, K. M., Nene, S. N. Use of response surface optimization for the production of biosurfactant from Rhodococcus spp. MTCC 2574. Bioresource Technology. 99 (16), 7875-7880 (2008).
- Shavandi, M., Mohebali, G., Haddadi, A., Shakarami, H., Nuhi, A. Emulsification potential of a newly isolated biosurfactant-producing bacterium, Rhodococcus sp. strain TA6. Colloids and Surfaces B, Biointerfaces. 82 (2), 477-482 (2011).
- White, D., Hird, L., Ali, S. Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp., strain PML026. Journal of Applied Microbiology. 115 (3), 744-755 (2013).
- Najafi, A., et al. Interactive optimization of biosurfactant production by Paenibacillus alvei ARN63 isolated from an Iranian oil well. Colloids and Surfaces. B, Biointerfaces. 82 (1), 33-39 (2011).
- Bezza, F. A., Chirwa, E. M. N. Pyrene biodegradation enhancement potential of lipopeptide biosurfactant produced by Paenibacillus dendritiformis CN5 strain. Journal of Hazardous Materials. 321, 218-227 (2017).
- Jimoh, A. A., Lin, J. Biotechnological applications of Paenibacillus sp. D9 lipopeptide biosurfactant produced in low-cost substrates. Applied Biochemistry and Biotechnology. 191 (3), 921-941 (2020).
- Liang, T. -. W., et al. Exopolysaccharides and antimicrobial biosurfactants produced by Paenibacillus macerans TKU029. Applied Biochemistry and Biotechnology. 172 (2), 933-950 (2014).
- Mesbaiah, F. Z., et al. Preliminary characterization of biosurfactant produced by a PAH-degrading Paenibacillus sp. under thermophilic conditions. Environmental Science and Pollution Research. 23 (14), 14221-14230 (2016).
- Quinn, G. A., Maloy, A. P., McClean, S., Carney, B., Slater, J. W. Lipopeptide biosurfactants from Paenibacillus polymyxa inhibit single and mixed species biofilms. Biofouling. 28 (10), 1151-1166 (2012).
- Gudiña, E. J., et al. Novel bioemulsifier produced by a Paenibacillus strain isolated from crude oil. Microbial Cell Factories. 14 (1), 1-11 (2015).
- Pradhan, A. K., Pradhan, N., Sukla, L. B., Panda, P. K., Mishra, B. K. Inhibition of pathogenic bacterial biofilm by biosurfactant produced by Lysinibacillus fusiformis S9. Bioprocess and Biosystems Engineering. 37 (2), 139-149 (2014).
- Manchola, L., Dussán, J. Lysinibacillus sphaericus and Geobacillus sp biodegradation of petroleum hydrocarbons and biosurfactant production. Remediation Journal. 25 (1), 85-100 (2014).
- Bhardwaj, G., Cameotra, S. S., Chopra, H. K. Biosurfactant from Lysinibacillus chungkukjangi from rice bran oil sludge and potential applications. Journal of Surfactants and Detergents. 19 (5), 957-965 (2016).
- Gaur, V. K., et al. Rhamnolipid from a Lysinibacillus sphaericus strain IITR51 and its potential application for dissolution of hydrophobic pesticides. Bioresource Technology. 272, 19-25 (2019).
- Habib, S., et al. Production of lipopeptide biosurfactant by a hydrocarbon-degrading Antarctic Rhodococcus. International Journal of Molecular Sciences. 21 (17), 6138 (2020).
- Shao, P., Ma, H., Zhu, J., Qiu, Q. Impact of ionic strength on physicochemical stability of o/w emulsions stabilized by Ulva fasciata polysaccharide. Food Hydrocolloids. 69, 202-209 (2017).
- . Overview of DLVO theory Available from: https://archive-ouverte.unige.ch/unige:148595 (2014)
- Kazemzadeh, Y., Ismail, I., Rezvani, H., Sharifi, M., Riazi, M. Experimental investigation of stability of water in oil emulsions at reservoir conditions: Effect of ion type, ion concentration, and system pressure. Fuel. 243, 15-27 (2019).
- Chong, H., Li, Q. Microbial production of rhamnolipids: opportunities, challenges and strategies. Microbial Cell Factories. 16 (1), 1-12 (2017).
- Zeng, G., et al. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and Rhamnolipid, in liquid culture media and compost matrix. Biodegradation. 18 (3), 303-310 (2007).
- Liu, G., et al. Advances in applications of rhamnolipids biosurfactant in environmental remediation: a review. Biotechnology and Bioengineering. 115 (4), 796-814 (2018).
- John, W. C., Ogbonna, I. O., Gberikon, G. M., Iheukwumere, C. C. Evaluation of biosurfactant production potential of Lysinibacillus fusiformis MK559526 isolated from automobile-mechanic-workshop soil. Brazilian Journal of Microbiology. 52 (2), 663-674 (2021).
- Naing, K. W., et al. Isolation and characterization of an antimicrobial lipopeptide produced by Paenibacillus ehimensis MA2012. Journal of Basic Microbiology. 55 (7), 857-868 (2015).
- Wittgens, A., et al. Novel insights into biosynthesis and uptake of rhamnolipids and their precursors. Applied Microbiology and Biotechnology. 101 (7), 2865-2878 (2017).
- Rahman, K., Rahman, T. J., McClean, S., Marchant, R., Banat, I. M. Rhamnolipid biosurfactant production by strains of Pseudomonas aeruginosa using low-cost raw materials. Biotechnology Progress. 18 (6), 1277-1281 (2002).
- Bahia, F. M., et al. Rhamnolipids production from sucrose by engineered Saccharomyces cerevisiae. Scientific Reports. 8 (1), 1-10 (2018).
- Kim, C. H., et al. Desorption and solubilization of anthracene by a rhamnolipid biosurfactant from Rhodococcus fascians. Water Environment Research. 91 (8), 739-747 (2019).
- Nalini, S., Parthasarathi, R. Optimization of rhamnolipid biosurfactant production from Serratia rubidaea SNAU02 under solid-state fermentation and its biocontrol efficacy against Fusarium wilt of eggplant. Annals of Agrarian Science. 16 (2), 108-115 (2018).
- Wang, Q., et al. Engineering bacteria for production of rhamnolipid as an agent for enhanced oil recovery. Biotechnology and Bioengineering. 98 (4), 842-853 (2007).
- Câmara, J., Sousa, M., Neto, E. B., Oliveira, M. Application of rhamnolipid biosurfactant produced by Pseudomonas aeruginosa in microbial-enhanced oil recovery (MEOR). Journal of Petroleum Exploration and Production Technology. 9 (3), 2333-2341 (2019).
- Amani, H., Mehrnia, M. R., Sarrafzadeh, M. H., Haghighi, M., Soudi, M. R. Scale up and application of biosurfactant from Bacillus subtilis in enhanced oil recovery. Applied Biochemistry and Biotechnology. 162 (2), 510-523 (2010).
- Gudiña, E. J., et al. Bioconversion of agro-industrial by-products in rhamnolipids toward applications in enhanced oil recovery and bioremediation. Bioresource Technology. 177, 87-93 (2015).
- Sun, G., Hu, J., Wang, Z., Li, X., Wang, W. Dynamic investigation of microbial activity in microbial enhanced oil recovery (MEOR). Petroleum Science and Technology. 36 (16), 1265-1271 (2018).
- Jha, S. S., Joshi, S. J., SJ, G. Lipopeptide production by Bacillus subtilis R1 and its possible applications. Brazilian Journal of Microbiology. 47 (4), 955-964 (2016).
- Darvishi, P., Ayatollahi, S., Mowla, D., Niazi, A. Biosurfactant production under extreme environmental conditions by an efficient microbial consortium, ERCPPI-2. Colloids and Surfaces. B, Biointerfaces. 84 (2), 292-300 (2011).
- Al-Wahaibi, Y., et al. Biosurfactant production by Bacillus subtilis B30 and its application in enhancing oil recovery. Colloids and Surfaces. B, Biointerfaces. 114, 324-333 (2014).
- Moutinho, L. F., Moura, F. R., Silvestre, R. C., Romão-Dumaresq, A. S. Microbial biosurfactants: A broad analysis of properties, applications, biosynthesis, and techno-economical assessment of rhamnolipid production. Biotechnology Progress. 37 (2), 3093 (2021).
- Youssef, N., Simpson, D. R., McInerney, M. J., Duncan, K. E. In-situ lipopeptide biosurfactant production by Bacillus strains correlates with improved oil recovery in two oil wells approaching their economic limit of production. International Biodeterioration & Biodegradation. 81, 127-132 (2013).
- Ruckenstein, E., Nagarajan, R. Critical micelle concentration and the transition point for micellar size distribution. The Journal of Physical Chemistry. 85 (20), 3010-3014 (1981).
- de Araujo, L. L., et al. Microbial enhanced oil recovery using a biosurfactant produced by Bacillus safensis isolated from mangrove microbiota-Part I biosurfactant characterization and oil displacement test. Journal of Petroleum Science and Engineering. 180, 950-957 (2019).
- Banat, I. M., De Rienzo, M. A. D., Quinn, G. A. Microbial biofilms: biosurfactants as antibiofilm agents. Applied Microbiology and Biotechnology. 98 (24), 9915-9929 (2014).
- Klosowska-Chomiczewska, I., Medrzycka, K., Karpenko, E. Biosurfactants-biodegradability, toxicity, efficiency in comparison with synthetic surfactants. Research and Application of New Technologies in Wastewater Treatment and Municipal Solid Waste Disposal in Ukraine, Sweden, and Poland. 17, 141-149 (2013).
- Fernandes, P. A. V., et al. Antimicrobial activity of surfactants produced by Bacillus subtilis R14 against multidrug-resistant bacteria. Brazilian Journal of Microbiology. 38 (4), 704-709 (2007).
- Santos, D. K. F., Rufino, R. D., Luna, J. M., Santos, V. A., Sarubbo, L. A. Biosurfactants: multifunctional biomolecules of the 21st century. International Journal of Molecular Sciences. 17 (3), 401 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon