需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用生物表面活性剂组合提高石油采收率
摘要
我们说明了筛选和鉴定产生生物表面活性剂的微生物的方法。还介绍了生物表面活性剂的色谱表征和化学鉴定方法,确定了生物表面活性剂在提高残油采收率方面的工业适用性。
摘要
生物表面活性剂是表面活性化合物,能够降低两个不同极性的相之间的表面张力。生物表面活性剂已成为化学表面活性剂的有前途的替代品,因为它具有较低的毒性,高生物降解性,环境相容性和对极端环境条件的耐受性。在这里,我们说明了用于筛选能够产生生物表面活性剂的微生物的方法。使用滴落塌陷,油扩散和乳液指数测定来鉴定产生生物表面活性剂的微生物。通过确定由于微生物构件的生长而导致的介质表面张力的降低,验证了生物表面活性剂的生产。我们还描述了生物表面活性剂表征和鉴定所涉及的方法。对提取的生物表面活性剂进行薄层色谱,然后对板进行差异染色以确定生物表面活性剂的性质。LCMS, 1H NMR和FT-IR用于化学鉴定生物表面活性剂。我们进一步说明了评估所生产生物表面活性剂组合在模拟砂堆积柱中提高残余油采收率的方法。
引言
生物表面活性剂是由微生物产生的两亲表面活性分子,具有降低表面和两相1之间的界面张力的能力。典型的生物表面活性剂含有亲水部分,其通常由糖部分或肽链或亲水氨基酸组成,疏水部分由饱和或不饱和脂肪酸链2组成。由于其两亲性质,生物表面活性剂在两相之间的界面处组装并降低边界处的界面张力,这有助于一相分散到另一相1,3中。迄今为止报道的各种类型的生物表面活性剂包括糖脂,其中碳水化合物 通过 酯键(例如,鼠李脂,三卤脂和桔梗脂)与长链脂肪族或羟基脂肪族酸相连,脂质附着在多肽链上的脂肽(例如,表面活性素和地衣官能素),以及通常由多糖 - 蛋白质复合物组成的聚合物生物表面活性剂(例如, 乳聚糖,脂质,阿拉桑和脂甘露聚糖)4。由微生物产生的其他类型的生物表面活性剂包括脂肪酸、磷脂、中性脂质和颗粒生物表面活性剂5.研究最多的一类生物表面活性剂是糖脂类,其中大多数研究都报告了鼠李糖脂6。鼠李糖含有一个或两个鼠李糖分子(形成亲水部分),与一个或两个长链脂肪酸分子(通常是羟基癸酸)相连。鼠李糖脂是首先从 铜绿假单胞菌7 中报告的原代糖脂。
与化学表面活性剂相比,生物表面活性剂因其提供的各种独特和独特的特性而受到越来越多的关注8.这些包括更高的特异性,更低的毒性,更大的多样性,易于制备,更高的生物降解性,更好的发泡性,环境相容性和极端条件下的活性9。生物表面活性剂的结构多样性(图S1)是另一个优点,使它们比化学对应物10更具优势。它们在较低浓度下通常更有效和高效,因为它们的临界胶束浓度(CMC)通常比化学表面活性剂11低几倍。据报道,它们具有高度耐热性(高达100°C),并且可以耐受更高的pH值(高达9)和高盐浓度(高达50 g / L)12 因此在需要暴露在极端条件下的工业过程中具有多种优势13。生物降解性和较低的毒性使它们适用于环境应用,如生物修复。由于它们提供的优势,它们在食品,农业,洗涤剂,化妆品和石油工业等各个行业中得到了越来越多的关注11.生物表面活性剂在石油修复中也引起了很多关注,以去除石油污染物和有毒污染物14。
在这里,我们报告了由 红球菌 IITD102, Lysinibacillus sp. IITD104和 Paenibacillus sp. IITD108生产的生物表面活性剂的生产,表征和应用。 图1概述了筛选,表征和应用生物表面活性剂组合以提高石油采收率所涉及的步骤。
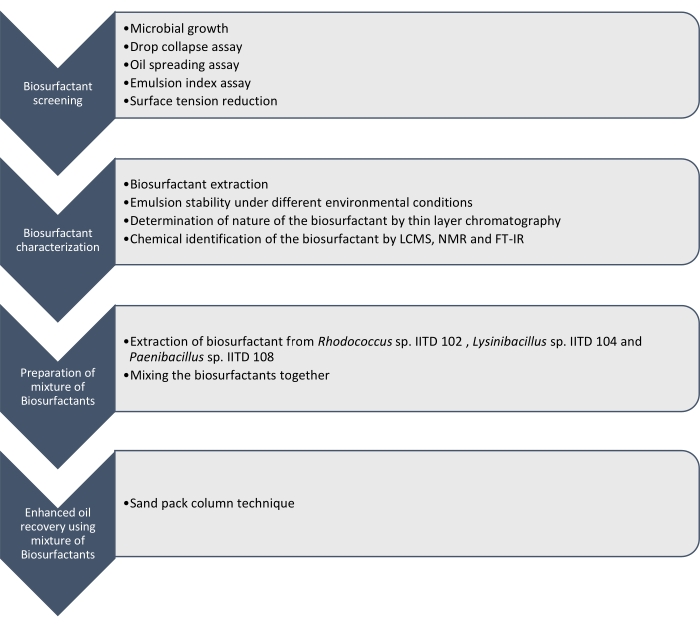
图1:使用生物表面活性剂组合提高石油采收率的方法。 图中显示了逐步工作流程。这项工作分四个步骤进行。首先,通过各种测定对微生物菌株进行培养和筛选,以生产生物表面活性剂,包括滴坍试验,油扩散测定,乳化指数测定和表面张力测量。然后,从无细胞肉汤中提取生物表面活性剂,并使用薄层色谱法鉴定其性质,并使用LCMS,NMR和FT-IR进一步鉴定它们。在下一步中,将提取的生物表面活性剂混合在一起,并使用砂包柱技术确定所得混合物提高石油采收率的潜力。 请点击此处查看此图的大图。
通过滴坍,油铺,乳液指数测定和测定由于微生物生长引起的无细胞培养基表面张力的降低,对这些微生物菌株进行筛选以产生生物表面活性剂。通过LCMS, 1H NMR和FT-IR提取,表征和化学鉴定生物表面活性剂。最后,制备了这些微生物产生的生物表面活性剂混合物,并用于回收模拟砂包柱中的残余油。
本研究仅说明了生物表面活性剂组合在提高残油采收率方面的筛选、鉴定、结构表征和应用方法。它没有提供由微生物菌株15,16产生的生物表面活性剂的详细功能表征。执行各种实验,例如关键胶束测定,热重分析,表面润湿性和生物降解性,以对任何生物表面活性剂进行详细的功能表征。但由于本文是方法论文,因此重点在于生物表面活性剂组合在提高残油采收率方面的筛选、鉴定、结构表征和应用;这些实验尚未纳入本研究。
研究方案
1. 微生物菌株的生长
- 称取 2 克 Luria 肉汤粉,并在 250 mL 锥形瓶中加入 50 mL 蒸馏水。混合内容物,直到粉末完全溶解,并使用蒸馏水将体积制成100 mL。
- 同样,再准备两个100 mL的Luria肉汤烧瓶,并将棉塞放在烧瓶的颈部。
- 用铝箔覆盖棉塞,并在121°C和15 psi下高压灭菌烧瓶15分钟以灭菌培养基。
- 高压灭菌后,让培养基冷却至室温。
- 对于菌株的原代培养物的制备,使用接种环从LA板中挑选单个菌落,并接种在含有5mL无菌Luria肉汤的试管中。
- 将试管在30°C下以180rpm孵育过夜。
- 通过将1 mL过夜生长的种子培养物加入层流气流柜内的烧瓶中,接种含有100 mL高压灭菌的Luria肉汤的烧瓶。
- 将烧瓶在旋转培养箱中以30°C和180rpm孵育7天。
- 孵育期完成后,收获烧瓶并将培养液转移到离心管中。在4°C的冷冻离心机中以4,500× g 离心培养物20分钟。
- 轻轻地将无细胞上清液倒入新鲜烧杯中,并将其用于生物表面活性剂生产的筛选测定。
2. 生物表面活性剂生产的筛选分析
注意:在以下各节中,商用表面活性剂(皂苷)用作阳性对照,而水和未接种的培养基用作阴性对照。
- 跌落塌陷试验
- 取干净的载玻片,并在载玻片表面涂上200μL油。
- 向油的中心加入20μL无细胞上清液,并使其不受干扰2-3分钟。
注意:如果液滴塌陷,则对生物表面活性剂存在的上清液进行正评分。
- 油扩散试验
- 在培养皿(直径75毫米)中取20mL双蒸馏水,并在水面上加入200μL原油。
- 向油的中心加入20μL无细胞上清液,并使其不受干扰1分钟。
注意:如果由于油驱赶而形成清除区,则将上清液评分为阳性,以确定生物表面活性剂的存在。
- 乳化指数测定(E24 测定)
- 将4 mL汽油(汽油)和无细胞上清液分别加入干净的玻璃试管中。
- 剧烈涡旋混合物3分钟,并使其在接下来的24小时内不受干扰。
- 24小时后,确定E24 指数占乳化层高度(cm)相对于整个液体柱高度(cm)的百分比。
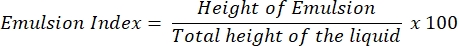
注意:如果在24小时后观察到乳液(水包油或油中水),则上清液可能含有生物表面活性剂。
- 表面张力测量
注:表面张力是使用杜努伊环法17测量的。本实验中使用的仪器(见 材料表)非常灵敏,因此请确保正确清洁玻璃容器和探头。- 打开系统并双击关联的软件将其打开。
- 用要确定其表面张力的液体清洁玻璃容器。
- 将液体(40 mL)加入容器中,并将容器安装在容器支架上。
- 解锁探头支架并将其安装在其上。现在,通过按手动控制器上的 锁定按钮锁定 探头支架。
- 使用手动控制器,调整平台的高度,使探头距离液体表面约2-3毫米。
- 现在使用软件测量表面张力。单击位于屏幕左上角面板上的 "文件 "。单击" 打开工作区"。将出现一个弹出窗口。
- 向下滚动并双击 K100:表面和界面张力 图标。
- 现在,单击位于屏幕左上角 的文件 图标。单击" 新建数据库"。输入用于保存数据的名称,然后单击 确定。
- 再次单击" 文件> SFT >环>新建测量"。输入测量的名称。确保配置模板显示 SFT 环。
- 通过选择探头和用于测量的容器,在 "测量配置" 窗口中填写详细信息。另外,填写液体和气相的详细信息。
注意:液相将是水,而气相将是空气。液相的密度是无细胞上清液的密度。这可以通过取50 mL液体的重量并计算密度为Kg / m3来确定。 - 现在单击" 过程 "选项卡并填写以下详细信息: 检测速度:6 mm/min,检测灵敏度:0.005 g,搜索速度:6 mm/min,搜索灵敏度:0.005 g,测量速度:3 mm/min,测量灵敏度:0.001 g,浸入深度:3 mm,返回距离:10%,校正: Harkins & Jordan,最大值: 5。单击 确定。
- 在弹出窗口中,选择要存储数据的数据库,然后单击 确定。
注意:可以在此处创建新数据库或向现有数据添加新的测量值。 - 现在点击 位于屏幕顶部中心的" 播放 "按钮。系统将开始执行脚本。系统稳定后,它将检测表面。将探头浸入液体中,来回移动探头并检测形成的薄片中的张力。
- 要获得结果,请单击屏幕左中侧的 "测量 "图标。单击" 数据 "并记下确定的表面张力。
- 测量完成后,降低平台的高度,从仪器上解锁和卸载探头和容器。
注意:为了确定由于生物表面活性剂生产而导致的表面张力降低,应使用未接种的LB作为对照。
3. 生物表面活性剂提取
- 使用2 N HCl将细胞游离上清液的pH调节至2,将混合物在4°C下储存过夜。
- 向上清液中加入等体积的氯仿 - 甲醇混合物(2:1),并剧烈混合20分钟。
- 保持混合物不受干扰,以便进行相分离。
- 除去含有水和甲醇的上相,将含有生物表面活性剂的下相留在通风橱中蒸发。
- 有机相蒸发后,将蜂蜜色的粗生物表面活性剂重新溶解在3mL氯仿中,并使用该混合物进一步鉴定和表征生物表面活性剂。
4. 乳液稳定性研究
-
不同温度下的乳液稳定性
- 在不同的试管中取5 mL无细胞上清液。
- 向每个试管中加入5 mL汽油,并通过涡旋3分钟剧烈混合。
- 将试管在不同温度(30°C,40°C,50°C,60°C和70°C)的不同水浴中孵育过夜。
- 24小时后,如前所述估计乳液指数。
-
不同pH值下的乳液稳定性
- 在干净的试管中取5mL无细胞上清液。
- 使用1 N HCl和1 N NaOH调节无细胞上清液(2,4,6,8和10)的pH值。
- 向试管中加入等量的汽油,并通过涡旋3分钟剧烈混合。
- 将试管在室温下保持不受干扰24小时。
- 如前所述估计乳液指数。
-
不同盐浓度下的乳液稳定性
- 在干净的试管中取5mL无细胞上清液。
- 向上清液中加入不同量的盐(NaCl)(0 g / L,5 g / L,10 g / L,20 g / L,60 g / L和80 g / L)。
- 通过涡旋3分钟溶解细胞游离上清液中的盐。
- 向试管中加入等量的汽油,并通过涡旋3分钟剧烈混合。
- 将试管在室温下保持不受干扰24小时。
- 估计24小时后的乳液指数。
5. 确定生物表面活性剂的性质
-
提取的生物表面活性剂的TLC
- 在TLC板上发现20μL生物表面活性剂。一次光斑2μL。
- 在三种不同的TLC板上发现生物表面活性剂。
- 制备含有氯仿:甲醇(2:1)的淋洗液的100mL混合物,并将淋洗液加入TLC室。关闭腔室的盖子,让它饱和20分钟。
- 干燥板后,将TLC板置于用氯仿甲醇混合物饱和的腔内并运行TLC。
- 淋洗液到达TLC板的顶部(距顶部1厘米)后,取出板并使其风干。
-
用于脂质检测的染色
- 取一个干净的TLC室,将一些(5-10)粒碘加入新鲜室中,并在室中饱和5至10分钟。
- 将TLC板放在腔内,观察黄色斑点的发展。如果出现斑点,则将生物表面活性剂评分为脂质成分的存在。
-
用于肽或氨基酸检测的染色
- 通过将0.4g茚三酮溶解在20mL丁醇中来制备茚三酮溶液。向混合物中加入0.6 mL 100%冰醋酸。
- 用茚三酮溶液喷洒TLC板,让它风干2分钟。在110°C下加热板并观察颜色的发展。
注意:如果出现蓝色斑点,则将生物表面活性剂评分为阳性,以发现任何肽链或氨基酸的存在。
-
用于碳水化合物检测的染色
- 通过在含有1 mLH 2SO 4的48 mL冰醋酸中加入2 mL对茴香醛来制备对茴香醛溶液。向混合物中加入0.6mL乙酸。
- 将混合物均匀地喷洒在TLC板上,让其风干2分钟。
- 将板在110°C下孵育并监测斑点的发展。
注意:如果出现绿色或棕色斑点,请将生物表面活性剂评分为阳性,以发现任何碳水化合物的存在。
6. 生物表面活性剂的化学鉴定
- 生物表面活性剂的LCMS
- 将25mg提取的生物表面活性剂溶解在1mL氯仿中。
- 使用 C18 色谱柱执行 LCMS(在锁定喷涂配置中,参考扫描频率为 10 s)。
- 使用氯仿:甲醇(1:1)作为流动相,并以0.1 mL / min的流速将2μL样品注入色谱柱中。
- 将实验参数设置为:极性:ES正,毛细管电压:3 kV,源温度:80°C,脱溶温度:300°C,脱溶气体流量:7,000 L/h,捕集气流量:0.40 mL/min。
- 在20分钟的检测时间内扫描100至1,200 Da的范围,并在正ES模式下测量离子。
- 使用任何质谱定量软件分析m / z值。
- 要进行分析,请登录软件。
- 单击 批量搜索 ,然后输入获得的质量列表。在正电荷模式下测量结果,并使用M + H和M + Na作为加合物。在 显示结构上保持精度为 10 PPM 和滴答声。
- 单击" 搜索 ",然后从化合物列表中选择PPM水平最低的化合物。
- 1 个生物表面活性剂的H NMR
注意:使用400 MHz NMR光谱仪对生物表面活性剂进行了 1H NMR(参见 材料表)。- 将5mg生物表面活性剂溶解在1mL氘化氯仿(CdCl3)中。
- 将混合物转移到NMR管中。正确盖上管子,然后将管子插入扳手中。使用调节管调整管的高度。
- 将管子与扳手一起放入NMR机器中,然后按照下面提到的步骤获得NMR光谱。
- 要选择样品管类型:sx N,其中N是相关软件中放置管的位置(例如,sx 13,如果管放置在第 13个位置)。
- 键入 edc 并按 Enter 键以创建可在其中存储数据的新文件夹。
- 将出现一个弹出窗口。通过单击列表中的CdCl 3 选择溶剂,然后输入样品的名称。
- 要启动协议,请键入"getprosol";要锁定溶剂,请键入"锁定 cdcl3"。
- 键入"topshim"以填充样本,最后键入"rga;zgefp"以获取数据。这将启动协议。
- 获得光谱后,键入"apk;abs n",然后按回车键进行相位和基线校正。
- 要选择主峰,请键入"pp"并按 Enter 键。要仅选择强烈峰值,请输入"mi"并键入应选择峰值的强度。默认值为 0.2。
- 要积分峰值,请单击 积分并将光 标放在要积分的峰值的左侧,同时按住光标单击并在峰值周围拖动光标。
- 通过单击左上角的" 文件 "保存数据,然后单击" 保存"。
- 可以通过键入"sx ej"将样本从机器中弹出。
- 分析峰并确定H原子的环境。
- 生物表面活性剂的傅里叶变换红外光谱
注意:提取的生物表面活性剂的FT-IR在ATR模式下使用市售分光光度计进行(参见 材料表)。- 打开分光光度计,检查吹扫、干燥剂和检测器。
- 要收集光谱,请首先收集背景光谱,而无需放置样本。
- 取提取的生物表面活性剂并完全干燥。将干燥的生物表面活性剂直接放在金刚石晶体上,施加压力并按ATR接触点。
- 在软件中,选择扫描次数(输入30),然后扫描从400 cm-1 到4,000 cm-1的光谱。
- 单击 "确定" 将样本光谱添加到光谱窗口。
- 单击"文件">"保存>"另存为",然后输入文件扩展名 .spa,然后单击"确定"。
7. 生物表面活性剂应用(提高石油采收率)
注意:在本实验中,使用双蒸馏水作为阴性对照,并使用10%SDS,10%吐温80和10%商业皂苷作为阳性对照。
- 取杯,用玻璃棉和玻璃珠密封底部出口。
- 用沙质土壤包装柱子,这样可以在土壤顶部添加一些液体,并且可以在底部收集流经。将立柱安装在支架上,并在土壤顶部添加一些玻璃珠。
- 用50 mL盐水溶液淹没色谱柱,并收集流过以确定孔隙体积。
孔体积=顶部添加的盐水体积 - 收集的流出量。 - 从塔的顶部添加后,通过迫使原油通过柱子,从塔中除去盐水。收集盐水和从色谱柱中流出的油的体积,以确定初始油饱和体积。从色谱柱中释放的盐水体积将是初始油饱和体积或原油到位。
- 保持柱子不受干扰24小时。
- 24 h后,用10孔体积的盐水淹没柱,并收集从柱中出来的油以估计二次采油率。二次采油后留在塔中的油对应于残余油。
- 通过在玻璃烧杯中加入等体积的提取的生物表面活性剂(步骤3.5后提取)来制备生物表面活性剂的混合物。将生物表面活性剂加入柱的顶部,并将柱孵育24小时。
- 24小时后,测量油和水的量以确定额外或增强的油采收率。从色谱柱中释放的油的体积将对应于回收的残余油。
- 使用以下等式估算提高的石油采收率:
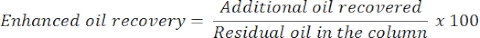
结果
通过各种测定筛选了三种细菌菌株(红球菌 属IITD102, 利西尼巴西勒 属IITD104和 帕尼巴西鲁斯 属IITD108)用于生产生物表面活性剂,包括滴塌法,油置换测定,乳化指数测定和表面张力降低。所有三种细菌菌株的无细胞上清液和化学表面活性剂溶液导致滴剂塌陷,因此生物表面活性剂的存在评分为阳性(图4a)。另一方面,水滴没有塌陷,因此生物表面活...
讨论
生物表面活性剂是最通用的生物活性成分之一,正在成为化学表面活性剂的有吸引力的替代品。它们具有更好的润湿性,较低的CMC,多样化的结构和环保性,因此在洗涤剂,油漆,化妆品,食品,制药,农业,石油和水处理等众多行业中具有广泛的应用18.这导致人们越来越有兴趣发现更多能够生产生物表面活性剂的微生物菌株。在这里,我们说明了筛选,鉴定和应用由红球菌...
披露声明
作者声明没有利益冲突。
致谢
作者要感谢印度政府生物技术部的财政支持。
材料
| Name | Company | Catalog Number | Comments |
| 1 ml pipette | Eppendorf, Germany | G54412G | |
| 1H NMR | Bruker Avance AV-III type spectrometer,USA | ||
| 20 ul pipette | Thermo scientific, USA | H69820 | |
| Autoclave | JAISBO, India | Ser no 5923 | Jain Scientific |
| Blue flame burner | Rocker scientific, Taiwan | dragon 200 | |
| Butanol | GLR inovations, India | GLR09.022930 | |
| C18 column | Agilent Technologies, USA | 770995-902 | |
| Centrifuge | Eppendorf, Germany | 5810R | |
| Chloroform | Merck, India | 1.94506.2521 | |
| Chloroform-d | SRL, India | 57034 | |
| Falcon tubes | Tarsons, India | 546041 | Radiation sterilized polypropylene |
| FT-IR | Thermo Fisher Scientific, USA | Nicolet iS50 | |
| Fume hood | Khera, India | 47408 | Customied |
| glacial acetic acid | Merck, India | 1.93002 | |
| Glass beads | Merck, India | 104014 | |
| Glass slides | Polar industrial Corporation, USA | Blue Star | 75 mm * 25 mm |
| Glass wool | Merk, India | 104086 | |
| Hydrochloric acid | Merck, India | 1003170510 | |
| Incubator | Thermo Scientific, USA | MaxQ600 | Shaking incubator |
| Incubator | Khera, India | Sunbim | |
| Iodine resublimed | Merck, India | 231-442-4 | resublimed Granules |
| K12 –Kruss tensiometer | Kruss Scientific, Germany | K100 | |
| Laminar air flow cabnet | Thermo Scientific, China | 1300 Series A2 | |
| LCMS | Agilent Technologies, USA | 1260 Infinity II | |
| Luria Broth | HIMEDIA, India | M575-500G | Powder |
| Methanol | Merck, India | 107018 | |
| Ninhydrin | Titan Biotech Limited, India | 1608 | |
| p- anisaldehyde | Sigma, USA | 204-602-6 | |
| Petri plate | Tarsons, India | 460090-90 MM | Radiation sterilized polypropylene |
| Saponin | Merck, India | 232-462-6 | |
| Sodium chloride | Merck, India | 231-598-3 | |
| Test tubes | Borosil, India | 9800U06 | Glass tubes |
| TLC plates | Merck, India | 1055540007 | |
| Vortex | GeNei, India | 2006114318 | |
| Water Bath | Julabo, India | SW21C |
参考文献
- Desai, J. D., Banat, I. M. Microbial production of surfactants and their commercial potential. Microbiology and Molecular Biology Reviews. 61 (1), 47-64 (1997).
- Banat, I. M. Biosurfactants production and possible uses in microbial enhanced oil recovery and oil pollution remediation: a review. Bioresource Technology. 51 (1), 1-12 (1995).
- Singh, A., Van Hamme, J. D., Ward, O. P. Surfactants in microbiology and biotechnology: Part 2. Application aspects. Biotechnology Advances. 25 (1), 99-121 (2007).
- Shah, N., Nikam, R., Gaikwad, S., Sapre, V., Kaur, J. Biosurfactant: types, detection methods, importance and applications. Indian Journal of Microbiology Research. 3 (1), 5-10 (2016).
- McClements, D. J., Gumus, C. E. Natural emulsifiers-Biosurfactants, phospholipids, biopolymers, and colloidal particles: Molecular and physicochemical basis of functional performance. Advances in Colloid and Interface Science. 234, 3-26 (2016).
- Nguyen, T. T., Youssef, N. H., McInerney, M. J., Sabatini, D. A. Rhamnolipid biosurfactant mixtures for environmental remediation. Water Research. 42 (6-7), 1735-1743 (2008).
- Maier, R. M., Soberon-Chavez, G. Pseudomonas aeruginosa rhamnolipids: biosynthesis and potential applications. Applied Microbiology and Biotechnology. 54 (5), 625-633 (2000).
- Banat, I. M., Makkar, R. S., Cameotra, S. S. Potential commercial applications of microbial surfactants. Applied Microbiology and Biotechnology. 53 (5), 495-508 (2000).
- Mulugeta, K., Kamaraj, M., Tafesse, M., Aravind, J. A review on production, properties, and applications of microbial surfactants as a promising biomolecule for environmental applications. Strategies and Tools for Pollutant Mitigation: Avenues to a Cleaner Environment. , 3-28 (2021).
- Sharma, J., Sundar, D., Srivastava, P. Biosurfactants: Potential agents for controlling cellular communication, motility, and antagonism. Frontiers in Molecular Biosciences. 8, 727070 (2021).
- Vijayakumar, S., Saravanan, V. Biosurfactants-types, sources and applications. Research Journal of Microbiology. 10 (5), 181-192 (2015).
- Curiel-Maciel, N. F., et al. Characterization of enterobacter cloacae BAGM01 producing a thermostable and alkaline-tolerant rhamnolipid biosurfactant from the Gulf of Mexico. Marine Biotechnology. 23 (1), 106-126 (2021).
- Nikolova, C., Gutierrez, T. Biosurfactants and their applications in the oil and gas industry: current state of knowledge and future perspectives. Frontiers in Bioengineering and Biotechnology. 9, (2021).
- Rastogi, S., Tiwari, S., Ratna, S., Kumar, R. Utilization of agro-industrial waste for biosurfactant production under submerged fermentation and its synergistic application in biosorption of Pb2. Bioresource Technology Reports. 15, 100706 (2021).
- Zargar, A. N., Lymperatou, A., Skiadas, I., Kumar, M., Srivastava, P. Structural and functional characterization of a novel biosurfactant from Bacillus sp. IITD106. Journal of Hazardous Materials. 423, 127201 (2022).
- Adnan, M., et al. Functional and structural characterization of pediococcus pentosaceus-derived biosurfactant and its biomedical potential against bacterial adhesion, quorum sensing, and biofilm formation. Antibiotics. 10 (11), 1371 (2021).
- Du Nouy, P. L. A new apparatus for measuring surface tension. The Journal of General Physiology. 1 (5), 521-524 (1919).
- Akbari, S., Abdurahman, N. H., Yunus, R. M., Fayaz, F., Alara, O. R. Biosurfactants-a new frontier for social and environmental safety: a mini review. Biotechnology Research and Innovation. 2 (1), 81-90 (2018).
- Bicca, F. C., Fleck, L. C., Ayub, M. A. Z. Production of biosurfactant by hydrocarbon degrading Rhodococcus ruber and Rhodococcus erythropolis. Revista de Microbiologia. 30 (3), 231-236 (1999).
- Kuyukina, M. S., et al. Recovery of Rhodococcus biosurfactants using methyl tertiary-butyl ether extraction. Journal of Microbiological Methods. 46 (2), 149-156 (2001).
- Philp, J., et al. Alkanotrophic Rhodococcus ruber as a biosurfactant producer. Applied Microbiology and Biotechnology. 59 (2), 318-324 (2002).
- Mutalik, S. R., Vaidya, B. K., Joshi, R. M., Desai, K. M., Nene, S. N. Use of response surface optimization for the production of biosurfactant from Rhodococcus spp. MTCC 2574. Bioresource Technology. 99 (16), 7875-7880 (2008).
- Shavandi, M., Mohebali, G., Haddadi, A., Shakarami, H., Nuhi, A. Emulsification potential of a newly isolated biosurfactant-producing bacterium, Rhodococcus sp. strain TA6. Colloids and Surfaces B, Biointerfaces. 82 (2), 477-482 (2011).
- White, D., Hird, L., Ali, S. Production and characterization of a trehalolipid biosurfactant produced by the novel marine bacterium Rhodococcus sp., strain PML026. Journal of Applied Microbiology. 115 (3), 744-755 (2013).
- Najafi, A., et al. Interactive optimization of biosurfactant production by Paenibacillus alvei ARN63 isolated from an Iranian oil well. Colloids and Surfaces. B, Biointerfaces. 82 (1), 33-39 (2011).
- Bezza, F. A., Chirwa, E. M. N. Pyrene biodegradation enhancement potential of lipopeptide biosurfactant produced by Paenibacillus dendritiformis CN5 strain. Journal of Hazardous Materials. 321, 218-227 (2017).
- Jimoh, A. A., Lin, J. Biotechnological applications of Paenibacillus sp. D9 lipopeptide biosurfactant produced in low-cost substrates. Applied Biochemistry and Biotechnology. 191 (3), 921-941 (2020).
- Liang, T. -. W., et al. Exopolysaccharides and antimicrobial biosurfactants produced by Paenibacillus macerans TKU029. Applied Biochemistry and Biotechnology. 172 (2), 933-950 (2014).
- Mesbaiah, F. Z., et al. Preliminary characterization of biosurfactant produced by a PAH-degrading Paenibacillus sp. under thermophilic conditions. Environmental Science and Pollution Research. 23 (14), 14221-14230 (2016).
- Quinn, G. A., Maloy, A. P., McClean, S., Carney, B., Slater, J. W. Lipopeptide biosurfactants from Paenibacillus polymyxa inhibit single and mixed species biofilms. Biofouling. 28 (10), 1151-1166 (2012).
- Gudiña, E. J., et al. Novel bioemulsifier produced by a Paenibacillus strain isolated from crude oil. Microbial Cell Factories. 14 (1), 1-11 (2015).
- Pradhan, A. K., Pradhan, N., Sukla, L. B., Panda, P. K., Mishra, B. K. Inhibition of pathogenic bacterial biofilm by biosurfactant produced by Lysinibacillus fusiformis S9. Bioprocess and Biosystems Engineering. 37 (2), 139-149 (2014).
- Manchola, L., Dussán, J. Lysinibacillus sphaericus and Geobacillus sp biodegradation of petroleum hydrocarbons and biosurfactant production. Remediation Journal. 25 (1), 85-100 (2014).
- Bhardwaj, G., Cameotra, S. S., Chopra, H. K. Biosurfactant from Lysinibacillus chungkukjangi from rice bran oil sludge and potential applications. Journal of Surfactants and Detergents. 19 (5), 957-965 (2016).
- Gaur, V. K., et al. Rhamnolipid from a Lysinibacillus sphaericus strain IITR51 and its potential application for dissolution of hydrophobic pesticides. Bioresource Technology. 272, 19-25 (2019).
- Habib, S., et al. Production of lipopeptide biosurfactant by a hydrocarbon-degrading Antarctic Rhodococcus. International Journal of Molecular Sciences. 21 (17), 6138 (2020).
- Shao, P., Ma, H., Zhu, J., Qiu, Q. Impact of ionic strength on physicochemical stability of o/w emulsions stabilized by Ulva fasciata polysaccharide. Food Hydrocolloids. 69, 202-209 (2017).
- . Overview of DLVO theory Available from: https://archive-ouverte.unige.ch/unige:148595 (2014)
- Kazemzadeh, Y., Ismail, I., Rezvani, H., Sharifi, M., Riazi, M. Experimental investigation of stability of water in oil emulsions at reservoir conditions: Effect of ion type, ion concentration, and system pressure. Fuel. 243, 15-27 (2019).
- Chong, H., Li, Q. Microbial production of rhamnolipids: opportunities, challenges and strategies. Microbial Cell Factories. 16 (1), 1-12 (2017).
- Zeng, G., et al. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and Rhamnolipid, in liquid culture media and compost matrix. Biodegradation. 18 (3), 303-310 (2007).
- Liu, G., et al. Advances in applications of rhamnolipids biosurfactant in environmental remediation: a review. Biotechnology and Bioengineering. 115 (4), 796-814 (2018).
- John, W. C., Ogbonna, I. O., Gberikon, G. M., Iheukwumere, C. C. Evaluation of biosurfactant production potential of Lysinibacillus fusiformis MK559526 isolated from automobile-mechanic-workshop soil. Brazilian Journal of Microbiology. 52 (2), 663-674 (2021).
- Naing, K. W., et al. Isolation and characterization of an antimicrobial lipopeptide produced by Paenibacillus ehimensis MA2012. Journal of Basic Microbiology. 55 (7), 857-868 (2015).
- Wittgens, A., et al. Novel insights into biosynthesis and uptake of rhamnolipids and their precursors. Applied Microbiology and Biotechnology. 101 (7), 2865-2878 (2017).
- Rahman, K., Rahman, T. J., McClean, S., Marchant, R., Banat, I. M. Rhamnolipid biosurfactant production by strains of Pseudomonas aeruginosa using low-cost raw materials. Biotechnology Progress. 18 (6), 1277-1281 (2002).
- Bahia, F. M., et al. Rhamnolipids production from sucrose by engineered Saccharomyces cerevisiae. Scientific Reports. 8 (1), 1-10 (2018).
- Kim, C. H., et al. Desorption and solubilization of anthracene by a rhamnolipid biosurfactant from Rhodococcus fascians. Water Environment Research. 91 (8), 739-747 (2019).
- Nalini, S., Parthasarathi, R. Optimization of rhamnolipid biosurfactant production from Serratia rubidaea SNAU02 under solid-state fermentation and its biocontrol efficacy against Fusarium wilt of eggplant. Annals of Agrarian Science. 16 (2), 108-115 (2018).
- Wang, Q., et al. Engineering bacteria for production of rhamnolipid as an agent for enhanced oil recovery. Biotechnology and Bioengineering. 98 (4), 842-853 (2007).
- Câmara, J., Sousa, M., Neto, E. B., Oliveira, M. Application of rhamnolipid biosurfactant produced by Pseudomonas aeruginosa in microbial-enhanced oil recovery (MEOR). Journal of Petroleum Exploration and Production Technology. 9 (3), 2333-2341 (2019).
- Amani, H., Mehrnia, M. R., Sarrafzadeh, M. H., Haghighi, M., Soudi, M. R. Scale up and application of biosurfactant from Bacillus subtilis in enhanced oil recovery. Applied Biochemistry and Biotechnology. 162 (2), 510-523 (2010).
- Gudiña, E. J., et al. Bioconversion of agro-industrial by-products in rhamnolipids toward applications in enhanced oil recovery and bioremediation. Bioresource Technology. 177, 87-93 (2015).
- Sun, G., Hu, J., Wang, Z., Li, X., Wang, W. Dynamic investigation of microbial activity in microbial enhanced oil recovery (MEOR). Petroleum Science and Technology. 36 (16), 1265-1271 (2018).
- Jha, S. S., Joshi, S. J., SJ, G. Lipopeptide production by Bacillus subtilis R1 and its possible applications. Brazilian Journal of Microbiology. 47 (4), 955-964 (2016).
- Darvishi, P., Ayatollahi, S., Mowla, D., Niazi, A. Biosurfactant production under extreme environmental conditions by an efficient microbial consortium, ERCPPI-2. Colloids and Surfaces. B, Biointerfaces. 84 (2), 292-300 (2011).
- Al-Wahaibi, Y., et al. Biosurfactant production by Bacillus subtilis B30 and its application in enhancing oil recovery. Colloids and Surfaces. B, Biointerfaces. 114, 324-333 (2014).
- Moutinho, L. F., Moura, F. R., Silvestre, R. C., Romão-Dumaresq, A. S. Microbial biosurfactants: A broad analysis of properties, applications, biosynthesis, and techno-economical assessment of rhamnolipid production. Biotechnology Progress. 37 (2), 3093 (2021).
- Youssef, N., Simpson, D. R., McInerney, M. J., Duncan, K. E. In-situ lipopeptide biosurfactant production by Bacillus strains correlates with improved oil recovery in two oil wells approaching their economic limit of production. International Biodeterioration & Biodegradation. 81, 127-132 (2013).
- Ruckenstein, E., Nagarajan, R. Critical micelle concentration and the transition point for micellar size distribution. The Journal of Physical Chemistry. 85 (20), 3010-3014 (1981).
- de Araujo, L. L., et al. Microbial enhanced oil recovery using a biosurfactant produced by Bacillus safensis isolated from mangrove microbiota-Part I biosurfactant characterization and oil displacement test. Journal of Petroleum Science and Engineering. 180, 950-957 (2019).
- Banat, I. M., De Rienzo, M. A. D., Quinn, G. A. Microbial biofilms: biosurfactants as antibiofilm agents. Applied Microbiology and Biotechnology. 98 (24), 9915-9929 (2014).
- Klosowska-Chomiczewska, I., Medrzycka, K., Karpenko, E. Biosurfactants-biodegradability, toxicity, efficiency in comparison with synthetic surfactants. Research and Application of New Technologies in Wastewater Treatment and Municipal Solid Waste Disposal in Ukraine, Sweden, and Poland. 17, 141-149 (2013).
- Fernandes, P. A. V., et al. Antimicrobial activity of surfactants produced by Bacillus subtilis R14 against multidrug-resistant bacteria. Brazilian Journal of Microbiology. 38 (4), 704-709 (2007).
- Santos, D. K. F., Rufino, R. D., Luna, J. M., Santos, V. A., Sarubbo, L. A. Biosurfactants: multifunctional biomolecules of the 21st century. International Journal of Molecular Sciences. 17 (3), 401 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。