A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التلاعب المكاني الزماني دون الخلوي للهيكل الخلوي للأنابيب الدقيقة في جنين الفأر الحي قبل الزرع باستخدام الفوتوستاتينات
In This Article
Summary
مثبطات الأنابيب الدقيقة النموذجية ، المستخدمة على نطاق واسع في البحوث الأساسية والتطبيقية ، لها تأثيرات بعيدة المدى على الخلايا. في الآونة الأخيرة ، ظهرت الفوتوستاتينات كفئة من مثبطات الأنابيب الدقيقة القابلة للتحويل الضوئي ، القادرة على التلاعب الفوري والقابل للانعكاس والدقيق مكانيا للأنابيب الدقيقة. يفصل هذا البروتوكول خطوة بخطوة تطبيق photostatins في جنين فأر 3D حي قبل الزرع.
Abstract
يشكل الهيكل الخلوي للنبيبات الدقيقة إطار الخلية وهو أساسي للنقل داخل الخلايا وانقسام الخلايا ونقل الإشارة. يمكن أن يكون للاضطراب الدوائي التقليدي لشبكة الأنابيب الدقيقة في كل مكان باستخدام ، على سبيل المثال ، نوكودازول عواقب وخيمة على أي خلية. مثبطات الأنابيب الدقيقة القابلة للتحويل الضوئي بشكل عكسي لديها القدرة على التغلب على القيود من خلال تمكين تنفيذ تأثيرات الدواء بطريقة يتم التحكم فيها مكانيا وزمنيا. واحدة من هذه العائلات من الأدوية هي الفوتوستاتينات القائمة على الآزوبنزين (PSTs). هذه المركبات غير نشطة في الظروف المظلمة ، وعند الإضاءة بضوء الأشعة فوق البنفسجية ، فإنها ترتبط بموقع ربط الكولشيسين β-tubulin وتمنع بلمرة الأنابيب الدقيقة والدوران الديناميكي. هنا ، تم تعيين تطبيق PSTs في جنين الفأر الحي ثلاثي الأبعاد (3D) قبل الزرع لتعطيل شبكة microtubule على المستوى دون الخلوي. يوفر هذا البروتوكول إرشادات للإعداد التجريبي ، بالإضافة إلى معلمات التنشيط الضوئي وإلغاء التنشيط ل PSTs باستخدام المجهر البؤري للخلية الحية. وهذا يضمن قابلية التكرار ويمكن الآخرين من تطبيق هذا الإجراء على أسئلتهم البحثية. قد تتطور مفاتيح التبديل الضوئية المبتكرة مثل PSTs كأدوات قوية لتعزيز فهم شبكة الأنابيب الدقيقة الديناميكية داخل الخلايا والتلاعب بالهيكل الخلوي بشكل غير جراحي في الوقت الفعلي. علاوة على ذلك ، قد تكون PSTs مفيدة في هياكل 3D الأخرى مثل المواد العضوية أو الأروميات أو أجنة الأنواع الأخرى.
Introduction
تختلف بنية الأنابيب الدقيقة اختلافا كبيرا عبر أنواع الخلايا المختلفة لدعم وظائف متنوعة 1,2. تسمح طبيعتها الديناميكية للنمو والانكماش بالتكيف السريع مع الإشارات خارج وداخل الخلايا والاستجابة للاحتياجات المتغيرة باستمرار للخلية. وبالتالي ، يمكن اعتبارها "بصمة مورفولوجية" تلعب دورا رئيسيا في الهوية الخلوية.
أدى الاستهداف الدوائي للهيكل الخلوي للأنابيب الدقيقة باستخدام مثبطات الجزيئات الصغيرة إلى عدد كبير من الاكتشافات الأساسية في علم الأحياء التنموي ، وبيولوجيا الخلايا الجذعية ، وبيولوجيا السرطان ، والبيولوجيا العصبية3،4،5،6،7. وعلى الرغم من أن هذا النهج لا غنى عنه، فإنه ينطوي على قيود مختلفة مثل السمية والآثار غير المستهدفة. على سبيل المثال ، أحد أكثر عوامل استهداف الأنابيب الدقيقة استخداما على نطاق واسع ، نوكودازول ، هو دواء قوي لإزالة البلمرة من الأنابيب الدقيقة8. ومع ذلك ، فإن مثبطات الجزيئات الصغيرة مثل نوكودازول نشطة من وقت التطبيق ، وبالنظر إلى الطبيعة الأساسية للهيكل الخلوي للأنابيب الدقيقة للعديد من الوظائف الخلوية الحرجة ، فإن إزالة البلمرة العالمية من الأنابيب الدقيقة يمكن أن تنتج تأثيرات خارج الهدف ، والتي قد تكون غير مناسبة للعديد من التطبيقات. بالإضافة إلى ذلك ، فإن علاج نوكودازول لا رجعة فيه ما لم يتم غسل العينات الخالية من الدواء ، مما يمنع التصوير الحي المستمر ، وبالتالي التتبع الدقيق لخيوط الأنابيب الدقيقة الفردية.
بدأ تطوير المركبات المنشطة بالضوء بإنشاء جزيئات غير محبوسة ضوئيا وبشرت بعصر جديد في استهداف ومراقبة آثار تثبيط نمو الأنابيب الدقيقة بطريقة دقيقة وخاضعة للتحكم الزماني المكاني. تم تطوير عائلة واحدة من الأدوية القابلة للتحويل الضوئي بشكل عكسي ، photostatins (PSTs) ، عن طريق استبدال مكون stilbene من combretastatin A-4 ب azobenzene9. تكون PSTs غير نشطة حتى الإضاءة بضوء الأشعة فوق البنفسجية ، حيث يتحول التكوين العابر غير النشط إلى تكوين رابطة الدول المستقلة النشط عن طريق الأيزومرات القابلة للعكس. تمنع Cis-PSTs بلمرة الأنابيب الدقيقة عن طريق الارتباط بموقع ربط الكولشيسين β-توبولين ، مما يمنع واجهته مع β-tubulin ويمنع dimerization المطلوب لنمو microtubule10. من بين مجموعة من PSTs ، برز PST-1P كمركب رصاص لأنه يتمتع بأعلى فعالية ، وهو قابل للذوبان في الماء بالكامل ، ويظهر بداية سريعة للنشاط الحيوي بعد الإضاءة.
يحدث الأيزومرات الأكثر فعالية عبر إلى رابطة الدول المستقلة ل PSTs عند أطوال موجية تتراوح بين 360-420 نانومتر ، مما يتيح خيارات مزدوجة لتنشيط PST. يمكن إعطاء خط ليزر 405 نانومتر على مجهر بؤري نموذجي للاستهداف المكاني الأمثل لتثبيط نمو الأنابيب الدقيقة. إن القدرة على تحديد موقع وتوقيت تنشيط PST من خلال إضاءة ليزر 405 نانومتر تسهل التحكم الزمني والمكاني الدقيق ، مما يسمح بتعطيل ديناميكيات الأنابيب الدقيقة على المستوى دون الخلوي ، ضمن أوقات الاستجابة دون الثانية9. بدلا من ذلك ، يسمح ضوء الأشعة فوق البنفسجية LED بأسعار معقولة لإضاءة الكائن الحي بالكامل بالحث على تعطيل بنية الأنابيب الدقيقة على مستوى الكائن الحي. قد يكون هذا بديلا فعالا من حيث التكلفة للباحثين الذين يكون الهدف هو بداية التثبيط في الوقت المحدد بدقة ، بدلا من الاستهداف المكاني. ميزة أخرى ل PSTs هي تعطيلها عند الطلب عن طريق تطبيق الضوء الأخضر للطول الموجي في نطاق 510-540 نانومتر9. وهذا يتيح تتبع خيوط الأنابيب الدقيقة قبل وأثناء وبعد تثبيط النمو بوساطة PST.
على الرغم من أن PSTs لا يزال تصميما حديثا نسبيا ، فقد تم استخدامه في العديد من التطبيقات المخبرية عبر مجالات بحثية متنوعة11 ، بما في ذلك التحقيق في آليات جديدة لهجرة الخلايا في الأميبويدات12 ، في الخلايا العصبية المعزولة من دماغ الفأر حديث الولادة13 ، وتطوير ظهارة الجناح في ذبابة الفاكهة 14 . أثبتت الأدوية الأخرى التفاعلية الخفيفة أنها أدوات قيمة في التعطيل المستهدف للوظيفة الخلوية. على سبيل المثال ، تم استخدام تناظرية من blebbistatin ، azidoblebbistatin ، لتعزيز تثبيط الميوسين تحت الإضاءة15,16. وهذا يسلط الضوء على إمكانية اكتشافات جديدة بسبب القدرة على تثبيط الوظيفة الخلوية التي يتم التحكم فيها زمنيا ومكانيا.
تقدم الكائنات الحية 3D أنظمة رائعة ولكنها أكثر حساسية للتعامل مع ديناميكيات الأنابيب الدقيقة على مستوى حيواني كامل أو خلية واحدة أو دون خلوية في ظل ظروف فسيولوجية. على وجه الخصوص ، يقدم جنين الفأر قبل الزرع نظرة ثاقبة استثنائية في الأعمال الداخلية للخلية وكذلك العلاقات بين الخلايا داخل الكائن الحي17. ساهمت الدورات المتتالية المستهدفة زمنيا ومكانيا لتنشيط وتعطيل PSTs في توصيف الجسر بين الأطوار ، وهو بنية ما بعد الحركية الخلوية بين الخلايا ، كمركز غير مركزي لتنظيم الأنابيب الدقيقة في جنين الفأر قبل الزرع16. أظهر إعداد تجريبي مماثل مشاركة الأنابيب الدقيقة النامية في ختم جنين الفأر للسماح بتكوين الكيسة الأريمية18. علاوة على ذلك ، تم استخدام PSTs أيضا في أجنة الزرد الكاملة للتحقيق في هجرة الخلايا العصبية عن طريق تثبيط نمو الأنابيب الدقيقة في مجموعة فرعية من الخلايا في الدماغ الخلفي19.
يصف هذا البروتوكول الإعداد التجريبي واستخدام PST-1P في جنين الفأر قبل الزرع. يمكن للتعليمات المقدمة هنا أيضا توجيه تطبيق PSTs لمجموعة واسعة من الأهداف مثل دراسة فصل الكروموسومات وانقسام الخلايا ، والاتجار بالبضائع داخل الخلايا ، وتكوين الخلايا وهجرتها. وعلاوة على ذلك، ستساعد هذه الدراسات على تنفيذ PSTs في الأنظمة العضوية، والأروميات، وغيرها من نماذج الأجنة مثل Caenorhabditis elegans و Xenopus laevis، فضلا عن إمكانية توسيع استخدام PSTs لتقنيات الإخصاب في المختبر .
Protocol
تمت الموافقة على التجارب من قبل لجنة موناش لأخلاقيات الحيوان تحت رقم أخلاقيات الحيوان 19143. تم إيواء الحيوانات في ظروف محددة خالية من مسببات الأمراض في منشأة الحيوانات (منصة موناش لأبحاث الحيوانات) بما يتفق بدقة مع المبادئ التوجيهية الأخلاقية.
1. جمع أجنة الفأر قبل الزرع
- الفئران Superovulate و mate كما هو موضح سابقا16,18 ، وفقا للمبادئ التوجيهية لأخلاقيات الحيوان المؤسسية.
ملاحظة: السلالات الأكثر استخداما لجمع الأجنة الحية هي الفئران C57BL/6 أو FVB/N. تم إنشاء جميع البيانات المعروضة هنا باستخدام فئران FVB / N. - في صباح اليوم التالي للتزاوج ، اطرد الزيجوت من قناة البيض باستخدام وسط M2 كما هو موضح20 ، أو وسط سائل البوق البشري (HTF). باستخدام جهاز ماصة الفم كما هو موضح21,22 ، قم بنقل الزيجوت إلى قطرات متوسطة محسنة من البوتاسيوم البسيط الطازج (KSOM) ، تم تسخينها مسبقا إلى 37 درجة مئوية وتوازنها إلى 5٪ CO2 ، في طبق استزراع 35 مم متراكب مع كمية كافية من الزيوت المعدنية لضمان التغطية الإعلامية.
- الزيجوت الحقن الدقيق كما هو موضح20 مع ترميز cRNA للأنابيب الدقيقة الحمراء الموسومة بالفلورسنت بالإضافة إلى علامة النهاية. هنا ، تم استخدام cRNA لبروتين ربط النهاية 3 (EB3)-dTomato بتركيز 30 نانوغرام / ميكرولتر بعد التحضير والتنقية كما هو موضح16,18 والتخفيف في المخزن المؤقت للحقن المجهري.
ملاحظة: يوصى بإعداد cRNA في وقت مبكر وتخزينه عند -20 درجة مئوية حتى الحاجة. - زرع الأجنة في الظلام عند 37 درجة مئوية و 5٪ CO2 حتى تصل الأجنة إلى مرحلة النمو المطلوبة لعلاج PST-1P.
ملاحظة: للحصول على مورد شامل لأوقات الاستزراع المطلوبة للمراحل الجنينية المختلفة ، انظر23. بالنسبة للأجنة المكونة من 16 خلية المستخدمة هنا ، فإن الزراعة إلى اليوم الجنيني 3 (E3) بعد الإخصاب.
2. إعداد طبق المخدرات والتصوير
ملاحظة: بالنسبة للخطوات من 2.1 إلى 2.10، اعمل حصريا في ظروف الإضاءة المظلمة أو الحمراء لتجنب تنشيط PST-1P غير المقصود. يجب استخدام رقائق الألومنيوم أو الأغطية الداكنة لجميع الأنابيب والأطباق التي تحتوي على PSTs.
- تحضير تركيز مخزون 50 mM PST-1P في الماء فائق النقاء.
ملاحظة: الوزن الجزيئي ل PST-1P هو 440 جم / مول. حل المخزون مستقر عند -20 درجة مئوية لمدة تصل إلى 1 سنة. PST-1P قابل للذوبان في الماء أو المخزن المؤقت المائي ولكنه لا يذوب بسهولة في DMSO. - من الخطوة 2.1 ، قم بإعداد تركيز عمل متوسط يبلغ 800 ميكرومتر PST-1P في ماء فائق النقاء.
- تمييع PST-1P إلى تركيز نهائي من 40 ميكرومتر في KSOM الطازجة. نظرا لأن التجربة النموذجية تتطلب حوالي 20 ميكرولتر من PST-1P المعالجة ب KSUM ، قم بتخفيف 1 ميكرولتر من 800 ميكرومتر PST-1P في 19 ميكرولتر من KSOM للحصول على حجم نهائي قدره 20 ميكرولتر لضمان إعداد وسط كاف مقدما ، باستخدام الضوء الأحمر فقط للرؤية.
ملاحظة: يمكن التحقق من كل من تركيز وحالة تنشيط تخفيف PST-1P عن طريق أخذ طيف امتصاص UV-Vis باستخدام مقياس الطيف الضوئي الذي ينبغي القيام به أثناء إنشاء المقايسة. يجب أن يكون الامتصاص عند 380 نانومتر (A380) لتخفيف 40 ميكرومتر كامل الترانس في كوفيت 1 سم حوالي 0.8. كل من أشكال رابطة الدول المستقلة والأشكال المتحولة لها نفس الامتصاص عند 455 نانومتر (A455). عندما تكون نسبة A380 إلى A455 حوالي 9: 1 ، يكون التخفيف غير نشط ( محول بالكامل). عندما تكون النسبة A380: A455 هي 1: 2 ، يتم تنشيط التخفيف بالكامل ( رابطة الدول المستقلة بالكامل). تعكس النسب الوسيطة حالات التنشيط الوسيطة. - لإعداد شريحة الحجرة للتصوير الحي ، ماصة 10 ميكرولتر من KSOM المعالج ب PST-1P في وسط بئر واحد لتشكيل قطرة نصف كروية (الشكل 1A).
- أضف بلطف ما يكفي من الزيت المعدني لتغطية القطرة ، مع التأكد من أنها لا تشتت الوسائط. هذا سيضمن عدم تبخر القطرة.
- قم بموازنة طبق انزلاق الغرفة في حاضنة عند 37 درجة مئوية و 5٪ CO2 لمدة لا تقل عن 3 ساعات أو على الأكثر ، بين عشية وضحاها.
- في نهاية فترة التوازن في الخطوة 2.6 ، قم بإعداد طبق استزراع 35 مم مع قطرة 10 ميكرولتر من PST-1P المعالج والاحترار المسبق والمتوازن KSOM كخطوة غسيل. لا تتراكب مع الزيت.
- انقل الأجنة عن طريق سحب الأجنة عن طريق الفم إلى قطرة KSOM المعالجة ب PST-1P من الخطوة 2.7.
ملاحظة: يوصى بالخطوتين 2.7 و2.8 لسحب الأجنة عن طريق الفم ولكنها اختيارية. - انقل الأجنة على الفور عن طريق سحب الأجنة عن طريق الفم إلى وسط قطرة KSOM المعالجة ب PST-1P في شريحة غرفة التصوير المعدة في الخطوات 2.4-2.6 (الشكل 1A).
- احتضن الأجنة عند 37 درجة مئوية و 5٪ CO2 في KSOM المعالج ب PST-1P في شريحة غرفة التصوير لمدة ساعة واحدة على الأقل قبل التصوير. إذا كان ذلك ممكنا ، قم بتركيب شريحة الغرفة على المجهر داخل غرفة بيئية عند 37 درجة مئوية و 5٪ CO2 ، وفي ظلام دامس لضمان أن جميع PST-1Ps في التكوين غير النشط وأن الأجنة يمكن أن تغرق في قاع الطبق.
3. التصوير الحي والتنشيط الضوئي PST-1P
ملاحظة: يتم تنفيذ الخطوات من 3.1 إلى 3.13 على مجهر بؤري بؤري المسح الضوئي بالليزر مزود بكاشفات الصمام الثنائي الضوئي الثلجي (APDs) وغرفة بيئية مظلمة. تشير هذه التعليمات على وجه التحديد إلى إعداد التصوير باستخدام برنامج الاقتناء الموضح في جدول المواد؛ ومع ذلك ، يمكن أيضا تطبيقها على أنظمة الفحص المجهري البؤري الأخرى.
- قم بإعداد هدف غمر الزيت المائي 63x/1.2 NA باستخدام وسط الغمر المحدد.
- باستخدام شعلة الضوء الأحمر لتوجيه تحديد المواقع ، تقدم الهدف للاتصال بوسط الغمر. في هذه المرحلة ، تجنب استخدام الضوء الأبيض أو الساطع للعثور على الأجنة لأن هذا يمكن أن ينشط PST-1P مبكرا.
- باستخدام العدسة وأثناء الإضاءة تحت الضوء الأحمر ، حدد موقع حافة قطرة الوسط ووضع الهدف مباشرة فوق هذا الموقع. هذا يمكن أن يساعد المستخدم على تحديد الاتجاه والعثور على المستوى البؤري.
- بعد ذلك ، من خلال العدسة أو على المسح الضوئي المباشر الذي يدعم البرنامج ، استخدم مرشح الطول الموجي الأحمر أو ليزر 561 نانومتر لتحديد موقع الأجنة داخل القطرة.
- استخدم وحدات التحكم في المرحلة ووضع المسح الضوئي المباشر لتعيين نقاط البداية والنهاية للحصول على مكدس z للجنين بأكمله.
- اضبط إعدادات طاقة الليزر (عادة ، مع أجهزة الكشف عالية الحساسية مثل APDs ، تكفي طاقة ليزر 561 نانومتر أقل من 5٪) ، والإزاحة الرقمية (عادة عند -0.900) لتحسين مظهر مذنبات EB3-dTomato وتقليل ضوضاء الخلفية ، والثقب عند 2 ميكرومتر ، ودقة البكسل 512 × 512 ، ووقت سكن البكسل 3.15 ميكروثانية.
- الحصول على كومة z من الجنين بأكمله مع فترات مقطع 1 ميكرومتر لتقييم مناطق نمو الأنابيب الدقيقة في الكائن الحي بأكمله (الشكل 1B).
- استخدم صورة z-stack ثلاثية الأبعاد من الخطوة 3.7 لتحديد مناطق الاهتمام (ROIs) لتجارب تتبع EB3-dTomato. قم بزيادة التكبير/التصغير إلى 3x وارسم عائد استثمار مستطيل حول منطقة الاهتمام دون الخلوية المحددة.
- احصل على فيلم بفاصل زمني لمستوى z واحد باستخدام القيم النموذجية لمعلمات التصوير: طاقة ليزر 561 نانومتر بنسبة 5٪ ، إزاحة رقمية تبلغ -0.900 ، دقة بكسل تبلغ 512 × 512 ، ثقب عند 3 ميكرومتر ، وقت سكن بكسل 3.15 ميكروثانية ، تكبير 3x ، فاصل زمني يبلغ 500 مللي ثانية.
ملاحظة: سيوفر 120 إطارا زمنيا فيلم تتبع مدته 1 دقيقة ويجب أن يكون كافيا لتحليل البيانات. يمكن أن يستمر الاستحواذ لفترة أطول ، شريطة أن يكون تبييض الفلوروفور ضئيلا (الشكل 1C). - لتنشيط PST-1P ، قم بالتبديل إلى ليزر 405 نانومتر واحصل على فيلم آخر بفاصل زمني مع ضبط ليزر 405 نانومتر على طاقة 10٪ ، ودقة بكسل تبلغ 512 × 512 ، وثقب مفتوح إلى أقصى حد ، ووقت سكن بكسل يبلغ 3.15 ميكروثانية ، وتكبير 3x ، وفاصل زمني يبلغ 500 مللي ثانية ، وما مجموعه 20 إطارا (الشكل 1D).
- قم بالتبديل مرة أخرى إلى ليزر 561 نانومتر وكرر الاستحواذ كما في الخطوة 3.9 لتأكيد فقدان مذنبات EB3-dTomato بعد تنشيط PST-1P (الشكل 1E). تأكد من أن هذا الاستحواذ يتم في أقرب وقت ممكن بعد التنشيط.
ملاحظة: يمكن تنفيذ الخطوة 3.10 بشكل متكرر لتثبيط أطول لمذنبات EB3-dTomato. ومع ذلك ، يجب مراقبة الأجنة بعناية لتجنب أي ضرر تسببه الأشعة فوق البنفسجية. - لعكس PST-1P مرة أخرى إلى حالته العابرة غير النشطة ، قم بتشغيل ليزر 514 نانومتر بقوة 10٪. احصل على فيلم بفاصل زمني مع ضبط ليزر 514 نانومتر على طاقة 10٪ ، ودقة بكسل تبلغ 512 × 512 ، وثقب مفتوح إلى أقصى حد ، ووقت سكن بكسل يبلغ 3.15 ميكروثانية ، وتكبير/تصغير 3x ، وفاصل زمني يبلغ 500 مللي ثانية ، وما مجموعه 20 إطارا زمنيا (الشكل 1F).
- كرر الخطوة 3.11 لتصور استرداد مذنبات EB3-dTomato (الشكل 1G).
4. تحليل بيانات الصور
- لتحليل وقياس تثبيط بلمرة الأنابيب الدقيقة بواسطة PSTs ، استخدم البرامج المتاحة للباحثين لتناسب احتياجاتهم الخاصة. أولئك الموصى باستخدامهم سيمتلكون أداة تتبع ، يمكنها تتبع حركة واتجاه وسرعة مذنبات EB3-dTomato يدويا أو تلقائيا16,18.
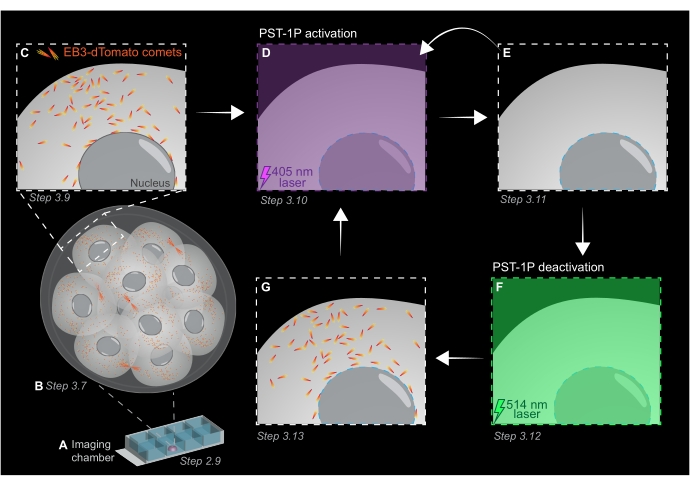
الشكل 1: التمثيل التخطيطي للتنشيط الضوئي PST-1P وإلغاء التنشيط في جنين الفأر الحي ثلاثي الأبعاد قبل الزرع. يتم إجراء جميع التجارب في ظلام دامس (خلفية سوداء) أو فقط عن طريق إضاءة الضوء الأحمر. (أ) يتم استزراع أجنة الفئران الحية قبل الزرع التي تعبر عن EB3-dTomato إلى مرحلة 16 خلية ثم يتم نقلها إلى قطرة من KSOM تحتوي على 40 ميكرومتر PST-1P في شريحة غرفة تصوير. (ب) تسمح الصورة ثلاثية الأبعاد للجنين بأكمله بتقييم نمو الأنابيب الدقيقة من خلال تصور توزيع المذنبات EB3-dTomato. (ج) لبدء التجربة، يتم تتبع مذنبات EB3-dTomato في منطقة دون خلوية باستخدام التصوير بالفاصل الزمني. (د) يؤدي التنشيط الضوئي اللاحق PST-1P في نفس المنطقة دون الخلوية باستخدام ليزر 405 نانومتر إلى فقدان مذنبات EB3-dTomato (E). يمكن تنفيذ تنشيط PST-1P المكثف ، إذا لزم الأمر ، عن طريق إضاءة ضوئية متسلسلة 405 نانومتر. (F-G) لعكس PST-1P مرة أخرى إلى حالته غير النشطة واستعادة مذنبات EB3-dTomato ، يتم تطبيق ليزر 514 نانومتر على نفس المنطقة دون الخلوية. إذا لزم الأمر ، يمكن إجراء جولات متعددة من التنشيط الضوئي وإلغاء التنشيط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
وتماشيا مع البروتوكول، تم حقن أجنة الفئران قبل الزرع بالحمض النووي الريبوزي المرسال (cRNA) ل EB3، الموسومة بالطماطم الفلورية الحمراء (EB3-dTomato). وهذا يتيح تصور الأنابيب الدقيقة المتنامية حيث يرتبط EB3 ببلمرة الأنابيب الدقيقة بالإضافة إلى نهايات24.
أجريت التجارب بعد 3 أ...
Discussion
شبكة الأنابيب الدقيقة هي جزء لا يتجزأ من الأعمال الداخلية الأساسية للخلية. وبالتالي ، فإن هذا يمثل تحديات في التلاعب بديناميكيات الأنابيب الدقيقة في الكائنات الحية ، حيث أن أي اضطراب في الشبكة يميل إلى أن يكون له عواقب واسعة النطاق على جميع جوانب الوظيفة الخلوية. يمثل ظهور مركبات استهداف ...
Disclosures
ولا يعلن صاحبا البلاغ عن أي مصلحة منافسة أو مالية.
Acknowledgements
يود المؤلفان أن يشكرا الدكتور أوليفر ثورن سيهولد ولي غاو على تزويدنا بالصور المخفضة للكوليستروتنات والمشورة بشأن إعداد المخطوطات ، وموناش للإنتاج لدعم التصوير ، وموناش مايكرو إيميتش لدعم الفحص المجهري.
تم دعم هذا العمل من خلال منحة مشروع المجلس الوطني للصحة والبحوث الطبية (NHMRC) APP2002507 إلى J.Z. ومنحة Azrieli الدراسية للمعهد الكندي للبحوث المتقدمة (CIFAR) إلى J.Z. يتم دعم المعهد الأسترالي للطب التجديدي من خلال منح من حكومة ولاية فيكتوريا والحكومة الأسترالية.
Materials
| Name | Company | Catalog Number | Comments |
| Aspirator tube | Sigma-Aldrich | A5177 | For mouth aspiration apparatus |
| Chamber slides - LabTek | Thermo Fisher Scientific | NUN155411 | |
| cRNA encoding for EB3-dTomato | N/A | N/A | Prepared according to manufacturers instructions using mMessage in vitro Transcription kit |
| Culture dishes - 35mm | Thermo Fisher Scientific | 150560 | |
| Human chorionic growth hormone | Sigma-Aldrich | C8554 | |
| Human Tubal Fluid (HTF) medium | Cosmo-Bio | CSR-R-B071 | |
| Imaris Image Analysis Software | Bitplane | ||
| Immersion Oil W 2010 | Carl Zeiss | 444969-0000-000 | For use with microscope immersion objective |
| LED torch - Red light | Celestron | 93588 | |
| M2 medium | Sigma-Aldrich | M7167 | |
| Mice - wild-type FVB/N, males and females | N/A | N/A | Females 8-9 weeks old. Males 2-6 months old. |
| Microcapillary Pipettes - Kimble | Sigma-Aldrich | Z543306 | For mouth aspiration apparatus |
| Microinjection buffer | N/A | N/A | 5 mM Tris, 5 mM NaCl, 0.1 mM EDTA, pH 7.4 |
| Mineral oil | Origio | ART-4008-5P | |
| mMessage In vitro Transcription kit | Thermo Fisher Scientific | AM1340 | |
| NanoDrop Spectrophotometer | Thermo Fisher Scientific | ||
| Potassium Simplex Optimised Medium (KSOM) medium | Cosmo-Bio | CSR-R-B074 | |
| Pregnant mare serum gonadotrophin | Prospec Bio | HOR-272 | |
| PST-1P | N/A | N/A | Borowiak, M. et al., Photoswitchable Inhibitors of Microtubule Dynamics Optically Control Mitosis and Cell Death. Cell. 162 (2), 403-411, doi:10.1016/j.cell.2015.06.049, (2015). |
| RNA purification kit | Sangon | B511361-0100 | |
| Ultrapure water | Sigma-Aldrich | W1503 | |
| ZEN Black Software | Carl Zeiss |
References
- Hawdon, A., Aberkane, A., Zenker, J. Microtubule-dependent subcellular organisation of pluripotent cells. Development. 148 (20), (2021).
- Sanchez, A. D., Feldman, J. L. Microtubule-organizing centers: from the centrosome to non-centrosomal sites. Current Opinion in Cell Biology. 44, 93-101 (2017).
- Galli, M., Morgan, D. O. Cell size determines the strength of the spindle assembly checkpoint during embryonic development. Developmental Cell. 36 (3), 344-352 (2016).
- Vazquez-Diez, C., Paim, L. M. G., FitzHarris, G. Cell-size-independent spindle checkpoint failure underlies chromosome segregation error in mouse embryos. Current Biology. 29 (5), 865-873 (2019).
- Baudoin, J. P., Alvarez, C., Gaspar, P., Metin, C. Nocodazole-induced changes in microtubule dynamics impair the morphology and directionality of migrating medial ganglionic eminence cells. Developmental Neuroscience. 30 (1-3), 132-143 (2008).
- Munz, F., et al. Human mesenchymal stem cells lose their functional properties after paclitaxel treatment. Scientific Reports. 8 (1), 312 (2018).
- Jordan, M. A., Wilson, L. Microtubules as a target for anticancer drugs. Nature Reviews Cancer. 4 (4), 253-265 (2004).
- Vasquez, R. J., Howell, B., Yvon, A. M., Wadsworth, P., Cassimeris, L. Nanomolar concentrations of nocodazole alter microtubule dynamic instability in vivo and in vitro. Molecular Biology of the Cell. 8 (6), 973-985 (1997).
- Borowiak, M., et al. Photoswitchable inhibitors of microtubule dynamics optically control mitosis and cell death. Cell. 162 (2), 403-411 (2015).
- Gaspari, R., Prota, A. E., Bargsten, K., Cavalli, A., Steinmetz, M. O. Structural basis of cis- and trans-Combretastatin binding to tubulin. Chem. 2 (1), 102-113 (2017).
- Thorn-Seshold, O., Meiring, J. Photocontrolling microtubule dynamics with photoswitchable chemical reagents. ChemRxiv. , (2021).
- Kopf, A., et al. Microtubules control cellular shape and coherence in amoeboid migrating cells. Journal of Cell Biology. 219 (6), 201907154 (2020).
- Sawada, M., et al. PlexinD1 signaling controls morphological changes and migration termination in newborn neurons. The EMBO Journal. 37 (4), 97404 (2018).
- Singh, A., et al. Polarized microtubule dynamics directs cell mechanics and coordinates forces during epithelial morphogenesis. Nature Cell Biology. 20 (10), 1126-1133 (2018).
- Kepiro, M., et al. Azidoblebbistatin, a photoreactive myosin inhibitor. Proceedings of the National Academy of Sciences of the United States of America. 109 (24), 9402-9407 (2012).
- Zenker, J., et al. A microtubule-organizing center directing intracellular transport in the early mouse embryo. Science. 357 (6354), 925-928 (2017).
- White, M. D., Zenker, J., Bissiere, S., Plachta, N. Instructions for assembling the early mammalian embryo. Developmental Cell. 45 (6), 667-679 (2018).
- Zenker, J., et al. Expanding actin rings zipper the mouse embryo for blastocyst formation. Cell. 173 (3), 776-791 (2018).
- Theisen, U., et al. Microtubules and motor proteins support zebrafish neuronal migration by directing cargo. Journal of Cell Biology. 219 (10), 201908040 (2020).
- Rulicke, T. Pronuclear microinjection of mouse zygotes. Methods in Molecular Biology. 254, 165-194 (2004).
- Greaney, J., Subramanian, G. N., Ye, Y., Homer, H. Isolation and in vitro culture of mouse oocytes. Bio-protocol. 11 (15), 4104 (2021).
- Subramanian, G. N., et al. Oocytes mount a noncanonical DNA damage response involving APC-Cdh1-mediated proteolysis. Journal of Cell Biology. 219 (4), 201907213 (2020).
- Mihajlovic, A. I., Bruce, A. W. The first cell-fate decision of mouse preimplantation embryo development: integrating cell position and polarity. Open Biology. 7 (11), 170210 (2017).
- Roostalu, J., et al. The speed of GTP hydrolysis determines GTP cap size and controls microtubule stability. Elife. 9, 51992 (2020).
- Gao, L., et al. In vivo photocontrol of microtubule dynamics and integrity, migration and mitosis, by the potent GFP-imaging-compatible photoswitchable reagents SBTubA4P and SBTub2M. BioRxiv. bioRxiv. , (2021).
- Tichy, A. M., Gerrard, E. J., Legrand, J. M. D., Hobbs, R. M., Janovjak, H. Engineering strategy and vector library for the rapid generation of modular light-controlled protein-protein interactions. Journal of Molecular Biology. 431 (17), 3046-3055 (2019).
- van Haren, J., Adachi, L. S., Wittmann, T. Optogenetic control of microtubule dynamics. Methods in Molecular Biology. 2101, 211-234 (2020).
- Adikes, R. C., Hallett, R. A., Saway, B. F., Kuhlman, B., Slep, K. C. Control of microtubule dynamics using an optogenetic microtubule plus end-F-actin cross-linker. Journal of Cell Biology. 217 (2), 779-793 (2018).
- Kogler, A. C., et al. Extremely rapid and reversible optogenetic perturbation of nuclear proteins in living embryos. Developmental Cell. 56 (16), 2348-2363 (2021).
- Maghelli, N., Tolic-Norrelykke, I. M. Laser ablation of the microtubule cytoskeleton: setting up and working with an ablation system. Methods in Molecular Biology. 777, 261-271 (2011).
- Bukhari, S. N. A., Kumar, G. B., Revankar, H. M., Qin, H. L. Development of combretastatins as potent tubulin polymerization inhibitors. Bioorganic Chemistry. 72, 130-147 (2017).
- Gilazieva, Z., Ponomarev, A., Rutland, C., Rizvanov, A., Solovyeva, V. Promising applications of tumor spheroids and organoids for personalized medicine. Cancers (Basel). 12 (10), 2727 (2020).
- Scherer, K. M., et al. Three-dimensional imaging and uptake of the anticancer drug combretastatin in cell spheroids and photoisomerization in gels with multiphoton excitation. Journal of Biomedical Optics. 20 (7), 78003 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved