É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Manipulação subcelular espiostemporal do Citoesqueleto microtubulo no embrião do rato de pré-implantação vivo usando Fotostatinas
Neste Artigo
Resumo
Inibidores típicos de microtúbulos, amplamente utilizados em pesquisas básicas e aplicadas, têm efeitos de longo alcance nas células. Recentemente, as fotostatinas surgiram como uma classe de inibidores de microtúbulos fotossentaráveis, capazes de manipulação instantânea, reversível e espacialmente precisa de microtúbulos. Este protocolo passo a passo detalha a aplicação de fotostatinas em um embrião de rato de pré-implantação 3D vivo.
Resumo
O citoesqueleto microtúbulo forma a estrutura de uma célula e é fundamental para o transporte intracelular, divisão celular e transdução de sinais. A ruptura farmacológica tradicional da onipresente rede de microtúbulos usando, por exemplo, nocodazol pode ter consequências devastadoras para qualquer célula. Inibidores de microtúbulos reversivelmente fotossceráveis têm o potencial de superar as limitações, permitindo que os efeitos medicamentosos sejam implementados de forma espacialmente controlada. Uma dessas famílias de drogas é a fotostatina baseada em azobenzeno (PSTs). Esses compostos são inativos em condições escuras, e após a iluminação com luz UV, eles se ligam ao local de ligação colchicina de β-tubulina e bloqueiam a polimerização de microtúbulos e a rotatividade dinâmica. Aqui, a aplicação de PSTs no embrião de rato de pré-implantação ao vivo 3D (3D) é definida para interromper a rede de microtúbulos em um nível subcelular. Este protocolo fornece instruções para a configuração experimental, bem como parâmetros de ativação e desativação de luz para PSTs usando microscopia confocal de células vivas. Isso garante a reprodutibilidade e permite que outras pessoas apliquem esse procedimento às suas questões de pesquisa. Fotossensíveis inovadores como os PSTs podem evoluir como ferramentas poderosas para avançar na compreensão da rede dinâmica de microtúbulos intracelulares e manipular não invasivamente o citoesqueleto em tempo real. Além disso, os PSTs podem ser úteis em outras estruturas 3D, como organoides, blastóides ou embriões de outras espécies.
Introdução
A arquitetura de microtúbulos varia amplamente entre diferentes tipos de células para suportar diversas funções 1,2. Sua natureza dinâmica de crescimento e encolhimento permite uma rápida adaptação a pistas extra e intracelulares e responder às necessidades em constante mudança de uma célula. Assim, pode ser considerada como a "impressão digital morfológica" desempenhando um papel fundamental na identidade celular.
O direcionamento farmacológico do citoesqueleto microtúbulo usando inibidores de pequenas moléculas levou a uma infinidade de descobertas fundamentais na biologia do desenvolvimento, biologia de células-tronco, biologia do câncer e neurobiologia 3,4,5,6,7. Essa abordagem, embora indispensável, apresenta várias limitações, como toxicidade e efeitos fora do alvo. Por exemplo, um dos agentes de microtúbula mais utilizados, nocodazole, é uma poderosa droga despolimerizadora de microtúbulos8. No entanto, inibidores de pequenas moléculas como o nocodazol são ativos desde o momento da aplicação e, dada a natureza essencial do citoesqueleto microtúbulo para muitas funções celulares críticas, a despolimerização global de microtúbulos pode produzir efeitos fora do alvo, que podem ser inadequados para muitas aplicações. Além disso, o tratamento do nocodazol é irreversível, a menos que as amostras sejam lavadas livre da droga, prevenindo imagens vivas contínuas e, portanto, o rastreamento preciso de filamentos microtúbulos individuais.
O desenvolvimento de compostos ativados pela luz começou com a criação de moléculas fotouncaged e anunciou uma nova era na segmentação e monitoramento dos efeitos da inibição do crescimento de microtúbulos de forma precisa e espacialmente controlada. Uma família de drogas reversivelmente fotowitchable, fotostatinas (PSTs), foram desenvolvidas substituindo o componente de stilbene da combretastatina A-4 por azobenzeno9. Os PSTs estão inativos até a iluminação com luz UV, pela qual a configuração trans inativa se converte na configuração cis ativa por isomerização reversível. Os Cis-PSTs inibem a polimerização de microtúbulos ligando-se ao local de ligação colchicina de β-tubulina, bloqueando sua interface com β-tubulina e prevenindo a dimerização necessária para o crescimento de microtúbulos10. Entre uma coorte de PSTs, pst-1P emergiu como um composto de chumbo, pois tem a maior potência, é totalmente solúvel em água, e mostra um rápido início de bioatividade após a iluminação.
A trans-isomerização mais eficaz de PSTs ocorre em comprimentos de onda entre 360-420 nm, o que permite duas opções para ativação de PST. Uma linha laser de 405 nm em um microscópio confocal típico pode ser administrada para o direcionamento espacial ideal da inibição do crescimento de microtúbulos. A capacidade de identificar a localização e o tempo da ativação do PST através da iluminação laser de 405 nm facilita o controle temporal e espacial preciso, permitindo a interrupção da dinâmica dos microtúbulos em um nível subcelular, dentro do vezes de resposta sub-segundo9. Alternativamente, uma luz LED UV acessível permite que a iluminação do organismo inteiro induza a interrupção em todo o organismo da arquitetura do microtúbulo. Esta pode ser uma alternativa econômica para pesquisadores para os quais o início precisamente cronometrado da inibição, em vez de direcionamento espacial, é o objetivo. Outra característica dos PSTs é sua inativação sob demanda, aplicando luz verde de um comprimento de onda na faixa de 510-540 nm9. Isso permite o rastreamento de filamentos microtúbulos antes, durante e depois da inibição de crescimento mediada pelo PST.
Os PSTs, embora ainda um projeto relativamente recente, têm sido usados em inúmeras aplicações in vitro em diversos campos de pesquisa11, incluindo a investigação de novos mecanismos de migração celular em ameebóides12, em neurônios isolados do cérebro do camundongo recém-nascido13, e desenvolvimento de epitélio de asa em Drosophila melanogaster14 . Outras drogas leves reativas provaram ser ferramentas valiosas na interrupção direcionada da função celular. Por exemplo, um análogo de blebbistatina, azidoblebbistatin, foi usado para a inibição aprimorada da mosina sob iluminação15,16. Isso destaca o potencial para novas descobertas devido à capacidade de inibição espacialmente controlada da função celular.
Organismos 3D vivos apresentam sistemas soberbos e ainda mais delicados para manipular a dinâmica dos microtúbulos em um nível animal inteiro, unicelular ou subcelular em condições fisiológicas. Em particular, o embrião do rato de pré-implantação oferece uma visão excepcional do funcionamento interno da célula, bem como das relações intercelulares dentro de um organismo17. Ciclos consecutivos de ativação e desativação de PSTs contribuíram para a caracterização da ponte interfase, uma estrutura pós-citocinética entre as células, como um centro-organizador de microtúbulos não centrosômicos no embrião de camundongos pré-implantação16. Uma configuração experimental semelhante demonstrou o envolvimento de microtúbulos crescentes na vedação do embrião do rato para permitir a formação de blastocisto18. Além disso, os PSTs também foram usados em embriões inteiros de zebrafish para investigar a migração de células neuronais inibindo o crescimento de microtúbulos em um subconjunto de células no cérebro traseiro19.
Este protocolo descreve a configuração experimental e o uso de PST-1P no embrião do rato de pré-implantação. As instruções aqui apresentadas também podem orientar a aplicação de PSTs para uma ampla gama de objetivos, como o estudo da segregação de cromossomo e divisão celular, tráfico de carga intracelular e morfogênese celular e migração. Além disso, tais estudos auxiliarão a implementação de PSTs em sistemas organoides, blastóides e outros modelos de embriões, como Caenorhabditis elegans e Xenopus laevis, bem como potencialmente expandirão o uso de PSTs para tecnologias de fertilização in vitro .
Protocolo
Os experimentos foram aprovados pelo Comitê de Ética Animal de Monash sob o número de ética animal 19143. Os animais foram alojados em condições específicas de casária animal sem patógenos na instalação animal (Monash Animal Research Platform) em estrita conformidade com as diretrizes éticas.
1. Coleção de embriões de camundongos pré-implantação
- Camundongos superovulados e acasalados, conforme descrito anteriormente16,18, em conformidade com as diretrizes institucionais de ética animal.
NOTA: As cepas mais utilizadas para a coleta de embriões vivos são os camundongos C57BL/6 ou FVB/N. Todos os dados aqui mostrados foram gerados usando camundongos FVB/N. - Na manhã seguinte ao acasalamento, o flush zygotes do oviduto usando m2 médio como descrito20, ou fluido tubal humano (HTF) médio. Usando um aparelho de pipeta bucal como descrito21,22, transfira zygotes para gotículas frescas de Potássico Simplex Optimised Medium (KSOM), pré-armados a 37 °C e equilibradas para 5% de CO2, em um prato de cultura de 35 mm sobreposto com um volume suficiente de óleo mineral para garantir a cobertura da mídia.
- Zygotes microinjetados como descrito20 com codificação cRNA para um microtúbulo vermelho fluorescente marcado mais marcador final. Aqui, o cRNA para a proteína de ligação final 3 (EB3)-dTomato foi usado em concentração de 30 ng/μL após a preparação e purificação como descrito16,18 e diluição no tampão de microinjeção.
NOTA: Recomenda-se preparar o cRNA com antecedência e armazená-lo a -20 °C até que seja necessário. - Embriões de cultura no escuro a 37 °C e 5% de CO2 até que os embriões tenham atingido o estágio de desenvolvimento desejado para o tratamento PST-1P.
NOTA: Para um recurso abrangente dos tempos de cultura necessários para diferentes estágios embrionários, consulte23. Para embriões de estágio de 16 células usados aqui, cultura para o dia embrionário 3 (E3) pós-fertilização.
2. Preparação de pratos de drogas e imagens
NOTA: Para as etapas 2.1-2.10, trabalhe exclusivamente nas condições escuras ou de luz vermelha para evitar a ativação PST-1P não intencional. A folha de alumínio ou as tampas escuras devem ser usadas para todos os tubos e pratos que contenham PSTs.
- Prepare uma concentração de estoque de 50 mM PST-1P em água ultrauso.
NOTA: O peso molecular do PST-1P é de 440 g/mol. A solução de estoque é estável a -20 °C por até 1 ano. PST-1P é solúvel em água ou tampão aquoso, mas não se dissolve facilmente em DMSO. - A partir da etapa 2.1, prepare uma concentração de trabalho intermediária de 800 μM PST-1P em água ultrapura.
- Diluir PST-1P para uma concentração final de 40 μM em KSOM fresco. Como um experimento típico requer aproximadamente 20 μL de KSOM tratado com PST-1P, diluir 1 μL de 800 μM PST-1P em 19 μL de KSOM para um volume final de 20 μL para garantir que o meio suficiente seja preparado com antecedência, usando apenas luz vermelha para visibilidade.
NOTA: Tanto a concentração quanto o status de ativação de uma diluição PST-1P podem ser verificados tomando um espectro de absorção UV-Vis usando um espectrômetro que deve ser feito durante o estabelecimento do ensaio. A absorvância a 380 nm (A380) de uma diluição totalmente trans de 40 μM em uma cuvette de 1 cm deve ser de aproximadamente 0,8. Ambas as formas cis e trans têm a mesma absorvância a 455 nm (A455). Quando a proporção do A380 para o A455 é de aproximadamente 9:1, a diluição é inativa (totalmente trans). Quando a razão A380:A455 é 1:2, a diluição é totalmente ativada (totalmente cis). As relações intermediárias refletem estados intermediários de ativação. - Para preparar o slide de câmara para imagens ao vivo, pipeta 10 μL de KSOM tratado pst-1P no centro de um poço para formar uma gotícula hemisférica (Figura 1A).
- Adicione suavemente óleo mineral suficiente para cobrir a gota, garantindo que ela não disperse a mídia. Isso garantirá que a gota não evapore.
- Pré-quente e CO2-equilibre a antena de slides de câmara em uma incubadora a 37 °C e 5% de CO2 para um mínimo de 3h ou no máximo, durante a noite.
- Ao final do período de equilíbrio na etapa 2.6, prepare um prato de cultura de 35 mm com uma gota de 10 μL de KSOM tratado por PST-1P, pré-armado e equilibrado como um passo de lavagem. Não sobreponha com óleo.
- Transfira embriões por tubos bucais na gotícula KSOM tratada pelo PST-1P a partir da etapa 2.7.
NOTA: As etapas 2.7 e 2.8 são recomendadas para a tubulação bucal de embriões, mas são opcionais. - Transfira imediatamente os embriões por tubos de boca para o centro da gotícula KSOM tratada pst-1P no slide da câmara de imagem preparado nas etapas 2.4-2.6 (Figura 1A).
- Incubar embriões a 37 °C e 5% de CO2 em KSOM tratados com PST-1P no slide da câmara de imagem por pelo menos 1 h antes da imagem. Se possível, monte o slide da câmara no microscópio dentro de uma câmara ambiental a 37 °C e 5% de CO2, e na escuridão completa para garantir que todos os PST-1Ps estejam na configuração transativa inativa e que os embriões possam afundar até o fundo do prato.
3. Imagem ao vivo e fotoativação PST-1P
NOTA: As etapas 3.1-3.13 são realizadas em um microscópio confocal de varredura a laser equipado com detectores de fotodiodo de avalanche (APDs) e uma câmara ambiental escura. Estas instruções referem-se especificamente à configuração de imagem usando o software de aquisição descrito na Tabela de Materiais; no entanto, eles também podem ser aplicados a outros sistemas de microscopia confocal.
- Prepare um objetivo de imersão de óleo de água 63x/1.2 NA com o meio de imersão prescrito.
- Usando uma tocha de luz vermelha para orientar o posicionamento, avance com o objetivo de entrar em contato com o meio de imersão. Nesta fase, evite usar luz branca ou brilhante para encontrar os embriões, pois isso poderia ativar precocemente o PST-1P.
- Usando a ocular e sob iluminação da luz vermelha, localize a borda da gota de meio e posicione o objetivo diretamente sobre este local. Isso pode ajudar o usuário a estabelecer orientação e encontrar o plano focal.
- Em seguida, através da ocular ou na varredura de modo ao vivo habilitada para software, use um filtro de comprimento de onda vermelho ou laser de 561 nm para localizar os embriões dentro da gotícula.
- Use controladores de palco e modo de varredura ao vivo para definir os pontos de partida e fim para adquirir uma pilha z de todo o embrião.
- Ajuste as configurações de alimentação do laser (normalmente, com detectores altamente sensíveis, como os APDs, é suficiente um laser de 561 nm de potência inferior a 5%, compensação digital (tipicamente em -0,900) para otimizar a aparência de cometas EB3-dTomato e minimizar o ruído de fundo, pinhole a 2 μm, resolução de pixels de 512 x 512, e tempo de pixel de 3,15 μs.
- Adquira uma pilha z de todo o embrião com intervalos de seção de 1 μm para avaliar áreas de crescimento de microtúbulos em todo o organismo (Figura 1B).
- Use a imagem 3D z-stack da etapa 3.7 para identificar regiões de interesse (ROIs) para experimentos de rastreamento EB3-dTomato. Aumente o zoom para 3x e desenhe um ROI retangular em torno da área subcelular específica de interesse.
- Adquira uma foto de lapso de tempo de um único z-plane usando os valores típicos dos parâmetros de imagem: 561 nm de potência laser a 5%, deslocamento digital de -0,900, resolução de pixels de 512 x 512, pinhole a 3 μm, pixel dwell tempo de 3,15 μs, zoom de 3x, intervalo de tempo de 500 ms.
NOTA: 120 períodos de tempo fornecerão um filme de rastreamento de 1 min e devem ser suficientes para análise de dados. A aquisição pode continuar por mais tempo, desde que o branqueamento do fluorohore seja mínimo (Figura 1C). - Para ativar o PST-1P, mude para um laser de 405 nm e adquira outra foto de lapso de tempo com o conjunto laser de 405 nm para 10% de potência, resolução de pixels de 512 x 512, pinhole aberto no máximo, pixel de 3,15 μs, zoom de 3x, intervalo de tempo de 500 ms, e um total de 20 quadros (Figura 1D).
- Mude de volta para laser de 561 nm e repita a aquisição como na etapa 3.9 para confirmar a perda de cometas EB3-dTomato após a ativação do PST-1P (Figura 1E). Certifique-se de que essa aquisição ocorra o mais rápido possível após a ativação.
NOTA: O passo 3.10 pode ser realizado repetidamente para maior inibição dos cometas EB3-dTomato. No entanto, os embriões devem ser monitorados cuidadosamente para evitar qualquer dano causado pela luz UV. - Para reverter o PST-1P de volta ao seu trans-estado inativos, engaje um laser de 514 nm com 10% de potência. Adquira um filme de lapso de tempo com o laser de 514 nm definido para 10% de potência, resolução de pixels de 512 x 512, pinhole aberto máximamente, pixel de 3,15 μs, zoom de 3x, intervalo de tempo de 500 ms, e um total de 20 períodos (Figura 1F).
- Repita o passo 3.11 para visualizar a recuperação dos cometas EB3-dTomato (Figura 1G).
4. Análise de dados de imagem
- Para analisar e quantificar a inibição da polimerização de microtúbulos por PSTs, utilize programas de software disponíveis aos pesquisadores para atender às suas necessidades específicas. Aqueles recomendados para uso possuirão uma ferramenta de rastreamento, que pode rastrear manualmente ou automaticamente o movimento, a direção e a velocidade dos cometas EB3-dTomato16,18.
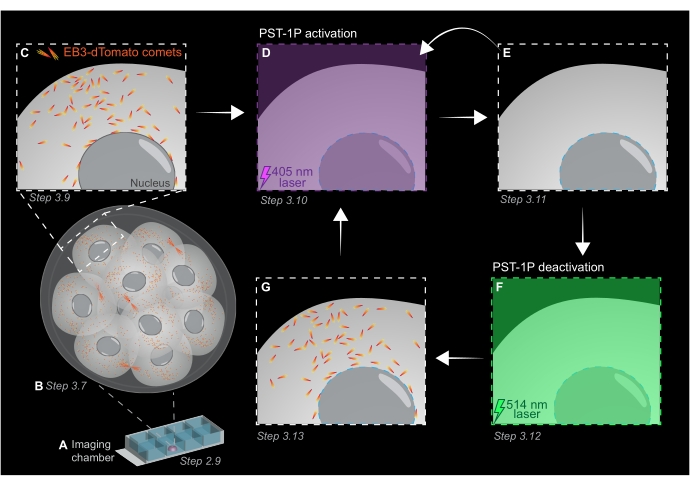
Figura 1: Representação esquemática da fotoativação e desativação do PST-1P no embrião de camundongos de pré-implantação 3D vivo. Todos os experimentos são realizados em completa escuridão (fundo preto) ou apenas pela iluminação da luz vermelha. (A) Embriões de camundongos de pré-implantação ao vivo expressando EB3-dTomato são cultivados para estágio de 16 células e, em seguida, transferidos para uma gotícula de KSOM contendo 40 μM PST-1P em um slide de câmara de imagem. (B) Uma imagem 3D de todo o embrião permite a avaliação do crescimento dos microtúbulos visualizando a distribuição de cometas EB3-dTomato. (C) Para iniciar o experimento, os cometas EB3-dTomato são rastreados em uma região subcelular usando imagens de lapso de tempo. (D) A fotoativação PST-1P subsequente na mesma região subcelular usando um laser de 405 nm resulta na perda de cometas EB3-dTomato (E). A ativação intensificada do PST-1P pode ser implementada, se necessário, por iluminação de luz sequencial de 405 nm. (F-G) Para reverter o PST-1P de volta ao seu estado inativo e restaurar cometas EB3-dTomato, um laser de 514 nm é aplicado na mesma região subcelular. Se necessário, várias rodadas de fotoativação e desativação podem ser realizadas. Clique aqui para ver uma versão maior desta figura.
Resultados
De acordo com o protocolo, os embriões de camundongos pré-implantação foram microinjetados com cRNA para EB3, marcado com dTomato fluorescente vermelho (EB3-dTomato). Isso permite a visualização de microtúbulos em crescimento à medida que o EB3 se liga ao microtúbulo polimerizador mais termina24.
Os experimentos foram realizados 3 dias após a fertilização (E3) quando o embrião do camundongo é composto por 16 células. Qualquer outro estágio de desenvolvim...
Discussão
A rede de microtúbulos é parte integrante do funcionamento interno fundamental de uma célula. Consequentemente, isso apresenta desafios na manipulação da dinâmica dos microtúbulos em organismos vivos, pois qualquer perturbação à rede tende a ter consequências generalizadas para todos os aspectos da função celular. O surgimento de compostos de microtúbulos fototravavel apresenta uma maneira de manipular precisamente o citoesqueleto em um nível subcelular, com controle superior para a indução e reversão d...
Divulgações
Os autores declaram não haver interesse concorrente ou financeiro.
Agradecimentos
Os autores gostariam de agradecer ao Dr. Oliver Thorn-Seshold e Li Gao por nos fornecerem fotostatinas e conselhos sobre preparação de manuscritos, Monash Production para suporte de filmagem e Monash Micro Imaging para suporte a microscopia.
Este trabalho foi apoiado pelo projeto do National Health and Medical Research Council (NHMRC) para a J.Z. e o Instituto Canadense de Pesquisa Avançada (CIFAR) Azrieli Scholarship para J.Z. O Instituto Australiano de Medicina Regenerativa é apoiado por subsídios do Governo do Estado de Victoria e do Governo Australiano.
Materiais
| Name | Company | Catalog Number | Comments |
| Aspirator tube | Sigma-Aldrich | A5177 | For mouth aspiration apparatus |
| Chamber slides - LabTek | Thermo Fisher Scientific | NUN155411 | |
| cRNA encoding for EB3-dTomato | N/A | N/A | Prepared according to manufacturers instructions using mMessage in vitro Transcription kit |
| Culture dishes - 35mm | Thermo Fisher Scientific | 150560 | |
| Human chorionic growth hormone | Sigma-Aldrich | C8554 | |
| Human Tubal Fluid (HTF) medium | Cosmo-Bio | CSR-R-B071 | |
| Imaris Image Analysis Software | Bitplane | ||
| Immersion Oil W 2010 | Carl Zeiss | 444969-0000-000 | For use with microscope immersion objective |
| LED torch - Red light | Celestron | 93588 | |
| M2 medium | Sigma-Aldrich | M7167 | |
| Mice - wild-type FVB/N, males and females | N/A | N/A | Females 8-9 weeks old. Males 2-6 months old. |
| Microcapillary Pipettes - Kimble | Sigma-Aldrich | Z543306 | For mouth aspiration apparatus |
| Microinjection buffer | N/A | N/A | 5 mM Tris, 5 mM NaCl, 0.1 mM EDTA, pH 7.4 |
| Mineral oil | Origio | ART-4008-5P | |
| mMessage In vitro Transcription kit | Thermo Fisher Scientific | AM1340 | |
| NanoDrop Spectrophotometer | Thermo Fisher Scientific | ||
| Potassium Simplex Optimised Medium (KSOM) medium | Cosmo-Bio | CSR-R-B074 | |
| Pregnant mare serum gonadotrophin | Prospec Bio | HOR-272 | |
| PST-1P | N/A | N/A | Borowiak, M. et al., Photoswitchable Inhibitors of Microtubule Dynamics Optically Control Mitosis and Cell Death. Cell. 162 (2), 403-411, doi:10.1016/j.cell.2015.06.049, (2015). |
| RNA purification kit | Sangon | B511361-0100 | |
| Ultrapure water | Sigma-Aldrich | W1503 | |
| ZEN Black Software | Carl Zeiss |
Referências
- Hawdon, A., Aberkane, A., Zenker, J. Microtubule-dependent subcellular organisation of pluripotent cells. Development. 148 (20), (2021).
- Sanchez, A. D., Feldman, J. L. Microtubule-organizing centers: from the centrosome to non-centrosomal sites. Current Opinion in Cell Biology. 44, 93-101 (2017).
- Galli, M., Morgan, D. O. Cell size determines the strength of the spindle assembly checkpoint during embryonic development. Developmental Cell. 36 (3), 344-352 (2016).
- Vazquez-Diez, C., Paim, L. M. G., FitzHarris, G. Cell-size-independent spindle checkpoint failure underlies chromosome segregation error in mouse embryos. Current Biology. 29 (5), 865-873 (2019).
- Baudoin, J. P., Alvarez, C., Gaspar, P., Metin, C. Nocodazole-induced changes in microtubule dynamics impair the morphology and directionality of migrating medial ganglionic eminence cells. Developmental Neuroscience. 30 (1-3), 132-143 (2008).
- Munz, F., et al. Human mesenchymal stem cells lose their functional properties after paclitaxel treatment. Scientific Reports. 8 (1), 312 (2018).
- Jordan, M. A., Wilson, L. Microtubules as a target for anticancer drugs. Nature Reviews Cancer. 4 (4), 253-265 (2004).
- Vasquez, R. J., Howell, B., Yvon, A. M., Wadsworth, P., Cassimeris, L. Nanomolar concentrations of nocodazole alter microtubule dynamic instability in vivo and in vitro. Molecular Biology of the Cell. 8 (6), 973-985 (1997).
- Borowiak, M., et al. Photoswitchable inhibitors of microtubule dynamics optically control mitosis and cell death. Cell. 162 (2), 403-411 (2015).
- Gaspari, R., Prota, A. E., Bargsten, K., Cavalli, A., Steinmetz, M. O. Structural basis of cis- and trans-Combretastatin binding to tubulin. Chem. 2 (1), 102-113 (2017).
- Thorn-Seshold, O., Meiring, J. Photocontrolling microtubule dynamics with photoswitchable chemical reagents. ChemRxiv. , (2021).
- Kopf, A., et al. Microtubules control cellular shape and coherence in amoeboid migrating cells. Journal of Cell Biology. 219 (6), 201907154 (2020).
- Sawada, M., et al. PlexinD1 signaling controls morphological changes and migration termination in newborn neurons. The EMBO Journal. 37 (4), 97404 (2018).
- Singh, A., et al. Polarized microtubule dynamics directs cell mechanics and coordinates forces during epithelial morphogenesis. Nature Cell Biology. 20 (10), 1126-1133 (2018).
- Kepiro, M., et al. Azidoblebbistatin, a photoreactive myosin inhibitor. Proceedings of the National Academy of Sciences of the United States of America. 109 (24), 9402-9407 (2012).
- Zenker, J., et al. A microtubule-organizing center directing intracellular transport in the early mouse embryo. Science. 357 (6354), 925-928 (2017).
- White, M. D., Zenker, J., Bissiere, S., Plachta, N. Instructions for assembling the early mammalian embryo. Developmental Cell. 45 (6), 667-679 (2018).
- Zenker, J., et al. Expanding actin rings zipper the mouse embryo for blastocyst formation. Cell. 173 (3), 776-791 (2018).
- Theisen, U., et al. Microtubules and motor proteins support zebrafish neuronal migration by directing cargo. Journal of Cell Biology. 219 (10), 201908040 (2020).
- Rulicke, T. Pronuclear microinjection of mouse zygotes. Methods in Molecular Biology. 254, 165-194 (2004).
- Greaney, J., Subramanian, G. N., Ye, Y., Homer, H. Isolation and in vitro culture of mouse oocytes. Bio-protocol. 11 (15), 4104 (2021).
- Subramanian, G. N., et al. Oocytes mount a noncanonical DNA damage response involving APC-Cdh1-mediated proteolysis. Journal of Cell Biology. 219 (4), 201907213 (2020).
- Mihajlovic, A. I., Bruce, A. W. The first cell-fate decision of mouse preimplantation embryo development: integrating cell position and polarity. Open Biology. 7 (11), 170210 (2017).
- Roostalu, J., et al. The speed of GTP hydrolysis determines GTP cap size and controls microtubule stability. Elife. 9, 51992 (2020).
- Gao, L., et al. In vivo photocontrol of microtubule dynamics and integrity, migration and mitosis, by the potent GFP-imaging-compatible photoswitchable reagents SBTubA4P and SBTub2M. BioRxiv. bioRxiv. , (2021).
- Tichy, A. M., Gerrard, E. J., Legrand, J. M. D., Hobbs, R. M., Janovjak, H. Engineering strategy and vector library for the rapid generation of modular light-controlled protein-protein interactions. Journal of Molecular Biology. 431 (17), 3046-3055 (2019).
- van Haren, J., Adachi, L. S., Wittmann, T. Optogenetic control of microtubule dynamics. Methods in Molecular Biology. 2101, 211-234 (2020).
- Adikes, R. C., Hallett, R. A., Saway, B. F., Kuhlman, B., Slep, K. C. Control of microtubule dynamics using an optogenetic microtubule plus end-F-actin cross-linker. Journal of Cell Biology. 217 (2), 779-793 (2018).
- Kogler, A. C., et al. Extremely rapid and reversible optogenetic perturbation of nuclear proteins in living embryos. Developmental Cell. 56 (16), 2348-2363 (2021).
- Maghelli, N., Tolic-Norrelykke, I. M. Laser ablation of the microtubule cytoskeleton: setting up and working with an ablation system. Methods in Molecular Biology. 777, 261-271 (2011).
- Bukhari, S. N. A., Kumar, G. B., Revankar, H. M., Qin, H. L. Development of combretastatins as potent tubulin polymerization inhibitors. Bioorganic Chemistry. 72, 130-147 (2017).
- Gilazieva, Z., Ponomarev, A., Rutland, C., Rizvanov, A., Solovyeva, V. Promising applications of tumor spheroids and organoids for personalized medicine. Cancers (Basel). 12 (10), 2727 (2020).
- Scherer, K. M., et al. Three-dimensional imaging and uptake of the anticancer drug combretastatin in cell spheroids and photoisomerization in gels with multiphoton excitation. Journal of Biomedical Optics. 20 (7), 78003 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados