È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Manipolazione subcellulare spaziotemporale del citoscheletro del microtubulo nell'embrione di topo vivente preimpianto utilizzando le fotostattine
In questo articolo
Riepilogo
I tipici inibitori dei microtubuli, ampiamente utilizzati nella ricerca di base e applicata, hanno effetti di vasta portata sulle cellule. Recentemente, le fotostattine sono emerse come una classe di inibitori dei microtubuli fotointerruttori, in grado di manipolare istantaneamente, reversibile e spaziotemporalmente precisa dei microtubuli. Questo protocollo passo-passo descrive in dettaglio l'applicazione delle fototitine in un embrione di topo preimpianto vivo 3D.
Abstract
Il citoscheletro microtubulo forma la struttura di una cellula ed è fondamentale per il trasporto intracellulare, la divisione cellulare e la trasduzione del segnale. L'interruzione farmacologica tradizionale della rete di microtubuli onnipresenti che utilizza, ad esempio, il nocodazolo può avere conseguenze devastanti per qualsiasi cellula. Gli inibitori dei microtubuli fotocomducibili in modo reversibile hanno il potenziale per superare le limitazioni consentendo l'implementazione degli effetti dei farmaci in modo spatiotemporalmente controllato. Una di queste famiglie di farmaci è la fototitina a base di azobenzene (PST). Questi composti sono inattivi in condizioni di oscurità e, dopo l'illuminazione con luce UV, si legano al sito di legame con la colchicina della β-tubulina e bloccano la polimerizzazione dei microtubuli e il turnover dinamico. Qui, l'applicazione dei PST nell'embrione di topo preimpianto vivo tridimensionale (3D) è destinata a interrompere la rete di microtubuli a livello subcellulare. Questo protocollo fornisce istruzioni per la configurazione sperimentale, nonché parametri di attivazione e disattivazione della luce per i PST utilizzando la microscopia confocale a cellule vive. Ciò garantisce la riproducibilità e consente ad altri di applicare questa procedura alle loro domande di ricerca. Fotointerruttori innovativi come i PST possono evolversi come potenti strumenti per far progredire la comprensione della rete dinamica di microtubuli intracellulari e per manipolare in modo non invasivo il citoscheletro in tempo reale. Inoltre, i PST possono rivelarsi utili in altre strutture 3D come organoidi, blastoidi o embrioni di altre specie.
Introduzione
L'architettura dei microtubuli varia ampiamente tra i diversi tipi di cellule per supportare diverse funzioni 1,2. La sua natura dinamica di crescita e restringimento consente un rapido adattamento a segnali extra- e intracellulari e di rispondere alle esigenze in continua evoluzione di una cellula. Quindi, può essere considerato come la "impronta digitale morfologica" che svolge un ruolo chiave nell'identità cellulare.
Il targeting farmacologico del citoscheletro dei microtubuli utilizzando inibitori di piccole molecole ha portato a una pletora di scoperte fondamentali nella biologia dello sviluppo, nella biologia delle cellule staminali, nella biologia del cancro e nella neurobiologia 3,4,5,6,7. Questo approccio, sebbene indispensabile, presenta varie limitazioni come la tossicità e gli effetti fuori bersaglio. Ad esempio, uno degli agenti bersaglio dei microtubuli più utilizzati, il nocodazolo, è un potente farmaco depolimerizzante dei microtubuli8. Tuttavia, gli inibitori di piccole molecole come il nocodazolo sono attivi dal momento dell'applicazione e, data la natura essenziale del citoscheletro dei microtubuli a molte funzioni cellulari critiche, la depolimerizzazione globale dei microtubuli può produrre effetti fuori bersaglio, che possono essere inadatti per molte applicazioni. Inoltre, il trattamento con nocodazolo è irreversibile a meno che i campioni non vengano lavati senza il farmaco, impedendo l'imaging vivo continuo e, quindi, il tracciamento preciso dei singoli filamenti di microtubuli.
Lo sviluppo di composti attivati dalla luce è iniziato con la creazione di molecole fotonunciate e ha annunciato una nuova era nel targeting e nel monitoraggio degli effetti dell'inibizione della crescita dei microtubuli in modo preciso e controllato spaziotemporalmente. Una famiglia di farmaci reversibilmente fotocommutabili, le fotostattine (PST), sono state sviluppate sostituendo il componente stilbene della combretastatina A-4 con l'azobenzene9. I PST sono inattivi fino all'illuminazione con luce UV, per cui la trans-configurazione inattiva si converte nella configurazione cis attiva mediante isomerizzazione reversibile. I Cis-PST inibiscono la polimerizzazione dei microtubuli legandosi al sito di legame della colchicina della β-tubulina, bloccando la sua interfaccia con β-tubulina e impedendo la dimerizzazione necessaria per la crescita dei microtubuli10. Tra una coorte di PST, PST-1P è emerso come un composto di piombo in quanto ha la più alta potenza, è completamente solubile in acqua e mostra un rapido inizio di bioattività dopo l'illuminazione.
L'isomerizzazione trans-cis più efficace dei PST si verifica a lunghezze d'onda comprese tra 360-420 nm, il che consente la doppia opzione per l'attivazione PST. Una linea laser da 405 nm su un tipico microscopio confocale può essere somministrata per un targeting spaziale ottimale dell'inibizione della crescita dei microtubuli. La capacità di individuare la posizione e la tempistica dell'attivazione PST attraverso l'illuminazione laser a 405 nm facilita un controllo temporale e spaziale preciso, consentendo l'interruzione della dinamica dei microtubuli a livello subcellulare, entro tempi di risposta inferiori al secondo9. In alternativa, una luce UV a LED a prezzi accessibili consente all'illuminazione dell'intero organismo di indurre l'interruzione dell'architettura dei microtubuli a livello di organismo. Questa può essere un'alternativa economica per i ricercatori per i quali l'inizio preciso dell'inibizione, piuttosto che il targeting spaziale, è l'obiettivo. Un'altra caratteristica dei PST è la loro inattivazione su richiesta applicando la luce verde di una lunghezza d'onda nell'intervallo 510-540 nm9. Ciò consente di tracciare i filamenti di microtubuli prima, durante e dopo l'inibizione della crescita mediata da PST.
I PST, pur essendo ancora un progetto relativamente recente, sono stati utilizzati in numerose applicazioni in vitro in diversi campi di ricerca11, tra cui lo studio di nuovi meccanismi di migrazione cellulare negli ameboidi12, nei neuroni isolati dal cervello del topo neonato13 e lo sviluppo dell'epitelio alare in Drosophila melanogaster14 . Altri farmaci reattivi alla luce hanno dimostrato di essere strumenti preziosi per l'interruzione mirata della funzione cellulare. Ad esempio, un analogo di blebbistatin, azidoblebbistatin, è stato utilizzato per una maggiore inibizione della miosina sotto illuminazione15,16. Ciò evidenzia il potenziale per nuove scoperte grazie alla capacità di inibizione della funzione cellulare controllata spatiotemporalmente.
Gli organismi 3D vivi presentano sistemi superbi ma più delicati per manipolare la dinamica dei microtubuli a livello di intero animale, singola cellula o subcellulare in condizioni fisiologiche. In particolare, l'embrione di topo preimpianto offre una visione eccezionale del funzionamento interno della cellula e delle relazioni intercellulari all'interno di un organismo17. Cicli consecutivi di attivazione e disattivazione dei PST temporalmente e spazialmente mirati hanno contribuito alla caratterizzazione del ponte interfase, una struttura post-citocinetica tra cellule, come centro di organizzazione dei microtubuli non centrosomiali nell'embrione di topo preimpianto16. Una configurazione sperimentale simile ha dimostrato il coinvolgimento dei microtubuli in crescita nella sigillatura dell'embrione di topo per consentire la formazione di blastocisti18. Inoltre, i PST sono stati utilizzati anche in embrioni interi di zebrafish per studiare la migrazione delle cellule neuronali inibendo la crescita di microtubuli in un sottogruppo di cellule nel cervello posteriore19.
Questo protocollo descrive la configurazione sperimentale e l'uso di PST-1P nell'embrione di topo preimpianto. Le istruzioni qui presentate possono anche guidare l'applicazione dei PST per una vasta gamma di obiettivi come lo studio della segregazione cromosomica e della divisione cellulare, il traffico di carichi intracellulari e la morfogenesi e migrazione cellulare. Inoltre, tali studi aiuteranno l'implementazione di PST in sistemi organoidi, blastoidi e altri modelli embrionali come Caenorhabditis elegans e Xenopus laevis, oltre a espandere potenzialmente l'uso di PST per le tecnologie di fecondazione in vitro .
Protocollo
Gli esperimenti sono stati approvati dal Monash Animal Ethics Committee con il numero di etica animale 19143. Gli animali sono stati alloggiati in specifiche condizioni di casa per animali privi di agenti patogeni presso la struttura per animali (Monash Animal Research Platform) in stretta conformità con le linee guida etiche.
1. Raccolta di embrioni di topo preimpianto
- Topi superovulati e mate come descritto in precedenza16,18, in conformità con le linee guida istituzionali di etica animale.
NOTA: I ceppi più comunemente usati per la raccolta di embrioni vivi sono topi C57BL/6 o FVB/N. Tutti i dati mostrati qui sono stati generati utilizzando mouse FVB / N. - La mattina dopo l'accoppiamento, sciacquare gli zigoti dall'ovidotto usando il mezzo M2 come descritto20 o il mezzo del liquido tubarico umano (HTF). Utilizzando un apparecchio a pipetta orale come descritto21,22, trasferire gli zigoti in goccioline fresche KSOM (Potassium Simplex Optimised Medium), preriscaldate a 37 °C ed equilibrate al 5% di CO2, in una capsula di coltura da 35 mm sovrapposta a un volume sufficiente di olio minerale per garantire la copertura mediatica.
- Microiniettare zigoti come descritto20 con codifica cRNA per un microtubulo rosso marcato fluorescente più marcatore finale. Qui, il cRNA per la proteina legante finale 3 (EB3)-dTomato è stato utilizzato a una concentrazione di 30 ng / μL dopo la preparazione e la purificazione come descritto16,18 e la diluizione nel tampone di microiniezione.
NOTA: Si consiglia di preparare il cRNA in anticipo e conservarlo a -20 °C fino a quando necessario. - Coltiva embrioni al buio a 37 °C e 5% di CO2 fino a quando gli embrioni non hanno raggiunto lo stadio di sviluppo desiderato per il trattamento PST-1P.
NOTA: Per una risorsa completa dei tempi di coltura richiesti per le diverse fasi embrionali si veda23. Per gli embrioni in stadio di 16 cellule utilizzati qui, dalla coltura al giorno embrionale 3 (E3) post-fecondazione.
2. Preparazione di farmaci e piatti di imaging
NOTA: per i passaggi da 2.1 a 2.10, lavorare esclusivamente in condizioni di buio o luce rossa per evitare l'attivazione involontaria di PST-1P. Il foglio di alluminio o le coperture scure devono essere utilizzati per tutti i tubi e le piastre contenenti PST.
- Preparare una concentrazione di stock di 50 mM PST-1P in acqua ultrapura.
NOTA: Il peso molecolare di PST-1P è di 440 g/mol. La soluzione madre è stabile a -20 °C fino a 1 anno. PST-1P è solubile in acqua o tampone acquoso ma non si dissolve facilmente in DMSO. - Dal passaggio 2.1, preparare una concentrazione di lavoro intermedia di 800 μM PST-1P in acqua ultrapura.
- Diluire PST-1P ad una concentrazione finale di 40 μM in KSOM fresco. Come esperimento tipico richiede circa 20 μL di KSOM trattato con PST-1P, diluire 1 μL di 800 μM PST-1P in 19 μL di KSOM per un volume finale di 20 μL per garantire che il mezzo sufficiente sia preparato in anticipo, utilizzando solo la luce rossa per la visibilità.
NOTA: Sia la concentrazione che lo stato di attivazione di una diluizione PST-1P possono essere controllati prendendo uno spettro di assorbanza UV-Vis utilizzando uno spettrofotometro che deve essere fatto durante la creazione del test. L'assorbanza a 380 nm (A380) di una diluizione completamente trans di 40 μM in una cuvetta da 1 cm dovrebbe essere di circa 0,8. Sia le forme cis- che trans hanno la stessa assorbanza a 455 nm (A455). Quando il rapporto tra A380 e A455 è di circa 9:1, la diluizione è inattiva (completamente trans). Quando il rapporto A380:A455 è 1:2, la diluizione è completamente attivata (completamente cis). I rapporti intermedi riflettono gli stati intermedi di attivazione. - Per preparare il vetrino della camera per l'imaging dal vivo, pipettare 10 μL di KSOM trattato con PST-1P nel centro di un pozzo per formare una goccia emisferica (Figura 1A).
- Aggiungere delicatamente olio minerale sufficiente a coprire la goccia, assicurandosi che non disperda il mezzo. Ciò garantirà che la goccia non evapori.
- Preriscaldare e CO 2-equilibrare la parabola della camera in un incubatore a 37 °C e 5% CO2 per un minimo di 3 ore o al massimo, durante la notte.
- Alla fine del periodo di equilibratura nel passaggio 2.6, preparare una piastra di coltura da 35 mm con una goccia da 10 μL di KSOM trattato con PST-1P, preriscaldato ed equilibrato come fase di lavaggio. Non sovrapporre con olio.
- Trasferire gli embrioni mediante pipettaggio orale nella goccia KSOM trattata con PST-1P dal passaggio 2.7.
NOTA: i passaggi 2.7 e 2.8 sono raccomandati per il pipettaggio orale degli embrioni, ma sono facoltativi. - Trasferire immediatamente gli embrioni mediante pipettaggio orale al centro della goccia KSOM trattata con PST-1P nel vetrino della camera di imaging preparato nei passaggi 2.4-2.6 (Figura 1A).
- Incubare embrioni a 37 °C e 5% di CO2 in KSOM trattato con PST-1P nel vetrino della camera di imaging per almeno 1 ora prima dell'imaging. Se possibile, montare il vetrino della camera sul microscopio all'interno di una camera ambientale a 37 °C e 5% di CO2 e nella completa oscurità per garantire che tutti i PST-1P siano nella trans-configurazione inattiva e che gli embrioni possano affondare sul fondo del piatto.
3. Imaging dal vivo e fotoattivazione PST-1P
NOTA: I passaggi da 3.1 a 3.13 vengono eseguiti su un microscopio confocale a scansione laser dotato di rilevatori di fotodiodi a valanga (APD) e una camera ambientale scura. Queste istruzioni si riferiscono specificamente alla configurazione dell'imaging utilizzando il software di acquisizione descritto nella Tabella dei materiali; tuttavia, possono essere applicati anche ad altri sistemi di microscopia confocale.
- Preparare un obiettivo di immersione in acqua 63x/1.2 NA con il mezzo di immersione prescritto.
- Utilizzando una torcia a luce rossa per guidare il posizionamento, avanzare l'obiettivo per contattare il mezzo di immersione. In questa fase, evitare di utilizzare la luce bianca o a campo brillante per trovare gli embrioni in quanto ciò potrebbe attivare precocemente PST-1P.
- Utilizzando l'oculare e sotto l'illuminazione a luce rossa, individuare il bordo della goccia di mezzo e posizionare l'obiettivo direttamente su questa posizione. Questo può aiutare l'utente a stabilire l'orientamento e trovare il piano focale.
- Successivamente, attraverso l'oculare o la scansione in modalità live abilitata dal software, utilizzare un filtro a lunghezza d'onda rossa o un laser a 561 nm per localizzare gli embrioni all'interno della goccia.
- Utilizza i controller di fase e la modalità di scansione dal vivo per impostare i punti di inizio e di fine per l'acquisizione di uno z-stack dell'intero embrione.
- Regolare le impostazioni di potenza del laser (in genere, con rilevatori altamente sensibili come gli APD, è sufficiente una potenza laser di 561 nm inferiore al 5%), offset digitale (in genere a -0,900) per ottimizzare l'aspetto delle comete EB3-dTomato e ridurre al minimo il rumore di fondo, foro stenopeico a 2 μm, risoluzione pixel di 512 x 512 e tempo di permanenza dei pixel di 3,15 μs.
- Acquisire una z-stack dell'intero embrione con intervalli di sezione di 1 μm per valutare le aree di crescita dei microtubuli nell'intero organismo (Figura 1B).
- Utilizzare l'immagine 3D z-stack del passaggio 3.7 per identificare le regioni di interesse (ROI) per gli esperimenti di tracciamento EB3-dTomato. Aumentare lo zoom a 3x e disegnare un ROI rettangolare attorno alla specifica area subcellulare di interesse.
- Acquisire un filmato time-lapse di un singolo piano z utilizzando i valori tipici dei parametri di imaging: potenza laser 561 nm al 5%, offset digitale di -0,900, risoluzione pixel di 512 x 512, foro stenopeico a 3 μm, tempo di permanenza pixel di 3,15 μs, zoom di 3x, intervallo di tempo di 500 ms.
NOTA: 120 intervalli di tempo forniranno un filmato di monitoraggio di 1 minuto e dovrebbero essere sufficienti per l'analisi dei dati. L'acquisizione può continuare più a lungo, a condizione che lo sbiancamento del fluoroforo sia minimo (Figura 1C). - Per attivare PST-1P, passare a un laser a 405 nm e acquisire un altro filmato time-lapse con il laser a 405 nm impostato al 10% di potenza, risoluzione pixel di 512 x 512, foro stenopeico aperto al massimo, tempo di permanenza dei pixel di 3,15 μs, zoom di 3x, intervallo di tempo di 500 ms e un totale di 20 fotogrammi (Figura 1D).
- Tornare al laser a 561 nm e ripetere l'acquisizione come nel passaggio 3.9 per confermare la perdita di comete EB3-dTomato dopo l'attivazione di PST-1P (Figura 1E). Assicurarsi che questa acquisizione avvenga il prima possibile dopo l'attivazione.
NOTA: Il passo 3.10 può essere eseguito ripetutamente per un'inibizione più lunga delle comete EB3-dTomato. Tuttavia, gli embrioni devono essere monitorati attentamente per evitare danni causati dalla luce UV. - Per invertire PST-1P al suo trans-stato inattivo, innestare un laser a 514 nm con una potenza del 10%. Acquisire un filmato time-lapse con il laser a 514 nm impostato al 10% di potenza, risoluzione pixel di 512 x 512, foro stenopeico aperto al massimo, tempo di permanenza dei pixel di 3,15 μs, zoom di 3x, intervallo di tempo di 500 ms e un totale di 20 intervalli di tempo (Figura 1F).
- Ripetere il passaggio 3.11 per visualizzare il recupero delle comete EB3-dTomato (Figura 1G).
4. Analisi dei dati delle immagini
- Per analizzare e quantificare l'inibizione della polimerizzazione dei microtubuli da parte dei PST, utilizzare programmi software a disposizione dei ricercatori per soddisfare le loro esigenze specifiche. Quelli consigliati per l'uso avranno uno strumento di tracciamento, in grado di tracciare manualmente o automaticamente il movimento, la direzione e la velocità delle comete EB3-dTomato16,18.
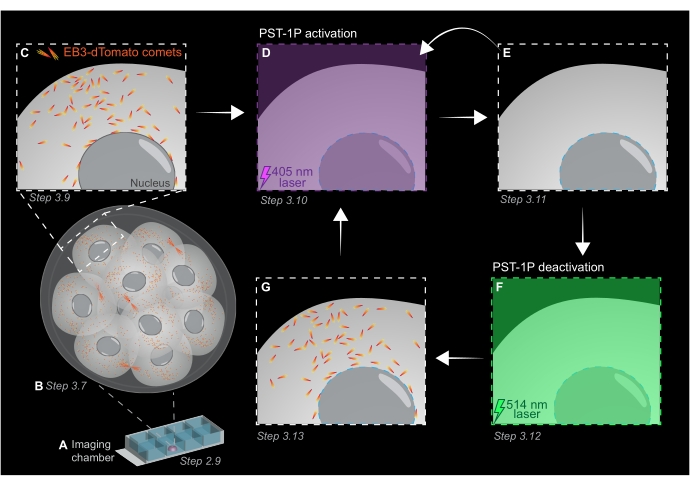
Figura 1: Rappresentazione schematica della fotoattivazione e disattivazione PST-1P nell'embrione di topo preimpianto 3D vivo. Tutti gli esperimenti vengono eseguiti nella completa oscurità (sfondo nero) o solo con illuminazione a luce rossa. (A) Gli embrioni di topo preimpianto vivi che esprimono EB3-dTomato vengono coltivati allo stadio a 16 cellule e quindi trasferiti in una goccia di KSOM contenente 40 μM PST-1P in un vetrino della camera di imaging. (B) Un'immagine 3D dell'intero embrione consente la valutazione della crescita dei microtubuli visualizzando la distribuzione delle comete EB3-dTomato. (C) Per iniziare l'esperimento, le comete EB3-dTomato vengono tracciate in una regione subcellulare utilizzando l'imaging time-lapse. (D) La successiva fotoattivazione PST-1P nella stessa regione subcellulare utilizzando un laser a 405 nm provoca la perdita di comete EB3-dTomato (E). L'attivazione intensificata di PST-1P può essere implementata, se necessario, mediante illuminazione sequenziale a 405 nm. (F-G) Per invertire PST-1P al suo stato inattivo e ripristinare le comete EB3-dTomato, un laser a 514 nm viene applicato alla stessa regione subcellulare. Se necessario, è possibile eseguire più cicli di fotoattivazione e disattivazione. Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
In linea con il protocollo, gli embrioni di topo preimpianto sono stati microiniettati con cRNA per EB3, marcati con dTomato fluorescente rosso (EB3-dTomato). Ciò consente la visualizzazione di microtubuli in crescita mentre EB3 si lega al microtubulo polimerizzante più estremità24.
Gli esperimenti sono stati eseguiti 3 giorni dopo la fecondazione (E3) quando l'embrione di topo è composto da 16 cellule. Qualsiasi altra fase di sviluppo preimpianto può essere utiliz...
Discussione
La rete di microtubuli è parte integrante del funzionamento interno fondamentale di una cellula. Di conseguenza, questo presenta sfide nella manipolazione della dinamica dei microtubuli negli organismi viventi, poiché qualsiasi perturbazione della rete tende ad avere conseguenze diffuse per tutti gli aspetti della funzione cellulare. L'emergere di composti foto-commutabili che prendono di mira i microtubuli presenta un modo per manipolare con precisione il citoscheletro a livello subcellulare, con un controllo superior...
Divulgazioni
Gli autori non dichiarano alcun interesse concorrente o finanziario.
Riconoscimenti
Gli autori desiderano ringraziare il Dr. Oliver Thorn-Seshold e Li Gao per averci fornito fototine e consigli sulla preparazione del manoscritto, Monash Production per il supporto alle riprese e Monash Micro Imaging per il supporto alla microscopia.
Questo lavoro è stato sostenuto dalla sovvenzione del progetto National Health and Medical Research Council (NHMRC) APP2002507 a J.Z. e dalla borsa di studio Azrieli dell'Istituto canadese per la ricerca avanzata (CIFAR) a J.Z. L'Australian Regenerative Medicine Institute è supportato da sovvenzioni del governo statale di Victoria e del governo australiano.
Materiali
| Name | Company | Catalog Number | Comments |
| Aspirator tube | Sigma-Aldrich | A5177 | For mouth aspiration apparatus |
| Chamber slides - LabTek | Thermo Fisher Scientific | NUN155411 | |
| cRNA encoding for EB3-dTomato | N/A | N/A | Prepared according to manufacturers instructions using mMessage in vitro Transcription kit |
| Culture dishes - 35mm | Thermo Fisher Scientific | 150560 | |
| Human chorionic growth hormone | Sigma-Aldrich | C8554 | |
| Human Tubal Fluid (HTF) medium | Cosmo-Bio | CSR-R-B071 | |
| Imaris Image Analysis Software | Bitplane | ||
| Immersion Oil W 2010 | Carl Zeiss | 444969-0000-000 | For use with microscope immersion objective |
| LED torch - Red light | Celestron | 93588 | |
| M2 medium | Sigma-Aldrich | M7167 | |
| Mice - wild-type FVB/N, males and females | N/A | N/A | Females 8-9 weeks old. Males 2-6 months old. |
| Microcapillary Pipettes - Kimble | Sigma-Aldrich | Z543306 | For mouth aspiration apparatus |
| Microinjection buffer | N/A | N/A | 5 mM Tris, 5 mM NaCl, 0.1 mM EDTA, pH 7.4 |
| Mineral oil | Origio | ART-4008-5P | |
| mMessage In vitro Transcription kit | Thermo Fisher Scientific | AM1340 | |
| NanoDrop Spectrophotometer | Thermo Fisher Scientific | ||
| Potassium Simplex Optimised Medium (KSOM) medium | Cosmo-Bio | CSR-R-B074 | |
| Pregnant mare serum gonadotrophin | Prospec Bio | HOR-272 | |
| PST-1P | N/A | N/A | Borowiak, M. et al., Photoswitchable Inhibitors of Microtubule Dynamics Optically Control Mitosis and Cell Death. Cell. 162 (2), 403-411, doi:10.1016/j.cell.2015.06.049, (2015). |
| RNA purification kit | Sangon | B511361-0100 | |
| Ultrapure water | Sigma-Aldrich | W1503 | |
| ZEN Black Software | Carl Zeiss |
Riferimenti
- Hawdon, A., Aberkane, A., Zenker, J. Microtubule-dependent subcellular organisation of pluripotent cells. Development. 148 (20), (2021).
- Sanchez, A. D., Feldman, J. L. Microtubule-organizing centers: from the centrosome to non-centrosomal sites. Current Opinion in Cell Biology. 44, 93-101 (2017).
- Galli, M., Morgan, D. O. Cell size determines the strength of the spindle assembly checkpoint during embryonic development. Developmental Cell. 36 (3), 344-352 (2016).
- Vazquez-Diez, C., Paim, L. M. G., FitzHarris, G. Cell-size-independent spindle checkpoint failure underlies chromosome segregation error in mouse embryos. Current Biology. 29 (5), 865-873 (2019).
- Baudoin, J. P., Alvarez, C., Gaspar, P., Metin, C. Nocodazole-induced changes in microtubule dynamics impair the morphology and directionality of migrating medial ganglionic eminence cells. Developmental Neuroscience. 30 (1-3), 132-143 (2008).
- Munz, F., et al. Human mesenchymal stem cells lose their functional properties after paclitaxel treatment. Scientific Reports. 8 (1), 312 (2018).
- Jordan, M. A., Wilson, L. Microtubules as a target for anticancer drugs. Nature Reviews Cancer. 4 (4), 253-265 (2004).
- Vasquez, R. J., Howell, B., Yvon, A. M., Wadsworth, P., Cassimeris, L. Nanomolar concentrations of nocodazole alter microtubule dynamic instability in vivo and in vitro. Molecular Biology of the Cell. 8 (6), 973-985 (1997).
- Borowiak, M., et al. Photoswitchable inhibitors of microtubule dynamics optically control mitosis and cell death. Cell. 162 (2), 403-411 (2015).
- Gaspari, R., Prota, A. E., Bargsten, K., Cavalli, A., Steinmetz, M. O. Structural basis of cis- and trans-Combretastatin binding to tubulin. Chem. 2 (1), 102-113 (2017).
- Thorn-Seshold, O., Meiring, J. Photocontrolling microtubule dynamics with photoswitchable chemical reagents. ChemRxiv. , (2021).
- Kopf, A., et al. Microtubules control cellular shape and coherence in amoeboid migrating cells. Journal of Cell Biology. 219 (6), 201907154 (2020).
- Sawada, M., et al. PlexinD1 signaling controls morphological changes and migration termination in newborn neurons. The EMBO Journal. 37 (4), 97404 (2018).
- Singh, A., et al. Polarized microtubule dynamics directs cell mechanics and coordinates forces during epithelial morphogenesis. Nature Cell Biology. 20 (10), 1126-1133 (2018).
- Kepiro, M., et al. Azidoblebbistatin, a photoreactive myosin inhibitor. Proceedings of the National Academy of Sciences of the United States of America. 109 (24), 9402-9407 (2012).
- Zenker, J., et al. A microtubule-organizing center directing intracellular transport in the early mouse embryo. Science. 357 (6354), 925-928 (2017).
- White, M. D., Zenker, J., Bissiere, S., Plachta, N. Instructions for assembling the early mammalian embryo. Developmental Cell. 45 (6), 667-679 (2018).
- Zenker, J., et al. Expanding actin rings zipper the mouse embryo for blastocyst formation. Cell. 173 (3), 776-791 (2018).
- Theisen, U., et al. Microtubules and motor proteins support zebrafish neuronal migration by directing cargo. Journal of Cell Biology. 219 (10), 201908040 (2020).
- Rulicke, T. Pronuclear microinjection of mouse zygotes. Methods in Molecular Biology. 254, 165-194 (2004).
- Greaney, J., Subramanian, G. N., Ye, Y., Homer, H. Isolation and in vitro culture of mouse oocytes. Bio-protocol. 11 (15), 4104 (2021).
- Subramanian, G. N., et al. Oocytes mount a noncanonical DNA damage response involving APC-Cdh1-mediated proteolysis. Journal of Cell Biology. 219 (4), 201907213 (2020).
- Mihajlovic, A. I., Bruce, A. W. The first cell-fate decision of mouse preimplantation embryo development: integrating cell position and polarity. Open Biology. 7 (11), 170210 (2017).
- Roostalu, J., et al. The speed of GTP hydrolysis determines GTP cap size and controls microtubule stability. Elife. 9, 51992 (2020).
- Gao, L., et al. In vivo photocontrol of microtubule dynamics and integrity, migration and mitosis, by the potent GFP-imaging-compatible photoswitchable reagents SBTubA4P and SBTub2M. BioRxiv. bioRxiv. , (2021).
- Tichy, A. M., Gerrard, E. J., Legrand, J. M. D., Hobbs, R. M., Janovjak, H. Engineering strategy and vector library for the rapid generation of modular light-controlled protein-protein interactions. Journal of Molecular Biology. 431 (17), 3046-3055 (2019).
- van Haren, J., Adachi, L. S., Wittmann, T. Optogenetic control of microtubule dynamics. Methods in Molecular Biology. 2101, 211-234 (2020).
- Adikes, R. C., Hallett, R. A., Saway, B. F., Kuhlman, B., Slep, K. C. Control of microtubule dynamics using an optogenetic microtubule plus end-F-actin cross-linker. Journal of Cell Biology. 217 (2), 779-793 (2018).
- Kogler, A. C., et al. Extremely rapid and reversible optogenetic perturbation of nuclear proteins in living embryos. Developmental Cell. 56 (16), 2348-2363 (2021).
- Maghelli, N., Tolic-Norrelykke, I. M. Laser ablation of the microtubule cytoskeleton: setting up and working with an ablation system. Methods in Molecular Biology. 777, 261-271 (2011).
- Bukhari, S. N. A., Kumar, G. B., Revankar, H. M., Qin, H. L. Development of combretastatins as potent tubulin polymerization inhibitors. Bioorganic Chemistry. 72, 130-147 (2017).
- Gilazieva, Z., Ponomarev, A., Rutland, C., Rizvanov, A., Solovyeva, V. Promising applications of tumor spheroids and organoids for personalized medicine. Cancers (Basel). 12 (10), 2727 (2020).
- Scherer, K. M., et al. Three-dimensional imaging and uptake of the anticancer drug combretastatin in cell spheroids and photoisomerization in gels with multiphoton excitation. Journal of Biomedical Optics. 20 (7), 78003 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon