需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用光敏转移素对活体植入前小鼠胚胎中的微管细胞骨架进行时空亚细胞操作
摘要
典型的微管抑制剂广泛用于基础和应用研究,对细胞具有深远的影响。最近,光敏素作为一类光开关微管抑制剂出现,能够对微管进行瞬时,可逆,时空精确操作。该分步实验方案详细介绍了迁光素在3D活体植入前小鼠胚胎中的应用。
摘要
微管细胞骨架形成细胞的框架,是细胞内运输、细胞分裂和信号转导的基础。例如,使用诺考达唑对无处不在的微管网络进行传统的药理学破坏可能对任何细胞产生破坏性后果。可逆光开关微管抑制剂有可能通过使药物效应能够以时空控制的方式实现来克服局限性。其中一个这样的药物家族是基于偶氮苯的光敏类药物(PST)。这些化合物在黑暗条件下是无活性的,并且在用紫外光照射时,它们与β微管蛋白的秋水仙碱结合位点结合并阻断微管聚合和动态周转。在这里,PST在3维(3D)活体植入前小鼠胚胎中的应用旨在亚细胞水平上破坏微管网络。该协议提供实验设置的说明,以及使用活细胞共聚焦显微镜的PST的光激活和失活参数。这确保了可重复性,并使其他人能够将此程序应用于他们的研究问题。像PST这样的创新型光开关可以发展成为促进对动态细胞内微管网络的理解并实时非侵入性地操纵细胞骨架的强大工具。此外,PST可能被证明在其他3D结构中有用,例如类器官,胚泡或其他物种的胚胎。
引言
微管结构在不同细胞类型之间差异很大,以支持不同的功能1,2。其生长和收缩的动态性质允许快速适应细胞外和细胞内线索,并响应细胞不断变化的需求。因此,它可以被认为是在细胞身份中起关键作用的"形态指纹"。
使用小分子抑制剂对微管细胞骨架进行药理靶向已导致发育生物学,干细胞生物学,癌症生物学和神经生物学中的大量基本发现3,4,5,6,7。这种方法虽然不可或缺,但存在各种局限性,例如毒性和脱靶效应。例如,使用最广泛的微管靶向剂之一诺考达唑是一种强大的微管解聚药物8。然而,诺考达唑等小分子抑制剂从应用时起就具有活性,并且鉴于微管细胞骨架对许多关键细胞功能的必要性质,微管的全局解聚可以产生脱靶效应,这可能不适用于许多应用。此外,除非样品洗涤不含药物,否则诺考达唑治疗是不可逆的,从而阻止连续的实时成像,从而防止精确跟踪单个微管丝。
光激活化合物的发展始于光辐射分子的产生,并预示着以精确和时空控制的方式靶向和监测微管生长抑制效果的新时代。一个可逆光开关药物家族,光刺激素(PST),是通过用偶氮苯9代替康布雷他汀A-4的二苯乙烯成分而开发的。PST在用紫外光照明之前处于非活性状态,其中非活性 转化构型通过可逆异构化转换为有源 顺式构型。 顺式-PST通过与秋水仙碱结合位点β-微管蛋白结合,阻断其与β微管蛋白的界面并防止微管生长所需的二聚反应来抑制微管聚合10。在一组PST中,PST-1P已成为一种先导化合物,因为它具有最高的效力,是完全水溶性的,并且在照明后显示出快速的生物活性。
PST最有效的 反式到 顺式异构化发生在360-420nm之间的波长处,这为PST活化提供了双重选择。可以在典型的共聚焦显微镜上施用405nm激光线,以实现微管生长抑制的最佳空间靶向。通过405 nm激光照明精确定位PST激活的位置和时间的能力有助于精确的时间和空间控制,允许在亚细胞水平上破坏微管动力学,在亚秒级响应时间内9。或者,经济实惠的LED紫外光允许整个生物体照明诱导生物体范围的微管结构破坏。对于研究人员来说,这可能是一种具有成本效益的替代方案,对他们来说,目标是精确定时的抑制发作,而不是空间靶向。PST的另一个特点是通过施加510-540nm范围内波长的绿光9来按需灭活。这样可以在PST介导的生长抑制之前,期间和之后追踪微管丝。
PST虽然仍然是一个相对较新的设计,但已被用于不同研究领域的许多体外应用11,包括研究变性腺细胞迁移的新机制12,从新生小鼠大脑中分离的神经元13,以及黑腹果蝇的翅膀上皮发育14.其他光反应药物已被证明是靶向破坏细胞功能的宝贵工具。例如,blebbistatin的类似物,azidoblebbistatin,用于在照明15,16下增强肌球蛋白抑制。这突出了由于时空控制抑制细胞功能的能力而具有新发现的潜力。
活的3D生物体呈现出精湛而又更精细的系统,可在生理条件下操纵整个动物,单细胞或亚细胞水平上的微管动力学。特别是,植入前小鼠胚胎为细胞的内部运作以及生物体内的细胞间关系提供了非凡的洞察力17。PST的激活和失活的时间和空间靶向连续循环有助于表征相间桥,即细胞之间的细胞动力学后结构,作为植入前小鼠胚胎16中的非中心体微管组织中心。类似的实验装置表明,生长的微管参与小鼠胚胎的密封以允许囊胚形成18。此外,PSTs还用于整个斑马鱼胚胎,通过抑制后脑19中一个细胞亚群中的微管生长来研究神经元细胞迁移。
该协议描述了PST-1P在植入前小鼠胚胎中的实验设置和使用。这里给出的说明还可以指导PST在各种目标中的应用,例如研究染色体分离和细胞分裂,细胞内货物的运输以及细胞形态发生和迁移。此外,这些研究将有助于在类器官系统,胚泡和其他胚胎模型中实施PST,如 秀丽隐杆线虫 和 非洲爪蟾,并可能扩大PST 在体外 受精技术中的应用。
研究方案
实验由莫纳什动物伦理委员会批准,动物伦理编号为19143。严格按照道德准则,动物被安置在动物设施(莫纳什动物研究平台)的特定无病原体动物房屋条件下。
1. 胚胎植入前胚胎采集
- 如前所述16,18的超排卵和交配小鼠,符合机构动物伦理准则。
注意:用于活胚胎收集的最常用的菌株是C57BL / 6或FVB / N小鼠。这里显示的所有数据都是使用FVB / N小鼠生成的。 - 在交配后的早晨,使用M2培养基(如所述20)或人输卵管液(HTF)培养基从输卵管中冲洗受精卵。使用如21,22所述的口腔移液器装置,将受精卵转移到新鲜的单纯钾优化培养基(KSOM)液滴中,预热至37°C并平衡至5%CO2,在35mm培养皿中覆盖足够体积的矿物油以确保培养基覆盖率。
- 显微注射如20所述的受精卵,其cRNA编码为红色荧光标记的微管加末端标记物。这里,在如上所述16,18制备和纯化并在显微注射缓冲液中稀释后,以30ng / μL浓度使用末端结合蛋白3(EB3)-dTomato的cRNA。
注意:建议提前制备cRNA并将其储存在-20°C直至需要。 - 在37°C和5%CO2 的黑暗中培养胚胎,直到胚胎达到PST-1P处理的所需发育阶段。
注意:有关不同胚胎阶段所需培养时间的综合资源,请参见23。对于这里使用的16细胞阶段胚胎,培养到受精后胚胎第3天(E3)。
2. 药物和成像皿制备
注意:对于步骤 2.1-2.10,请仅在黑暗或红光条件下工作,以避免意外的 PST-1P 激活。所有含有PST的管子和培养皿都应使用铝箔或深色盖子。
- 在超纯水中制备50mM PST-1P的储备液。
注意:PST-1P的分子量为440克/摩尔。储备溶液在-20°C下稳定长达1年。PST-1P可溶于水或水缓冲液,但不易溶于DMSO。 - 从步骤2.1开始,在超纯水中制备工作浓度为800μM PST-1P的中间体。
- 将PST-1P稀释至新鲜KSOM中终浓度为40μM。由于典型的实验需要大约20μL的PST-1P处理的KSOM,将1μL的800μM PST-1P稀释在19μLKSOM中,最终体积为20μL,以确保提前制备足够的培养基,仅使用红光即可看到。
注意:PST-1P稀释液的浓度和活化状态都可以通过使用分光光度计采集紫外可见吸光度光谱来检查,这应该在测定建立期间完成。在1cm比色皿中,全反式40μM稀释液在380nm(A 380)处的吸光度应约为0.8。顺式和反式在455nm处具有相同的吸光度(A455)。当A380与A455的比例约为9:1时,稀释液是无活性的(完全反式)。当A380:A455的比例为1:2时,稀释液被完全激活(完全顺式)。中间比率反映了活化的中间状态。 - 为了准备用于实时成像的腔室载玻片,将10μLPST-1P处理的KSOM移液到一个孔的中心以形成半球形液滴(图1A)。
- 轻轻加入足够的矿物油以覆盖液滴,确保它不会分散介质。这将确保液滴不会蒸发。
- 预热和CO2-平衡室载玻片在培养箱中在37°C和5%CO2 下至少3小时或最多过夜。
- 在步骤2.6中的平衡期结束时,制备35mm培养皿,其中包含10μL PST-1P处理,预热和平衡KSOM液滴作为洗涤步骤。不要沾上油。
- 通过口腔移液将胚胎转移到步骤2.7中经过PST-1P处理的KSOM液滴中。
注意:建议将步骤2.7和2.8用于胚胎的口腔移液,但这是可选的。 - 立即通过口移液将胚胎移植到步骤2.4-2.6制备的成像室载玻片中PST-1P处理的KSOM液滴的中心(图1A)。
- 在成像前,在成像室载玻片中将胚胎在37°C和PST-1P处理的KSOM中孵育5%CO2 至少1小时。如果可能,将腔室载玻片安装在显微镜上,在37°C和5%CO 2的环境室内,并在完全黑暗中, 以确保所有PST-1P都处于非活性 反式配置中,并且胚胎可以沉入培养皿的底部。
3. 实时成像和PST-1P光活化
注:步骤3.1-3.13在装有雪崩光电二极管探测器(APD)和黑暗环境室的激光扫描共聚焦显微镜上执行。这些说明具体是指使用 材料表中描述的采集软件进行成像设置;然而,它们也可以应用于其他共聚焦显微镜系统。
- 用规定的浸渍培养基制备63x/ 1.2 NA水油浸物镜。
- 使用红灯手电筒引导定位,推进物镜接触浸入介质。在这个阶段,避免使用白光或明场光来寻找胚胎,因为这会早熟地激活PST-1P。
- 使用目镜并在红光照明下,定位介质液滴的边缘,并将物镜直接定位在该位置。这可以帮助用户建立方向并找到焦平面。
- 接下来,通过目镜或软件启用的实时模式扫描,使用红色波长滤光片或561nm激光定位液滴内的胚胎。
- 使用分阶段控制器和实时扫描模式设置获取整个胚胎的z堆栈的起点和终点。
- 调整激光功率设置(通常,使用高灵敏度探测器,如APD,561 nm激光功率小于5%就足够了),数字偏移(通常在-0.900)以优化EB3-dTomato彗星的外观并最小化背景噪声,针孔在2μm,像素分辨率为512 x 512,像素停留时间为3.15 μs。
- 以1μm的切片间隔获取整个胚胎的z堆栈,以评估整个生物体中微管生长的区域(图1B)。
- 使用步骤 3.7 中的 3D z 轴堆栈图像识别 EB3-dTomato 跟踪实验的感兴趣区域 (ROI)。将缩放比例增加到 3 倍,并在感兴趣的特定亚细胞区域周围绘制一个矩形 ROI。
- 使用成像参数的典型值获取单个z平面的延时短片:561 nm激光功率(5%),数字偏移为-0.900,像素分辨率为512 x 512,针孔为3 μm,像素停留时间为3.15 μs,变焦为3x,时间间隔为500 ms。
注意:120个时间范围将提供1分钟的跟踪电影,应该足以进行数据分析。只要荧光基团的漂白最小,采集可以持续更长时间(图1C)。 - 要激活 PST-1P,请切换到 405 nm 激光器并获取另一个延时短片,其中 405 nm 激光器设置为 10% 功率,像素分辨率为 512 x 512,针孔最大打开,像素停留时间为 3.15 μs,变焦为 3 倍,时间间隔为 500 ms,总共 20 帧(图 1D)。
- 切换回561 nm激光并重复采集,如步骤3.9所示,以确认PST-1P激活后EB3-d番茄彗星的损失(图1E)。确保在激活后尽快进行此获取。
注意:步骤3.10可以重复进行,以延长EB3-dTomato彗星的抑制时间。但是,必须仔细监测胚胎,以避免紫外线造成的任何伤害。 - 要将PST-1P反转回其非活动 交易状态,请以10%的功率接合514 nm激光器。将 514 nm 激光设置为 10% 功率、像素分辨率为 512 x 512、针孔最大打开、像素停留时间为 3.15 μs、变焦为 3 倍、时间间隔为 500 ms 以及总共 20 个时间帧,从而获取延时短片(图 1F)。
- 重复步骤3.11以可视化EB3-d番茄彗星的恢复(图1G)。
4. 图像数据分析
- 为了分析和量化PST对微管聚合的抑制作用,请使用研究人员可用的软件程序来满足他们的特定需求。那些推荐使用的人将拥有一个跟踪工具,可以手动或自动跟踪EB3-dTomato彗星16,18的运动,方向和速度。
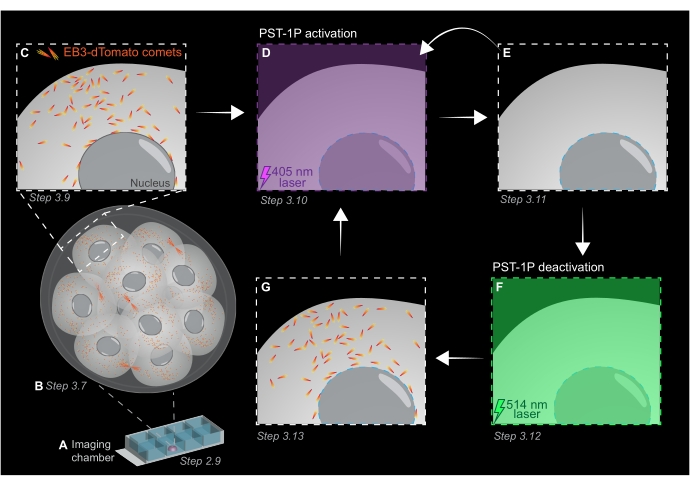
图1:PST-1P光活化和失活在活体3D植入前小鼠胚胎中的示意图。 所有实验均在完全黑暗(黑色背景)或仅通过红光照明进行。(A)将表达EB3-dTomato的活植入前小鼠胚胎培养至16细胞阶段,然后转移到成像室载玻片中含有40μM PST-1P的KSOM液滴中。(B)整个胚胎的3D图像可以通过可视化EB3-dTomato彗星的分布来评估微管生长。(C)为了开始实验,EB3-dTomato彗星在亚细胞区域使用延时成像进行跟踪。(D)随后使用405nm激光在同一亚细胞区域的PST-1P光活化导致EB3-d番茄彗星(E)的损失。如有必要,可以通过顺序405 nm光照来实现增强的PST-1P激活。(F-G)为了将PST-1P逆转回其非活性状态并恢复EB3-dTomato彗星,将514nm激光器施加到相同的亚细胞区域。如果需要,可以执行多轮光活化和失活。请点击此处查看此图的大图。
结果
根据方案,植入前小鼠胚胎用cRNA显微注射EB3,用红色荧光dTomato(EB3-dTomato)标记。这使得生长中的微管可视化成为可能,因为EB3与聚合微管加末端24结合。
实验在受精后3天(E3)进行,当时小鼠胚胎由16个细胞组成。可以使用任何其他植入前发育阶段,具体取决于要研究的科学问题。为了证明使用405nm激光激活方案的最小光漂白,显示了未处理胚胎的对照实?...
讨论
微管网络是细胞基本内部运作的组成部分。因此,这为操纵生物体中的微管动力学带来了挑战,因为对网络的任何扰动往往对细胞功能的各个方面产生广泛的影响。光开关微管靶向化合物的出现提供了一种在亚细胞水平上精确操纵细胞骨架的方法,对微管生长抑制的诱导和逆转具有卓越的控制力9。该协议展示了如何在植入前小鼠胚胎中通过光激活的PST-1P在亚细胞尺度上以时间精...
披露声明
作者声明没有竞争或经济利益。
致谢
作者要感谢Oliver Thorn-Seshold博士和Li Gao博士为我们提供的摄影素和手稿准备建议,Monash Production提供拍摄支持,Monash Micro Imaging提供显微镜支持。
这项工作得到了国家卫生和医学研究委员会(NHMRC)项目赠款APP2002507对J.Z.和加拿大高级研究所(CIFAR)Azrieli奖学金对J.Z.的支持。澳大利亚再生医学研究所得到了维多利亚州政府和澳大利亚政府的赠款支持。
材料
| Name | Company | Catalog Number | Comments |
| Aspirator tube | Sigma-Aldrich | A5177 | For mouth aspiration apparatus |
| Chamber slides - LabTek | Thermo Fisher Scientific | NUN155411 | |
| cRNA encoding for EB3-dTomato | N/A | N/A | Prepared according to manufacturers instructions using mMessage in vitro Transcription kit |
| Culture dishes - 35mm | Thermo Fisher Scientific | 150560 | |
| Human chorionic growth hormone | Sigma-Aldrich | C8554 | |
| Human Tubal Fluid (HTF) medium | Cosmo-Bio | CSR-R-B071 | |
| Imaris Image Analysis Software | Bitplane | ||
| Immersion Oil W 2010 | Carl Zeiss | 444969-0000-000 | For use with microscope immersion objective |
| LED torch - Red light | Celestron | 93588 | |
| M2 medium | Sigma-Aldrich | M7167 | |
| Mice - wild-type FVB/N, males and females | N/A | N/A | Females 8-9 weeks old. Males 2-6 months old. |
| Microcapillary Pipettes - Kimble | Sigma-Aldrich | Z543306 | For mouth aspiration apparatus |
| Microinjection buffer | N/A | N/A | 5 mM Tris, 5 mM NaCl, 0.1 mM EDTA, pH 7.4 |
| Mineral oil | Origio | ART-4008-5P | |
| mMessage In vitro Transcription kit | Thermo Fisher Scientific | AM1340 | |
| NanoDrop Spectrophotometer | Thermo Fisher Scientific | ||
| Potassium Simplex Optimised Medium (KSOM) medium | Cosmo-Bio | CSR-R-B074 | |
| Pregnant mare serum gonadotrophin | Prospec Bio | HOR-272 | |
| PST-1P | N/A | N/A | Borowiak, M. et al., Photoswitchable Inhibitors of Microtubule Dynamics Optically Control Mitosis and Cell Death. Cell. 162 (2), 403-411, doi:10.1016/j.cell.2015.06.049, (2015). |
| RNA purification kit | Sangon | B511361-0100 | |
| Ultrapure water | Sigma-Aldrich | W1503 | |
| ZEN Black Software | Carl Zeiss |
参考文献
- Hawdon, A., Aberkane, A., Zenker, J. Microtubule-dependent subcellular organisation of pluripotent cells. Development. 148 (20), (2021).
- Sanchez, A. D., Feldman, J. L. Microtubule-organizing centers: from the centrosome to non-centrosomal sites. Current Opinion in Cell Biology. 44, 93-101 (2017).
- Galli, M., Morgan, D. O. Cell size determines the strength of the spindle assembly checkpoint during embryonic development. Developmental Cell. 36 (3), 344-352 (2016).
- Vazquez-Diez, C., Paim, L. M. G., FitzHarris, G. Cell-size-independent spindle checkpoint failure underlies chromosome segregation error in mouse embryos. Current Biology. 29 (5), 865-873 (2019).
- Baudoin, J. P., Alvarez, C., Gaspar, P., Metin, C. Nocodazole-induced changes in microtubule dynamics impair the morphology and directionality of migrating medial ganglionic eminence cells. Developmental Neuroscience. 30 (1-3), 132-143 (2008).
- Munz, F., et al. Human mesenchymal stem cells lose their functional properties after paclitaxel treatment. Scientific Reports. 8 (1), 312 (2018).
- Jordan, M. A., Wilson, L. Microtubules as a target for anticancer drugs. Nature Reviews Cancer. 4 (4), 253-265 (2004).
- Vasquez, R. J., Howell, B., Yvon, A. M., Wadsworth, P., Cassimeris, L. Nanomolar concentrations of nocodazole alter microtubule dynamic instability in vivo and in vitro. Molecular Biology of the Cell. 8 (6), 973-985 (1997).
- Borowiak, M., et al. Photoswitchable inhibitors of microtubule dynamics optically control mitosis and cell death. Cell. 162 (2), 403-411 (2015).
- Gaspari, R., Prota, A. E., Bargsten, K., Cavalli, A., Steinmetz, M. O. Structural basis of cis- and trans-Combretastatin binding to tubulin. Chem. 2 (1), 102-113 (2017).
- Thorn-Seshold, O., Meiring, J. Photocontrolling microtubule dynamics with photoswitchable chemical reagents. ChemRxiv. , (2021).
- Kopf, A., et al. Microtubules control cellular shape and coherence in amoeboid migrating cells. Journal of Cell Biology. 219 (6), 201907154 (2020).
- Sawada, M., et al. PlexinD1 signaling controls morphological changes and migration termination in newborn neurons. The EMBO Journal. 37 (4), 97404 (2018).
- Singh, A., et al. Polarized microtubule dynamics directs cell mechanics and coordinates forces during epithelial morphogenesis. Nature Cell Biology. 20 (10), 1126-1133 (2018).
- Kepiro, M., et al. Azidoblebbistatin, a photoreactive myosin inhibitor. Proceedings of the National Academy of Sciences of the United States of America. 109 (24), 9402-9407 (2012).
- Zenker, J., et al. A microtubule-organizing center directing intracellular transport in the early mouse embryo. Science. 357 (6354), 925-928 (2017).
- White, M. D., Zenker, J., Bissiere, S., Plachta, N. Instructions for assembling the early mammalian embryo. Developmental Cell. 45 (6), 667-679 (2018).
- Zenker, J., et al. Expanding actin rings zipper the mouse embryo for blastocyst formation. Cell. 173 (3), 776-791 (2018).
- Theisen, U., et al. Microtubules and motor proteins support zebrafish neuronal migration by directing cargo. Journal of Cell Biology. 219 (10), 201908040 (2020).
- Rulicke, T. Pronuclear microinjection of mouse zygotes. Methods in Molecular Biology. 254, 165-194 (2004).
- Greaney, J., Subramanian, G. N., Ye, Y., Homer, H. Isolation and in vitro culture of mouse oocytes. Bio-protocol. 11 (15), 4104 (2021).
- Subramanian, G. N., et al. Oocytes mount a noncanonical DNA damage response involving APC-Cdh1-mediated proteolysis. Journal of Cell Biology. 219 (4), 201907213 (2020).
- Mihajlovic, A. I., Bruce, A. W. The first cell-fate decision of mouse preimplantation embryo development: integrating cell position and polarity. Open Biology. 7 (11), 170210 (2017).
- Roostalu, J., et al. The speed of GTP hydrolysis determines GTP cap size and controls microtubule stability. Elife. 9, 51992 (2020).
- Gao, L., et al. In vivo photocontrol of microtubule dynamics and integrity, migration and mitosis, by the potent GFP-imaging-compatible photoswitchable reagents SBTubA4P and SBTub2M. BioRxiv. bioRxiv. , (2021).
- Tichy, A. M., Gerrard, E. J., Legrand, J. M. D., Hobbs, R. M., Janovjak, H. Engineering strategy and vector library for the rapid generation of modular light-controlled protein-protein interactions. Journal of Molecular Biology. 431 (17), 3046-3055 (2019).
- van Haren, J., Adachi, L. S., Wittmann, T. Optogenetic control of microtubule dynamics. Methods in Molecular Biology. 2101, 211-234 (2020).
- Adikes, R. C., Hallett, R. A., Saway, B. F., Kuhlman, B., Slep, K. C. Control of microtubule dynamics using an optogenetic microtubule plus end-F-actin cross-linker. Journal of Cell Biology. 217 (2), 779-793 (2018).
- Kogler, A. C., et al. Extremely rapid and reversible optogenetic perturbation of nuclear proteins in living embryos. Developmental Cell. 56 (16), 2348-2363 (2021).
- Maghelli, N., Tolic-Norrelykke, I. M. Laser ablation of the microtubule cytoskeleton: setting up and working with an ablation system. Methods in Molecular Biology. 777, 261-271 (2011).
- Bukhari, S. N. A., Kumar, G. B., Revankar, H. M., Qin, H. L. Development of combretastatins as potent tubulin polymerization inhibitors. Bioorganic Chemistry. 72, 130-147 (2017).
- Gilazieva, Z., Ponomarev, A., Rutland, C., Rizvanov, A., Solovyeva, V. Promising applications of tumor spheroids and organoids for personalized medicine. Cancers (Basel). 12 (10), 2727 (2020).
- Scherer, K. M., et al. Three-dimensional imaging and uptake of the anticancer drug combretastatin in cell spheroids and photoisomerization in gels with multiphoton excitation. Journal of Biomedical Optics. 20 (7), 78003 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。