Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Manipulación subcelular espaciotemporal del citoesqueleto de microtúbulos en el embrión de ratón vivo preimplantacional utilizando fotostatinas
En este artículo
Resumen
Los inhibidores típicos de los microtúbulos, utilizados ampliamente en la investigación básica y aplicada, tienen efectos de gran alcance en las células. Recientemente, las fotostatinas surgieron como una clase de inhibidores de microtúbulos fotoconmutables, capaces de manipular instantáneamente, reversible y espaciotemporalmente precisa de microtúbulos. Este protocolo paso a paso detalla la aplicación de fotostatinas en un embrión de ratón preimplantacional vivo en 3D.
Resumen
El citoesqueleto de microtúbulos forma el marco de una célula y es fundamental para el transporte intracelular, la división celular y la transducción de señales. La interrupción farmacológica tradicional de la red de microtúbulos ubicuos utilizando, por ejemplo, nocodazol puede tener consecuencias devastadoras para cualquier célula. Los inhibidores de microtúbulos fotoconmutables reversiblemente tienen el potencial de superar las limitaciones al permitir que los efectos de los medicamentos se implementen de una manera controlada espaciotemporalmente. Una de esas familias de medicamentos son las fotostatinas a base de azobenceno (PST). Estos compuestos son inactivos en condiciones de oscuridad, y al iluminarse con luz UV, se unen al sitio de unión a la colchicina de β-tubulina y bloquean la polimerización del microtúbulo y la rotación dinámica. Aquí, la aplicación de PST en el embrión de ratón preimplantacional vivo de 3 dimensiones (3D) se establece para interrumpir la red de microtúbulos a nivel subcelular. Este protocolo proporciona instrucciones para la configuración experimental, así como parámetros de activación y desactivación de la luz para PST que utilizan microscopía confocal de células vivas. Esto asegura la reproducibilidad y permite a otros aplicar este procedimiento a sus preguntas de investigación. Los fotointerruptores innovadores como los PST pueden evolucionar como herramientas poderosas para avanzar en la comprensión de la red dinámica de microtúbulos intracelulares y para manipular de forma no invasiva el citoesqueleto en tiempo real. Además, los PST pueden resultar útiles en otras estructuras 3D como organoides, blastoides o embriones de otras especies.
Introducción
La arquitectura de los microtúbulos varía ampliamente entre los diferentes tipos de células para admitir diversas funciones 1,2. Su naturaleza dinámica de crecimiento y contracción permite una rápida adaptación a las señales extra e intracelulares y responder a las necesidades siempre cambiantes de una célula. Por lo tanto, se puede considerar como la "huella morfológica" que juega un papel clave en la identidad celular.
La orientación farmacológica del citoesqueleto de microtúbulos utilizando inhibidores de moléculas pequeñas ha llevado a una gran cantidad de descubrimientos fundamentales en biología del desarrollo, biología de células madre, biología del cáncer y neurobiología 3,4,5,6,7. Este enfoque, si bien es indispensable, presenta varias limitaciones, como la toxicidad y los efectos fuera del objetivo. Por ejemplo, uno de los agentes dirigidos a los microtúbulos más utilizados, el nocodazol, es un potente fármaco despolimerizante de microtúbulos8. Sin embargo, los inhibidores de moléculas pequeñas como el nocodazol están activos desde el momento de la aplicación y, dada la naturaleza esencial del citoesqueleto de microtúbulos para muchas funciones celulares críticas, la despolimerización global de microtúbulos puede producir efectos fuera del objetivo, que pueden ser inadecuados para muchas aplicaciones. Además, el tratamiento con nocodazol es irreversible a menos que las muestras se laven libres del medicamento, lo que impide la obtención continua de imágenes en vivo y, por lo tanto, el seguimiento preciso de los filamentos de microtúbulos individuales.
El desarrollo de compuestos activados por la luz comenzó con la creación de moléculas fotouncatadas y ha anunciado una nueva era en la orientación y el monitoreo de los efectos de la inhibición del crecimiento de microtúbulos de una manera precisa y controlada espaciotemporalmente. Una familia de fármacos fotoconmutables reversiblemente, las fotostatinas (PST), se desarrollaron reemplazando el componente de estilbeno de la combretastatina A-4 con azobenceno9. Los PST están inactivos hasta la iluminación con luz UV, por lo que la transconfiguración inactiva se convierte en la configuración cis activa por isomerización reversible. Los Cis-PST inhiben la polimerización de microtúbulos al unirse al sitio de unión de colchicina de β-tubulina, bloqueando su interfaz con β-tubulina y previniendo la dimerización requerida para el crecimiento de microtúbulos10. Entre una cohorte de PST, PST-1P ha surgido como un compuesto de plomo, ya que tiene la mayor potencia, es totalmente soluble en agua y muestra un rápido inicio de bioactividad después de la iluminación.
La isomerización trans-a cis más efectiva de los PST ocurre en longitudes de onda entre 360-420 nm, lo que permite opciones duales para la activación de PST. Se puede administrar una línea láser de 405 nm en un microscopio confocal típico para una orientación espacial óptima de la inhibición del crecimiento de microtúbulos. La capacidad de identificar la ubicación y el momento de la activación de PST a través de la iluminación láser de 405 nm facilita el control temporal y espacial preciso, lo que permite la interrupción de la dinámica de los microtúbulos a nivel subcelular, dentro de los tiempos de respuesta de menos de un segundo9. Alternativamente, una luz UV LED asequible permite que la iluminación de todo el organismo induzca la interrupción de la arquitectura de los microtúbulos en todo el organismo. Esta puede ser una alternativa rentable para los investigadores para quienes el inicio de la inhibición en el momento preciso, en lugar de la orientación espacial, es el objetivo. Otra característica de los PST es su inactivación bajo demanda mediante la aplicación de luz verde de una longitud de onda en el rango de 510-540 nm9. Esto permite el rastreo de filamentos de microtúbulos antes, durante y después de la inhibición del crecimiento mediada por PST.
Los PST, aunque todavía son un diseño relativamente reciente, se han utilizado en numerosas aplicaciones in vitro en diversos campos de investigación11, incluida la investigación de nuevos mecanismos de migración celular en ameboides12, en neuronas aisladas del cerebro del ratón recién nacido13 y el desarrollo del epitelio del ala en Drosophila melanogaster14 . Otros medicamentos reactivos a la luz han demostrado ser herramientas valiosas en la interrupción dirigida de la función celular. Por ejemplo, se utilizó un análogo de blebbistatina, azidoblebbistatina, para mejorar la inhibición de la miosina bajo iluminación15,16. Esto destaca el potencial de nuevos descubrimientos debido a la capacidad de inhibición espaciotemporánea controlada de la función celular.
Los organismos 3D vivos presentan sistemas excelentes pero más delicados para manipular la dinámica de los microtúbulos a nivel de todo el animal, una sola célula o subcelular en condiciones fisiológicas. En particular, el embrión de ratón preimplantacional ofrece una visión excepcional del funcionamiento interno de la célula, así como de las relaciones intercelulares dentro de un organismo17. Los ciclos consecutivos de activación y desactivación de PST dirigidos temporal y espacialmente contribuyeron a la caracterización del puente interfase, una estructura postcitocinética entre células, como un centro organizador de microtúbulos no centrosómicos en el embrión de ratón preimplantacional16. Una configuración experimental similar demostró la participación de los microtúbulos en crecimiento en el sellado del embrión de ratón para permitir la formación de blastocistos18. Además, los PST también se utilizaron en embriones enteros de pez cebra para investigar la migración de células neuronales mediante la inhibición del crecimiento de microtúbulos en un subconjunto de células en el cerebro posterior19.
Este protocolo describe la configuración experimental y el uso de PST-1P en el embrión de ratón preimplantacional. Las instrucciones presentadas aquí también pueden guiar la aplicación de los PST para una amplia gama de objetivos, como el estudio de la segregación cromosómica y la división celular, el tráfico de carga intracelular y la morfogénesis y migración celular. Además, dichos estudios ayudarán a la implementación de PST en sistemas organoides, blastoides y otros modelos embrionarios como Caenorhabditis elegans y Xenopus laevis, así como potencialmente ampliarán el uso de PST para tecnologías de fertilización in vitro .
Protocolo
Los experimentos fueron aprobados por el Comité de Ética Animal de Monash bajo el número de ética animal 19143. Los animales fueron alojados en condiciones específicas de hogar de animales libres de patógenos en la instalación de animales (Monash Animal Research Platform) en estricta conformidad con las pautas éticas.
1. Colección de embriones de ratón preimplantacionales
- Ratones superovulados y de pareja descritos anteriormente16,18, en cumplimiento de las directrices institucionales de ética animal.
NOTA: Las cepas más utilizadas para la recolección de embriones vivos son los ratones C57BL/6 o FVB/N. Todos los datos mostrados aquí fueron generados usando ratones FVB/N. - En la mañana después del apareamiento, enjuague los cigotos del oviducto usando el medio M2 como se describe20, o el medio del líquido tubárico humano (HTF). Utilizando un aparato de pipeta bucal como se describe21,22, transfiera los cigotos a gotas frescas de Potassium Simplex Optimised Medium (KSOM), precalentadas a 37 °C y equilibradas al 5% de CO2, en un plato de cultivo de 35 mm superpuesto con un volumen suficiente de aceite mineral para garantizar la cobertura de los medios.
- Microinyect zygotes como se describe20 con cRNA codificando para un marcador final de microtúbulos rojos marcados fluorescentemente. Aquí, el ARNc para la proteína de unión final 3 (EB3)-dTomato se utilizó a una concentración de 30 ng / μL después de preparar y purificar como se describe16,18 y diluir en tampón de microinyección.
NOTA: Se recomienda preparar el ARNc con anticipación y almacenarlo a -20 °C hasta que sea necesario. - Cultivar embriones en la oscuridad a 37 °C y 5% de CO2 hasta que los embriones hayan alcanzado la etapa de desarrollo deseada para el tratamiento con PST-1P.
NOTA: Para un recurso completo de los tiempos de cultivo requeridos para diferentes etapas embrionarias ver23. Para embriones en etapa de 16 células utilizados aquí, cultivo hasta el día embrionario 3 (E3) después de la fertilización.
2. Preparación de medicamentos y platos de imágenes
NOTA: Para los pasos 2.1-2.10, trabaje exclusivamente en condiciones de luz oscura o roja para evitar la activación involuntaria de PST-1P. Se debe usar papel de aluminio o cubiertas oscuras para todos los tubos y platos que contengan PST.
- Preparar una concentración de stock de 50 mM PST-1P en agua ultrapura.
NOTA: El peso molecular de PST-1P es de 440 g/mol. La solución madre es estable a -20 °C durante un máximo de 1 año. PST-1P es soluble en agua o tampón acuoso, pero no se disuelve fácilmente en DMSO. - A partir del paso 2.1, prepare una concentración de trabajo intermedia de 800 μM PST-1P en agua ultrapura.
- Diluir PST-1P a una concentración final de 40 μM en KSOM fresco. Como un experimento típico requiere aproximadamente 20 μL de KSOM tratado con PST-1P, diluya 1 μL de 800 μM PST-1P en 19 μL de KSOM para un volumen final de 20 μL para garantizar que se prepare suficiente medio de antemano, utilizando solo luz roja para la visibilidad.
NOTA: Tanto la concentración como el estado de activación de una dilución PST-1P se pueden verificar tomando un espectro de absorbancia UV-Vis utilizando un espectrofotómetro que debe realizarse durante el establecimiento del ensayo. La absorbancia a 380 nm (A380) de una dilución totalmente trans de 40 μM en una cubeta de 1 cm debe ser de aproximadamente 0,8. Tanto las formas cis como las trans tienen la misma absorbancia a 455 nm (A455). Cuando la relación entre el A380 y el A455 es de aproximadamente 9:1, la dilución es inactiva (totalmente trans). Cuando la relación A380:A455 es 1:2, la dilución está completamente activada (completamente cis). Las proporciones intermedias reflejan los estados intermedios de activación. - Para preparar el portaobjetos de cámara para imágenes en vivo, pipetee 10 μL de KSOM tratado con PST-1P en el centro de un pozo para formar una gota hemisférica (Figura 1A).
- Agregue suavemente suficiente aceite mineral para cubrir la gota, asegurándose de que no disperse el medio. Esto asegurará que la gota no se evapore.
- Precalentamiento y CO2-equilibran la placa deslizante de la cámara en una incubadora a 37 ° C y 5% de CO2 durante un mínimo de 3 h o, como máximo, durante la noche.
- Al final del período de equilibrio en el paso 2.6, prepare un plato de cultivo de 35 mm con una gota de 10 μL de KSOM tratado con PST-1P, precalentado y equilibrado como paso de lavado. No superponga con aceite.
- Transfiera embriones por pipeteo bucal a la gota de KSOM tratada con PST-1P del paso 2.7.
NOTA: Los pasos 2.7 y 2.8 se recomiendan para el pipeteo bucal de embriones, pero son opcionales. - Transfiera inmediatamente los embriones por pipeteo bucal en el centro de la gota de KSOM tratada con PST-1P en el portaobjetos de la cámara de imágenes preparado en los pasos 2.4-2.6 (Figura 1A).
- Incubar embriones a 37 °C y 5% de CO2 en KSOM tratado con PST-1P en el portaobjetos de la cámara de imágenes durante al menos 1 h antes de la toma de imágenes. Si es posible, monte el portaobjetos de cámara en el microscopio dentro de una cámara ambiental a 37 ° C y 5% de CO2, y en completa oscuridad para garantizar que todos los PST-1P estén en la transconfiguración inactiva y que los embriones puedan hundirse en el fondo del plato.
3. Imágenes en vivo y fotoactivación PST-1P
NOTA: Los pasos 3.1-3.13 se realizan en un microscopio confocal de escaneo láser equipado con detectores de fotodiodos de avalancha (APD) y una cámara ambiental oscura. Estas instrucciones se refieren específicamente a la configuración de imágenes utilizando el software de adquisición descrito en la Tabla de Materiales; sin embargo, también se pueden aplicar a otros sistemas de microscopía confocal.
- Prepare un objetivo de inmersión en aceite de agua 63x/1.2 NA con el medio de inmersión prescrito.
- Usando una antorcha de luz roja para guiar el posicionamiento, avance el objetivo para contactar con el medio de inmersión. En esta etapa, evite usar luz blanca o de campo brillante para encontrar los embriones, ya que esto podría activar precozmente PST-1P.
- Usando el ocular y mientras esté bajo iluminación de luz roja, ubique el borde de la gota de medio y coloque el objetivo directamente sobre esta ubicación. Esto puede ayudar al usuario a establecer la orientación y encontrar el plano focal.
- A continuación, a través del ocular o en el escaneo en modo en vivo habilitado por software, use un filtro de longitud de onda roja o un láser de 561 nm para localizar los embriones dentro de la gota.
- Utilice controladores de etapa y el modo de escaneo en vivo para establecer los puntos de inicio y final para adquirir una pila z de todo el embrión.
- Ajuste la configuración de potencia del láser (por lo general, con detectores altamente sensibles como los APD, una potencia láser de 561 nm de menos del 5% es suficiente), el desplazamiento digital (generalmente a -0.900) para optimizar la apariencia de los cometas EB3-dTomato y minimizar el ruido de fondo, el agujero de alfiler a 2 μm, la resolución de píxeles de 512 x 512 y el tiempo de permanencia de píxeles de 3.15 μs.
- Adquirir una pila z de todo el embrión con intervalos de sección de 1 μm para evaluar áreas de crecimiento de microtúbulos en todo el organismo (Figura 1B).
- Utilice la imagen 3D z-stack del paso 3.7 para identificar regiones de interés (ROI) para experimentos de seguimiento EB3-dTomato. Aumente el zoom a 3x y dibuje un ROI rectangular alrededor del área subcelular específica de interés.
- Adquiera una película de lapso de tiempo de un solo plano z utilizando los valores típicos de los parámetros de imagen: potencia láser de 561 nm al 5%, desplazamiento digital de -0.900, resolución de píxeles de 512 x 512, agujero de alfiler a 3 μm, tiempo de permanencia de píxeles de 3.15 μs, zoom de 3x, intervalo de tiempo de 500 ms.
NOTA: 120 marcos de tiempo proporcionarán una película de seguimiento de 1 minuto y deberían ser suficientes para el análisis de datos. La adquisición puede continuar durante más tiempo, siempre que el blanqueamiento del fluoróforo sea mínimo (Figura 1C). - Para activar PST-1P, cambie a un láser de 405 nm y adquiera otra película de lapso de tiempo con el láser de 405 nm configurado al 10% de potencia, resolución de píxeles de 512 x 512, agujero de alfiler abierto al máximo, tiempo de permanencia de píxeles de 3.15 μs, zoom de 3x, intervalo de tiempo de 500 ms y un total de 20 cuadros (Figura 1D).
- Vuelva al láser de 561 nm y repita la adquisición como en el paso 3.9 para confirmar la pérdida de cometas EB3-dTomato después de la activación de PST-1P (Figura 1E). Asegúrese de que esta adquisición se lleve a cabo lo antes posible después de la activación.
NOTA: El paso 3.10 se puede realizar repetidamente para una inhibición más prolongada de los cometas EB3-dTomato. Sin embargo, los embriones deben ser monitoreados cuidadosamente para evitar cualquier daño causado por la luz UV. - Para revertir PST-1P a su estado transactivo, active un láser de 514 nm al 10% de potencia. Adquiera una película de lapso de tiempo con el láser de 514 nm configurado al 10% de potencia, resolución de píxeles de 512 x 512, agujero de alfiler abierto al máximo, tiempo de permanencia de píxeles de 3.15 μs, zoom de 3x, intervalo de tiempo de 500 ms y un total de 20 marcos de tiempo (Figura 1F).
- Repita el paso 3.11 para visualizar la recuperación de los cometas EB3-dTomato (Figura 1G).
4. Análisis de datos de imagen
- Para analizar y cuantificar la inhibición de la polimerización de microtúbulos por parte de los PST, utilice programas de software disponibles para los investigadores para satisfacer sus necesidades específicas. Los recomendados para su uso poseerán una herramienta de seguimiento, que puede rastrear manual o automáticamente el movimiento, la dirección y la velocidad de los cometas EB3-dTomato16,18.
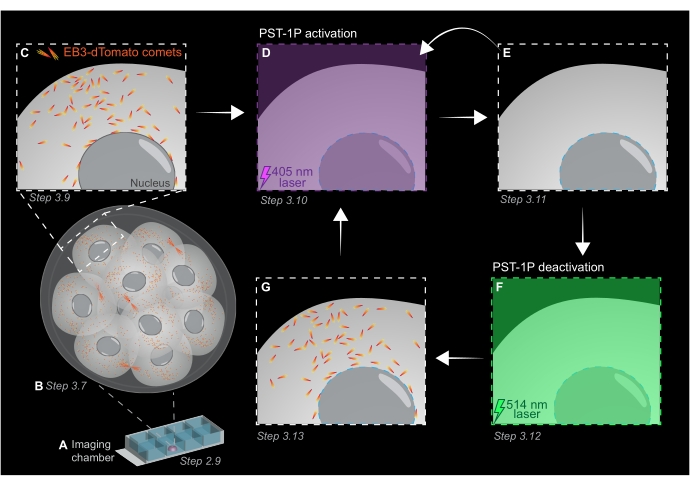
Figura 1: Representación esquemática de la fotoactivación y desactivación de PST-1P en el embrión de ratón preimplantacional 3D vivo. Todos los experimentos se realizan en completa oscuridad (fondo negro) o solo mediante iluminación de luz roja. (A) Los embriones de ratón preimplantacionales vivos que expresan EB3-dTomato se cultivan en etapa de 16 células y luego se transfieren a una gota de KSOM que contiene 40 μM PST-1P en un portaobjetos de cámara de imágenes. (B) Una imagen 3D de todo el embrión permite la evaluación del crecimiento de microtúbulos mediante la visualización de la distribución de los cometas EB3-dTomato. (C) Para comenzar el experimento, los cometas EB3-dTomato son rastreados en una región subcelular utilizando imágenes de lapso de tiempo. (D) La fotoactivación pst-1P posterior en la misma región subcelular utilizando un láser de 405 nm da como resultado la pérdida de cometas EB3-dTomato (E). La activación intensificada de PST-1P se puede implementar, si es necesario, mediante iluminación de luz secuencial de 405 nm. (F-G) Para revertir PST-1P a su estado inactivo y restaurar los cometas EB3-dTomato, se aplica un láser de 514 nm a la misma región subcelular. Si es necesario, se pueden realizar varias rondas de fotoactivación y desactivación. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
De acuerdo con el protocolo, los embriones de ratón preimplantacionales fueron microinyectados con ARNc para EB3, marcados con dTomato fluorescente rojo (EB3-dTomato). Esto permite la visualización de microtúbulos en crecimiento a medida que EB3 se une a los microtúbulos polimerizantes más los extremos24.
Los experimentos se realizaron 3 días después de la fertilización (E3) cuando el embrión de ratón está compuesto por 16 células. Se puede utilizar cualquie...
Discusión
La red de microtúbulos es parte integral del funcionamiento interno fundamental de una célula. En consecuencia, esto presenta desafíos en la manipulación de la dinámica de los microtúbulos en los organismos vivos, ya que cualquier perturbación en la red tiende a tener consecuencias generalizadas para todos los aspectos de la función celular. La aparición de compuestos fotoconmutables dirigidos a microtúbulos presenta una forma de manipular con precisión el citoesqueleto a nivel subcelular, con un control super...
Divulgaciones
Los autores declaran que no hay interés competitivo o financiero.
Agradecimientos
Los autores desean agradecer al Dr. Oliver Thorn-Seshold y Li Gao por proporcionarnos fotostatinas y consejos sobre la preparación de manuscritos, Monash Production por el apoyo a la filmación y Monash Micro Imaging por el apoyo a la microscopía.
Este trabajo fue apoyado por la subvención del proyecto APP2002507 del Consejo Nacional de Salud e Investigación Médica (NHMRC) a J.Z. y la Beca Azrieli del Instituto Canadiense de Investigación Avanzada (CIFAR) a J.Z. El Instituto Australiano de Medicina Regenerativa cuenta con el apoyo de subvenciones del Gobierno del Estado de Victoria y el Gobierno de Australia.
Materiales
| Name | Company | Catalog Number | Comments |
| Aspirator tube | Sigma-Aldrich | A5177 | For mouth aspiration apparatus |
| Chamber slides - LabTek | Thermo Fisher Scientific | NUN155411 | |
| cRNA encoding for EB3-dTomato | N/A | N/A | Prepared according to manufacturers instructions using mMessage in vitro Transcription kit |
| Culture dishes - 35mm | Thermo Fisher Scientific | 150560 | |
| Human chorionic growth hormone | Sigma-Aldrich | C8554 | |
| Human Tubal Fluid (HTF) medium | Cosmo-Bio | CSR-R-B071 | |
| Imaris Image Analysis Software | Bitplane | ||
| Immersion Oil W 2010 | Carl Zeiss | 444969-0000-000 | For use with microscope immersion objective |
| LED torch - Red light | Celestron | 93588 | |
| M2 medium | Sigma-Aldrich | M7167 | |
| Mice - wild-type FVB/N, males and females | N/A | N/A | Females 8-9 weeks old. Males 2-6 months old. |
| Microcapillary Pipettes - Kimble | Sigma-Aldrich | Z543306 | For mouth aspiration apparatus |
| Microinjection buffer | N/A | N/A | 5 mM Tris, 5 mM NaCl, 0.1 mM EDTA, pH 7.4 |
| Mineral oil | Origio | ART-4008-5P | |
| mMessage In vitro Transcription kit | Thermo Fisher Scientific | AM1340 | |
| NanoDrop Spectrophotometer | Thermo Fisher Scientific | ||
| Potassium Simplex Optimised Medium (KSOM) medium | Cosmo-Bio | CSR-R-B074 | |
| Pregnant mare serum gonadotrophin | Prospec Bio | HOR-272 | |
| PST-1P | N/A | N/A | Borowiak, M. et al., Photoswitchable Inhibitors of Microtubule Dynamics Optically Control Mitosis and Cell Death. Cell. 162 (2), 403-411, doi:10.1016/j.cell.2015.06.049, (2015). |
| RNA purification kit | Sangon | B511361-0100 | |
| Ultrapure water | Sigma-Aldrich | W1503 | |
| ZEN Black Software | Carl Zeiss |
Referencias
- Hawdon, A., Aberkane, A., Zenker, J. Microtubule-dependent subcellular organisation of pluripotent cells. Development. 148 (20), (2021).
- Sanchez, A. D., Feldman, J. L. Microtubule-organizing centers: from the centrosome to non-centrosomal sites. Current Opinion in Cell Biology. 44, 93-101 (2017).
- Galli, M., Morgan, D. O. Cell size determines the strength of the spindle assembly checkpoint during embryonic development. Developmental Cell. 36 (3), 344-352 (2016).
- Vazquez-Diez, C., Paim, L. M. G., FitzHarris, G. Cell-size-independent spindle checkpoint failure underlies chromosome segregation error in mouse embryos. Current Biology. 29 (5), 865-873 (2019).
- Baudoin, J. P., Alvarez, C., Gaspar, P., Metin, C. Nocodazole-induced changes in microtubule dynamics impair the morphology and directionality of migrating medial ganglionic eminence cells. Developmental Neuroscience. 30 (1-3), 132-143 (2008).
- Munz, F., et al. Human mesenchymal stem cells lose their functional properties after paclitaxel treatment. Scientific Reports. 8 (1), 312 (2018).
- Jordan, M. A., Wilson, L. Microtubules as a target for anticancer drugs. Nature Reviews Cancer. 4 (4), 253-265 (2004).
- Vasquez, R. J., Howell, B., Yvon, A. M., Wadsworth, P., Cassimeris, L. Nanomolar concentrations of nocodazole alter microtubule dynamic instability in vivo and in vitro. Molecular Biology of the Cell. 8 (6), 973-985 (1997).
- Borowiak, M., et al. Photoswitchable inhibitors of microtubule dynamics optically control mitosis and cell death. Cell. 162 (2), 403-411 (2015).
- Gaspari, R., Prota, A. E., Bargsten, K., Cavalli, A., Steinmetz, M. O. Structural basis of cis- and trans-Combretastatin binding to tubulin. Chem. 2 (1), 102-113 (2017).
- Thorn-Seshold, O., Meiring, J. Photocontrolling microtubule dynamics with photoswitchable chemical reagents. ChemRxiv. , (2021).
- Kopf, A., et al. Microtubules control cellular shape and coherence in amoeboid migrating cells. Journal of Cell Biology. 219 (6), 201907154 (2020).
- Sawada, M., et al. PlexinD1 signaling controls morphological changes and migration termination in newborn neurons. The EMBO Journal. 37 (4), 97404 (2018).
- Singh, A., et al. Polarized microtubule dynamics directs cell mechanics and coordinates forces during epithelial morphogenesis. Nature Cell Biology. 20 (10), 1126-1133 (2018).
- Kepiro, M., et al. Azidoblebbistatin, a photoreactive myosin inhibitor. Proceedings of the National Academy of Sciences of the United States of America. 109 (24), 9402-9407 (2012).
- Zenker, J., et al. A microtubule-organizing center directing intracellular transport in the early mouse embryo. Science. 357 (6354), 925-928 (2017).
- White, M. D., Zenker, J., Bissiere, S., Plachta, N. Instructions for assembling the early mammalian embryo. Developmental Cell. 45 (6), 667-679 (2018).
- Zenker, J., et al. Expanding actin rings zipper the mouse embryo for blastocyst formation. Cell. 173 (3), 776-791 (2018).
- Theisen, U., et al. Microtubules and motor proteins support zebrafish neuronal migration by directing cargo. Journal of Cell Biology. 219 (10), 201908040 (2020).
- Rulicke, T. Pronuclear microinjection of mouse zygotes. Methods in Molecular Biology. 254, 165-194 (2004).
- Greaney, J., Subramanian, G. N., Ye, Y., Homer, H. Isolation and in vitro culture of mouse oocytes. Bio-protocol. 11 (15), 4104 (2021).
- Subramanian, G. N., et al. Oocytes mount a noncanonical DNA damage response involving APC-Cdh1-mediated proteolysis. Journal of Cell Biology. 219 (4), 201907213 (2020).
- Mihajlovic, A. I., Bruce, A. W. The first cell-fate decision of mouse preimplantation embryo development: integrating cell position and polarity. Open Biology. 7 (11), 170210 (2017).
- Roostalu, J., et al. The speed of GTP hydrolysis determines GTP cap size and controls microtubule stability. Elife. 9, 51992 (2020).
- Gao, L., et al. In vivo photocontrol of microtubule dynamics and integrity, migration and mitosis, by the potent GFP-imaging-compatible photoswitchable reagents SBTubA4P and SBTub2M. BioRxiv. bioRxiv. , (2021).
- Tichy, A. M., Gerrard, E. J., Legrand, J. M. D., Hobbs, R. M., Janovjak, H. Engineering strategy and vector library for the rapid generation of modular light-controlled protein-protein interactions. Journal of Molecular Biology. 431 (17), 3046-3055 (2019).
- van Haren, J., Adachi, L. S., Wittmann, T. Optogenetic control of microtubule dynamics. Methods in Molecular Biology. 2101, 211-234 (2020).
- Adikes, R. C., Hallett, R. A., Saway, B. F., Kuhlman, B., Slep, K. C. Control of microtubule dynamics using an optogenetic microtubule plus end-F-actin cross-linker. Journal of Cell Biology. 217 (2), 779-793 (2018).
- Kogler, A. C., et al. Extremely rapid and reversible optogenetic perturbation of nuclear proteins in living embryos. Developmental Cell. 56 (16), 2348-2363 (2021).
- Maghelli, N., Tolic-Norrelykke, I. M. Laser ablation of the microtubule cytoskeleton: setting up and working with an ablation system. Methods in Molecular Biology. 777, 261-271 (2011).
- Bukhari, S. N. A., Kumar, G. B., Revankar, H. M., Qin, H. L. Development of combretastatins as potent tubulin polymerization inhibitors. Bioorganic Chemistry. 72, 130-147 (2017).
- Gilazieva, Z., Ponomarev, A., Rutland, C., Rizvanov, A., Solovyeva, V. Promising applications of tumor spheroids and organoids for personalized medicine. Cancers (Basel). 12 (10), 2727 (2020).
- Scherer, K. M., et al. Three-dimensional imaging and uptake of the anticancer drug combretastatin in cell spheroids and photoisomerization in gels with multiphoton excitation. Journal of Biomedical Optics. 20 (7), 78003 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados