Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Пространственно-височная субклеточная манипуляция цитоскелетом микротрубочек в живом преимплантационном эмбрионе мыши с использованием фотостатинов
В этой статье
Резюме
Типичные ингибиторы микротрубочек, широко используемые в фундаментальных и прикладных исследованиях, оказывают далеко идущее воздействие на клетки. В последнее время фотостатины появились как класс фотопереключаемых ингибиторов микротрубочек, способных к мгновенным, обратимым, пространственно-временным точным манипуляциям с микротрубочками. Этот пошаговый протокол подробно описывает применение фотостатинов в 3D-живом предимплантационном эмбрионе мыши.
Аннотация
Цитоскелет микротрубочек образует каркас клетки и является фундаментальным для внутриклеточного транспорта, деления клеток и передачи сигнала. Традиционное фармакологическое разрушение вездесущей сети микротрубочек с использованием, например, нокодазола может иметь разрушительные последствия для любой клетки. Обратимо фотопереключаемые ингибиторы микротрубочек обладают потенциалом для преодоления ограничений, позволяя осуществлять эффекты лекарств пространственно-временным контролируемым образом. Одним из таких семейств препаратов являются фотостатины на основе азобензола (PST). Эти соединения неактивны в темных условиях, и при освещении ультрафиолетовым светом они связываются с колхицинсвязывающим участком β-тубулина и блокируют полимеризацию микротрубочек и динамический оборот. Здесь применение PST в 3-мерном (3D) живом преимплантационном эмбрионе мыши направлено на разрушение сети микротрубочек на субклеточном уровне. Этот протокол предоставляет инструкции для экспериментальной установки, а также параметры активации и деактивации света для PST с использованием конфокальной микроскопии живых клеток. Это обеспечивает воспроизводимость и позволяет другим применять эту процедуру к своим исследовательским вопросам. Инновационные фотопереключатели, такие как PST, могут развиваться как мощные инструменты для продвижения понимания динамической внутриклеточной сети микротрубочек и неинвазивного манипулирования цитоскелетом в режиме реального времени. Кроме того, PST могут оказаться полезными в других 3D-структурах, таких как органоиды, бластоиды или эмбрионы других видов.
Введение
Архитектура микротрубочек широко варьируется в разных типах клеток для поддержки различных функций 1,2. Его динамический характер роста и усадки позволяет быстро адаптироваться к вне- и внутриклеточным сигналам и реагировать на постоянно меняющиеся потребности клетки. Следовательно, его можно рассматривать как «морфологический отпечаток пальца», играющий ключевую роль в клеточной идентичности.
Фармакологическое нацеливание цитоскелета микротрубочек с использованием ингибиторов малых молекул привело к множеству фундаментальных открытий в биологии развития, биологии стволовых клеток, биологии рака и нейробиологии 3,4,5,6,7. Этот подход, хотя и незаменим, сопряжен с различными ограничениями, такими как токсичность и нецелевые последствия. Например, один из наиболее широко используемых микротрубочек-таргетирующих агентов, нокодазол, является мощным микротрубоче-деполимеризующим препаратом8. Однако низкомолекулярные ингибиторы, такие как нокодазол, активны с момента применения, и, учитывая сущностную природу цитоскелета микротрубочек для многих критических клеточных функций, глобальная деполимеризация микротрубочек может вызывать нецелевые эффекты, которые могут быть непригодны для многих применений. Кроме того, лечение нокодазолом является необратимым, если образцы не промываются без препарата, что препятствует непрерывной визуализации в реальном времени и, таким образом, точному отслеживанию отдельных нитей микротрубочек.
Разработка светоактивированных соединений началась с создания фотоненасыщенных молекул и ознаменовала новую эру в нацеливании и мониторинге эффектов ингибирования роста микротрубочек точным и пространственно-временно контролируемым образом. Одно семейство обратимо фотопереключаемых препаратов, фотостатины (PST), были разработаны путем замены стилбенового компонента комбретастатина А-4 азобензолом9. PST неактивны до освещения ультрафиолетовым светом, в результате чего неактивная трансконфигурация преобразуется в активную цис-конфигурацию путем обратимой изомеризации. Цис-PST ингибируют полимеризацию микротрубочек путем связывания с местом связывания колхицина β-тубулина, блокируя его интерфейс с β-тубулином и предотвращая димеризацию, необходимую для роста микротрубочек10. Среди когорты PST-1P появился как соединение свинца, поскольку он обладает самой высокой эффективностью, полностью водорастворим и показывает быстрое начало биологической активности после освещения.
Наиболее эффективная транс- и цис-изомеризация PST происходит на длинах волн между 360-420 нм, что обеспечивает двойные варианты активации PST. Лазерная линия 405 нм на типичном конфокальном микроскопе может быть введена для оптимального пространственного нацеливания ингибирования роста микротрубочек. Возможность точно определять местоположение и время активации PST с помощью лазерного освещения 405 нм облегчает точное временное и пространственное управление, позволяя нарушать динамику микротрубочек на субклеточном уровне в течение времени откликаменее секунды 9. В качестве альтернативы, доступный светодиодный ультрафиолетовый свет позволяет освещению всего организма вызывать нарушение архитектуры микротрубочек в масштабах всего организма. Это может быть экономически эффективной альтернативой для исследователей, для которых целью является точно своевременное начало торможения, а не пространственное нацеливание. Еще одной особенностью PST является их инактивация по требованию путем применения зеленого света длины волныв диапазоне 9 510-540 нм. Это позволяет отслеживать нити микротрубочек до, во время и после PST-опосредованного ингибирования роста.
PST, хотя они все еще относительно недавно были разработаны, были использованы в многочисленных приложениях in vitro в различных областях исследований11, включая изучение новых механизмов миграции клеток у амебоидов12, в нейронах, выделенных из мозга новорожденной мыши13, и развитие эпителия крыла у Drosophila melanogaster14 . Другие светореактивные препараты оказались ценными инструментами в целенаправленном нарушении клеточной функции. Например, аналог блеббистатина, азидоблеббистатин, использовался для усиленного ингибирования миозина при освещении 15,16. Это подчеркивает потенциал для новых открытий благодаря способности пространственно-временно контролируемого ингибирования клеточной функции.
Живые 3D-организмы представляют собой превосходные, но более тонкие системы для манипулирования динамикой микротрубочек на общеживийном, одноклеточном или субклеточном уровне в физиологических условиях. В частности, предимплантационный эмбрион мыши дает исключительное представление о внутренней работе клетки, а также о межклеточных отношениях внутри организма17. Временные и пространственно-целевые последовательные циклы активации и дезактивации PST способствовали характеристике межфазного моста, постцитокинетической структуры между клетками, как нецентросомального центра организации микротрубочек в предимплантационном эмбрионе мыши16. Аналогичная экспериментальная установка продемонстрировала участие растущих микротрубочек в уплотнении эмбриона мыши, чтобы обеспечить образование бластоцисты18. Кроме того, PST также использовались в целых эмбрионах рыбок данио для исследования миграции нейронных клеток путем ингибирования роста микротрубочек в подмножестве клеток в заднем мозге19.
Этот протокол описывает экспериментальную установку и использование PST-1P в предимплантационном эмбрионе мыши. Инструкции, представленные здесь, также могут служить руководством для применения PST для широкого спектра целей, таких как изучение сегрегации хромосом и деления клеток, незаконный оборот внутриклеточного груза, а также морфогенез и миграция клеток. Кроме того, такие исследования будут способствовать внедрению PST в органоидных системах, бластоидах и других моделях эмбрионов, таких как Caenorhabditis elegans и Xenopus laevis, а также потенциально расширят использование PST для технологий экстракорпорального оплодотворения.
протокол
Эксперименты были одобрены Комитетом по этике животных Монаша под номером 19143. Животные были размещены в специфических условиях без патогенов на животном объекте (Monash Animal Research Platform) в строгом соответствии с этическими принципами.
1. Преимплантационный сбор эмбрионов мышей
- Суперовулят и спарируют мышей, как описано ранее16,18, в соответствии с институциональными руководящими принципами этики животных.
ПРИМЕЧАНИЕ: Наиболее часто используемыми штаммами для сбора живых эмбрионов являются мыши C57BL/6 или FVB/N. Все данные, показанные здесь, были сгенерированы с использованием мышей FVB/N. - Утром после спаривания смывайте зиготы из яйцевода, используя среду M2, как описано20, или среду human Tubal Fluid (HTF). Используя ротовой пипеточный аппарат, как описано 21,22, перенесите зиготы в свежие капли калия Simplex Optimized Medium (KSOM), предварительно сваренные до 37 °C и уравновешенные до 5% CO 2, в 35-миллиметровой чашке для культивирования, наложенной достаточным объемом минерального масла для обеспечения освещения в средствах массовой информации.
- Микроинъекционные зиготы, как описано20, с кодированием кРНК для красной флуоресцентно меченой микротрубочки плюс концевой маркер. Здесь цРНК для конечного связывающего белка 3 (EB3)-dTomato использовали в концентрации 30 нг/мкл после приготовления и очистки, как описано16,18 и разбавления в буфере микроинъекции.
ПРИМЕЧАНИЕ: Рекомендуется заранее подготовить цРНК и хранить ее при -20 °C до тех пор, пока это не потребуется. - Культивируйте эмбрионы в темноте при 37 °C и 5% CO2 до тех пор, пока эмбрионы не достигнут желаемой стадии развития для лечения PST-1P.
ПРИМЕЧАНИЕ: Полный ресурс о времени культивирования, необходимом для различных эмбриональных стадий, см.23. Для 16-клеточной стадии эмбрионов, используемых здесь, культивирование до эмбрионального дня 3 (Е3) после оплодотворения.
2. Приготовление лекарств и изображений блюд
ПРИМЕЧАНИЕ: На этапах 2.1-2.10 работайте исключительно в условиях темного или красного света, чтобы избежать непреднамеренной активации PST-1P. Алюминиевая фольга или темные крышки должны использоваться для всех туб и тарелок, содержащих PST.
- Приготовьте концентрацию запаса 50 мМ PST-1P в сверхчистой воде.
ПРИМЕЧАНИЕ: Молекулярная масса PST-1P составляет 440 г/моль. Запасной раствор стабилен при -20 °C в течение 1 года. PST-1P растворим в воде или водном буфере, но не легко растворяется в ДМСО. - Из стадии 2.1 подготовьте промежуточную рабочую концентрацию 800 мкМ PST-1P в сверхчистой воде.
- Разбавляют PST-1P до конечной концентрации 40 мкМ в свежем KSOM. В качестве типичного эксперимента требуется приблизительно 20 мкл PST-1P-обработанного KSOM, разбавление 1 мкл 800 мкМ PST-1P в 19 мкл KSOM для конечного объема 20 мкл, чтобы обеспечить заранее достаточную среду, используя только красный свет для видимости.
ПРИМЕЧАНИЕ: Как концентрацию, так и статус активации разбавления PST-1P можно проверить, взяв спектр поглощения UV-Vis с помощью спектрофотометра, что должно быть сделано во время проведения анализа. Поглощение при 380 нм (A380) полностью транс-40 мкМ разведения в кювете 1 см должно составлять приблизительно 0,8. Как цис-, так и транс-формы имеют одинаковую абсорбцию при 455 нм (A455). Когда отношение A380 к A455 составляет приблизительно 9:1, разбавление является неактивным (полностью транс). Когда соотношение А380:А455 составляет 1:2, разбавление полностью активируется (полностью цис). Промежуточные соотношения отражают промежуточные состояния активации. - Для подготовки камерного слайда для живой визуализации пипетку 10 мкл PST-1P-обработанного KSOM в центр одной скважины с образованием полусферической капли (рисунок 1A).
- Осторожно добавьте достаточное количество минерального масла, чтобы покрыть каплю, следя за тем, чтобы она не рассеивала среду. Это гарантирует, что капля не испарится.
- Предварительно разогрейте и СО2-уравновешивайте камеру скользящей посуды в инкубаторе при 37 °C и 5% CO 2 в течение как минимум 3 ч или не более, на ночь.
- В конце периода уравновешивания на этапе 2.6 приготовьте 35-миллиметровую культуральную посуду с капелькой 10 мкл обработанной PST-1P, предварительной и уравновешенной KSOM в качестве стадии стирки. Не накладывать маслом.
- Перенос эмбрионов путем пипетирования через рот в капельку KSOM, обработанную PST-1P, с этапа 2.7.
ПРИМЕЧАНИЕ: Шаги 2.7 и 2.8 рекомендуются для пипетирования эмбрионов полостью рта, но являются необязательными. - Немедленно переносите эмбрионы путем пипетирования полостью рта в центр обработанной PST-1P капли KSOM в слайде камеры визуализации, подготовленном на этапах 2.4-2.6 (рисунок 1A).
- Инкубировать эмбрионы при 37 °C и 5% CO2 в KSOM, обработанном PST-1P, в слайде камеры визуализации в течение не менее 1 ч перед визуализацией. Если возможно, установите затвор камеры на микроскоп внутри камеры окружающей среды при 37 °C и 5% CO2 и в полной темноте, чтобы убедиться, что все PST-1P находятся в неактивной трансконфигурации и что эмбрионы могут опускаться на дно чашки.
3. Живая визуализация и фотоактивация PST-1P
ПРИМЕЧАНИЕ: Этапы 3.1-3.13 выполняются на лазерном сканирующем конфокальном микроскопе, оснащенном лавинными фотодиодными детекторами (APD) и темной камерой окружающей среды. Эти инструкции относятся конкретно к настройке изображения с использованием программного обеспечения для сбора данных, описанного в Таблице материалов; однако они также могут быть применены к другим системам конфокальной микроскопии.
- Подготовьте цель погружения водяного масла 63x/1.2 NA с предписанной иммерсионной средой.
- Используя факел красного света для управления позиционированием, продвигайте цель, чтобы связаться со средой погружения. На этом этапе избегайте использования белого или яркого света для поиска эмбрионов, так как это может преждевременно активировать PST-1P.
- С помощью окуляра и при освещении красным светом найдите край капли среды и расположите цель непосредственно над этим местом. Это может помочь пользователю установить ориентацию и найти фокальную плоскость.
- Затем, через окуляр или на программном сканировании в реальном времени, используйте красный фильтр длин волны или лазер 561 нм, чтобы найти эмбрионы внутри капли.
- Используйте контроллеры стадии и режим сканирования в реальном времени, чтобы установить начальную и конечную точки для получения z-стека всего эмбриона.
- Отрегулируйте настройки мощности лазера (как правило, с помощью высокочувствительных детекторов, таких как APD, достаточно лазерной мощности 561 нм менее 5%), цифрового смещения (обычно при -0,900) для оптимизации внешнего вида комет EB3-dTomato и минимизации фонового шума, точечного отверстия при 2 мкм, пиксельного разрешения 512 x 512 и времени выдержки пикселей 3,15 мкс.
- Приобретите z-стек всего эмбриона с интервалами сечения 1 мкм для оценки площадей роста микротрубочек во всем организме (рисунок 1B).
- Используйте 3D-изображение z-стека из шага 3.7 для определения областей, представляющих интерес (ROI) для экспериментов по отслеживанию EB3-dTomato. Увеличьте масштаб до 3x и нарисуйте прямоугольную рентабельность инвестиций вокруг конкретной подклеточной области, представляющей интерес.
- Получите покадровое видео одной z-плоскости, используя типичные значения параметров изображения: мощность лазера 561 нм при 5%, цифровое смещение -0,900, разрешение пикселей 512 x 512, точечное отверстие при 3 мкм, время выдержки пикселя 3,15 мкс, зум 3x, интервал времени 500 мс.
ПРИМЕЧАНИЕ: 120 таймфреймов обеспечат отслеживание фильма продолжительностью 1 минуту и должны быть достаточными для анализа данных. Приобретение может продолжаться дольше при условии, что отбеливание флуорофора минимально (рисунок 1С). - Чтобы активировать PST-1P, переключитесь на лазер 405 нм и получите еще один покадровый фильм с лазером 405 нм, настроенным на мощность 10%, разрешением пикселей 512 x 512, максимально открытым отверстием, временем ожидания пикселя 3,15 мкс, зумом 3x, временным интервалом 500 мс и в общей сложности 20 кадрами (рисунок 1D).
- Переключитесь обратно на лазер 561 нм и повторите сбор, как на шаге 3.9, чтобы подтвердить потерю комет EB3-dTomato после активации PST-1P (рисунок 1E). Убедитесь, что это приобретение происходит как можно скорее после активации.
ПРИМЕЧАНИЕ: Шаг 3.10 может быть выполнен повторно для более длительного ингибирования комет EB3-dTomato. Тем не менее, эмбрионы должны тщательно контролироваться, чтобы избежать любого вреда, причиняемого ультрафиолетовым светом. - Чтобы вернуть PST-1P обратно в его неактивное транс-состояние, включите лазер 514 нм с мощностью 10%. Получите покадровый фильм с лазером 514 нм, настроенным на мощность 10%, разрешением пикселей 512 x 512, максимальным открытием точечного отверстия, временем выдержки пикселя 3,15 мкс, зумом 3x, временным интервалом 500 мс и в общей сложности 20 таймфреймами (рисунок 1F).
- Повторите шаг 3.11 для визуализации восстановления комет EB3-dTomato (рисунок 1G).
4. Анализ данных изображения
- Для анализа и количественной оценки ингибирования полимеризации микротрубочек PST используйте программы, доступные исследователям, в соответствии с их конкретными потребностями. Те, кто рекомендован к использованию, будут обладать инструментом отслеживания, который может вручную или автоматически отслеживать движение, направление и скорость комет EB3-dTomato 16,18.
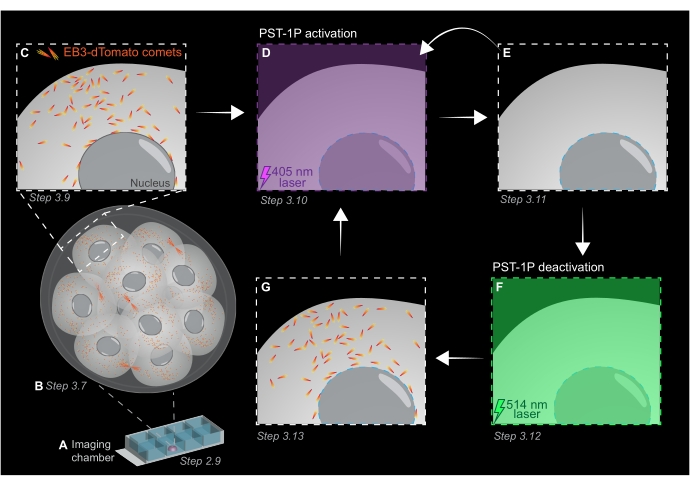
Рисунок 1: Схематическое изображение фотоактивации и деактивации PST-1P в живом 3D-предимплантационном эмбрионе мыши. Все эксперименты проводятся в полной темноте (черный фон) или только при освещении красным светом. (A) Живые предимплантационные эмбрионы мышей, экспрессирующие EB3-dTomato, культивируют до 16-клеточной стадии, а затем переносят в каплю KSOM, содержащую 40 мкМ PST-1P в слайде камеры визуализации. (B) 3D-изображение всего эмбриона позволяет оценить рост микротрубочек путем визуализации распределения комет EB3-dTomato. (C) Чтобы начать эксперимент, кометы EB3-dTomato отслеживаются в субклеточной области с использованием покадровой визуализации. (D) Последующая фотоактивация PST-1P в той же субклеточной области с использованием лазера 405 нм приводит к потере комет EB3-dTomato (E). Усиленная активация PST-1P может быть реализована, при необходимости, путем последовательной световой подсветки 405 нм. (Ф-Г) Чтобы вернуть PST-1P в неактивное состояние и восстановить кометы EB3-dTomato, к той же субклеточной области применяется лазер 514 нм. При необходимости могут быть выполнены несколько раундов фотоактивации и деактивации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
В соответствии с протоколом, эмбрионы мышей с преимплантацией были микроинъективированы с цРНК для EB3, помеченные красным флуоресцентным dTomato (EB3-dTomato). Это позволяет визуализировать растущие микротрубочки, поскольку EB3 связывается с полимеризующими микротрубочками плюс концы
Обсуждение
Сеть микротрубочек является неотъемлемой частью фундаментальной внутренней работы клетки. Следовательно, это создает проблемы в манипулировании динамикой микротрубочек в живых организмах, поскольку любое возмущение сети, как правило, имеет широко распространенные последствия для в...
Раскрытие информации
Авторы заявляют об отсутствии конкурирующей или финансовой заинтересованности.
Благодарности
Авторы хотели бы поблагодарить доктора Оливера Торна-Сесхольда и Ли Гао за предоставление нам фотостатинов и консультаций по подготовке рукописей, Monash Production за поддержку съемок и Monash Micro Imaging за поддержку микроскопии.
Эта работа была поддержана грантом проекта Национального совета по здравоохранению и медицинским исследованиям (NHMRC) APP2002507 для J.Z. и стипендией Азриэли Канадского института перспективных исследований (CIFAR) для J.Z. Австралийский институт регенеративной медицины финансируется за счет грантов правительства штата Виктория и правительства Австралии.
Материалы
| Name | Company | Catalog Number | Comments |
| Aspirator tube | Sigma-Aldrich | A5177 | For mouth aspiration apparatus |
| Chamber slides - LabTek | Thermo Fisher Scientific | NUN155411 | |
| cRNA encoding for EB3-dTomato | N/A | N/A | Prepared according to manufacturers instructions using mMessage in vitro Transcription kit |
| Culture dishes - 35mm | Thermo Fisher Scientific | 150560 | |
| Human chorionic growth hormone | Sigma-Aldrich | C8554 | |
| Human Tubal Fluid (HTF) medium | Cosmo-Bio | CSR-R-B071 | |
| Imaris Image Analysis Software | Bitplane | ||
| Immersion Oil W 2010 | Carl Zeiss | 444969-0000-000 | For use with microscope immersion objective |
| LED torch - Red light | Celestron | 93588 | |
| M2 medium | Sigma-Aldrich | M7167 | |
| Mice - wild-type FVB/N, males and females | N/A | N/A | Females 8-9 weeks old. Males 2-6 months old. |
| Microcapillary Pipettes - Kimble | Sigma-Aldrich | Z543306 | For mouth aspiration apparatus |
| Microinjection buffer | N/A | N/A | 5 mM Tris, 5 mM NaCl, 0.1 mM EDTA, pH 7.4 |
| Mineral oil | Origio | ART-4008-5P | |
| mMessage In vitro Transcription kit | Thermo Fisher Scientific | AM1340 | |
| NanoDrop Spectrophotometer | Thermo Fisher Scientific | ||
| Potassium Simplex Optimised Medium (KSOM) medium | Cosmo-Bio | CSR-R-B074 | |
| Pregnant mare serum gonadotrophin | Prospec Bio | HOR-272 | |
| PST-1P | N/A | N/A | Borowiak, M. et al., Photoswitchable Inhibitors of Microtubule Dynamics Optically Control Mitosis and Cell Death. Cell. 162 (2), 403-411, doi:10.1016/j.cell.2015.06.049, (2015). |
| RNA purification kit | Sangon | B511361-0100 | |
| Ultrapure water | Sigma-Aldrich | W1503 | |
| ZEN Black Software | Carl Zeiss |
Ссылки
- Hawdon, A., Aberkane, A., Zenker, J. Microtubule-dependent subcellular organisation of pluripotent cells. Development. 148 (20), (2021).
- Sanchez, A. D., Feldman, J. L. Microtubule-organizing centers: from the centrosome to non-centrosomal sites. Current Opinion in Cell Biology. 44, 93-101 (2017).
- Galli, M., Morgan, D. O. Cell size determines the strength of the spindle assembly checkpoint during embryonic development. Developmental Cell. 36 (3), 344-352 (2016).
- Vazquez-Diez, C., Paim, L. M. G., FitzHarris, G. Cell-size-independent spindle checkpoint failure underlies chromosome segregation error in mouse embryos. Current Biology. 29 (5), 865-873 (2019).
- Baudoin, J. P., Alvarez, C., Gaspar, P., Metin, C. Nocodazole-induced changes in microtubule dynamics impair the morphology and directionality of migrating medial ganglionic eminence cells. Developmental Neuroscience. 30 (1-3), 132-143 (2008).
- Munz, F., et al. Human mesenchymal stem cells lose their functional properties after paclitaxel treatment. Scientific Reports. 8 (1), 312 (2018).
- Jordan, M. A., Wilson, L. Microtubules as a target for anticancer drugs. Nature Reviews Cancer. 4 (4), 253-265 (2004).
- Vasquez, R. J., Howell, B., Yvon, A. M., Wadsworth, P., Cassimeris, L. Nanomolar concentrations of nocodazole alter microtubule dynamic instability in vivo and in vitro. Molecular Biology of the Cell. 8 (6), 973-985 (1997).
- Borowiak, M., et al. Photoswitchable inhibitors of microtubule dynamics optically control mitosis and cell death. Cell. 162 (2), 403-411 (2015).
- Gaspari, R., Prota, A. E., Bargsten, K., Cavalli, A., Steinmetz, M. O. Structural basis of cis- and trans-Combretastatin binding to tubulin. Chem. 2 (1), 102-113 (2017).
- Thorn-Seshold, O., Meiring, J. Photocontrolling microtubule dynamics with photoswitchable chemical reagents. ChemRxiv. , (2021).
- Kopf, A., et al. Microtubules control cellular shape and coherence in amoeboid migrating cells. Journal of Cell Biology. 219 (6), 201907154 (2020).
- Sawada, M., et al. PlexinD1 signaling controls morphological changes and migration termination in newborn neurons. The EMBO Journal. 37 (4), 97404 (2018).
- Singh, A., et al. Polarized microtubule dynamics directs cell mechanics and coordinates forces during epithelial morphogenesis. Nature Cell Biology. 20 (10), 1126-1133 (2018).
- Kepiro, M., et al. Azidoblebbistatin, a photoreactive myosin inhibitor. Proceedings of the National Academy of Sciences of the United States of America. 109 (24), 9402-9407 (2012).
- Zenker, J., et al. A microtubule-organizing center directing intracellular transport in the early mouse embryo. Science. 357 (6354), 925-928 (2017).
- White, M. D., Zenker, J., Bissiere, S., Plachta, N. Instructions for assembling the early mammalian embryo. Developmental Cell. 45 (6), 667-679 (2018).
- Zenker, J., et al. Expanding actin rings zipper the mouse embryo for blastocyst formation. Cell. 173 (3), 776-791 (2018).
- Theisen, U., et al. Microtubules and motor proteins support zebrafish neuronal migration by directing cargo. Journal of Cell Biology. 219 (10), 201908040 (2020).
- Rulicke, T. Pronuclear microinjection of mouse zygotes. Methods in Molecular Biology. 254, 165-194 (2004).
- Greaney, J., Subramanian, G. N., Ye, Y., Homer, H. Isolation and in vitro culture of mouse oocytes. Bio-protocol. 11 (15), 4104 (2021).
- Subramanian, G. N., et al. Oocytes mount a noncanonical DNA damage response involving APC-Cdh1-mediated proteolysis. Journal of Cell Biology. 219 (4), 201907213 (2020).
- Mihajlovic, A. I., Bruce, A. W. The first cell-fate decision of mouse preimplantation embryo development: integrating cell position and polarity. Open Biology. 7 (11), 170210 (2017).
- Roostalu, J., et al. The speed of GTP hydrolysis determines GTP cap size and controls microtubule stability. Elife. 9, 51992 (2020).
- Gao, L., et al. In vivo photocontrol of microtubule dynamics and integrity, migration and mitosis, by the potent GFP-imaging-compatible photoswitchable reagents SBTubA4P and SBTub2M. BioRxiv. bioRxiv. , (2021).
- Tichy, A. M., Gerrard, E. J., Legrand, J. M. D., Hobbs, R. M., Janovjak, H. Engineering strategy and vector library for the rapid generation of modular light-controlled protein-protein interactions. Journal of Molecular Biology. 431 (17), 3046-3055 (2019).
- van Haren, J., Adachi, L. S., Wittmann, T. Optogenetic control of microtubule dynamics. Methods in Molecular Biology. 2101, 211-234 (2020).
- Adikes, R. C., Hallett, R. A., Saway, B. F., Kuhlman, B., Slep, K. C. Control of microtubule dynamics using an optogenetic microtubule plus end-F-actin cross-linker. Journal of Cell Biology. 217 (2), 779-793 (2018).
- Kogler, A. C., et al. Extremely rapid and reversible optogenetic perturbation of nuclear proteins in living embryos. Developmental Cell. 56 (16), 2348-2363 (2021).
- Maghelli, N., Tolic-Norrelykke, I. M. Laser ablation of the microtubule cytoskeleton: setting up and working with an ablation system. Methods in Molecular Biology. 777, 261-271 (2011).
- Bukhari, S. N. A., Kumar, G. B., Revankar, H. M., Qin, H. L. Development of combretastatins as potent tubulin polymerization inhibitors. Bioorganic Chemistry. 72, 130-147 (2017).
- Gilazieva, Z., Ponomarev, A., Rutland, C., Rizvanov, A., Solovyeva, V. Promising applications of tumor spheroids and organoids for personalized medicine. Cancers (Basel). 12 (10), 2727 (2020).
- Scherer, K. M., et al. Three-dimensional imaging and uptake of the anticancer drug combretastatin in cell spheroids and photoisomerization in gels with multiphoton excitation. Journal of Biomedical Optics. 20 (7), 78003 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены