Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fotostatinler Kullanılarak Canlı Preimplantasyon Fare Embriyosundaki Mikrotübül Sitoiskeletinin Spatiotemporal Subcellular Manipülasyonu
Bu Makalede
Özet
Temel ve uygulamalı araştırmalarda yaygın olarak kullanılan tipik mikrotübül inhibitörleri, hücreler üzerinde geniş kapsamlı etkilere sahiptir. Son zamanlarda, fotostatinler, mikrotübüllerin anlık, geri dönüşümlü, mekansal olarak hassas manipülasyonunu yapabilen bir fotodeğiştirilebilir mikrotübül inhibitörleri sınıfı olarak ortaya çıkmıştır. Bu adım adım protokol, fotostatinlerin 3D canlı preimplantasyon fare embriyosunda uygulanmasını detaylandırır.
Özet
Mikrotübül sitoiskeleti bir hücrenin çerçevesini oluşturur ve hücre içi taşıma, hücre bölünmesi ve sinyal iletimi için temeldir. Her yerde bulunan mikrotübül ağının geleneksel farmakolojik bozulması, örneğin nokodazol kullanarak, herhangi bir hücre için yıkıcı sonuçlar doğurabilir. Geri dönüşümlü olarak foto-değiştirilebilir mikrotübül inhibitörleri, ilaç etkilerinin mekansal olarak geçici olarak kontrol edilen bir şekilde uygulanmasını sağlayarak sınırlamaların üstesinden gelme potansiyeline sahiptir. Böyle bir ilaç ailesi, azobenzen bazlı fotostatinlerdir (PST'ler). Bu bileşikler karanlık koşullarda inaktiftir ve UV ışığı ile aydınlatıldıktan sonra, β-tübülinin kolşisin bağlanma bölgesine bağlanırlar ve mikrotübül polimerizasyonunu ve dinamik dönüşü bloke ederler. Burada, PST'lerin 3 boyutlu (3D) canlı preimplantasyon fare embriyosunda uygulanması, mikrotübül ağını hücre altı düzeyde bozmak için ortaya konmuştur. Bu protokol, deney düzeneği için talimatların yanı sıra canlı hücre konfokal mikroskopisi kullanan PST'ler için ışık aktivasyonu ve deaktivasyon parametreleri sağlar. Bu, tekrarlanabilirliği sağlar ve başkalarının bu prosedürü araştırma sorularına uygulamalarını sağlar. PST'ler gibi yenilikçi fotoanahtarlar, dinamik hücre içi mikrotübül ağının anlaşılmasını ilerletmek ve hücre iskeletini gerçek zamanlı olarak invaziv olmayan bir şekilde manipüle etmek için güçlü araçlar olarak gelişebilir. Ayrıca, PST'ler organoidler, blastoidler veya diğer türlerin embriyoları gibi diğer 3D yapılarda yararlı olabilir.
Giriş
Mikrotübül mimarisi, farklı işlevleri desteklemek için farklı hücre tipleri arasında büyük farklılıklar gösterir 1,2. Büyüme ve büzülmenin dinamik doğası, hücre dışı ve hücre içi ipuçlarına hızlı adaptasyona ve bir hücrenin sürekli değişen ihtiyaçlarına cevap vermeye izin verir. Bu nedenle, hücresel kimlikte önemli bir rol oynayan "morfolojik parmak izi" olarak düşünülebilir.
Küçük molekül inhibitörleri kullanılarak mikrotübül sitoiskeletinin farmakolojik olarak hedeflenmesi, gelişim biyolojisi, kök hücre biyolojisi, kanser biyolojisi ve nörobiyolojideçok sayıda temel keşfe yol açmıştır 3,4,5,6,7. Bu yaklaşım, vazgeçilmez olmakla birlikte, toksisite ve hedef dışı etkiler gibi çeşitli sınırlamalar sunar. Örneğin, en yaygın kullanılan mikrotübül hedefleme ajanlarından biri olan nokodazol, güçlü bir mikrotübül depolimerize edici ilaçtır8. Bununla birlikte, nokodazol gibi küçük moleküllü inhibitörler, uygulama anından itibaren aktiftir ve mikrotübül sitoiskeletinin birçok kritik hücresel fonksiyona temel doğası göz önüne alındığında, mikrotübüllerin küresel depolimerizasyonu, birçok uygulama için uygun olmayabilecek hedef dışı etkiler üretebilir. Ek olarak, nokodazol tedavisi, numuneler ilaçtan arındırılmadıkça, sürekli canlı görüntülemeyi önlemedikçe ve böylece bireysel mikrotübül filamentlerinin hassas bir şekilde izlenmesi sağlanmadıkça geri dönüşümsüzdür.
Işıkla aktive edilen bileşiklerin gelişimi, fotounklanmış moleküllerin yaratılmasıyla başladı ve mikrotübül büyüme inhibisyonunun etkilerini hassas ve mekansal olarak kontrol edilen bir şekilde hedefleme ve izlemede yeni bir çağın habercisi oldu. Geri dönüşümlü olarak foto-değiştirilebilir ilaçların bir ailesi olan fotostatinler (PST'ler), combretastatin A-4'ün stilben bileşeninin azobenzen9 ile değiştirilmesiyle geliştirilmiştir. PST'ler UV ışığı ile aydınlatılana kadar inaktiftir, böylece inaktif trans-konfigürasyon tersinir izomerizasyon ile aktif cis-konfigürasyonuna dönüşür. Cis-PST'ler, β-tübülinin kolşisin bağlanma bölgesine bağlanarak, β-tübülin ile arayüzünü bloke ederek ve mikrotübül büyümesi için gerekli dimerizasyonu önleyerek mikrotübül polimerizasyonunu inhibe eder10. Bir PST kohortu arasında, PST-1P, en yüksek potansiyele sahip olduğu, tamamen suda çözünür olduğu ve aydınlatmadan sonra hızlı bir biyoaktivite başlangıcı gösterdiği için bir kurşun bileşiği olarak ortaya çıkmıştır.
PST'lerin en etkili trans-cis-izomerizasyonu, 360-420 nm arasındaki dalga boylarında gerçekleşir ve bu da PST aktivasyonu için çift seçenek sağlar. Tipik bir konfokal mikroskop üzerinde 405 nm lazer çizgisi, mikrotübül büyüme inhibisyonunun optimal uzamsal hedeflemesi için uygulanabilir. PST aktivasyonunun yerini ve zamanlamasını 405 nm lazer aydınlatma ile belirleme yeteneği, hassas zamansal ve mekansal kontrolü kolaylaştırarak, mikrotübül dinamiklerinin hücre altı düzeyde, saniyenin altındaki tepki süreleri9 içinde bozulmasına izin verir. Alternatif olarak, uygun fiyatlı bir LED UV ışığı, tüm organizma aydınlatmasının mikrotübül mimarisinin organizma çapında bozulmasına neden olmasını sağlar. Bu, mekansal hedefleme yerine, tam olarak zamanlanmış inhibisyon başlangıcının hedef olduğu araştırmacılar için uygun maliyetli bir alternatif olabilir. PST'lerin bir diğer özelliği, 510-540 nm aralığında 9 dalga boyunda yeşil ışık uygulayarak isteğe bağlıinaktivasyonlarıdır. Bu, PST aracılı büyüme inhibisyonu öncesinde, sırasında ve sonrasında mikrotübül filamentlerinin izlenmesini sağlar.
PST'ler, hala nispeten yeni bir tasarım olmasına rağmen, çeşitli araştırma alanlarında 11, amipoidlerde 12'de yeni hücre göçü mekanizmalarının araştırılması, yenidoğan farenin beyninden izole edilen nöronlarda13 ve Drosophila melanogaster'de kanat epitel gelişimi14 dahil olmak üzere çok sayıda in vitro uygulamada kullanılmıştır. . Diğer ışık reaktif ilaçların, hücresel fonksiyonun hedeflenen bozulmasında değerli araçlar olduğu kanıtlanmıştır. Örneğin, blebbistatinin bir analoğu olan azidoblebbistatin,aydınlatma 15,16 altında miyozin inhibisyonunu arttırmak için kullanılmıştır. Bu, hücresel fonksiyonun mekansal olarak zamansal olarak kontrol edilen inhibisyonu nedeniyle yeni keşifler potansiyelini vurgulamaktadır.
Canlı 3D organizmalar, fizyolojik koşullar altında tüm hayvan, tek hücreli veya hücre altı düzeyde mikrotübül dinamiklerini manipüle etmek için mükemmel ama daha hassas sistemler sunar. Özellikle, preimplantasyon fare embriyosu, hücrenin iç işleyişine ve bir organizma içindeki hücreler arası ilişkilere olağanüstü bir bakış açısı sunar17. PST'lerin zamansal ve mekansal olarak hedeflenmiş ardışık aktivasyon ve deaktivasyon döngüleri, preimplantasyon fare embriyosunda sentrozomal olmayan bir mikrotübül organizasyon merkezi olarak hücreler arasındaki post-sitokinetik bir yapı olan interfaz köprüsünün karakterizasyonuna katkıda bulunmuştur16. Benzer bir deney düzeneği, blastosist oluşumuna izin vermek için fare embriyosunun sızdırmazlığına büyüyen mikrotübüllerin katılımını göstermiştir18. Ayrıca, PST'ler, arka beyin19'daki hücrelerin bir alt kümesinde mikrotübül büyümesini inhibe ederek nöronal hücre göçünü araştırmak için tüm zebra balığı embriyolarında da kullanılmıştır.
Bu protokol, preimplantasyon fare embriyosunda PST-1P'nin deneysel kurulumunu ve kullanımını açıklar. Burada sunulan talimatlar ayrıca, kromozom ayrışması ve hücre bölünmesi, hücre içi kargo kaçakçılığı ve hücre morfogenezi ve göçü gibi çok çeşitli hedefler için PST'lerin uygulanmasına rehberlik edebilir. Ayrıca, bu tür çalışmalar PST'lerin organoid sistemlerde, blastoidlerde ve Caenorhabditis elegans ve Xenopus laevis gibi diğer embriyo modellerinde uygulanmasına yardımcı olacak ve ayrıca in vitro fertilizasyon teknolojileri için PST'lerin kullanımını potansiyel olarak genişletecektir.
Protokol
Deneyler Monash Hayvan Etiği Komitesi tarafından 19143 hayvan etiği numarası altında onaylanmıştır. Hayvanlar, etik kurallara sıkı sıkıya bağlı kalarak hayvan tesisinde (Monash Hayvan Araştırma Platformu) belirli patojensiz hayvan evi koşullarında barındırılmıştır.
1. Preimplantasyon fare embriyo toplama
- Kurumsal hayvan etiği kurallarına uygun olarak, daha önce16,18'de tanımlandığı gibi fareleri süperovülat ve çiftleştirin.
NOT: Canlı embriyo toplama için en yaygın kullanılan suşlar C57BL/6 veya FVB/N farelerdir. Burada gösterilen tüm veriler FVB/N fareler kullanılarak oluşturulmuştur. - Çiftleşmeden sonraki sabah, tarif edildiği gibi M2 ortamı veya İnsan Tubal Sıvısı (HTF) ortamı kullanarak yumurta kanalından zigotları yıkayın. 21,22'de açıklandığı gibi bir ağızlı pipet aparatı kullanarak, zigotları, ortam kapsamını sağlamak için yeterli miktarda mineral yağ ile kaplanmış 35 mm'lik bir kültür kabında, 37 °C'ye kadar önceden ısıtılmış ve% 5 CO2'ye dengelenmiş taze Potasyum Simpleks Optimize Edilmiş Orta (KSOM) damlacıklarına aktarın.
- Kırmızı floresan etiketli bir mikrotübül artı uç işaretleyici için cRNA kodlaması ile20'de tarif edildiği gibi mikroenjekte zigotlar. Burada, Son Bağlayıcı protein 3 (EB3)-dDomates için cRNA, tarif edilen16,18 gibi hazırlandıktan ve saflaştırıldıktan ve mikroenjeksiyon tamponunda seyreltildikten sonra 30 ng / μL konsantrasyonunda kullanılmıştır.
NOT: cRNA'nın önceden hazırlanması ve gerekinceye kadar -20 °C'de saklanması önerilir. - Kültür embriyoları 37 ° C'de karanlıkta ve% 5 CO2, embriyolar PST-1P tedavisi için istenen gelişim aşamasına ulaşana kadar.
NOT: Farklı embriyonik aşamalar için gerekli kültür sürelerinin kapsamlı bir kaynağı için bkz.23. Burada kullanılan 16 hücreli evre embriyolar için, döllenme sonrası embriyonik gün 3 (E3) kültürü.
2. İlaç ve görüntüleme kabı hazırlama
NOT: Adım 2.1-2.10'da, istenmeyen PST-1P etkinleştirmesini önlemek için yalnızca karanlık veya kırmızı ışık koşullarında çalışın. PST içeren tüm tüpler ve bulaşıklar için alüminyum folyo veya koyu renkli kapaklar kullanılmalıdır.
- Ultra saf suda 50 mM PST-1P'lik bir stok konsantrasyonu hazırlayın.
NOT: PST-1P'nin moleküler ağırlığı 440 g/mol'dür. Stok çözeltisi 1 yıla kadar -20 ° C'de kararlıdır. PST-1P, suda veya sulu tamponda çözünür, ancak DMSO'da kolayca çözünmez. - Adım 2.1'den itibaren, ultra saf suda 800 μM PST-1P'lik bir ara çalışma konsantrasyonu hazırlayın.
- PST-1P'yi taze KSOM'da 40 μM'lik son konsantrasyona kadar seyreltin. Tipik bir deney yaklaşık 20 μL PST-1P ile muamele edilmiş KSOM gerektirdiğinden, görünürlük için sadece kırmızı ışık kullanarak, yeterli ortamın önceden hazırlanmasını sağlamak için 20 μL'lik bir son hacim için 19 μL KSOM'da 800 μM PST-1P'nin 1 μL'sini seyreltin.
NOT: Bir PST-1P seyreltmesinin hem konsantrasyonu hem de aktivasyon durumu, tahlil kurulumu sırasında yapılması gereken bir spektrofotometre kullanılarak bir UV-Vis absorbans spektrumu alınarak kontrol edilebilir. 1 cm'lik bir küvette tamamen trans 40 μM seyreltmenin 380 nm'deki (A380) emilimi yaklaşık 0,8 olmalıdır. Hem cis hem de transformlar 455 nm'de (A455) aynı absorbansa sahiptir. A380'in A455'e oranı yaklaşık 9: 1 olduğunda, seyreltme etkin değildir (tamamen trans). A380: A455 oranı 1: 2 olduğunda, seyreltme tamamen etkinleştirilir (tamamen cis). Ara oranlar, ara aktivasyon durumlarını yansıtır. - Oda slaytını canlı görüntülemeye hazırlamak için, yarım küre şeklinde bir damlacık oluşturmak üzere bir kuyucuğun ortasına 10 μL PST-1P ile muamele edilmiş KSOM pipetinde (Şekil 1A).
- Damlacığı örtmek için nazikçe yeterli miktarda mineral yağ ekleyin ve ortamın dağılmamasını sağlayın. Bu, damlacığın buharlaşmamasını sağlayacaktır.
- Ön ısıtma ve CO 2-bir inkübatörde hazne sürgü kabını 37 ° C'de ve% 5 CO2'yi en az 3 saat veya en fazla bir gecede dengeler.
- Adım 2.6'daki denge periyodunun sonunda, yıkama adımı olarak 10 μL PST-1P ile muamele edilmiş, önceden ısıtılmış ve dengelenmiş KSOM damlacığı ile 35 mm'lik bir kültür kabı hazırlayın. Yağ ile kaplamayın.
- Embriyoları ağız pipetleme yoluyla adım 2.7'den itibaren PST-1P ile muamele edilmiş KSOM damlacığına aktarın.
NOT: Adım 2.7 ve 2.8, embriyoların ağızdan pipetlenmesi için önerilir, ancak isteğe bağlıdır. - Embriyoları, 2.4-2.6 adımlarında hazırlanan görüntüleme odası slaytındaki PST-1P ile muamele edilmiş KSOM damlacığının merkezine ağız pipetleme yoluyla derhal aktarın (Şekil 1A).
- Embriyoları 37 °C'de ve PST-1P ile tedavi edilen KSOM'da% 5 CO2'de inkübe edin, görüntülemeden önce en az 1 saat boyunca görüntüleme odasında kaydırın. Mümkünse, tüm PST-1P'lerin inaktif trans-konfigürasyonda olduğundan ve embriyoların çanağın dibine batabileceğinden emin olmak için oda kızağını mikroskop üzerinde 37 ° C'de ve% 5 CO2'de ve tamamen karanlıkta bir çevre odasına monte edin.
3. Canlı görüntüleme ve PST-1P fotoaktivasyonu
NOT: Adım 3.1-3.13, çığ fotodiyot dedektörleri (APD'ler) ve karanlık bir çevre odası ile donatılmış bir lazer taramalı konfokal mikroskopta gerçekleştirilir. Bu talimatlar özellikle Malzeme Tablosunda açıklanan satın alma yazılımını kullanan görüntüleme kurulumuna atıfta bulunur; ancak diğer konfokal mikroskopi sistemlerine de uygulanabilirler.
- Öngörülen daldırma ortamı ile 63x/1.2 NA su yağı daldırma hedefi hazırlayın.
- Konumlandırmayı yönlendirmek için kırmızı ışıklı bir meşale kullanarak, daldırma ortamına temas etmek için hedefi ilerletin. Bu aşamada, embriyoları bulmak için beyaz veya parlak alan ışığı kullanmaktan kaçının, çünkü bu PST-1P'yi erken aktive edebilir.
- Göz merceğini kullanarak ve kırmızı ışık aydınlatması altındayken, ortam damlacığının kenarını bulun ve hedefi doğrudan bu konumun üzerine yerleştirin. Bu, kullanıcının oryantasyon oluşturmasına ve odak düzlemini bulmasına yardımcı olabilir.
- Daha sonra, göz merceği veya yazılım etkin canlı mod taramasında, damlacık içindeki embriyoları bulmak için kırmızı dalga boyu filtresi veya 561 nm lazer kullanın.
- Tüm embriyonun bir z-yığınını elde etmek için başlangıç ve bitiş noktalarını ayarlamak üzere aşama denetleyicilerini ve canlı tarama modunu kullanın.
- EB3-dDomates kuyruklu yıldızlarının görünümünü optimize etmek ve arka plan gürültüsünü en aza indirmek için lazer güç ayarlarını yapın (tipik olarak, APD'ler gibi son derece hassas dedektörlerle,% 5'ten daha az bir 561 nm lazer gücü yeterlidir), dijital ofset (tipik olarak -0,900'de), 2 μm'de iğne deliği, 512 x 512 piksel çözünürlüğü ve 3,15 μs piksel bekleme süresi.
- Tüm organizmadaki mikrotübül büyüme alanlarını değerlendirmek için 1 μm kesit aralıklarına sahip tüm embriyonun bir z-yığınını elde edin (Şekil 1B).
- EB3-dDomates izleme denemeleri için ilgi çekici bölgeleri (YG) belirlemek üzere adım 3.7'deki 3B z-stack görüntüsünü kullanın. Yakınlaştırmayı 3 kata çıkarın ve belirli hücre altı ilgi alanının etrafına dikdörtgen bir yatırım getirisi çizin.
- Görüntüleme parametrelerinin tipik değerlerini kullanarak tek bir z-düzleminin hızlandırılmış filmini elde edin: %5'te 561 nm lazer gücü, -0,900 dijital ofset, 512 x 512 piksel çözünürlüğü, 3 μm'de iğne deliği, 3,15 μs piksel bekleme süresi, 3x yakınlaştırma, 500 ms zaman aralığı.
NOT: 120 zaman dilimi, 1 dakikalık bir izleme filmi sağlayacaktır ve veri analizi için yeterli olmalıdır. Floroforun ağartılmasının minimum olması koşuluyla edinim daha uzun süre devam edebilir (Şekil 1C). - PST-1P'yi etkinleştirmek için 405 nm lazere geçin ve 405 nm lazer %10 güce ayarlanmış, 512 x 512 piksel çözünürlüğü, iğne deliği maksimum açılma, 3,15 μs piksel bekleme süresi, 3x yakınlaştırma, 500 ms zaman aralığı ve toplam 20 kare ile başka bir hızlandırılmış film elde edin (Şekil 1D).
- 561 nm lazere geri dönün ve PST-1P'nin aktivasyonundan sonra EB3-dDomates kuyruklu yıldızlarının kaybını doğrulamak için adım 3.9'daki gibi alımı tekrarlayın (Şekil 1E). Bu satın alma işleminin etkinleştirmeyi takiben mümkün olan en kısa sürede gerçekleştiğinden emin olun.
NOT: Adım 3.10, EB3-dDomates kuyruklu yıldızlarının daha uzun süre inhibisyonu için tekrar tekrar gerçekleştirilebilir. Bununla birlikte, UV ışığının neden olduğu herhangi bir zararı önlemek için embriyolar dikkatle izlenmelidir. - PST-1P'yi etkin olmayan trans durumuna geri döndürmek için,% 10 güçte 514 nm lazer kullanın. %10 güce ayarlanmış 514 nm lazer, 512 x 512 piksel çözünürlüğü, maksimum açılmış iğne deliği, 3,15 μs piksel bekleme süresi, 3x yakınlaştırma, 500 ms zaman aralığı ve toplam 20 zaman dilimi ile hızlandırılmış bir film elde edin (Şekil 1F).
- EB3-dDomates kuyruklu yıldızlarının geri kazanılmasını görselleştirmek için adım 3.11'i tekrarlayın (Şekil 1G).
4. Görüntü veri analizi
- PST'ler tarafından mikrotübül polimerizasyonunun inhibisyonunu analiz etmek ve ölçmek için, araştırmacıların özel ihtiyaçlarına uyacak şekilde kullanabilecekleri yazılım programlarını kullanın. Kullanılması önerilenler, EB3-dDomates kuyruklu yıldızlarının hareketini, yönünü ve hızını manuel veya otomatik olarak izleyebilen bir izleme aracına sahip olacak16,18.
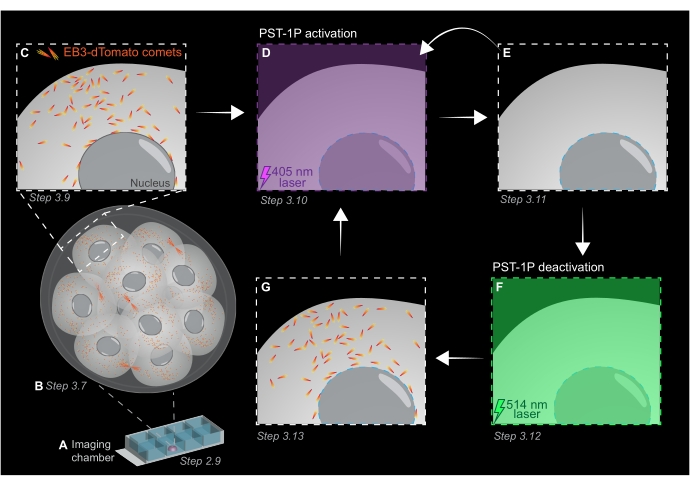
Şekil 1: Canlı 3D preimplantasyon fare embriyosunda PST-1P fotoaktivasyon ve deaktivasyonun şematik gösterimi. Tüm deneyler tamamen karanlıkta (siyah arka plan) veya sadece kırmızı ışık aydınlatmasıyla gerçekleştirilir. (A) EB3-dDomates eksprese eden canlı preimplantasyon fare embriyoları 16 hücreli aşamaya kültürlenir ve daha sonra bir görüntüleme odası slaytında 40 μM PST-1P içeren bir KSOM damlacığına aktarılır. (B) Tüm embriyonun 3D görüntüsü, EB3-dDomates kuyruklu yıldızlarının dağılımını görselleştirerek mikrotübül büyümesinin değerlendirilmesine izin verir. (C) Deneyi başlatmak için, EB3-dDomates kuyruklu yıldızları, hızlandırılmış görüntüleme kullanılarak hücre altı bir bölgede izlenir. (D) 405 nm lazer kullanılarak aynı hücre altı bölgede müteakip PST-1P fotoaktivasyonu, EB3-dDomates kuyruklu yıldızlarının (E) kaybına neden olur. Yoğunlaştırılmış PST-1P aktivasyonu, gerekirse, sıralı 405 nm ışık aydınlatması ile uygulanabilir. (F-G) PST-1P'yi etkin olmayan durumuna geri döndürmek ve EB3-dDomates kuyruklu yıldızlarını geri yüklemek için, aynı hücre altı bölgeye 514 nm lazer uygulanır. Gerekirse, birden fazla fotoaktivasyon ve devre dışı bırakma turu gerçekleştirilebilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Protokol doğrultusunda, preimplantasyon fare embriyolarına, kırmızı floresan dDomates (EB3-dDomates) ile etiketlenmiş EB3 için cRNA ile mikroenjekte edildi. Bu, EB3 polimerize edici mikrotübüle bağlandığı için büyüyen mikrotübüllerin görselleştirilmesini sağlar artı24 uçları.
Deneyler, fare embriyosu 16 hücreden oluştuğunda döllenmeden 3 gün sonra (E3) gerçekleştirildi. Araştırılacak bilimsel soruya bağlı olarak başka herhangi bir pr...
Tartışmalar
Mikrotübül ağı, bir hücrenin temel iç işleyişinin ayrılmaz bir parçasıdır. Sonuç olarak, bu, canlı organizmalarda mikrotübül dinamiklerini manipüle etmede zorluklar ortaya koymaktadır, çünkü ağdaki herhangi bir bozulma, hücresel fonksiyonun tüm yönleri için yaygın sonuçlara sahip olma eğilimindedir. Foto-değiştirilebilir mikrotübül hedefleme bileşiklerinin ortaya çıkışı, mikrotübül büyüme inhibisyonu9'un indüksiyonu ve tersine çevrilmesi için üstün k...
Açıklamalar
Yazarlar rakip veya finansal çıkar beyan etmezler.
Teşekkürler
Yazarlar, Dr. Oliver Thorn-Seshold ve Li Gao'ya bize fotostatinler ve el yazması hazırlama konusunda tavsiyelerde bulundukları için, film çekme desteği için Monash Production'a ve mikroskopi desteği için Monash Micro Imaging'e teşekkür etmek istiyorlar.
Bu çalışma, J.Z.'ye Ulusal Sağlık ve Tıbbi Araştırma Konseyi (NHMRC) proje hibesi APP2002507 ve J.Z.'ye Kanada İleri Araştırma Enstitüsü (CIFAR) Azrieli Bursu ile desteklenmiştir. Avustralya Rejeneratif Tıp Enstitüsü, Victoria Eyalet Hükümeti ve Avustralya Hükümeti'nden gelen hibelerle desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Aspirator tube | Sigma-Aldrich | A5177 | For mouth aspiration apparatus |
| Chamber slides - LabTek | Thermo Fisher Scientific | NUN155411 | |
| cRNA encoding for EB3-dTomato | N/A | N/A | Prepared according to manufacturers instructions using mMessage in vitro Transcription kit |
| Culture dishes - 35mm | Thermo Fisher Scientific | 150560 | |
| Human chorionic growth hormone | Sigma-Aldrich | C8554 | |
| Human Tubal Fluid (HTF) medium | Cosmo-Bio | CSR-R-B071 | |
| Imaris Image Analysis Software | Bitplane | ||
| Immersion Oil W 2010 | Carl Zeiss | 444969-0000-000 | For use with microscope immersion objective |
| LED torch - Red light | Celestron | 93588 | |
| M2 medium | Sigma-Aldrich | M7167 | |
| Mice - wild-type FVB/N, males and females | N/A | N/A | Females 8-9 weeks old. Males 2-6 months old. |
| Microcapillary Pipettes - Kimble | Sigma-Aldrich | Z543306 | For mouth aspiration apparatus |
| Microinjection buffer | N/A | N/A | 5 mM Tris, 5 mM NaCl, 0.1 mM EDTA, pH 7.4 |
| Mineral oil | Origio | ART-4008-5P | |
| mMessage In vitro Transcription kit | Thermo Fisher Scientific | AM1340 | |
| NanoDrop Spectrophotometer | Thermo Fisher Scientific | ||
| Potassium Simplex Optimised Medium (KSOM) medium | Cosmo-Bio | CSR-R-B074 | |
| Pregnant mare serum gonadotrophin | Prospec Bio | HOR-272 | |
| PST-1P | N/A | N/A | Borowiak, M. et al., Photoswitchable Inhibitors of Microtubule Dynamics Optically Control Mitosis and Cell Death. Cell. 162 (2), 403-411, doi:10.1016/j.cell.2015.06.049, (2015). |
| RNA purification kit | Sangon | B511361-0100 | |
| Ultrapure water | Sigma-Aldrich | W1503 | |
| ZEN Black Software | Carl Zeiss |
Referanslar
- Hawdon, A., Aberkane, A., Zenker, J. Microtubule-dependent subcellular organisation of pluripotent cells. Development. 148 (20), (2021).
- Sanchez, A. D., Feldman, J. L. Microtubule-organizing centers: from the centrosome to non-centrosomal sites. Current Opinion in Cell Biology. 44, 93-101 (2017).
- Galli, M., Morgan, D. O. Cell size determines the strength of the spindle assembly checkpoint during embryonic development. Developmental Cell. 36 (3), 344-352 (2016).
- Vazquez-Diez, C., Paim, L. M. G., FitzHarris, G. Cell-size-independent spindle checkpoint failure underlies chromosome segregation error in mouse embryos. Current Biology. 29 (5), 865-873 (2019).
- Baudoin, J. P., Alvarez, C., Gaspar, P., Metin, C. Nocodazole-induced changes in microtubule dynamics impair the morphology and directionality of migrating medial ganglionic eminence cells. Developmental Neuroscience. 30 (1-3), 132-143 (2008).
- Munz, F., et al. Human mesenchymal stem cells lose their functional properties after paclitaxel treatment. Scientific Reports. 8 (1), 312 (2018).
- Jordan, M. A., Wilson, L. Microtubules as a target for anticancer drugs. Nature Reviews Cancer. 4 (4), 253-265 (2004).
- Vasquez, R. J., Howell, B., Yvon, A. M., Wadsworth, P., Cassimeris, L. Nanomolar concentrations of nocodazole alter microtubule dynamic instability in vivo and in vitro. Molecular Biology of the Cell. 8 (6), 973-985 (1997).
- Borowiak, M., et al. Photoswitchable inhibitors of microtubule dynamics optically control mitosis and cell death. Cell. 162 (2), 403-411 (2015).
- Gaspari, R., Prota, A. E., Bargsten, K., Cavalli, A., Steinmetz, M. O. Structural basis of cis- and trans-Combretastatin binding to tubulin. Chem. 2 (1), 102-113 (2017).
- Thorn-Seshold, O., Meiring, J. Photocontrolling microtubule dynamics with photoswitchable chemical reagents. ChemRxiv. , (2021).
- Kopf, A., et al. Microtubules control cellular shape and coherence in amoeboid migrating cells. Journal of Cell Biology. 219 (6), 201907154 (2020).
- Sawada, M., et al. PlexinD1 signaling controls morphological changes and migration termination in newborn neurons. The EMBO Journal. 37 (4), 97404 (2018).
- Singh, A., et al. Polarized microtubule dynamics directs cell mechanics and coordinates forces during epithelial morphogenesis. Nature Cell Biology. 20 (10), 1126-1133 (2018).
- Kepiro, M., et al. Azidoblebbistatin, a photoreactive myosin inhibitor. Proceedings of the National Academy of Sciences of the United States of America. 109 (24), 9402-9407 (2012).
- Zenker, J., et al. A microtubule-organizing center directing intracellular transport in the early mouse embryo. Science. 357 (6354), 925-928 (2017).
- White, M. D., Zenker, J., Bissiere, S., Plachta, N. Instructions for assembling the early mammalian embryo. Developmental Cell. 45 (6), 667-679 (2018).
- Zenker, J., et al. Expanding actin rings zipper the mouse embryo for blastocyst formation. Cell. 173 (3), 776-791 (2018).
- Theisen, U., et al. Microtubules and motor proteins support zebrafish neuronal migration by directing cargo. Journal of Cell Biology. 219 (10), 201908040 (2020).
- Rulicke, T. Pronuclear microinjection of mouse zygotes. Methods in Molecular Biology. 254, 165-194 (2004).
- Greaney, J., Subramanian, G. N., Ye, Y., Homer, H. Isolation and in vitro culture of mouse oocytes. Bio-protocol. 11 (15), 4104 (2021).
- Subramanian, G. N., et al. Oocytes mount a noncanonical DNA damage response involving APC-Cdh1-mediated proteolysis. Journal of Cell Biology. 219 (4), 201907213 (2020).
- Mihajlovic, A. I., Bruce, A. W. The first cell-fate decision of mouse preimplantation embryo development: integrating cell position and polarity. Open Biology. 7 (11), 170210 (2017).
- Roostalu, J., et al. The speed of GTP hydrolysis determines GTP cap size and controls microtubule stability. Elife. 9, 51992 (2020).
- Gao, L., et al. In vivo photocontrol of microtubule dynamics and integrity, migration and mitosis, by the potent GFP-imaging-compatible photoswitchable reagents SBTubA4P and SBTub2M. BioRxiv. bioRxiv. , (2021).
- Tichy, A. M., Gerrard, E. J., Legrand, J. M. D., Hobbs, R. M., Janovjak, H. Engineering strategy and vector library for the rapid generation of modular light-controlled protein-protein interactions. Journal of Molecular Biology. 431 (17), 3046-3055 (2019).
- van Haren, J., Adachi, L. S., Wittmann, T. Optogenetic control of microtubule dynamics. Methods in Molecular Biology. 2101, 211-234 (2020).
- Adikes, R. C., Hallett, R. A., Saway, B. F., Kuhlman, B., Slep, K. C. Control of microtubule dynamics using an optogenetic microtubule plus end-F-actin cross-linker. Journal of Cell Biology. 217 (2), 779-793 (2018).
- Kogler, A. C., et al. Extremely rapid and reversible optogenetic perturbation of nuclear proteins in living embryos. Developmental Cell. 56 (16), 2348-2363 (2021).
- Maghelli, N., Tolic-Norrelykke, I. M. Laser ablation of the microtubule cytoskeleton: setting up and working with an ablation system. Methods in Molecular Biology. 777, 261-271 (2011).
- Bukhari, S. N. A., Kumar, G. B., Revankar, H. M., Qin, H. L. Development of combretastatins as potent tubulin polymerization inhibitors. Bioorganic Chemistry. 72, 130-147 (2017).
- Gilazieva, Z., Ponomarev, A., Rutland, C., Rizvanov, A., Solovyeva, V. Promising applications of tumor spheroids and organoids for personalized medicine. Cancers (Basel). 12 (10), 2727 (2020).
- Scherer, K. M., et al. Three-dimensional imaging and uptake of the anticancer drug combretastatin in cell spheroids and photoisomerization in gels with multiphoton excitation. Journal of Biomedical Optics. 20 (7), 78003 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır