Method Article
مراقبة حركية تجميع البروتين في الجسم الحي باستخدام عد التضمين الآلي في Caenorhabditis elegans
* These authors contributed equally
In This Article
Summary
هنا ، يتم تقديم طريقة لتحليل حركية تجميع البروتين في الديدان الخيطية Caenorhabditis elegans. يتم تصوير الحيوانات من مجموعة سكانية متزامنة مع العمر في نقاط زمنية مختلفة ، تليها عد التضمين شبه الآلي في CellProfiler وتناسبها مع نموذج رياضي في AmyloFit.
Abstract
يعد تجميع البروتين في شوائب غير قابلة للذوبان سمة مميزة لمجموعة متنوعة من الأمراض البشرية ، وكثير منها مرتبط بالعمر. الديدان الخيطية Caenorhabditis elegans هي كائن حي نموذجي راسخ تم استخدامه على نطاق واسع في هذا المجال لدراسة تجميع البروتين والسمية. تتيح شفافيتها البصرية التصور المباشر لتجميع البروتين بواسطة المجهر الفلوري. علاوة على ذلك ، فإن الدورة التناسلية السريعة والعمر القصير يجعلان من الديدان الخيطية نموذجا مناسبا لفحص الجينات والجزيئات التي تعدل هذه العملية.
ومع ذلك ، فإن القياس الكمي للحمل الكلي في الحيوانات الحية غير موحد بشكل جيد ، وعادة ما يتم إجراؤه عن طريق العد اليدوي للإدراج تحت مجهر تشريح التألق في نقطة زمنية واحدة. ويمكن أن يؤدي هذا النهج إلى تباين كبير بين المراقبين ويحد من فهم عملية التجميع. في المقابل ، يتم مراقبة تراكم البروتين الشبيه بالأميلويد في المختبر بشكل روتيني بواسطة فلورة ثيوفلافين T بطريقة كمية للغاية ويتم حلها بمرور الوقت.
هنا ، يتم تقديم طريقة مماثلة للتحليل غير المتحيز لحركية التجميع في C. elegans الحية ، باستخدام مجهر بؤري عالي الإنتاجية جنبا إلى جنب مع تحليل الصور حسب الطلب وتركيب البيانات. يتم إثبات قابلية تطبيق هذه الطريقة من خلال مراقبة تكوين تضمين بروتين البولي جلوتامين (polyQ) المسمى بالفلورسنت في خلايا عضلات جدار الجسم. يسمح سير عمل تحليل الصور بتحديد أعداد الشوائب في نقاط زمنية مختلفة ، والتي يتم تركيبها على نموذج رياضي يعتمد على أحداث النوى المستقلة في خلايا العضلات الفردية. قد تكون الطريقة الموصوفة هنا مفيدة لتقييم آثار عوامل البروتينات والعلاجات المحتملة لأمراض تجميع البروتين في حي بطريقة قوية وكميتة.
Introduction
يحدث تراكم البروتينات غير المطوية في رواسب غير قابلة للذوبان في مجموعة واسعة من الأمراض. ومن الأمثلة المعروفة على ذلك تجميع β أميلويد وتاو في مرض الزهايمر ، α-سينوكلين في مرض باركنسون ، وهنتنغتين مع polyQ الموسع في مرض هنتنغتون 1,2. يرتبط سوء طي هذه الببتيدات المتعددة إلى ألياف أميلويد بالسمية وموت الخلايا بواسطة آليات لا تزال غير واضحة إلى حد كبير. سيكون توضيح آليات تكوين الأميلويد أمرا بالغ الأهمية لتطوير علاجات فعالة ، غير متوفرة حاليا.
تم إجراء تحقيقات مفصلة لتشكيل الأميلويد في المختبر بناء على قياسات التألق ثيوفلافين T ، مما أدى إلى فهم ميكانيكي لعملية التجميع وتأثير الجزيئات المثبطة3،4،5. ومع ذلك ، ليس من الواضح ما إذا كانت آليات التجميع نفسها صحيحة في البيئة المعقدة للخلايا الحية والكائنات الحية. الدودة الخيطية Caenorhabditis elegans هي كائن حي نموذجي مناسب لدراسة تراكم البروتين في الجسم الحي. لديها تشريح بسيط نسبيا ولكنها تتكون من أنسجة متعددة ، بما في ذلك العضلات والأمعاء والجهاز العصبي. وهي تتميز بشكل جيد وراثيا ، وأدوات التعديل الوراثي متاحة بسهولة. علاوة على ذلك ، لديها وقت جيل قصير من ~ 3 أيام وعمر إجمالي من 2-3 أسابيع. على هذا النحو ، يمكن فحص تجميع البروتين عبر عمر الحيوان على نطاق زمني مناسب تجريبيا. وأخيرا، فإن الديدان الخيطية شفافة بصريا، مما يتيح تتبع تجميع البروتينات ذات العلامات الفلورية في الحيوانات الحية.
تم استغلال هذه الميزات من C. elegans سابقا للتحقيق في تجميع بروتينات polyQ كنموذج لأمراض توسع Huntington وغيرها من أمراض توسع polyQ. فوق العتبة المسببة للأمراض من 35-40 بقايا الجلوتامين ، يمكن ملاحظة بروتينات polyQ الموسومة بالبروتين الفلوري الأصفر (YFP) لتشكيل شوائب غير قابلة للذوبان في الأنسجة العضلية6,7 ، الخلايا العصبية8 ، والأمعاء 9,10. وقد استخدمت هذه الميزات على نطاق واسع لفحص الجينات 11،12،13 ومعدلات الجزيئات الصغيرة 14 من تجميع البروتين والسمية.
C. elegans لديه القدرة على لعب دور مهم في سد الفجوة بين الدراسات المختبرية لتجميع البروتين ونماذج الأمراض الأكثر تعقيدا مثل الفئران15. C. elegans قابل لفحص المخدرات16 ولكن يمكن أيضا استغلاله للحصول على فهم أساسي للآليات الجزيئية لتراكم البروتين في الجسم الحي ، كما هو موضح مؤخرا17. ومع ذلك ، بالنسبة لكلا التطبيقين ، من الأهمية بمكان استخراج مقياس كمي وقابل للتكرار لتجميع البروتين. هنا ، يتم تحقيق ذلك باستخدام مجهر بؤري بؤري عالي الإنتاجية جنبا إلى جنب مع خط أنابيب مخصص لتحليل الصور (الشكل 1).
Protocol
1. نمو السكان المتزامنين مع العمر من C. elegans
- الحفاظ على سلالات C. elegans على ألواح وسط نمو الديدان الخيطية (NGM) المبذرة بالإشريكية القولونية OP50 عند 20 درجة مئوية وفقا للإجراءات القياسية18.
- قم بإجراء وضع بيض متزامن عن طريق وضع 10 ديدان خيطية للبالغين على صفيحة NGM ببذور 6 سم مع اختيار دودة بلاتينية. اترك البالغين لوضع البيض لمدة ~ 2 ساعة عند 20 درجة مئوية قبل إزالتها. قم بإعداد 1-4 لوحات لكل سلالة ، اعتمادا على خصوبة السلالة وعدد النقاط الزمنية التي يجب اتخاذها.
- ضع الألواح مع البيض في الحاضنة عند 20 درجة مئوية. راقب تطور الحيوانات حتى تصل إلى مرحلة البلوغ.
ملاحظة: يتم تعريف اليوم الذي وصلت فيه الحيوانات إلى مرحلة البلوغ هنا على أنه اليوم 1. عادة ، هذا بعد ثلاثة أيام من وضع البيض. - بدءا من اليوم 1 ، انقل الحيوانات إلى ألواح NGM جديدة يوميا لفصلها عن ذريتها. للتعويض عن الحيوانات التي تموت أو تضيع أثناء النقل ، انقل ~ 40 حيوانا لكل سلالة أضعاف عدد النقاط المراد تصويرها (انظر الخطوة 2). استمر حتى تتوقف الحيوانات عن وضع البيض المخصب (~ اليوم 6 من مرحلة البلوغ).
ملاحظة: استبعد الحيوانات ذات التعبئة أو الأنماط الظاهرية التنموية الأخرى. عادة ما يلاحظ التعبئة في السلالات التي تعبر عن البروتينات المعرضة للتجميع.
2. إعداد عينة من C. elegans في لوحة متعددة الآبار
ملاحظة: نظرا لأن إجراء التصوير يتطلب تخديرا من شأنه أن يقتل الحيوانات في نهاية المطاف، فلا يمكن إعادة استخدام نفس الحيوانات في نقاط زمنية لاحقة. بدلا من ذلك ، يتم تصوير مختلفة من نفس الدفعة المتزامنة مع العمر في أيام مختلفة. على الرغم من أن معظم السلالات سيكون لها عدد قليل من التضمينات في اليوم 1 ، فمن المستحسن تضمين هذه النقطة الزمنية كخط أساس.
- قم بإعداد لوحة 384 بئرا عن طريق ملء العدد المطلوب من الآبار ب 100 ميكرولتر من المخزن المؤقت M9 مع استكمال 25 mM NaN3 كمخدر. املأ بئرا واحدا لكل سلالة ليتم تصويرها.
ملاحظة: أزيد الصوديوم (NaN3) سام ويجب التعامل معه بعناية. - لكل سلالة ، انقل 20 حيوانا إلى بئر واحد باستخدام اختيار دودة البلاتين.
ملاحظة: يجب وضع الديدان خارج العشب البكتيري قبل وضعها في البئر. تجعل البكتيريا الحيوانات تلتصق باختيار الدودة ، والتي يمكن أن تمنع إطلاقها وسوف تغيم على محتويات البئر. بشكل عام ، 20 هو العدد الأمثل للحيوانات لكل بئر لمنع التداخل بين الديدان مع الحد من التصوير غير الضروري لمساحة البئر الفارغة. - قم بتغطية اللوحة بالغطاء لمنع التبخر ، وقم بتصوير اللوحة في غضون 1 ساعة بعد التحضير.
- كرر الخطوات 2.1-2.3 يوميا حتى يتم الوصول إلى هضبة ثابتة في أرقام التضمين أو حتى تموت معظم الحيوانات. قم بإجراء إعداد العينة والتصوير في نفس الوقت كل يوم لضمان فترات 24 ساعة.
3. الحصول على صورة على المجهر البؤري عالي الإنتاجية
ملاحظة: يمكن أيضا إعداد هذه التجربة على مجهر بؤري منتظم للقرص الدوار مع حامل لوحة متعدد الآبار. تعد الكاميرا ذات مجال الرؤية الكبير مفيدة للحد من عدد البلاط المطلوب تصويره ليمتد على البئر بأكمله. راجع جدول المواد للحصول على تفاصيل حول المجهر والبرامج المستخدمة في هذا البروتوكول.
- قم بتشغيل الأداة وافتح البرنامج.
- بدء تشغيل بروتوكول جديد بالانتقال إلى إعدادات القياس | جديد. حدد نوع اللوحة الصحيحة متعددة الآبار وانقر فوق إنشاء إعداد قياس جديد.
- قم بإعداد القناة للتألق بالانتقال إلى الفصل 1. حدد الهدف إلى 10x. حدد 488 نانومتر كمصدر للضوء وBP525/25 كمرشح للانبعاثات لصورة YFP. اضبط الربط على 2x2 لتقليل حجم الملف.
- انقر فوق إضافة قناة وحدد Brightfield كطريقة.
- لإضافة صورة تألق متحد البؤرة z-stack إلى القياس، اختر اكتساب التألق 3D ضمن قائمة الإجراءات. انتقل إلى تحديد واختر Ch 1. لتقليل أحجام الملفات، اضبط معالجة الصور على الحد الأقصى بحيث يتم حفظ الحد الأقصى لصورة الإسقاط بدلا من المكدس z الكامل.
- انقر فوق BF / درجة الحموضة | اختر | الفصل 2 لقناة برايتفيلد.
- انقر على زر التشغيل (ابحث عن رمز المثلث ذي الإشارة اليمنى) بجوار تفريغ لوحات الآبار ووضع لوحة 384 بئرا في المجهر.
- ضمن اكتساب التألق 3D ، انقر فوق اختبار وحدد بئرا يحتوي على الديدان لتحديد مسافة التحول المثلى التي تتمركز فيها الديدان بشكل صحيح. اضبط المسافة التصاعدية على 50 ميكرومتر ، والمسافة التنازلية على -50 ميكرومتر ، والفاصل الزمني للتقطيع على 2 ميكرومتر لالتقاط سمك الحيوانات بالكامل في المكدس z.
- قم بتحسين وقت التعرض للحصول على كثافة إشارة جيدة لجميع السلالات الأربع مع تجنب التشبع. استخدم نفس وقت التعرض لجميع السلالات والنقاط الزمنية.
- حدد الآبار المراد تصويرها ضمن إعداد مسح لوحة البئر. حدد البلاط واحصل على البئر بالكامل.
- احفظ إعداد القياس وابدأ التجربة بالنقر فوق بدء القياس. بالنسبة للنقاط الزمنية اللاحقة، افتح نفس إعداد القياس واضبط مسافة التحول والآبار المراد تصويرها.
4. خياطة الصور المبلطة في ImageJ
ملاحظة: هذه الخطوة مطلوبة فقط عند استخدام هدف أكبر من 4x ، حيث يتم الحصول على صورة كل بئر كمربعات متعددة. في سير عمل التحليل هذا ، يتم إجراء خياطة البلاط باستخدام البرنامج المجاني FIJI / ImageJ19 (الشكل 2). اعتمادا على الأداة المستخدمة في الخطوة 3 ، قد يكون من الممكن أيضا إجراء خياطة مباشرة في البرنامج المصاحب.
- قم بتنزيل FIJI20 وافتحه.
- انتقل إلى المكونات الإضافية | خياطة | الشبكة / مجموعة خياطة21.
- في النافذة المنبثقة، خياطة الشبكة/المجموعة، حدد النوع والترتيب اللذين تم من خلالهما تجميع اللوحات. اختر الشبكة: صف تلو الآخر واليمين وأسفل.
- في النافذة التالية، خياطة الشبكة: الشبكة: صف تلو الآخر، يمين وأسفل، أدخل عدد المربعات في الاتجاهين x وy. بالنسبة لهدف 10x المستخدم هنا، اختر 2 كحجم الشبكة x و3 كحجم الشبكة y و0 كتداخل البلاط.
- انقر فوق استعراض وحدد المجلد الذي يحتوي على صور TIFF المراد خياطتها.
- أدخل اسم الملف الشائع ضمن أسماء الملفات للتجانبات، باستخدام {i} في موضع رقم التجانب في كل اسم ملف.
- ألغ تحديد جميع المربعات أدناه.
- قم بتشغيل المكون الإضافي.
- احفظ الصور الناتجة كملفات TIFF لتحليلها في الخطوة التالية.
5. العد الآلي للتضمين باستخدام CellProfiler22
- قم بتنزيل وتثبيت برنامج تحليل الصور مفتوح المصدر ، CellProfiler23. قم بتنزيل خط أنابيب InclusionCounting.cpproj من github.com/sinnigelab/aggregate-quantification.
- افتح CellProfiler واسحب خط الأنابيب إلى النافذة إسقاط ملف خط أنابيب هنا. انقر فوق نعم لتحميل المشروع.
- انقر فوق وحدة إدخال الصور واسحب الصور المخيطة إلى النافذة إسقاط الملفات والمجلد هنا.
- انقر على وحدة إدخال البيانات الوصفية . اضبط التعبير العادي للاستخراج من اسم الملف وفقا لأسماء الصور المخيطة.
- انقر فوق وحدة إدخال NamesandTypes واضبط حدد معايير القاعدة لمطابقة القنوات في أسماء الملفات.
ملاحظة: في الإعدادات الافتراضية لخط الأنابيب، يتم التعرف على أسماء الملفات التي تحتوي على BF كصور ساطعة وتسمى Worms. يتم التعرف على أسماء الملفات التي تحتوي على YFP كصور فلورية وتسمى Fluorescence. - انقر فوق عرض إعدادات الإخراج لتحديد مجلد افتراضي لحفظ الإخراج من CellProfiler.
- انقر فوق بدء وضع الاختبار للتحقق من إعدادات خط الأنابيب باستخدام مجموعة بيانات التصوير الأولى. انقر فوق تشغيل لتشغيل جميع الوحدات النمطية في خط الأنابيب أو خطوة لتشغيل من خلال خط الأنابيب وحدة واحدة في كل مرة. لضبط الخطوط العريضة للدودة في وحدة EditObjectsManually ، انقر فوق تعليمات لرؤية الإرشادات وانقر فوق تم لمواصلة تشغيل خط الأنابيب.
ملاحظة: لن يتم تصدير القياسات المستخرجة أثناء وجودك في وضع الاختبار. قد تحتاج معلمات العتبة للكشف عن الديدان والشوائب إلى التعديل بناء على السلالات والتكبير المستخدمة. - انقر فوق الخروج من وضع الاختبار وتحليل الصور.
- افتح مجلد الإخراج لعرض ملفات الإخراج. افتح الصور التي تحتوي على اسم الملف الأصلي متبوعا بالخطوط العريضة للتحقق مما إذا كانت الديدان والتضمينات قد تم وضعها بشكل صحيح.
ملاحظة: يمكن العثور على عدد التضمينات لكل فيروس متنقل في الملف المسمى ExpandedWormObjects. يمكن العثور على مزيد من المعلومات حول صور الإدخال في الملف المسمى صورة. يمكن تحديد مخرجات إضافية في الوحدة النمطية ExportToSpreadsheet في خط الأنابيب.
6. الملاءمة العالمية لبيانات عدد التضمين باستخدام AmyloFit5
ملاحظة: لا يمكن تنفيذ هذه الخطوة إلا عند توفر بيانات عن تركيزات بروتين متعددة. بالنسبة ل Q40-YFP ، تم إنشاء مجموعة من أربع سلالات بمستويات مختلفة من التعبير المفرط في خلايا عضلات جدار الجسم سابقا17. وفي حالات أخرى، ينبغي توليد سلالات جديدة باستخدام الحقن المجهري البلازميدي والتكامل الجينومي24.
- انتقل إلى منصة التركيب المجانية عبر الإنترنت لحركية التجميع AmyloFit25. إما التسجيل أو تسجيل الدخول باستخدام حساب موجود.
ملاحظة: يمكن الوصول إلى دليل شامل حول كيفية استخدام AmyloFit للحصول على مساعدة إضافية. راجع الرابط الموجود أعلى يمين صفحة الويب (بعد تسجيل الدخول) لمزيد من المعلومات. - لبدء استخدام AmyloFit ، قم بتسمية المشروع وانقر فوق إنشاء مشروع. افتح المشروع بالنقر فوق فتح وإنشاء جلسة عن طريق إعطائها اسما والنقر فوق إنشاء وتحميل الجلسة.
- انقر على إضافة بيانات وقم بتحميل الملف الذي يحتوي على متوسط أعداد التضمينات لكل حيوان، باتباع متطلبات تنسيق البيانات الموضحة في اللوحة اليمنى. انقر فوق تحميل بيانات جديدة.
- تخطي خطوات المعالجة المسبقة، غير المطلوبة لبيانات عد التضمين، عن طريق تعيين عدد النقاط إلى المتوسط للإزاحة صفر نقطة وعدد النقاط إلى المتوسط فوق الهضبة إلى 0. انقر على إرسال. كرر هذه الخطوة لكل تركيز بروتين (أي كل عمود في الملف الذي تم تحميله).
- حدد مخصص في لوحة النموذج، وأدخل Ncells*(1-exp(-Kcell*m**(n)*(t-1))) في مربع المعادلة وانقر فوق تحميل النموذج.
ملاحظة: نظرا لأن AmyloFit تم تصميمه في الأصل لتحليل البيانات الحركية من الفحوصات المخبرية ، فيجب تحميل نموذج مخصص لتحليل بيانات عدد التضمين الخاصة ب C. elegans. في المعادلة المستخدمة هنا ، خلايا N هي عدد الخلايا التي يحدث فيها تكوين التضمين ، والخلية K هي ثابت معدل التنوي ، و m تركيز البروتين داخل الخلايا ، و n ترتيب تفاعل النوى. - قم بتعيين أنواع المعلمات إلى Global Const لخلايا N و Global fit للخلية K و n و Const ل m. اضبط قيمة خلايا N على 95 لخلايا عضلات جدار الجسم والتخمين الأولي للخلية K و n إلى 1. أدخل قيم m للسلالات المختلفة في اللوحة اليمنى.
ملاحظة: التخمينات الأولية ليست ذات صلة بالنموذج البسيط نسبيا المستخدم هنا. بالنسبة للنماذج الأكثر تعقيدا ، من المفيد إدخال تقدير للقيم المتوقعة لتقصير وقت الحساب. - اترك عدد قفزات الحوض دون تغيير وانقر فوق احتواء في لوحة التركيب.
- قم باستخراج الملاءمة بالنقر فوق تنزيل البيانات وملاءمة.
ملاحظة: سيتم سرد المعلمات المستخرجة بواسطة الملاءمة العامة للنموذج في الزاوية السفلية اليسرى. سيتم إنشاء مخطط للبيانات والملاءمة تلقائيا في اللوحة العلوية اليمنى. يمكن استخراج هذه المؤامرة بالنقر فوق تنزيل pdf وتخصيصها بالانتقال إلى عرض خيارات المؤامرة. تحتوي الخلية K على وحدات تركيز الجزيئات-n time-1 cell-1. لمقارنة القيم مع n مختلفة ، يمكن تحويل الخلية K إلى معدل التنوي عند تركيز بروتين معين عن طريق ضربه في mn.
النتائج
تم استخدام الطريقة الموضحة هنا (الشكل 1) لتحليل حركية التجميع لبنية تتكون من 40 جلوتامين منصهرة في YFP (Q40-YFP). يتم التعبير عن البروتين تحت سيطرة المروج unc-54 ، مما يدفع التعبير في خلايا العضلات جدار الجسم. نظرا لأن هذه الأهداف كبيرة نسبيا وسهلة التصور ، فإن استخدام هدف 10x يكفي لحل الشوائب التي تشكلها Q40-YFP في هذا الأنسجة. تم تطوير أربع سلالات (خطوط A-D) سابقا تعبر عن البروتين بدرجات مختلفة لتقييم اعتماد تركيز تراكم polyQ في الجسم الحي17.
تم إنشاء مجموعات متزامنة مع العمر من الخطوط A-D عن طريق وضع البيض لمدة 2 ساعة ، تليها عملية نقل يومية بمجرد وصول النسل إلى مرحلة البلوغ. من اليوم الأول إلى اليوم 10 من مرحلة البلوغ ، تم تصوير 20 حيوانا من كل سلالة من السلالات الأربع في صفيحة من 384 بئرا ، باستخدام مجهر بؤري عالي الإنتاجية. تم الحصول على صور الآبار على شكل 6 بلاطات ، والتي تم خياطتها معا باستخدام مكون إضافي في ImageJ21 (الشكل 2). تم تحليل الصور المخيطة لاحقا باستخدام خط أنابيب CellProfiler22 المصنوع خصيصا (الشكل 3) لتحديد متوسط عدد التضمين لكل لكل سلالة ونقطة زمنية.
ثم تم تركيب البيانات على نموذج رياضي في AmyloFit5 (الشكل 4). يعتمد النموذج على افتراض أن كل خلية من خلايا عضلات جدار الجسم البالغ عددها 95 خلية تكتسب بشكل مستقل إدراجا واحدا من خلال حدث نووية يحد من المعدل ، يليه نمو إجمالي سريع17. أسفرت الملاءمة عن معدل نوى ثابت قدره 9.9 × 105 جزيئات M-2.1 d-1 cell-1 وترتيب تفاعل قدره 2.1 ، يقابل معدل نواة 0.38 جزيء d-1 cell-1 عند تركيز بروتين داخل الخلايا يبلغ 1 mM. أدى اثنان من النسخ المتماثلة البيولوجية المستقلة إلى قيم متطابقة بشكل وثيق لمعدل التنوي وترتيب التفاعل ، والتي تتفق مع دراسة سابقة باستخدام بروتوكول مماثل17 (الجدول 1).
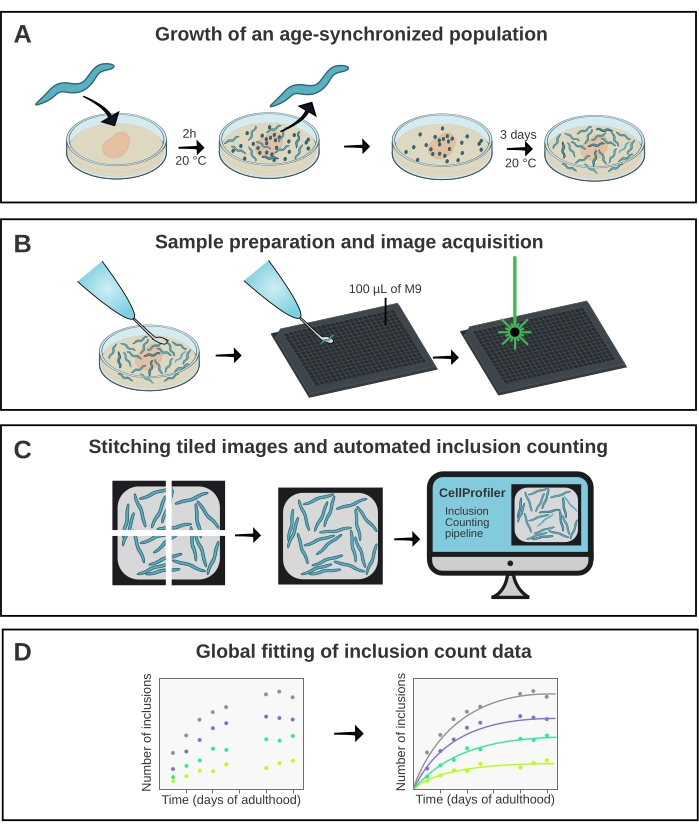
الشكل 1: نظرة عامة تخطيطية على الطريقة . (أ) يتم إنشاء مجموعات C. elegans المتزامنة مع العمر بواسطة وضع البيض في الوقت المحدد. (ب) يتم تصوير الحيوانات من نفس المجموعة في صفيحة من 384 بئرا في نقاط زمنية مختلفة. (ج) يتم خياطة البلاط معا لتشكيل صور للآبار بأكملها ، والتي يتم تحليلها في CellProfiler لتحديد أرقام التضمين لكل. (د) يتم تركيب البيانات على نموذج رياضي باستخدام AmyloFit. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
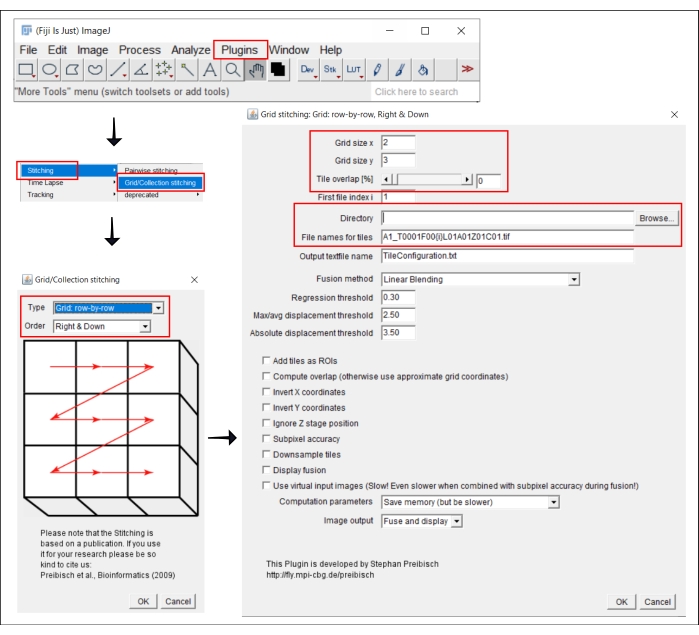
الشكل 2: لقطات شاشة لإجراء الخياطة في ImageJ باستخدام المكون الإضافي Grid / Collection خياطة21. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: مخطط خط أنابيب CellProfiler لقياس أعداد التضمينات. (A-C) تستخدم صورة الحقل الساطع (A) لتحديد الديدان (B ، عن قرب في C). (D-G) تستخدم صورة التألق (D ، عن قرب في E) لتحديد الشوائب (F). ترتبط الديدان والشوائب بتوفير عدد الشوائب لكل دودة في البئر (G). الصور المعروضة هي لحيوانات Q40 Line A في اليوم 3 من مرحلة البلوغ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
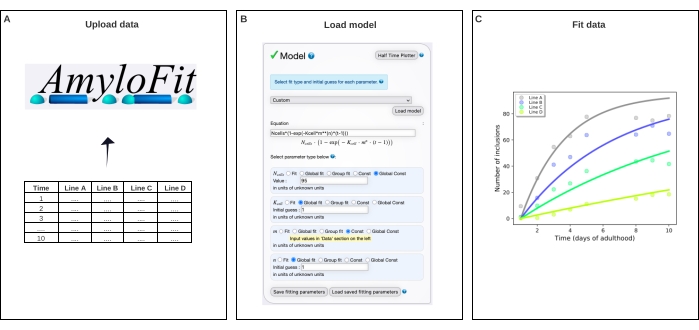
الشكل 4: تركيب البيانات مع نموذج رياضي في AmyloFit. (أ) يتم تحميل البيانات إلى AmyloFit. (ب) يتم إدخال معادلة مخصصة لتشكيل نموذج التضمين ، بافتراض أحداث نواة مستقلة في كل خلية. (ج) تركيب حركية التجميع لخطوط C. elegans A-D التي تعبر عن مستويات مختلفة من Q40-YFP. وتمثل البيانات نسختين متماثلتين بيولوجيتين مستقلتين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مجموعة البيانات 1 | مجموعة البيانات 2 | سينيغ وآخرون.17 | |
| n | 2.1 | 1.9 | 1.6 |
| الخلية K (جزيئات M-n d-1 cell-1) | 9.9 × 105 | 1.4 × 105 | 3.1 × 104 |
| معدل التنوي عند 1 mM (جزيئات d-1 cell-1) | 0.38 | 0.21 | 0.35 |
الجدول 1: قيم معدل التنوي وترتيب التفاعل لتجميع Q40-YFP. بيانات لنسختين بيولوجيتين مستقلتين من البروتوكول ومقارنتهما بالبيانات المنشورة سابقا17.
Discussion
تسهل الطريقة المعروضة هنا تحليلا كميا وغير متحيز لحركية تجميع البروتين في الكائن الحي النموذجي C. elegans. ويعتمد ذلك على أربعة عناصر رئيسية (الشكل 1): 1) الحفاظ على مجموعة متزامنة حسب العمر من الديدان الخيطية؛ و 1) الحفاظ على عدد من الديدان الخيطية المتزامنة مع تقدم العمر؛ و 1) الحفاظ على عدد من الديدان الخيطية المتزامنة مع العمر؛ و 1) الحفاظ على عدد من الديدان الخيطية المتزامنة 2) المجهر الفلوري في لوحات متعددة الآبار ؛ 3) العد الآلي للتضمين في CellProfiler ؛ 4) تركيب البيانات في AmyloFit. بالمقارنة مع العد اليدوي للشوائب في الحيوانات المتحركة بحرية أو من الصور المحفوظة26 ، فإن القياس الكمي في CellProfiler أسرع وأكثر حيازة. التقدم الرئيسي الآخر للبروتوكول هو الحصول على البيانات الحركية ، بدلا من النقاط الزمنية الفردية ، والتي توفر رؤى كمية في آلية التجميع عند ملاءمة البيانات مع نموذج رياضي.
يمكن استخدام العناصر الأربعة للبروتوكول كوحدات مستقلة يمكن تعديلها اعتمادا على التطبيق. يمكن أيضا الحفاظ على السكان المتزامنين مع العمر باستخدام 5-fluoro-2′-deoxyuridine (FUDR) لتعقيم الحيوانات. يؤثر هذا المركب على العمر الافتراضي والبروتيوستاسيس24,25 وهو مسرطن للغاية للمجرب ؛ ومع ذلك ، فإنه يمنع النقل اليدوي للديدان ، والتي يمكن أن تكون كثيفة العمالة عند التعامل مع أعداد كبيرة. البدائل الأخرى هي استخدام الطفرات المعقمة29 أو أجهزة الترشيح لفصل النسل30.
يمكن أيضا تعديل خطوة الفحص المجهري الفلوري ، على سبيل المثال ، باستخدام تكبيرات أعلى لمراقبة تراكم البروتين في الخلايا العصبية. قد يكون الفحص المجهري واسع المجال كافيا لمراقبة تراكم polyQ في خلايا العضلات عندما يكون الفرق النسبي بين الظروف أكثر أهمية من الأعداد المطلقة للشوائب. لا يزال من الممكن استخدام خط أنابيب CellProfiler في هذه الحالات ، على الرغم من أن الإعدادات للتعرف على الديدان والتضمينات ستحتاج إلى تعديلها من قبل المستخدم. إنتاجية هذه التقنية محدودة حاليا بسبب الحاجة إلى الانتقاء اليدوي للحيوانات في لوحة 384 بئرا. يمكن علاج هذا عن طريق استخدام أجهزة الموائع الدقيقة16. أزيد الصوديوم هو مخدر قاس نسبيا ، والذي يمكن استبداله بالتجميد البدني مع الهلاميات المائية أو الخرز28,29.
يعتمد التحليل في AmyloFit المعروض هنا على آلية تجميع تتكون من أحداث نووية مستقلة في الخلايا الفردية. في الحالات التي لا يتناسب فيها هذا النموذج ، يجب على المستخدم النظر في بديل مثل نموذج التجميع التعاوني الذي تم تطويره سابقا17. أحد القيود المفروضة على هذا النهج هو أن السلالات التي تعبر عن البروتين ذي الأهمية بتركيزات مختلفة يجب أن تكون متاحة ، على الرغم من أنه يمكن توليدها باستخدام طرق C. elegans الروتينية 24.
وإجمالا، يوفر هذا البروتوكول وسيلة للحصول على بيانات عالية الجودة لحركية تجميع البروتين في نظام نموذجي في الجسم الحي ، مما يسمح بإجراء تحليل مفصل لآليات التجميع17. على الرغم من أن الطريقة قد أثبتت لتجميع polyQ في الأنسجة العضلية C. elegans ، إلا أن التطبيقات المستقبلية للبروتوكول قد تشمل بروتينات وأنسجة أخرى وتأثيرات عوامل البروتيوستاسيس والجزيئات الصغيرة.
Disclosures
وليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
نشكر مختبر موريموتو لسلالات C. elegans و Esmeralda Bosman على المساعدة في المجهر البؤري عالي الإنتاجية. تم تمويل هذا العمل من خلال منحة بدء التشغيل من جامعة أوتريخت إلى T.S.
Materials
| Name | Company | Catalog Number | Comments |
| 384-well plate | Greiner | 781091 | Black with flat clear bottom |
| AmyloFit | Knowles lab | v2.0 | Access at www.amylofit.ch.cam.ac.uk |
| C. elegans Q40 line A | Morimoto lab | AM1228 | Genotype rmIs404[unc-54p::Q40::YFP] |
| C. elegans Q40 line B | Morimoto lab | AM1229 | Genotype rmIs404[unc-54p::Q40::YFP] |
| C. elegans Q40 line C | Morimoto lab | AM1230 | Genotype rmIs404[unc-54p::Q40::YFP] |
| C. elegans Q40 line D | Morimoto lab | AM1231 | Genotype rmIs404[unc-54p::Q40::YFP] |
| CellProfiler | Broad Institute | 4.1.3 | Downloaded from https://cellprofiler.org |
| E. coli OP50 | Caenorhabditis Genetics Center (CGC) | OP50 | |
| FIJI | Open-source | (Fiji Is Just) ImageJ v2.1/1.5.3j | Downloaded from https://imagej.net/software/fiji/ |
| High-throughput confocal microscope | Yokogawa | CellVoyager CV8000 | |
| M9 buffer | Home-made | 3 g/L KH2PO4, 6 g/L Na2HPO4, 0.5 g/L NaCl, 1 mM MgSO4 | |
| NGM plates | Home-made | 17 g/L agar, 2.5 g/L bacto-peptone, 3 g/L NaCl, 25 mM KPO4 buffer pH 6.0, 1 mM MgSO4, 1 mM CaCl2, 5 mg/L cholesterol | |
| Pasteur pipette | WU Mainz | 250 | To make worm pick, 150 mm length |
| Platinum iridium wire | Alfa Aesar | 39383 | To make worm pick, 0.25 mm diameter |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Stereomicroscope | Leica | S9 |
References
- Knowles, T. P. J., Vendruscolo, M., Dobson, C. M. The amyloid state and its association with protein misfolding diseases. Nature Reviews. Molecular Cell Biology. 15 (6), 384-396 (2014).
- Chiti, F., Dobson, C. M. Protein misfolding, amyloid formation, and human disease: a summary of progress over the last decade. Annual Review of Biochemistry. 86 (1), 27-68 (2017).
- Knowles, T. P. J., et al. An analytical solution to the kinetics of breakable filament assembly. Science. 326 (5959), 1533-1537 (2009).
- Cohen, S. I. A., et al. Proliferation of amyloid-β42 aggregates occurs through a secondary nucleation mechanism. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9758-9763 (2013).
- Meisl, G., et al. Molecular mechanisms of protein aggregation from global fitting of kinetic models. Nature Protocols. 11 (2), 252-272 (2016).
- Satyal, S. H., et al. Polyglutamine aggregates alter protein folding homeostasis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 97 (11), 5750-5755 (2000).
- Morley, J. F., Brignull, H. R., Weyers, J. J., Morimoto, R. I. The threshold for polyglutamine-expansion protein aggregation and cellular toxicity is dynamic and influenced by aging in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 99 (16), 10417-10422 (2002).
- Brignull, H. R., Moore, F. E., Tang, S. J., Morimoto, R. I. Polyglutamine proteins at the pathogenic threshold display neuron-specific aggregation in a pan-neuronal Caenorhabditis elegans model. Journal of Neuroscience. 26 (29), 7597-7606 (2006).
- Moronetti Mazzeo, L. E., Dersh, D., Boccitto, M., Kalb, R. G., Lamitina, T. Stress and aging induce distinct polyQ protein aggregation states. Proceedings of the National Academy of Sciences of the United States of America. 109 (26), 10587-10592 (2012).
- Prahlad, V., Morimoto, R. I. Neuronal circuitry regulates the response of Caenorhabditis elegans to misfolded proteins. Proceedings of the National Academy of Sciences of the United States of America. 108 (34), 14204-14209 (2011).
- Nollen, E. A. A. Genome-wide RNA interference screen identifies previously undescribed regulators of polyglutamine aggregation. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6403-6408 (2004).
- Silva, M. C., et al. A genetic screening strategy identifies novel regulators of the proteostasis network. PLoS Genetics. 7 (12), 1002438 (2011).
- Brehme, M., et al. A chaperome subnetwork safeguards proteostasis in aging and neurodegenerative disease. Cell Reports. 9, 1-16 (2014).
- Calamini, B., et al. Small-molecule proteostasis regulators for protein conformational diseases. Nature Chemical Biology. 8 (2), 185-196 (2012).
- Sinnige, T., Stroobants, K., Dobson, C. M., Vendruscolo, M. Biophysical studies of protein misfolding and aggregation in in vivo models of Alzheimer's and Parkinson's diseases. Quarterly Reviews of Biophysics. 49, 22 (2020).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nature Communications. 7, 13023 (2016).
- Sinnige, T., et al. Kinetic analysis reveals that independent nucleation events determine the progression of polyglutamine aggregation in C. elegans. Proceedings of the National Academy of Sciences of the United States of America. 118 (11), 202188118 (2021).
- Brenner, S. Caenorhabditis elegans. Methods. 77 (1), 71-94 (1974).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- . FIJI/ImageJ Available from: https://imagej.net/downloads (2012)
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Lamprecht, M. R., Sabatini, D. M., Carpenter, A. E. CellProfiler: free, versatile software for automated biological image analysis. BioTechniques. 42 (1), 71-75 (2007).
- CellProfiler. Broad Institute Available from: https://cellprofiler.org/releases (2021)
- Mello, C. C., Kramer, J. M., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrachromosomal maintenance and integration of transforming sequences. EMBO Journal. 10 (12), 3959-3970 (1991).
- . Knowles group, University of Cambridge Available from: https://amylofit.com/amylofitmain/login/ (2021)
- Lazaro-Pena, M. I., Cornwell, A. B., Samuelson, A. V. Quantifying tissue-specific proteostatic decline in Caenorhabditis elegans. Journal of Visualized Experiments: JoVE. (175), (2021).
- Feldman, N., Kosolapov, L., Ben-Zvi, A. Fluorodeoxyuridine improves Caenorhabditis elegans proteostasis independent of reproduction onset. PLoS One. 9 (1), 85964 (2014).
- Brunquell, J., Bowers, P., Westerheide, S. D. Fluorodeoxyuridine enhances the heat shock response and decreases polyglutamine aggregation in an HSF-1-dependent manner in Caenorhabditis elegans. Mechanisms of Ageing and Development. 141-142, 1-4 (2014).
- David, D. C., et al. Widespread protein aggregation as an inherent part of aging in C. elegans. PLoS Biology. 8 (8), 47-48 (2010).
- Hunter, S., Maulik, M., Scerbak, C., Vayndorf, E., Taylor, B. E. Caenorhabditis sieve: A low-tech instrument and methodology for sorting small multicellular organisms. Journal of Visualized Experiments: JoVE. (137), (2018).
- Burnett, K., Edsinger, E., Albrecht, D. R. Rapid and gentle hydrogel encapsulation of living organisms enables long-term microscopy over multiple hours. Communications Biology. 1, 73 (2018).
- Dong, L., et al. Reversible and long-term immobilization in a hydrogel-microbead matrix for high-resolution imaging of Caenorhabditis elegans and other small organisms. PLoS One. 13 (3), 0193989 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved