Method Article
Мониторинг кинетики агрегации белка In Vivo с использованием автоматизированного подсчета включений в Caenorhabditis elegans
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь представлен метод анализа кинетики агрегации белка у нематоды Caenorhabditis elegans. Животные из популяции, синхронизированной по возрасту, визуализируются в разные моменты времени, за которыми следует полуавтоматический подсчет включения в CellProfiler и соответствие математической модели в AmyloFit.
Аннотация
Агрегация белка в нерастворимые включения является отличительной чертой разнообразных заболеваний человека, многие из которых связаны с возрастом. Нематода Caenorhabditis elegans является хорошо зарекомендовавшим себя модельным организмом, который широко используется в этой области для изучения агрегации и токсичности белка. Его оптическая прозрачность позволяет непосредственно визуализировать агрегацию белка с помощью флуоресцентной микроскопии. Более того, быстрый репродуктивный цикл и короткая продолжительность жизни делают нематоду подходящей моделью для скрининга генов и молекул, которые модулируют этот процесс.
Однако количественная оценка совокупной нагрузки у живых животных плохо стандартизирована, обычно выполняется ручным подсчетом включения под флуоресцентным рассеченным микроскопом в одну точку времени. Такой подход может привести к высокой изменчивости между наблюдателями и ограничить понимание процесса агрегирования. Напротив, агрегация амилоидоподобных белков in vitro обычно контролируется флуоресценцией тиофлавина Т с высоким количественным и временным разрешением.
Здесь представлен аналогичный метод для непредвзятого анализа кинетики агрегации у живых C. elegans с использованием высокопроизводительного конфокального микроскопа в сочетании с индивидуальным анализом изображений и подгонкой данных. Применимость данного метода демонстрируется путем мониторинга включения образования флуоресцентно меченого белка полиглутамина (polyQ) в мышечных клетках стенки организма. Рабочий процесс анализа изображений позволяет определять количество включений в разных точках времени, которые подогнаны к математической модели, основанной на независимых событиях нуклеации в отдельных мышечных клетках. Метод, описанный здесь, может оказаться полезным для оценки воздействия факторов протеостаза и потенциальных терапевтических средств для лечения заболеваний агрегации белка у живого животного надежным и количественным образом.
Введение
Накопление неправильно свернутых белков в нерастворимые отложения происходит при широком спектре заболеваний. Известными примерами являются агрегация амилоид-β и тау при болезни Альцгеймера, α-синуклеина при болезни Паркинсона и гентингтина с вспененным полиQ при болезни Гентингтона 1,2. Неправильное сворачивание этих полипептидов в амилоидные фибриллы связано с токсичностью и гибелью клеток механизмами, которые до сих пор в значительной степени неясны. Выяснение механизмов образования амилоида будет иметь решающее значение для разработки эффективных методов лечения, которые в настоящее время недоступны.
Детальные исследования образования амилоида были выполнены in vitro на основе измерений флуоресценции тиофлавина Т, что привело к механистическому пониманию процесса агрегации и влияния ингибирующих молекул 3,4,5. Однако неясно, справедливы ли те же механизмы агрегации в сложной среде живых клеток и организмов. Червь-нематода Caenorhabditis elegans является подходящим модельным организмом для изучения агрегации белка in vivo. Он имеет относительно простую анатомию, но состоит из нескольких тканей, включая мышцы, кишечник и нервную систему. Он генетически хорошо характеризуется, и инструменты для генетической модификации легко доступны. Кроме того, он имеет короткое время генерации ~ 3 дня и общую продолжительность жизни 2-3 недели. Таким образом, агрегация белка может быть исследована на протяжении всей жизни животного в экспериментально удобной временной шкале. Наконец, нематода оптически прозрачна, что позволяет отслеживать агрегацию флуоресцентно меченых белков у живых животных.
Эти особенности C. elegans ранее использовались для исследования агрегации белков polyQ в качестве модели для гентингтона и других заболеваний расширения polyQ. Выше патогенного порога в 35-40 остатков глутамина можно наблюдать, что белки polyQ, помеченные желтым флуоресцентным белком (YFP), образуют нерастворимые включения в мышечной ткани 6,7, нейронах8 и кишечнике 9,10. Эти особенности были широко использованы для скрининга генов 11,12,13 и низкомолекулярных модификаторов 14 агрегации и токсичности белка.
C. elegans может сыграть важную роль в преодолении разрыва между исследованиями агрегации белка in vitro и более сложными моделями заболеваний, такими как мыши15. C. elegans поддается скринингу лекарств16 , но также может быть использован для получения фундаментального понимания молекулярных механизмов агрегации белка in vivo, как было продемонстрировано недавно17. Однако для обоих применений первостепенное значение имеет извлечение количественной и воспроизводимой меры агрегации белка. Здесь это достигается за счет использования высокопроизводительного конфокального микроскопа в сочетании с выделенным конвейером анализа изображений (рисунок 1).
протокол
1. Рост возрастно-синхронизированной популяции C. elegans
- Поддерживать штаммы C. elegans на пластинах среды роста нематод (NGM), засеянных Escherichia coli OP50 при 20 °C в соответствии со стандартными процедурами18.
- Выполните синхронную яйцекладку, поместив 10 взрослых нематод на 6-сантиметровую посеянную пластину NGM с платиновой червячной киркой. Оставьте взрослым отложить яйца в течение ~ 2 ч при 20 °C, прежде чем удалить их. Подготовьте по 1-4 тарелки на штамм, в зависимости от плодовитости штамма и количества временных точек, которые необходимо принять.
- Поместите тарелки с яйцами в инкубатор при температуре 20 °C. Следите за развитием животных до тех пор, пока они не достигнут совершеннолетия.
ПРИМЕЧАНИЕ: День, когда животные достигли совершеннолетия, определяется здесь как день 1. Как правило, это происходит через три дня после яйцекладки. - Начиная с 1-го дня, ежедневно переносите животных на новые семенные пластины NGM, чтобы отделить их от потомства. Чтобы компенсировать животных, которые умирают или теряются во время переноса, перенесите ~ 40 животных на штамм, умноженное на количество точек, которые должны быть изображены (см. шаг 2). Продолжайте до тех пор, пока животные не перестанут откладывать оплодотворенные яйца (~6-й день взрослой жизни).
ПРИМЕЧАНИЕ: Исключить животных с мешками или другими фенотипами развития. Мешки обычно наблюдаются у штаммов, экспрессирующих белки, склонные к агрегации.
2. Пробоподготовка C. elegans в многоязычной пластине
ПРИМЕЧАНИЕ: Поскольку процедура визуализации требует анестетиков, которые в конечном итоге убьют животных, те же животные не могут быть повторно использованы для последующих временных точек. Вместо этого разные животные из одной и той же синхронизированной по возрасту партии визуализируются в разные дни. Несмотря на то, что большинство штаммов будут иметь мало включений на 1-й день, рекомендуется включить этот момент времени в качестве базового уровня.
- Подготовьте плиту из 384 скважин, заполнив необходимое количество скважин 100 мкл буфера M9, дополненного 25 мМ NaN3 в качестве анестетика. Заполните по одной лунке для каждого штамма для получения изображения.
ПРИМЕЧАНИЕ: Азид натрия (NaN3) токсичен и с ним следует обращаться осторожно. - Для каждого штамма переведите 20 животных в одну скважину с помощью платинового червячного кирка.
ПРИМЕЧАНИЕ: Черви должны быть размещены вне бактериального газона, прежде чем помещать их в колодец. Бактерии заставляют животных прилипать к червячной кирке, что может предотвратить их высвобождение и затуманить содержимое колодца. Как правило, 20 является оптимальным количеством животных на скважину, чтобы предотвратить перекрытие между червями, ограничивая при этом ненужную визуализацию пустого пространства скважины. - Накройте пластину крышкой, чтобы предотвратить испарение, и визуализируйте пластину в течение 1 часа после приготовления.
- Повторяйте шаги 2,1-2,3 ежедневно до тех пор, пока не будет достигнуто устойчивое плато в количестве включений или пока большинство животных не умрут. Выполняйте пробоподготовку и визуализацию в одно и то же время каждый день, чтобы обеспечить интервалы в 24 часа.
3. Получение изображений на высокопроизводительный конфокальный микроскоп
ПРИМЕЧАНИЕ: Этот эксперимент также может быть установлен на обычном вращающемся дисковом конфокальном микроскопе с держателем многолуночной пластины. Камера с большим полем зрения полезна для ограничения количества плиток, которые необходимо визуализировать, чтобы охватить весь колодец. Смотрите Таблицу материалов для получения подробной информации о микроскопе и программном обеспечении, используемом в этом протоколе.
- Включите прибор и откройте программное обеспечение.
- Запустите новый протокол, перейдя в настройки измерений | Новый. Выберите правильный тип пластины с несколькими ячейками и нажмите кнопку Создать новый параметр измерения.
- Настройте канал для флуоресценции, перейдя к Ch 1. Установите цель в 10x. Выберите 488 нм в качестве источника света и BP525/25 в качестве эмиссионного фильтра для изображения YFP. Установите для параметра binning значение 2x2 , чтобы уменьшить размер файла.
- Нажмите Добавить канал и выберите Brightfield в качестве метода.
- Чтобы добавить к измерению конфокальное флуоресцентное изображение z-стека, выберите 3D-флуоресцентное получение в списке действий. Перейдите в раздел Выбрать и выберите Ch 1. Чтобы свести к минимуму размеры файлов, установите для параметра Обработка изображений значение Максимальная , чтобы сохранялось максимальное проекционное изображение, а не полный z-стек.
- Нажмите | получения BF/Ph Выберите | Ch 2 для канала brightfield.
- Нажмите кнопку воспроизведения (найдите символ треугольника, указывающего вправо) рядом с пунктом «Выгрузить пластины скважины » и поместите пластину с 384 скважинами в микроскоп.
- В разделе 3D Fluorescence Acquisition нажмите « Тест » и выберите скважину, содержащую червей, чтобы определить оптимальное расстояние смещения, на котором черви правильно центрируются. Установите расстояние по возрастанию на 50 мкм, расстояние по убыванию на -50 мкм и интервал нарезки на 2 мкм, чтобы захватить всю толщину животных в z-стеке.
- Оптимизируйте время экспозиции, чтобы получить хорошую интенсивность сигнала для всех четырех штаммов, избегая при этом насыщения. Используйте одинаковое время экспозиции для всех штаммов и временных точек.
- Выберите скважины для получения изображения в разделе Настройка сканирования плит скважины. Выберите Плитка и приобретите целый колодец.
- Сохраните параметр измерения и начните эксперимент, нажав кнопку Начать измерение. Для последующих временных точек откройте ту же настройку измерения и отрегулируйте расстояние смещения и скважины, которые будут визуализированы.
4. Сшивание плиточных изображений в ImageJ
ПРИМЕЧАНИЕ: Этот шаг требуется только при использовании объектива размером более 4x, для которого изображение каждой скважины получено в виде нескольких плиток. В этом рабочем процессе анализа сшивание плиток выполняется с помощью свободного программного обеспечения FIJI/ImageJ19 (рисунок 2). В зависимости от инструмента, используемого на этапе 3, также может быть возможно выполнить сшивание непосредственно в сопроводительном программном обеспечении.
- Скачайте FIJI20 и откройте его.
- Перейти в | плагинов | сшивания Сетка/Коллекционное сшивание21.
- Во всплывающем окне Grid/Collection Stitching выберите тип и порядок сбора плиток. Выберите Сетка: строка за строкой и Вправо и вниз.
- В следующем окне Сетка: Сетка: строка за строкой, Вправо и вниз, вставьте количество плиток в направлениях x и y. Для 10-кратной цели, используемой здесь, выберите 2 в качестве размера сетки x, 3 в качестве размера сетки y и 0 в качестве перекрытия плитки.
- Нажмите кнопку Обзор и выберите папку, содержащую изображения TIFF для сшивания.
- Вставьте общее имя файла в поле Имена файлов для плиток, используя {i} в позиции номера плитки в каждом имени файла.
- Снимите все флажки ниже.
- Запустите плагин.
- Сохраните полученные изображения в виде файлов TIFF для анализа на следующем шаге.
5. Автоматический подсчет включений с помощью CellProfiler22
- Загрузите и установите программное обеспечение для анализа изображений с открытым исходным кодом CellProfiler23. Загрузите конвейер InclusionCounting.cpproj с github.com/sinnigelab/aggregate-quantification.
- Откройте CellProfiler и перетащите конвейер в окно Перетащить файл конвейера сюда. Нажмите кнопку Да , чтобы загрузить проект.
- Нажмите на модуль ввода изображений и перетащите сшитые изображения в окно Перетащить файлы и папку здесь.
- Щелкните модуль ввода метаданных . Настройте регулярное выражение для извлечения из имени файла в соответствии с именами сшитых изображений.
- Щелкните модуль ввода NamesandTypes и настройте Критерии выберите критерии правила в соответствии с каналами в именах файлов.
ПРИМЕЧАНИЕ: В настройках конвейера по умолчанию имена файлов, содержащие BF , распознаются как изображения brightfield и называются Worms. Имена файлов, содержащие YFP , распознаются как флуоресцентные изображения и называются Fluorescence. - Щелкните Просмотр настроек вывода , чтобы выбрать папку по умолчанию для сохранения выходных данных CellProfiler.
- Щелкните Запустить тестовый режим , чтобы проверить параметры конвейера с помощью первого набора данных изображений. Щелкните Выполнить , чтобы запустить все модули в конвейере, или Шаг , чтобы запустить через конвейер по одному модулю за раз. Чтобы настроить контуры червей в модуле EditObjectsManually , щелкните Справка , чтобы просмотреть инструкции, и нажмите кнопку Готово , чтобы продолжить запуск конвейера.
ПРИМЕЧАНИЕ: Извлеченные измерения не будут экспортированы в тестовом режиме. Пороговые параметры для обнаружения червей и включений, возможно, потребуется скорректировать в зависимости от используемых деформаций и увеличения. - Нажмите «Выход из тестового режима» и «Анализ изображений».
- Откройте выходную папку для просмотра выходных файлов. Откройте изображения с исходным именем файла, за которым следуют контуры , чтобы проверить, правильно ли наложены черви и включения.
ПРИМЕЧАНИЕ: Количество включений на червя можно найти в файле с именем ExpandedWormObjects. Более подробную информацию о входных изображениях можно найти в файле с именем Image. Дополнительные выходные данные можно выбрать в модуле ExportToSpreadsheet в конвейере.
6. Глобальная подгонка данных о количестве включений с помощью AmyloFit5
ПРИМЕЧАНИЕ: Этот шаг может быть выполнен только при наличии данных о множественных концентрациях белка. Для Q40-YFP ранее был создан набор из четырех штаммов с различными уровнями сверхэкспрессии в мышечных клетках стенки тела17. В других случаях новые штаммы должны генерироваться с использованием плазмидной микроинъекции и геномной интеграции24.
- Перейдите на бесплатную онлайн-платформу для установки кинетики агрегации AmyloFit25. Зарегистрируйтесь или войдите в систему с помощью существующей учетной записи.
ПРИМЕЧАНИЕ: Обширное руководство по использованию AmyloFit можно получить для получения дополнительной помощи. Смотрите ссылку в левом верхнем углу веб-страницы (после входа в систему) для получения дополнительной информации. - Чтобы начать использовать AmyloFit, назовите проект и нажмите Создать проект. Откройте проект, нажав кнопку Открыть , и создайте сеанс, присвоив ему имя и щелкнув Создать и загрузить сеанс.
- Нажмите кнопку Добавить данные и загрузите файл, содержащий среднее количество включений на животное, в соответствии с требованиями к формату данных, показанными на левой панели. Щелкните Загрузить новые данные.
- Пропустите шаги предварительной обработки, которые не требуются для данных подсчета включений, установив количество точек, которые необходимо усреднить для смещения нулевой точки , и количество точек, которое должно быть усреднено для плато до 0. Нажмите кнопку Отправить. Повторите этот шаг для каждой концентрации белка (т.е. для каждого столбца в загруженном файле).
- Выберите Пользовательский на панели модели, введите Ncells*(1-exp(-Kcell*m**(n)*(t-1))) в поле уравнения и нажмите Загрузить модель.
ПРИМЕЧАНИЕ: Поскольку AmyloFit был первоначально разработан для анализа кинетических данных из анализов in vitro, для анализа данных о количестве включений C. elegans должна быть загружена специальная модель. В уравнении, используемом здесь, N-клетки — это количество клеток, в которых происходит образование включения, K-клетка — постоянная скорости зародыша, m — внутриклеточная концентрация белка, а n — порядок реакции зародышеобразования. - Задайте для типов параметров Global Const для Nячеек, Global fit для K-ячейки и n и Const для m. Установите значение N-клеток равным 95 для мышечных клеток стенки тела и Начальное предположение для K-клетки и n к 1. Введите значения m для различных деформаций в левой панели.
ПРИМЕЧАНИЕ: Первоначальные предположения не имеют отношения к относительно простой модели, используемой здесь. Для более сложных моделей полезно ввести оценку ожидаемых значений, чтобы сократить время расчета. - Оставьте количество прыжков в бассейне без изменений и нажмите « По размеру » на монтажной панели.
- Извлеките подгонку, щелкнув Загрузить данные и Подогнать.
ПРИМЕЧАНИЕ: Параметры, извлеченные глобальным соответствием модели, будут перечислены в правом нижнем углу. График данных и подгонки будет автоматически сгенерирован в верхней правой панели. Этот участок можно извлечь, щелкнув Загрузить pdf и настроить, перейдя в раздел Параметры отображения графика. К-клетка имеет единицы концентрации молекул -n time-1 клетка-1. Для сравнения значений с различным n, K-клетку можно преобразовать в скорость нуклеации при заданной концентрации белка, умножив ее на mn.
Результаты
Метод, описанный здесь (рисунок 1), использовался для анализа кинетики агрегации конструкции, содержащей 40 глутаминов, сплавленных с YFP (Q40-YFP). Белок экспрессируется под контролем промотора unc-54 , стимулируя экспрессию в мышечных клетках стенки тела. Поскольку они относительно велики и легко визуализируются, использование 10-кратного объектива достаточно для разрешения включений, образованных Q40-YFP в этой ткани. Ранее были разработаны четыре штамма (линии A-D), экспрессирующие белок в разной степени для оценки концентрационно-зависимости агрегации polyQ in vivo17.
Синхронизированные по возрасту популяции линий A-D были сгенерированы 2-часовой яйцекладкой, за которой следовал ежедневный перенос, как только потомство достигло совершеннолетия. С 1 по 10 день взрослой жизни 20 животных из каждого из четырех штаммов были изображены в 384-луночной пластине с использованием высокопроизводительного конфокального микроскопа. Изображения колодцев были получены в виде 6 плиток, которые были сшиты вместе с помощью плагина в ImageJ21 (рисунок 2). Сшитые изображения были впоследствии проанализированы с использованием специально изготовленного конвейера CellProfiler22 (рисунок 3) для количественной оценки среднего числа включения на животное для каждого штамма и точки времени.
Затем данные были сопоставлены с математической моделью в AmyloFit5 (рисунок 4). Модель основана на предположении, что каждая из 95 мышечных клеток стенки тела независимо приобретает одно включение путем события нуклеации, ограничивающего скорость, за которым следует быстрый совокупный рост17. Припадение дало константу скорости нуклеации 9,9 × 105 молекул M-2,1 d-1 клетки-1 и порядок реакции 2,1, соответствующий скорости нуклеации 0,38 молекулы d-1 клетка-1 при внутриклеточной концентрации белка 1 мМ. Две независимые биологические реплики привели к близко соответствующим значениям скорости нуклеации и порядка реакций, которые согласуются с предыдущим исследованием с использованием аналогичного протокола17 (таблица 1).
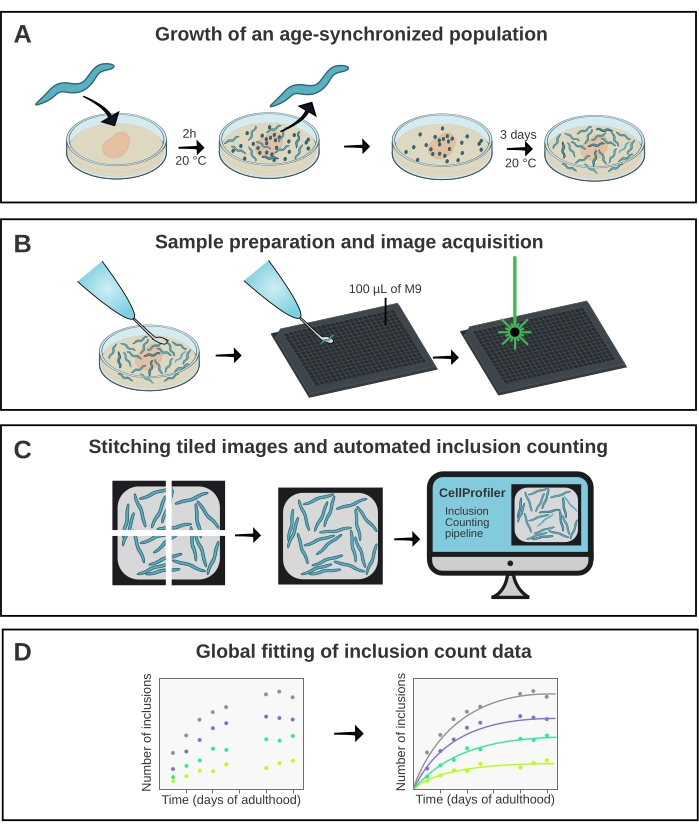
Рисунок 1: Схематический обзор метода. (A) Популяции C. elegans , синхронизированные по возрасту, генерируются синхронизированной яйцекладкой. (B) Животные из одной и той же популяции изображены в 384-луночной пластине в разные моменты времени. (C) Плитки сшиваются вместе для формирования изображений целых скважин, которые анализируются в CellProfiler для количественной оценки числа включений на животное. (D) Данные устанавливаются в математическую модель с использованием AmyloFit. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
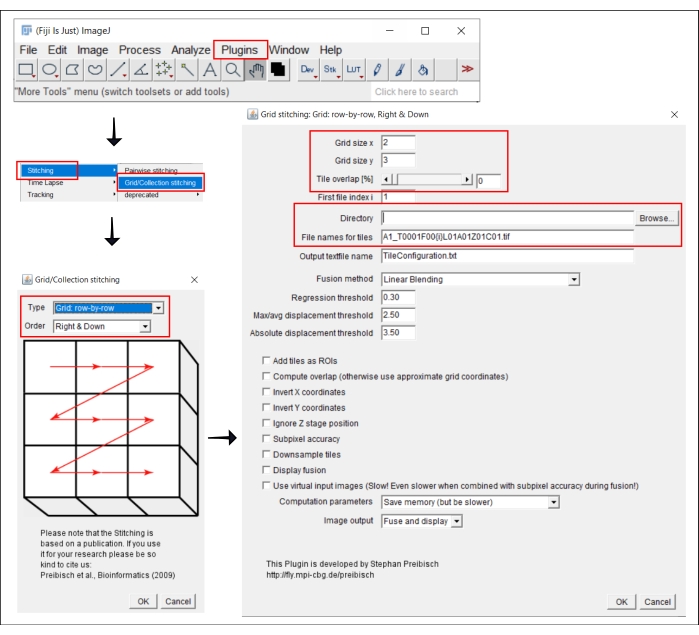
Рисунок 2: Скриншоты процедуры сшивания в ImageJ с помощью плагина Grid/Collection stitching21. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Схема конвейера CellProfiler для количественной оценки чисел включений. (A-C) Изображение яркого поля (A) используется для идентификации червей (B, крупный план в C). (Д-Г) Флуоресцентное изображение (D, крупный план в E) используется для идентификации включений (F). Черви и включения связаны, чтобы обеспечить количество включений для каждого червя в скважине (G). Показаны изображения животных линии Q40 A на 3-й день взрослой жизни. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
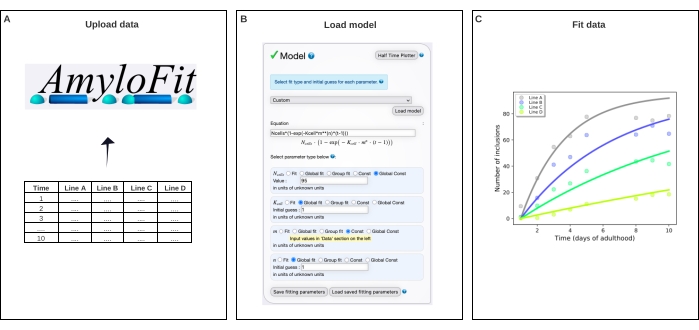
Рисунок 4: Подгонка данных к математической модели в AmyloFit. (A) Данные загружаются в AmyloFit. (B) Для формирования включения модели вводится пользовательское уравнение, предполагающее независимые события нуклеации в каждой клетке. (C) Подгонка кинетики агрегации для линий A-D C. elegans , выражающих различные уровни Q40-YFP. Данные являются репрезентативными для двух независимых биологических реплик. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Набор данных 1 | Набор данных 2 | Синниге и др.17 | |
| n | 2.1 | 1.9 | 1.6 |
| К-клетка (молекулы M-n d-1 клетка-1) | 9,9 х 105 | 1,4 х 105 | 3,1 х 104 |
| Скорость нуклеации при 1 мМ (молекулы d-1 клетка-1) | 0.38 | 0.21 | 0.35 |
Таблица 1: Значения скорости нуклеации и порядка реакции агрегации Q40-YFP. Данные для двух независимых биологических реплик протокола и сравнение с ранее опубликованными данными17.
Обсуждение
Способ, представленный в настоящем описании, облегчает непредвзятый и количественный анализ кинетики агрегации белка в модельном организме C. elegans. Это зависит от четырех ключевых элементов (рисунок 1): 1) поддержание синхронизированной по возрасту популяции нематод; 2) флуоресцентная микроскопия в многоязычных пластинах; 3) автоматизированный подсчет включений в CellProfiler; 4) подгонка данных в AmyloFit. По сравнению с ручным подсчетом включений у свободно движущихся животных или из сохраненных изображений26, количественная оценка в CellProfiler является более быстрой и более объективной. Другим ключевым достижением протокола является получение кинетических данных, а не отдельных временных точек, что дает количественное представление о механизме агрегации при подгонке данных к математической модели.
Четыре элемента протокола могут быть использованы в качестве независимых модулей, которые могут быть изменены в зависимости от приложения. Популяции, синхронизированные по возрасту, также могут поддерживаться с использованием 5-фтор-2'-дезоксиуридина (FUDR) для стерилизации животных. Это соединение влияет на продолжительность жизни и протеостаз24,25 и является высококанцерогенным для экспериментатора; однако это исключает ручную передачу червей, которая может быть трудоемкой при обработке большого количества. Другими альтернативами являются использование стерильных мутантов29 или фильтрационных устройств для разделения потомства30.
Стадия флуоресцентной микроскопии также может быть скорректирована, например, с использованием более высоких увеличений для мониторинга агрегации белка в нейронах. Широкоугольной микроскопии может быть достаточно для мониторинга агрегации polyQ в мышечных клетках, когда относительная разница между состояниями более важна, чем абсолютное число включений. Конвейер CellProfiler по-прежнему можно использовать в этих случаях, хотя параметры для распознавания червей и включений должны быть скорректированы пользователем. Пропускная способность техники в настоящее время ограничена необходимостью ручного отбора животных в 384-луночную плиту. Это потенциально может быть исправлено путем использования микрофлюидных устройств16. Азид натрия является относительно жестким анестетиком, который может быть заменен физической иммобилизацией гидрогелями или бусинами28,29.
Анализ в AmyloFit, представленный здесь, основан на механизме агрегации, состоящем из независимых событий нуклеации в отдельных клетках. В тех случаях, когда эта модель не подходит, пользователю следует рассмотреть альтернативу, такую как модель кооперативной агрегации, разработанная ранее17. Ограничение этого подхода заключается в том, что штаммы, экспрессирующие интересующий белок в различных концентрациях, должны быть доступны, хотя они могут быть получены с использованием рутинных методов C. elegans 24.
В целом, этот протокол предоставляет средства для получения высококачественных данных для кинетики агрегации белка в модельной системе in vivo , что позволяет проводить детальный анализ механизмов агрегации17. Хотя метод был продемонстрирован для агрегации polyQ в мышечной ткани C. elegans , будущие применения протокола могут включать другие белки и ткани и эффекты факторов протеостаза и малых молекул.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Мы благодарим лабораторию Моримото за штаммы C. elegans и Esmeralda Bosman за помощь в работе с высокопроизводительным конфокальным микроскопом. Эта работа финансировалась за счет стартового гранта Утрехтского университета T.S.
Материалы
| Name | Company | Catalog Number | Comments |
| 384-well plate | Greiner | 781091 | Black with flat clear bottom |
| AmyloFit | Knowles lab | v2.0 | Access at www.amylofit.ch.cam.ac.uk |
| C. elegans Q40 line A | Morimoto lab | AM1228 | Genotype rmIs404[unc-54p::Q40::YFP] |
| C. elegans Q40 line B | Morimoto lab | AM1229 | Genotype rmIs404[unc-54p::Q40::YFP] |
| C. elegans Q40 line C | Morimoto lab | AM1230 | Genotype rmIs404[unc-54p::Q40::YFP] |
| C. elegans Q40 line D | Morimoto lab | AM1231 | Genotype rmIs404[unc-54p::Q40::YFP] |
| CellProfiler | Broad Institute | 4.1.3 | Downloaded from https://cellprofiler.org |
| E. coli OP50 | Caenorhabditis Genetics Center (CGC) | OP50 | |
| FIJI | Open-source | (Fiji Is Just) ImageJ v2.1/1.5.3j | Downloaded from https://imagej.net/software/fiji/ |
| High-throughput confocal microscope | Yokogawa | CellVoyager CV7000S | |
| M9 buffer | Home-made | 3 g/L KH2PO4, 6 g/L Na2HPO4, 0.5 g/L NaCl, 1 mM MgSO4 | |
| NGM plates | Home-made | 17 g/L agar, 2.5 g/L bacto-peptone, 3 g/L NaCl, 25 mM KPO4 buffer pH 6.0, 1 mM MgSO4, 1 mM CaCl2, 5 mg/L cholesterol | |
| Pasteur pipette | WU Mainz | 250 | To make worm pick, 150 mm length |
| Platinum iridium wire | Alfa Aesar | 39383 | To make worm pick, 0.25 mm diameter |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Stereomicroscope | Leica | S9 |
Ссылки
- Knowles, T. P. J., Vendruscolo, M., Dobson, C. M. The amyloid state and its association with protein misfolding diseases. Nature Reviews. Molecular Cell Biology. 15 (6), 384-396 (2014).
- Chiti, F., Dobson, C. M. Protein misfolding, amyloid formation, and human disease: a summary of progress over the last decade. Annual Review of Biochemistry. 86 (1), 27-68 (2017).
- Knowles, T. P. J., et al. An analytical solution to the kinetics of breakable filament assembly. Science. 326 (5959), 1533-1537 (2009).
- Cohen, S. I. A., et al. Proliferation of amyloid-β42 aggregates occurs through a secondary nucleation mechanism. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9758-9763 (2013).
- Meisl, G., et al. Molecular mechanisms of protein aggregation from global fitting of kinetic models. Nature Protocols. 11 (2), 252-272 (2016).
- Satyal, S. H., et al. Polyglutamine aggregates alter protein folding homeostasis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 97 (11), 5750-5755 (2000).
- Morley, J. F., Brignull, H. R., Weyers, J. J., Morimoto, R. I. The threshold for polyglutamine-expansion protein aggregation and cellular toxicity is dynamic and influenced by aging in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 99 (16), 10417-10422 (2002).
- Brignull, H. R., Moore, F. E., Tang, S. J., Morimoto, R. I. Polyglutamine proteins at the pathogenic threshold display neuron-specific aggregation in a pan-neuronal Caenorhabditis elegans model. Journal of Neuroscience. 26 (29), 7597-7606 (2006).
- Moronetti Mazzeo, L. E., Dersh, D., Boccitto, M., Kalb, R. G., Lamitina, T. Stress and aging induce distinct polyQ protein aggregation states. Proceedings of the National Academy of Sciences of the United States of America. 109 (26), 10587-10592 (2012).
- Prahlad, V., Morimoto, R. I. Neuronal circuitry regulates the response of Caenorhabditis elegans to misfolded proteins. Proceedings of the National Academy of Sciences of the United States of America. 108 (34), 14204-14209 (2011).
- Nollen, E. A. A. Genome-wide RNA interference screen identifies previously undescribed regulators of polyglutamine aggregation. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6403-6408 (2004).
- Silva, M. C., et al. A genetic screening strategy identifies novel regulators of the proteostasis network. PLoS Genetics. 7 (12), 1002438(2011).
- Brehme, M., et al. A chaperome subnetwork safeguards proteostasis in aging and neurodegenerative disease. Cell Reports. 9, 1-16 (2014).
- Calamini, B., et al. Small-molecule proteostasis regulators for protein conformational diseases. Nature Chemical Biology. 8 (2), 185-196 (2012).
- Sinnige, T., Stroobants, K., Dobson, C. M., Vendruscolo, M. Biophysical studies of protein misfolding and aggregation in in vivo models of Alzheimer's and Parkinson's diseases. Quarterly Reviews of Biophysics. 49, 22(2020).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nature Communications. 7, 13023(2016).
- Sinnige, T., et al. Kinetic analysis reveals that independent nucleation events determine the progression of polyglutamine aggregation in C. elegans. Proceedings of the National Academy of Sciences of the United States of America. 118 (11), 202188118(2021).
- Brenner, S. Caenorhabditis elegans. Methods. 77 (1), 71-94 (1974).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- FIJI/ImageJ. , Available from: https://imagej.net/downloads (2012).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Lamprecht, M. R., Sabatini, D. M., Carpenter, A. E. CellProfiler: free, versatile software for automated biological image analysis. BioTechniques. 42 (1), 71-75 (2007).
- CellProfiler. Broad Institute. , Available from: https://cellprofiler.org/releases (2021).
- Mello, C. C., Kramer, J. M., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrachromosomal maintenance and integration of transforming sequences. EMBO Journal. 10 (12), 3959-3970 (1991).
- Knowles group, University of Cambridge. , Available from: https://amylofit.com/amylofitmain/login/ (2021).
- Lazaro-Pena, M. I., Cornwell, A. B., Samuelson, A. V. Quantifying tissue-specific proteostatic decline in Caenorhabditis elegans. Journal of Visualized Experiments: JoVE. (175), (2021).
- Feldman, N., Kosolapov, L., Ben-Zvi, A. Fluorodeoxyuridine improves Caenorhabditis elegans proteostasis independent of reproduction onset. PLoS One. 9 (1), 85964(2014).
- Brunquell, J., Bowers, P., Westerheide, S. D. Fluorodeoxyuridine enhances the heat shock response and decreases polyglutamine aggregation in an HSF-1-dependent manner in Caenorhabditis elegans. Mechanisms of Ageing and Development. 141-142, 1-4 (2014).
- David, D. C., et al. Widespread protein aggregation as an inherent part of aging in C. elegans. PLoS Biology. 8 (8), 47-48 (2010).
- Hunter, S., Maulik, M., Scerbak, C., Vayndorf, E., Taylor, B. E. Caenorhabditis sieve: A low-tech instrument and methodology for sorting small multicellular organisms. Journal of Visualized Experiments: JoVE. (137), (2018).
- Burnett, K., Edsinger, E., Albrecht, D. R. Rapid and gentle hydrogel encapsulation of living organisms enables long-term microscopy over multiple hours. Communications Biology. 1, 73(2018).
- Dong, L., et al. Reversible and long-term immobilization in a hydrogel-microbead matrix for high-resolution imaging of Caenorhabditis elegans and other small organisms. PLoS One. 13 (3), 0193989(2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены