Method Article
ניטור הצטברות חלבונים קינטיקה ב Vivo באמצעות ספירת הכללה אוטומטית ב Elegans Caenorhabditis
* These authors contributed equally
In This Article
Summary
כאן, שיטה מוצגת לניתוח של קינטיקה הצטברות חלבון נמטודה Caenorhabditis elegans. בעלי חיים מאוכלוסייה מסונכרנת גיל הם בתמונה בנקודות זמן שונות, ואחריו ספירת הכללה חצי אוטומטית CellProfiler והתאמה למודל מתמטי באמילופיט.
Abstract
הצטברות חלבונים לתכלילים בלתי מסיסים היא סימן היכר של מגוון מחלות אנושיות, שרבות מהן קשורות לגיל. אלגנס Caenorhabditis נמטודה הוא אורגניזם מודל מבוסס היטב כי כבר בשימוש נרחב בתחום כדי ללמוד צבירת חלבון ורעילות. השקיפות האופטית שלו מאפשרת הדמיה ישירה של צבירת חלבונים על ידי מיקרוסקופיה פלואורסצנטית. יתר על כן, מחזור הרבייה המהיר ותוחלת החיים הקצרה הופכים את הנמטודה למודל מתאים לסינון גנים ומולקולות המווסתים את התהליך הזה.
עם זאת, כימות העומס המצרפי בבעלי חיים מתוקנן בצורה גרועה, המבוצע בדרך כלל על ידי ספירת הכללה ידנית תחת מיקרוסקופ ניתוח פלואורסצנטי בנקודת זמן אחת. גישה זו יכולה לגרום לשונות גבוהה בין משקיפים ומגבילה את ההבנה של תהליך הצבירה. לעומת זאת, צבירת חלבונים דמוי עמילואיד במבחנה מנוטרת באופן שגרתי על ידי פלואורסצנטיות T thioflavin באופן כמותי מאוד ונפתר בזמן.
כאן מוצגת שיטה אנלוגית לניתוח לא משוחד של קינטיקה מצטברת ב- C. elegans החיים, תוך שימוש במיקרוסקופ קונפוקלי בעל תפוקה גבוהה בשילוב עם ניתוח תמונה מותאם אישית והתאמת נתונים. הישימות של שיטה זו מודגמת על ידי ניטור היווצרות הכללה של חלבון פוליגלוטמין (polyQ) שכותרתו פלואורסצנטית בתאי השריר של דופן הגוף. זרימת העבודה של ניתוח התמונה מאפשרת לקבוע את מספר ההכללות בנקודות זמן שונות, המותאמות למודל מתמטי המבוסס על אירועי גרעין עצמאיים בתאי שריר בודדים. השיטה המתוארת כאן עשויה להיות שימושית כדי להעריך את ההשפעות של גורמי פרוטאוסטזיס וטיפולים פוטנציאליים למחלות צבירה של חלבונים בחיה חיה בצורה חזקה וכמותית.
Introduction
הצטברות של חלבונים שלא טופלו בטעות לתוך מרבצים בלתי מסיסים מתרחשת במגוון רחב של מחלות. דוגמאות ידועות הן הצטברות של עמילואיד-β וטאו במחלת אלצהיימר, α-סינוקלאין במחלת פרקינסון, וציד עם polyQ מורחב במחלת הנטינגטון 1,2. הטיוח השגוי של פוליפפטידים אלה לתוך סיבי עמילואיד קשורה רעילות ומוות תאים על ידי מנגנונים שעדיין לא ברורים במידה רבה. הבהרת המנגנונים של היווצרות עמילואיד תהיה חיונית לפיתוח טיפולים יעילים, שאינם זמינים כרגע.
חקירות מפורטות של היווצרות עמילואיד בוצעו במבחנה בהתבסס על מדידות פלואורסצנטיות T thioflavin, מה שמוביל להבנה מכנית של תהליך הצבירה ואת ההשפעה של מולקולות מעכבות 3,4,5. עם זאת, לא ברור אם אותם מנגנוני צבירה נכונים בסביבה המורכבת של תאים חיים ואורגניזמים. תולעת הנמטודה Caenorhabditis elegans היא אורגניזם מודל מתאים ללמוד צבירת חלבון ב vivo. יש לו אנטומיה פשוטה יחסית אבל מורכב מרקמות מרובות, כולל שריר, מעי, ומערכת עצבים. הוא מאופיין היטב מבחינה גנטית, וכלים לשינוי גנטי זמינים. יתר על כן, יש לו זמן דור קצר של ~ 3 ימים ותוחלת חיים כוללת של 2-3 שבועות. ככזה, צבירה של חלבונים ניתן לבחון על פני תוחלת החיים של החיה על ציר זמן נוח ניסיוני. לבסוף, הנמטודה שקופה אופטית, ומאפשרת מעקב אחר צבירה של חלבונים המסומנים בפלואורסצנטיות בבעלי חיים.
תכונות אלה של C. elegans נוצלו בעבר כדי לחקור את הצטברות של חלבונים polyQ כמודל למחלות הרחבה של הנטינגטון ופוליאק אחרים. מעל הסף הפתוגניים של 35-40 שאריות גלוטמין, ניתן לראות את חלבוני הפולי-Q המסומנים בחלבון פלואורסצנטי צהוב (YFP) כדי ליצור תכלילים בלתי מסיסים ברקמת השריר 6,7, נוירונים8 והמעי 9,10. תכונות אלה היו בשימוש נרחב כדי לסנן עבור גנים 11,12,13 ומשלי מולקולות קטנות14 של צבירת חלבון ורעילות.
ל- C. elegans יש פוטנציאל לשחק תפקיד חשוב בגישור על הפער בין מחקרי הפריה חוץ גופית של צבירת חלבונים למודלים מורכבים יותר של מחלות כגון עכברים15. C. elegans הוא מקובל על סינון סמים16 אבל יכול גם להיות מנוצל כדי לקבל הבנה בסיסית של המנגנונים המולקולריים של צבירת חלבון ב vivo, כפי שהוכח לאחרונה17. עם זאת, עבור שני היישומים, יש חשיבות עליונה כדי לחלץ מידה כמותית לשחזור של צבירת חלבון. כאן, זה מושג באמצעות מיקרוסקופ קונפוקלי בעל תפוקה גבוהה בשילוב עם צינור ניתוח תמונה ייעודי (איור 1).
Protocol
1. גידול של אוכלוסייה מסונכרנת גיל של C. elegans
- לשמור על זני C. elegans על צלחות בינוני צמיחה נמטודה (NGM) זרע עם Escherichia coli OP50 ב 20 °C (50 °F) על פי נהלים סטנדרטיים18.
- בצע הטלת ביצה מסונכרנת על ידי הצבת 10 נמטודות בוגרות על צלחת NGM 6 ס"מ זרעים עם פיק תולעים פלטינה. השאירו את המבוגרים להטיל ביצים במשך ~ 2 שעות ב 20 °C (50 °F) לפני הסרתם. הכן 1-4 צלחות לכל זן, בהתאם לפוריות של הזן ואת מספר נקודות הזמן שיש לקחת.
- מניחים את הצלחות עם ביצים באינקובטור ב 20 °C (50 °F). עקוב אחר התפתחות בעלי החיים עד שהם מגיעים לבגרות.
הערה: היום שבו בעלי החיים הגיעו לבגרות מוגדר כאן כיום 1. בדרך כלל, זה שלושה ימים לאחר הטלת הביצה. - החל מהיום הראשון, העבירו את החיות ללוחות גז טבעיים חדשים מדי יום כדי להפריד אותם מצאצאיהם. כדי לפצות על בעלי חיים שמתים או הולכים לאיבוד במהלך ההעברה, להעביר ~ 40 בעלי חיים לכל זן פעמים את מספר הנקודות שיש לדמיין (ראה שלב 2). המשך עד שבעלי החיים יפסיקו להטיל ביצים מופרות (~ יום 6 לבגרות).
הערה: אל תכלול בעלי חיים עם אריזה או פנוטיפים התפתחותיים אחרים. אריזה נצפתה בדרך כלל בזנים המבטאים חלבונים בעלי נטייה לצבירה.
2. הכנה מדגם של C. elegans בצלחת multiwell
הערה: מכיוון שהליך ההדמיה דורש הרדמה שבסופו של דבר תהרוג את בעלי החיים, לא ניתן לעשות שימוש חוזר באותם בעלי חיים לנקודות הזמן הבאות. במקום זאת, בעלי חיים שונים מאותה אצווה מסונכרנת גיל הם בתמונה בימים שונים. למרות שרוב הזנים יהיו מעט תכלילים ביום 1, מומלץ לכלול נקודת זמן זו כבסיס.
- הכן את צלחת 384-well על ידי מילוי המספר הנדרש של בארות עם 100 μL של מאגר M9 בתוספת 25 mM NaN3 כמו הרדמה. מלאו באר אחת לכל זן כדי להיות בתמונה.
הערה: נתרן אזיד (NaN3) רעיל ויש לטפל בו בזהירות. - עבור כל זן, להעביר 20 בעלי חיים לתוך באר אחת באמצעות פיק תולעת פלטינה.
הערה: התולעים חייבות להיות ממוקמות מחוץ למדשאת החיידקים לפני הצבתן בבאר. חיידקים גורמים לבעלי החיים לדבוק בבחירת התולעים, מה שיכול למנוע את שחרורם ויערפל את תכולת הבאר. בדרך כלל, 20 הוא המספר האופטימלי של בעלי חיים לבאר כדי למנוע חפיפה בין התולעים תוך הגבלת הדמיה מיותרת של שטח באר ריקה. - לכסות את הצלחת עם המכסה כדי למנוע אידוי, ולדמות את הצלחת בתוך 1 שעות לאחר ההכנה.
- חזור על שלבים 2.1-2.3 מדי יום עד שתגיע רמה קבועה במספרי ההכללה או עד שרוב בעלי החיים ימותו. בצע את הכנת המדגם והדמיה באותו זמן בכל יום כדי להבטיח מרווחים של 24 שעות.
3. רכישת תמונה במיקרוסקופ הקונפוקלי בעל התפוקה הגבוהה
הערה: ניתן גם להגדיר ניסוי זה במיקרוסקופ קונפוקלי רגיל של דיסק מסתובב עם מחזיק לוח רב-תכליתי. מצלמה עם שדה ראייה גדול מועילה כדי להגביל את מספר האריחים הדרושים לצילום כדי להשתרע על פני הבאר כולה. עיין בטבלת החומרים לקבלת פרטים אודות המיקרוסקופ והתוכנה המשמשים בפרוטוקול זה.
- הפעל את המכשיר ופתח את התוכנה.
- התחל פרוטוקול חדש על-ידי מעבר אל הגדרות מדידה | חדש. בחר את סוג הלוחות הרב-תכליתי הנכון ולחץ על צור הגדרת מדידה חדשה.
- הגדר את הערוץ עבור פלואורסצנטיות על ידי מעבר ל Ch 1. הגדר את המטרה ל - 10x. בחר 488 ננומטר כמקור האור ו - BP525/25 כמסנן הפליטה ל- YFP התמונה. הגדר את binning ל - 2x2 כדי להקטין את גודל הקובץ.
- לחץ על הוסף ערוץ ובחר ברייטפילד כשיטה.
- להוספת תמונת פלואורסצנטית קונפוקלית z-stack למדידה, בחרו ברכישת פלואורסצנטיות תלת-ממדית תחת 'רשימת פעולות'. עבור אל בחר ובחר Ch 1. כדי למזער את גדלי הקבצים, הגדר/י את ״עיבוד תמונה״ למקסימום כך שתמונת ההקרנה המרבית תישמר במקום מחסנית z המלאה.
- לחץ על | רכישה של BF/Ph בחר | פרק 2 לערוץ ברייטפילד.
- לחץ על כפתור ההפעלה (חפש את סמל המשולש המצביע לימין) לצד Unload Well Plates והנח את הצלחת בעלת 384 הבאר במיקרוסקופ.
- תחת רכישת פלואורסצנטיות תלת-ממדית, לחץ על בדוק ובחר תולעים המכילות באר כדי לקבוע את מרחק השינוי האופטימלי שבו התולעים ממורכזות כראוי. הגדר מרחק עולה ל-50 מיקרומטר, מרחק יורד ל-50 מיקרומטר ומרווח חיתוך ל-2 מיקרומטר כדי ללכוד את כל עובי החיות בערימת z.
- מטב את זמן החשיפה כדי לקבל עוצמת אות טובה עבור כל ארבעת הזנים תוך הימנעות מרוויה. השתמש באותו זמן חשיפה עבור כל הזנים ונקודות הזמן.
- בחר את הבארות שיש לצלם תחת הגדרת סריקת צלחת היטב. בחר אריח ורכוש באר שלמה.
- שמור את הגדרת המדידה והתחל את הניסוי על-ידי לחיצה על התחל מדידה. עבור נקודות זמן עוקבות, פתח את אותה הגדרת מדידה והתאם את המרחק המשתנה ואת הבארות שיש לדמות.
4. תפירת תמונות אריחים ב- ImageJ
הערה: שלב זה נדרש רק בעת שימוש במטרה הגדולה מ- 4x, שעבורה התמונה של כל באר נרכשת כאריחים מרובים. בזרימת עבודה זו, תפירת האריחים מתבצעת באמצעות התוכנה החופשית FIJI/ImageJ19 (איור 2). בהתאם למכשיר המשמש בשלב 3, ייתכן שניתן יהיה גם לבצע תפירה ישירות בתוכנה הנלווית.
- הורד את FIJI20 ופתח אותו.
- עבור אל | תוספים | תפירה רשת / אוסף תפירה21.
- בחלון המוקפץ, תפירת רשת/אוסף, בחר את הסוג והסדר שבאמצעותם נאספו האריחים. בחר רשת: שורה אחר שורה וימין ולמטה.
- בחלון הבא, תפירת רשת: רשת: שורה אחר שורה, ימין ולמטה, הוסף את מספר האריחים בכיווני x ו- y. עבור המטרה 10x המשמשת כאן, בחר 2 כגודל הרשת x, 3 כגודל הרשת y ו - 0 כחפיפת האריח.
- לחץ על עיון ובחר את התיקיה המכילה את תמונות TIFF לתפירה.
- הוסף את שם הקובץ המשותף תחת שמות קבצים עבור אריחים, תוך שימוש ב- {i} במיקום מספר האריח בכל שם קובץ.
- שחרר את כל הקופסאות למטה.
- הפעל את התוסף.
- שמור את התמונות המתקבלות כקבצי TIFF לניתוח בשלב הבא.
5. ספירת הכללה אוטומטית באמצעות CellProfiler22
- הורד והתקן את תוכנת ניתוח התמונות בקוד פתוח, CellProfiler23. הורד את צינור InclusionCounting.cpproj מ- github.com/sinnigelab/aggregate-quantification.
- פתח את CellProfiler וגרור את הצינור לחלון שחרר קובץ צינור כאן. לחץ על כן כדי לטעון את הפרוייקט.
- לחץ על מודול הקלט תמונות וגרור את התמונות התפורות לתוך החלון שחרר קבצים ותיקיה כאן.
- לחץ על מודול קלט המטה-נתונים . התאם את הביטוי הרגיל כדי לחלץ משם הקובץ בהתאם לשמות התמונות התפורות.
- לחץ על מודול הקלט NamesandTypes והתאם בחר את קריטריוני הכלל כך שיתאימו לערוצים בשמות הקבצים.
הערה: בהגדרות ברירת המחדל של הצינור, שמות קבצים המכילים BF מזוהים כתמונות Brightfield ונקראים תולעים. שמות קבצים המכילים YFP מזוהים כתמונות פלואורסצנטיות ונקראים פלואורסצנטיות. - לחץ על הצג הגדרות פלט כדי לבחור תיקיית ברירת מחדל לשמירת הפלט מ- CellProfiler.
- לחץ על התחל מצב בדיקה כדי לבדוק את ההגדרות של הצינור באמצעות ערכת נתוני ההדמיה הראשונה. לחץ על הפעל כדי להפעיל את כל המודולים בצנרת או שלב כדי לרוץ דרך מודול הצינור אחד בכל פעם. כדי להתאים את קווי המתאר של התולעת במודול EditObjectsManually , לחץ על עזרה כדי לראות את ההוראות ולחץ על בוצע כדי להמשיך להפעיל את הצינור.
הערה: המדידות שחולצו לא ייוצאו במצב בדיקה. ייתכן שיהיה צורך להתאים את פרמטרי הסף לזיהוי תולעים ותכלילים בהתבסס על הזנים וההגדלה שבהם נעשה שימוש. - לחץ על צא ממצב בדיקה וניתח תמונות.
- פתח את תיקיית הפלט כדי להציג את קבצי הפלט. פתח את התמונות עם שם הקובץ המקורי ואחריו קווי מתאר כדי לבדוק אם התולעים והתכלילים היו בשכבת-על נכונה.
הערה: ניתן למצוא את מספר ההכללות לתולעת בקובץ בשם ExpandedWormObjects. מידע נוסף אודות תמונות הקלט ניתן למצוא בקובץ בשם Image. ניתן לבחור פלט נוסף במודול ExportToSpreadsheet בצבר.
6. התאמה גלובלית של נתוני ספירת הכללה באמצעות AmyloFit5
הערה: שלב זה יכול להתבצע רק כאשר נתונים עבור ריכוזי חלבון מרובים זמינים. עבור Q40-YFP, קבוצה של ארבעה זנים עם רמות שונות של ביטוי יתר בתאי השריר של דופן הגוף נוצרה בעבר17. במקרים אחרים, זנים חדשים צריכים להיווצר באמצעות מיקרו-הנדסה פלסמיד ואינטגרציה גנומית24.
- עבור לפלטפורמת ההתאמה המקוונת החינמית עבור קינטיקה צבירה AmyloFit25. הירשם או היכנס באמצעות חשבון קיים.
הערה: ניתן לגשת לקבלת עזרה נוספת ממדריך נרחב על אופן השימוש ב- AmyloFit. עיין בקישור בפינה הימנית העליונה של דף האינטרנט (לאחר הכניסה) לקבלת מידע נוסף. - כדי להתחיל להשתמש ב- AmyloFit, תן שם לפרוייקט ולחץ על צור פרוייקט. פתח את הפרוייקט על-ידי לחיצה על פתח וצור הפעלה על-ידי מתן שם ולחיצה על צור & לטעון הפעלה.
- לחץ על הוסף נתונים והעלה את הקובץ המכיל את המספר הממוצע של תכלילים לכל בעל חיים, בהתאם לדרישות תבנית הנתונים המוצגות בחלונית הימנית. לחץ על טען נתונים חדשים.
- דלג על שלבי העיבוד המקדים, שאינם נדרשים לנתוני ספירת הכללה, על-ידי הגדרת מספר הנקודות לממוצע עבור היסט נקודת אפס ומספר הנקודות לממוצע עבור הרמה ל- 0. לחץ על שלח. חזור על שלב זה עבור כל ריכוז חלבון (כלומר, כל עמודה בקובץ שהועלה).
- בחרו 'מותאם אישית ' בחלונית 'המודל', הזינו את Ncells*(1-exp(-Kcell*m**(n)*(t-1)) בתיבת המשוואה ולחצו על 'טען מודל'.
הערה: כמו AmyloFit תוכנן במקור לניתוח של נתונים קינטיים מבדיקות הפריה חוץ גופית, מודל מותאם אישית חייב להיות טעון כדי לנתח את נתוני ספירת ההכללה של C. elegans. במשוואה המשמשת כאן, תאי N הם מספר התאים שבהם מתרחשת היווצרות הכללה, תא K הוא קבוע קצב התגרענות, m ריכוז החלבון התאי, ו- n סדר התגובה של התגרענות. - הגדר את סוגי הפרמטרים כקונסט הכללי עבור תאי N, התאמה כללית עבור תא K ו- n ו- Const עבור m. הגדר ערך של תאי N ל- 95 עבור תאי שריר בקיר הגוף וניחוש ראשוני עבור תא K ו - n עד 1. הזינו את הערכים של m לזנים השונים בחלונית השמאלית.
הערה: ניחושים ראשוניים אינם רלוונטיים למודל הפשוט יחסית המשמש כאן. עבור מודלים מורכבים יותר, כדאי להזין אומדן של הערכים הצפויים כדי לקצר את זמן החישוב. - השאירו את מספר דילוגי האגן ללא שינוי ולחצו על 'התאם ' בחלונית המתאימה.
- חלץ את ההתאמה על-ידי לחיצה על הורד נתונים והתאם.
הערה: הפרמטרים שחולצו על-ידי ההתאמה הכללית של המודל יפורטו בפינה השמאלית התחתונה. חלקה של הנתונים וההתאמה תיווצר באופן אוטומטי בחלונית הימנית העליונה. ניתן לחלץ עלילה זו על-ידי לחיצה על הורד PDF והתאמה אישית על-ידי מעבר אל הצג אפשרויות התוויה. לתא K יש יחידות של ריכוז מולקולות-n זמן-1 תא-1. כדי להשוות ערכים עם n שונה, ניתן להמיר את תא K לקצב התגרענות בריכוז חלבון נתון על ידי הכפלתו ב- mn.
תוצאות
השיטה המתוארת כאן (איור 1) שימשה לניתוח קינטיקה מצטברת של מבנה הכולל 40 גלוטמינים הותכו ל-YFP (Q40-YFP). החלבון בא לידי ביטוי תחת שליטתו של מקדם unc-54 , המניע את הביטוי בתאי השריר של דופן הגוף. כמו אלה הם גדולים יחסית וקל לדמיין, השימוש במטרה 10x מספיק כדי לפתור את התכלילים שנוצרו על ידי Q40-YFP ברקמה זו. ארבעה זנים (קווים A-D) פותחו בעבר המבטאים את החלבון בהיקפים שונים כדי להעריך את התלות בריכוז של צבירת polyQ ב vivo17.
אוכלוסיות מסונכרנות גיל של קווים A-D נוצרו על ידי הטלת ביצה 2 שעות, ואחריו העברה יומית ברגע שהצאצאים הגיעו לבגרות. מיום 1 עד יום 10 של הבגרות, 20 בעלי חיים מכל אחד מארבעת הזנים צולמו בצלחת 384-well, באמצעות מיקרוסקופ קונפוקלי בעל תפוקה גבוהה. התמונות של הבארות נרכשו כ-6 אריחים, שנתפרו יחד באמצעות תוסף ב-ImageJ21 (איור 2). התמונות שנתפרו נותחו לאחר מכן באמצעות צינור CellProfiler22 מותאם אישית (איור 3) כדי לכמת את מספר ההכללה הממוצע לכל בעל חיים עבור כל זן ונקודת זמן.
לאחר מכן הותאמו הנתונים למודל מתמטי באמילופיט5 (איור 4). המודל מבוסס על ההנחה כי כל אחד מ-95 תאי השריר של דופן הגוף רוכש באופן עצמאי הכללה אחת על ידי אירוע התגרענות מגביל קצב, ואחריו צמיחה מצטברת מהירה17. ההתאמה הניבה קבוע שיעור התגרענות של 9.9 × 105 מולקולות M-2.1 d-1 תא-1 וסדר תגובה של 2.1, המקביל לקצב התגרענות של 0.38 מולקולות d-1 תא-1 בריכוז חלבון תאי של 1 מ"מ. שני שכפולים ביולוגיים עצמאיים הובילו לערכים תואמים באופן הדוק עבור שיעור התגרענות וסדר התגובה, אשר עולים בקנה אחד עם מחקר קודם באמצעות פרוטוקולדומה 17 (טבלה 1).
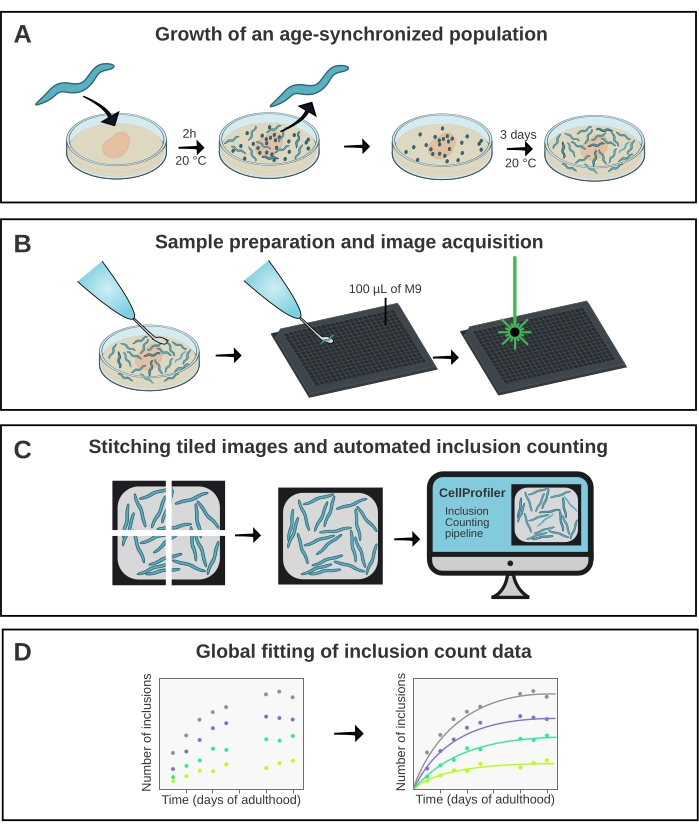
איור 1: סקירה סכמטית של השיטה. (א) אוכלוסיות C. elegans המסונכרנות לגיל נוצרות על ידי הטלת ביצים מתוזמנת. (ב) בעלי חיים מאותה אוכלוסייה מצולמים בלוח של 384 בארות בנקודות זמן שונות. (ג) האריחים תפורים יחד כדי ליצור תמונות של כל הבארות, המנותחות ב- CellProfiler כדי לכמת את מספרי ההכללה לכל בעל חיים. (ד) הנתונים מותאמים למודל מתמטי באמצעות AmyloFit. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
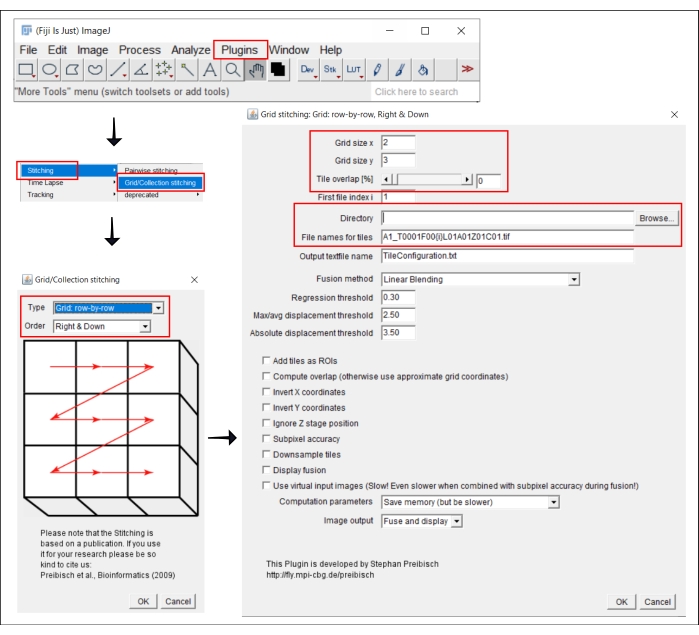
איור 2: צילומי מסך של הליך התפירה ב- ImageJ באמצעות תפירת רשת/אוסףהתוסף 21. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: סכמטית של צינור CellProfiler כדי לכמת מספרי תכלילים. (A-C) תמונת ברייטפילד (A) משמשת לזיהוי התולעים (B, תקריב ב- C). (D-G) תמונת הפלואורסצנטיות (D, תקריב ב- E) משמשת לזיהוי ההכללות (F). התולעים וההכללות קשורות כדי לספק את מספר ההכללות עבור כל תולעת בבאר (G). התמונות המוצגות הן של Q40 קו A בעלי חיים ביום 3 של הבגרות. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
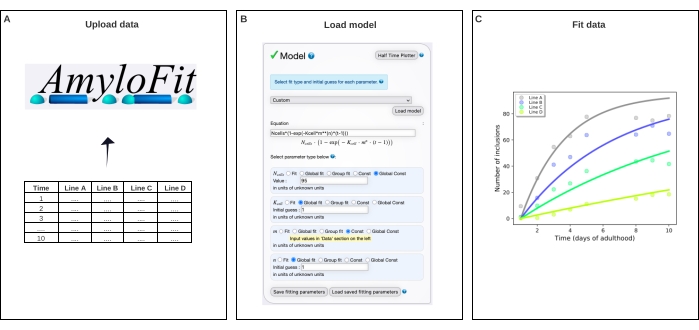
איור 4: התאמת הנתונים למודל מתמטי ב- AmyloFit. (A) הנתונים מועלים ל- AmyloFit. (B) משוואה מותאמת אישית מוזנת להיווצרות הכללת מודל, בהנחה של אירועי התגרענות עצמאיים בכל תא. (ג) התאמת קינטיקה צבירה עבור C. elegans שורות A-D המבטאות רמות שונות של Q40-YFP. הנתונים מייצגים שני משכפלים ביולוגיים עצמאיים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| ערכת נתונים 1 | ערכת נתונים 2 | Sinnige et al.17 | |
| n | 2.1 | 1.9 | 1.6 |
| תא K (מולקולות M-n d-1 תא-1) | 9.9 x 105 | 1.4 x 105 | 3.1 x 104 |
| קצב התגרענות ב 1 מ"מ (מולקולות d-1 תא-1) | 0.38 | 0.21 | 0.35 |
טבלה 1: ערכים של קצב התגרענות וסדר התגובה של צבירת Q40-YFP. נתונים עבור שני משכפלים ביולוגיים עצמאיים של הפרוטוקול והשוואה עם נתונים17 שפורסמו בעבר.
Discussion
השיטה המוצגת במסמך זה מאפשרת ניתוח לא משוחד וכמותי של קינטיקה של צבירת חלבונים במודל אורגניזם C. elegans. זה תלוי בארבעה אלמנטים מרכזיים (איור 1): 1) שמירה על אוכלוסייה מסונכרנת גיל של נמטודות; 2) מיקרוסקופיה פלואורסצנטית בלוחות multiwell; 3) ספירת הכללה אוטומטית ב- CellProfiler; 4) התאמת נתונים באמילופיט. בהשוואה לספירה ידנית של הכללות בבעלי חיים הנעים בחופשיות או מתמונות שמורות26, הכימות ב- CellProfiler הוא מהיר יותר ולא משוחד יותר. ההתקדמות העיקרית הנוספת של הפרוטוקול היא רכישת נתונים קינטיים, ולא נקודות זמן בודדות, המספקות תובנות כמותיות על מנגנון הצבירה בעת התאמת הנתונים למודל מתמטי.
ארבעת הרכיבים של הפרוטוקול יכולים לשמש כמודולים עצמאיים שניתן לשנות בהתאם ליישום. אוכלוסיות מסונכרנות גיל ניתן גם לשמור באמצעות 5-פלואורו-2′-deoxyuridine (FUDR) כדי לחטא את בעלי החיים. תרכובת זו משפיעה על תוחלת החיים ועל פרוטאוסטזיס24,25 והוא מסרטן מאוד לנסיין; עם זאת, הוא מונע העברה ידנית של התולעים, אשר יכול להיות עבודה אינטנסיבית כאשר מספרים גדולים מטופלים. חלופות אחרות הן שימוש במוטנטים סטריליים29 או מכשירי סינון כדי להפריד בין צאצאים30.
ניתן גם להתאים את שלב המיקרוסקופיה הפלואורסצנטית, למשל, באמצעות הגדלות גבוהות יותר לניטור הצטברות חלבונים בתאי עצב. מיקרוסקופיה Widefield עשוי להיות מספיק כדי לפקח על צבירת polyQ בתאי שריר כאשר ההבדל היחסי בין התנאים חשוב יותר מאשר המספרים המוחלטים של תכלילים. צינור CellProfiler עדיין יכול לשמש במקרים אלה, אם כי ההגדרות לזיהוי תולעים ותכלילים יצטרכו להיות מותאמות על ידי המשתמש. התפוקה של הטכניקה מוגבלת כיום על ידי הצורך בקטיף ידני של בעלי החיים לתוך צלחת 384-well. זה יכול להיות מתוקן באופן פוטנציאלי על ידי שימוש במכשירים microfluidic16. נתרן אזיד הוא חומר הרדמה קשה יחסית, אשר יכול להיות מוחלף על ידי אימוביליזציה פיזית עם hydrogels או חרוזים 28,29.
הניתוח באמילופיט המוצג כאן מבוסס על מנגנון צבירה המורכב מאירועי התגרענות עצמאיים בתאים בודדים. במקרים בהם מודל זה אינו מתאים, על המשתמש לשקול חלופה כגון מודל הצבירה השיתופית שפותח בעבר17. מגבלה של גישה זו היא כי זנים המבטאים את החלבון של עניין בריכוזים שונים צריך להיות זמין, אם כי אלה יכולים להיווצר באמצעות שיטות שגרתיות C. elegans 24.
בסך הכל, פרוטוקול זה מספק את האמצעים להשגת נתונים באיכות גבוהה עבור קינטיקה של צבירת חלבונים במערכת מודל in vivo , ומאפשר ניתוח מפורט של מנגנוני צבירה17. למרות שהשיטה הודגמה עבור צבירה polyQ ברקמת השריר C. elegans, יישומים עתידיים של הפרוטוקול עשויים לכלול חלבונים ורקמות אחרים ואת ההשפעות של גורמי פרוטאוסטזיס ומולקולות קטנות.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
אנו מודים למעבדת מורימוטו על זני C. elegans ואזמרלדה בוסמן על הסיוע במיקרוסקופ הקונפוקלי בעל התפוקה הגבוהה. עבודה זו מומנה על ידי מענק סטארט-אפ מאוניברסיטת אוטרכט ל- T.S.
Materials
| Name | Company | Catalog Number | Comments |
| 384-well plate | Greiner | 781091 | Black with flat clear bottom |
| AmyloFit | Knowles lab | v2.0 | Access at www.amylofit.ch.cam.ac.uk |
| C. elegans Q40 line A | Morimoto lab | AM1228 | Genotype rmIs404[unc-54p::Q40::YFP] |
| C. elegans Q40 line B | Morimoto lab | AM1229 | Genotype rmIs404[unc-54p::Q40::YFP] |
| C. elegans Q40 line C | Morimoto lab | AM1230 | Genotype rmIs404[unc-54p::Q40::YFP] |
| C. elegans Q40 line D | Morimoto lab | AM1231 | Genotype rmIs404[unc-54p::Q40::YFP] |
| CellProfiler | Broad Institute | 4.1.3 | Downloaded from https://cellprofiler.org |
| E. coli OP50 | Caenorhabditis Genetics Center (CGC) | OP50 | |
| FIJI | Open-source | (Fiji Is Just) ImageJ v2.1/1.5.3j | Downloaded from https://imagej.net/software/fiji/ |
| High-throughput confocal microscope | Yokogawa | CellVoyager CV7000S | |
| M9 buffer | Home-made | 3 g/L KH2PO4, 6 g/L Na2HPO4, 0.5 g/L NaCl, 1 mM MgSO4 | |
| NGM plates | Home-made | 17 g/L agar, 2.5 g/L bacto-peptone, 3 g/L NaCl, 25 mM KPO4 buffer pH 6.0, 1 mM MgSO4, 1 mM CaCl2, 5 mg/L cholesterol | |
| Pasteur pipette | WU Mainz | 250 | To make worm pick, 150 mm length |
| Platinum iridium wire | Alfa Aesar | 39383 | To make worm pick, 0.25 mm diameter |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Stereomicroscope | Leica | S9 |
References
- Knowles, T. P. J., Vendruscolo, M., Dobson, C. M. The amyloid state and its association with protein misfolding diseases. Nature Reviews. Molecular Cell Biology. 15 (6), 384-396 (2014).
- Chiti, F., Dobson, C. M. Protein misfolding, amyloid formation, and human disease: a summary of progress over the last decade. Annual Review of Biochemistry. 86 (1), 27-68 (2017).
- Knowles, T. P. J., et al. An analytical solution to the kinetics of breakable filament assembly. Science. 326 (5959), 1533-1537 (2009).
- Cohen, S. I. A., et al. Proliferation of amyloid-β42 aggregates occurs through a secondary nucleation mechanism. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9758-9763 (2013).
- Meisl, G., et al. Molecular mechanisms of protein aggregation from global fitting of kinetic models. Nature Protocols. 11 (2), 252-272 (2016).
- Satyal, S. H., et al. Polyglutamine aggregates alter protein folding homeostasis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 97 (11), 5750-5755 (2000).
- Morley, J. F., Brignull, H. R., Weyers, J. J., Morimoto, R. I. The threshold for polyglutamine-expansion protein aggregation and cellular toxicity is dynamic and influenced by aging in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 99 (16), 10417-10422 (2002).
- Brignull, H. R., Moore, F. E., Tang, S. J., Morimoto, R. I. Polyglutamine proteins at the pathogenic threshold display neuron-specific aggregation in a pan-neuronal Caenorhabditis elegans model. Journal of Neuroscience. 26 (29), 7597-7606 (2006).
- Moronetti Mazzeo, L. E., Dersh, D., Boccitto, M., Kalb, R. G., Lamitina, T. Stress and aging induce distinct polyQ protein aggregation states. Proceedings of the National Academy of Sciences of the United States of America. 109 (26), 10587-10592 (2012).
- Prahlad, V., Morimoto, R. I. Neuronal circuitry regulates the response of Caenorhabditis elegans to misfolded proteins. Proceedings of the National Academy of Sciences of the United States of America. 108 (34), 14204-14209 (2011).
- Nollen, E. A. A. Genome-wide RNA interference screen identifies previously undescribed regulators of polyglutamine aggregation. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6403-6408 (2004).
- Silva, M. C., et al. A genetic screening strategy identifies novel regulators of the proteostasis network. PLoS Genetics. 7 (12), 1002438(2011).
- Brehme, M., et al. A chaperome subnetwork safeguards proteostasis in aging and neurodegenerative disease. Cell Reports. 9, 1-16 (2014).
- Calamini, B., et al. Small-molecule proteostasis regulators for protein conformational diseases. Nature Chemical Biology. 8 (2), 185-196 (2012).
- Sinnige, T., Stroobants, K., Dobson, C. M., Vendruscolo, M. Biophysical studies of protein misfolding and aggregation in in vivo models of Alzheimer's and Parkinson's diseases. Quarterly Reviews of Biophysics. 49, 22(2020).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nature Communications. 7, 13023(2016).
- Sinnige, T., et al. Kinetic analysis reveals that independent nucleation events determine the progression of polyglutamine aggregation in C. elegans. Proceedings of the National Academy of Sciences of the United States of America. 118 (11), 202188118(2021).
- Brenner, S. Caenorhabditis elegans. Methods. 77 (1), 71-94 (1974).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- FIJI/ImageJ. , Available from: https://imagej.net/downloads (2012).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Lamprecht, M. R., Sabatini, D. M., Carpenter, A. E. CellProfiler: free, versatile software for automated biological image analysis. BioTechniques. 42 (1), 71-75 (2007).
- CellProfiler. Broad Institute. , Available from: https://cellprofiler.org/releases (2021).
- Mello, C. C., Kramer, J. M., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrachromosomal maintenance and integration of transforming sequences. EMBO Journal. 10 (12), 3959-3970 (1991).
- Knowles group, University of Cambridge. , Available from: https://amylofit.com/amylofitmain/login/ (2021).
- Lazaro-Pena, M. I., Cornwell, A. B., Samuelson, A. V. Quantifying tissue-specific proteostatic decline in Caenorhabditis elegans. Journal of Visualized Experiments: JoVE. (175), (2021).
- Feldman, N., Kosolapov, L., Ben-Zvi, A. Fluorodeoxyuridine improves Caenorhabditis elegans proteostasis independent of reproduction onset. PLoS One. 9 (1), 85964(2014).
- Brunquell, J., Bowers, P., Westerheide, S. D. Fluorodeoxyuridine enhances the heat shock response and decreases polyglutamine aggregation in an HSF-1-dependent manner in Caenorhabditis elegans. Mechanisms of Ageing and Development. 141-142, 1-4 (2014).
- David, D. C., et al. Widespread protein aggregation as an inherent part of aging in C. elegans. PLoS Biology. 8 (8), 47-48 (2010).
- Hunter, S., Maulik, M., Scerbak, C., Vayndorf, E., Taylor, B. E. Caenorhabditis sieve: A low-tech instrument and methodology for sorting small multicellular organisms. Journal of Visualized Experiments: JoVE. (137), (2018).
- Burnett, K., Edsinger, E., Albrecht, D. R. Rapid and gentle hydrogel encapsulation of living organisms enables long-term microscopy over multiple hours. Communications Biology. 1, 73(2018).
- Dong, L., et al. Reversible and long-term immobilization in a hydrogel-microbead matrix for high-resolution imaging of Caenorhabditis elegans and other small organisms. PLoS One. 13 (3), 0193989(2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved