A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحضير الأزيريدين غير المنشط Enantiopure وتخليق البيماميد B و D و epiallo-isomuscarine
In This Article
Summary
في هذه الدراسة ، نقوم بإعداد كل من enantiomers من aziridine-2-carboxylate ، والتي تستخدم في التوليف غير المتماثل للقلويدات ، بما في ذلك biemamide B و D ، و (-)-epiallo-isomuscarine.
Abstract
الأزيريدين المحتوية على النيتروجين غير المتجانسة ذات قيمة صناعية كبيرة لإعداد الجزيئات الحلقية وغير الحلقية. ومع ذلك ، من الصعب جدا والشاق صنع الأزيريدين في أشكال نقية بصريا على نطاق واسع لتطبيق التوليف غير المتماثل لمركبات آزا. لحسن الحظ ، حققنا بنجاح كل من enantiomers (2R) - و (2S) - aziridine-2-carboxylates مع مجموعة α-methylbenzyl المتبرعة بالإلكترون في النيتروجين الدائري كأزيريدين غير نشط. تحتوي أزيريدين البدء هذه على مجموعتين وظيفيتين متميزتين - حلقة ثلاثية الأعضاء شديدة التفاعل وكربوكسيلات متعدد الاستخدامات. وهي قابلة للتطبيق في فتح الحلقة أو تحويل الحلقة مع الأزيريدين وفي تحويل المجموعة الوظيفية إلى الآخرين من الكربوكسيلات. تم استخدام كل من هذه enantiomers في إعداد المركبات الأمينية غير الحلقية المهمة بيولوجيا و / أو aza-heterocyclic بطريقة غير متماثلة. وعلى وجه التحديد، يصف هذا التقرير أول توليف غير متماثل ملائم لكل من مضادات التخدير للمنتجات الطبيعية البحرية من نوع 5 و 6 ديهيدرووراسيل بيماميد B و D كمثبطات محتملة β TGF. يتكون هذا التوليف من تفاعل ريجيو وتفاعل فتح الحلقة الانتقائي المجسمة لأزيريدين -2-كربوكسيلات والتكوين اللاحق ل 4-aminoteterahydropyrimidine-2,4-dione. وتناول مثال آخر في هذا البروتوكول تفاعل موكاياما الانتقائي النمطي للغاية لأزيريدين -2-كربوكسيلات وإثير سيليل إينول، بعد فتح حلقة الأزيريدين داخل الجزيئية لتوفير وصول سهل وسهل إلى (-)-epiallo-isomuscarine.
Introduction
توجد حلقات صغيرة تتكون من السيكلوبروبان والأوكسايران والأزيريدين في مركبات مختلفة مثل المنتجات الطبيعية والأدوية 1,2. يتم استخدامها في المقام الأول كمواد أولية تستغل سلالة الحلقة. من بين المركبات ثلاثية الحلقات ، تمت دراسة أزيريدين على نطاق أقل على نطاق أقل بسبب عدم استقراره وتفاعله الذي لا يمكن السيطرة عليه3. كما هو موضح في خرائط الجهد الكهروستاتيكي (الشكل 1) ، فإن المجموعة المرتبطة بالنيتروجين الحلقي الأزيريدين ، سواء كانت تتبرع بالإلكترون أو تجذب الإلكترون ، تجعل أساسيات النيتروجين مختلفة. يوفر هذا الاختلاف تباينا صارخا مع التفاعل والانتقائية للأزيريدين المقابلين.
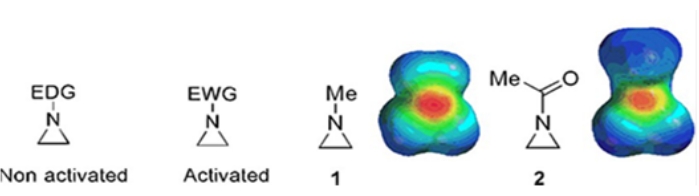
الشكل 1: الهياكل الكيميائية للأزيريدين "المنشطة" و "غير المنشطة" وخرائط الجهد الكهروستاتيكي لأمثلتها التمثيلية N-methylaziridine و N-acetylaziridine4. وقد عدل هذا الرقم بإذن من رانجيث وآخرين(4). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
عندما يحتوي النيتروجين الحلقي على مجموعة سحب الإلكترون ، مثل السلفونات والفوسفونات والكاربامات ، فإننا نسميها أزيريدين "منشطة". هذا هو رد فعل بسهولة مع nucleophiles للتعويض عن عدم استقرارها مع نطاق محدود من regiochemistry. يتم تحضير هذه الأزيريدين المنشطة من خلال طرق حفازة مختلفة وتستخدم كمادة أولية. وقد تعامل الكثير من كيمياء الأزيريدين الحديثة مع هذه الأزيريدين المنشطة. ومع ذلك ، يعاني الأزيريدين المنشط من قيود معينة ناتجة عن عدم استقراره ونطاق رد فعله المحدود لفتحة الحلقة. من ناحية أخرى، فإن الأزيريدين الذين يحملون بدائل للتبرع بالإلكترونات، مثل الألكيل أو مجموعات الألكيل البديلة، في النيتروجين الحلقي المسمى "غير المنشط"4، مستقر نسبيا في معظم الظروف ويمكن تركه على مقاعد البدلاء لفترة طويلة دون تحلل كبير. تحدث تفاعلات فتح الحلقة المحبة للنواة للأزيريدين غير المنشط عن طريق تكوين أيونات الأزيريدينيوم. معظم تفاعلات فتح حلقة أزيريدين وتحولات الحلقة تستمر بطريقة كيميائية ريجيوكيميائية عالية. ومع ذلك ، يناقش عدد قليل جدا من تقارير الأدبيات إعداد أزيريدين نقي بصريا غير منشط مع بدائل في مواضع C2 أو C3 5,6.
توضح هذه الورقة التحضير الناجح لمشتقات أزيرال أزيريدين -2-كربوكسيلات المحتوية على مجموعة α-ميثيل بنزيل، وتحديدا (-)-المنثول (1 R)-فينيل إيثيل أزيريدين -2-كربوكسيلات كخليط دياستيريوميريك له، من تفاعل 2,3-ثنائي برومو بروبيونات و(1R)-فينيل إيثيلامين. ومن هذا الخليط الدياستيريومي، تم الحصول على إنانتيوبيور (1 R)-فينيل إيثيل-(2R)- و(2S)-أزيريدين-2-كربوكسيلات كاسترات (-)-mentholyl الخاصة بهم في أشكال نقية بصريا عن طريق إعادة التبلور الانتقائي من MeOH و n-pentane على مقاييس متعددة الكيلوغرامات (الشكل 1)7. يمكن تحويل استرات المنثول (-) بسهولة إلى استرات الإيثيل أو الميثيل الخاصة بها عن طريق الاسترة في وجود المغنيسيوم أو كربونات البوتاسيوم7. يمكن أيضا تحضير هذه المركبات بسهولة على نطاق مختبري من تفاعلات ألكيل 2,3-ديبروموبروبيونات أو ثلاثي الفينيل من α-كيتوستر مع شيرال 2-فينيل إيثيلامين متبوعا بفصل خليط دياستيريومريك باستخدام كروماتوغرافيا عمود فلاش بسيطة8.
بمجرد أن يكون لدينا enantiopure chiral aziridine-2-carboxylate ، يمكننا توليف العديد من الجزيئات المستهدفة المهمة بيولوجيا المحتوية على النيتروجين الدوري وغير الحلقي بناء على تحولات المجموعة الوظيفية للكربوكسيلات وتفاعلات فتح حلقة الأزيريدين الانتقائية والنمطية للغاية 6,9,10. تم تطبيق أول توليف غير متماثل مناسب لكل من enantiomers من 5 ، 6-dihydrouracil-type Marine Natural Products biemamide B و D كمثبطات TGF-β المحتملة11,12. ثانيا ، تم تحقيق التوليف الانتقائي الدياستيري للكيتونات β-(aziridin-2-yl)-β-hydroxy من خلال تفاعل Mukaiyama aldol من 1-(1-phenylethyl)-aziridine-2-carboxaldehyde النقي بصريا ومختلف silanes enol في وجود ZnCl 2 ، في غلة عالية (>82٪) مع انتقائية نمطية مثالية تقريبا (98:2 dr) عبر حالة انتقالية يتم التحكم فيها بالاستخلاب . تم استخدام هذه للتخليق غير المتماثل لقلويدات epiallo-isomuscarine 13,14,15.
Protocol
1. تخليق خليط دياستيريومريك من أزيريدين شيرال (-)-المنثول استر المشتقة (1)
- أضف 2,3-dibromopropane (-)-menthol ester 1a (5.0 جم ، 13.58 mM ، 1.0 equiv) وقضيب تحريك مغناطيسي إلى قارورة مستديرة القاع ذات رقبتين مجففة في الفرن 250 مل تحت جو النيتروجين (N2).
- أضف الأسيتونيتريل اللامائي (60 مل) إلى قارورة التفاعل باستخدام حقنة محكمة الإغلاق.
- ثم قم بتبريد خليط التفاعل عند 0 درجة مئوية باستخدام حمام ثلجي وحرك خليط التفاعل لمدة 5 دقائق.
- أضف كربونات البوتاسيوم (5.6 جم ، 40.74 mM ، 3.0 مكافئ) إلى خليط التفاعل عند نفس درجة الحرارة واتركه يقلب لمدة 30 دقيقة.
- أضف (2R)-phenylethylamine (2.0 مل ، 16.29 نانومتر ، 1.2 مكافئ) بطريقة قطرية في درجة حرارة الغرفة (RT) واسمح لخليط التفاعل بالتحريك لمدة 12 ساعة.
- رصد تقدم التفاعل باستخدام كروماتوغرافيا الطبقة الرقيقة باستخدام 9: 1 v/v hexane:ethyl acetate (EtOAc; Rf = 0.4) كمفسرة.
- بعد اكتمال التفاعل ، قم بتصفية الخليط فوق ورق الترشيح (حجم المسام 70 مم).
- ثم ، أضف الماء (30 مل) إلى الترشيح العضوي واستخرج الطبقة العضوية باستخدام Et 2 O (2× 50 mL) مرتين باستخدام قمع فاصل.
- جفف المستخلصات العضوية مجتمعة على 7.5 جم من Na2SO4 اللامائية وركز في فراغ (<15 مللي بار) باستخدام مبخر دوار.
ملاحظة: الآن يتم الحصول على خليط خام من ثنائي ستيريومريك أزيرال أزيريدين يحتوي على كل من الأيزومرات من (R) - (1 R ، 2S ، 5 R) -2-isopropyl-5-methylcyclohexyl1-(R) -1-phenylethyl) aziridine-2-carboxylate و (S) - (1 R ، 2 S ، 5 R) - 2-isopropyl-5-methylcyclohexyl1-(R) -1-phenylethyl) aziridine-2-carboxylate (4.1 g ، 90٪). - عزل الأزيريدين الشيرالي (R)-(1R,2S,5R)-2-الأيزوبروبيل-5-ميثيل سيكلوهكسيل 1-(R)-1- فينيل الليثيل)أزيريدين-2-كربوكسيلات (2) بطريقة التبلور الانتقائية
- أضف 8.7 جم من الخليط الخام من مشتق الأزيريدين الشيرال (-)-Menthol ester 1 وتذوب في 70 مل من الميثانول إلى قارورة مستديرة القاع مجففة في الفرن سعة 250 مل.
- الآن قم بتسخين خليط التفاعل حتى 70 درجة مئوية باستخدام حمام ماء ساخن ، ثم قم بتبريد خليط التفاعل عند -10 درجة مئوية حتى تتشكل البلورة الصلبة.
- قم بتصفية المركب الصلب على ورق ترشيح (حجم المسام 70 مم) للحصول على 2.2 جم من (R)-(1R,2S,5R)-2-isopropyl-5-methylcyclohexyl 1-(R)-1-phenylethyl)aziridine-2-carboxylate (2) ester.
- ركز محلول الترشيح مرة أخرى في فراغ (<15 مللي بار) باستخدام مبخر دوار ، وقم بإذابة 50 مل من الإيثانول في خليط التفاعل المتبقي وأعد تبلوره عند -10 درجة مئوية للحصول على 1.2 جم من (R) -(1R ، 2S ، 5R) -2-isopropyl-5-methylcyclohexyl 1-(R)-1-phenylethyl)aziridine-2-carboxylate (2).
- في هذا الوقت ، استخدم الإيثانول الكحولي الآخر بنفس طريقة الميثانول.
- بعد إعادة التبلور ، قم بالتصفية مرة أخرى فوق ورقة ترشيح (حجم المسام 70 مم) ، وركز 5.3 جم المتبقية من محلول الترشيح الخام بالكامل في فراغ (<15 مللي بار) باستخدام مبخر دوار ، وأضف 50 مل من مذيب هيدروكربوني بنتان.
- حافظ على محلول التفاعل المتبقي عند -15 درجة مئوية.
ملاحظة: الآن يتم الحصول على مركب صلب يبلغ حوالي 1.9 غرام من (S)-(1R,2S,5R)-2-isopropyl-5-methylcyclohexyl1-(R)-1-phenylethyl)aziridine-2-carboxylate ester (3). - بعد الحصول على البلورات ، ركز المحلول مرة أخرى في فراغ (<15 مللي بار) باستخدام مبخر دوار وقم بإذابته في 30 مل من مذيب الهيدروكربون البنتان.
- أعد التبلور مرة أخرى عند -15 درجة مئوية للحصول على 0.8 جم من (S)-(1R,2S,5R)-2-isopropyl-5-methylcyclohexyl1-(R)-1-phenylethyl)aziridine-2-carboxylate ester (2').
- الحصول على (R)-إيثيل 1-((R)-1-فينيل إيثيل)أزيريدين-2-كربوكسيلات (3)
- أضف (R)-(1 R,2S,5 R)-2-isopropyl-5-methylcyclohexyl1-(R)-1-phenylethyl)aziridine-2-carboxylate (2) (0.167 جم، 0.57 mM) وقضيب تحريك مغناطيسي في قارورة مستديرة القاع ذات رقبتين مجففة في الفرن 25 مل تحت جو النيتروجين (N 2).
- أضف 1.8 مل من الإيثانول إلى قارورة التفاعل باستخدام حقنة محكمة الإغلاق وحركها على RT.
- ثم أضف كربونات البوتاسيوم (0.40 جم ، 20.28 مليمول ، 4.0 مكافئ) وحركها في RT لمدة يومين.
- راقب تقدم التفاعل باستخدام كروماتوغرافيا الطبقة الرقيقة (eluent, 8:2 v/v, hexane:ethyl acetate (EtOAc), Rf = 0.6).
- بعد اكتمال التفاعل ، قم بتصفية الخليط فوق ورق ترشيح (حجم المسام 70 مم) ، ثم أضف الماء (5 مل) إلى الترشيح العضوي واستخرج الطبقة العضوية باستخدام CH 2 Cl 2 (2× 15 مل) مرتين باستخدام قمع فصل.
- جفف المستخلصات العضوية مجتمعة أكثر من 3.0 جم من Na2SO4 اللامائية وركز في فراغ (<15 مللي بار) باستخدام مبخر دوار.
- تنقية المنتج الخام عن طريق كروماتوغرافيا عمود الطور العادي على هلام السيليكا (70-230 شبكة) لتوفير منتج نقي (R)-إيثيل 1-(R)-1-فينيل ليثيل)أزيريدين-2-كربوكسيلات (3) (950 ملغ، 88٪). Rf (30٪ EtOAc / hexane = 0.50).
2. ريجيو وفتح حلقة أزيريدين الانتقائية المجسمة بواسطة نوكليوفيل أزيد للتخليق الكلي للبيماميد B و biemamide D
- تخليق (R)-إيثيل 2-azido-3-(((R)-1-فينيل ليثيل)أمينو)بروبانوات (5)
- نقل (500 ملغم ، 2.20 مللي متر ، 1.0 ما يعادل) من chiral (S) - ethyl 1-(R) -1-phenylethyl) aziridine-2-carboxylate (4) وشريط تحريك مغناطيسي إلى قارورة مستديرة القاع ذات رقبتين مجففة في الفرن 50 مل تحت جو مفتوح.
- أضف 50٪ من الإيثانول المائي (15 مل) إلى خليط التفاعل.
- يبرد خليط التفاعل عند 0 درجة مئوية ويضاف حمض الكبريتيك المركز (36 نيوتن) قطرة للحفاظ على درجة الحموضة 4.0 تقريبا ، ويحرك لمدة 5 دقائق.
- أضف أزيد الصوديوم (370 مجم ، 5.70 mM ، 2.5 مكافئ) عند 0 درجة مئوية واترك خليط التفاعل يحرك لمدة 10 دقائق عند نفس درجة الحرارة ثم يسخن عند RT.
- ثم ، أضف AlCl 3 ∙6H2O (55 mg ، 0.22 mM ، 0.1 equiv) كمحفز في نفس RT واسمح بالتحريك لمدة3 ساعات إضافية.
- راقب تقدم التفاعل باستخدام كروماتوغرافيا الطبقة الرقيقة (eluent، 6:4 v/v، hexane:ethyl acetate (EtOAc)، Rf = 0.2).
- قم بإخماد خليط التفاعل بجزأين من 20 مل من NaHCO3 المشبع.
- ثم قم بتصفية الخليط الخام فوق وسادة سيليت مع الإيثانول (2 × 10 مل).
- ركز خليط التفاعل في فراغ (<15 مللي بار) باستخدام مبخر دوار.
- استخرج الطبقة العضوية باستخدام CH 2 Cl 2(2 × 50 مل) مرتين باستخدام قمع فاصل.
- ثم جفف الطبقة العضوية مجتمعة على 5.0 غرام من اللامائية Na2SO4 لمدة 5 دقائق.
- ركز الطبقة العضوية الخام في فراغ (<15 مللي بار) باستخدام مبخر دوار لشراء منتج أزيد خام.
- قم بتنقية المنتج الخام باستخدام كروماتوغرافيا عمود الطور العادي على هلام السيليكا (70-230 شبكة) عن طريق التخلص من 40٪ EtOAc / hexane (R f = 0.20) لتوفير 490 ملغ (90٪ عائد) من (R)-ethyl 2-azido-3-((R)-1-phenylethyl)amino) propanoate (5) كسائل لزج.
- تخليق (9H-فلورين-9-yl) ميثيل (3-(((R)-3-ميثيل-2,4-ديوكسو-1-(R)-1 فينيل ليثيل)سداسي هيدرو بيريميدين-5-يل)أمينو)-3-أوكسوبروبيل)كربامات (7)
- نقل 150 ملغ من chiral (R) -5-amino-3-methyl-1-(R)-1-phenylethyl) dihydropyrimidine-2,4 (1H,3H)-dione (6) (150 mg ، 0.60 mM ، 1.0 equiv) وشريط تحريك مغناطيسي إلى قارورة مستديرة القاع ذات رقبتين مجففة في الفرن 25 مل تحت الغلاف الجوي N2.
- أضف CH 2 Cl2الجاف (15.0 مل) إلى قارورة التفاعل باستخدام حقنة محكمة الإغلاق.
- ثم قم بتبريد خليط التفاعل عند 0 درجة مئوية باستخدام حمام ثلجي وحرك خليط التفاعل لمدة 5 دقائق.
- أضف Fmoc-beta-alanine (377 مجم ، 1.20 mM ، 2.0 مكافئ) و DIPEA (0.67 مل ، 3.64 mM ، 6.0 مكافئ) عند 0 درجة مئوية وحركه لمدة 5 دقائق.
- أضف EDCI (347 مجم ، 1.82 mM ، 3.0 مكافئ) و HOBt (165 mg ، 1.21 mM ، 2.0 equiv) إلى خليط التفاعل عند 0 درجة مئوية واتركه يقلب لمدة 10 دقائق عند نفس درجة الحرارة.
- احتفظ بخليط التفاعل في RT واتركه يحرك لمدة 8 ساعات إضافية.
- راقب تقدم التفاعل باستخدام كروماتوغرافيا الطبقة الرقيقة باستخدام (2:8 v/v, hexane:ethyl acetate (EtOAc), Rf = 0.4) ككاشف.
- قم بإخماد خليط التفاعل بالماء (10 مل).
- اغسل الطبقة العضوية المدمجة بمحلول ملحي (15 مل) ، ثم استخرج الطبقة العضوية باستخدام CH 2 Cl2(2 × 20 مل) مرتين باستخدام قمع فاصل.
- ثم جفف الطبقة العضوية المدمجة على 5.0 جم من Na2SO4 اللامائي لمدة 5 دقائق وركز في فراغ (<15 مللي بار) باستخدام مبخر دوار.
- قم بتنقية المنتج الخام باستخدام كروماتوغرافيا عمود الطور العادي على هلام السيليكا (70-230 شبكة) عن طريق التخلص من 80٪ EtOAc / hexane (Rf = 0.40) لتوفير 295 ملغ من (7) (90٪ من العائد).
3. تفاعل Mukaiyama aldol الانتقائي المجسمة مع chiral aziridine-2-carboxaldehyde و regio و stereoselective aziridine ring open by internal hydroxy nucleophile للتوليف الكلي ل (-)- epiallo-somuscarine (17)
- تخليق (S)-4-هيدروكسي-4-(R)-1-(R)-1-فينيل ليثيل)أزيريدين-2-yl)بوتان-2-واحد (12)
- نقل (R)-1-(R)-1-phenylethyl)aziridine-2-carbaldehyde (10) (140 ملغ، 0.8 ملليمتر، 1.0 مكافئ) وقضيب تحريك مغناطيسي إلى قارورة مستديرة القاع ذات رقبتين مجففة في الفرن سعة 25 مل تحت الغلاف الجوي N2.
- أضف CH3CN الجاف (4.0 مل) إلى قارورة التفاعل باستخدام حقنة محكمة الإغلاق.
- ثم قم بتبريد خليط التفاعل عند -20 درجة مئوية باستخدام حمام الأسيتون الجليدي وحرك خليط التفاعل لمدة 5 دقائق.
- أضف ZnCl2 اللامائي (108 ملغ ، 0.8 mM ، 1.0 مكافئ) إلى خليط التفاعل عند -20 درجة مئوية واتركه يقلب لمدة 5 دقائق.
- ثم أضف ثلاثي ميثيل (prop-1-en-2-yloxy) سيلان (11) (104 ملغ ، 0.8 مللي متر ، 1.0 مكافئ) مذاب في CH 3 CN الجاف (3.0مل) إلى خليط التفاعل عند -20 درجة مئوية بطريقة قطرية واترك خليط التفاعل يحرك لمدة ساعة واحدة في نفس درجة الحرارة.
- راقب تقدم التفاعل باستخدام كروماتوغرافيا الطبقة الرقيقة باستخدام 8: 2 v / v hexane: خلات الإيثيل (EtOAc) ، Rf = 0.2) كشفاف.
- قم بإخماد خليط التفاعل باستخدام NaHCO3 المشبع (4 مل).
- استخراج الطبقة العضوية مع EtOAc (2 × 15 مل) مرتين باستخدام قمع فصل.
- جفف الطبقة العضوية المدمجة مع 3.0 غرام من Na2SO4 اللامائي وركز في فراغ (<15 مللي بار) باستخدام مبخر دوار.
- تنقية المنتج الخام باستخدام كروماتوغرافيا عمود الطور العادي على هلام السيليكا (70-230 شبكة) عن طريق التخلص من 80٪ EtOAc / hexane ، (R f = 0.20) لتوفير 58 ملغ من (S) -4-hydroxy-4-((R)-1-(R)-1-phenylethyl)aziridin-2-yl)butan-2-one) (12) (85٪ العائد).
- تخليق (R)-N-(((2 R,3 S,5 R)-3-((tert-butyldimethylsilyl)oxy)-5-methyltetra hydrofuran-2-yl)methyl)-1-phenylethanamine (15)
- نقل (S)-4-((tert-butyldimethylsilyl)oxy)-4-(R)-1-(R)-1-phenylethyl) aziridin-2-yl)butan-2-one (13) (400 mg, 1.15 mM, 1.0 equiv) وقضيب تحريك مغناطيسي إلى قارورة مستديرة القاع ذات رقبتين مجففة في الفرن 25 مل تحت الغلاف الجوي N2.
- أضف THF اللامائي (50 مل) إلى قارورة التفاعل باستخدام حقنة محكمة الإغلاق.
- يبرد خليط التفاعل على درجة حرارة -78 درجة مئوية باستخدام حمام ثلج أسيتون جاف ويترك للتحريك لمدة 5 دقائق.
- ثم أضف الليثيوم ثلاثي الثواني - بوتيل بوروهيدريد (L-selectride) (محلول 1 M في THF) (2.3 مل ، 2.0 مكافئ) قطرة إلى خليط التفاعل عند -78 درجة مئوية واتركيه يحرك لمدة 25 دقيقة أخرى.
- قم بتسخين خليط التفاعل إلى RT واتركه يقلب لمدة 8 ساعات.
- راقب تقدم التفاعل بواسطة TLC باستخدام 30٪ EtOAc / hexane (Rf = 0.40) كمكافئ.
- بعد الاستهلاك الكامل للمركب 13 ، قم بإخماد خليط التفاعل ب 0.1 M من NaOH (5 مل).
- استخراج الطبقة العضوية مع EtOAc (3 × 15 مل) ، ثم يغسل مع محلول ملحي (15 مل).
- جفف الطبقة العضوية التي تزيد عن 3.0 جم من Na2SO4 اللامائية وركز في فراغ (<15 مللي بار) باستخدام مبخر دوار.
- قم بتنقية المنتج الخام باستخدام كروماتوغرافيا عمود الطور العادي على هلام السيليكا (70-230 شبكة ، eluent ، 8: 2 v / v ، hexane: خلات الإيثيل (EtOAc) ، Rf = 0.2) لتوفير مركب نقي (15) (382 ملغ ، 95٪ عائد).
- تخليق (-)-epiallo-isomuscarine يوديد (17)
- انقل المركب 16 (20 مجم ، 0.15 مل ، 1.0 مكافئ) وقضيب تحريك مغناطيسي إلى قارورة مستديرة القاع 10 مل مجففة في الفرن تحت الغلاف الجوي N2 .
- أضف 3 مل من قارورة تفاعل EtOAc باستخدام حقنة محكمة الإغلاق.
- ثم أضف يوديد الميثيل (0.4 مل ، 3.0 ملليمتر) إلى خليط التفاعل في RT.
- أضف 1,2,2,6,6-خماسي ميثيل بيبيريدين (PMP) (0.05 مل، 0.3 مل، 2.0 مكافئ) إلى خليط التفاعل عند 0 درجة مئوية.
- ثم ، احتفظ بخليط التفاعل في RT واتركه يحرك لمدة 16 ساعة إضافية.
- تبخر المذيب في فراغ (<15 مللي بار) باستخدام مبخر دوار لإعطاء المنتج الخام.
- يغسل ثلاث مرات عن طريق إضافة (3 × 5 مل) 10٪ MeOH في EtOAc إلى خليط التفاعل الخام.
- ثم اغسل الخليط الخام مع n-Pentane (5 مل) وركز تحت الفراغ (<15 مللي بار) باستخدام مبخر دوار لتحقيق يوديد نقي (-)-epiallo-isomuscarine (17) (32 ملغ ، 68٪).
4. توصيف جميع المنتجات
- توصيف جميع المركبات الجديدة بواسطة 1 H ، 13C NMR spectroscopy ، وقياس الطيف الكتلي عالي الدقة (HRMS) 7،8،11.
النتائج
هنا ، نبلغ عن توليف enantiopure aziridine-2-carboxylates. تم تحضير الخليط الدياستيريوميري من (R)-(1 R,2 S,5 R)-2-isopropyl-5-methylcyclohexyl1-(R)-1-phenylethyl)aziridine-2-carboxylate (2) و (S)-(1R,2S,5R)-2-isopropyl-5-methylcyclohexyl1-(R)-1-phenylethyl)aziridine-2-carboxylate (3) (4.1 g, 90٪) في محصول كمي من 2,3 -dibromopropane (-)-mentholyl ester و (1
Discussion
الأزيريدين كدورات غير متجانسة تحتوي على ثلاثة أعضاء تحتوي على النيتروجين لديها إمكانات هائلة لبدء الحياة القتالية الاصطناعية أو الوسيطة لإعداد جزيئات عضوية غنية بالنيتروجين. استنادا إلى المجموعة التي تحمل النيتروجين الحلقي ، يتم تصنيفها على أنها أزيريدينات "منشطة" و "غير منشطة" يختلف تف...
Disclosures
يعلن المؤلفون أنه لم يكن هناك تضارب في المصالح في هذه الدراسة.
Acknowledgements
تم دعم هذا البحث من قبل المؤسسة الوطنية للبحوث في كوريا (NRF-2020R1A2C1007102 و 2021R1A5A6002803) مع مركز الاتجاهات الجديدة في التوليف العضوي ومنحة HUFS 2022.
Materials
| Name | Company | Catalog Number | Comments |
| (2R)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester, 98% | Sigma-Aldrich | 57054-0 | |
| (2S)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester | Sigma-Aldrich | 57051-6 | |
| 1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride | TCI | 424331-25 g | CAS No: 25952-53-8 |
| 1,4-Dioxane | SAMCHUN | D0654-1 kg | CAS No: 123-91-1 |
| 1-Hydroxybenzotriazole hydrate | Aldrich | 219-989-7-50 g | CAS No: 123333-53-9 |
| 2,6-Lutidine | Alfa Aesar | A10478-AP, 500 mL | CAS No: 108-48-5 |
| Acetonitrile | SAMCHUN | A0127-18 L | CAS No: 75-05-8 |
| Acetonitrile-d3 | Cambridge Isotope Laboratories, | 15G-744-25 g | CAS No: 2206-26-0 |
| Aluminum chloride hexahydrate | Aldrich | 231-208-1, 500 g | CAS No : 7784-13-6 |
| Bruker AVANCE III HD (400 MHz) spectrometer | Bruker | NA | |
| Chloroform-d | Cambridge Isotope Laboratories, | 100 g | CAS No: 865-49-6 |
| Dichloromethane | SAMCHUN | M0822-18 L | CAS No: 75-09-2 |
| Dimethyl sulfoxide-d6 | Cambridge Isotope Laboratories, | 25 g | CAS No: 2206-27-1 |
| Ethanol | EMSURE | 1009831000,1L | CAS No: 64-17-5 |
| Ethyl acetate | SAMCHUN | E0191-18 L | CAS No: 141-78-6 |
| High resolution mass spectra/MALDI-TOF/TOF Mass Spectrometry | AB SCIEX | 4800 Plus | High resolution mass spectra |
| JASCO P-2000 | JASCO | P-2000 | For optical rotation |
| Lithium aluminum hydride | TCI | L0203-100 g | CAS No: 16853-85-3 |
| L-Selectride, 1 M solution in THF | Acros | 176451000, 100 mL | CAS No: 38721-52-7 |
| Methanol | SAMCHUN | M0585-18 L | CAS No: 67-56-1 |
| N-[(9H-Fluoren-9-ylmethoxy)carbonyl]-β-alanine | TCI | F08825G-5 g | CAS No: 35737-10-1 |
| N-Ethyldiisopropylamine | Aldrich | 230-392-0, 100 mL | CAS No: 7087-68-5 |
| n-Hexane | SAMCHUN | H0114-18 L | CAS No: 110-54-3 |
| Ninhydrin | Alfa Aesar | A10409-250 g | CAS No: 485-47-2 |
| p-Anisaldehyde | aldrich | A88107-5 g | CAS No: 123-11-5 |
| Phosphomolybdic acid hydrate | TCI | P1910-100 g | CAS No: 51429-74-4 |
| Sodium azide | D.S.P | 703301-500 g | CAS No: 26628-22-8 |
| Sodium Hydride 60% dispersion in mineral oil | Sigma-Aldrich | 452912-100 G | CAS No: 7646-69-7 |
| Sodium hydroxide | DUKSAN | A31226-1 kg | CAS No: 1310-73-2 |
| Sodium sulfate | SAMCHUN | S1011-1 kg | CAS No: 7757-82-6 |
| Thin Layer Chromatography (TLC) | Merck | 100390 | |
| Tert-Butyldimethylsilyl trifluoromethanesulfonate, 98% | Aldrich | 274-102-0, 25 g | CAS NO: 69739-34-0 |
| Tetrahydrofuran | SAMCHUN | T0148-18 L | CAS No: 109-99-9 |
| Triethylethylamine | DAEJUNG | 8556-4400-1 L | CAS No: 121-44-8 |
| UV light | Korea Ace Sci | TN-4C | 254 nm |
| Zinc chloride, anhydrous, 98+% | Alfa Aesar | A16281-22100 g | CAS No : 7646-85-7 |
References
- Pitzer, K. S. Strain energies of cyclic hydrocarbons. Science. 101 (2635), 672 (1945).
- Dudev, T., Lim, C. Ring strain energies from ab initio calculations. Journal of the American Chemical Society. 120 (18), 4450-4458 (1998).
- D'hooghe, M., Ha, H. -. J. . Synthesis of 4- to 7-Membered Heterocycles by Ring Expansion. , (2016).
- Ranjith, J., Ha, H. -. J. Synthetic applications of aziridinium ions. Molecules. 26 (6), 1744 (2021).
- Sweeney, J. B. Aziridines: epoxides' ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Stankovic, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Lee, W. K., Ha, H. -. J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Tranchant, M. J., Dalla, V., Jabin, I., Decroix, B. Reaction of vinyl triflates of α-keto esters with primary amines: efficient synthesis of aziridine carboxylates. Tetrahedron. 58 (42), 8425-8432 (2002).
- Ha, H. -. J., Jung, J. -. H., Lee, W. K. Application of regio- and stereoselective functional group transformation of chiral aziridine-2-carboxylate. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- Kim, Y., et al. Preparation of 2,3-diaminopropionate from ring opening of aziridine-2-carboxylate. Tetrahedron Letters. 46 (25), 4407-4409 (2005).
- Srivastava, N., Macha, L., Ha, H. -. J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Zhang, F., et al. Biemamides A-E, inhibitors of the TGF-β pathway that block the epithelial to mesenchymal transition. Organic Letters. 20 (18), 5529-5532 (2018).
- Srivastava, N., Ha, H. -. J. Highly efficient and stereoselective Mukaiyama Aldol reaction with chiral aziridine-2-carboxaldehyde and its synthetic applications. Asian Journal of Organic Chemistry. 11 (1), 2021005671 (2021).
- Kempter, I., et al. Synthesis and structural characterization of the isomuscarines. Tetrahedron. 70 (10), 1918-1927 (2014).
- Pirrrung, M. C., DeAmicis, C. V. Total synthesis of the muscarines. Tetrahedron Letters. 29 (2), 159-162 (1988).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved