A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הכנת אזירידינים לא פעילים של אננטיופור וסינתזה של ביאמאמיד B, D ואפיאלו-איזומוסקרין
In This Article
Summary
במחקר זה אנו מכינים את שני האננטיומרים של אזירידין-2-קרבוקסילאט, המשמשים בסינתזה האסימטרית של אלקלואידים, כולל ביאממיד B ו-D, ו-(-)-אפיאלו-איזומוסקרין.
Abstract
אזירידינים הטרוציקלים המכילים חנקן הם בעלי ערך רב מבחינה סינתטית להכנת מולקולות אזציקליות ואציקליות. עם זאת, קשה מאוד ומייגע לעשות אזירידינים בצורות טהורות אופטית בקנה מידה גדול כדי ליישם סינתזה אסימטרית של תרכובות אזה. למרבה המזל, השגנו בהצלחה גם את האננטיומרים (2R)- וגם את (2S)-אזירידין-2-קרבוקסילאטים עם קבוצת α-מתילבנזיל התורמת אלקטרונים בחנקן הטבעתי כאזירידינים שאינם מופעלים. לאזירידינים ההתחלתיים האלה יש שתי קבוצות פונקציונליות נפרדות - טבעת תלת-איברית תגובתית מאוד וקרבוקסילאט רב-תכליתי. הם ישימים בפתיחת טבעת או בהתמרת טבעת עם אזירידין ובטרנספורמציה קבוצתית פונקציונלית לאחרים מקרבוקסילאט. שני האננטיומרים הללו שימשו להכנת תרכובות אמינו-ציקליות חשובות מבחינה ביולוגית ו/או אזה-הטרוציקליות באופן אסימטרי. באופן ספציפי, דו"ח זה מתאר את הסינתזה האסימטרית המהירה הראשונה של שני האננטיומרים של מוצרים טבעיים ימיים מסוג 5, 6-dihydrouracil, ביאמאמיד B ו-D כמעכבי TGF-β פוטנציאליים. סינתזה זו כללה רג'יו- ותגובת פתיחת הטבעת הסטריאו-סלקטיבית של אזירידין-2-קרבוקסילאט ולאחר מכן היווצרות של 4-אמינוטטראהירופירימידין-2,4-דיון. דוגמה נוספת בפרוטוקול זה עסקה בתגובת מוקיאמה סטריאו-סלקטיבית מאוד של אתר אזירידין-2-קרבוקסילאט וסליל אנול, בעקבות פתיחת טבעת אזירידין תוך-מולקולרית כדי לספק גישה קלה ופאזית ל-(-)-epiallo-isomuscarine.
Introduction
טבעות קטנות המורכבות מציקלופרופנים, אוקסירנים ואזירידינים נמצאות בתרכובות שונות כגון מוצרים טבעיים ותרופות 1,2. הם משמשים בעיקר כחומרי התחלה המנצלים את זן הטבעת שלהם. בין התרכובות בעלות שלוש הטבעות, אזירידין נחקר פחות בהרחבה בשל חוסר היציבות והתגובתיות הבלתי נשלטת שלו3. כפי שניתן לראות במפות הפוטנציאל האלקטרוסטטי (איור 1), קבוצה המחוברת לטבעת-חנקן אזירידין, בין אם היא תורמת אלקטרונים או מושכת אלקטרונים, הופכת את הבסיס של חנקן לשונה. הבדל זה מספק ניגוד בולט לתגובתיות ולסלקטיביות של האזירידינים המתאימים.
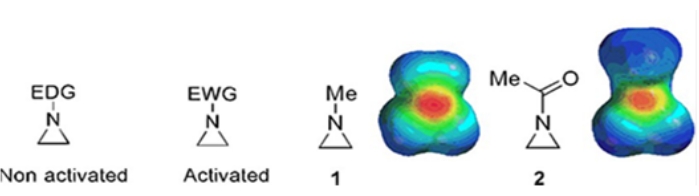
איור 1: מבנים כימיים של אזירידינים "פעילים" ו"לא מופעלים" ומפות פוטנציאל אלקטרוסטטיות של הדוגמאות הייצוגיות שלהם N-מתיללייזרידין ו-N-אצטילאזירידין4. נתון זה שונה באישורם של Ranjith et al.4. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
כאשר לחנקן הטבעתי יש קבוצה מושכת אלקטרונים, כגון סולפונט, פוספונאט וקרבמט, אנו קוראים לו אזירידין "מופעל". זה מגיב בקלות עם נוקליאופילים כדי לפצות על חוסר היציבות שלה עם היקף מוגבל של regiochemistry. אזירידינים פעילים אלה מוכנים בשיטות קטליטיות שונות ומשמשים כחומר מוצא. הרבה מהכימיה של אזירידין לאחרונה עסקה באזירידינים המופעלים האלה. עם זאת, אזירידינים פעילים סובלים ממגבלות מסוימות הנובעות מחוסר היציבות שלהם ומהיקף התגובה המוגבל של פתח הטבעת. מצד שני, אזירידינים הנושאים תחליפים התורמים אלקטרונים, כמו אלקיל או קבוצות אלקיל חלופיות, בטבעת חנקן הנקראת "לא מופעלת"4, הם יציבים יחסית ברוב הנסיבות וניתן להשאירם על הספסל במשך זמן רב ללא פירוק משמעותי. תגובות פתיחת הטבעת הנוקלאופיליות של אזירידין שאינו מופעל מתרחשות באמצעות היווצרות יוני אזירידיניום. רוב התגובות של פתיחת טבעת אזירידין וטרנספורמציות טבעת מתנהלות באופן רג'יכימי מאוד. עם זאת, מעט מאוד דיווחי ספרות דנים בהכנת אזירידינים טהורים אופטית שאינם מופעלים עם תחליפים במיקומי C2 או C3 5,6.
מאמר זה מראה את ההכנה המוצלחת של נגזרות α-מתילבנזיל המכילות קבוצת כיראליות המכילות כיראליות אזירידין-2-קרבוקסילאט, במיוחד (-)-מנטוליל (1R)-פנילאתילאזירידין-2-קרבוקסילאטים כתערובת דיאסטרומרית, מתגובה של 2,3-דיברומופרופיונאט ו-(1R)-פנילאתילאמין. מתערובת דיאסטריאומרית זו, אננטיופור (1R)-פנילאתיל-(2R)- ו-(2S)-אזירידין-2-קרבוקסילאטים כאסטרים (-)-מנטוליל שלהם התקבלו בצורות טהורות אופטית על ידי רקורסיסטליזציה סלקטיבית מ-MeOH ו-n-פנטאן על סולמות של מאות קילו (איור 1)7. אסטרים (-)-מנטוליל אלה יכולים להיות מומרים בקלות לאסטרי האתיל או המתיל שלהם על ידי טרנסאסטריפיקציה בנוכחות מגנזיום או אשלגן קרבונט7. תרכובות אלה יכולות גם להיות מוכנות בקלות בקנה מידה מעבדתי מהתגובות של אלקיל 2,3-דיברומופרופיונאטים או טריפלאט ויניל של α-קטוסטר עם כיראלי 2-פניל-אתילאמין ואחריו הפרדת התערובת הדאסטרומרית באמצעות כרומטוגרפיה פשוטה של עמודי פלאש8.
ברגע שיש לנו אננטיופור כיראלי אזירידין-2-קרבוקסילאט, אנו יכולים לסנתז מולקולות מטרה מחזוריות ואציקליות שונות המכילות חנקן חשוב מבחינה ביולוגית בהתבסס על טרנספורמציות קבוצתיות פונקציונליות של קרבוקסילאט ותגובות פתיחה של טבעת אזירידין רג'יו וסטריאוזלקטיביתמאוד 6,9,10. הסינתזה האסימטרית המהירה הראשונה יושמה עבור שני האננטיומרים של מוצרים טבעיים ימיים מסוג 5, 6-dihydrouracil, ביאמאמיד B ו-D כמעכבי TGF-β פוטנציאליים11,12. שנית, הסינתזה הדיאסטרואוזלקטיבית של β-(aziridin-2-yl)-β-הידרוקסי קטונים הושגה על ידי תגובת Mukaiyama aldol של 1-(1-פנילאתיל) טהור אופטית-אזירידין-2-קרבוקלדהיד וסילאנים שונים של אנול בנוכחות ZnCl2, בתפוקה גבוהה (>82%) עם סטריאוסלקטיביות כמעט מושלמת (98:2 dr) באמצעות מצב מעבר מבוקר כלציה. אלה שימשו לסינתזה אסימטרית של אלקלואידים אפילולו-איזומוסקרינים 13,14,15.
Protocol
1. סינתזה של תערובת דיאסטריאומרית של אזירידין כיראלי (-)-מנטול אסטר נגזרת (1)
- הוסיפו 2,3-דיברומופרופאן (-)-מנטול אסטר 1a (5.0 גרם, 13.58 מ"מ, 1.0 שוויון) ופס ערבוב מגנטי לתוך בקבוקון תחתית עגולה בעלת שני צווארים מיובשים בתנור תחת אטמוספירה של250 מ"ל מתחת לחנקן (N 2).
- הוסיפו אצטוניטריל נטול מים (60 מ"ל) לבקבוקון התגובה באמצעות מזרק אטום.
- לאחר מכן קררו את תערובת התגובה בטמפרטורה של 0 מעלות צלזיוס באמצעות אמבט קרח וערבבו את תערובת התגובה במשך 5 דקות.
- מוסיפים אשלגן פחמתי (5.6 גרם, 40.74 מ"מ, 3.0 שווה) לתערובת התגובה באותה טמפרטורה ומאפשרים לערבב במשך 30 דקות.
- מוסיפים (2R)-פניל-אתיל-אמין (2.0 מ"ל, 16.29 ננומטר, 1.2 שווה ערך) באופן טיפתי בטמפרטורת החדר (RT) ומאפשרים לתערובת התגובה לערבב במשך 12 שעות.
- עקוב אחר התקדמות התגובה באמצעות כרומטוגרפיית שכבה דקה באמצעות 9:1 v/v הקסן:אתיל אצטט (EtOAc; Rf = 0.4) כ- eluent.
- לאחר השלמת התגובה, יש לסנן את התערובת על פני נייר מסנן (גודל נקבובית 70 מ"מ).
- לאחר מכן, מוסיפים מים (30 מ"ל) לתוך התסיס האורגני ומוציאים את השכבה האורגנית עם Et2O (2 x 50 מ"ל) פעמיים באמצעות משפך מפריד.
- יבשו את התמציות האורגניות המשולבות מעל 7.5 גרם של Na2SO4 נטול מים והתרכזו בוואקואו (<15 mbar) באמצעות מאייד סיבובי.
הערה: כעת מתקבלת תערובת גולמית של אזירידין כיראלי דיאסטריאומרי המכיל את שני האיזומרים של (R)-(1R,2 S,5 R)-2-איזופרופיל-5-מתיל-ציקלוהקסיל1-((R)-1-פנילאתיל)אזירידין-2-קרבוקסילאט ו-(S)-(1R,2 S,5 R)-2-איזופרופיל-5-מתיל-ציקלוהקסיל1-((R)-1-פנילאתיל)אזירידין-2-קרבוקסילאט (4.1 גרם, 90%) מתקבל. - בידוד של אזירידין כיראלי (R)-(1R,2S,5R)-2-איזופרופיל-5-מתיל-ציקלוהקסיל 1-((R)-1- פנילאתיל)אזירידין-2-קרבוקסילאט (2) בשיטת התגבשות סלקטיבית
- מוסיפים 8.7 גרם מהתערובת הגולמית של כיראלי אזירידין (-)-מנטול אסטר 1 נגזרת ומומסים ב-70 מ"ל של מתנול לבקבוקון 250 מ"ל בעל צוואר יחיד בעל צוואר עגול בעל צוואר יחיד.
- כעת מחממים את תערובת התגובה עד 70 מעלות צלזיוס על ידי שימוש באמבט מים חמים, ואז מקררים את תערובת התגובה בטמפרטורה של -10 מעלות צלזיוס עד שנוצר גביש מוצק.
- סנן את התרכובת המוצקה מעל נייר סינון (גודל נקבובית 70 מ"מ) כדי לקבל 2.2 גרם של (R)-(1R,2S,5R)-2-איזופרופיל-5-מתיל-ציקלוהקסיל 1-((R)-1-פנילאתיל)אזירידין-2-קרבוקסילאט (2) אסטר.
- ריכז את תמיסת התסיסה שוב בוואקואו (<15 mbar) באמצעות מאייד סיבובי, ממיס 50 מ"ל של אתנול בתערובת התגובה הנותרת והתאושש ב-10 °C -כדי לקבל 1.2 גרם של (R)-(1R,2S,5R)-2-איזופרופיל-5-מתיל-ציקלוהקסיל 1-((R)-1-פנילאתיל)אזירידין-2-קרבוקסילאט (2).
- בשלב זה, השתמש באתנול אלכוהול אחר באותו אופן כמו מתנול.
- לאחר הריסטליזציה, שוב מסננים על נייר מסנן (גודל נקבובית 70 מ"מ), מרכזים את תמיסת התסיסה הגולמית שנותרה 5.3 גרם לחלוטין בוואקואו (<15 mbar) באמצעות מאייד סיבובי, ומוסיפים 50 מ"ל של ממס פחמימנים פנטן.
- שמור על תמיסת התגובה הנותרת בטמפרטורה של -15 °C (74 °F).
הערה: כעת מתקבלת תרכובת מוצקה של כמעט 1.9 גרם של (S)-(1R,2S,5R)-2-איזופרופיל-5-מתיל-ציקלוהקסיל1-((R)-1-פנילאתיל)אזירידין-2-קרבוקסילאט אסטר (3). - לאחר קבלת גבישים, לרכז את התמיסה שוב vacuo (<15 mbar) באמצעות מאייד סיבובי ולהמיס אותו 30 מ"ל של ממס פחמימנים פנטן.
- יש לתקן שוב בטמפרטורה של -15 °C (15 °C) כדי לקבל 0.8 גרם של (S)-(1R,2S,5R)-2-איזופרופיל-5-מתיל-ציקלוהקסיל1-((R)-1-פנילאתיל)אזירידין-2-קרבוקסילאט אסטר (2')..
- קבלת (R)-אתיל 1-((R)-1-פנילאתיל)אזירידין-2-קרבוקסילאט (3)
- הוסיפו (R)-(1R,2 S,5 R)-2-איזופרופיל-5-מתיל-ציקלוהקסיל1-((R)-1-פנילאתיל)אזירידין-2-קרבוקסילאט (2) (0.167 גרם, 0.57 מ"מ) ופס ערבוב מגנטי לתוך אטמוספירה עם תחתית עגולה בעלת שני צווארים מיובשים בתנור 25 מ"ל מתחת לחנקן (N2).
- הוסיפו 1.8 מ"ל של אתנול לבקבוקון התגובה באמצעות מזרק אטום וערבבו אותו ב-RT.
- לאחר מכן מוסיפים אשלגן פחמתי (0.40 גרם, 20.28 mmol, 4.0 equiv) ומערבבים אותו ב-RT למשך יומיים.
- עקוב אחר התקדמות התגובה באמצעות כרומטוגרפיה בשכבה דקה (eluent, 8:2 v/v, הקסן:אתיל אצטט (EtOAc), Rf = 0.6).
- לאחר השלמת התגובה, יש לסנן את התערובת על פני נייר מסנן (גודל נקבובית 70 מ"מ), ולאחר מכן להוסיף מים (5 מ"ל) לתוך התסיס האורגני ולחלץ את השכבה האורגנית עם CH2Cl2 (2 x 15 מ"ל) פעמיים באמצעות משפך מפריד.
- יבשו את התמציות האורגניות המשולבות מעל 3.0 גרם של אנפור מים Na2SO4 והתרכזו בוואקואו (<15 mbar) באמצעות מאייד סיבובי.
- טהרו את המוצר הגולמי על ידי כרומטוגרפיית עמודת פאזה רגילה על ג'ל סיליקה (70-230 רשת) כדי לאפשר מוצר טהור (R)-אתיל 1-((R)-1-פנילאתיל)אזירידין-2-קרבוקסילאט (3) (950 מ"ג, 88%). Rf (30% EtOAc/hexane = 0.50).
2. רג'יו ופתיחת טבעת אזירידין סטריאוסלקטיבית על ידי נוקליאופיל אזיד לסינתזה הכוללת של ביאממיד B וביאמאמיד D
- סינתזה של (R)-אתיל 2-אזידו-3-(((R)-1-פנילאתיל)אמינו)פרופנואט (5)
- העברה (500 מ"ג, 2.20 מ"מ, 1.0 שווה ערך) של כיראלי (S)-אתיל 1-((R)-1-פנילאתיל)אזירידין-2-קרבוקסילאט (4) ופס ערבוב מגנטי לתוך בקבוקון 50 מ"ל עם שני צווארים עגולים מיובשים בתנור תחת אטמוספירה פתוחה.
- מוסיפים 50% אתנול מימי (15 מ"ל) לתערובת התגובה.
- מצננים את תערובת התגובה ב-0 מעלות צלזיוס ומוסיפים חומצה גופרתית מרוכזת (36 N) באופן טיפתי כדי לשמור על כמעט pH 4.0, ומערבבים במשך 5 דקות.
- מוסיפים נתרן אזיד (370 מ"ג, 5.70 מ"מ, 2.5 שווה ערך) ב-0 מעלות צלזיוס ומאפשרים לתערובת התגובה לערבב במשך 10 דקות באותה טמפרטורה ואז להתחמם ב-RT.
- לאחר מכן, הוסיפו את AlCl3∙6H2O (55 מ"ג, 0.22 מ"מ, 0.1 שווה ערך) כזרז באותו RT ואפשרו לערבב במשך 3 שעות נוספות.
- עקוב אחר התקדמות התגובה באמצעות כרומטוגרפיית שכבה דקה (eluent, 6:4 v/v, hexane:ethyl acetate (EtOAc), Rf = 0.2).
- מרווים את תערובת התגובה עם שתי מנות של NaHCO3 רווי 20 מ"ל.
- לאחר מכן סנן את התערובת הגולמית מעל כרית סליט עם אתנול (2 x 10 מ"ל).
- ריכז את תערובת התגובה בוואקואו (<15 mbar) באמצעות מאייד סיבובי.
- חלץ את השכבה האורגנית עם CH2Cl2 (2 x 50 מ"ל) פעמיים באמצעות משפך מפריד.
- לאחר מכן יבשו את השכבה האורגנית המשולבת מעל 5.0 גרם של נטול מים Na2SO4 למשך 5 דקות.
- ריכזו את השכבה האורגנית הגולמית בוואקו (<15 mbar) באמצעות מאייד סיבובי כדי לאפשר מוצר אזיד גולמי.
- טהרו את המוצר הגולמי עם כרומטוגרפיית עמודת פאזה רגילה על ג'ל סיליקה (70-230 רשת) על ידי טיהור עם 40% EtOAc/hexane (Rf = 0.20) כדי לאפשר 490 מ"ג (90% תשואה) של (R)-אתיל 2-אזידו-3-(((R)-1-פנילאתיל)אמינו)פרופנואט (5) כנוזל צמיג.
- סינתזה של (9H-Fluoren-9-yl)מתיל(3-((R)-3-מתיל-2,4-דיוקסו-1-((R)-1 פנילאתיל)הקסהידרו פירימידין-5-יל)אמינו)-3-אוקסופרופיל)קרבמט (7)
- מעבירים 150 מ"ג כיראל (R)-5-אמינו-3-מתיל-1-((R)-1-פניל-אתיל) דיהידרופירימידין-2,4(1H,3H)-דיאון (6) (150 מ"ג, 0.60 מ"מ, 1.0 שווה ערך) ופס ערבוב מגנטי לתוך בקבוקון עגול בעל שני צווארים מיובש בתנור בגודל 25 מ"ל מתחת לאטמוספרה N2 .
- הוסף CH2Cl2 יבש (15.0 מ"ל) לבקבוקון התגובה באמצעות מזרק אטום.
- לאחר מכן קררו את תערובת התגובה בטמפרטורה של 0 מעלות צלזיוס באמצעות אמבט קרח וערבבו את תערובת התגובה במשך 5 דקות.
- הוסיפו את Fmoc-beta-alanine (377 מ"ג, 1.20 מ"מ, 2.0 שוויון) ו-DIPEA (0.67 מ"ל, 3.64 מ"מ, 6.0 שווה) ב-0 מעלות צלזיוס וערבבו אותו במשך 5 דקות.
- מוסיפים EDCI (347 מ"ג, 1.82 מ"מ, 3.0 שווה ערך) ו-HOBt (165 מ"ג, 1.21 מ"מ, 2.0 שווה ערך) לתערובת התגובה ב-0 מעלות צלזיוס ומאפשרים לערבב במשך 10 דקות באותה טמפרטורה.
- שמרו את תערובת התגובה ב-RT ואפשרו לערבב במשך 8 שעות נוספות.
- עקוב אחר התקדמות התגובה באמצעות כרומטוגרפיית שכבה דקה באמצעות (2:8 v/v, הקסן:אתיל אצטט (EtOAc), Rf = 0.4) כאלואנט.
- מרווים את תערובת התגובה במים (10 מ"ל).
- יש לשטוף את השכבה האורגנית המשולבת בתמלחת (15 מ"ל), ולאחר מכן לחלץ את השכבה האורגנית עם CH2Cl2 (2 x 20 מ"ל) פעמיים באמצעות משפך מפריד.
- לאחר מכן מייבשים את השכבה האורגנית המשולבת מעל 5.0 גרם של Na2SO4 נטול מים למשך 5 דקות ומרכזים אותה בוואקואו (<15 mbar) באמצעות מאייד סיבובי.
- טהרו את המוצר הגולמי באמצעות כרומטוגרפיית עמודת פאזה רגילה על ג'ל סיליקה (70-230 רשת) על ידי התנשאות עם 80% EtOAc/hexane (Rf = 0.40) כדי לאפשר 295 מ"ג של (7) (90% תפוקה).
3. תגובת מוקאיאמה אלדול סטריאוסלקטיבית עם אזירידין כיראלי-2-קרבוקסלדהיד והרג'יו שלה ופתיחת טבעת אזירידין סטריאוסלקטיבית על ידי הידרוקסי נוקליאופיל פנימי לסינתזה כוללת של (-)- אפיאלו-סומוסקרין (17)
- סינתזה של (S)-4-הידרוקסי-4-((R)-1-((R)-1-פנילאתיל)אזירידין-2-yl)בוטן-2-1 (12)
- העברה (R)-1-((R)-1-פנילאתיל)אזירידין-2-קרבלדהיד (10) (140 מ"ג, 0.8 מ"מ, 1.0 שוויון) ופס ערבוב מגנטי לתוך בקבוקון תחתית עגולה עם שני צווארים מיובש בתנור 25 מ"ל מתחת לאטמוספירה N2 .
- הוסף CH3CN יבש (4.0 מ"ל) לבקבוקון התגובה באמצעות מזרק אטום.
- לאחר מכן מצננים את תערובת התגובה בטמפרטורה של -20 מעלות צלזיוס באמצעות אמבט אצטון קרח ומערבבים את תערובת התגובה למשך 5 דקות.
- מוסיפים ZnCl2 נטול מים (108 מ"ג, 0.8 מ"מ, 1.0 שווה ערך) לתערובת התגובה בטמפרטורה של -20 מעלות צלזיוס ומאפשרים לערבב במשך 5 דקות.
- לאחר מכן הוסיפו טרימתיל (prop-1-en-2-yloxy)silane (11) (104 מ"ג, 0.8 mM, 1.0 equiv) המומס ב-CH3CN יבש (3.0 מ"ל) לתערובת התגובה בטמפרטורה של -20 מעלות צלזיוס באופן טיפתי, ואפשרו לתערובת התגובה לערבב במשך שעה אחת באותה טמפרטורה.
- עקוב אחר התקדמות התגובה באמצעות כרומטוגרפיית שכבה דקה באמצעות 8:2 v/v hexane:אתיל אצטט (EtOAc), Rf = 0.2) כאלואנט.
- מרווים את תערובת התגובה עם NaHCO3 רווי (4 מ"ל).
- חלצו את השכבה האורגנית בעזרת EtOAc (2 x 15 מ"ל) פעמיים באמצעות משפך מפריד.
- מייבשים את השכבה האורגנית המשולבת עם 3.0 גרם של נטול מים Na2SO4 ומרכזים אותה בוואקואו (<15 mbar) באמצעות מאייד סיבובי.
- טהרו את המוצר הגולמי עם כרומטוגרפיית עמודת פאזה רגילה על ג'ל סיליקה (70-230 רשת) על ידי התמזגות עם 80% EtOAc/hexane, (Rf = 0.20) כדי לאפשר 58 מ"ג של (S)-4-הידרוקסי-4-((R)-1-(R)-1-פנילאתיל)אזירידין-2-yl)butan-2-one) (12) (85% תשואה).
- סינתזה של (R)-N-((2R,3 S,5 R)-3-((tert-butyldimethylsilyl)oxy)-5-methyltetra hydrofuran-2-yl)methyl)-1-phenylethanamine (15)
- העברה (S)-4-((tert-butyldimethylsilyl)oxy)-4-((R)-1-((R)-1-phenylethyl) aziridin-2-yl)butan-2-one (13) (400 מ"ג, 1.15 mM, 1.0 equiv) ופס ערבוב מגנטי לתוך בקבוקון תחתית עגול 25 מ"ל מיובש בתנור 25 מ"ל תחת אטמוספירה N2 .
- הוסיפו THF נטול מים (50 מ"ל) לבקבוקון התגובה באמצעות מזרק אטום.
- מקררים את תערובת התגובה בטמפרטורה של -78 מעלות צלזיוס באמצעות אמבט אצטון קרח יבש ומאפשרים לערבב במשך 5 דקות.
- לאחר מכן הוסיפו ליתיום טרי-שניות-בוטילבורוהידריד (L-selectride) (תמיסת 1 M ב-THF) (2.3 מ"ל, 2.0 שווה שווה) באופן טיפתי לתערובת התגובה בטמפרטורה של -78 מעלות צלזיוס ואפשרו לערבב עוד 25 דקות.
- מחממים את תערובת התגובה ל-RT ומאפשרים לערבב במשך 8 שעות.
- עקוב אחר התקדמות התגובה על ידי TLC באמצעות 30% EtOAc/hexane (Rf = 0.40) כ- eluent.
- לאחר הצריכה המלאה של תרכובת 13, להרוות את תערובת התגובה עם 0.1 M של NaOH (5 מ"ל).
- יש לחלץ את השכבה האורגנית באמצעות EtOAc (3 x 15 מ"ל), ולאחר מכן לשטוף במי מלח (15 מ"ל).
- מייבשים את השכבה האורגנית מעל 3.0 גרם של נטול מים Na2SO4 ומתרכזים בוואקואו (<15 mbar) באמצעות מאייד סיבובי.
- טהרו את המוצר הגולמי עם כרומטוגרפיית עמודת פאזה רגילה על ג'ל סיליקה (70-230 רשת, eluent, 8:2 v/v, hexane:ethyl acetate (EtOAc), Rf = 0.2) כדי לאפשר תרכובת טהורה (15) (382 מ"ג, 95% תשואה).
- סינתזה של (-)-אפיאלו-איזומוסקרין יודיד (17)
- מעבירים תרכובת 16 (20 מ"ג, 0.15 מ"מ, 1.0 שווה שווה) ופס ערבוב מגנטי לתוך בקבוקון עגול 10 מ"ל מיובש בתנור תחת אטמוספירה N2 .
- הוסף 3 מ"ל של בקבוקון תגובת EtOAc באמצעות מזרק אטום.
- לאחר מכן הוסיפו מתיל יודיד (0.4 מ"ל, 3.0 מ"מ) לתערובת התגובה ב-RT.
- הוסף 1,2,2,6,6,6-פנטמתיל-פיפרידין (PMP) (0.05 מ"ל, 0.3 mM, 2.0 equiv) לתערובת התגובה ב-0 °C (0°C).
- לאחר מכן, שמור את תערובת התגובה ב- RT ואפשר לערבב במשך 16 שעות נוספות.
- אידוי הממס ב vacuo (<15 mbar) באמצעות מאייד סיבובי כדי לתת את המוצר הגולמי.
- יש לשטוף שלוש פעמים על ידי הוספת (3 x 5 מ"ל) 10% MeOH ב-EtOAc לתערובת התגובה הגולמית.
- לאחר מכן יש לשטוף את התערובת הגולמית עם n-Pentane (5 מ"ל) ולהתרכז תחת ואקום (<15 mbar) באמצעות מאייד סיבובי כדי להשיג יודיד טהור (-)-epiallo-isomuscarine יודיד (17) (32 מ"ג, 68%).
4. אפיון כל המוצרים
- אפיינו את כל התרכובות החדשות ב-1H, ספקטרוסקופיית 13C NMR וספקטרומטריית מסה ברזולוציה גבוהה (HRMS)7,8,11.
תוצאות
כאן אנו מדווחים על סינתזה של אננטיופור אזירידין-2-קרבוקסילטים. התערובת הדאסטריאומרית של (R)-(1R,2 S,5 R)-2-איזופרופיל-5-מתיל-ציקלוהקסיל1-(R)-1-פנילאתיל)אזירידין-2-קרבוקסילאט (2) ו-(S)-(1R,2S,5R)-2-איזופרופיל-5-מתיל-ציקלוהקסיל1-((R)-1-פנילאתיל)אזירידין-2-קרבוקסילאט (
Discussion
ל-Aziridines כהטרו-ציקלים בעלי שלושה איברים המכילים חנקן יש פוטנציאל עצום לאימוני לחימה או חומרי ביניים סינתטיים להכנת מולקולות אורגניות עשירות בחנקן. בהתבסס על הקבוצה הנושאת את החנקן הטבעתי, הם מסווגים כאזירידינים "מופעלים" ו"לא מופעלים", שהתגובתיות הכימית והסלקטיביות שלהם שונות. עם זאת, שיטו...
Disclosures
המחברים מצהירים כי לא היה ניגוד עניינים במחקר זה.
Acknowledgements
מחקר זה נתמך על ידי קרן המחקר הלאומית של קוריאה (NRF-2020R1A2C1007102 ו- 2021R1A5A6002803) עם המרכז לכיוונים חדשים בסינתזה אורגנית ומענק HUFS 2022.
Materials
| Name | Company | Catalog Number | Comments |
| (2R)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester, 98% | Sigma-Aldrich | 57054-0 | |
| (2S)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester | Sigma-Aldrich | 57051-6 | |
| 1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride | TCI | 424331-25 g | CAS No: 25952-53-8 |
| 1,4-Dioxane | SAMCHUN | D0654-1 kg | CAS No: 123-91-1 |
| 1-Hydroxybenzotriazole hydrate | Aldrich | 219-989-7-50 g | CAS No: 123333-53-9 |
| 2,6-Lutidine | Alfa Aesar | A10478-AP, 500 mL | CAS No: 108-48-5 |
| Acetonitrile | SAMCHUN | A0127-18 L | CAS No: 75-05-8 |
| Acetonitrile-d3 | Cambridge Isotope Laboratories, | 15G-744-25 g | CAS No: 2206-26-0 |
| Aluminum chloride hexahydrate | Aldrich | 231-208-1, 500 g | CAS No : 7784-13-6 |
| Bruker AVANCE III HD (400 MHz) spectrometer | Bruker | NA | |
| Chloroform-d | Cambridge Isotope Laboratories, | 100 g | CAS No: 865-49-6 |
| Dichloromethane | SAMCHUN | M0822-18 L | CAS No: 75-09-2 |
| Dimethyl sulfoxide-d6 | Cambridge Isotope Laboratories, | 25 g | CAS No: 2206-27-1 |
| Ethanol | EMSURE | 1009831000,1L | CAS No: 64-17-5 |
| Ethyl acetate | SAMCHUN | E0191-18 L | CAS No: 141-78-6 |
| High resolution mass spectra/MALDI-TOF/TOF Mass Spectrometry | AB SCIEX | 4800 Plus | High resolution mass spectra |
| JASCO P-2000 | JASCO | P-2000 | For optical rotation |
| Lithium aluminum hydride | TCI | L0203-100 g | CAS No: 16853-85-3 |
| L-Selectride, 1 M solution in THF | Acros | 176451000, 100 mL | CAS No: 38721-52-7 |
| Methanol | SAMCHUN | M0585-18 L | CAS No: 67-56-1 |
| N-[(9H-Fluoren-9-ylmethoxy)carbonyl]-β-alanine | TCI | F08825G-5 g | CAS No: 35737-10-1 |
| N-Ethyldiisopropylamine | Aldrich | 230-392-0, 100 mL | CAS No: 7087-68-5 |
| n-Hexane | SAMCHUN | H0114-18 L | CAS No: 110-54-3 |
| Ninhydrin | Alfa Aesar | A10409-250 g | CAS No: 485-47-2 |
| p-Anisaldehyde | aldrich | A88107-5 g | CAS No: 123-11-5 |
| Phosphomolybdic acid hydrate | TCI | P1910-100 g | CAS No: 51429-74-4 |
| Sodium azide | D.S.P | 703301-500 g | CAS No: 26628-22-8 |
| Sodium Hydride 60% dispersion in mineral oil | Sigma-Aldrich | 452912-100 G | CAS No: 7646-69-7 |
| Sodium hydroxide | DUKSAN | A31226-1 kg | CAS No: 1310-73-2 |
| Sodium sulfate | SAMCHUN | S1011-1 kg | CAS No: 7757-82-6 |
| Thin Layer Chromatography (TLC) | Merck | 100390 | |
| Tert-Butyldimethylsilyl trifluoromethanesulfonate, 98% | Aldrich | 274-102-0, 25 g | CAS NO: 69739-34-0 |
| Tetrahydrofuran | SAMCHUN | T0148-18 L | CAS No: 109-99-9 |
| Triethylethylamine | DAEJUNG | 8556-4400-1 L | CAS No: 121-44-8 |
| UV light | Korea Ace Sci | TN-4C | 254 nm |
| Zinc chloride, anhydrous, 98+% | Alfa Aesar | A16281-22100 g | CAS No : 7646-85-7 |
References
- Pitzer, K. S. Strain energies of cyclic hydrocarbons. Science. 101 (2635), 672 (1945).
- Dudev, T., Lim, C. Ring strain energies from ab initio calculations. Journal of the American Chemical Society. 120 (18), 4450-4458 (1998).
- D'hooghe, M., Ha, H. -. J. . Synthesis of 4- to 7-Membered Heterocycles by Ring Expansion. , (2016).
- Ranjith, J., Ha, H. -. J. Synthetic applications of aziridinium ions. Molecules. 26 (6), 1744 (2021).
- Sweeney, J. B. Aziridines: epoxides' ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Stankovic, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Lee, W. K., Ha, H. -. J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Tranchant, M. J., Dalla, V., Jabin, I., Decroix, B. Reaction of vinyl triflates of α-keto esters with primary amines: efficient synthesis of aziridine carboxylates. Tetrahedron. 58 (42), 8425-8432 (2002).
- Ha, H. -. J., Jung, J. -. H., Lee, W. K. Application of regio- and stereoselective functional group transformation of chiral aziridine-2-carboxylate. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- Kim, Y., et al. Preparation of 2,3-diaminopropionate from ring opening of aziridine-2-carboxylate. Tetrahedron Letters. 46 (25), 4407-4409 (2005).
- Srivastava, N., Macha, L., Ha, H. -. J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Zhang, F., et al. Biemamides A-E, inhibitors of the TGF-β pathway that block the epithelial to mesenchymal transition. Organic Letters. 20 (18), 5529-5532 (2018).
- Srivastava, N., Ha, H. -. J. Highly efficient and stereoselective Mukaiyama Aldol reaction with chiral aziridine-2-carboxaldehyde and its synthetic applications. Asian Journal of Organic Chemistry. 11 (1), 2021005671 (2021).
- Kempter, I., et al. Synthesis and structural characterization of the isomuscarines. Tetrahedron. 70 (10), 1918-1927 (2014).
- Pirrrung, M. C., DeAmicis, C. V. Total synthesis of the muscarines. Tetrahedron Letters. 29 (2), 159-162 (1988).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved