Method Article
مزارع الخلايا العصبية الحصين للكشف عن ودراسة الأجسام المضادة المسببة للأمراض الجديدة المشاركة في التهاب الدماغ المناعي الذاتي
In This Article
Summary
التهاب الدماغ المناعي الذاتي هو فئة جديدة من الأمراض التي تتوسطها الأجسام المضادة في الجهاز العصبي المركزي. يمكن استخدام الخلايا العصبية الحصين لاكتشاف وتوصيف هذه الأجسام المضادة. توفر هذه المقالة بروتوكولا لزراعة الخلايا الأولية والتلطيخ المناعي لتحديد الأجسام المضادة الذاتية في المصل والسائل الدماغي الشوكي للمرضى.
Abstract
على مدى السنوات ال 15 الماضية ، تم تمييز فئة جديدة من الأمراض التي تتوسط الأجسام المضادة في الجهاز العصبي المركزي (CNS) ويتم تعريفها الآن باسم "التهاب الدماغ المناعي الذاتي" (AE). يوجد حاليا 17 متلازمات AE معروفة ، وكلها مرتبطة بالأجسام المضادة ضد سطح الخلية العصبية أو البروتينات المتشابكة. المتلازمات السريرية معقدة وتختلف وفقا لنوع الأجسام المضادة المرتبطة بها. ومن أشهر هذه الأمراض التهاب الدماغ المضاد لمستقبلات الأسبارتات D-methyl D-aspartate (NMDAR) ، وهو اضطراب عصبي بارز مرتبط بضعف شديد في الذاكرة والسلوك. تتفاعل الأجسام المضادة المرتبطة بها مع الوحدة الفرعية GluN1 من NMDAR في المجال الطرفي N. النهج الأكثر استخداما لاكتشاف وتوصيف الأجسام المضادة AE يشمل ثقافة الخلايا العصبية الحصين المنفصلة والجنينية والقوارض. أثناء عملية توصيف الأجسام المضادة ، تتعرض الخلايا العصبية الحية في الثقافة لمصل المرضى أو السائل الدماغي الشوكي ، ويشير اكتشاف التفاعل إلى أن عينات المصل أو السائل الدماغي الشوكي للمريض تحتوي على أجسام مضادة ضد مستضدات السطح العصبي. يمكن أيضا استخدام ثقافات الحصين لتحديد ما إذا كانت الأجسام المضادة لدى المرضى يحتمل أن تكون مسببة للأمراض من خلال فحص ما إذا كانت تسبب تغيرات هيكلية أو وظيفية في الخلايا العصبية. يعتمد مستوى نجاح هذه الدراسات على جودة الثقافات وعلى البروتوكولات المستخدمة للحصول على تفاعل عينات المرضى واكتشافه. توفر هذه المقالة بروتوكولا محسنا لزراعة الخلايا الأولية للخلايا العصبية الحصين الفئران الجنينية جنبا إلى جنب مع تلطيخ المناعة لتحديد وجود الأجسام المضادة في المصل أو السائل الدماغي الشوكي للمرضى. كما يتم تقديم مثال على كيفية فحص الآثار المسببة للأمراض المحتملة للأجسام المضادة NMDAR باستخدام الخلايا العصبية المستزرعة وتصوير الكالسيوم.
Introduction
التهاب الدماغ المناعي الذاتي (AE) هو فئة تم اكتشافها مؤخرا من أمراض الجهاز العصبي المركزي (CNS) بوساطة الأجسام المضادة التي تستهدف سطح الخلايا العصبية أو البروتينات المشبكية 1,2. تختلف السمات السريرية وفقا للجسم المضاد ولكنها تشمل عادة ضعف الذاكرة والإدراك ، والسلوك المتغير والأعراض النفسية ، والحركات غير الطبيعية ، وضعف النوم ، وانخفاض مستوى الوعي ، والنوبات. يمكن أن تؤثر هذه الاضطرابات على الأفراد من جميع الأعمار ، مع بعض أنواع AE التي تؤثر في الغالب على الأطفال والشباب2.
على مدى السنوات ال 15 الماضية ، تم وصف 17 متلازمات AE مع أجسام مضادة ضد بروتينات محددة على السطح العصبي / المتشابك (الجدول 1). بعض الأمثلة على الأهداف العصبية تشمل المستقبلات المثيرة المشبكية NMDAR 3,4 و AMPAR5 ، والمستقبل المثبط المشبكي GABAbR6 ، والبروتين المفرز العصبي LGI17 ، وجزيء التصاق الخلية IgLON58. بالنسبة لمعظم هذه AE ، أظهرت الدراسات أن الأجسام المضادة تعطل بنية أو وظيفة المستضد المستهدف ، مما يدعم بقوة دورا مسببا للأمراض. على سبيل المثال ، في التهاب الدماغ المضاد ل NMDAR ، تتفاعل الأجسام المضادة مع المجال الطرفي N للوحدة الفرعية GluN1 في NMDAR ، مما ينتج عنه استيعاب انتقائي وعكسي لهذه المستقبلات ينتج عنه تغييرات عصبية نفسية بارزة 4,9,10,11. وبالتالي ، يمكن أيضا استخدام تحديد أي من الأجسام المضادة المعروفة ال 17 في المصل أو السائل الدماغي الشوكي للمريض كاختبار تشخيصي يحدد تشخيص AE معين.
واحدة من التقنيات المستخدمة بشكل متكرر لتحديد وتوصيف هذه الأجسام المضادة تشمل استخدام ثقافات الخلايا العصبية الحصين المنفصلة والجنينية والقوارض. هذه الثقافات مفيدة لعدة أسباب: الدماغ الجنيني سهل الانفصال ويحتوي على مستوى منخفض من الخلايا الدبقية ، المصدر الرئيسي للتلوث في الثقافات العصبية12 ؛ عدد خلايا الحصين متجانس نسبيا مقارنة بمعظم المناطق الأخرى في الجهاز العصبي المركزي ، حيث تمثل الخلايا الهرمية الغالبية العظمى13,14 ؛ يتم تحضير الثقافات من الأجنة في المراحل المتأخرة عندما يكتمل توليد الخلايا العصبية الهرمية ولكن الخلايا الحبيبية لم تتطور بعد ، مما يزيد من تجانس الثقافة ؛ عندما تعبر الخلايا العصبية الهرمية المستزرعة عن معظم ميزاتها الظاهرية الرئيسية ، وتكون قادرة على تشكيل تشعبات متطورة ، وإنشاء شبكات متصلة بشكل متشابك يمكن استخدامها في التحقيقات الهيكلية والكهروفسيولوجية12,13 ؛ نظرا لأن الأجسام المضادة لا يمكنها اختراق الخلايا العصبية الحية ، فإن استخدام الثقافات الحية يسمح بتحديد الأهداف المستضدية الموجودة على سطح الخلية ؛ ويسمح الترسيب المناعي لمركب مستضد الأجسام المضادة من الثقافات العصبية بتحديد المستضد المستهدف5.
يعتمد نجاح الدراسات التي تستخدم الثقافات العصبية بشكل كبير على جودة الثقافات والبروتوكولات المستخدمة لتقييم التفاعل المناعي لمصل المريض أو السائل الدماغي الشوكي (CSF). تشمل المتغيرات التي يمكن أن تؤثر على الثقافات إجراءات عزل الحصين قبل تطور الثقافة ، وتفكك الأنسجة ، وكثافة الطلاء ، وسطح النمو المستخدم ، وتكوين الوسائط 13،15،16. توفر هذه المقالة بروتوكولا محسنا لزراعة الخلايا الأولية للخلايا العصبية الحصين الفئران الجنينية جنبا إلى جنب مع تلطيخ المناعة الفلورسنت الذي يمكن استخدامه لتحديد وجود الأجسام المضادة ضد مستضدات AE المعروفة والأهداف السطحية الجديدة المحتملة. كما يقدم مثالا على كيفية فحص الآثار المسببة للأمراض للأجسام المضادة NMDAR بواسطة تقنيات تصوير الخلايا الحية باستخدام الخلايا العصبية الحصينية المستزرعة التي تعبر عن مؤشر الكالسيوم المشفر وراثيا (GECI) من عائلة GCaMP ، GCaMP5G.
| البروتين المستهدف | وظيفة البروتين | حجرة الخلية | المتلازمة الرئيسية |
| نمدار | أيون شانيل | البروتين المشبكي | التهاب الدماغ المضاد ل NMDAR |
| أمبار | أيون شانيل | البروتين المشبكي | التهاب الدماغ الحوفي |
| غلوك2 | أيون شانيل | البروتين المشبكي | التهاب الدماغ |
| GABAaR | أيون شانيل | البروتين المشبكي | التهاب الدماغ |
| GABAbR | مستقبلات التمثيل الغذائي | البروتين المشبكي | التهاب الدماغ الحوفي |
| mGluR1 | مستقبلات التمثيل الغذائي | البروتين المشبكي | التهاب الدماغ |
| mGluR2 | مستقبلات التمثيل الغذائي | البروتين المشبكي | التهاب الدماغ |
| إم غلور5 | مستقبلات التمثيل الغذائي | البروتين المشبكي | التهاب الدماغ |
| D2R | مستقبلات التمثيل الغذائي | البروتين المشبكي | التهاب الدماغ العقد القاعدية |
| إل جي آي1 | جزيء الالتصاق | بروتين سطح الخلية | التهاب الدماغ الحوفي |
| كاسبر2 | جزيء الالتصاق | بروتين سطح الخلية | التهاب الدماغ الحوفي |
| إيغلون5 | جزيء الالتصاق | بروتين سطح الخلية | مكافحة مرض IgLON5 |
| نيوريكسين-3α | جزيء الالتصاق | بروتين سطح الخلية | التهاب الدماغ |
| DNER (Tr) | البروتين عبر الغشاء | بروتين سطح الخلية | التهاب الدماغ |
| SEZ6L | البروتين عبر الغشاء | بروتين سطح الخلية | التهاب الدماغ |
| الأمفيفيسين | جزيء هيكلي | بروتين سطح الخلية | التهاب الدماغ الحوفي |
| DPPX | الببتيداز | بروتين سطح الخلية | التهاب الدماغ |
الجدول 1: الأجسام المضادة لسطح الخلية العصبية والبروتينات المتشابكة.
Protocol
تمت الموافقة على جميع الإجراءات من قبل لجنة الأخلاقيات المحلية بجامعة برشلونة بعد اللوائح الأوروبية (2010/63/UE) حول استخدام ورعاية التجارب. تم الحصول على موافقة خطية مستنيرة من المرضى ، وتمت الموافقة على الدراسة من قبل مجلس المراجعة المؤسسية المحلية لاستخدام العينات البشرية (مستشفى كلينيك ، HCB / 2018 / 0192).
ملاحظة: هناك ثلاثة أجزاء في البروتوكول الحالي. الأول هو لإنشاء الثقافات العصبية ، والثاني هو للكشف عن الأجسام المضادة السطحية باستخدام الثقافات الحية للخلايا العصبية ، والثالث هو تحديد إمراض هذه الأجسام المضادة.
الجزء 1: إنشاء ثقافات عصبية حصينية مفككة ، جنينية ، قوارض
1. الخطوات التحضيرية
- طلاء Poly-L-Lysine لأسطح الطلاء (3 أيام قبل التشريح)
- تحضير مخزن البورات العازل بإضافة 2.38 غرام من حمض البوريك و 1.27 غرام من البوراكس إلى 500 مل من الماء المقطر وتحريكه لمدة 15 دقيقة حتى يذوب. تحت غطاء محرك السيارة، قم بتعقيم محلول التخزين المؤقت عن طريق التصفية (حجم المسام 0.2 ميكرومتر)، والتسمية، وتخزينها في درجة حرارة الغرفة (RT).
ملاحظة: هذا الحل مستقر ويمكن استخدامه لمدة 6 أشهر.
تنبيه: عند إعداد مخزن مؤقت للبورات، ارتد معدات الحماية الشخصية الموصى بها. - تحضير محلول مرق بولي إل-ليسين (PLL) (100 ملغم/مل) بإضافة 1 غرام من البولي سال إلى 10 مل من الماء المقطر وتحريكه حتى يذوب. إعداد 500 ميكرولتر أليكوتس من حل الأسهم PL. للوصول إلى تركيز نهائي قدره 1 ملغ / مل ، أضف 500 ميكرولتر من أليكوت PLL إلى 50 مل من مخزن بورات العازل وتدور حتى تذوب ، وتعقيم المحلول عن طريق التصفية (حجم المسام 0.2 ميكرومتر).
ملاحظة: هذا الحل مستقر ويمكن استخدامه لمدة 6 أشهر. - تحضير الأسطح للطلاء. استخدم أغطية قطرها 12 مم لإجراءات تلطيخ المناعة وأطباق ذات قاع زجاجي للدراسات التي ستشمل تصوير الخلايا العصبية الحية. في حالة استخدام الأغطية ، قم بالأوتوكلاف ثم ضع خمسة أغطية في كل طبق (قطره 3.5 سم).
ملاحظة: يؤثر سمك الغطاء على جودة وشدة إشارة الصور المكتسبة. تم تصميم معظم أهداف المجهر ل # 1.5 coverslips. اختر الأغطية المناسبة وفقا لإعداد التصوير وتقنياته. - تحت غطاء محرك السيارة ، أضف 1.5 مل من محلول PLL إلى كل طبق (طبق ذو قاع زجاجي أو طبق 3.5 سم مع خمسة أغطية للغطاء). تأكد من غمر جميع أغطية الغطاء وتخزينها في RT لمدة 24 ساعة.
- 2 أيام قبل تشريح ، شفط محلول PLL وغسل بالماء المعقم الخالي من السموم الداخلية ، والتأكد من غمر الأغطية. احتفظ بالماء في الأطباق وخزنه في RT لمدة 24 ساعة.
- 1 يوم قبل تشريح ، استنشاق الماء واستبداله بوسائط ثقافة NB + B27 (انظر أدناه) ، ووضع الأطباق في حاضنة عند 37 درجة مئوية لمدة 24 ساعة.
- تحضير مخزن البورات العازل بإضافة 2.38 غرام من حمض البوريك و 1.27 غرام من البوراكس إلى 500 مل من الماء المقطر وتحريكه لمدة 15 دقيقة حتى يذوب. تحت غطاء محرك السيارة، قم بتعقيم محلول التخزين المؤقت عن طريق التصفية (حجم المسام 0.2 ميكرومتر)، والتسمية، وتخزينها في درجة حرارة الغرفة (RT).
- إعداد وسائل الإعلام الثقافية وحل المخزون (1 يوم قبل التشريح)
- وسط النسر المعدل من دولبيكو (DMEM): إلى 500 مل من DMEM عالي الجلوكوز (4.5 جم / لتر) بدون L-Glutamine والفينول الأحمر ، أضف 50 مل من مصل الحصان ، و 50 مل من مصل البقر الجنيني (FBS) ، و 10 مل من L-glutamine (200 mM) ، و 10 مل من بيروفات الصوديوم (100 mM) ، و 10 مل من البنسلين - الستربتومايسين (10000 U / mL). تصفية (0.2 ميكرومتر حجم المسام) وتخزينها في 5 مل aliquots في 4 درجة مئوية مع غطاء مغلق بإحكام.
ملاحظة: هذا الحل مستقر ويمكن استخدامه لمدة 1 شهر. - وسط عصبي قاعدي (NB) مكمل ب B27 (NB + B27): إلى 50 مل من وسط NB بدون أحمر الفينول ، أضف 1 مل من ملحق B27.
- وسط السبات-E المكمل ب B27 (السبات + B27): إلى 50 مل من وسط السبات-E ، أضف 1 مل من ملحق B27.
- المحلول الفسيولوجي خارج الخلية (EPS): إلى 1 لتر من الماء المعقم ، أضف ما يلي عند التركيزات النهائية المحددة: كلوريد الصوديوم (140 ملليمتر) ، KCl (3.5 ملليمتر) ، HEPES (10 ملليمتر) ، الجلوكوز (20 ملليمتر) ، و CaCl 2 (2 ملليمتر). يحرك المزيج حتى يذوب ويضبط الرقم الهيدروجيني على 7.4 بإضافة NaOH (0.5 M) أو HCl (0.5 M). تحت غطاء المحرك ، قم بالتعقيم عن طريق التصفية (حجم المسام 0.2 ميكرومتر) وتخزينها عند 4 درجات مئوية.
- وسط النسر المعدل من دولبيكو (DMEM): إلى 500 مل من DMEM عالي الجلوكوز (4.5 جم / لتر) بدون L-Glutamine والفينول الأحمر ، أضف 50 مل من مصل الحصان ، و 50 مل من مصل البقر الجنيني (FBS) ، و 10 مل من L-glutamine (200 mM) ، و 10 مل من بيروفات الصوديوم (100 mM) ، و 10 مل من البنسلين - الستربتومايسين (10000 U / mL). تصفية (0.2 ميكرومتر حجم المسام) وتخزينها في 5 مل aliquots في 4 درجة مئوية مع غطاء مغلق بإحكام.
- المعدات والمواد المختبرية الأخرى (يوم التشريح)
- اضبط الحمام المائي على 37 درجة مئوية. سخن الأليكوتات التالية: 50 مل من HBSS ، و 5 مل من DMEM.
- قم بتعقيم الأدوات التالية عن طريق الانغماس في كوب يحتوي على الإيثانول المطلق (الشكل 1B): ملقط ، ملقط منحني ، مقص ، ملقط منحني بدقة ، ملقط مستقيم بدقة ، مقص جراحي ، ملقط دقيق الزاوية ، ومقص زنبركي دقيق.
ملاحظة: لحماية الأدوات، ضع مادة ناعمة (على سبيل المثال، مناديل علمية دقيقة) في أسفل الدورق. - املأ صينيتين بالثلج وضع العناصر التالية.
- صينية الثلج 1 (الشكل 1C): ضع الأدوات الجراحية في الكأس مع الإيثانول المطلق ، ودورق مع HBSS لشطف الأدوات الجراحية ، وطبق 10 سم مع HBSS لوضع الأجنة ، وطبق 6 سم مع HBSS لوضع رؤوس الأجنة ، وطبق 6 سم مع السبات + B27 لوضع أدمغة الأجنة.
- صينية الثلج 2: ضع أليكوت 1 مل من التربسين 2.5٪ وطبق 3.5 سم مع السبات + B27 للحصين التشريحي.
ملاحظة: يعتمد الوقت اللازم لهذا الإجراء على خبرة الباحث وعدد الأجنة المراد تشريحها. لذلك ، يجب أن يظل الجليد مجمدا لفترة زمنية مطلوبة. يوصى باستخدام صواني البوليسترين لهذا الغرض.
2. التشريح والبذر (الشكل 1)
- عزلة الحصين
ملاحظة: يتم قتل الفئران الحوامل مع الأجنة في E18 مباشرة قبل بدء البروتوكول وفقا للجنة الأخلاقيات المحلية بجامعة برشلونة ، بعد اللوائح الأوروبية (2010/63/UE) حول استخدام ورعاية التجارب. في هذا البروتوكول ، تم استخدام استنشاق ثاني أكسيد الكربون (CO2) كوسيلة للقتل الرحيم.- تشريح الفئران على مستوى الصفاق البطني باستخدام ملقط ومقص. استخرجي الرحم مع أجنة E18 وضعيه في طبق طوله 10 سم تم تبريده على الجليد.
ملاحظة: من المهم تجنب التصاق شعر الفئران بالأجنة. يوصى باستخدام كميات وفيرة من الإيثانول بنسبة 70٪ لتعقيم البطن. من هذه الخطوة فصاعدا ، اعمل داخل غطاء المحرك على صينية الثلج 1. - افتح الأكياس الجنينية وانقل الأجنة إلى طبق 10 سم باستخدام HBSS ، مع التأكد من غمر الأجنة بالكامل.
- قم بإزالة رأس الجنين بالمقص وضعه في طبق 6 سم باستخدام HBSS. كرر هذه العملية مع جميع الأجنة.
ملاحظة: لتجنب التلوث، يجب التخلص من جميع الأنسجة باستثناء رؤوس الأجنة في حاوية ذات غطاء لولبي. - أمسك رأس الجنين بملقط منحني بدقة واخترق المدارات بزوج من الملقط المستقيم الناعم ، ويدخل بزاوية 45 درجة ، ثم حرر الملقط المنحني الدقيق.
ملاحظة: يجب ألا يمر الملقط عبر الدماغ ، لذلك من المهم الحفاظ على الزاوية عند الدخول. - تشريح الجلد والجمجمة باستخدام مقص الجراحة ، بدءا من العظم القذالي إلى العظم الجبهي. قم بإزالة الدماغ بزوج من الملقط المنحني بدقة وضعه في طبق 6 سم مع السبات + B27. كرر هذه العملية حتى يتم استرداد جميع الأدمغة.
- افصل القوس بين التيلينسيفالون والملقط المستقيم الدقيق.
ملاحظة: من هذه الخطوة فصاعدا ، يتم تشريح الحصين تحت المجهر المجسم. يوصى باستخدام مصابيح مفصلية بحيث يضيء الضوء سطح التشريح من الجانبين. يوصى أيضا باستخدام خلفية سوداء لأن هذا يوفر المزيد من التباين ، مما يسمح بتمييز الحصين بشكل أفضل. - قم بإعداد طبق 10 سم عن طريق وضع قطرات من السبات + B27 على مسافات 1 سم (على سبيل المثال ، في دائرة). ضع telencephalon واحد لكل قطرة من السبات + B27 وتصور من خلال نطاق التشريح (يوصى بالتكبير الموضوعي 1.25x).
- قشر السحايا بعناية وإزالة المهاد لتصور الحصين بشكل أفضل.
- تشريح الحصين مع مقص الربيع الدقيق ووضعه في طبق 3.5 سم مع السبات + B27 في صينية الثلج 2. كرر ذلك لكل تيلينسيفالون حتى يتم جمع كل الحصين.
- جمع بعناية كل الحصين مع ماصة باستور ونقلها إلى أنبوب 50 مل.
ملاحظة: خذ الحد الأدنى لحجم السبات + B27 عند جمع الحصين حتى لا تخفف التربسين.
- تشريح الفئران على مستوى الصفاق البطني باستخدام ملقط ومقص. استخرجي الرحم مع أجنة E18 وضعيه في طبق طوله 10 سم تم تبريده على الجليد.
- تفكك الخلايا
- الانفصال الأنزيمي للحصين
- في أنبوب 50 مل الذي يحتوي على الحصين ، أضف 1 مل من التربسين بنسبة 2.5٪ واجعله بحجم 5 مل مع HBSS. احتضان لمدة 15 دقيقة في الحمام المائي عند 37 درجة مئوية.
- لتخفيف التربسين ، أضف 10 مل من HBSS المسخن مسبقا واحتضنه لمدة 5 دقائق في الحمام المائي عند 37 درجة مئوية.
- انقل الحصين الذي يظهر الآن ككتلة مخاطية إلى أنبوب 50 مل مع ماصة دقيقة 1000 ميكرولتر ، وأضف 6 مل من HBSS المسخن مسبقا ، واحتضنه لمدة 5 دقائق في الحمام المائي عند 37 درجة مئوية.
- التفكك الميكانيكي للحصين
- انقل الكتلة إلى أنبوب 2 مل مع قاع مخروطي ، مع أخذ الحد الأدنى من الحجم. أضف 1 مل من وسائط DMEM المسخنة مسبقا. قم بتجانس الكريات باستخدام ماصة دقيقة سعة 1000 ميكرولتر عن طريق الشفط بلطف لأعلى ولأسفل.
ملاحظة: من الأهمية بمكان تجنب توليد فقاعات عند الشفط لأن الفقاعات قد تحلل الخلايا. - كرر الطموح لأعلى ولأسفل باستخدام ماصة زجاجية مسحوبة مسبقا (10x-20x) ، مع ملامسة طرفها للقاع المخروطي للأنبوب. تجنب توليد فقاعات. في نهاية هذه الخطوة ، يجب أن يكون الخليط شفافا.
- بمجرد خلطه بشكل متجانس بحيث يكون الخليط شفافا ، انقل الخليط إلى أنبوب يحتوي على 4 مل من وسائط DMEM عند 37 درجة مئوية وتجانس مع ماصة زجاجية عن طريق السحب لأعلى ولأسفل.
- انقل الكتلة إلى أنبوب 2 مل مع قاع مخروطي ، مع أخذ الحد الأدنى من الحجم. أضف 1 مل من وسائط DMEM المسخنة مسبقا. قم بتجانس الكريات باستخدام ماصة دقيقة سعة 1000 ميكرولتر عن طريق الشفط بلطف لأعلى ولأسفل.
- الانفصال الأنزيمي للحصين
- بذر الخلايا
- عد الخلايا. يمكن حساب عدد الخلايا العصبية في المحلول وفقا للإجراءات المختبرية القياسية.
ملاحظة: في تجارب التصوير للكشف عن الأجسام المضادة ونشاط الكالسيوم، يكون تركيز 50000 خلية لكل طبق 3.5 سم هو الأمثل. - الحفاظ على الخلايا معلقة ، وسحب الحجم المحسوب ، وطبق في أطباق 3.5 سم تحتوي على أغطية مغلفة ب PLL أو في الأطباق ذات القاع الزجاجي المطلي ب PLL.
- قم بتوزيع الخلايا بالتساوي على الأطباق عن طريق الاهتزاز بهدوء في حركات متقاطعة (ذهابا وإيابا ، ثم من جانب إلى آخر ؛ كرر حسب الحاجة) ووضع الأطباق في حاضنة CO2 (5٪).
ملاحظة: من المهم استخدام الحركات المتقاطعة لتجنب استقرار الخلايا في محيط الطبق. - كل أسبوع ، أضف ما يقرب من 1 مل من NB + B27 ، حتى لا تجف الثقافة.
ملاحظة: بعد أسبوعين (14 يوما في المختبر [div]) ، تكون الخلايا العصبية ناضجة وتعبر عن جميع العوامل التي سيتم استخدامها للتجريب. يبلغ متوسط العدد الإجمالي للخلايا العصبية التي تم الحصول عليها باستخدام هذا البروتوكول حوالي 2.5 × 106 خلايا عصبية قادمة من متوسط 12 جنينا E18 لكل فأر حامل.
- عد الخلايا. يمكن حساب عدد الخلايا العصبية في المحلول وفقا للإجراءات المختبرية القياسية.
الجزء 2: استخدام الثقافات العصبية الحصينية للكشف عن الأجسام المضادة في بروتينات سطح الخلايا العصبية
ملاحظة: يوضح هذا الجزء من البروتوكول كيفية استخدام ثقافات الحصين لتحديد الأجسام المضادة المضادة ل NMDAR في المصل و / أو CSF للمرضى الذين يعانون من التهاب الدماغ المضاد ل NMDAR. يستخدم التلطيخ المناعي الفلوري لتصور التفاعل في الخلايا العصبية الحية ، ولكن يمكن أيضا استخدام طرق تصور أخرى. سيكون التحكم المناسب لهذه التجربة هو المصل أو السائل الدماغي الشوكي من فرد سليم. عند استخدام العينات البشرية ، ضع في اعتبارك أن موافقة اللجنة الأخلاقية المؤسسية قد تكون مطلوبة.
3. تلطيخ مناعي الفلورسنت الحي
- استخدم 14 خلية div تم زراعتها على أغطية (50000 خلية لكل طبق 3.5 سم يحتوي على خمسة أغطية للأغطية).
- داخل غطاء المحرك، اشطف الأغطية ب NB المسخن مسبقا إلى 37 درجة مئوية.
- أضف العينة التي تحتوي في هذه الحالة على أجسام مضادة مضادة ل NMDAR (تستخدم كجسم مضاد أولي) مخففة في وسائط NB في الساعة 1:200 للمصل أو 1: 2 ل CSF وتحضن 1 ساعة عند 37 درجة مئوية (داخل حاضنة CO2 (5٪).
- اشطفيه بعناية باستخدام PBS 3x على RT.
- أضف محلول التثبيت (4٪ من الفورمالديهايد في PBS) واحتضنه في RT لمدة 5 دقائق.
تنبيه: عند التعامل مع 4٪ من الفورمالديهايد ، اعمل داخل غطاء المحرك وارتد معدات الحماية الشخصية الموصى بها. - اغسل 3x مع PBS لمدة 5 دقائق لكل منهما.
- أضف الجسم المضاد الثانوي الماعز المضاد للإنسان AF488 في 1:1000 تخفيف واحتضان في RT لمدة 1 ساعة.
ملاحظة: أثناء الحضانة، احم نفسك من التعرض للضوء عن طريق تغطيتها بورق الألمنيوم. - اغسل 3x مع PBS لمدة 5 دقائق لكل منهما. شطف بالماء المقطر
- قم بتركيب الغطاء بوسط تركيب سائل (على سبيل المثال ، وسائط تركيب مضادة للتلاشي مع DAPI ؛ حوالي 7 ميكرولتر) ، وقم بشفط أي سائل متبقي وشطفه بالماء المقطر. الخلايا العصبية جاهزة الآن للتصوير الفلوري.
تنبيه: عند التعامل مع وسط التركيب، ارتد معدات الحماية الشخصية الموصى بها.
الجزء 3: عرض التأثيرات المسببة للأمراض للأجسام المضادة باستخدام تصوير الكالسيوم
ملاحظة: يوضح هذا الجزء من البروتوكول كيفية تحديد ما إذا كانت الأجسام المضادة لدى المرضى لها تأثير وظيفي على الثقافات ، مما يشير إلى الإمراض. من أجل زيادة أهمية الآثار ، تم استخدام مجموعة من السائل الدماغي الشوكي من ثمانية مرضى. تم تسجيل نشاط الكالسيوم للثقافات الحية عند التحفيز الكيميائي (NMDA + Glycine) باستخدام مؤشر الكالسيوم الفلوري GECI (GCaMP5G). تتطلب هذه الدراسات مجهرا فلوريا مقلوبا مع غرفة خلية يمكنها الحفاظ على الظروف الفسيولوجية المطلوبة للخلايا العصبية.
4. تصوير الكالسيوم
- استخدم 14-18 خلية div تم زراعتها على أغطية (50000 خلية لكل طبق 3.5 سم مع خمسة أغطية علوية)
- قبل أسبوع واحد من التصوير ، أضف الناقل الفيروسي pAAV2-CAG-GCaMP5G عند 2.5 × 1010 GC / mL إلى الخلايا واحتضنه لمدة 5-7 أيام.
ملاحظة: هذا الناقل AAV من النمط المصلي 2 المتاح تجاريا والمعبأة مسبقا يعبر بشكل مفرط عن مؤشر الكالسيوم المشفر وراثيا GCaMP5G تحت مروج CAG. - قبل يوم واحد من التصوير ، أضف عينة المريض (في هذا المثال ، مجموعة من السائل الدماغي الشوكي المخفف 1:25 في NB + B27) واحتضنها لمدة 24 ساعة. قم دائما بترشيح العينات البشرية (حجم المسام 0.2 ميكرومتر) قبل الاستخدام لتجنب التلوث.
ملاحظة: بالنسبة لهذه الدراسات ، يجب تشغيل التحكم في السائل الدماغي الشوكي من الأشخاص الأصحاء بالتوازي. - في يوم التصوير ، قم بإعداد إعداد التصوير واضبط غرفة خلية المجهر على 37 درجة مئوية ، واملأ الممر بالماء المقطر ، وغرس 5٪ من ثاني أكسيد الكربون2 للحفاظ على الظروف الفسيولوجية للخلية.
- في غطاء المحرك ، اغسل الخلايا من الخطوة 3 مع 3 مل من EPS المسخن مسبقا إلى 37 درجة مئوية
- قم بتغطية الخلايا ب 2.45 مل من EPS ونقلها إلى غرفة خلية المجهر. أضف NBQX (10 ميكرومتر) لمنع مستقبلات AMPA و KA لتصور استجابة مستقبلات NMDA بشكل حصري.
- في المجهر الفلوري المقلوب المجهز بمصباح زئبق ومكعب مرشح FITC ، احصل على فيلم مدته 2 دقيقة مع إطارات مسجلة كل 100 مللي ثانية (نشاط عفوي).
ملاحظة: تم استخدام هدف جوي 20x NA 0.75 ، وتم التقاط الصور (512 × 512 بكسل ، تدرج رمادي 16 بت) كل 100 مللي ثانية باستخدام كاميرا sCMOS. - احصل على الفيلم الثاني لمدة 4 دقائق مع إطارات مسجلة كل 100 مللي ثانية. بعد فترة وجيزة من بدء عملية الاستحواذ ، أضف محلول التحفيز (NMDA [100 ميكرومتر] + الجلايسين [1 ميكرومتر]) إلى الطبق.
ملاحظة: ستؤدي إضافة الوسائط إلى الطبق إلى حدوث اضطراب يمكن أن يعطل ظروف التصوير (التركيز البؤري وكثافة التألق و / أو إشارة الخلفية غير المحددة). لا تضيف أكثر من 50 ميكرولتر من المحلول إلى الطبق المملوء بسعة 2.5 مل لتقليل احتمال حدوث مثل هذه التعديلات. - باستخدام برنامج معالجة الصور (تم استخدام ImageJ هنا) ، قم باستخراج إشارة التألق بمرور الوقت ، والتي تم الحصول عليها عند التحفيز ، من الثقافات المحتضنة مع المريض والتحكم في عينات CSF.
ملاحظة: تخضع مجسات GCaMP ، عند ارتباطها بأيونات الكالسيوم الحرة ، لتغيير توافقي يجعلها أكثر إشراقا. لذلك ، ترتبط الزيادة في شدة التألق بتدفق الكالسيوم بسبب إزالة الاستقطاب العصبي. - تحديد مناطق الاهتمام (ROI) لتحليلها. قم بتقسيم سومات الخلايا العصبية يدويا وإضافة عائد الاستثمار إلى مدير عائد الاستثمار (تحليل أدوات > > إدارة عائد الاستثمار > إضافة). احفظ عائد الاستثمار من قائمة مدير عائد الاستثمار (المزيد > حفظ).
- اضبط القياسات (تحليل > تعيين القياسات) وحدد متوسط القيمة الرمادية. استخراج ملف تعريف متوسط كثافة التألق من سومات الخلية بالنقر فوق المزيد > Multi Measure، ثم احفظ الجدول الذي تم إنشاؤه كجدول بيانات .xls.
- قم بإجراء تحليلات إحصائية لمقارنة التألق بين المجموعات (السائل الدماغي الشوكي للمرضى مقابل السائل الدماغي الشوكي للمراقبة).
النتائج
إنشاء ثقافات عصبية الحصين المنفصلة والجنينية والقوارض
يعتمد البروتوكول المعروض هنا على الدراسات المؤثرة حول زراعة الخلايا العصبية التي أجراها Banker و Goslin15. تم تنقيح البروتوكول للحصول على ثقافات عصبية ذات مورفولوجيا وكثافة ونقاء مثالية لإجراء دراسات الكشف عن الأجسام المضادة على سطح الخلايا العصبية. ينقسم بروتوكول التشريح والبذر إلى ثلاثة أجزاء (الشكل 1 أ). الجزء الأول ، عزل الحصين ، يتكون من الاستخراج الجراحي للأنسجة الحية (الشكل 1A ، اللوحة اليسرى). كما هو موضح في الشكل ، فإن فئران Wistar الحوامل مع أجنة E18 هي المادة الأساسية الرئيسية لثقافة ناجحة. بمجرد استخراج الدماغ من أجنة E18 ، يتم إجراء الجراحة المجهرية تحت المجهر المجسم. باستخدام الأدوات المناسبة (الشكل 1B) والمعالجة الدقيقة ، من الممكن فصل الحصين عن بقية الأنسجة العصبية. ويبين الشكل 1C التخلص من الأنسجة في وسائط محددة. يتكون الجزء الثاني من البروتوكول من تفكك خلية الحصين. وهي مقسمة إلى خطوتين (الشكل 1A ، اللوحة الوسطى): التفكك الأنزيمي والتفكك الميكانيكي للحصين ، مما يؤدي إلى خلايا مفردة سليمة ومنفصلة. باستخدام هذه المنهجية ، من الممكن الحصول على مزارع الخلايا بدون مجاميع الخلايا ، كما هو موضح في الشكل 2A-D. يتكون الجزء الثالث من البروتوكول من بذر الخلايا (الشكل 1A ، اللوحة اليمنى). هذا الجزء من البروتوكول أمر بالغ الأهمية من أجل ضبط كثافة وتجانس الثقافة العصبية في اللوحة. يوفر عد الخلايا وبذر 50000 خلية عصبية في مساحة طبق 3.5 سم كثافة مثالية لإجراء تجارب ليس فقط لتحديد وجود الأجسام المضادة لبروتينات سطح الخلايا العصبية (الشكل 3) ولكن أيضا لتحليل إمراض هذه الأجسام المضادة باستخدام تصوير الكالسيوم (الشكل 4).
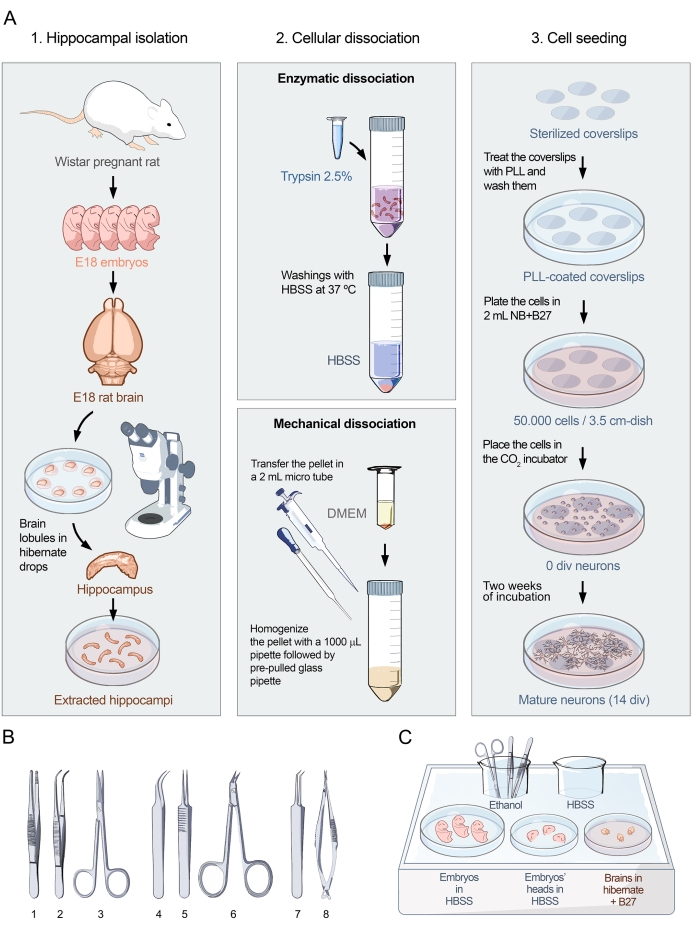
الشكل 1: البروتوكول البصري للثقافات الأولية للخلايا العصبية الحصينية. (أ) مخطط انسيابي يوضح الأجزاء الثلاثة من البروتوكول لإعداد مزارع الخلايا المنفصلة للخلايا العصبية الحصين من الفئران الجنينية في E18. ينقسم البروتوكول إلى 1. عزلة الحصين ، 2. تفكك الخلية ، و 3. بذر الخلايا. (ب) اختيار الأدوات الموصى بها لعزل الحصين مجمعة في ثلاث فئات: (1- ملقط، 2- ملقط منحني، 3- مقص) لجمع الأجنة، (4- ملقط منحني ناعم، 5- ملقط مستقيم ناعم، 6- مقص جراحي) لاستخراج الدماغ، و (7- ملقط بزاوية دقيقة، 8- مقص نابض دقيق) لعزل الحصين. (ج) تمثيل تخطيطي لصينية الثلج 1 مع لوحات ووسائط ضرورية لعزل الحصين. يتم وضع الأجنة والرؤوس في HBSS ، في حين يتم وضع الأدمغة في وسط السبات + B27. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
ثقافات الخلايا العصبية الحصين في 18 div ناضجة ومترابطة وتعبر عن البروتينات الهيكلية والوظيفية
في نمو ونضج الثقافات العصبية ، يمكن تقدير مرحلتين مختلفتين: مرحلة الاستقطاب للخلية العصبية (الشكل 2A ، B) ومرحلة التطور المتشنج وبناء الشبكة المشبكية (الشكل 2C ، D). يتم توزيع الخلايا على 1 div بالتساوي وقد التزمت باللوحة ، وطورت صفيحة حول جسم الخلية مع بدء تمدد الخلايا العصبية البسيطة (الشكل 2A). بعد بضعة أيام في الثقافة ، تمتد الخلايا العصبية لمسافة قصيرة. تظهر الخلايا استقطابا كبيرا ، ولكن هناك القليل من النمو الصافي (الشكل 2B). بعد هذه المرحلة ، يكون تكوين المشابك بارزا ، وتبدأ الخلايا العصبية في الترابط. تستمر الشبكة العصبية في النمو وتصبح أكثر تعقيدا (الشكل 2C). في 18 div ، تكون الخلايا العصبية ناضجة ومترابطة. تم بناء الشبكة العصبية (الشكل 2D). بمجرد تشكيل العمود الفقري المشبكي وتوصيله ، يتم استقطاب الخلايا العصبية بالكامل وتعبر عن جميع البروتينات الوظيفية والهيكلية. من بين العديد من البروتينات التي تعبر عنها الخلايا العصبية المستزرعة الناضجة ، تم اختيار المستقبل العصبي NMDA (الشكل 2E) والبروتين المشبكي PSD95 (الشكل 2F) هنا كعلامات تمثيلية. علاوة على ذلك ، من الممكن تصور المحاور بشكل انتقائي عن طريق وضع علامات على الخيوط العصبية (NF) (الشكل 2G) وتصور التشعبات عن طريق استهداف بروتين MAP2 (الشكل 2H).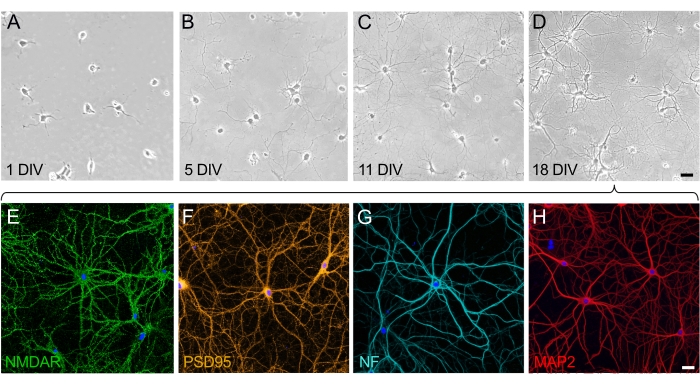
الشكل 2: المسار الزمني لنضج مزارع الخلايا المنفصلة للخلايا العصبية الحصينية. (A-D) صور تباين الطور للخلايا العصبية الحصين خلال الأيام ال 18 الأولى من الثقافة. (أ) الخلايا العصبية في 1 div عند التعلق بالركيزة المغلفة ب PLL. (ب) ظهور خلايا عصبية صغيرة في الخلايا العصبية في 5 div. (C) طورت الخلايا العصبية في 11 div عصبيات طويلة تستطيل وتكتسب خصائص محورية. (د) الخلايا العصبية في 18 div ناضجة وشكلت شبكة عصبية. شريط المقياس (A-D) = 40 ميكرومتر (E-H) صور الفلورسنت التمثيلية التي تم التقاطها بواسطة الفحص المجهري بالليزر البؤري باستخدام علامات انتقائية لإظهار الخلايا العصبية الناضجة عند 18 div. كانت الثقافات العصبية ثابتة وملطخة بالمناعة مع الأجسام المضادة التي تلطخ بشكل انتقائي مستقبلات الخلايا العصبية (NMDAR) ، (F) علامة متشابكة (PSD95) ، (G) علامة محورية (خيوط عصبية ، NF) ، و (H) علامة تغصنية (MAP2). شريط المقياس (E-H) = 20 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تتفاعل الأجسام المضادة في عينات المرضى مع مستضدات سطح الخلايا العصبية
تحتوي العينات (المصل والسائل الدماغي الشوكي) التي تم الحصول عليها من المرضى الذين يعانون من التهاب الدماغ المضاد ل NMDAR على أجسام مضادة ذاتية تتعرف على NMDAR الموجود على سطح الخلايا العصبية. ينتج عن حضانة الثقافات مع عينات المريض إشارة تألق مكثفة على سطح الخلية والتشعبات (الشكل 3A ، C). وعلى النقيض من ذلك، لا تنتج عينات التحكم أي إشارة تألق عند إعطائها للمزارع العصبية (الشكل 3ب، د). تظهر هذه النتائج كيف يمكن استخدام الثقافات لفحص عينات المرضى بحثا عن الأجسام المضادة ويمكن أن تؤدي إلى تحديد الأجسام المضادة الجديدة التي تستهدف سطح الخلايا العصبية.
عينة السائل الدماغي الشوكي من المريض تقلل من تركيز الكالسيوم داخل الخلايا في الثقافات التي يسببها NMDA من الخلايا العصبية الحصين
لتقييم تأثير الأجسام المضادة للمرضى على النشاط العصبي (بعد العلاج لمدة 24 ساعة) ، تمت مراقبة عابرات الكالسيوم داخل الخلايا بصريا من الخلايا العصبية المستزرعة في الوقت الفعلي عند التحفيز بوساطة NMDA. يولد تطبيق NMDA زيادة في شدة التألق ، كما هو موضح في التغيير في التألق الأخضر داخل الخلايا (الشكل 4A والفيديو التكميلي 1). أظهرت الخلايا العصبية المعالجة بعينة السائل الدماغي الشوكي الضابطة اختلافا أعلى في شدة التألق (56٪) عند تطبيق المحفز مقارنة بالخلايا المعالجة بعينة السائل الدماغي الشوكي للمريض. تم قياس الاختلافات في شدة التألق ، وتمت مقارنة منحنيات التحفيز بوساطة NMDA من البيانات المستخرجة من سوما الخلايا (الشكل 4B ، C). تظهر منحنيات التحفيز أنه كان هناك تدفق داخل الخلايا من الكالسيوم في كلا السيناريوهين ، لكن الثقافات المعالجة باستخدام السائل الدماغي الشوكي للمرضى (الخط الرمادي) أظهرت استجابة أقل من الثقافات المعالجة بالتحكم (الخط الأسود). تظهر هذه النتائج أن الأجسام المضادة الموجودة في السائل الدماغي الشوكي للمرضى تقلل من النشاط الخلوي بسبب تفاعل الأجسام المضادة مع NMDAR ، وبالتالي تسبب تأثيرا مسببا للأمراض.
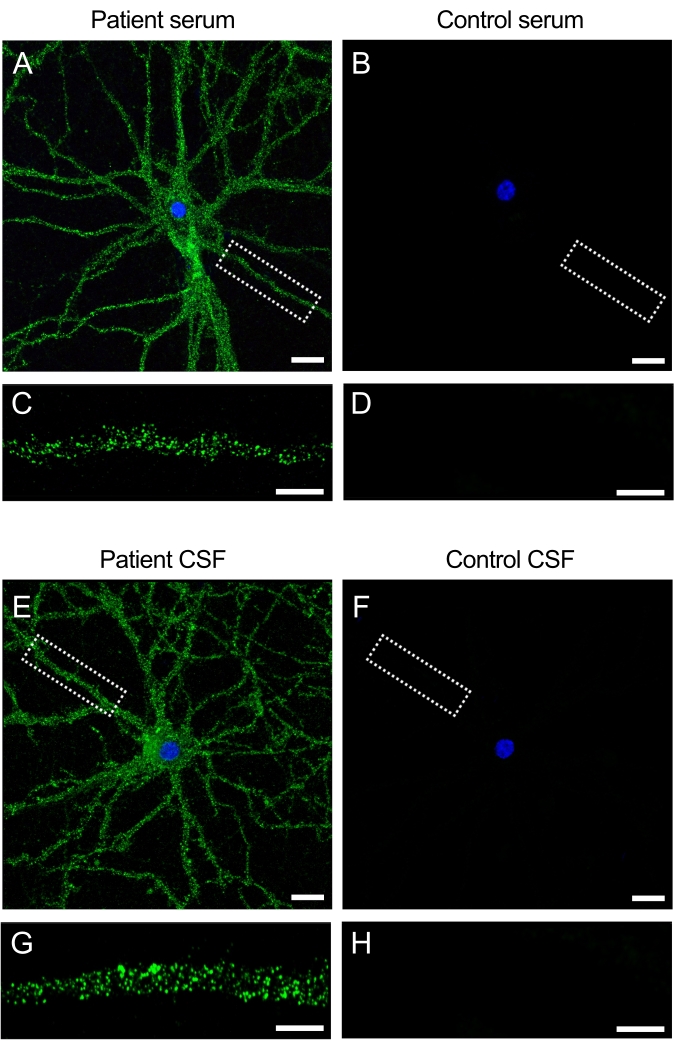
الشكل 3: تتفاعل الأجسام المضادة للمريض مع سطح الثقافات العصبية . (A ، E) Serum و CSF من المرضى الذين يعانون من التهاب الدماغ المضاد ل NMDAR يتفاعلون مع سطح خلية الخلايا العصبية الحية للفئران الحصين ، (B ، F) في حين أن المصل و CSF من مواضيع التحكم لا تظهر أي تفاعل. شريط المقياس (A,B,E,F) = 20 ميكرومتر. صورة تكبير أعلى لمادة تغصنية (63x) تظهر نمط السطح النموذجي للتفاعل ل (C ، G) مصل المريض و CSF و (D ، H) سلبي للضوابط. تم التقاط الصور بواسطة المجهر الضوئي بالليزر البؤري. شريط المقياس = 10 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
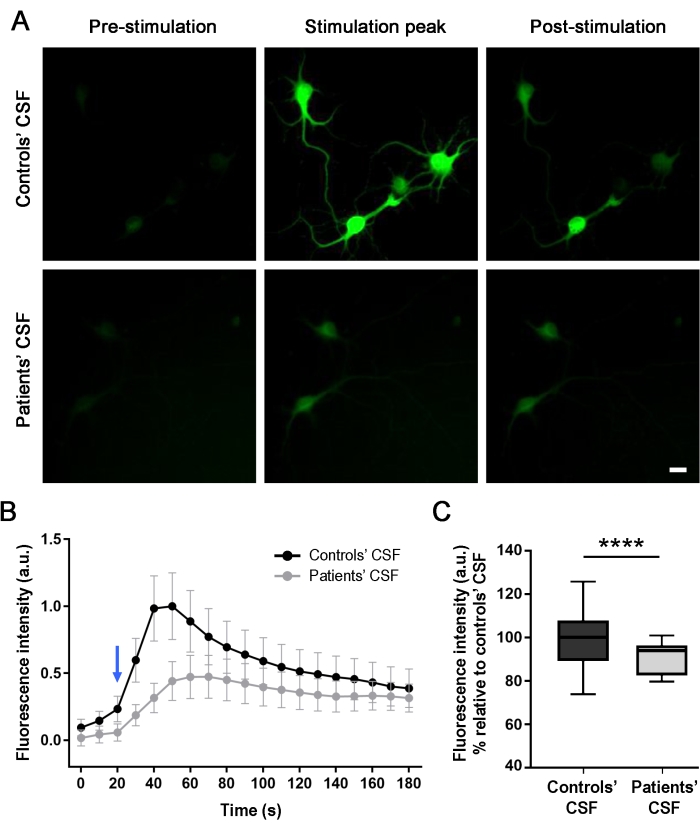
الشكل 4: تقلل الأجسام المضادة للمرضى من تدفق الكالسيوم في الخلايا العصبية للفئران التي تعبر عن GCaMP5G. (أ) أدى إعطاء محلول التحفيز (NMDA [100 ميكرومتر] + الجلايسين [1 ميكرومتر]) في مزارع الخلايا العصبية إلى تدفق الكالسيوم ، كما هو موضح من خلال زيادة التألق الأخضر داخل الخلايا (ذروة التحفيز) ، مقارنة بالصورة التي تم التقاطها قبل التحفيز (ما قبل التحفيز). بعد 120 ثانية ، تنخفض شدة التألق وتستقر (بعد التحفيز). أظهرت الثقافات التي عولجت باستخدام السائل الدماغي الشوكي للمرضى انخفاضا كبيرا (56٪) في زيادة الكالسيوم بوساطة NMDA مقارنة بالسائل الدماغي الشوكي للمراقبة. تم التقاط الصور بواسطة المجهر الفلوري. شريط المقياس = 20 ميكرومتر. (ب) مخطط لإحدى التجارب المستقلة الثلاث التي تمثل شدة التألق بمرور الوقت (180 ثانية) للثقافات المعالجة بالسائل الدماغي الشوكي (الخط الأسود) والسائل الدماغي الشوكي للمرضى (الخط الرمادي) عند تحفيز NMDA (السهم الأزرق). n (CSF الخاص بعناصر التحكم) = 20 خلية; n (السائل الدماغي الشوكي للمرضى) = 28 خلية. يتم تمثيل البيانات كمتوسط ± تظهر مخططات مربع SEM. (C) النسب المئوية المتوسطة و 25 و 75. تشير الشعيرات إلى القيم الدنيا والقصوى. تم إجراء تقييم الدلالة من خلال تحليل ثنائي الاتجاه للتباين (ANOVA ؛ p < 0.0001) واختبارات Mann-Whitney U (p < 0.0001). واعتبرت قيمة p < 0.05 ذات دلالة إحصائية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيديو تكميلي 1: فيديو يظهر اثنين من الخلايا العصبية الحصين تعبر عن GCaMP5G جنبا إلى جنب: الخلايا العصبية المعالجة مع CSF السيطرة (يسار) مقابل الخلايا العصبية المعالجة مع السائل الدماغي الشوكي للمرضى (يمين). يؤدي تطبيق NMDAR (التحفيز) إلى زيادة في شدة التألق داخل الخلايا في كلتا الحالتين ، ولكن مع مستوى أعلى بكثير في الخلايا العصبية المعالجة باستخدام السائل الدماغي الشوكي للتحكم مقارنة بالسائل الدماغي الشوكي للمرضى. تم التقاط الصور بواسطة الفحص المجهري الفلوري وتحريرها باستخدام ImageJ بتطبيق جدول البحث (LUT) Fire. 1700 إطار (170 ثانية) ؛ تسارع 5 مرات. شريط المقياس = 10 ميكرومتر. يرجى النقر هنا لتنزيل هذا الملف.
Discussion
لقد فتح المجال المتنامي للمناعة الذاتية بوساطة الأجسام المضادة نافذة من الفرص لتحديد الأجسام المضادة الذاتية العصبية التي يمكن استخدامها لتحسين تشخيص المرضى وعلاجهم. ثقافات الخلايا العصبية الحصين هي أداة أساسية لتحديد الأجسام المضادة. لذلك ، من المهم إجراء بروتوكول موحد للحصول على نتائج موثوقة وقابلة للتكرار. تتم مناقشة أهم الخطوات التي يجب مراعاتها والقيود واستكشاف الأخطاء وإصلاحها هنا.
يمكن تجميع الخطوات الحاسمة لهذا البروتوكول في ثلاث فئات اعتمادا على ما إذا كانت تؤثر على نقاء أو تجانس أو بقاء الخلايا العصبية الحصينية.
النقاء - للحصول على مزارع الخلايا الأولية المثلى ، يجب أن يكون المحقق واثقا ومدربا وقادرا على العمل بسرعة ، خاصة لتقليل وقت التشريح. حتى لو كانت الخلايا العصبية الهرمية هي نوع الخلايا الرئيسية ، فإن الحصين يحتوي على مجموعة متنوعة من الخلايا العصبية الداخلية14. لتوليد ثقافات ذات خلايا دبقية صغيرة ، يجب استخراج الحصين مع الحد الأدنى من الأنسجة المحيطة. يساعد استخدام خلفية سوداء أثناء التشريح على تحديد حدود الحصين تحت المجهر المجسم. بالإضافة إلى ذلك ، ينبغي أن يؤخذ في الاعتبار أن انخفاض كثافة الخلايا يؤدي إلى دعم أقل للباراكرين ويجعل من الصعب الحفاظ على الثقافة13. لذلك ، من المهم الحفاظ على هذا التوازن في الاعتبار. هذا مهم في دراسات التصوير التي تستخدم عددا منخفضا من الخلايا (50000 خلية عصبية لكل طبق 3.5 سم). لتكون قادرة على الحصول على وقت إضافي لاستخراج الحصين ، يجب استخدام وسائط السبات التي تحافظ على الأنسجة17. العمل مع الأدوات الجراحية الكافية ضروري أيضا. الأدوات عالية الدقة حساسة ، لذلك يجب ضمان قابلية تكرار التقنية من خلال حمايتها بعناية.
التجانس - لتطوير ثقافة بدون مجاميع الخلايا ، تمت ترقية تفكك الخلايا الميكانيكية من خلال الجمع بين استخدام ماصات زجاجية مسحوبة مسبقا مع ماصة قياسية سعة 1000 ميكرولتر.
الجدوى - في هذا البروتوكول ، لم تتم إضافة أي مضادات حيوية لأنها تؤثر على استثارة الخلايا العصبية وتغير الخصائص الكهروفسيولوجية للخلايا العصبية المستزرعة18. لذلك ، من المحتمل جدا حدوث تلوث إذا لم يتم الحفاظ على أعلى معايير العقم. درجة الحرارة هي أيضا عامل رئيسي. الحفاظ على الأنسجة باردة أثناء عزل الحصين يبطئ عملية التمثيل الغذائي ويقلل من تدهور الخلايا. لذلك ، تم الاحتفاظ بالأنسجة على الجليد حتى عملية تفكك الخلية. علاوة على ذلك ، من الأهمية بمكان إيجاد التوازن الصحيح أثناء تفكك الخلايا الأنزيمية التي تفكك الخلايا دون تحلل خلوي ملحوظ. في هذا البروتوكول ، تم تحسين توقيت الحضانة بالتريبسين وخطوات الغسيل اللاحقة للحصول على خلايا فردية ذات مساحة كافية للسماح بإنشاء شبكة عصبية مناسبة.
تم العثور على خطوات حاسمة أيضا في الفلورسنت المناعي الحي وتسجيلات نشاط الكالسيوم من الثقافات العصبية. لإجراء تلطيخ مناعي حي ناجح لتحديد وجود الأجسام المضادة لبروتينات سطح الخلية في عينات المرضى ، يجب على المرء تجنب اختراق الخلايا التي من شأنها أن تسمح للأجسام المضادة بالوصول إلى البروتينات داخل الخلايا. بالإضافة إلى ذلك ، استنادا إلى عيار الأجسام المضادة ، يجب تعديل وقت الحضانة وتخفيف العينة وفقا لذلك (على سبيل المثال ، يمكن للأجسام المضادة ذات العيار العالي جدا أن تعطي تلطيخا في الخلفية يجعل تفسير النتائج صعبا). عند إجراء تقييم الإمراض للأجسام المضادة الذاتية باستخدام تصوير الكالسيوم ، يحتاج المرء إلى استخدام وسائط مثالية لقياسات النشاط الخلوي (على سبيل المثال ، قمع Mg2+ في وسط الثقافة مهم للأداء الجيد). علاوة على ذلك ، بالنسبة للتصوير الفلوري ، يجب تجنب الوسائط التي تحتوي على مؤشرات الأس الهيدروجيني مثل الفينول الأحمر لأنها تقدم إشارة خلفية غير محددة.
هناك نوعان من القيود الرئيسية لاستخدام الثقافات العصبية الحصين. أولا ، بالمقارنة مع خطوط الخلايا المستقرة ، يجب إنشاء الثقافات الأولية باستمرار ، وهذا يعني استخدام المختبر بانتظام. يمكن أن تحل خطوط الخلايا الجذعية متعددة القدرات المستحثة (iPSC) محل الحاجة إلى استخدام النماذج الحيوانية ، لكن بروتوكولات التمايز الخاصة ب iPSC لا تزال غير مثالية. ثانيا ، لا تعبر الخلايا العصبية المشتقة من iPSC عن الأطياف الكاملة للبروتينات السطحية ، وبالتالي ، إذا تم استخدامها ، فإن عدم وجود تفاعل لا يعني بالضرورة سلبية العينة19.
هناك ثلاث طرق للكشف عن وجود الأجسام المضادة الذاتية في المصل أو السائل الدماغي الشوكي للمرضى المشتبه في إصابتهم ب AE: الفحص القائم على الأنسجة (TBA) باستخدام أنسجة دماغ الفئران ، والفحص القائم على الخلايا (CBA) باستخدام خلايا HEK المنقولة للتعبير عن البروتينات العصبية ، والتطبيق المذكور هنا باستخدام الثقافات الحية للخلايا العصبية الحصين19. تكمن أهمية طريقة الخلايا العصبية الحصينية المستزرعة في قدرتها على التمييز بين التفاعل مع المستضدات السطحية وداخل الخلايا التي لا يمكن تمييزها بسهولة بواسطة TBA. إلى جانب ذلك ، فإن الثقافات العصبية الأولية ، على عكس CBA في الخلايا المنقولة HEK ، لا تقتصر على ذخيرة البروتينات المنقولة. بالإضافة إلى ذلك ، يمكن استخدام الخلايا العصبية الحصينية المستزرعة لتحديد الأجسام المضادة الجديدة ومستضداتها المستهدفة عند دمجها مع الترسيب المناعي وقياس الطيف الكتلي ، وبالتالي توسيع نطاق الأجسام المضادة التي يمكن تحديدها. وأخيرا ، فإنه يسمح بتقييم الآثار المسببة للأمراض للأجسام المضادة الذاتية عن طريق طرق التصوير الحية التي يمكنها مراقبة التغيرات في النشاط الخلوي. في الختام ، فإن تحديد الأجسام المضادة الذاتية الجديدة يمكن في النهاية من بدء علاجات مناعية محددة لتحسين نتائج المرضى.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح.
Acknowledgements
نشكر ميرشي ريفاس وماريا مارسال وغوستافو كاسترو وجوردي كورتيس وألينا هيرشمان وأنخيل ساندوفال (ICFO-Institut de Ciències Fotòniques) ومرسيدس ألبا وماريا رادوسيفيتش وديفيد سوتو وكزافييه غاسول ومار غواسب وليديا ساباتير (IDIBAPS، مستشفى كلينيك، جامعة برشلونة) على دعمهم الفني وعلى توفير الكواشف، وجوزيب دالماو وميرنا ر. روزنفيلد (IDIBAPS، مستشفى كلينيك ، جامعة برشلونة) لمراجعتهم النقدية للمخطوطة والإرشاد. وقد مول هذه الدراسة معهد كارلوس الثالث (ISCIII) وشارك في تمويلها الاتحاد الأوروبي، ومؤسسة (PI20/00280، J.P.)، ومؤسسة CELLEX (P.L-A.)؛ وزارة الاقتصاد والمنافسة - برنامج سيفيرو أوتشوا لمراكز التميز في البحث والتطوير (CEX2019-000910-S, P.L-A.)؛ برنامج CERCA و Laserlab-Europe (871124 ، P.L-A.) ؛ وزارة العلوم والابتكار (MCIN/AEI/10.13039/501100011033, P.L-A.)؛ وفوندو سوشال يوروبيو (PRE2020-095721, M.C.).
Materials
| Name | Company | Catalog Number | Comments |
| 10 cm Cell culture dish | Nunc | 12-565-020 | |
| 12 mm round coverslips | Fisher | NC9708845 | |
| 20x NA 0.75 S Fluor air objective | Nikon | CFI Super Fluor 20X | |
| 3.5 cm Cell culture dish | Nunc | 12-565-90 | |
| 6 cm Cell culture dish | Nunc | 12-565-94 | |
| B27 supplement | Gibco | 17504-044 | |
| Beaker 100 mL | Pirex | - | |
| Borax | Sigma-Aldrich | B9876 | |
| Boric Acid | Sigma-Aldrich | B0252 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved forceps | FST | 11009-13 | |
| D-Glucose | Sigma-Aldrich | D9434 | |
| DMEM High Glucose (4.5 g/L), without L-Glutamine, without Phenol Red | Capricorn | DMEM-HXRXA | |
| Female Wistar rat (18-days pregnant) | Janvier | - | |
| Fetal Bovine Serum (FBS) | Biowest | S181B-500 | |
| Fine-angled forceps | FST | 11251-35 | |
| Fine-curved forceps | FST | 11272-30 | |
| Fine-straight forceps | FST | 11251-23 | |
| FITC filter cube | Nikon | Standard Series | |
| Forceps | FST | 11000-12 | |
| Goat anti-Human AF488 | Invitrogen | A11013 | |
| HBSS | Capricorn | HBSS-1A | |
| HEPES | Sigma-Aldrich | H3375 | |
| Hibernate-E medium | Gibco | A12476-01 | |
| Horse Serum (HS) | Thermofisher | 26050088 | |
| Human anti-NMDAR antibody (CSF) | Patient Sample | - | |
| Human anti-NMDAR antibody (Serum) | Patient Sample | - | |
| ImageJ/Fiji | NIH | v1.50i | |
| Inverted fluorescence microscope | Nikon | Eclipse TE2000-U | |
| KCl | Sigma-Aldrich | 44675 | |
| L-Glutamine | Biowest | X0550-100 | |
| Mercury lamp | Nikon | C-HGFI | |
| Microscope cell chamber | Custom-build | - | |
| NaCl | Sigma-Aldrich | S9887 | |
| NBQX | Tocris | 373 | |
| Neurobasal without phenol red | Gibco | 12348-017 | |
| NMDA | Sigma-Aldrich | M3262 | |
| pAAV2-CAG-GCaMP5G | VectorBiolabs | - | |
| Paraformaldehyde 4% | Thermo scientific | J199943-K2 | |
| Penicillin-Streptomycin | Biowest | L0022-100 | |
| Phosphate-Buffered Saline | Gibco | 10010023 | |
| Poly-L-Lysine (PLL) | Peptide international | OKK-35056 | |
| Polystyrene ice tray | - | - | re-used cap of a polysterene box |
| Precision spring-scissors | FST | 15000-08 | |
| ProLong Gold with DAPI (antifading mounting media) | Molecular Probes | P36941 | |
| Scissors | FST | 14068-12 | |
| Sodium pyruvate | Biowest | L0642-100 | |
| Stereo microscope | Zeiss | Stemi 2000 | |
| Surgery scissors | FST | 14081-09 | |
| Trypsin 2.5% | Gibco | 15090046 | |
| Water, sterile endotoxine free | Sigma-Aldrich | W3500 |
References
- Dalmau, J., Geis, C., Graus, F. Autoantibodies to synaptic receptors and neuronal cell surface proteins in autoimmune diseases of the central nervous system. Physiological Reviews. 97 (2), 839-887 (2017).
- Dalmau, J., Graus, F. Antibody-mediated encephalitis. The New England Journal of Medicine. 378 (9), 840-851 (2018).
- Dalmau, J., et al. Paraneoplastic anti- N -methyl-D-aspartate receptor encephalitis associated with ovarian teratoma. Annals of Neurology. 61 (1), 25-36 (2007).
- Dalmau, J., et al. Anti-NMDA-receptor encephalitis: case series and analysis of the effects of antibodies. Lancet Neurology. 7 (12), 1091-1098 (2008).
- Lai, M., et al. AMPA receptor antibodies in limbic encephalitis alter synaptic receptor location. Annals of Neurology. 65, 424-434 (2009).
- Lancaster, E., et al. Antibodies to the GABAB receptor in limbic encephalitis with seizures: case series and characterisation of the antigen. Lancet Neurology. 9 (1), 67-76 (2010).
- Lai, M., et al. Investigation of LGI1 as the antigen in limbic encephalitis previously attributed to potassium channels: a case series. Lancet Neurology. 9 (8), 776-785 (2010).
- Sabater, L., et al. A novel NREM and REM parasomnia with sleep breathing disorder associated with antibodies against IgLON5: a case series, pathological features, and characterization of the antigen. Lancet Neurology. 13 (6), 575-586 (2014).
- Hughes, E. G., et al. Cellular and synaptic mechanisms of anti-NMDA receptor encephalitis. The Journal of Neuroscience. 30 (17), 5866-5875 (2010).
- Moscato, E. H., et al. Acute mechanisms underlying antibody effects in anti-N-methyl-D-aspartate receptor encephalitis. Annals of Neurology. 76 (1), 108-119 (2014).
- Planagumà, J., et al. Human N-methyl D-aspartate receptor antibodies alter memory and behaviour in mice. Brain. 138 (1), 94-109 (2015).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Research. 126 (3), 397-425 (1977).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocols. 1 (5), 2406-2415 (2006).
- Benson, D. L., Watkins, F. H., Steward, O., Banker, G. Characterization of GABAergic neurons in hippocampal cell cultures. Journal of Neurocytology. 23 (5), 279-295 (1994).
- Banker, G., Goslin, K. . Culturing Nerve Cells. , (1998).
- Nunez, J. Primary culture of hippocampal neurons from P0 newborn rats. Journal of Visualized Experiments. (19), e895 (2008).
- Brewer, G. J., Price, P. J. Viable cultured neurons in ambient carbon dioxide and hibernation storage for a month. Neuroreport. 7 (9), 1509-1512 (1996).
- Bahrami, F., Janahmadi, M. Antibiotic supplements affect electrophysiological properties and excitability of rat hippocampal pyramidal neurons in primary culture. Iranian Biomedical Journal. 17 (2), 101-106 (2013).
- Ricken, G., et al. Detection methods for autoantibodies in suspected autoimmune encephalitis. Frontiers in Neurology. 9, 841 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved