Method Article
Otoimmün Ensefalitte Yer Alan Yeni Patojenik Antikorları Tespit Etmek ve İncelemek için Hipokampal Nöronal Kültürler
Bu Makalede
Özet
Otoimmün ensefalit, merkezi sinir sisteminin antikor aracılı hastalıklarının yeni bir kategorisidir. Hipokampal nöronlar bu antikorları keşfetmek ve karakterize etmek için kullanılabilir. Bu makalede, hastaların serum ve beyin omurilik sıvısındaki otoantikorları belirlemek için primer hücre kültürü ve immün boyama için bir protokol sunulmaktadır.
Özet
Son 15 yılda, merkezi sinir sisteminin (CNS) antikor aracılı hastalıklarının yeni bir kategorisi karakterize edilmiştir ve şimdi "otoimmün ensefalit" (AE) olarak tanımlanmaktadır. Şu anda bilinen 17 AE sendromu vardır ve hepsi nöronal hücre yüzeyine veya sinaptik proteinlere karşı antikorlarla ilişkilidir. Klinik sendromlar karmaşıktır ve ilişkili antikorun tipine göre değişir. Bu hastalıkların en bilinenleri, ciddi hafıza ve davranış bozuklukları ile ilişkili belirgin bir nöropsikiyatrik bozukluk olan anti-N-metil D-aspartat reseptörü (NMDAR) ensefalitidir. İlişkili antikorlar, N-terminal alanındaki NMDAR'ın GluN1 alt birimi ile reaksiyona girer. AE antikorlarının keşfi ve karakterizasyonu için en sık kullanılan yaklaşım, ayrışmış, fetal, kemirgen hipokampal nöronların kültürünü içerir. Antikor karakterizasyonu sürecinde, kültürdeki canlı nöronlar hastanın serum veya BOS'una maruz kalır ve reaktivitenin tespiti, hastanın serum veya BOS örneklerinin nöronal yüzey antijenlerine karşı antikorlar içerdiğini gösterir. Hipokampal kültürler, nöronların yapısal veya fonksiyonel değişikliklerine neden olup olmadıklarını inceleyerek hastalardaki antikorların potansiyel olarak patojenik olup olmadığını belirlemek için de kullanılabilir. Bu çalışmaların başarı düzeyi, kültürlerin kalitesine ve hasta örneklerinin reaktivitesini elde etmek ve tespit etmek için kullanılan protokollere bağlıdır. Bu makalede, hastaların serumunda veya BOS'unda antikorların varlığını belirlemek için fetal sıçan hipokampal nöronlarının primer hücre kültürü için immün boyama ile birlikte optimize edilmiş bir protokol sunulmaktadır. Kültürlü nöronlar ve kalsiyum görüntüleme kullanılarak NMDAR antikorlarının potansiyel patojenik etkilerinin nasıl inceleneceğine dair bir örnek de sunulmaktadır.
Giriş
Otoimmün ensefalit (AE), nöronal yüzeyi veya sinaptik proteinleri hedef alan antikorların aracılık ettiği merkezi sinir sistemi (CNS) hastalıklarının yakın zamanda keşfedilen bir kategorisidir 1,2. Klinik özellikler antikora göre değişmekle birlikte genellikle bozulmuş hafıza ve biliş, davranış değişikliği ve psikiyatrik semptomlar, anormal hareketler, uyku disfonksiyonu, bilinç düzeyinde azalma ve nöbetleri içerir. Bu bozukluklar her yaştan bireyi etkileyebilir, bazı AE türleri ağırlıklı olarak çocukları ve genç yetişkinleri etkiler2.
Son 15 yılda, spesifik nöronal yüzey/sinaptik proteinlere karşı antikorları olan 17 AE sendromu tanımlanmıştır (Tablo 1). Nöronal hedeflerin birkaç örneği arasında sinaptik uyarıcı reseptörler NMDAR3,4 ve AMPAR5, sinaptik inhibitör reseptör GABAbR6, nöronal salgılanan protein LGI17 ve hücre adezyon molekülü IgLON58 bulunmaktadır. Bu AE'lerin çoğu için, çalışmalar antikorların hedef antijenlerinin yapısını veya işlevini bozduğunu ve patojenik bir rolü güçlü bir şekilde desteklediğini göstermiştir. Örneğin, anti-NMDAR ensefalitinde, antikorlar NMDAR'ın GluN1 alt biriminin N-terminal alanı ile reaksiyona girer ve bu reseptörlerin seçici ve geri dönüşümlü bir içselleştirilmesini üreterek belirgin nöropsikiyatrik değişikliklerle sonuçlanır 4,9,10,11. Bu nedenle, bir hastanın serumunda veya BOS'unda bilinen 17 antikordan herhangi birinin tanımlanması, belirli bir AE'nin tanısını belirleyen bir tanı testi olarak da kullanılabilir.
Bu antikorların tanımlanması ve karakterizasyonu için daha sık kullanılan tekniklerden biri, ayrışmış, fetal, kemirgen hipokampal nöronların kültürlerinin kullanımını içerir. Bu kültürler çeşitli nedenlerden dolayı yararlıdır: embriyonik beynin ayrışması kolaydır ve nöronal kültürlerde kontaminasyonun ana kaynağı olan düşük düzeyde glial hücreler içerir12; hipokampusun hücre popülasyonu, CNS'nin diğer bölgelerinin çoğuna kıyasla nispeten homojendir ve piramidal hücreler büyük çoğunluğu temsil eder13,14; kültürler, piramidal nöronların üretimi tamamlandığında geç evre embriyolardan hazırlanır, ancak granül hücreler henüz gelişmemiştir, bu da kültürün homojenliğine daha da katkıda bulunur; kültürlendiğinde, piramidal nöronlar ana fenotipik özelliklerinin çoğunu ifade eder, iyi gelişmiş dendritler oluşturabilir ve yapısal ve elektrofizyolojik araştırmalar için kullanılabilecek sinaptik olarak bağlı ağlar kurabilir12,13; antikorlar canlı nöronlara nüfuz edemediğinden, canlı kültürlerin kullanımı hücre yüzeyinde bulunan antijenik hedeflerin tanımlanmasına izin verir; ve nöronal kültürlerden antikor-antijen kompleksinin immünopresipitasyonu, hedef antijenintanımlanmasına izin verir 5.
Nöronal kültürleri kullanan çalışmaların başarısı, kültürlerin kalitesine ve hastanın serum veya beyin omurilik sıvısının (BOS) immünoreaktivitesini değerlendirmek için kullanılan protokollere büyük ölçüde bağlıdır. Kültürleri etkileyebilecek değişkenler arasında, kültür gelişiminden önce hipokampüsün izolasyonu, dokunun ayrışması, kaplama yoğunluğu, kullanılan büyüme yüzeyi ve ortamın bileşimi13,15,16 yer almaktadır. Bu makalede, fetal sıçan hipokampal nöronlarının primer hücre kültürü için, bilinen AE antijenlerine ve potansiyel olarak yeni yüzey hedeflerine karşı antikorların varlığını belirlemek için kullanılabilecek floresan immünoboyama ile birlikte optimize edilmiş bir protokol sunulmaktadır. Ayrıca, GCaMP ailesinden, GCaMP5G'den genetik olarak kodlanmış bir kalsiyum göstergesini (GECI) ifade eden kültürlü hipokampal nöronları kullanarak NMDAR antikorlarının patojenik etkilerinin canlı hücre görüntüleme teknikleriyle nasıl inceleneceğine dair bir örnek sunmaktadır.
| Hedef protein | Protein fonksiyonu | Hücre bölmesi | Ana sendrom |
| NMDAR | İyon Chanel · | Sinaptik protein | Anti-NMDAR ensefaliti |
| AMPAR | İyon Chanel · | Sinaptik protein | Limbik ensefalit |
| GluK2 | İyon Chanel · | Sinaptik protein | Ensefalit |
| GABAaR | İyon Chanel · | Sinaptik protein | Ensefalit |
| GABAbR | Metabotropik reseptör | Sinaptik protein | Limbik ensefalit |
| mGluR1 | Metabotropik reseptör | Sinaptik protein | Ensefalit |
| mGluR2 | Metabotropik reseptör | Sinaptik protein | Ensefalit |
| mGluR5 | Metabotropik reseptör | Sinaptik protein | Ensefalit |
| D2R Serisi | Metabotropik reseptör | Sinaptik protein | Bazal gangliyon ensefaliti |
| LGI1 | Adezyon molekülü | Hücre yüzey proteini | Limbik ensefalit |
| CASPR2 | Adezyon molekülü | Hücre yüzey proteini | Limbik ensefalit |
| IgLON5 Serisi | Adezyon molekülü | Hücre yüzey proteini | Anti-IgLON5 hastalığı |
| Nöreksin-3α | Adezyon molekülü | Hücre yüzey proteini | Ensefalit |
| DNER (Tr) | Transmembran proteini | Hücre yüzey proteini | Ensefalit |
| SEZ6L | Transmembran proteini | Hücre yüzey proteini | Ensefalit |
| Amfifizin | Yapısal molekül | Hücre yüzey proteini | Limbik ensefalit |
| cesaret | Peptitaz | Hücre yüzey proteini | Ensefalit |
Tablo 1: Nöronal hücre yüzeyine ve sinaptik proteinlere karşı antikorlar.
Protokol
Tüm prosedürler, deney hayvanlarının kullanımı ve bakımı ile ilgili Avrupa (2010/63/UE) düzenlemelerini takiben Barselona Üniversitesi yerel etik komitesi tarafından onaylanmıştır. Hastalardan yazılı bilgilendirilmiş onam alındı ve çalışma, insan örneklerinin kullanımı için yerel kurumsal inceleme kurulu tarafından onaylandı (Hospital Clínic, HCB / 2018/0192).
NOT: Geçerli protokolde üç bölüm vardır. Birincisi nöronal kültürlerin kurulması, ikincisi nöronların canlı kültürlerini kullanarak yüzey antikorlarının tespiti ve üçüncüsü bu antikorların patojenitesini belirlemektir.
BÖLÜM 1: Ayrışmış, fetal, kemirgen hipokampal nöronal kültürlerin kurulması
1. Hazırlık adımları
- Kaplama yüzeylerinin Poli-L-Lizin kaplaması (diseksiyondan 3 gün önce)
- Borat tamponunu, 500 mL damıtılmış suya 2.38 g borik asit ve 1.27 g boraks ekleyerek ve eriyene kadar 15 dakika karıştırarak hazırlayın. Bir kaputun altında, tampon çözeltisini filtreleyerek (0,2 μm gözenek boyutu) sterilize edin, etiketleyin ve oda sıcaklığında (RT) saklayın.
NOT: Bu çözelti kararlıdır ve 6 ay boyunca kullanılabilir.
DİKKAT: Borat tamponu hazırlarken, önerilen kişisel koruyucu ekipmanı kullanın. - Poli-L-Lizin (PLL) stok çözeltisini (100 mg / mL) 10 mL damıtılmış suya 1 g PLL ekleyerek ve çözünene kadar karıştırarak hazırlayın. 500 μL PLL stok çözeltisi alikotu hazırlayın. 1 mg / mL'lik nihai bir konsantrasyona ulaşmak için, 50 mL borat tamponuna 500 μL PLL aliquot ekleyin ve çözünene kadar girdap yapın ve çözeltiyi filtreleyerek sterilize edin (0.2 μm gözenek boyutu).
NOT: Bu çözelti kararlıdır ve 6 ay boyunca kullanılabilir. - Yüzeyleri kaplama için hazırlayın. İmmün boyama prosedürleri için 12 mm çapında kapaklar ve canlı nöronların görüntülenmesini içerecek çalışmalar için cam tabanlı tabaklar kullanın. Kapak kayışı kullanıyorsanız, otoklav yapın ve ardından her bir kaba (3,5 cm çaplı) beş kapak kapağı yerleştirin.
NOT: Kapak kapağının kalınlığı, elde edilen görüntülerin sinyalinin kalitesini ve yoğunluğunu etkiler. Çoğu mikroskop hedefi, # 1.5 kapak kaymaları için tasarlanmıştır. Görüntüleme kurulumuna ve tekniklerine göre uygun kapak kapaklarını seçin. - Bir kaputun altında, her bir tabağa 1,5 mL PLL çözeltisi ekleyin (cam tabanlı tabak veya beş kapaklı 3,5 cm'lik tabak). Tüm kapak kapaklarının suya batırıldığından ve RT'de 24 saat boyunca saklandığından emin olun.
- Diseksiyondan 2 gün önce, PLL çözeltisini aspire edin ve steril endotoksin içermeyen suyla yıkayın, kapak kapaklarının suya batırıldığından emin olun. Suyu bulaşıklarda tutun ve RT'de 24 saat saklayın.
- Diseksiyondan 1 gün önce, suyu aspire edin ve NB + B27 kültür ortamı ile değiştirin (aşağıya bakınız) ve bulaşıkları 24 saat boyunca 37 ° C'de bir inkübatöre yerleştirin.
- Borat tamponunu, 500 mL damıtılmış suya 2.38 g borik asit ve 1.27 g boraks ekleyerek ve eriyene kadar 15 dakika karıştırarak hazırlayın. Bir kaputun altında, tampon çözeltisini filtreleyerek (0,2 μm gözenek boyutu) sterilize edin, etiketleyin ve oda sıcaklığında (RT) saklayın.
- Kültür ortamı ve stok çözeltisinin hazırlanması (diseksiyondan 1 gün önce)
- Dulbecco'nun Modifiye Kartal Ortamı (DMEM): L-Glutamin ve fenol kırmızısı olmadan 500 mL DMEM Yüksek Glikozuna (4.5 g / L), 50 mL at serumu, 50 mL fetal sığır serumu (FBS), 10 mL L-glutamin (200 mM), 10 mL sodyum piruvat (100 mM), 10 mL penisilin-streptomisin (10.000 U / mL) ekleyin. Filtreleyin (0,2 μm gözenek boyutu) ve sıkıca kapalı bir kapakla 4 oC'de 5 mL alikotlarda saklayın.
NOT: Bu çözelti kararlıdır ve 1 ay boyunca kullanılabilir. - B27 (NB + B27) ile desteklenmiş nörobazal (NB) ortam: Fenol kırmızısı olmadan 50 mL NB ortamına 1 mL B27 takviyesi ekleyin.
- B27 (Hazırda Bekletme + B27) ile desteklenmiş hazırda bekletme-E ortamı: 50 mL Hazırda Bekletme-E ortamına 1 mL B27 takviyesi ekleyin.
- Hücre Dışı Fizyolojik Çözelti (EPS): 1 L steril suya, belirtilen son konsantrasyonlarda aşağıdakileri ekleyin: NaCl (140 mM), KCl (3.5 mM), HEPES (10 mM), glikoz (20 mM) ve CaCl 2 (2 mM). Çözünene kadar karıştırın ve NaOH (0,5 M) veya HCl (0,5 M) ekleyerek pH'ı 7,4'e ayarlayın. Kaputun altında, filtreleyerek (0,2 μm gözenek boyutu) sterilize edin ve 4 oC'de saklayın.
- Dulbecco'nun Modifiye Kartal Ortamı (DMEM): L-Glutamin ve fenol kırmızısı olmadan 500 mL DMEM Yüksek Glikozuna (4.5 g / L), 50 mL at serumu, 50 mL fetal sığır serumu (FBS), 10 mL L-glutamin (200 mM), 10 mL sodyum piruvat (100 mM), 10 mL penisilin-streptomisin (10.000 U / mL) ekleyin. Filtreleyin (0,2 μm gözenek boyutu) ve sıkıca kapalı bir kapakla 4 oC'de 5 mL alikotlarda saklayın.
- Ekipman ve diğer laboratuvar malzemeleri (diseksiyon günü)
- Su banyosunu 37 °C'ye ayarlayın. Aşağıdaki alikotları ısıtın: 50 mL HBSS ve 5 mL DMEM.
- Mutlak etanol içeren bir beherin içine daldırarak aşağıdaki aletleri sterilize edin (Şekil 1B): forseps, kavisli forseps, makas, ince kavisli forseps, ince düz forseps, ameliyat makasları, ince açılı forseps ve hassas yaylı makas.
NOT: Aletleri korumak için, kabın altına yumuşak bir malzeme (örneğin, bilimsel hassas mendiller) yerleştirin. - İki tepsiyi buzla doldurun ve aşağıdaki öğeleri yerleştirin.
- Buz tepsisi 1 (Şekil 1C): Cerrahi aletleri mutlak etanol içeren beherin içine, cerrahi aletleri durulamak için HBSS'li bir beher, embriyoları yerleştirmek için HBSS'li 10 cm'lik bir tabağı, embriyoların kafalarını yerleştirmek için HBSS'li 6 cm'lik bir tabağı ve embriyoların beyinlerini yerleştirmek için Hibernate + B27'li 6 cm'lik bir tabağı yerleştirin.
- Buz tepsisi 2: Disseke hipokampus için 1 mL'lik bir tripsin aliquot 2.5% ve Hibernate + B27 ile 3.5 cm'lik bir tabak yerleştirin.
NOT: Bu prosedür için gereken süre, araştırmacının deneyimine ve diseke edilecek embriyo sayısına bağlıdır. Bu nedenle, buz gerekli süre boyunca donmuş kalmalıdır. Bu amaçla polistiren tepsiler önerilir.
2. Diseksiyon ve tohumlama (Şekil 1)
- Hipokampal izolasyon
NOT: E18'de embriyosu olan gebe sıçanlar, Barselona Üniversitesi yerel etik komitesine uygun olarak, deney hayvanlarının kullanımı ve bakımı ile ilgili Avrupa (2010/63/UE) yönetmeliklerine uygun olarak, protokol başlamadan hemen önce ötenazi yapılır. Bu protokolde ötenazi yöntemi olarak karbondioksit (CO2) inhalasyonu kullanılmıştır.- Forseps ve makas kullanarak sıçanı abdominal periton seviyesinde disseke edin. Uterusu E18 embriyolarıyla çıkarın ve buz üzerinde soğutulmuş 10 cm'lik bir kaba koyun.
NOT: Sıçan kıllarının embriyolara yapışmasını önlemek önemlidir. Karnı sterilize etmek için bol miktarda% 70 etanol kullanılması önerilir. Bu adımdan itibaren, buz tepsisi 1'deki kaputun içinde çalışın. - Embriyonik keseleri açın ve embriyoları HBSS ile 10 cm'lik kaba aktarın, embriyoların tamamen daldırıldığından emin olun.
- Embriyo kafasını makasla çıkarın ve HBSS ile 6 cm'lik tabağa yerleştirin. Bu işlemi tüm embriyolarla tekrarlayın.
NOT: Kontaminasyonu önlemek için, embriyo kafaları dışındaki tüm dokular vidalı kapaklı bir kaba atılmalıdır. - Embriyo kafasını ince kavisli forsepslerle tutun ve yörüngeleri bir çift ince-düz forseps ile delin, 45° açıyla girin ve ardından ince kavisli forsepsleri serbest bırakın.
NOT: Forseps beyinden geçmemelidir, bu nedenle girerken açıyı korumak önemlidir. - Oksipital kemikten başlayarak frontal kemiğe kadar cerrahi makasla cildi ve kafatasını disseke edin. Beyni bir çift ince kavisli forseps ile çıkarın ve Hibernate + B27 ile 6 cm'lik kaba koyun. Tüm beyinler iyileşene kadar bu işlemi tekrarlayın.
- Telensefalonları ince düz forsepslerle Sagittal olarak ayırın.
NOT: Bu adımdan itibaren, hipokampusun diseksiyonu bir stereomikroskop altında gerçekleştirilir. Işığın diseksiyon yüzeyini yanlardan aydınlatması için mafsallı lambaların kullanılması önerilir. Ayrıca, hipokampüsün daha iyi ayırt edilmesini sağlayan daha fazla kontrast sağladığı için siyah bir arka plan kullanılması önerilir. - Hibernate + B27 damlalarını 1 cm mesafeye (örneğin, bir daire içinde) yerleştirerek 10 cm'lik bir yemek hazırlayın. Hibernate + B27 damlası başına bir telensefalon yerleştirin ve diseksiyon kapsamı boyunca görselleştirin (1.25x objektif büyütme önerilir).
- Meninksleri dikkatlice soyun ve hipokampüsü daha iyi görselleştirmek için talamusu çıkarın.
- Hipokampüsü hassas yaylı makasla inceleyin ve buz tepsisi 2'de Hibernate + B27 ile 3,5 cm'lik kaba yerleştirin. Tüm hipokampuslar toplanana kadar her telensefalon için tekrarlayın.
- Tüm hipokampusları bir Pasteur pipetle dikkatlice toplayın ve 50 mL'lik bir tüpe aktarın.
NOT: Tripsini seyreltmemek için hipokampiyi toplarken minimum Hazırda Bekletme + B27 hacmini alın.
- Forseps ve makas kullanarak sıçanı abdominal periton seviyesinde disseke edin. Uterusu E18 embriyolarıyla çıkarın ve buz üzerinde soğutulmuş 10 cm'lik bir kaba koyun.
- Hücre ayrışması
- Hipokampusun enzimatik ayrışması
- Hipokampi içeren 50 mL'lik tüpte, 1 mL% 2.5 tripsin ekleyin ve HBSS ile 5 mL'lik bir hacme getirin. 37 ° C'de su banyosunda 15 dakika boyunca inkübe edin.
- Tripsini seyreltmek için, 10 mL önceden ısıtılmış HBSS ekleyin ve 37 ° C'deki su banyosunda 5 dakika boyunca inkübe edin.
- Şimdi mukus kütlesi olarak görünen hipokampiyi, 1.000 μL mikropipet ile 50 mL'lik bir tüpe aktarın, 6 mL önceden ısıtılmış HBSS ekleyin ve 37 ° C'de su banyosunda 5 dakika boyunca inkübe edin.
- Hipokampusun mekanik ayrışması
- Kütleyi, minimum hacmi alarak konik tabanlı 2 mL'lik bir tüpe aktarın. 1 mL önceden ısıtılmış DMEM ortamı ekleyin. Pelet, yukarı ve aşağı doğru hafifçe aspire ederek 1.000 μL mikropipet ile homojenize edin.
NOT: Aspirasyon yaparken kabarcık üretmekten kaçınmak çok önemlidir, çünkü kabarcıklar hücreleri lize edebilir. - Yukarı ve aşağı aspirasyonu, ucu tüpün konik tabanıyla temas halinde olacak şekilde önceden çekilmiş bir cam pipetle (10x-20x) tekrarlayın. Kabarcık oluşturmaktan kaçının. Bu adımın sonunda, karışım yarı saydam olmalıdır.
- Karışım yarı saydam olacak şekilde homojen olarak karıştırıldıktan sonra, karışımı 37 °C'de 4 mL DMEM ortamı içeren bir tüpe aktarın ve yukarı ve aşağı pipetle indirerek bir cam pipetle homojenize edin.
- Kütleyi, minimum hacmi alarak konik tabanlı 2 mL'lik bir tüpe aktarın. 1 mL önceden ısıtılmış DMEM ortamı ekleyin. Pelet, yukarı ve aşağı doğru hafifçe aspire ederek 1.000 μL mikropipet ile homojenize edin.
- Hipokampusun enzimatik ayrışması
- Hücre tohumlama
- Hücreleri sayın. Çözeltideki nöronların sayısı standart laboratuvar prosedürlerine göre sayılabilir.
NOT: Antikor tespiti ve kalsiyum aktivitesi için görüntüleme deneylerinde, 3,5 cm'lik çanak başına 50.000 hücre konsantrasyonu en uygunudur. - Hücreleri askıda tutarak, hesaplanan hacmi geri çekin ve PLL kaplı kapaklar içeren 3,5 cm'lik tabaklarda veya PLL kaplı cam tabanlı tabaklarda tabaklayın.
- Çapraz hareketlerle yumuşak bir şekilde sallayarak (ileri geri, sonra yan yana; gerektiğinde tekrarlayın) bulaşıkların üzerindeki hücreleri eşit olarak dağıtın ve bulaşıkları CO2 (% 5) inkübatörüne yerleştirin.
NOT: Hücrelerin çanağın çevresine yerleşmesini önlemek için çapraz hareketler kullanmak önemlidir. - Her hafta yaklaşık 1 mL NB + B27 ekleyin, böylece kültür kurumaz.
NOT: 2 hafta sonra (14 gün in vitro [div]), nöronlar olgunlaşır ve deney için kullanılacak tüm faktörleri ifade eder. Bu protokol kullanılarak elde edilen toplam ortalama nöron sayısı, gebe sıçan başına ortalama 12 E18 embriyodan gelen yaklaşık 2.5 x 106 nörondur.
- Hücreleri sayın. Çözeltideki nöronların sayısı standart laboratuvar prosedürlerine göre sayılabilir.
BÖLÜM 2: Nöronal hücre yüzey proteinlerinde antikor tespiti için hipokampal nöronal kültürlerin kullanılması
NOT: Protokolün bu bölümü, anti-NMDAR ensefalitli hastaların serumunda ve / veya CSF'sinde anti-NMDAR antikorlarını tanımlamak için hipokampal kültürlerin nasıl kullanıldığını göstermektedir. Floresan immün boyama, canlı nöronlardaki reaktiviteyi görselleştirmek için kullanılır, ancak diğer görselleştirme yöntemleri de kullanılabilir. Bu deney için uygun bir kontrol, sağlıklı bir bireyden serum veya BOS olacaktır. İnsan örneklerini kullanırken, kurumsal etik komiteden onay alınması gerekebileceğini unutmayın.
3. Canlı floresan immün boyama
- Kapak fişlerinde yetiştirilmiş 14 div hücresi kullanın (beş kapak fişi içeren 3,5 cm'lik çanak başına 50.000 hücre).
- Kaputun içinde, kapak kapaklarını NB ile önceden ısıtılmış 37 ° C'ye kadar durulayın.
- Bu durumda, NB ortamında serum için 1:200'de veya BOS için 1:2'de seyreltilmiş anti-NMDAR antikorları (birincil antikor olarak kullanılır) içeren numuneyi ekleyin ve 37 ° C'de (CO2 (% 5) inkübatörünün içinde) 1 saat inkübe edin.
- RT'de PBS 3x ile dikkatlice durulayın.
- Fiksasyon çözeltisi (PBS'de% 4 formaldehit) ekleyin ve RT'de 5 dakika inkübe edin.
DİKKAT: %4 formaldehit kullanırken, kaputun içinde çalışın ve önerilen kişisel koruyucu ekipmanı giyin. - Her biri 5 dakika boyunca PBS ile 3 kat yıkayın.
- İkincil antikor Keçi anti-İnsan AF488'i 1:1000 seyreltmede ekleyin ve RT'de 1 saat boyunca inkübe edin.
NOT: Kuluçka sırasında, alüminyum folyo ile kaplayarak ışığa maruz kalmaktan koruyun. - Her biri 5 dakika boyunca PBS ile 3 kat yıkayın. Damıtılmış su ile durulayın
- Kapak fişlerini sıvı bir montaj ortamıyla (örneğin, DAPI ile solmaya karşı koruma ortamı; yaklaşık 7 μL) monte edin, kalan sıvıyı aspire edin ve damıtılmış suyla durulayın. Nöronlar artık floresan görüntüleme için hazır.
DİKKAT: Montaj ortamını tutarken, önerilen kişisel koruyucu ekipmanı kullanın.
BÖLÜM 3: Kalsiyum görüntüleme kullanılarak antikor patojenik etkilerinin gösterilmesi
NOT: Protokolün bu kısmı, hastalardaki antikorların kültürler üzerinde fonksiyonel bir etkiye sahip olup olmadığının nasıl belirleneceğini göstermektedir, bu da patojeniteyi düşündürecektir. Etkilerin önemini arttırmak için, sekiz hastadan bir BOS havuzu kullanıldı. Canlı kültürlerin kalsiyum aktivitesi, GECI floresan kalsiyum göstergesi (GCaMP5G) kullanılarak kimyasal stimülasyon (NMDA + Glisin) üzerine kaydedildi. Bu çalışmalar, nöronların gerekli fizyolojik koşullarını koruyabilen bir hücre odasına sahip ters çevrilmiş bir floresan mikroskobu gerektirir.
4. Kalsiyum görüntüleme
- Kapak fişlerinde yetiştirilmiş 14-18 div hücresi kullanın (beş kapaklı 3,5 cm'lik tabak başına 50.000 hücre)
- Görüntülemeden 1 hafta önce, hücrelere 2.5 x 10 10 GC / mL'de viral vektör pAAV2-CAG-GCaMP5G'yi ekleyin ve 5-7 gün boyunca inkübe edin.
NOT: Ticari olarak temin edilebilen, önceden paketlenmiş AAV serotip 2 vektörü, bir CAG promotörü altında genetik olarak kodlanmış kalsiyum göstergesi GCaMP5G'yi aşırı eksprese eder. - Görüntülemeden 1 gün önce, hasta örneğini ekleyin (bu örnekte, NB + B27'de 1:25 seyreltilmiş bir BOS havuzu) ve 24 saat boyunca inkübe edin. Kontaminasyonu önlemek için insan numunelerini (0,2 μm gözenek boyutu) kullanmadan önce daima süzün.
NOT: Bu çalışmalar için, sağlıklı deneklerden kontrol BOS'unun paralel olarak çalıştırılması gerekir. - Görüntüleme gününde, görüntüleme kurulumunu hazırlayın ve mikroskop hücre odasını 37 ° C'ye ayarlayın, şeridi damıtılmış suyla doldurun ve hücre fizyolojik koşullarını korumak için% 5 CO2 ile demleyin.
- Davlumbazda, hücreleri Adım 3'ten 37 ° C'ye önceden ısıtılmış 3 mL EPS ile yıkayın
- Hücreleri 2.45 mL EPS ile örtün ve mikroskop hücre odasına aktarın. Yalnızca NMDA reseptör yanıtını görselleştirmek üzere AMPA ve KA reseptörlerini bloke etmek için NBQX (10 μM) ekleyin.
- Bir cıva lambası ve bir FITC filtre küpü ile donatılmış ters floresan mikroskopta, her 100 ms'de bir kaydedilen karelerle (kendiliğinden aktivite) 2 dakikalık bir film elde edin.
NOT: 20x NA 0,75 hava hedefi kullanıldı ve sCMOS kamera ile her 100 ms'de bir görüntü (512 x 512 piksel, 16 bit gri tonlamalı) çekildi. - Her 100 ms'de bir kaydedilen karelerle 4 dakikalık ikinci filmi edinin. Edinime başladıktan kısa bir süre sonra, yemeğe stimülasyon çözeltisi (NMDA [100 μM] + Glisin [1 μM]) ekleyin.
NOT: Çanağa ortam eklenmesi, görüntüleme koşullarını (odak, floresan yoğunluğu ve / veya spesifik olmayan arka plan sinyali) bozabilecek türbülans üretecektir. Bu tür değişikliklerin olasılığını azaltmak için doldurulmuş 2,5 mL'lik kaba 50 μL'den fazla çözelti eklemeyin. - Görüntü işleme yazılımını kullanarak (burada ImageJ kullanılmıştır), stimülasyon üzerine elde edilen floresan sinyalini zamanla hasta ile inkübe edilen kültürlerden çıkarın ve BOS örneklerini kontrol edin.
NOT: GCaMP probları, serbest kalsiyum iyonlarına bağlanırken, daha parlak olmalarına neden olan konformasyonel bir değişikliğe uğrarlar. Bu nedenle, floresan yoğunluğundaki artış, nöronal depolarizasyona bağlı bir kalsiyum akışı ile ilişkilidir. - Analiz edilecek ilgi bölgelerini (ROI) belirleyin. Nöronların somalarını manuel olarak segmentlere ayırın ve YG'leri YG yöneticisine ekleyin (Yatırım Getirisi Yöneticisi'> > Araçlarını Analiz Edin > Ekleyin). YG'yi YG Yöneticisi menüsünden kaydedin (Kaydet > daha fazlası).
- Ölçümleri ayarlayın (Ölçümleri analiz et > ayarla) ve Ortalama gri değerini seçin. Daha > Çoklu Ölçü'yü tıklatarak hücre somalarından ortalama floresan yoğunluk profilini ayıklayın ve ardından oluşturulan tabloyu .xls bir elektronik tablo olarak kaydedin.
- Gruplar arasındaki floresanı karşılaştırmak için istatistiksel analizler yapın (hastanın CSF'sine karşı kontrolün CSF'si).
Sonuçlar
Ayrışmış, fetal, kemirgen hipokampal nöronal kültürlerin kurulması
Burada sunulan protokol, Banker ve Goslin15 tarafından gerçekleştirilen sinir hücresi kültürü üzerine yapılan etkili çalışmalara dayanmaktadır. Protokol, nöronal yüzey antikor tespit çalışmalarını gerçekleştirmek için optimal morfoloji, yoğunluk ve saflığa sahip nöronal kültürler elde etmek için rafine edilmiştir. Diseksiyon ve tohumlama protokolü üç bölüme ayrılmıştır (Şekil 1A). İlk bölüm, hipokampal izolasyon, canlı dokunun cerrahi olarak çıkarılmasından oluşur (Şekil 1A, sol panel). Şekilde gösterildiği gibi, E18 embriyolu hamile Wistar sıçanları, başarılı bir kültür için anahtar başlangıç malzemesidir. Beyin E18 embriyolarından çıkarıldıktan sonra, mikrocerrahi bir stereomikroskop altında gerçekleştirilir. Uygun aletlerle (Şekil 1B) ve hassas kullanımla, hipokampüsü sinir dokusunun geri kalanından ayırmak mümkündür. Dokuların spesifik ortamdaki yerleşimi Şekil 1C'de gösterilmiştir. Protokolün ikinci kısmı hipokampal hücre ayrışmasından oluşur. İki adıma bölünmüştür (Şekil 1A, orta panel): hipokampusun enzimatik ayrışması ve mekanik ayrışması, bozulmamış, ayrışmış, tek hücrelerle sonuçlanır. Bu metodolojiyi kullanarak, Şekil 2A-D'de gösterildiği gibi, hücre agregaları olmadan hücre kültürleri elde etmek mümkündür. Protokolün üçüncü kısmı hücre tohumlamasından oluşur (Şekil 1A, sağ panel). Protokolün bu kısmı, plakadaki nöronal kültürün yoğunluğunu ve homojenliğini ayarlamak için çok önemlidir. Hücrelerin sayılması ve 3,5 cm'lik bir çanak alanına 50.000 nöronun tohumlanması, sadece nöronal hücre yüzey proteinlerine karşı antikorların varlığını belirlemek için deneyler yapmak için değil (Şekil 3) aynı zamanda bu antikorların patojenitesini kalsiyum görüntüleme ile analiz etmek için de optimal bir yoğunluk sağlar (Şekil 4).
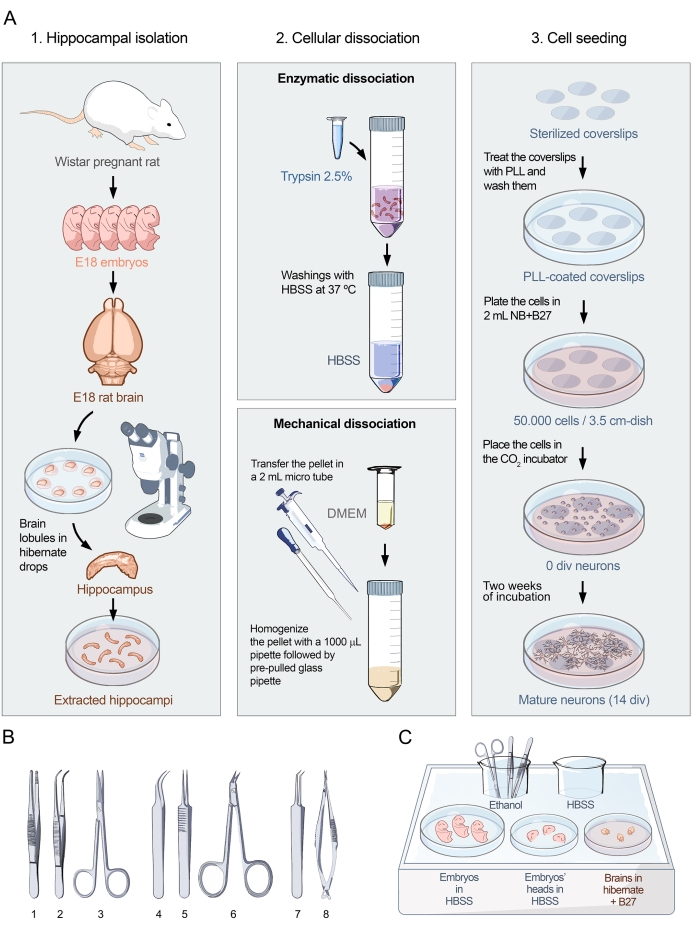
Şekil 1: Hipokampal nöronların birincil kültürleri için görsel protokol. (A) E18'deki embriyonik sıçanlardan hipokampal nöronların ayrışmış hücre kültürlerini hazırlamak için protokolün üç bölümünü gösteren akış şeması. Protokol 1'e ayrılmıştır. Hipokampal izolasyon, 2. Hücre ayrışması ve 3. Hücre tohumlama. (B) Hipokampal izolasyon için önerilen araçların seçimi üç kategoride gruplandırılmıştır: (1- Forseps, 2- Kavisli forseps, 3- Makas), embriyo toplama için, (4- İnce kavisli forseps, 5- İnce-düz forseps, 6- Cerrahi makas) beyin ekstraksiyonu için ve (7- İnce açılı forseps, 8- Hassas yay makasları) hipokampal izolasyon için. (C) Hipokampus izolasyonu için gerekli plakalar ve ortamlarla buz tepsisi 1'in şematik gösterimi. Embriyolar ve kafalar HBSS'ye yerleştirilirken, beyinler Hibernate ortamı + B27'ye yerleştirilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
18 div'deki hipokampal nöronların kültürleri olgun, birbirine bağlı ve yapısal ve fonksiyonel proteinleri eksprese eder.
Nöronal kültürlerin büyümesinde ve olgunlaşmasında, iki farklılaşmış faz takdir edilebilir: nöronun polarizasyon fazı (Şekil 2A, B) ve dendritik gelişim ve sinaptik ağın inşası aşaması (Şekil 2C, D). 1 div üzerindeki hücreler eşit olarak dağılır ve plakaya yapışır, hücre gövdesinin etrafında küçük nöritlerin yayılmaya başladığı bir lamel gelişir (Şekil 2A). Kültürde birkaç gün sonra, nöritler kısa bir mesafe uzar. Hücreler önemli bir polarizasyon gösterir, ancak çok az net büyüme vardır (Şekil 2B). Bu aşamadan sonra, sinaptogenez belirgindir ve nöronlar birbirine bağlanmaya başlar. Nöronal ağ büyümeye devam eder ve daha karmaşık hale gelir (Şekil 2C). 18 devde, nöronlar olgun ve birbirine bağlıdır; nöronal ağ inşa edilmiştir (Şekil 2D). Sinaptik dikenler oluştuktan ve bağlandıktan sonra, nöronlar tamamen polarize olur ve tüm fonksiyonel ve yapısal proteinleri ifade eder. Olgun kültürlü nöronlar tarafından eksprese edilen birçok proteinden, nöronal reseptör NMDA (Şekil 2E) ve sinaptik protein PSD95 (Şekil 2F) burada temsili belirteçler olarak seçilmiştir. Ayrıca, nörofilamenti (NF) etiketleyerek (Şekil 2G) ve MAP2 proteinini hedefleyerek dendritleri görselleştirerek aksonları seçici olarak görselleştirmek mümkündür (Şekil 2H).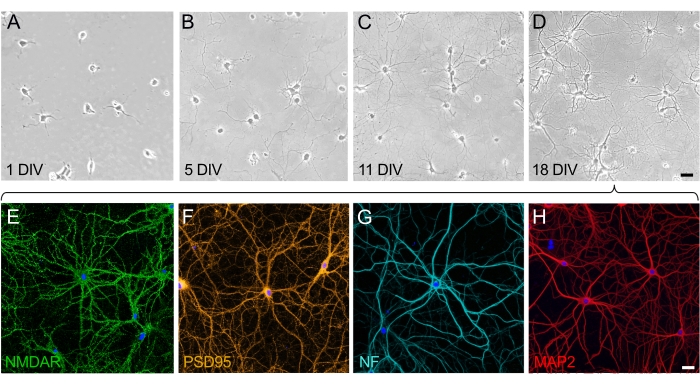
Şekil 2: Hipokampal nöronların ayrışmış hücre kültürlerinin olgunlaşmasının zaman seyri. (A-D) Kültürün ilk 18 günü boyunca hipokampal nöronların faz-kontrast görüntüleri. (A) PLL kaplı substrata bağlandıktan sonra 1 div'de nöronlar. (B) 5 div'de nöronlarda küçük nöritlerin ortaya çıkması. (C) 11 div'deki nöronlar, aksonal özellikleri uzatan ve kazanan uzun nöritler geliştirmiştir. (D) 18 div'deki nöronlar olgundur ve bir sinir ağı oluşturmuştur. Ölçek çubuğu (A-D) = 40 μm. (E-H) 18 div'de olgun nöronları göstermek için seçici belirteçler kullanılarak konfokal lazer tarama mikroskobu ile çekilen temsili floresan görüntüler. Nöronal kültürler, (E) nöronal reseptör (NMDAR), (F) sinaptik belirteç (PSD95), (G) aksonal belirteç (nörofilament, NF) ve (H) dendritik belirteç (MAP2) için seçici olarak boyanan antikorlarla sabitlendi ve immünoboyalandı. Ölçek çubuğu (E-H) = 20 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Hasta örneklerindeki antikorlar nöronal hücre yüzey antijenleri ile reaksiyona girer
Anti-NMDAR ensefaliti olan hastalardan elde edilen örnekler (serum ve BOS), nöronların yüzeyinde bulunan NMDAR'ı tanıyan otoantikorlar içerir. Kültürlerin hasta örnekleri ile inkübasyonu, hücre yüzeyinde ve dendritlerde yoğun bir floresan sinyali üretir (Şekil 3A,C). Buna karşılık, kontrol örnekleri nöronal kültürlere uygulandığında floresan sinyali üretmez (Şekil 3B, D). Bu bulgular, kültürlerin hasta örneklerini antikorlar için taramak için nasıl kullanılabileceğini ve nöronal hücre yüzeyini hedef alan yeni antikorların tanımlanmasına yol açabileceğini göstermektedir.
Hastadan alınan BOS örneği, hipokampal nöronların NMDA'ya bağlı kültürlerinde hücre içi kalsiyum konsantrasyonunu azaltır
Hastaların antikorlarının nöral aktivite üzerindeki etkisini değerlendirmek için (24 saatlik tedaviden sonra), hücre içi kalsiyum geçicileri, NMDA aracılı stimülasyon üzerine gerçek zamanlı olarak kültürlenmiş nöronlardan optik olarak izlendi. NMDA uygulaması, hücre içi yeşil floresandaki bir değişiklikle gösterildiği gibi, floresan yoğunluğunda bir artış oluşturur (Şekil 4A ve Ek Video 1). Kontrol BOS örneği ile tedavi edilen nöronlar, stimülatör uygulandığında, hasta BOS örneği ile tedavi edilen hücrelere kıyasla floresan yoğunluğunda (% 56) daha yüksek bir fark göstermiştir. Floresan yoğunluğundaki farklılıklar ölçüldü ve hücrelerin somalarından elde edilen verilerden elde edilen NMDA aracılı stimülasyon eğrileri karşılaştırıldı (Şekil 4B,C). Stimülasyon eğrileri, her iki senaryoda da hücre içi kalsiyum akışı olduğunu göstermektedir, ancak hastaların BOS (gri çizgi) ile tedavi edilen kültürler, kontrol ile tedavi edilen kültürlerden (siyah çizgi) daha düşük bir yanıt göstermiştir. Bu sonuçlar, hastaların BOS'unda bulunan antikorların, antikorların NMDAR ile etkileşimi nedeniyle hücresel aktiviteyi azalttığını ve böylece patojenik bir etkiye neden olduğunu göstermektedir.
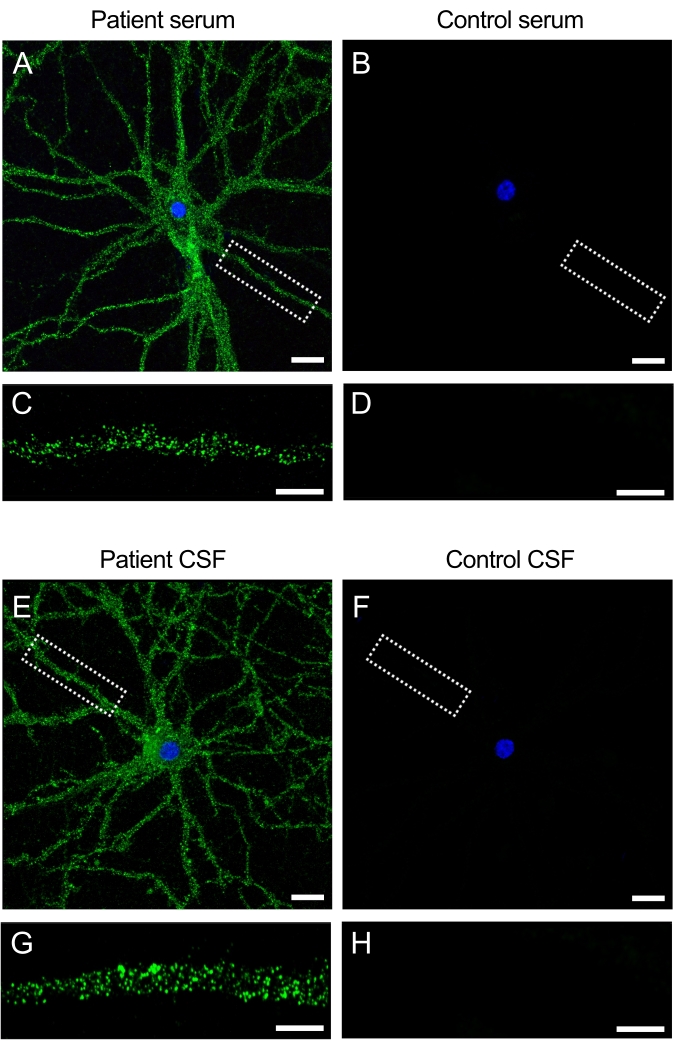
Şekil 3: Hasta antikorları nöronal kültürlerin yüzeyi ile reaksiyona girer. (A,E) Anti-NMDAR ensefalitli hastalardan alınan serum ve BOS, canlı sıçan hipokampal nöronlarının hücre yüzeyi ile reaksiyona girerken, (B,F) kontrol deneklerinden alınan serum ve BOS reaktivite göstermez. Ölçek çubuğu (A,B,E,F) = 20 μm. Bir dendritin (63x) daha yüksek büyütme görüntüsü, (C, G) hastanın serumu ve CSF'si için tipik reaktivite yüzey paternini ve kontroller için (D, H) negatifini gösterir. Görüntüler konfokal lazer tarama mikroskobu ile alındı. Ölçek çubuğu = 10 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
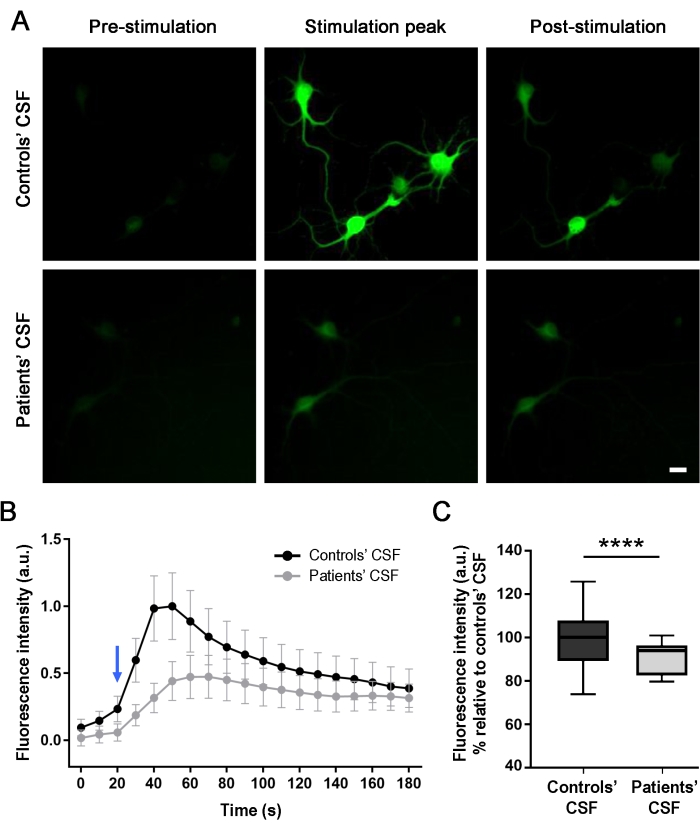
Şekil 4: Hasta antikorları, GCaMP5G'yi eksprese eden sıçan nöronlarındaki kalsiyum akışını azaltır. (A) Nöron kültürlerinde stimülasyon çözeltisinin (NMDA [100 μM] + Glisin [1 μM]) uygulanması, stimülasyondan önce alınan görüntüye (ön stimülasyon) kıyasla, hücre içi yeşil floresanın (stimülasyon zirvesi) arttırılmasıyla belirtildiği gibi bir kalsiyum akışını tetikledi. 120 s'den sonra, floresan yoğunluğu azalır ve stabilize olur (stimülasyon sonrası). Hastaların BOS ile tedavi edilen kültürler, kontrolün CSF'sine kıyasla NMDA aracılı kalsiyum artışında önemli bir azalma (% 56) göstermiştir. Görüntüler floresan mikroskopi ile alındı. Ölçek çubuğu = 20 μm. (B) NMDA stimülasyonu (mavi ok) üzerine kontrol BOSU (siyah çizgi) ve hastaların BOS (gri çizgi) ile tedavi edilen kültürler için zaman içindeki floresan yoğunluğunu (180 sn) temsil eden üç bağımsız deneyden birinin grafiği. n(Controls' CSF) = 20 hücre; n(Hastanın BOS'u) = 28 hücre. Veriler ortalama ± SEM olarak gösterilir. (C) Kutu grafikleri medyan, 25. ve 75. yüzdelik dilimleri gösterir. Bıyıklar minimum ve maksimum değerleri gösterir. Anlamlılık değerlendirmesi iki yönlü varyans analizi (ANOVA; p < 0.0001) ve Mann-Whitney U testleri (p < 0.0001) ile yapıldı. 0.05 p < değeri istatistiksel olarak anlamlı kabul edildi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Video 1: GCaMP5G'yi yan yana eksprese eden iki hipokampal nöronu gösteren video: kontrol CSF'si ile tedavi edilen nöron (solda) ve hastaların CSF'si ile tedavi edilen nöron (sağda). NMDAR (stimülasyon) uygulaması, her iki durumda da hücre içi floresan yoğunluğunda bir artış yaratır, ancak kontrolün BOS'u ile tedavi edilen nöronda, hastaların CSF'si ile tedavi edilene göre önemli ölçüde daha yüksek bir seviyeye sahiptir. Görüntüler floresan mikroskobu ile çekildi ve arama tablosu (LUT) Fire'ı uygulayan ImageJ ile düzenlendi. 1700 kare (170 sn); 5 kez hızlandırıldı. Ölçek çubuğu = 10 μm. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Antikor aracılı otoimmünitenin büyüyen alanı, hastaların tanı ve tedavisini iyileştirmek için kullanılabilecek nöronal otoantikorların tanımlanması için bir fırsat penceresi açmıştır. Hipokampal nöronların kültürleri, antikor tanımlaması için gerekli bir araçtır; bu nedenle, güvenilir ve tekrarlanabilir sonuçlar elde etmek için standartlaştırılmış bir protokol gerçekleştirmek önemlidir. Dikkate alınması gereken en önemli adımlar, sınırlamalar ve sorun giderme burada tartışılmaktadır.
Bu protokolün kritik adımları, hipokampal nöronların saflığını, homojenliğini veya yaşayabilirliğini etkileyip etkilemediklerine bağlı olarak üç kategoriye ayrılabilir.
Saflık – Optimal birincil hücre kültürlerini elde etmek için, araştırmacı kendinden emin, eğitimli olmalı ve özellikle diseksiyon süresini en aza indirmek için hızlı bir şekilde çalışabilmelidir. Piramidal nöronlar ana hücre tipi olsa bile, hipokampus çeşitli internöronlar içerir14. Minimal glial hücreli kültürler üretmek için, hipokampus minimum çevre doku ile ekstrakte edilmelidir. Diseksiyon sırasında siyah bir arka planın kullanılması, stereomikroskop altında hipokampüsün sınırlarını belirlemeye yardımcı olur. Ek olarak, düşük hücre yoğunluklarının daha az parakrin desteği ile sonuçlandığı ve kültürün korunmasını zorlaştırdığı dikkate alınmalıdır13. Bu nedenle, bu dengeyi akılda tutmak önemlidir. Bu, düşük sayıda hücre (3.5 cm'lik çanak başına 50.000 nöron) kullanan görüntüleme çalışmalarında önemlidir. Hipokampal ekstraksiyon için ek süreye sahip olabilmek için, dokuyu koruyan Hibernate media kullanılmalıdır17. Yeterli cerrahi aletlerle çalışmak da esastır. Yüksek hassasiyetli aletler hassastır, bu nedenle tekniğin tekrarlanabilirliği dikkatlice korunarak sağlanmalıdır.
Homojenlik - Hücre agregaları olmayan bir kültür geliştirmek için, mekanik hücre ayrışması, önceden çekilmiş cam pipetlerin kullanımı standart 1.000 μL pipetle birleştirilerek yükseltilmiştir.
Canlılık – Bu protokolde, nöronal uyarılabilirliği etkiledikleri ve kültürlenmiş nöronların elektrofizyolojik özelliklerini değiştirdikleri için antibiyotik eklenmemiştir18. Bu nedenle, en yüksek sterilite standartları korunmazsa kontaminasyon olasılığı çok yüksektir. Sıcaklık da önemli bir faktördür. Hipokampal izolasyon sırasında dokuyu soğuk tutmak metabolizmayı yavaşlatır ve hücre bozulmasını azaltır. Bu nedenle doku, hücre ayrışma sürecine kadar buz üzerinde tutuldu. Ayrıca, hücreleri belirgin hücre lizisi olmadan ayrıştıran enzimatik hücre ayrışması sırasında doğru dengeyi bulmak çok önemlidir. Bu protokolde, tripsin ile inkübasyon zamanlamaları ve sonraki yıkama adımları, uygun bir nöronal ağın oluşturulmasına izin vermek için yeterli alana sahip bireysel hücreler elde etmek için optimize edilmiştir.
Kritik adımlar, nöronal kültürlerden floresan canlı immün boyama ve kalsiyum aktivitesi kayıtlarında da bulunur. Hasta örneklerinde hücre yüzey proteinlerine karşı antikorların varlığını belirlemek için başarılı bir canlı immün boyama gerçekleştirmek için, antikorların hücre içi proteinlere erişmesine izin verecek hücrelerin geçirgenliğinden kaçınılmalıdır. Ek olarak, antikorların titresine bağlı olarak, inkübasyon süresi ve numune seyreltmesi buna göre ayarlanmalıdır (örneğin, çok yüksek titreli antikorlar, sonuçların yorumlanmasını zorlaştıran arka plan boyaması verebilir). Kalsiyum görüntüleme ile otoantikorların patojenite değerlendirmesi yapılırken, hücresel aktivite ölçümleri için en uygun olan bir ortam kullanılması gerekir (örneğin, kültür ortamında Mg2 + baskılanması iyi performans için önemlidir). Ayrıca, floresan görüntüleme için, spesifik olmayan bir arka plan sinyali verdiği için fenol kırmızısı gibi pH göstergelerine sahip ortamlardan kaçınılmalıdır.
Hipokampal nöronal kültürlerin kullanımının iki ana sınırlaması vardır. İlk olarak, kararlı hücre hatlarıyla karşılaştırıldığında, birincil kültürler sürekli olarak üretilmelidir ve bu, laboratuvar hayvanlarının düzenli olarak kullanılması anlamına gelir. İndüklenmiş pluripotent kök hücre (iPSC) hatları, hayvan modellerini kullanma ihtiyacının yerini alabilir, ancak iPSC için farklılaşma protokolleri hala optimal değildir. İkincisi, iPSC'den türetilen nöronlar, yüzey proteinlerinin tam spektrumunu ifade etmez ve bu nedenle, eğer kullanılırsa, reaktivitenin yokluğu, numune19'un olumsuzluğunu ima etmez.
AE'ye sahip olduğundan şüphelenilen hastaların serumunda veya BOS'unda otoantikorların varlığını taramak için üç yöntem vardır: sıçan beyin dokusunu kullanan doku bazlı tahlil (TBA), nöronal proteinleri eksprese etmek için transfekte edilen HEK hücrelerini kullanan hücre bazlı tahlil (CBA) ve hipokampal nöronların canlı kültürleri kullanılarak burada bildirilen uygulama19. Kültürlü hipokampal nöron yönteminin önemi, TBA ile kolayca ayırt edilemeyen yüzey ve hücre içi antijenlerle reaktiviteyi ayırt etme yeteneğinde yatmaktadır. Ayrıca, birincil nöronal kültürler, HEK transfekte hücrelerindeki CBA'dan farklı olarak, transfekte proteinlerin repertuarı ile sınırlı değildir. Ek olarak, kültürlenmiş hipokampal nöronlar, immünopresipitasyon ve kütle spektrometrisi ile birleştirildiğinde yeni antikorları ve hedef antijenlerini tanımlamak ve bu nedenle tanımlanabilir antikorların spektrumunu genişletmek için kullanılabilir. Son olarak, otoantikorların patojenik etkilerinin, hücresel aktivitedeki değişiklikleri izleyebilen canlı görüntüleme yöntemleri ile değerlendirilmesine izin verir. Sonuç olarak, yeni otoantikorların tanımlanması sonunda hasta sonuçlarını iyileştirmek için spesifik immünoterapilerin başlatılmasını sağlar.
Açıklamalar
Yazarların çıkar çatışması yoktur.
Teşekkürler
Merche Rivas, Maria Marsal, Gustavo Castro, Jordi Cortés, Alina Hirschmann ve Angel Sandoval (ICFO-Institut de Ciències Fotòniques) ve Mercedes Alba, Marija Radosevic, David Soto, Xavier Gasull, Mar Guasp ve Lidia Sabater'e (IDIBAPS, Hospital Clínic, Barselona Üniversitesi) teknik destekleri ve reaktifler sağladıkları için ve Josep Dalmau ve Myrna R. Rosenfeld'e (IDIBAPS, Hospital Clínic, Barselona Üniversitesi) makale ve mentorluk hakkındaki eleştirel incelemeleri için. Bu çalışma Instituto de Salud Carlos III (ISCIII) tarafından finanse edilmiş ve Avrupa Birliği, FIS (PI20/00280, J.P.), Fundació CELLEX (P.L-A.) tarafından ortaklaşa finanse edilmiştir; Ministerio de Economía y Competitividad - Ar-Ge'de Mükemmeliyet Merkezleri için Severo Ochoa programı (CEX2019-000910-S, P.L-A.); CERCA programı ve Laserlab-Europe (871124, P.L-A.); Ministerio de Ciencia e Innovación (MCIN/AEI/ 10.13039/501100011033, P.L-A.); ve Fondo Social Europeo (PRE2020-095721, M.C.).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 cm Cell culture dish | Nunc | 12-565-020 | |
| 12 mm round coverslips | Fisher | NC9708845 | |
| 20x NA 0.75 S Fluor air objective | Nikon | CFI Super Fluor 20X | |
| 3.5 cm Cell culture dish | Nunc | 12-565-90 | |
| 6 cm Cell culture dish | Nunc | 12-565-94 | |
| B27 supplement | Gibco | 17504-044 | |
| Beaker 100 mL | Pirex | - | |
| Borax | Sigma-Aldrich | B9876 | |
| Boric Acid | Sigma-Aldrich | B0252 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved forceps | FST | 11009-13 | |
| D-Glucose | Sigma-Aldrich | D9434 | |
| DMEM High Glucose (4.5 g/L), without L-Glutamine, without Phenol Red | Capricorn | DMEM-HXRXA | |
| Female Wistar rat (18-days pregnant) | Janvier | - | |
| Fetal Bovine Serum (FBS) | Biowest | S181B-500 | |
| Fine-angled forceps | FST | 11251-35 | |
| Fine-curved forceps | FST | 11272-30 | |
| Fine-straight forceps | FST | 11251-23 | |
| FITC filter cube | Nikon | Standard Series | |
| Forceps | FST | 11000-12 | |
| Goat anti-Human AF488 | Invitrogen | A11013 | |
| HBSS | Capricorn | HBSS-1A | |
| HEPES | Sigma-Aldrich | H3375 | |
| Hibernate-E medium | Gibco | A12476-01 | |
| Horse Serum (HS) | Thermofisher | 26050088 | |
| Human anti-NMDAR antibody (CSF) | Patient Sample | - | |
| Human anti-NMDAR antibody (Serum) | Patient Sample | - | |
| ImageJ/Fiji | NIH | v1.50i | |
| Inverted fluorescence microscope | Nikon | Eclipse TE2000-U | |
| KCl | Sigma-Aldrich | 44675 | |
| L-Glutamine | Biowest | X0550-100 | |
| Mercury lamp | Nikon | C-HGFI | |
| Microscope cell chamber | Custom-build | - | |
| NaCl | Sigma-Aldrich | S9887 | |
| NBQX | Tocris | 373 | |
| Neurobasal without phenol red | Gibco | 12348-017 | |
| NMDA | Sigma-Aldrich | M3262 | |
| pAAV2-CAG-GCaMP5G | VectorBiolabs | - | |
| Paraformaldehyde 4% | Thermo scientific | J199943-K2 | |
| Penicillin-Streptomycin | Biowest | L0022-100 | |
| Phosphate-Buffered Saline | Gibco | 10010023 | |
| Poly-L-Lysine (PLL) | Peptide international | OKK-35056 | |
| Polystyrene ice tray | - | - | re-used cap of a polysterene box |
| Precision spring-scissors | FST | 15000-08 | |
| ProLong Gold with DAPI (antifading mounting media) | Molecular Probes | P36941 | |
| Scissors | FST | 14068-12 | |
| Sodium pyruvate | Biowest | L0642-100 | |
| Stereo microscope | Zeiss | Stemi 2000 | |
| Surgery scissors | FST | 14081-09 | |
| Trypsin 2.5% | Gibco | 15090046 | |
| Water, sterile endotoxine free | Sigma-Aldrich | W3500 |
Referanslar
- Dalmau, J., Geis, C., Graus, F. Autoantibodies to synaptic receptors and neuronal cell surface proteins in autoimmune diseases of the central nervous system. Physiological Reviews. 97 (2), 839-887 (2017).
- Dalmau, J., Graus, F. Antibody-mediated encephalitis. The New England Journal of Medicine. 378 (9), 840-851 (2018).
- Dalmau, J., et al. Paraneoplastic anti- N -methyl-D-aspartate receptor encephalitis associated with ovarian teratoma. Annals of Neurology. 61 (1), 25-36 (2007).
- Dalmau, J., et al. Anti-NMDA-receptor encephalitis: case series and analysis of the effects of antibodies. Lancet Neurology. 7 (12), 1091-1098 (2008).
- Lai, M., et al. AMPA receptor antibodies in limbic encephalitis alter synaptic receptor location. Annals of Neurology. 65, 424-434 (2009).
- Lancaster, E., et al. Antibodies to the GABAB receptor in limbic encephalitis with seizures: case series and characterisation of the antigen. Lancet Neurology. 9 (1), 67-76 (2010).
- Lai, M., et al. Investigation of LGI1 as the antigen in limbic encephalitis previously attributed to potassium channels: a case series. Lancet Neurology. 9 (8), 776-785 (2010).
- Sabater, L., et al. A novel NREM and REM parasomnia with sleep breathing disorder associated with antibodies against IgLON5: a case series, pathological features, and characterization of the antigen. Lancet Neurology. 13 (6), 575-586 (2014).
- Hughes, E. G., et al. Cellular and synaptic mechanisms of anti-NMDA receptor encephalitis. The Journal of Neuroscience. 30 (17), 5866-5875 (2010).
- Moscato, E. H., et al. Acute mechanisms underlying antibody effects in anti-N-methyl-D-aspartate receptor encephalitis. Annals of Neurology. 76 (1), 108-119 (2014).
- Planagumà, J., et al. Human N-methyl D-aspartate receptor antibodies alter memory and behaviour in mice. Brain. 138 (1), 94-109 (2015).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Research. 126 (3), 397-425 (1977).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocols. 1 (5), 2406-2415 (2006).
- Benson, D. L., Watkins, F. H., Steward, O., Banker, G. Characterization of GABAergic neurons in hippocampal cell cultures. Journal of Neurocytology. 23 (5), 279-295 (1994).
- Banker, G., Goslin, K. . Culturing Nerve Cells. , (1998).
- Nunez, J. Primary culture of hippocampal neurons from P0 newborn rats. Journal of Visualized Experiments. (19), e895 (2008).
- Brewer, G. J., Price, P. J. Viable cultured neurons in ambient carbon dioxide and hibernation storage for a month. Neuroreport. 7 (9), 1509-1512 (1996).
- Bahrami, F., Janahmadi, M. Antibiotic supplements affect electrophysiological properties and excitability of rat hippocampal pyramidal neurons in primary culture. Iranian Biomedical Journal. 17 (2), 101-106 (2013).
- Ricken, G., et al. Detection methods for autoantibodies in suspected autoimmune encephalitis. Frontiers in Neurology. 9, 841 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır