Method Article
תרביות נוירונים בהיפוקמפוס כדי לזהות ולחקור נוגדנים פתוגניים חדשים המעורבים בדלקת המוח אוטואימונית
In This Article
Summary
דלקת המוח האוטואימונית היא קטגוריה חדשה של מחלות בתיווך נוגדנים של מערכת העצבים המרכזית. ניתן להשתמש בנוירונים בהיפוקמפוס כדי לגלות ולאפיין נוגדנים אלה. מאמר זה מספק פרוטוקול לתרבית תאים ראשונית ואימונוסטינינג כדי לקבוע נוגדנים עצמיים בסרום ובנוזל המוח והשדרה של חולים.
Abstract
במהלך 15 השנים האחרונות, קטגוריה חדשה של מחלות בתיווך נוגדנים של מערכת העצבים המרכזית (CNS) אופיינה ומוגדרת כיום כ"דלקת מוח אוטואימונית" (AE). ישנן כיום 17 תסמונות AE ידועות, וכולן קשורות לנוגדנים כנגד פני התא העצבי או חלבונים סינפטיים. התסמונות הקליניות מורכבות ומשתנות בהתאם לסוג הנוגדן הקשור. הידועה ביותר מבין מחלות אלה היא אנטי-N-מתיל D-אספרטט קולטן (NMDAR) דלקת המוח, שהיא הפרעה נוירופסיכיאטרית בולטת הקשורה לליקויים חמורים בזיכרון ובהתנהגות. הנוגדנים הקשורים מגיבים עם תת-היחידה GluN1 של NMDAR בתחום N-terminal. הגישה הנפוצה ביותר לגילוי ואפיון של נוגדני AE כוללת את התרבות של נוירונים היפוקמפליים מנותקים, עובריים, מכרסמים. בתהליך אפיון הנוגדנים, נוירונים חיים בתרבית נחשפים לסרום או ל-CSF של המטופלים, וזיהוי תגובתיות מצביע על כך שדגימות הסרום או ה-CSF של המטופל מכילות נוגדנים נגד אנטיגנים של פני השטח העצביים. תרביות היפוקמפוס יכולות לשמש גם כדי לקבוע אם הנוגדנים בחולים הם פתוגניים פוטנציאליים על ידי בדיקה אם הם גורמים לשינויים מבניים או תפקודיים של הנוירונים. רמת ההצלחה של מחקרים אלה תלויה באיכות התרביות ובפרוטוקולים המשמשים להשגת וזיהוי תגובתיות דגימות המטופלים. מאמר זה מספק פרוטוקול אופטימלי לתרבית תאים ראשונית של נוירונים היפוקמפליים של חולדות עובריות בשילוב עם אימונוסטינינג כדי לקבוע את נוכחותם של נוגדנים בסרום או CSF של חולים. דוגמה לאופן שבו ניתן לבחון את ההשפעות הפתוגניות הפוטנציאליות של נוגדני NMDAR באמצעות נוירונים בתרבית והדמיית סידן מוצגת גם כן.
Introduction
דלקת מוח אוטואימונית (AE) היא קטגוריה שהתגלתה לאחרונה של מחלות של מערכת העצבים המרכזית (CNS) המתווכת על ידי נוגדנים המכוונים לפני השטח העצביים או חלבונים סינפטיים 1,2. המאפיינים הקליניים משתנים בהתאם לנוגדן, אך בדרך כלל כוללים פגיעה בזיכרון ובקוגניציה, שינוי בהתנהגות ובתסמינים פסיכיאטריים, תנועות לא תקינות, הפרעות בתפקוד השינה, ירידה ברמת ההכרה והתקפים. הפרעות אלה יכולות להשפיע על אנשים בכל הגילאים, עם סוגים מסוימים של AE המשפיעים בעיקר על ילדים ומבוגרים צעירים2.
במהלך 15 השנים האחרונות תוארו 17 תסמונות AE עם נוגדנים כנגד חלבונים ספציפיים על פני השטח העצביים/סינפטיים (טבלה 1). כמה דוגמאות למטרות העצביות כוללות את הקולטנים המעוררים הסינפטיים NMDAR3,4 ו- AMPAR5, הקולטן המעכב הסינפטי GABAbR6, החלבון המופרש העצבי LGI17, ומולקולת הידבקות התאים IgLON58. עבור רוב אלה AE, מחקרים הראו כי נוגדנים משבשים את המבנה או התפקוד של אנטיגן המטרה שלהם, תומך מאוד בתפקיד פתוגני. לדוגמה, בדלקת מוח אנטי-NMDAR, הנוגדנים מגיבים עם תחום N-terminal של תת-היחידה GluN1 של NMDAR, ומייצרים הפנמה סלקטיבית והפיכה של קולטנים אלה שמביאה לשינויים נוירופסיכיאטריים בולטים 4,9,10,11. לפיכך, זיהוי של כל אחד 17 נוגדנים ידועים בסרום או CSF של המטופל יכול לשמש גם כמבחן אבחון הקובע את האבחנה של AE מסוים.
אחת הטכניקות הנפוצות יותר לזיהוי ואפיון של נוגדנים אלה כוללת שימוש בתרביות של נוירונים היפוקמפליים מנותקים, עובריים, מכרסמים. תרביות אלה שימושיות מכמה סיבות: המוח העוברי קל לניתוק ומכיל רמה נמוכה של תאי גליה, המקור העיקרי לזיהום בתרביות נוירונים12; אוכלוסיית התאים בהיפוקמפוס הומוגנית יחסית בהשוואה לרוב האזורים האחרים של מערכת העצבים המרכזית, כאשר תאים פירמידליים מייצגים את הרוב המכריעשל 13,14; תרביות מוכנות מעוברים בשלב מאוחר כאשר הדור של נוירונים פירמידליים הושלם אך תאי גרגיר עדיין לא התפתחו, מה שמוסיף עוד יותר להומוגניות של התרבית; כאשר נוירונים פירמידליים מתורבתים, מבטאים את רוב התכונות הפנוטיפיות העיקריות שלהם, מסוגלים ליצור דנדריטים מפותחים היטב, ולהקים רשתות מחוברות סינפטיות שיכולות לשמש לחקירות מבניות ואלקטרופיזיולוגיות12,13; מכיוון שנוגדנים אינם יכולים לחדור לנוירונים חיים, השימוש בתרביות חיות מאפשר זיהוי של מטרות אנטיגניות השוכנות על פני התא; ומיצוי חיסוני של קומפלקס הנוגדן-אנטיגן מתרביות נוירונים מאפשר זיהוי של אנטיגן המטרה5.
הצלחת המחקרים המשתמשים בתרביות נוירונים תלויה מאוד באיכות התרביות ובפרוטוקולים המשמשים להערכת הפעילות החיסונית של סרום או נוזל המוח והשדרה של המטופל (CSF). משתנים שיכולים להשפיע על התרביות כוללים את ההליכים לבידוד ההיפוקמפוס לפני התפתחות התרבית, הדיסוציאציה של הרקמה, צפיפות הציפוי, משטח הצמיחה המשמש והרכב המדיה13,15,16. מאמר זה מספק פרוטוקול אופטימלי לתרבית תאים ראשוניים של נוירונים בהיפוקמפוס של חולדות עובריות בשילוב עם חיזוק חיסוני פלואורסצנטי שניתן להשתמש בו כדי לקבוע את נוכחותם של נוגדנים נגד אנטיגנים ידועים של AE ומטרות פוטנציאליות חדשות על פני השטח. הוא גם מספק דוגמה כיצד לבחון את ההשפעות הפתוגניות של נוגדני NMDAR על ידי טכניקות הדמיה של תאים חיים באמצעות נוירונים בהיפוקמפוס בתרבית המבטאים מחוון סידן מקודד גנטית (GECI) ממשפחת GCaMP, GCaMP5G.
| חלבון מטרה | תפקוד חלבונים | תא תא | תסמונת ראשית |
| NMDAR | יון שאנל | חלבון סינפטי | דלקת המוח נגד NMDAR |
| אמפאר | יון שאנל | חלבון סינפטי | דלקת המוח הלימבית |
| גלוק2 | יון שאנל | חלבון סינפטי | דלקת המוח |
| GABAaR | יון שאנל | חלבון סינפטי | דלקת המוח |
| GABAbR | קולטן מטאבוטרופי | חלבון סינפטי | דלקת המוח הלימבית |
| mGluR1 | קולטן מטאבוטרופי | חלבון סינפטי | דלקת המוח |
| mGluR2 | קולטן מטאבוטרופי | חלבון סינפטי | דלקת המוח |
| mGluR5 | קולטן מטאבוטרופי | חלבון סינפטי | דלקת המוח |
| D2R | קולטן מטאבוטרופי | חלבון סינפטי | דלקת המוח של הגרעינים הבסיסיים |
| LGI1 | מולקולת הידבקות | חלבון פני התא | דלקת המוח הלימבית |
| CASPR2 | מולקולת הידבקות | חלבון פני התא | דלקת המוח הלימבית |
| איגלון5 | מולקולת הידבקות | חלבון פני התא | מחלת אנטי-IgLON5 |
| נוריקסין-3α | מולקולת הידבקות | חלבון פני התא | דלקת המוח |
| DNER (Tr) | חלבון טרנסממברנה | חלבון פני התא | דלקת המוח |
| SEZ6L | חלבון טרנסממברנה | חלבון פני התא | דלקת המוח |
| אמפיפיסין | מולקולה מבנית | חלבון פני התא | דלקת המוח הלימבית |
| DPPX | פפטידאז | חלבון פני התא | דלקת המוח |
טבלה 1: נוגדנים לפני השטח של התא העצבי ולחלבונים סינפטיים.
Protocol
כל ההליכים אושרו על ידי ועדת האתיקה המקומית של אוניברסיטת ברצלונה בעקבות התקנות האירופיות (2010/63/UE) לגבי שימוש וטיפול בחיות ניסוי. התקבלה הסכמה מדעת בכתב ממטופלים, והמחקר אושר על ידי ועדת הבדיקה המוסדית המקומית לשימוש בדגימות אנושיות (Hospital Clínic, HCB/2018/0192).
הערה: ישנם שלושה חלקים בפרוטוקול הנוכחי. הראשון הוא להקמת תרבויות נוירונים, השני הוא לזיהוי של נוגדנים פני השטח באמצעות תרביות חיות של נוירונים, והשלישי הוא לקבוע את הפתוגניות של נוגדנים אלה.
חלק 1: הקמת תרביות עצביות היפוקמפוס מנותקות, עובריות, מכרסמים
1. שלבי הכנה
- ציפוי פולי-L-ליזין של משטחי הציפוי (3 ימים לפני הדיסקציה)
- הכינו את חיץ הבוראט על ידי הוספת 2.38 גרם חומצה בורית ו-1.27 גרם בורקס ל-500 מ"ל מים מזוקקים וערבוב במשך 15 דקות עד להמסתו. מתחת למכסה המנוע, עקר את תמיסת החיץ על-ידי סינון (גודל נקבוביות של 0.2 מיקרומטר), תיוג ואחסון בטמפרטורת החדר (RT).
הערה: פתרון זה יציב וניתן להשתמש בו במשך 6 חודשים.
אזהרה: בעת הכנת חיץ בוראט, יש ללבוש ציוד מגן אישי מומלץ. - הכינו את תמיסת הציר Poly-L-Lysine (PLL) (100 מ"ג/מ"ל) על ידי הוספת גרם אחד של PLL ל-10 מ"ל מים מזוקקים וערבוב עד להמסתה. הכן 500 μL aliquots של פתרון מלאי PLL. כדי להגיע לריכוז סופי של 1 מ"ג/מ"ל, יש להוסיף 500 μL של PLL aliquot ל-50 מ"ל של חיץ בוראט ומערבולת עד להמסתה, ולעקר את התמיסה על ידי סינון (גודל נקבוביות 0.2 מיקרומטר).
הערה: פתרון זה יציב וניתן להשתמש בו במשך 6 חודשים. - הכינו את המשטחים לציפוי. השתמשו בכיסויים בקוטר 12 מ"מ להליכי חיסון ובכלים עם תחתית זכוכית למחקרים שיכללו הדמיה של תאי עצב חיים. אם משתמשים בכיסויים, יש להניח חמישה כיסויים בכל צלחת (בקוטר 3.5 ס"מ).
הערה: עובי הכיסוי משפיע על האיכות והעוצמה של האות של התמונות שנרכשו. רוב מטרות המיקרוסקופ מיועדות לכיסויים #1.5. בחר את הכיסויים המתאימים בהתאם למערך ההדמיה ולטכניקות. - מתחת למכסה המנוע, הוסיפו 1.5 מ"ל של תמיסת PLL לכל צלחת (צלחת עם תחתית זכוכית או צלחת באורך 3.5 ס"מ עם חמישה כיסויים). ודאו שכל הכיסויים שקועים ומאוחסנים ב-RT למשך 24 שעות.
- יומיים לפני הנתיחה, שאפו את תמיסת ה-PLL ושטפו במים סטריליים נטולי אנדוטוקסין, וודאו שהכיסויים שקועים. יש לשמור מים בכלים ולאחסן ב-RT למשך 24 שעות.
- יום אחד לפני הנתיחה, שאפו את המים והחליפו אותם במדיה תרבותית NB + B27 (ראו להלן), והניחו את הכלים באינקובטור בטמפרטורה של 37 מעלות צלזיוס למשך 24 שעות.
- הכינו את חיץ הבוראט על ידי הוספת 2.38 גרם חומצה בורית ו-1.27 גרם בורקס ל-500 מ"ל מים מזוקקים וערבוב במשך 15 דקות עד להמסתו. מתחת למכסה המנוע, עקר את תמיסת החיץ על-ידי סינון (גודל נקבוביות של 0.2 מיקרומטר), תיוג ואחסון בטמפרטורת החדר (RT).
- הכנת מדיה תרבותית ותמיסת מלאי (יום אחד לפני הנתיחה)
- מדיום הנשר המעובד (DMEM) של Dulbecco: ל-500 מ"ל של DMEM גלוקוז גבוה (4.5 גרם/ליטר) ללא L-גלוטמין ופנול אדום, יש להוסיף 50 מ"ל של סרום סוסים, 50 מ"ל של סרום בקר עוברי (FBS), 10 מ"ל של L-גלוטמין (200 mM), 10 מ"ל של נתרן פירובט (100 mM), 10 מ"ל של פניצילין-סטרפטומיצין (10,000 U/mL). מסננים (בגודל נקבוביות 0.2 מיקרומטר) ומאחסנים ב-5 מ"ל ב-4 oC עם מכסה סגור היטב.
הערה: פתרון זה יציב וניתן להשתמש בו למשך חודש אחד. - מדיום נוירובסל (NB) בתוספת B27 (NB + B27): ל-50 מ"ל של מדיום NB ללא פנול אדום, יש להוסיף 1 מ"ל של תוסף B27.
- תוסף מסוג Hibernate-E בינוני עם B27 (מצב שינה + B27): ל-50 מ"ל של תוסף מסוג Hibernate-E, יש להוסיף 1 מ"ל של תוסף B27.
- תמיסה פיזיולוגית חוץ-תאית (EPS): ל-1 ליטר מים סטריליים, הוסיפו את הדברים הבאים בריכוזים הסופיים שצוינו: NaCl (140 mM), KCl (3.5 mM), HEPES (10 mM), גלוקוז (20 mM) ו-CaCl 2 (2 mM). מערבבים עד להמסה ומתאימים את ה-pH ל-7.4 על ידי הוספת NaOH (0.5 מ') או HCl (0.5 מ'). מתחת למכסה המנוע, יש לעקר על ידי סינון (גודל נקבוביות 0.2 מיקרומטר) ולאחסן ב-4 oC.
- מדיום הנשר המעובד (DMEM) של Dulbecco: ל-500 מ"ל של DMEM גלוקוז גבוה (4.5 גרם/ליטר) ללא L-גלוטמין ופנול אדום, יש להוסיף 50 מ"ל של סרום סוסים, 50 מ"ל של סרום בקר עוברי (FBS), 10 מ"ל של L-גלוטמין (200 mM), 10 מ"ל של נתרן פירובט (100 mM), 10 מ"ל של פניצילין-סטרפטומיצין (10,000 U/mL). מסננים (בגודל נקבוביות 0.2 מיקרומטר) ומאחסנים ב-5 מ"ל ב-4 oC עם מכסה סגור היטב.
- ציוד וחומרי מעבדה אחרים (יום דיסקציה)
- הגדר אמבט מים ל 37 מעלות צלזיוס. מחממים את האליקוטים הבאים: 50 מ"ל של HBSS, ו -5 מ"ל של DMEM.
- עקר את הכלים הבאים על-ידי טבילה בכוס המכילה אתנול מוחלט (איור 1B): מלקחיים, מלקחיים מעוקלים, מספריים, מלקחיים מעוקלים עדינים, מלקחיים ישרים עדינים, מספריים לניתוחים, מלקחיים בעלי זווית עדינה ומספריים קפיציים מדויקים.
הערה: כדי להגן על הכלים, הניחו חומר רך (למשל, מגבונים מדויקים מדעית) בתחתית הכוס. - מלאו שני מגשים בקרח והניחו את הפריטים הבאים.
- מגש קרח 1 (איור 1C): הניחו כלי ניתוח בכוס עם אתנול מוחלט, עם HBSS לשטיפת כלי הניתוח, צלחת בגודל 10 ס"מ עם HBSS להנחת העוברים, צלחת בגודל 6 ס"מ עם HBSS כדי למקם את ראשי העוברים, ותבשיל בגודל 6 ס"מ עם Hibernate + B27 כדי למקם את המוחות של העוברים.
- מגש קרח 2: מניחים 1 מ"ל אליקוט של טריפסין 2.5% ותבשיל בגודל 3.5 ס"מ עם תרדמה + B27 להיפוקמפוס המנותק.
הערה: הזמן הדרוש להליך זה תלוי בניסיון החוקר ובמספר העוברים שיש לנתח. לכן, הקרח חייב להישאר קפוא למשך פרק הזמן הדרוש. מגשי פוליסטירן מומלצים למטרה זו.
2. דיסקציה וזריעה (איור 1)
- בידוד בהיפוקמפוס
הערה: חולדות הרות עם עוברים ב- E18 מורדמות מיד לפני תחילת הפרוטוקול בהתאם לוועדת האתיקה המקומית של אוניברסיטת ברצלונה, בהתאם לתקנות האירופיות (2010/63/UE) לגבי השימוש והטיפול בחיות ניסוי. בפרוטוקול זה, שאיפת פחמן דו חמצני (CO2) שימשה כשיטה להמתת חסד.- לנתח את החולדה ברמה של הצפק הבטן באמצעות מלקחיים ומספריים. לחלץ את הרחם עם עוברי E18 ולהניח אותו בצלחת 10 ס"מ כי כבר צונן על קרח.
הערה: חשוב להימנע מהצמדת שערות החולדות לעוברים. מומלץ להשתמש בכמויות גדולות של 70% אתנול כדי לעקר את הבטן. משלב זה והלאה, עבדו בתוך מכסה המנוע על מגש קרח 1. - פותחים את השקים העובריים ומעבירים את העוברים לצלחת של 10 ס"מ עם HBSS, ומוודאים שהעוברים שקועים במלואם.
- הסר את ראש העובר עם מספריים ומניחים אותו בצלחת 6 ס"מ עם HBSS. חזור על תהליך זה עם כל העוברים.
הערה: כדי למנוע זיהום, יש להשליך את כל הרקמות למעט ראשי העוברים במיכל עם מכסה הברגה. - החזיקו את ראש העובר עם מלקחיים מעוקלים עדינים ונקבו את המסלולים עם זוג מלקחיים ישרים עדינים, נכנסים בזווית של 45 מעלות, ואז שחררו את המלקחיים המעוקלים העדינים.
הערה: אסור שהמלקחיים יעברו דרך המוח, ולכן חשוב לשמור על הזווית בעת הכניסה. - לנתח את העור והגולגולת עם מספריים הניתוח, החל מהעצם העורפית לעצם הקדמית. הסר את המוח עם זוג מלקחיים מעוקלים דק ומניחים אותו בצלחת 6 ס"מ עם Hibernate + B27. חזרו על התהליך הזה עד שכל המוחות יתאוששו.
- להפריד באופן סגיטאלי את הטלנצפלונים עם המלקחיים הישרים העדינים.
הערה: משלב זה ואילך, כריתת ההיפוקמפוס מתבצעת תחת סטריאומיקרוסקופ. מומלץ להשתמש במנורות מפרקיות כך שהאור יאיר את משטח הדיסקציה מהצדדים. מומלץ גם להשתמש ברקע שחור כמו זה מספק יותר ניגודיות, המאפשר להבחין טוב יותר את ההיפוקמפוס. - הכינו מנה בקוטר 10 ס"מ על ידי הנחת טיפות של תרדמה + B27 במרחקים של 1 ס"מ (למשל, במעגל). הניחו טלנספלון אחד לכל טיפה של מצב שינה + B27 ודמיינו דרך טווח הניתוח (מומלץ הגדלה אובייקטיבית של פי 1.25).
- בזהירות לקלף את קרום המוח ולהסיר את התלמוס כדי לדמיין טוב יותר את ההיפוקמפוס.
- נתחו את ההיפוקמפוס עם מספריים הקפיצים המדויקים והניחו אותו בכלי בקוטר 3.5 ס"מ עם Hibernate + B27 במגש קרח 2. חזרו על הפעולה על כל טלנספלון עד שכל ההיפוקמפי נאספים.
- בזהירות לאסוף את כל היפוקמפי עם פיפטה פסטר ולהעביר אותם צינור 50 מ"ל.
הערה: קח את הנפח המינימלי של Hibernate + B27 בעת איסוף ההיפוקמפי כדי לא לדלל את הטריפסין.
- לנתח את החולדה ברמה של הצפק הבטן באמצעות מלקחיים ומספריים. לחלץ את הרחם עם עוברי E18 ולהניח אותו בצלחת 10 ס"מ כי כבר צונן על קרח.
- דיסוציאציה של תאים
- דיסוציאציה אנזימטית של ההיפוקמפוס
- בצינור 50 מ"ל המכיל את ההיפוקמפי, מוסיפים 1 מ"ל של 2.5% טריפסין ומביאים אותו לנפח של 5 מ"ל עם HBSS. דגירה במשך 15 דקות באמבט המים ב 37 מעלות צלזיוס.
- כדי לדלל את הטריפסין, להוסיף 10 מ"ל של HBSS מחומם מראש דגירה במשך 5 דקות באמבט מים ב 37 מעלות צלזיוס.
- מעבירים את ההיפוקמפי שנראה כעת כמסת ריר לצינור של 50 מ"ל עם מיקרופיפט של 1,000 μL, מוסיפים 6 מ"ל של HBSS שחומם מראש, ודוגרים במשך 5 דקות באמבט המים בטמפרטורה של 37 מעלות צלזיוס.
- דיסוציאציה מכנית של ההיפוקמפוס
- העבר את המסה לצינור 2 מ"ל עם תחתית חרוטית, לוקח את נפח מינימלי. הוסף 1 מ"ל של מדיית DMEM שחוממה מראש. הומוגניות של הכדור עם מיקרופיפטה של 1,000 μL על ידי שאיפה עדינה למעלה ולמטה.
הערה: חשוב להימנע מיצירת בועות בעת השאיפה שכן בועות עלולות ללכלך את התאים. - חזור על השאיפה למעלה ולמטה עם פיפטה זכוכית משוכה מראש (10x-20x), עם הקצה שלה במגע עם החלק התחתון החרוטי של הצינור. הימנעו מיצירת בועות. בסוף שלב זה, התערובת חייבת להיות שקופה.
- לאחר ערבוב הומוגני כך שהתערובת שקופה, מעבירים את התערובת לצינור המכיל 4 מ"ל של מדיית DMEM בטמפרטורה של 37 מעלות צלזיוס והומוגניות עם פיפטה זכוכית על ידי פיפטינג למעלה ולמטה.
- העבר את המסה לצינור 2 מ"ל עם תחתית חרוטית, לוקח את נפח מינימלי. הוסף 1 מ"ל של מדיית DMEM שחוממה מראש. הומוגניות של הכדור עם מיקרופיפטה של 1,000 μL על ידי שאיפה עדינה למעלה ולמטה.
- דיסוציאציה אנזימטית של ההיפוקמפוס
- זריעת תאים
- ספירת התאים. ניתן לספור את מספר הנוירונים בתמיסה על פי נהלי מעבדה סטנדרטיים.
הערה: בניסויי הדמיה לזיהוי נוגדנים ופעילות סידן, ריכוז של 50,000 תאים למנה של 3.5 ס"מ הוא אופטימלי. - שמירה על התאים תלויים, משיכת הנפח המחושב, וצלחת בכלים בגודל 3.5 ס"מ המכילים כיסויים מצופים PLL או בכלים עם תחתית זכוכית מצופה PLL.
- פזרו באופן שווה את התאים על הכלים על ידי ניעור רך בתנועות מוצלבות (קדימה ואחורה, ואז מצד לצד; חזרו על הפעולה לפי הצורך) והניחו את הכלים באינקובטור CO2 (5%).
הערה: חשוב להשתמש בתנועות צולבות כדי למנוע מהתאים להתיישב בשולי המנה. - כל שבוע, להוסיף כ 1 מ"ל של NB + B27, כך התרבות לא יבש.
הערה: לאחר שבועיים (14 ימים במבחנה [div]), הנוירונים בוגרים ומבטאים את כל הגורמים שישמשו לניסויים. המספר הממוצע הכולל של נוירונים שהתקבלו באמצעות פרוטוקול זה הוא בערך 2.5 x 106 נוירונים המגיעים מממוצע של 12 עוברי E18 לכל חולדה הרה.
- ספירת התאים. ניתן לספור את מספר הנוירונים בתמיסה על פי נהלי מעבדה סטנדרטיים.
חלק 2: שימוש בתרביות נוירונים בהיפוקמפוס לזיהוי נוגדנים בחלבוני פני השטח של התא העצבי
הערה: חלק זה של הפרוטוקול מדגים כיצד תרביות היפוקמפוס משמשות לזיהוי נוגדנים נגד NMDAR בסרום ו / או CSF של חולים עם דלקת מוח אנטי NMDAR. אימונוסטינינג פלואורסצנטי משמש כדי לדמיין את תגובתיות הנוירונים החיים, אך ניתן להשתמש גם בשיטות הדמיה אחרות. בקרה מתאימה לניסוי זה תהיה סרום או CSF מאדם בריא. בעת שימוש בדגימות אנושיות, יש לזכור כי ייתכן שיידרש אישור מוועדת האתיקה המוסדית.
3. חיסון פלואורסצנטי חי
- השתמשו ב-14 תאי div שגודלו על גבי כיסויים (50,000 תאים למנה בקוטר 3.5 ס"מ המכילה חמישה כיסויים).
- בתוך מכסה המנוע, שטפו את הכיסויים עם NB מחומם מראש ל-37 מעלות צלזיוס.
- הוסף את הדגימה שבמקרה זה מכילה נוגדנים נגד NMDAR (המשמשים כנוגדן ראשוני) מדולל במדיית NB בשעה 1:200 לסרום או 1:2 ל- CSF ודגירה של שעה אחת ב- 37 מעלות צלזיוס (בתוך חממת CO2 (5%).
- יש לשטוף בזהירות עם PBS 3x ב-RT.
- הוסיפו תמיסת קיבוע (4% פורמלדהיד ב-PBS) ודגרו ב-RT למשך 5 דקות.
התראה: בעת טיפול בפורמלדהיד של 4%, יש לעבוד בתוך מכסה המנוע וללבוש ציוד מגן אישי מומלץ. - יש לשטוף 3x עם PBS במשך 5 דקות כל אחד.
- הוסף נוגדן משני עז נגד אדם AF488 ב 1:1000 דילול דגירה ב RT במשך שעה אחת.
הערה: במהלך הדגירה, יש להגן מפני חשיפה לאור על ידי כיסוי ברדיד אלומיניום. - יש לשטוף 3x עם PBS במשך 5 דקות כל אחד. יש לשטוף במים מזוקקים
- הרכב את הכיסויים עם מדיום הרכבה נוזלי (לדוגמה, מדיה להרכבה נגד דהייה עם DAPI; כ-7 μL), שאף את כל הנוזלים הנותרים ושטוף במים מזוקקים. הנוירונים מוכנים כעת להדמיה פלואורסצנטית.
התראה: בעת טיפול במדיום הרכבה, יש ללבוש את ציוד המגן האישי המומלץ.
חלק 3: הדגמה של השפעות פתוגניות נוגדנים באמצעות הדמיית סידן
הערה: חלק זה של הפרוטוקול מדגים כיצד לקבוע אם לנוגדנים בחולים יש השפעה תפקודית על התרביות, מה שמרמז על פתוגניות. על מנת להגדיל את משמעות ההשפעות, נעשה שימוש במאגר של CSF משמונה חולים. פעילות הסידן של התרביות החיות נרשמה על גירוי כימי (NMDA + גליצין) באמצעות מחוון סידן פלואורסצנטי GECI (GCaMP5G). מחקרים אלה דורשים מיקרוסקופ פלואורסצנטי הפוך עם תא תא שיכול לשמור על התנאים הפיזיולוגיים הנדרשים של הנוירונים.
4. הדמיית סידן
- השתמש ב-14-18 תאי div שגודלו על גבי כיסויים (50,000 תאים למנה בגודל 3.5 ס"מ עם חמישה כיסויים)
- שבוע לפני ההדמיה, יש להוסיף את הווקטור הנגיפי pAAV2-CAG-GCaMP5G ברזולוציה של 2.5 x10 GC/mL לתאים ולדגור במשך 5-7 ימים.
הערה: וקטור SAV סרוטיפ 2 זה, הזמין מסחרית, ארוז מראש, מבטא יתר על המידה מחוון סידן מקודד גנטית GCaMP5G תחת מקדם CAG. - יום אחד לפני ההדמיה, הוסף את דגימת המטופל (בדוגמה זו, מאגר של CSF מדולל 1:25 ב- NB + B27) ודגרה במשך 24 שעות. יש לסנן תמיד דגימות אנושיות (גודל נקבוביות 0.2 מיקרומטר) לפני השימוש כדי למנוע זיהום.
הערה: עבור מחקרים אלה, בקרת CSF מנבדקים בריאים צריכה להיות מופעלת במקביל. - ביום ההדמיה, הכינו את מערך ההדמיה והגדירו את תא התא במיקרוסקופ ל-37 מעלות צלזיוס, מלאו את הנתיב במים מזוקקים והחדירו 5% CO2 כדי לשמור על התנאים הפיזיולוגיים של התא.
- במכסה המנוע, לשטוף את התאים משלב 3 עם 3 מ"ל של EPS מחומם מראש ל 37 °C
- מכסים את התאים עם 2.45 מ"ל של EPS ולהעביר אותם לתא התא מיקרוסקופ. הוסף NBQX (10 μM) כדי לחסום את קולטני AMPA ו- KA כדי לדמיין באופן בלעדי את תגובת הקולטן NMDA.
- במיקרוסקופ הפלואורסצנטי ההפוך המצויד במנורת כספית וקוביית מסנן FITC, רכשו סרט של 2 דקות עם מסגרות שנרשמו כל 100 מילישניות (פעילות ספונטנית).
הערה: נעשה שימוש במטרה אווירית של 20x NA 0.75, ותמונות (512 x 512 פיקסלים, גווני אפור של 16 סיביות) צולמו כל 100 אלפיות השנייה במצלמת sCMOS. - רכוש את הסרט השני של 4 דקות עם מסגרות שהוקלטו כל 100 אלפיות השנייה. זמן קצר לאחר תחילת הרכישה, הוסיפו תמיסת גירוי (NMDA [100 μM] + גליצין [1 μM]) לצלחת.
הערה: הוספת המדיה למנה תיצור מערבולות שעלולות לשבש את תנאי ההדמיה (מיקוד, עוצמת פלואורסצנטיות ו/או אות רקע לא ספציפי). אין להוסיף יותר מ 50 μL של פתרון לתוך צלחת מלא 2.5 מ"ל כדי להקטין את ההסתברות של שינויים כאלה. - באמצעות תוכנת עיבוד תמונה (ImageJ שימשה כאן), לחלץ את האות הפלואורסצנטי לאורך זמן, המתקבל עם הגירוי, מהתרביות שהודגמו עם המטופל ולשלוט בדגימות CSF.
הערה: בדיקות GCaMP, כאשר הן נקשרות ליוני סידן חופשיים, עוברות שינוי קונפורמציה הגורם להן להיות בהירות יותר. לכן, העלייה בעוצמת הפלואורסצנציה מתואמת עם זרם סידן עקב דפולריזציה עצבית. - קבע את אזורי העניין (ROI) לניתוח. פלח באופן ידני את הסומאות של נוירונים והוסף את ה- ROI למנהל החזר ההשקעה (נתח כלים > > מנהל החזר ההשקעה > הוסף). שמור את ההחזר על ההשקעה מתפריט ROI Manager (עוד > שמירה).
- קבעו את המידות ('נתח > קבעו מדידות') ובחרו בערך האפור 'ממוצע'. חלץ את פרופיל עוצמת הפלואורסצנציה הממוצעת מסומות התא על-ידי לחיצה על עוד > Multi Measure ולאחר מכן שמור את הטבלה שנוצרה כגיליון אלקטרוני .xls.
- בצע ניתוחים סטטיסטיים כדי להשוות את הפלואורסצנטיות בין הקבוצות (CSF של המטופלים לעומת CSF של הבקרה).
תוצאות
הקמת תרביות עצביות היפוקמפוס מנותקות, עובריות, מכרסמים
הפרוטוקול המוצג כאן מבוסס על המחקרים המשפיעים על גידול תאי עצב שבוצעו על ידי בנקר וגוסלין15. הפרוטוקול שוכלל כדי להשיג תרביות נוירונים עם מורפולוגיה, צפיפות וטוהר אופטימליים לביצוע מחקרי זיהוי נוגדנים על פני השטח של תאי עצב. פרוטוקול הדיסקציה והזריעה מחולק לשלושה חלקים (איור 1A). החלק הראשון, בידוד ההיפוקמפוס, מורכב ממיצוי כירורגי של הרקמה החיה (איור 1A, פאנל שמאלי). כפי שעולה מהאיור, חולדות Wistar הרות עם עוברי E18 הן חומר המוצא העיקרי לתרבות מצליחה. ברגע שהמוח מופק מעוברי E18, המיקרו-כירורגיה מתבצעת תחת סטריאומיקרוסקופ. בעזרת כלים מתאימים (איור 1B) וטיפול מדויק, ניתן להפריד את ההיפוקמפוס משאר רקמת העצב. הנטייה של רקמות במדיה הספציפית מתוארת באיור 1C. החלק השני של הפרוטוקול מורכב מהדיסוציאציה של תאי ההיפוקמפוס. הוא מחולק לשני שלבים (איור 1A, פאנל אמצעי): דיסוציאציה אנזימטית ודיסוציאציה מכנית של ההיפוקמפוס, וכתוצאה מכך תאים בודדים, מנותקים. באמצעות מתודולוגיה זו ניתן להשיג תרביות תאים ללא אגרגטים של תאים, כפי שמיוצג באיור 2A-D. החלק השלישי של הפרוטוקול מורכב מזריעת התאים (איור 1A, פאנל ימני). חלק זה של הפרוטוקול הוא חיוני על מנת להתאים את הצפיפות וההומוגניות של התרבות העצבית בצלחת. ספירת התאים וזריעת 50,000 תאי עצב באזור של צלחת בגודל 3.5 ס"מ מספקת צפיפות אופטימלית לביצוע לא רק ניסויים כדי לקבוע את נוכחותם של נוגדנים לחלבונים על פני השטח של התא העצבי (איור 3), אלא גם לנתח את הפתוגנטיות של נוגדנים אלה באמצעות הדמיית סידן (איור 4).
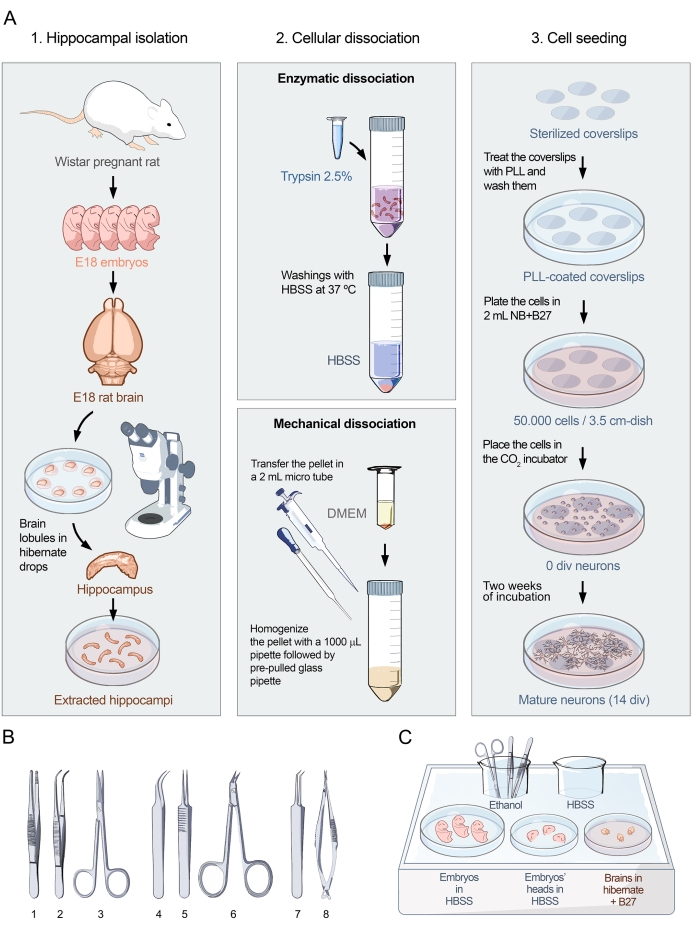
איור 1: פרוטוקול חזותי לתרביות ראשוניות של נוירונים בהיפוקמפוס. (A) תרשים זרימה המציג את שלושת חלקי הפרוטוקול להכנת תרביות תאים מנותקים של נוירונים בהיפוקמפוס מחולדות עובריות ב-E18. הפרוטוקול מחולק ל -1. בידוד בהיפוקמפוס, 2. דיסוציאציה של תאים, ו-3. זריעת תאים. (B) בחירת כלים מומלצים לבידוד בהיפוקמפוס המקובצים לשלוש קטגוריות: (1- מלקחיים, 2- מלקחיים מעוקלים, 3- מספריים) לאיסוף עוברים, (4- מלקחיים מעוקלים עדינים, 5- מלקחיים ישרים-עדינים, 6- מספריים כירורגיים) לחילוץ המוח, ו-(7- מלקחיים בזווית עדינה, 8- מספריים קפיציים מדויקים) לבידוד בהיפוקמפוס. (C) ייצוג סכמטי של מגש קרח 1 עם צלחות ומדיה הדרושים לבידוד ההיפוקמפוס. עוברים וראשים ממוקמים ב-HBSS, ואילו מוחות ממוקמים במצב שינה בינוני + B27. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
תרביות של נוירונים בהיפוקמפוס בגיל 18 div הן בוגרות, מחוברות זו לזו ומבטאות חלבונים מבניים ותפקודיים
בגדילה ובהתבגרות של תרביות עצביות, ניתן להעריך שני שלבים מובחנים: שלב הקיטוב של תא העצב (איור 2A,B) ושלב ההתפתחות והבנייה הדנדריטית של הרשת הסינפטית (איור 2C,D). תאים על צלילה אחת מתחלקים באופן שווה ונדבקו לצלחת, ומפתחים למלה סביב גוף התא עם נויריטים קלים שמתחילים להתרחב (איור 2A). לאחר כמה ימים בתרבית, הנוירוריטים משתרעים למרחק קצר. התאים מראים קיטוב משמעותי, אך יש צמיחה נטו קטנה (איור 2B). לאחר שלב זה, סינפטוגנזה בולטת, והנוירונים מתחילים להתחבר. הרשת העצבית ממשיכה לגדול ונעשית מורכבת יותר (איור 2C). בגיל 18, תאי העצב בוגרים ומחוברים זה לזה; הרשת העצבית בנויה (איור 2D). ברגע שעמודי השדרה הסינפטיים נוצרים ומחוברים, תאי העצב מקוטבים לחלוטין ומבטאים את כל החלבונים הפונקציונליים והמבניים. מבין החלבונים הרבים המתבטאים על-ידי תאי עצב בוגרים בתרבית, הקולטן העצבי NMDA (איור 2E) והחלבון הסינפטי PSD95 (איור 2F) נבחרו כאן כסמנים מייצגים. יתר על כן, אפשר לדמיין אקסונים באופן סלקטיבי על-ידי תיוג נוירופילמנט (NF) (איור 2G) והדמיה של דנדריטים על-ידי התמקדות בחלבון MAP2 (איור 2H).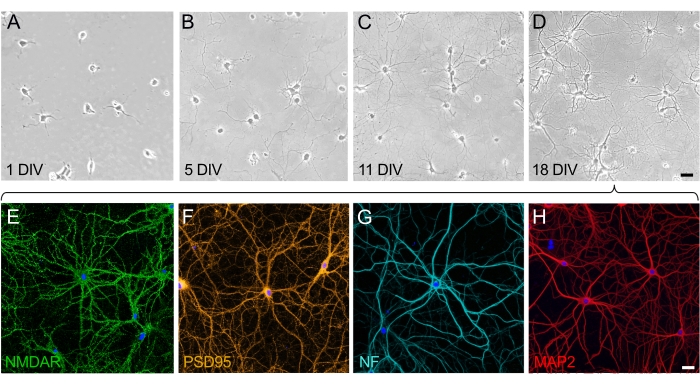
איור 2: מהלך הזמן של ההבשלה של תרביות תאים מנותקים של נוירונים בהיפוקמפוס. (A-D) תמונות ניגודיות פאזה של נוירונים בהיפוקמפוס במהלך 18 הימים הראשונים של התרבית. (A) תאי עצב ב-1 צוללים עם ההצמדה למצע המצופה PLL. (B) הופעתם של נויריטים קטנים בתאי עצב ב-5 div. (C) נוירונים ב-11 div פיתחו נויריטים ארוכים שמתארכים ורוכשים מאפיינים אקסונאליים. (D) תאי עצב ב-18 div הם בוגרים ויצרו רשת עצבית. סרגל קנה מידה (A-D) = 40 מיקרומטר. (E-H) תמונות פלואורסצנטיות מייצגות שצולמו על ידי מיקרוסקופיה של סריקת לייזר קונפוקלית באמצעות סמנים סלקטיביים כדי להראות נוירונים בוגרים ב-18 div. תרביות נוירונים היו קבועות ומוכתמות בנוגדנים שמכתימים באופן סלקטיבי את הקולטן העצבי (E) (NMDAR), (F) סמן סינפטי (PSD95), (G) סמן אקסונאלי (נוירופילמנט, NF) ו-(H) סמן דנדריטי (MAP2). סרגל קנה מידה (E-H) = 20 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
נוגדנים בדגימות מטופלים מגיבים עם אנטיגנים על פני השטח של התאים העצביים
הדגימות (סרום ו- CSF) המתקבלות מחולים הסובלים מדלקת המוח נגד NMDAR מכילות נוגדנים עצמיים המזהים את ה- NMDAR הקיים על פני השטח של נוירונים. הדגירה של התרביות עם דגימות המטופלים מייצרת אות פלואורסצנטי אינטנסיבי על פני התא ועל הדנדריטים (איור 3A,C). לעומת זאת, דגימות בקרה אינן מייצרות אות פלואורסצנטי כאשר הן ניתנות לתרביות העצביות (איור 3B,D). ממצאים אלה מראים כיצד ניתן להשתמש בתרביות כדי לסנן דגימות של מטופלים אחר נוגדנים, ויכולים להוביל לזיהוי נוגדנים חדשים המכוונים לפני השטח של התא העצבי.
דגימת CSF מהחולה מפחיתה את ריכוז הסידן התוך-תאי בתרביות המושרות על-ידי NMDA של נוירונים בהיפוקמפוס
כדי להעריך את השפעת הנוגדנים של המטופלים על הפעילות העצבית (לאחר טיפול של 24 שעות), נטרו באופן אופטי מעברי סידן תוך תאיים מהנוירונים בתרבית בזמן אמת על גירוי בתיווך NMDA. היישום של NMDA יוצר עלייה בעוצמת הפלואורסצנציה, כפי שמעיד שינוי בפלואורסצנציה הירוקה התוך-תאית (איור 4A ווידאו משלים 1). תאי עצב שטופלו בדגימת CSF של הבקרה הראו הבדל גבוה יותר בעוצמת הפלואורסצנטיות (56%) כאשר הגירוי הופעל בהשוואה לתאים שטופלו בדגימת CSF של המטופל. ההבדלים בעוצמת הפלואורסצנציה נמדדו, ועקומות הגירוי בתיווך NMDA מהנתונים שחולצו מהסומא של התאים הושוו (איור 4B,C). עקומות הגירוי מראות כי היה זרם תוך-תאי של סידן בשני התרחישים, אך התרביות שטופלו ב-CSF (קו אפור) של המטופלים הראו תגובה נמוכה יותר מאשר התרביות שטופלו בביקורת (קו שחור). תוצאות אלה מראות כי הנוגדנים הנמצאים ב-CSF של המטופלים מפחיתים את הפעילות התאית עקב האינטראקציה של הנוגדנים עם ה-NMDAR, ובכך גורמים להשפעה פתוגנית.
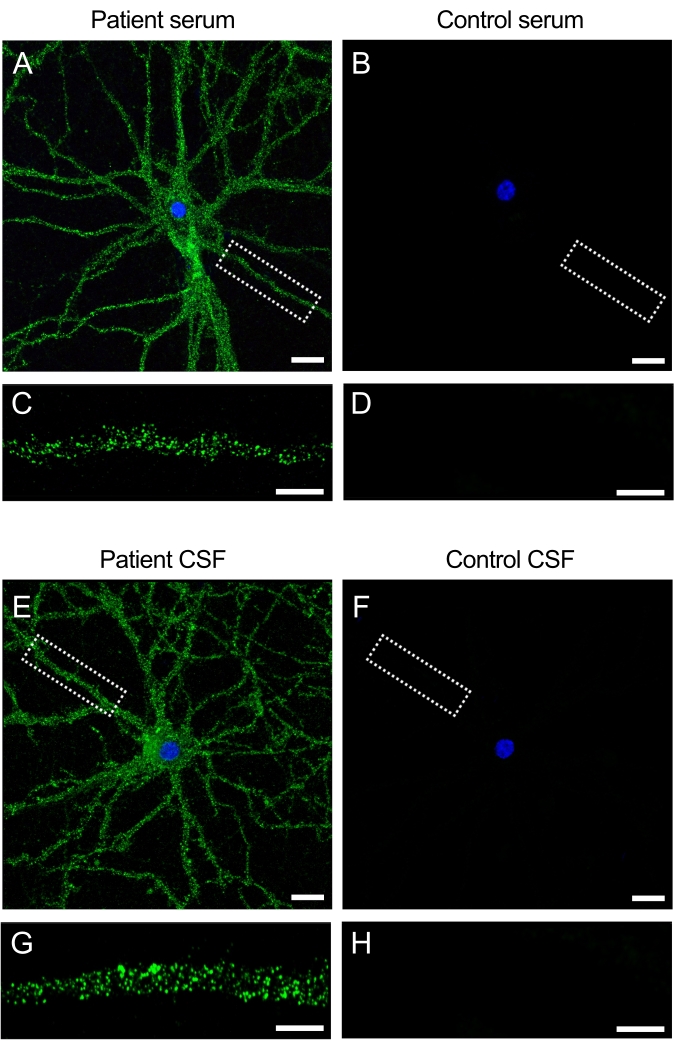
איור 3: נוגדנים של מטופלים מגיבים עם פני השטח של תרביות עצביות . (A,E) סרום ו-CSF מחולים עם דלקת המוח נגד NMDAR מגיבים עם פני התא של נוירונים חיים בהיפוקמפוס של חולדה, (B,F) ואילו הסרום וה-CSF של נבדקי הביקורת לא מראים תגובתיות. סרגל קנה מידה (A,B,E,F) = 20 μm. תמונת הגדלה גבוהה יותר של דנדריט (63x) המציגה את תבנית פני השטח האופיינית של תגובתיות עבור (C,G) הסרום של המטופל ו-CSF ו-(D,H) שלילית עבור בקרות. התמונות צולמו על ידי מיקרוסקופיה של סריקת לייזר קונפוקלית. סרגל קנה מידה = 10 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
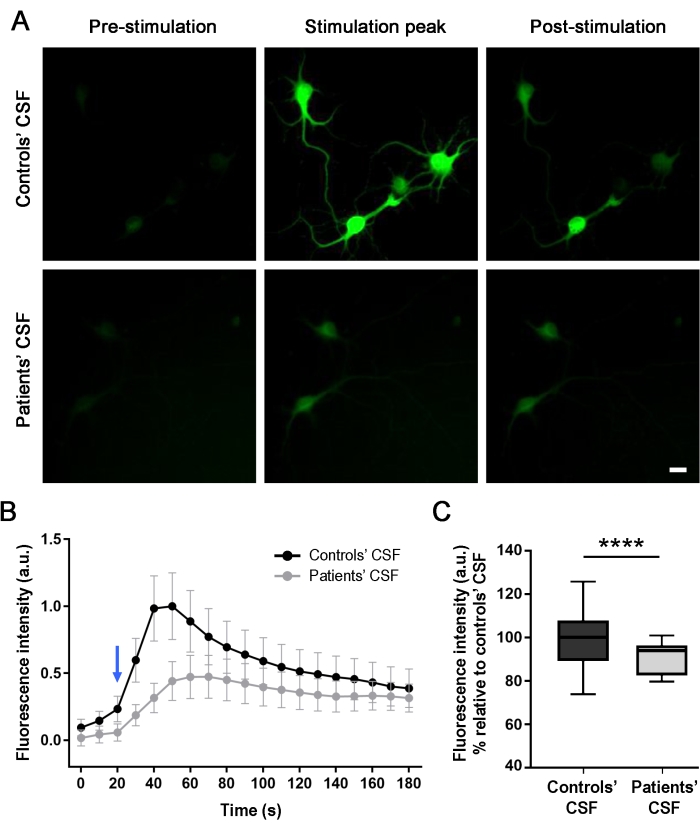
איור 4: נוגדנים של מטופלים מפחיתים את זרם הסידן בתאי עצב של חולדות המבטאים GCaMP5G. (A) מתן תמיסת גירוי (NMDA [100 μM] + גליצין [1 μM]) בתרביות של נוירונים עורר זרם סידן, כפי שצוין על ידי הגדלת פלואורסצנטיות ירוקה תוך תאית (שיא הגירוי), בהשוואה לתמונה שצולמה לפני הגירוי (טרום גירוי). לאחר 120 שניות, עוצמת הפלואורסצנציה יורדת ומתייצבת (לאחר הגירוי). תרביות שטופלו ב-CSF של המטופלים הראו ירידה משמעותית (56%) בעלייה בסידן בתיווך NMDA בהשוואה ל-CSF של הביקורת. התמונות צולמו על ידי מיקרוסקופיה פלואורסצנטית. סרגל קנה מידה = 20 מיקרומטר. (B) תרשים של אחד משלושת הניסויים הבלתי תלויים המייצגים את עוצמת הפלואורסצנטיות לאורך זמן (180 שניות) עבור התרביות שטופלו ב-CSF (קו שחור) של הבקרה ו-CSF (קו אפור) של המטופלים על גירוי NMDA (חץ כחול). n(CSF של בקרות) = 20 תאים; n (CSF של המטופלים) = 28 תאים. הנתונים מיוצגים כממוצע ± SEM. (C) חלקות תיבה מציגות את האחוזון החציוני, ה-25 וה-75. שפם מציין את ערכי המינימום והמקסימום. הערכת המשמעות בוצעה על ידי ניתוח דו-כיווני של שונות (ANOVA; p < 0.0001) ומבחני Mann-Whitney U (p < 0.0001). ערך של p < 0.05 נחשב מובהק סטטיסטית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
סרטון משלים 1: סרטון המציג שני נוירונים בהיפוקמפוס המבטאים GCaMP5G זה לצד זה: נוירון שטופל ב-CSF של Control (משמאל) לעומת נוירון שטופל ב-CSF של המטופלים (מימין). היישום של NMDAR (גירוי) יוצר עלייה בעוצמת הפלואורסצנציה התוך-תאית בשני המקרים, אך עם רמה גבוהה משמעותית בנוירון המטופל ב- CSF של הבקרה לעומת זה שטופל ב- CSF של המטופלים. התמונות צולמו על ידי מיקרוסקופיה פלואורסצנטית ונערכו באמצעות ImageJ החלת טבלת בדיקת המידע (LUT) Fire. 1700 מסגרות (170 שניות); מואץ 5 פעמים. סרגל קנה מידה = 10 מיקרומטר. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
התחום ההולך וגדל של אוטואימוניות בתיווך נוגדנים פתח חלון הזדמנויות לזיהוי נוגדנים עצמיים עצביים שניתן להשתמש בהם כדי לשפר את האבחון והטיפול בחולים. תרבויות של נוירונים בהיפוקמפוס הן כלי חיוני לזיהוי נוגדנים; לכן, חשוב לבצע פרוטוקול סטנדרטי כדי לקבל תוצאות אמינות וניתנות לשחזור. השלבים החשובים ביותר שיש לקחת בחשבון, מגבלות ופתרון בעיות, נדונים כאן.
ניתן לקבץ את השלבים הקריטיים של פרוטוקול זה לשלוש קטגוריות, תלוי אם הם משפיעים על הטוהר, על ההומוגניות או על הכדאיות של הנוירונים בהיפוקמפוס.
טוהר - כדי להשיג תרביות תאים ראשוניות אופטימליות, על החוקר להיות בטוח בעצמו, מאומן ומסוגל לעבוד במהירות, במיוחד כדי למזער את זמן הנתיחה. גם אם תאי עצב פירמידליים הם סוג התא העיקרי, ההיפוקמפוס מכיל מגוון של אינטרנורונים14. כדי ליצור תרביות עם תאי גליה מינימליים, יש לחלץ את ההיפוקמפוס עם הרקמה המינימלית שמסביב. השימוש ברקע שחור במהלך הדיסקציה מסייע לזהות את גבולות ההיפוקמפוס תחת הסטריאומיקרוסקופ. בנוסף, יש לקחת בחשבון כי צפיפות תאים נמוכה יותר לגרום פחות תמיכה paracrine ולעשות את זה יותר קשה לשמור על התרבית13. לכן, חשוב לזכור את האיזון הזה. זה חשוב במחקרי הדמיה המשתמשים במספר נמוך של תאים (50,000 נוירונים לכל צלחת של 3.5 ס"מ). כדי להיות מסוגל לקבל זמן נוסף עבור מיצוי ההיפוקמפוס, מדיה Hibernate המשמר את הרקמהיש להשתמש 17. עבודה עם כלי ניתוח נאותים היא גם חיונית. כלים ברמת דיוק גבוהה הם עדינים, ולכן יש להבטיח את יכולת השחזור של הטכניקה על ידי הגנה קפדנית עליהם.
הומוגניות - כדי לפתח תרבית ללא אגרגטים של תאים, הדיסוציאציה המכנית של התא שודרגה על ידי שילוב של פיפטות זכוכית משוכות מראש עם פיפטה סטנדרטית של 1,000 μL.
כדאיות - בפרוטוקול זה לא נוספו אנטיביוטיקה מכיוון שהם משפיעים על ההתרגשות העצבית ומשנים את התכונות האלקטרופיזיולוגיות של הנוירונים בתרבית18. לכן, זיהום סביר מאוד אם הסטנדרטים הגבוהים ביותר של סטריליות אינם נשמרים. הטמפרטורה היא גם גורם מפתח. שמירה על הרקמה קרה במהלך בידוד ההיפוקמפוס מאטה את חילוף החומרים ומפחיתה את השפלת התאים. הרקמה הוחזקה, אם כן, על קרח עד לתהליך הדיסוציאציה של התא. יתר על כן, חיוני למצוא את האיזון הנכון במהלך דיסוציאציה אנזימטית של תאים המפרקים את התאים ללא תזה של תאים מסומנים. בפרוטוקול זה, תזמוני הדגירה עם טריפסין ושלבי הכביסה הבאים עברו אופטימיזציה כדי להשיג תאים בודדים עם מספיק מקום כדי לאפשר יצירת רשת עצבית מתאימה.
צעדים קריטיים נמצאים גם ברישומי פעילות חיסונית חיה פלואורסצנטית ובפעילות סידן מתרביות הנוירונים. כדי לבצע בדיקות חיסוניות חיות מוצלחות לקביעת נוכחות נוגדנים לחלבונים על פני התא בדגימות של מטופלים, יש להימנע מחדירה של התאים שתאפשר לנוגדנים גישה לחלבונים תוך-תאיים. בנוסף, בהתבסס על titer של הנוגדנים, זמן הדגירה ודילול הדגימה צריכים להיות מותאמים בהתאם (למשל, נוגדני טיטר גבוהים מאוד יכולים לתת כתם רקע שמקשה על פירוש התוצאות). בעת ביצוע הערכת הפתוגניות של הנוגדנים העצמיים עם הדמיית סידן, יש להשתמש במדיה אופטימלית למדידות פעילות תאית (למשל, דיכוי Mg2+ במדיום התרבית חשוב לביצועים טובים). יתר על כן, עבור הדמיה פלואורסצנטית, יש להימנע ממדיה עם מחווני pH כגון פנול אדום מכיוון שהיא מציגה אות רקע לא ספציפי.
ישנן שתי מגבלות עיקריות של השימוש בתרביות נוירונים בהיפוקמפוס. ראשית, בהשוואה לקווי תאים יציבים, תרביות ראשוניות חייבות להיווצר ברציפות, וזה מרמז על שימוש בחיות מעבדה באופן קבוע. קווי תאי גזע פלוריפוטנטיים מושרים (iPSC) יכולים להחליף את הצורך בשימוש במודלים של בעלי חיים, אך פרוטוקולי ההתמיינות עבור iPSC עדיין אינם אופטימליים. שנית, נוירונים שמקורם ב- iPSC אינם מבטאים את הספקטרום המלא של חלבוני פני השטח, ולכן, אם נעשה בהם שימוש, היעדר תגובתיות אינו מרמז בהכרח על השליליות של המדגם19.
ישנן שלוש שיטות לסינון נוכחות של נוגדנים עצמיים בסרום או ב-CSF של חולים החשודים כבעלי AE: בדיקה מבוססת רקמה (TBA) באמצעות רקמת מוח של חולדה, בדיקה מבוססת תאים (CBA) באמצעות תאי HEK שעברו טרנספקציה כדי לבטא חלבונים עצביים, והיישום המדווח כאן באמצעות תרביות חיות של נוירונים בהיפוקמפוס19. החשיבות של שיטת נוירוני ההיפוקמפוס בתרבית טמונה ביכולתה להבדיל בין תגובתיות לבין אנטיגנים על פני השטח ואנטיגנים תוך-תאיים שאינם ניתנים להבחנה בקלות על-ידי TBA. חוץ מזה, תרביות נוירונים ראשוניות, בניגוד ל-CBA בתאי HEK שעברו טרנספקציה, אינן מוגבלות על ידי הרפרטואר של חלבונים שעברו טרנספקציה. בנוסף, ניתן להשתמש בנוירונים מתורבתים בהיפוקמפוס כדי לזהות נוגדנים חדשים ואת אנטיגני המטרה שלהם בשילוב עם מיצוי חיסוני וספקטרומטריית מסה, ולכן להרחיב את הספקטרום של נוגדנים הניתנים לזיהוי. לבסוף, הוא מאפשר להעריך את ההשפעות הפתוגניות של הנוגדנים העצמיים על ידי שיטות הדמיה חיות שיכולות לעקוב אחר שינויים בפעילות התאית. לסיכום, זיהוי נוגדנים עצמיים חדשים מאפשר בסופו של דבר ייזום של אימונותרפיות ספציפיות לשיפור תוצאות המטופלים.
Disclosures
למחברים אין ניגודי עניינים.
Acknowledgements
אנו מודים למרצ'ה ריבאס, מריה מרסל, גוסטבו קסטרו, ג'ורדי קורטס, אלינה הירשמן ואנחל סנדובל (ICFO-Institut de Ciències Fotòniques) ומרסדס אלבה, מריה רדוסביץ', דויד סוטו, חאווייר גאסול, מאר גואספ ולידיה סבאטר (IDIBAPS, בית החולים קליניק, אוניברסיטת ברצלונה) על התמיכה הטכנית שלהם ועל מתן ריאגנטים, וג'וזפ דלמאו ומירנה ר. רוזנפלד (IDIBAPS, Hospital Clínic, אוניברסיטת ברצלונה) על הסקירה הביקורתית שלהם על כתב היד וההדרכה. מחקר זה מומן על ידי מכון סאלוד קרלוס השלישי (ISCIII) ומומן במשותף על ידי האיחוד האירופי, FIS (PI20/00280, J.P.), Fundació CELLEX (P.L-A.); Ministerio de Economía y Competitividad - תוכנית Severo Ochoa למרכזי מצוינות במו"פ (CEX2019-000910-S, P.L-A.); תוכנית CERCA ולייזרלאב-אירופה (871124, P.L-A.); Ministerio de Ciencia e Innovación (MCIN/AEI/ 10.13039/501100011033, P.L-A.); ופונדו סושיאל יורופו (PRE2020-095721, M.C.).
Materials
| Name | Company | Catalog Number | Comments |
| 10 cm Cell culture dish | Nunc | 12-565-020 | |
| 12 mm round coverslips | Fisher | NC9708845 | |
| 20x NA 0.75 S Fluor air objective | Nikon | CFI Super Fluor 20X | |
| 3.5 cm Cell culture dish | Nunc | 12-565-90 | |
| 6 cm Cell culture dish | Nunc | 12-565-94 | |
| B27 supplement | Gibco | 17504-044 | |
| Beaker 100 mL | Pirex | - | |
| Borax | Sigma-Aldrich | B9876 | |
| Boric Acid | Sigma-Aldrich | B0252 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved forceps | FST | 11009-13 | |
| D-Glucose | Sigma-Aldrich | D9434 | |
| DMEM High Glucose (4.5 g/L), without L-Glutamine, without Phenol Red | Capricorn | DMEM-HXRXA | |
| Female Wistar rat (18-days pregnant) | Janvier | - | |
| Fetal Bovine Serum (FBS) | Biowest | S181B-500 | |
| Fine-angled forceps | FST | 11251-35 | |
| Fine-curved forceps | FST | 11272-30 | |
| Fine-straight forceps | FST | 11251-23 | |
| FITC filter cube | Nikon | Standard Series | |
| Forceps | FST | 11000-12 | |
| Goat anti-Human AF488 | Invitrogen | A11013 | |
| HBSS | Capricorn | HBSS-1A | |
| HEPES | Sigma-Aldrich | H3375 | |
| Hibernate-E medium | Gibco | A12476-01 | |
| Horse Serum (HS) | Thermofisher | 26050088 | |
| Human anti-NMDAR antibody (CSF) | Patient Sample | - | |
| Human anti-NMDAR antibody (Serum) | Patient Sample | - | |
| ImageJ/Fiji | NIH | v1.50i | |
| Inverted fluorescence microscope | Nikon | Eclipse TE2000-U | |
| KCl | Sigma-Aldrich | 44675 | |
| L-Glutamine | Biowest | X0550-100 | |
| Mercury lamp | Nikon | C-HGFI | |
| Microscope cell chamber | Custom-build | - | |
| NaCl | Sigma-Aldrich | S9887 | |
| NBQX | Tocris | 373 | |
| Neurobasal without phenol red | Gibco | 12348-017 | |
| NMDA | Sigma-Aldrich | M3262 | |
| pAAV2-CAG-GCaMP5G | VectorBiolabs | - | |
| Paraformaldehyde 4% | Thermo scientific | J199943-K2 | |
| Penicillin-Streptomycin | Biowest | L0022-100 | |
| Phosphate-Buffered Saline | Gibco | 10010023 | |
| Poly-L-Lysine (PLL) | Peptide international | OKK-35056 | |
| Polystyrene ice tray | - | - | re-used cap of a polysterene box |
| Precision spring-scissors | FST | 15000-08 | |
| ProLong Gold with DAPI (antifading mounting media) | Molecular Probes | P36941 | |
| Scissors | FST | 14068-12 | |
| Sodium pyruvate | Biowest | L0642-100 | |
| Stereo microscope | Zeiss | Stemi 2000 | |
| Surgery scissors | FST | 14081-09 | |
| Trypsin 2.5% | Gibco | 15090046 | |
| Water, sterile endotoxine free | Sigma-Aldrich | W3500 |
References
- Dalmau, J., Geis, C., Graus, F. Autoantibodies to synaptic receptors and neuronal cell surface proteins in autoimmune diseases of the central nervous system. Physiological Reviews. 97 (2), 839-887 (2017).
- Dalmau, J., Graus, F. Antibody-mediated encephalitis. The New England Journal of Medicine. 378 (9), 840-851 (2018).
- Dalmau, J., et al. Paraneoplastic anti- N -methyl-D-aspartate receptor encephalitis associated with ovarian teratoma. Annals of Neurology. 61 (1), 25-36 (2007).
- Dalmau, J., et al. Anti-NMDA-receptor encephalitis: case series and analysis of the effects of antibodies. Lancet Neurology. 7 (12), 1091-1098 (2008).
- Lai, M., et al. AMPA receptor antibodies in limbic encephalitis alter synaptic receptor location. Annals of Neurology. 65, 424-434 (2009).
- Lancaster, E., et al. Antibodies to the GABAB receptor in limbic encephalitis with seizures: case series and characterisation of the antigen. Lancet Neurology. 9 (1), 67-76 (2010).
- Lai, M., et al. Investigation of LGI1 as the antigen in limbic encephalitis previously attributed to potassium channels: a case series. Lancet Neurology. 9 (8), 776-785 (2010).
- Sabater, L., et al. A novel NREM and REM parasomnia with sleep breathing disorder associated with antibodies against IgLON5: a case series, pathological features, and characterization of the antigen. Lancet Neurology. 13 (6), 575-586 (2014).
- Hughes, E. G., et al. Cellular and synaptic mechanisms of anti-NMDA receptor encephalitis. The Journal of Neuroscience. 30 (17), 5866-5875 (2010).
- Moscato, E. H., et al. Acute mechanisms underlying antibody effects in anti-N-methyl-D-aspartate receptor encephalitis. Annals of Neurology. 76 (1), 108-119 (2014).
- Planagumà, J., et al. Human N-methyl D-aspartate receptor antibodies alter memory and behaviour in mice. Brain. 138 (1), 94-109 (2015).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Research. 126 (3), 397-425 (1977).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocols. 1 (5), 2406-2415 (2006).
- Benson, D. L., Watkins, F. H., Steward, O., Banker, G. Characterization of GABAergic neurons in hippocampal cell cultures. Journal of Neurocytology. 23 (5), 279-295 (1994).
- Banker, G., Goslin, K. . Culturing Nerve Cells. , (1998).
- Nunez, J. Primary culture of hippocampal neurons from P0 newborn rats. Journal of Visualized Experiments. (19), e895 (2008).
- Brewer, G. J., Price, P. J. Viable cultured neurons in ambient carbon dioxide and hibernation storage for a month. Neuroreport. 7 (9), 1509-1512 (1996).
- Bahrami, F., Janahmadi, M. Antibiotic supplements affect electrophysiological properties and excitability of rat hippocampal pyramidal neurons in primary culture. Iranian Biomedical Journal. 17 (2), 101-106 (2013).
- Ricken, G., et al. Detection methods for autoantibodies in suspected autoimmune encephalitis. Frontiers in Neurology. 9, 841 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved