Method Article
海马神经元培养检测和研究自身免疫性脑炎中涉及的新型致病抗体
摘要
自身免疫性脑炎是一类新的抗体介导的中枢神经系统疾病。海马神经元可用于发现和表征这些抗体。本文提供了原代细胞培养和免疫染色的方案,以确定患者血清和脑脊液中的自身抗体。
摘要
在过去的15年中,一类新的抗体介导的中枢神经系统(CNS)疾病已被表征,现在被定义为"自身免疫性脑炎"(AE)。目前有17种已知的AE综合征,并且都与针对神经元细胞表面或突触蛋白的抗体有关。临床综合征很复杂,根据相关抗体的类型而有所不同。这些疾病中最著名的是抗N-甲基D-天冬氨酸受体(NMDAR)脑炎,这是一种与严重记忆和行为障碍相关的突出神经精神疾病。相关抗体在N末端结构域与NMDAR的GluN1亚基反应。最常用于发现和表征AE抗体的方法包括解离的、胎儿的、啮齿动物海马神经元的培养。在抗体表征过程中,培养中的活神经元暴露于患者的血清或脑脊液中,反应性的检测表明患者的血清或脑脊液样本含有针对神经元表面抗原的抗体。海马培养也可用于通过检查患者体内的抗体是否引起神经元的结构或功能改变来确定其是否具有潜在致病性。这些研究的成功程度取决于培养物的质量以及用于获取和检测患者样本反应性的方案。本文为胎鼠海马神经元的原代细胞培养提供了优化的方案,结合免疫染色来确定患者血清或脑脊液中是否存在抗体。还介绍了如何使用培养的神经元和钙成像检查NMDAR抗体的潜在致病作用的示例。
引言
自身免疫性脑炎(AE)是最近发现的一类中枢神经系统(CNS)疾病,由靶向神经元表面或突触蛋白1,2的抗体介导。临床特征因抗体而异,但通常包括记忆和认知受损、行为改变和精神症状、运动异常、睡眠功能障碍、意识水平下降和癫痫发作。这些疾病可影响所有年龄段的个体,某些类型的AE主要影响儿童和年轻人2。
在过去的15年中,已经描述了17种具有针对特定神经元表面/突触蛋白抗体的AE综合征(表1)。神经元靶标的一些例子包括突触兴奋受体NMDAR3,4和AMPAR5,突触抑制受体GABAbR6,神经元分泌蛋白LGI17和细胞粘附分子IgLON58。对于大多数这些AE,研究表明抗体破坏其靶抗原的结构或功能,强烈支持致病作用。例如,在抗NMDAR脑炎中,抗体与NMDAR的GluN1亚基的N末端结构域发生反应,产生这些受体的选择性和可逆内化,导致明显的神经精神改变4,9,10,11。因此,鉴定患者血清或脑脊液中17种已知抗体中的任何一种也可以用作确定特定AE诊断的诊断测试。
更常用于鉴定和表征这些抗体的技术之一包括使用解离的、胎儿的、啮齿动物海马神经元的培养物。这些培养物有用,原因如下:胚胎脑易于解离,含有低水平的神经胶质细胞,这是神经元培养物中污染的主要来源12;与中枢神经系统的大多数其他区域相比,海马体的细胞群相对均匀,金字塔细胞占绝大多数13,14;当锥体神经元的生成完成但颗粒细胞尚未发育时,从晚期胚胎制备培养物,进一步增加了培养物的同质性;培养后,锥体神经元表达其大部分主要表型特征,能够形成发育良好的树突,并建立可用于结构和电生理研究的突触连接网络12,13;由于抗体不能穿透活神经元,因此使用活培养物可以鉴定驻留在细胞表面的抗原靶标;来自神经元培养物的抗体-抗原复合物的免疫沉淀允许鉴定靶抗原5。
使用神经元培养物的研究的成功与否高度依赖于培养物的质量以及用于评估患者血清或脑脊液(CSF)免疫反应性的方案。可能影响培养物的变量包括培养物发育前分离海马体的程序、组织的解离、铺板密度、使用的生长表面以及培养基的组成13、15、16。本文为胎儿大鼠海马神经元的原代细胞培养提供了优化的方案,结合荧光免疫染色,可用于确定针对已知AE抗原和潜在新型表面靶标的抗体的存在。它还提供了一个示例,说明如何使用表达来自GCaMP家族GCaMP5G的遗传编码钙指示剂(GECI)的培养海马神经元的活细胞成像技术检查NMDAR抗体的致病作用。
| 靶蛋白 | 蛋白质功能 | 细胞隔室 | 主要综合征 |
| 国家核统计局 | 离子香奈儿 | 突触蛋白 | 抗NMDAR脑炎 |
| 安帕尔 | 离子香奈儿 | 突触蛋白 | 边缘脑炎 |
| 谷基K2 | 离子香奈儿 | 突触蛋白 | 脑炎 |
| 加巴阿 | 离子香奈儿 | 突触蛋白 | 脑炎 |
| GABAbR | 代谢受体 | 突触蛋白 | 边缘脑炎 |
| mGluR1 | 代谢受体 | 突触蛋白 | 脑炎 |
| mGluR2 | 代谢受体 | 突触蛋白 | 脑炎 |
| mGluR5 | 代谢受体 | 突触蛋白 | 脑炎 |
| D2R | 代谢受体 | 突触蛋白 | 基底神经节脑炎 |
| LGI1 | 粘附分子 | 细胞表面蛋白 | 边缘脑炎 |
| CASPR2 | 粘附分子 | 细胞表面蛋白 | 边缘脑炎 |
| IgLON5 | 粘附分子 | 细胞表面蛋白 | 抗 IgLON5 疾病 |
| 神经素-3α | 粘附分子 | 细胞表面蛋白 | 脑炎 |
| DNER (Tr) | 跨膜蛋白 | 细胞表面蛋白 | 脑炎 |
| SEZ6L | 跨膜蛋白 | 细胞表面蛋白 | 脑炎 |
| 两栖素 | 结构分子 | 细胞表面蛋白 | 边缘脑炎 |
| DPPX | 肽酶 | 细胞表面蛋白 | 脑炎 |
表1:针对神经元细胞表面和突触蛋白的抗体。
研究方案
所有程序均由巴塞罗那大学当地伦理委员会根据欧洲(2010/63 / UE)关于实验动物使用和护理的规定批准。从患者那里获得了书面知情同意,该研究得到了当地机构审查委员会的批准,用于使用人类样本(医院临床,HCB/2018/0192)。
注意:当前协议中有三个部分。第一个用于建立神经元培养物,第二个用于使用神经元的活培养物检测表面抗体,第三个用于确定这些抗体的致病性。
第1部分:分离的,胎儿的,啮齿动物海马神经元培养物的建立
1. 准备步骤
- 电镀表面的聚-L-赖氨酸涂层(解剖前3天)
- 通过将2.38g硼酸和1.27g硼砂加入500mL蒸馏水中并搅拌15分钟直至溶解来制备硼酸盐缓冲液。在罩下,通过过滤(0.2μm孔径)对缓冲溶液进行灭菌,标记并在室温(RT)下储存。
注意:此解决方案稳定,可使用6个月。
注意:制备硼酸盐缓冲液时,请穿戴推荐的个人防护设备。 - 通过将 1 g PLL 加入 10 mL 蒸馏水中并搅拌直至溶解来制备聚-L-赖氨酸 (PLL) 储备溶液 (100 mg/mL)。准备 500 μL 等分试样的 PLL 储备溶液。要达到 1 mg/mL 的最终浓度,请将 500 μL PLL 等分试样加入 50 mL 硼酸盐缓冲液中并旋转直至溶解,并通过过滤(0.2 μm 孔径)对溶液进行灭菌。
注意:此解决方案稳定,可使用6个月。 - 准备用于涂层的表面。使用直径为12毫米的盖玻片进行免疫染色程序,使用玻璃底培养皿进行包括活神经元成像在内的研究。如果使用盖玻片,请高压灭菌,然后在每个培养皿中放置五个盖玻片(直径3.5厘米)。
注意:盖玻片的厚度会影响所采集图像信号的质量和强度。大多数显微镜物镜设计用于#1.5盖玻片。根据成像设置和技术选择合适的盖玻片。 - 在引擎盖下,向每个培养皿中加入 1.5 mL PLL 溶液(玻璃底培养皿或带有五个盖玻片的 3.5 cm 培养皿)。确保所有盖玻片都浸没并在室温下储存24小时。
- 解剖前2天,吸出PLL溶液并用无菌无内毒素水洗涤,确保盖玻片浸没。将水保存在盘子中并在室温下储存24小时。
- 解剖前1天,吸出水并用NB + B27培养基(见下文)代替,并将培养皿置于37°C的培养箱中24小时。
- 通过将2.38g硼酸和1.27g硼砂加入500mL蒸馏水中并搅拌15分钟直至溶解来制备硼酸盐缓冲液。在罩下,通过过滤(0.2μm孔径)对缓冲溶液进行灭菌,标记并在室温(RT)下储存。
- 培养基和储备溶液的制备(解剖前1天)
- Dulbecco 的改良鹰培养基 (DMEM):加入 500 mL 不含 L-谷氨酰胺和酚红的 DMEM 高葡萄糖 (4.5 g/L),加入 50 mL 马血清、50 mL 胎牛血清 (FBS)、10 mL L-谷氨酰胺 (200 mM)、10 mL 丙酮酸钠 (100 mM)、10 mL 青霉素-链霉素 (10,000 U/mL)。过滤器(0.2 μm 孔径)并在 4 oC 下以 5 mL 等分试样储存,盖上密闭的盖子。
注意:此溶液稳定,可使用1个月。 - 补充有 B27 (NB + B27) 的神经基础 (NB) 培养基:加入 50 mL 不含酚红的 NB 培养基中,加入 1 mL B27 补充剂。
- 补充 B27 的冬眠-E 培养基(冬眠 + B27):在 50 mL 冬眠-E 培养基中加入 1 mL B27 补充剂。
- 细胞外生理溶液(EPS):向1L无菌水中添加以下指定的最终浓度:NaCl(140mM),KCl(3.5mM),HEPES(10mM),葡萄糖(20mM)和CaCl2 (2mM)。搅拌直至溶解,并通过加入NaOH(0.5 M)或HCl(0.5 M)将pH调节至7.4。在引擎盖下,通过过滤(0.2μm孔径)进行灭菌并储存在4 oC。
- Dulbecco 的改良鹰培养基 (DMEM):加入 500 mL 不含 L-谷氨酰胺和酚红的 DMEM 高葡萄糖 (4.5 g/L),加入 50 mL 马血清、50 mL 胎牛血清 (FBS)、10 mL L-谷氨酰胺 (200 mM)、10 mL 丙酮酸钠 (100 mM)、10 mL 青霉素-链霉素 (10,000 U/mL)。过滤器(0.2 μm 孔径)并在 4 oC 下以 5 mL 等分试样储存,盖上密闭的盖子。
- 设备和其他实验室材料(解剖日)
- 将水浴设置为37°C。 加热以下等分试样:50 mL HBSS 和 5 mL DMEM。
- 通过将以下工具浸入含有无水乙醇的烧杯中(图1B)来消毒:镊子,弯曲镊子,剪刀,细弯曲镊子,细直镊子,手术剪刀,细角镊子和精密弹簧剪刀。
注意:为保护工具,请在烧杯底部放置柔软材料(例如,科学精密湿巾)。 - 在两个托盘中装满冰块并放置以下物品。
- 冰盘1(图1C):将手术工具放入装有无水乙醇的烧杯中,将带有HBSS的烧杯用于冲洗手术工具,将带有HBSS的10厘米培养皿用于放置胚胎,将带有HBSS的6厘米培养皿放置胚胎的头部,以及带有Hibernate + B27的6厘米培养皿中放置胚胎的大脑。
- 冰盘 2:将 1 mL 等分试样的胰蛋白酶 2.5% 和 3.5 cm 培养皿中放入冬眠 + B27 用于解剖的海马体。
注意:此过程所需的时间取决于研究者的经验和要解剖的胚胎数量。因此,冰必须在所需的时间内保持冻结。为此,建议使用聚苯乙烯托盘。
2. 解剖和播种(图1)
- 海马隔离
注意:根据巴塞罗那大学当地伦理委员会,根据欧洲(2010/63 / UE)关于实验动物使用和护理的规定,在协议开始之前立即对E18胚胎的怀孕大鼠实施安乐死。在该协议中,二氧化碳(CO2)吸入被用作安乐死的方法。- 使用镊子和剪刀在腹膜水平解剖大鼠。用E18胚胎取出子宫,并将其放入在冰上冷却的10厘米培养皿中。
注意:重要的是要避免附着在胚胎上的大鼠毛发。建议使用大量的70%乙醇对腹部进行消毒。从此步骤开始,在冰盘 1 上的引擎盖内工作。 - 打开胚胎囊,用HBSS将胚胎转移到10厘米的培养皿中,确保胚胎完全浸入。
- 用剪刀取出胚胎头,并将其放入带有HBSS的6厘米培养皿中。对所有胚胎重复此过程。
注意:为避免污染,除胚胎头外的所有组织都应丢弃在带有螺旋盖的容器中。 - 用细弧镊子握住胚头,用一对细直镊子刺穿眼眶,以45°角进入,然后松开细弯的镊子。
注意:镊子不得穿过大脑,因此进入时保持角度很重要。 - 用手术剪刀解剖皮肤和颅骨,从枕骨到额骨。用一对细弯曲的镊子取出大脑,并将其放入6厘米的冬眠+ B27培养皿中。重复这个过程,直到所有的大脑都恢复了。
- 用细直镊子将端脑分开。
注意:从这一步开始,海马体的解剖在体视显微镜下进行。建议使用铰接灯,以便光线从侧面照亮解剖表面。还建议使用黑色背景,因为这提供了更多的对比度,可以更好地区分海马体。 - 准备一个 10 厘米的盘子,将 Hibernate + B27 滴在 1 厘米的距离(例如,在圆圈中)。每滴Hibernate + B27放置一个端脑,并通过解剖镜进行可视化(建议使用1.25倍物镜放大倍率)。
- 小心地剥去脑膜并去除丘脑,以更好地观察海马体。
- 用精密弹簧剪刀解剖海马体,并将其放入冰盘2中带有Hibernatate + B27的3.5厘米培养皿中。对每个端脑重复,直到收集到所有海马体。
- 用巴斯德移液管小心收集所有海马,并将它们转移到 50 mL 管中。
注意:收集海马体时,服用最小体积的Hibernate + B27,以免稀释胰蛋白酶。
- 使用镊子和剪刀在腹膜水平解剖大鼠。用E18胚胎取出子宫,并将其放入在冰上冷却的10厘米培养皿中。
- 细胞解离
- 海马体的酶解离
- 在含有海马体的 50 mL 管中,加入 1 mL 2.5% 胰蛋白酶,并用 HBSS 将其体积定为 5 mL。在37°C的水浴中孵育15分钟。
- 要稀释胰蛋白酶,加入10mL预热的HBSS,并在37°C的水浴中孵育5分钟。
- 将现在显示为粘液块的海马转移到带有1,000μL微量移液器的50mL管中,加入6mL预热的HBSS,并在37°C的水浴中孵育5分钟。
- 海马体的机械解离
- 将质量转移到锥形底部的 2 mL 管中,取最小体积。加入 1 mL 预热的 DMEM 培养基。用 1,000 μL 微量移液器轻轻上下吸出沉淀,使沉淀均质化。
注意:吸气时避免产生气泡至关重要,因为气泡可能会裂解细胞。 - 用预拉玻璃移液器(10x-20x)重复上下抽吸,其尖端与管的锥形底部接触。避免产生气泡。在此步骤结束时,混合物必须是半透明的。
- 一旦均匀混合使混合物呈半透明状态,将混合物转移到含有4mL DMEM培养基的管中,并在37°C下移液,并用玻璃移液管匀浆。
- 将质量转移到锥形底部的 2 mL 管中,取最小体积。加入 1 mL 预热的 DMEM 培养基。用 1,000 μL 微量移液器轻轻上下吸出沉淀,使沉淀均质化。
- 海马体的酶解离
- 细胞接种
- 计数细胞。溶液中的神经元数量可以根据标准实验室程序进行计数。
注意:在抗体检测和钙活性的成像实验中,每3.5厘米培养皿50,000个细胞的浓度是最佳的。 - 保持细胞悬浮,取出计算的体积,并将板装在含有PLL涂层盖玻片的3.5厘米培养皿中或PLL涂层玻璃底培养皿中。
- 通过以交叉运动(来回,然后左右;根据需要重复)轻轻摇动,将细胞均匀分布在培养皿上,并将培养皿放入CO2 (5%)培养箱中。
注意:重要的是使用交叉运动以避免细胞沉淀在培养皿的外围。 - 每周加入约1mL的NB + B27,使培养物不会干燥。
注意:2周后(体 外 14天[div]),神经元成熟并表达用于实验的所有因子。使用该协议获得的神经元总数约为2.5 x 106 个神经元,来自每只怀孕大鼠平均12个E18胚胎。
- 计数细胞。溶液中的神经元数量可以根据标准实验室程序进行计数。
第2部分:使用海马神经元培养物检测神经元细胞表面蛋白中的抗体
注意:协议的这一部分展示了如何使用海马培养物来鉴定抗NMDAR脑炎患者血清和/或脑脊液中的抗NMDAR抗体。荧光免疫染色用于可视化活神经元的反应性,但也可以使用其他可视化方法。该实验的适当对照是来自健康个体的血清或脑脊液。使用人体样本时,请记住可能需要机构伦理委员会的批准。
3. 活荧光免疫染色
- 使用在盖玻片上生长的 14 个 div 细胞(每 3.5 cm 培养皿包含 5 个盖玻片,每 3.5 个细胞 50,000 个细胞)。
- 在引擎盖内,用预热至37°C的NB冲洗盖玻片。
- 加入含有抗NMDAR抗体(用作一抗)的样品,该样品在NB培养基中以1:200稀释用于血清或1:2稀释用于CSF,并在37°C下孵育1小时(在CO2 (5%)培养箱内)。
- 在室温下用PBS 3x仔细冲洗。
- 加入固定溶液(PBS中的4%甲醛)并在室温下孵育5分钟。
注意:处理 4% 甲醛时,请在引擎盖内工作并穿戴推荐的个人防护设备。 - 用PBS洗涤3次,每次5分钟。
- 在1:1000稀释度下加入二抗山羊抗人AF488,并在室温下孵育1小时。
注意:在孵育过程中,用铝箔覆盖以防止光照。 - 用PBS洗涤3次,每次5分钟。用蒸馏水冲洗
- 用液体封片剂(例如,带有DAPI的防褪色封片剂;约7μL)安装盖玻片,吸出任何剩余的液体并用蒸馏水冲洗。神经元现在已准备好进行荧光成像。
注意:处理封片剂时,请穿戴推荐的个人防护设备。
第3部分:使用钙成像证明抗体致病作用
注意:协议的这一部分演示了如何确定患者的抗体是否对培养物具有功能影响,这表明致病性。为了增加效果的重要性,使用了来自八名患者的脑脊液池。使用GECI荧光钙指示剂(GCaMP5G)在化学刺激(NMDA +甘氨酸)下记录活培养物的钙活性。这些研究需要一个带有细胞室的倒置荧光显微镜,可以维持神经元所需的生理条件。
4. 钙成像
- 使用在盖玻片上生长的 14-18 个 div 细胞(每 3.5 cm 培养皿 50,000 个细胞,带有 5 个盖玻片)
- 成像前 1 周,将病毒载体 pAAV2-CAG-GCaMP5G 以 2.5 x10 10 GC/mL 加入细胞中并孵育 5-7 天。
注意:这种市售的预包装AAV血清型2载体在CAG启动子下过表达遗传编码的钙指示剂GCaMP5G。 - 成像前1天,加入患者样品(在本例中,在NB + B27中以1:25稀释的CSF池)并孵育24小时。使用前务必滤过人体样品(0.2 μm孔径),以避免污染。
注意:对于这些研究,健康受试者的对照脑脊液需要并行运行。 - 在成像当天,准备成像设置并将显微镜细胞室设置为37°C,用蒸馏水填充泳道,并注入5%CO2 以维持细胞生理条件。
- 在罩中,用预热至37°C的3mLEPS洗涤步骤3中的细胞
- 用 2.45 mL EPS 覆盖细胞并将其转移到显微镜细胞室中。添加NBQX(10μM)以阻断AMPA和KA受体,以专门可视化NMDA受体反应。
- 在配备汞灯和FITC滤光片立方体的倒置荧光显微镜中,获取2分钟的短片,每100毫秒记录一次帧(自发活动)。
注意:使用20x NA 0.75空气物镜,使用sCMOS相机每100 ms拍摄一次图像(512 x 512像素,16位灰度)。 - 获取第二个4分钟的短片,每100毫秒记录一次帧。开始采集后不久,将刺激溶液(NMDA [100 μM] + 甘氨酸 [1 μM])添加到培养皿中。
注意:将培养基添加到培养皿中会产生湍流,可能会破坏成像条件(焦点、荧光强度和/或非特异性背景信号)。不要向填充的 2.5 mL 培养皿中添加超过 50 μL 的溶液,以降低此类变化的可能性。 - 使用图像处理软件(此处使用ImageJ),从与患者一起孵育的培养物中提取随时间推移的荧光信号,并在刺激时获得荧光信号,并对照CSF样品。
注意:GCaMP探针与游离钙离子结合时,会发生构象变化,导致它们变得更亮。因此,荧光强度的增加与神经元去极化引起的钙内流相关。 - 确定要分析的感兴趣区域 (ROI)。手动分割神经元的体细胞并将ROI添加到ROI管理器(ROI管理器>添加>分析>工具)。从ROI管理器菜单中保存ROI(更多>保存)。
- 设置测量值(分析>设置测量值)并选择 平均灰度值。通过单击 更多>多重测量从细胞体中提取平均荧光强度分布,然后将生成的表保存为.xls电子表格。
- 进行统计分析以比较组之间的荧光(患者的脑脊液与对照组的脑脊液)。
结果
分离、胎儿、啮齿动物海马神经元培养物的建立
这里提出的协议是基于Banker和Goslin15对神经细胞培养进行的有影响力的研究。该方案已经过改进,以获得具有最佳形态、密度和纯度的神经元培养物,用于进行神经元表面抗体检测研究。解剖和接种方案分为三部分(图1A)。第一部分,海马分离,包括手术提取活组织(图1A,左图)。如图所示,具有E18胚胎的怀孕Wistar大鼠是成功培养的关键起始材料。一旦从E18胚胎中提取大脑,在体视显微镜下进行显微手术。通过适当的工具(图1B)和精确处理,可以将海马体与神经组织的其余部分分离。组织在特定培养基中的处置如图1C所示。协议的第二部分包括海马细胞解离。它细分为两个步骤(图1A,中图):海马体的酶解离和机械解离,导致完整的解离单细胞。使用这种方法,可以获得没有细胞聚集体的细胞培养物,如图2A-D所示。协议的第三部分包括细胞接种(图1A,右图)。协议的这一部分对于调整平板中神经元培养物的密度和均匀性至关重要。计数细胞并在3.5cm培养皿的区域中接种50,000个神经元可提供最佳密度,不仅可以进行实验以确定神经元细胞表面蛋白抗体的存在(图3),还可以通过钙成像分析这些抗体的致病性(图4)。
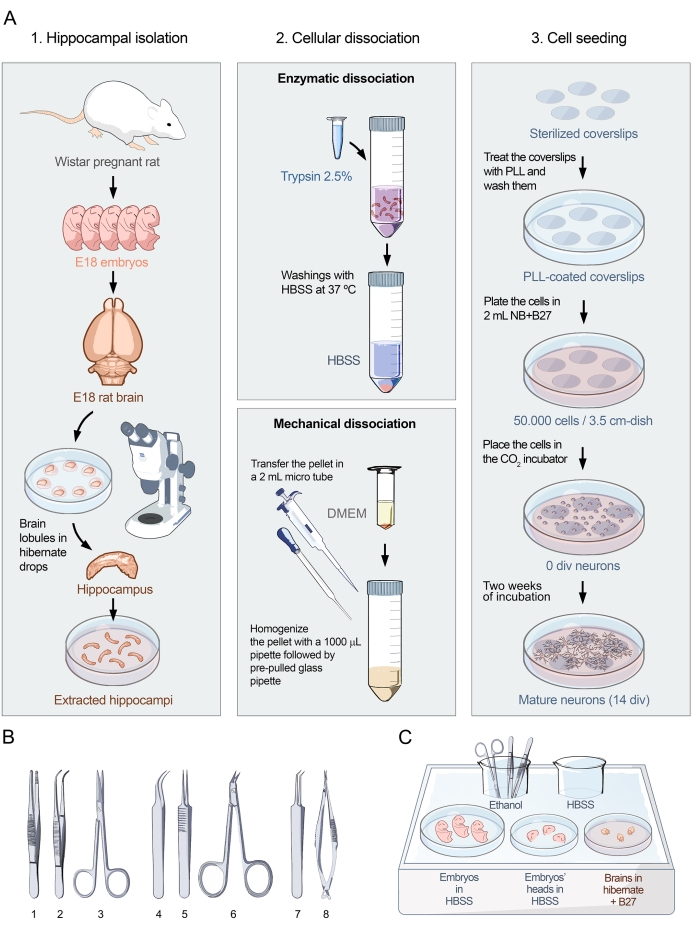
图 1:海马神经元原代培养物的视觉实验方案。 (A)流程图显示了在E18处制备胚胎大鼠海马神经元解离细胞培养物的方案的三个部分。协议分为1。海马隔离,2。细胞解离,和 3.细胞接种。(B)选择推荐的海马分离工具分为三类:(1-镊子,2-弯曲镊子,3-剪刀)用于胚胎收集,(4-细弯曲镊子,5-细直钳,6-手术剪刀)用于脑提取,(7-细角镊子,8-精密弹簧剪刀)用于海马隔离。(C)冰盘1的示意图,其中包含海马体分离所需的板和培养基。胚胎和头部放置在HBSS中,而大脑放置在冬眠培养基+ B27中。请点击此处查看此图的大图。
18 div 的海马神经元培养物成熟、相互连接并表达结构和功能蛋白
在神经元培养物的生长和成熟中,可以理解两个分化的阶段:神经元的极化阶段(图2A,B)和突触网络的树突发育和构建阶段(图2C,D)。1 div上的细胞均匀分布并粘附在板上,在细胞体周围形成薄片,小神经突开始延伸(图2A)。培养几天后,神经突会延伸一小段距离。细胞显示出显着的极化,但几乎没有净生长(图2B)。在这个阶段之后,突触发生是突出的,神经元开始相互连接。神经元网络不断增长并变得更加复杂(图2C)。在 18 div 时,神经元成熟且相互连接;构建神经元网络(图2D)。一旦突触棘形成并连接,神经元就会完全极化并表达所有功能和结构蛋白。在成熟培养神经元表达的许多蛋白质中,神经元受体NMDA(图2E)和突触蛋白PSD95(图2F)被选为代表性标记。此外,可以通过标记神经丝(NF)(图2G)和通过靶向MAP2蛋白(图2H)来可视化树突来选择性地可视化轴突。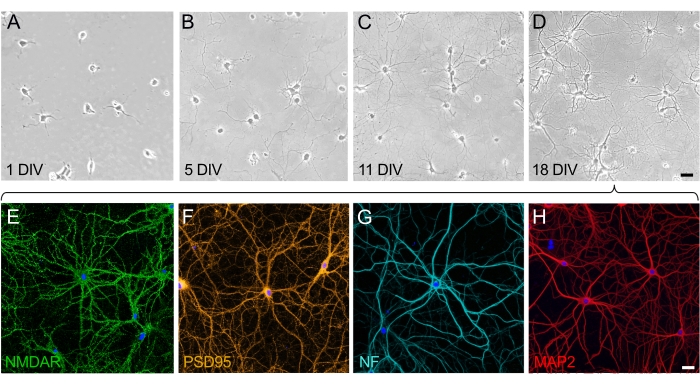
图2:海马神经元解离细胞培养物成熟的时间过程。 (A-D)培养前18天内海马神经元的相差图像。(A) 附着在 PLL 涂层基板上时 1 格的神经元。(B)在5 div处的神经元中出现小神经突。 (C)11 div处的神经元已经发展出长神经突,这些神经突伸长并获得轴突特征。(D)18 div的神经元已经成熟并形成了神经网络。比例尺 (A-D) = 40 μm. (E-H) 通过共聚焦激光扫描显微镜拍摄的代表性荧光图像,使用选择性标记显示 18 div 处的成熟神经元。固定神经元培养物并用选择性染色(E)神经元受体(NMDAR),(F)突触标志物(PSD95),(G)轴突标志物(神经丝,NF)和(H)树突状标志物(MAP2)的抗体进行免疫染色。比例尺 (E-H) = 20 μm。 请点击此处查看此图的大图。
患者样本中的抗体与神经元细胞表面抗原发生反应
从抗NMDAR脑炎患者获得的样本(血清和CSF)含有识别神经元表面存在的NMDAR的自身抗体。将培养物与患者样品一起孵育,在细胞表面和树突上产生强烈的荧光信号(图3A,C)。相反,对照样品在施用于神经元培养物时不产生荧光信号(图3 B,D)。这些发现显示了如何使用培养物筛选患者样本中的抗体,并可以鉴定出靶向神经元细胞表面的新型抗体。
来自患者的脑脊液样本降低了NMDA诱导的海马神经元培养物中的细胞内钙浓度
为了评估患者抗体对神经活动的影响(治疗24小时后),在NMDA介导的刺激下,从培养的神经元实时光学监测细胞内钙瞬变。NMDA的应用产生荧光强度的增加,如细胞内绿色荧光的变化所示(图4A和补充视频1)。与用患者脑脊液样本处理的细胞相比,当应用刺激器处理的神经元时,用对照CSF样本处理的神经元显示出更高的荧光强度差异(56%)。测量荧光强度的差异,并比较从细胞体中提取的数据中NMDA介导的刺激曲线(图4B,C)。刺激曲线显示,在两种情况下都有细胞内钙流入,但用患者脑脊液(灰线)治疗的培养物的反应低于对照处理的培养物(黑线)。这些结果表明,由于抗体与NMDAR的相互作用,患者脑脊液中存在的抗体降低了细胞活性,从而引起致病作用。
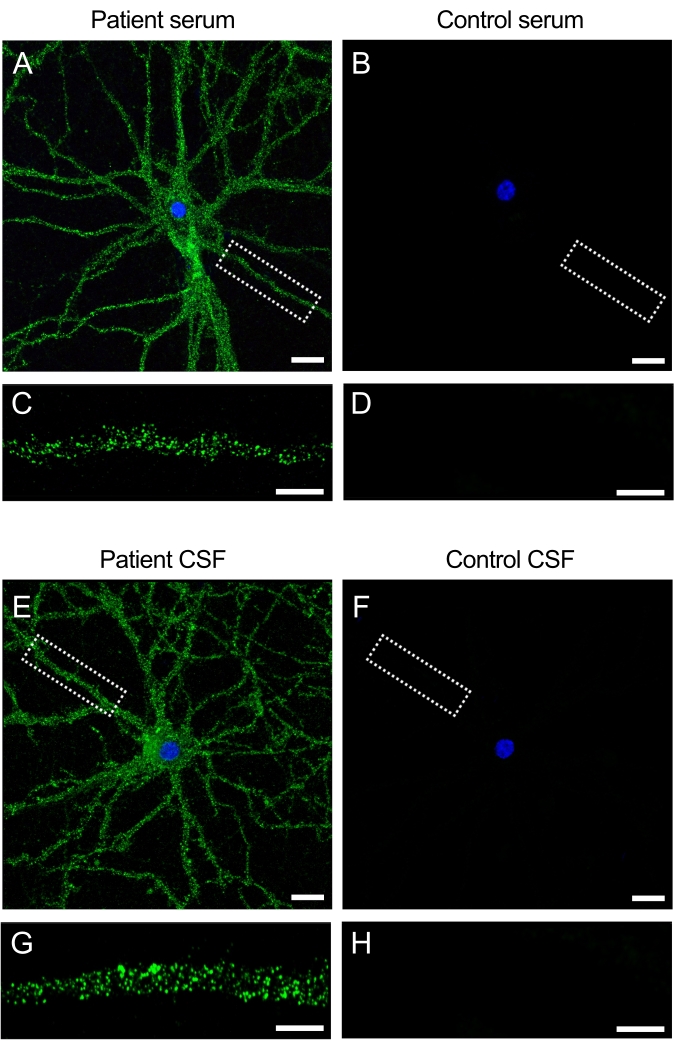
图 3:患者抗体与神经元培养物表面 反应。 (A,E)抗NMDAR脑炎患者的血清和脑脊液与活大鼠海马神经元的细胞表面发生反应,(B,F),而来自对照受试者的血清和脑脊液没有反应性。比例尺 (A,B,E,F) = 20 μm。树突(63x)的更高放大倍率图像,显示患者血清和脑脊液(C,G)反应性的典型表面模式,对照组(D,H)阴性。图像通过共聚焦激光扫描显微镜拍摄。比例尺 = 10 μm。 请点击此处查看此图的大图。
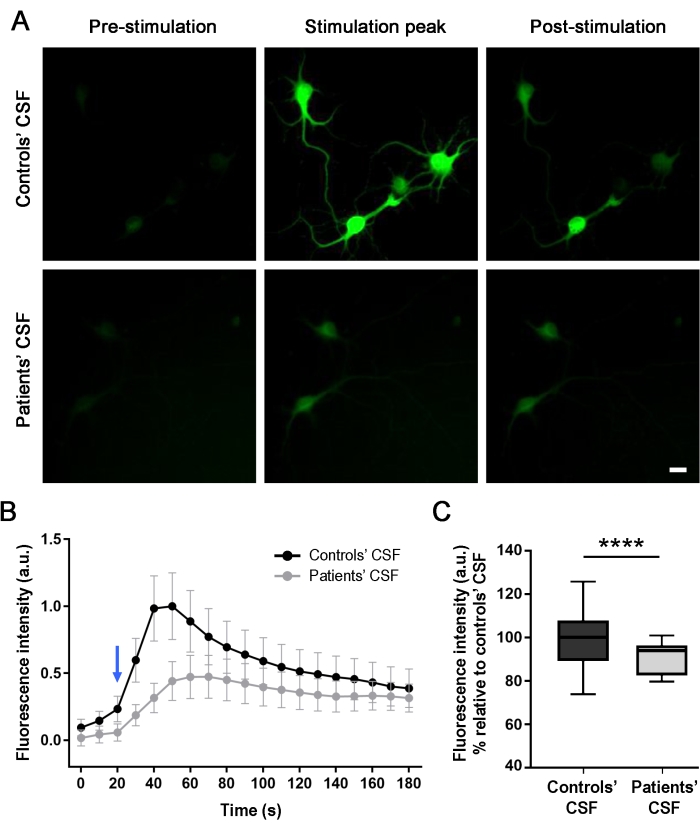
图 4:患者抗体减少表达 GCaMP5G 的大鼠神经元中的钙内流。 (A)在神经元培养物中施用刺激溶液(NMDA [100μM] + 甘氨酸[1μM])触发钙内流入,如增加细胞内绿色荧光(刺激峰)所示,与刺激前拍摄的图像相比(刺激前)。120秒后,荧光强度降低并稳定(刺激后)。用患者脑脊液治疗的培养物显示,与对照组的脑脊液相比,NMDA介导的钙增加显着减少(56%)。图像通过荧光显微镜拍摄。比例尺 = 20 μm。(B)三个独立实验之一的图,表示在NMDA刺激(蓝色箭头)下用对照组的CSF(黑线)和患者的CSF(灰线)处理的培养物随时间(180秒)的荧光强度。n(对照组的脑脊液)= 20个细胞;n(患者的脑脊液)= 28个细胞。数据表示为平均± SEM。 (C) 箱形图显示中位数、第 25 个和第 75 个百分位数。晶须表示最小值和最大值。通过双向方差分析(方差分析;p < 0.0001)和曼-惠特尼U检验(p < 0.0001)进行显著性评估。p < 0.05 的值被认为具有统计学意义。请点击此处查看此图的大图。
补充视频 1: 视频显示两个并排表达GCaMP5G的海马神经元:用对照组的脑脊液治疗的神经元(左)与用患者的脑脊液治疗的神经元(右)。NMDAR(刺激)的应用在这两种情况下都会增加细胞内荧光强度,但用对照组的脑脊液治疗的神经元中的水平明显高于用患者脑脊液治疗的神经元。图像通过荧光显微镜拍摄,并用ImageJ应用查找表(LUT)火进行编辑。1700帧(170秒);加速5倍。比例尺 = 10 μm。 请点击这里下载此文件。
讨论
抗体介导的自身免疫领域的不断发展为鉴定可用于改善患者诊断和治疗的神经元自身抗体打开了一扇机会之窗。海马神经元培养是抗体鉴定的重要工具;因此,执行标准化方案以获得可靠且可重复的结果非常重要。此处讨论了要考虑的最重要步骤、限制和故障排除。
该协议的关键步骤可以分为三类,具体取决于它们是否影响海马神经元的纯度,同质性或活力。
纯度 - 为了获得最佳的原代细胞培养物,研究者必须有信心、训练有素且能够快速工作,特别是要尽量减少解剖时间。即使锥体神经元是主要的细胞类型,海马体也包含多种中间神经元14。为了产生具有最少神经胶质细胞的培养物,必须用最少的周围组织提取海马体。在解剖过程中使用黑色背景有助于在体视显微镜下识别海马体的极限。此外,应该考虑到较低的细胞密度导致旁分泌支持较少,并且使维持培养物更加困难13。因此,重要的是要牢记这种平衡。这在使用少量细胞(每3.5厘米培养皿50,000个神经元)的成像研究中很重要。为了能够有额外的时间进行海马提取,应使用保留组织的冬眠培养基17。使用适当的手术工具也是必不可少的。高精度工具非常精细,因此应通过仔细保护它们来确保技术的可重复性。
均一性 - 为了开发无细胞聚集体的培养物,通过将预拉式玻璃移液器与标准 1,000 μL 移液器结合使用,对机械细胞解离进行了升级。
活力 - 在该协议中,没有添加抗生素,因为它们影响神经元兴奋性并改变培养神经元的电生理特性18。因此,如果不保持最高的无菌标准,很可能受到污染。温度也是一个关键因素。在海马分离期间保持组织冷会减慢新陈代谢并减少细胞降解。因此,将组织保持在冰上,直到细胞解离过程。此外,在酶促细胞解离过程中找到正确的平衡至关重要,该解离使细胞解聚而没有明显的细胞裂解。在该协议中,与胰蛋白酶孵育的时间和随后的洗涤步骤已经过优化,以获得具有足够空间的单个细胞,以允许创建适当的神经元网络。
在神经元培养物的荧光活免疫染色和钙活性记录中也发现了关键步骤。为了进行成功的活免疫染色以确定患者样品中是否存在细胞表面蛋白抗体,必须避免细胞透化,从而使抗体进入细胞内蛋白。此外,根据抗体的滴度,孵育时间和样品稀释度必须相应地调整(例如,非常高滴度的抗体会产生背景染色,这使得解释结果变得困难)。当通过钙成像对自身抗体进行致病性评估时,需要使用最适合细胞活性测量的培养基(例如,培养基中的Mg2+ 抑制对于良好的性能很重要)。此外,对于荧光成像,应避免使用pH指示剂(如酚红)的培养基,因为它会引入非特异性背景信号。
使用海马神经元培养物有两个主要限制。首先,与稳定的细胞系相比,原代培养物必须连续生成,这意味着定期使用实验动物。诱导多能干细胞(iPSC)系可以取代使用动物模型的需求,但iPSC的分化方案仍然不是最佳的。其次,来自iPSC的神经元不表达表面蛋白的完整光谱,因此,如果使用,没有反应性并不一定意味着样品的阴性19。
有三种方法可以筛查疑似AE患者的血清或脑脊液中是否存在自身抗体:使用大鼠脑组织的基于组织的测定(TBA),使用转染的HEK细胞表达神经元蛋白的基于细胞的测定(CBA),以及此处使用海马神经元的活培养物报告的应用19。培养的海马神经元方法的重要性在于它能够区分与TBA不易区分的表面和细胞内抗原的反应性。此外,与HEK转染细胞中的CBA不同,原代神经元培养不受转染蛋白库的限制。此外,培养的海马神经元与免疫沉淀和质谱相结合时可用于鉴定新型抗体及其靶抗原,因此拓宽了可识别抗体的谱。最后,它允许通过可以监测细胞活性改变的实时成像方法评估自身抗体的致病作用。总之,新的自身抗体的鉴定最终能够启动特异性免疫疗法以改善患者的预后。
披露声明
作者没有利益冲突。
致谢
我们感谢Merche Rivas,Maria Marsal,Gustavo Castro,Jordi Cortés,Alina Hirschmann和Angel Sandoval(ICFO-Institut de Ciències Fotòniques)和Mercedes Alba,Marija Radosevic,David Soto,Xavier Gasull,Mar Guasp和Lidia Sabater(IDIBAPS,医院,巴塞罗那大学临床医院)的技术支持和试剂,以及Josep Dalmau和Myrna R. Rosenfeld(IDIBAPS, 巴塞罗那大学临床医院)对手稿的批判性审查和指导。这项研究由卡洛斯三世健康研究所(ISCIII)资助,由欧盟、FIS(PI20/00280,JP)、CELLEX基金会(PL-A.)共同资助;Ministerio de Economía y Competitividad - Severo Ochoa R&D Centre for Excellence Centre (CEX2019-000910-S, P.L-A.);CERCA计划和欧洲激光实验室(871124,P.L-A.);科学和创新部(MCIN/AEI/ 10.13039/501100011033,P.L-A.);和Fondo Social Europeo(PRE2020-095721,M.C.)。
材料
| Name | Company | Catalog Number | Comments |
| 10 cm Cell culture dish | Nunc | 12-565-020 | |
| 12 mm round coverslips | Fisher | NC9708845 | |
| 20x NA 0.75 S Fluor air objective | Nikon | CFI Super Fluor 20X | |
| 3.5 cm Cell culture dish | Nunc | 12-565-90 | |
| 6 cm Cell culture dish | Nunc | 12-565-94 | |
| B27 supplement | Gibco | 17504-044 | |
| Beaker 100 mL | Pirex | - | |
| Borax | Sigma-Aldrich | B9876 | |
| Boric Acid | Sigma-Aldrich | B0252 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved forceps | FST | 11009-13 | |
| D-Glucose | Sigma-Aldrich | D9434 | |
| DMEM High Glucose (4.5 g/L), without L-Glutamine, without Phenol Red | Capricorn | DMEM-HXRXA | |
| Female Wistar rat (18-days pregnant) | Janvier | - | |
| Fetal Bovine Serum (FBS) | Biowest | S181B-500 | |
| Fine-angled forceps | FST | 11251-35 | |
| Fine-curved forceps | FST | 11272-30 | |
| Fine-straight forceps | FST | 11251-23 | |
| FITC filter cube | Nikon | Standard Series | |
| Forceps | FST | 11000-12 | |
| Goat anti-Human AF488 | Invitrogen | A11013 | |
| HBSS | Capricorn | HBSS-1A | |
| HEPES | Sigma-Aldrich | H3375 | |
| Hibernate-E medium | Gibco | A12476-01 | |
| Horse Serum (HS) | Thermofisher | 26050088 | |
| Human anti-NMDAR antibody (CSF) | Patient Sample | - | |
| Human anti-NMDAR antibody (Serum) | Patient Sample | - | |
| ImageJ/Fiji | NIH | v1.50i | |
| Inverted fluorescence microscope | Nikon | Eclipse TE2000-U | |
| KCl | Sigma-Aldrich | 44675 | |
| L-Glutamine | Biowest | X0550-100 | |
| Mercury lamp | Nikon | C-HGFI | |
| Microscope cell chamber | Custom-build | - | |
| NaCl | Sigma-Aldrich | S9887 | |
| NBQX | Tocris | 373 | |
| Neurobasal without phenol red | Gibco | 12348-017 | |
| NMDA | Sigma-Aldrich | M3262 | |
| pAAV2-CAG-GCaMP5G | VectorBiolabs | - | |
| Paraformaldehyde 4% | Thermo scientific | J199943-K2 | |
| Penicillin-Streptomycin | Biowest | L0022-100 | |
| Phosphate-Buffered Saline | Gibco | 10010023 | |
| Poly-L-Lysine (PLL) | Peptide international | OKK-35056 | |
| Polystyrene ice tray | - | - | re-used cap of a polysterene box |
| Precision spring-scissors | FST | 15000-08 | |
| ProLong Gold with DAPI (antifading mounting media) | Molecular Probes | P36941 | |
| Scissors | FST | 14068-12 | |
| Sodium pyruvate | Biowest | L0642-100 | |
| Stereo microscope | Zeiss | Stemi 2000 | |
| Surgery scissors | FST | 14081-09 | |
| Trypsin 2.5% | Gibco | 15090046 | |
| Water, sterile endotoxine free | Sigma-Aldrich | W3500 |
参考文献
- Dalmau, J., Geis, C., Graus, F. Autoantibodies to synaptic receptors and neuronal cell surface proteins in autoimmune diseases of the central nervous system. Physiological Reviews. 97 (2), 839-887 (2017).
- Dalmau, J., Graus, F. Antibody-mediated encephalitis. The New England Journal of Medicine. 378 (9), 840-851 (2018).
- Dalmau, J., et al. Paraneoplastic anti- N -methyl-D-aspartate receptor encephalitis associated with ovarian teratoma. Annals of Neurology. 61 (1), 25-36 (2007).
- Dalmau, J., et al. Anti-NMDA-receptor encephalitis: case series and analysis of the effects of antibodies. Lancet Neurology. 7 (12), 1091-1098 (2008).
- Lai, M., et al. AMPA receptor antibodies in limbic encephalitis alter synaptic receptor location. Annals of Neurology. 65, 424-434 (2009).
- Lancaster, E., et al. Antibodies to the GABAB receptor in limbic encephalitis with seizures: case series and characterisation of the antigen. Lancet Neurology. 9 (1), 67-76 (2010).
- Lai, M., et al. Investigation of LGI1 as the antigen in limbic encephalitis previously attributed to potassium channels: a case series. Lancet Neurology. 9 (8), 776-785 (2010).
- Sabater, L., et al. A novel NREM and REM parasomnia with sleep breathing disorder associated with antibodies against IgLON5: a case series, pathological features, and characterization of the antigen. Lancet Neurology. 13 (6), 575-586 (2014).
- Hughes, E. G., et al. Cellular and synaptic mechanisms of anti-NMDA receptor encephalitis. The Journal of Neuroscience. 30 (17), 5866-5875 (2010).
- Moscato, E. H., et al. Acute mechanisms underlying antibody effects in anti-N-methyl-D-aspartate receptor encephalitis. Annals of Neurology. 76 (1), 108-119 (2014).
- Planagumà, J., et al. Human N-methyl D-aspartate receptor antibodies alter memory and behaviour in mice. Brain. 138 (1), 94-109 (2015).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Research. 126 (3), 397-425 (1977).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocols. 1 (5), 2406-2415 (2006).
- Benson, D. L., Watkins, F. H., Steward, O., Banker, G. Characterization of GABAergic neurons in hippocampal cell cultures. Journal of Neurocytology. 23 (5), 279-295 (1994).
- Banker, G., Goslin, K. . Culturing Nerve Cells. , (1998).
- Nunez, J. Primary culture of hippocampal neurons from P0 newborn rats. Journal of Visualized Experiments. (19), e895 (2008).
- Brewer, G. J., Price, P. J. Viable cultured neurons in ambient carbon dioxide and hibernation storage for a month. Neuroreport. 7 (9), 1509-1512 (1996).
- Bahrami, F., Janahmadi, M. Antibiotic supplements affect electrophysiological properties and excitability of rat hippocampal pyramidal neurons in primary culture. Iranian Biomedical Journal. 17 (2), 101-106 (2013).
- Ricken, G., et al. Detection methods for autoantibodies in suspected autoimmune encephalitis. Frontiers in Neurology. 9, 841 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。