Method Article
Hippocampus-neuronale Kulturen zum Nachweis und zur Untersuchung neuer pathogener Antikörper, die an der Autoimmunenzephalitis beteiligt sind
In diesem Artikel
Zusammenfassung
Autoimmunenzephalitis ist eine neue Kategorie von Antikörper-vermittelten Erkrankungen des zentralen Nervensystems. Hippocampus-Neuronen können verwendet werden, um diese Antikörper zu entdecken und zu charakterisieren. Dieser Artikel enthält ein Protokoll für die primäre Zellkultur und Immunfärbung zur Bestimmung von Autoantikörpern im Serum und in der Zerebrospinalflüssigkeit von Patienten.
Zusammenfassung
In den letzten 15 Jahren wurde eine neue Kategorie von Antikörper-vermittelten Erkrankungen des zentralen Nervensystems (ZNS) charakterisiert und wird nun als "Autoimmunenzephalitis" (AE) definiert. Derzeit sind 17 AE-Syndrome bekannt, die alle mit Antikörpern gegen die neuronale Zelloberfläche oder synaptische Proteine assoziiert sind. Die klinischen Syndrome sind komplex und variieren je nach Art des assoziierten Antikörpers. Die bekannteste dieser Erkrankungen ist die Anti-N-Methyl-D-Aspartat-Rezeptor (NMDAR) -Enzephalitis, eine prominente neuropsychiatrische Erkrankung, die mit schweren Gedächtnis- und Verhaltensstörungen einhergeht. Die assoziierten Antikörper reagieren mit der GluN1-Untereinheit des NMDAR an der N-terminalen Domäne. Der am häufigsten verwendete Ansatz für die Entdeckung und Charakterisierung von AE-Antikörpern umfasst die Kultur dissoziierter, fötaler, Nagetier-Hippocampus-Neuronen. Während des Prozesses der Antikörpercharakterisierung werden lebende Neuronen in Kultur dem Serum oder Liquor des Patienten ausgesetzt, und der Nachweis der Reaktivität zeigt an, dass die Serum- oder Liquorproben des Patienten Antikörper gegen neuronale Oberflächenantigene enthalten. Hippocampus-Kulturen können auch verwendet werden, um festzustellen, ob die Antikörper bei Patienten potenziell pathogen sind, indem untersucht wird, ob sie strukturelle oder funktionelle Veränderungen der Neuronen verursachen. Der Erfolg dieser Studien hängt von der Qualität der Kulturen und von den Protokollen ab, die zur Gewinnung und Detektion der Reaktivität von Patientenproben verwendet werden. Dieser Artikel bietet ein optimiertes Protokoll für die primäre Zellkultur von fetalen Ratten-Hippocampus-Neuronen in Kombination mit Immunfärbung, um das Vorhandensein von Antikörpern im Serum oder Liquor von Patienten zu bestimmen. Ein Beispiel dafür, wie die potenziellen pathogenen Wirkungen von NMDAR-Antikörpern mit kultivierten Neuronen und Kalziumbildgebung untersucht werden können, wird ebenfalls vorgestellt.
Einleitung
Autoimmunenzephalitis (AE) ist eine kürzlich entdeckte Kategorie von Erkrankungen des zentralen Nervensystems (ZNS), die durch Antikörper vermittelt werden, die auf neuronale Oberflächen- oder synaptische Proteine abzielen 1,2. Die klinischen Merkmale variieren je nach Antikörper, umfassen jedoch häufig Gedächtnis- und Kognitionsstörungen, verändertes Verhalten und psychiatrische Symptome, abnormale Bewegungen, Schlafstörungen, Bewusstseinsstörungen und Krampfanfälle. Diese Störungen können Personen jeden Alters betreffen, wobei einige Arten von AE hauptsächlich Kinder und junge Erwachsene betreffen2.
In den letzten 15 Jahren wurden 17 AE-Syndrome mit Antikörpern gegen spezifische neuronale Oberflächen-/synaptische Proteine beschrieben (Tabelle 1). Einige Beispiele für die neuronalen Ziele sind die synaptischen exzitatorischen Rezeptoren NMDAR3,4 und AMPAR5, der synaptische inhibitorische Rezeptor GABAbR6, das neuronal sezernierte Protein LGI17 und das Zelladhäsionsmolekül IgLON58. Für die meisten dieser AE haben Studien gezeigt, dass die Antikörper die Struktur oder Funktion ihres Zielantigens stören und eine pathogene Rolle stark unterstützen. Zum Beispiel reagieren die Antikörper bei der Anti-NMDAR-Enzephalitis mit der N-terminalen Domäne der GluN1-Untereinheit des NMDAR, wodurch eine selektive und reversible Internalisierung dieser Rezeptoren erzeugt wird, die zu prominenten neuropsychiatrischen Veränderungen führt 4,9,10,11. So kann die Identifizierung eines der 17 bekannten Antikörper im Serum oder Liquor eines Patienten auch als diagnostischer Test verwendet werden, der die Diagnose eines spezifischen AE stellt.
Eine der am häufigsten verwendeten Techniken zur Identifizierung und Charakterisierung dieser Antikörper umfasst die Verwendung von Kulturen von dissoziierten, fötalen, Nagetier-Hippocampus-Neuronen. Diese Kulturen sind aus mehreren Gründen nützlich: Das embryonale Gehirn ist leicht zu dissoziieren und enthält einen geringen Anteil an Gliazellen, die Hauptkontaminationsquelle in neuronalen Kulturen12; die Zellpopulation des Hippocampus ist im Vergleich zu den meisten anderen Regionen des ZNS relativ homogen, wobei Pyramidenzellen die überwiegende Mehrheit ausmachen13,14; Kulturen werden aus Embryonen im Spätstadium hergestellt, wenn die Erzeugung pyramidaler Neuronen abgeschlossen ist, sich aber noch keine Körnerzellen entwickelt haben, was die Homogenität der Kultur weiter erhöht. Wenn sie kultiviert werden, exprimieren pyramidale Neuronen die meisten ihrer wichtigsten phänotypischen Merkmale, sind in der Lage, gut entwickelte Dendriten zu bilden und synaptisch verbundene Netzwerke zu etablieren, die für strukturelle und elektrophysiologische Untersuchungen verwendet werden können12,13; Da Antikörper nicht in lebende Neuronen eindringen können, ermöglicht die Verwendung lebender Kulturen die Identifizierung antigener Ziele, die sich auf der Zelloberfläche befinden. und die Immunpräzipitation des Antikörper-Antigen-Komplexes aus neuronalen Kulturen ermöglicht die Identifizierung des Zielantigens5.
Der Erfolg von Studien mit neuronalen Kulturen hängt stark von der Qualität der Kulturen und den Protokollen ab, die zur Beurteilung der Immunreaktivität des Serums oder der Zerebrospinalflüssigkeit (CSF) eines Patienten verwendet werden. Zu den Variablen, die die Kulturen beeinflussen können, gehören die Verfahren zur Isolierung des Hippocampus vor der Kulturentwicklung, die Dissoziation des Gewebes, die Beschichtungsdichte, die verwendete Wachstumsoberfläche und die Zusammensetzung der Medien13,15,16. Dieser Artikel bietet ein optimiertes Protokoll für die primäre Zellkultur von fetalen Ratten-Hippocampus-Neuronen in Kombination mit fluoreszierender Immunfärbung, mit der das Vorhandensein von Antikörpern gegen bekannte AE-Antigene und potenziell neuartige Oberflächenziele bestimmt werden kann. Es bietet auch ein Beispiel dafür, wie die pathogenen Wirkungen von NMDAR-Antikörpern durch bildgebende Verfahren mit lebenden Zellen unter Verwendung kultivierter Hippocampus-Neuronen untersucht werden können, die einen genetisch kodierten Kalziumindikator (GECI) aus der GCaMP-Familie, GCaMP5G, exprimieren.
| Zielprotein | Proteinfunktion | Zellkompartiment | Hauptsyndrom |
| NMDAR | Ion Chanel | Synaptisches Protein | Anti-NMDAR-Enzephalitis |
| AMPAR | Ion Chanel | Synaptisches Protein | Limbische Enzephalitis |
| GluK2 | Ion Chanel | Synaptisches Protein | Enzephalitis |
| GABAaR | Ion Chanel | Synaptisches Protein | Enzephalitis |
| GABAbR | Metabotroper Rezeptor | Synaptisches Protein | Limbische Enzephalitis |
| mGluR1 | Metabotroper Rezeptor | Synaptisches Protein | Enzephalitis |
| mGluR2 | Metabotroper Rezeptor | Synaptisches Protein | Enzephalitis |
| mGluR5 | Metabotroper Rezeptor | Synaptisches Protein | Enzephalitis |
| D2R | Metabotroper Rezeptor | Synaptisches Protein | Enzephalitis der Basalganglien |
| LGI1 | Adhäsionsmolekül | Zelloberflächenprotein | Limbische Enzephalitis |
| CASPR2 | Adhäsionsmolekül | Zelloberflächenprotein | Limbische Enzephalitis |
| IgLON5 | Adhäsionsmolekül | Zelloberflächenprotein | Anti-IgLON5-Krankheit |
| Neurexin-3α | Adhäsionsmolekül | Zelloberflächenprotein | Enzephalitis |
| DNER (Tr) | Transmembranprotein | Zelloberflächenprotein | Enzephalitis |
| SEZ6L | Transmembranprotein | Zelloberflächenprotein | Enzephalitis |
| Amphiphysin | Strukturmolekül | Zelloberflächenprotein | Limbische Enzephalitis |
| DPPX | Peptidase | Zelloberflächenprotein | Enzephalitis |
Tabelle 1: Antikörper gegen die neuronale Zelloberfläche und synaptische Proteine.
Protokoll
Alle Verfahren wurden von der lokalen Ethikkommission der Universität Barcelona gemäß den europäischen Vorschriften (2010/63/EU) über die Verwendung und Pflege von Versuchstieren genehmigt. Die Studie wurde vom lokalen institutionellen Prüfungsausschuss für die Verwendung menschlicher Proben genehmigt (Hospital Clínic, HCB/2018/0192).
HINWEIS: Das aktuelle Protokoll besteht aus drei Teilen. Die erste dient der Etablierung der neuronalen Kulturen, die zweite dient dem Nachweis von Oberflächenantikörpern mit lebenden Neuronenkulturen und die dritte dient der Bestimmung der Pathogenität dieser Antikörper.
TEIL 1: Etablierung dissoziierter, fötaler, Nagetier-Hippocampus-neuronaler Kulturen
1. Vorbereitende Schritte
- Poly-L-Lysin-Beschichtung der Beschichtungsflächen (3 Tage vor der Dissektion)
- Bereiten Sie den Boratpuffer vor, indem Sie 2,38 g Borsäure und 1,27 g Borax zu 500 ml destilliertem Wasser geben und 15 Minuten lang rühren, bis es aufgelöst ist. Unter einer Haube die Pufferlösung sterilisieren, indem Sie filtrieren (0,2 μm Porengröße), etikettieren und bei Raumtemperatur (RT) lagern.
HINWEIS: Diese Lösung ist stabil und kann 6 Monate lang verwendet werden.
ACHTUNG: Tragen Sie bei der Herstellung von Boratpuffer die empfohlene persönliche Schutzausrüstung. - Die Poly-L-Lysin (PLL)-Stammlösung (100 mg/ml) wird hergestellt, indem 1 g PLL zu 10 ml destilliertem Wasser gegeben und gerührt wird, bis sie aufgelöst ist. Bereiten Sie 500 μL Aliquots PLL-Stammlösung vor. Um eine Endkonzentration von 1 mg/ml zu erreichen, werden 500 μL PLL-Aliquot zu 50 ml Boratpuffer gegeben und bis zur Auflösung geschwenkt und die Lösung durch Filtern sterilisiert (0,2 μm Porengröße).
HINWEIS: Diese Lösung ist stabil und kann 6 Monate lang verwendet werden. - Bereiten Sie die Oberflächen für die Beschichtung vor. Verwenden Sie Deckgläser mit einem Durchmesser von 12 mm für Immunfärbungsverfahren und Glasbodenschalen für Studien, die die Bildgebung lebender Neuronen umfassen. Wenn Sie Deckgläser verwenden, autoklavieren und legen Sie dann fünf Deckgläser in jede Schale (3,5 cm Durchmesser).
HINWEIS: Die Dicke des Deckglases beeinflusst die Qualität und Intensität des Signals der aufgenommenen Bilder. Die meisten Mikroskopobjektive sind für #1.5 Deckgläser ausgelegt. Wählen Sie die geeigneten Deckgläser entsprechend dem Bildaufbau und den Techniken aus. - Fügen Sie unter einer Haube 1,5 ml PLL-Lösung zu jedem Gericht hinzu (Glasbodenschale oder 3,5 cm Schale mit fünf Deckgläsern). Stellen Sie sicher, dass alle Deckgläser untergetaucht und 24 Stunden bei RT gelagert werden.
- 2 Tage vor der Dissektion die PLL-Lösung absaugen und mit sterilem endotoxinfreiem Wasser waschen, wobei die Deckgläser untergetaucht sind. Wasser im Geschirr aufbewahren und bei RT für 24 h lagern.
- 1 Tag vor der Dissektion saugen Sie das Wasser ab und ersetzen Sie es durch NB + B27-Nährmedien (siehe unten) und stellen Sie das Geschirr für 24 h bei 37 ° C in einen Inkubator.
- Bereiten Sie den Boratpuffer vor, indem Sie 2,38 g Borsäure und 1,27 g Borax zu 500 ml destilliertem Wasser geben und 15 Minuten lang rühren, bis es aufgelöst ist. Unter einer Haube die Pufferlösung sterilisieren, indem Sie filtrieren (0,2 μm Porengröße), etikettieren und bei Raumtemperatur (RT) lagern.
- Vorbereitung von Nährmedien und Stammlösung (1 Tag vor der Dissektion)
- Dulbecco's Modified Eagle Medium (DMEM): Zu 500 ml DMEM High Glucose (4,5 g/L) ohne L-Glutamin und Phenolrot 50 ml Pferdeserum, 50 ml fetales Rinderserum (FBS), 10 ml L-Glutamin (200 mM), 10 ml Natriumpyruvat (100 mM), 10 ml Penicillin-Streptomycin (10.000 U / ml). Filter (0,2 μm Porengröße) und lagern Sie in 5 ml Aliquots bei 4 oC mit einer fest verschlossenen Kappe.
HINWEIS: Diese Lösung ist stabil und kann 1 Monat lang verwendet werden. - Neurobasales (NB) Medium ergänzt mit B27 (NB + B27): Zu 50 ml NB-Medium ohne Phenolrot 1 ml B27-Ergänzung hinzufügen.
- Hibernate-E-Medium ergänzt mit B27 (Hibernate + B27): Zu 50 ml Hibernate-E-Medium fügen Sie 1 ml B27-Ergänzung hinzu.
- Extrazelluläre physiologische Lösung (EPS): Zu 1 l sterilem Wasser wird Folgendes in den angegebenen Endkonzentrationen hinzugefügt: NaCl (140 mM), KCl (3,5 mM), HEPES (10 mM), Glucose (20 mM) und CaCl 2 (2 mM). Rühren Sie, bis es aufgelöst ist, und stellen Sie den pH-Wert auf 7,4 ein, indem Sie NaOH (0,5 M) oder HCl (0,5 M) hinzufügen. Unter der Haube durch Filtern sterilisieren (0,2 μm Porengröße) und bei 4 oC lagern.
- Dulbecco's Modified Eagle Medium (DMEM): Zu 500 ml DMEM High Glucose (4,5 g/L) ohne L-Glutamin und Phenolrot 50 ml Pferdeserum, 50 ml fetales Rinderserum (FBS), 10 ml L-Glutamin (200 mM), 10 ml Natriumpyruvat (100 mM), 10 ml Penicillin-Streptomycin (10.000 U / ml). Filter (0,2 μm Porengröße) und lagern Sie in 5 ml Aliquots bei 4 oC mit einer fest verschlossenen Kappe.
- Geräte und andere Labormaterialien (Tag der Sektion)
- Stellen Sie ein Wasserbad auf 37 °C. Erhitzen Sie die folgenden Aliquots: 50 ml HBSS und 5 ml DMEM.
- Sterilisieren Sie die folgenden Werkzeuge, indem Sie sie in ein Becherglas mit absolutem Ethanol tauchen (Abbildung 1B): Pinzette, gebogene Pinzette, Schere, fein gekrümmte Pinzette, feingerade Pinzette, chirurgische Schere, feinwinklige Pinzette und Präzisionsfederschere.
HINWEIS: Um die Werkzeuge zu schützen, legen Sie ein weiches Material (z. B. wissenschaftliche Präzisionstücher) auf den Boden des Becherglases. - Füllen Sie zwei Tabletts mit Eis und legen Sie die folgenden Gegenstände ab.
- Eisschale 1 (Abbildung 1C): Legen Sie chirurgische Instrumente in das Becherglas mit absolutem Ethanol, ein Becherglas mit HBSS zum Spülen der chirurgischen Instrumente, eine 10-cm-Schale mit HBSS zum Platzieren der Embryonen, eine 6-cm-Schale mit HBSS zum Platzieren der Köpfe der Embryonen und eine 6-cm-Schale mit Hibernate + B27 zum Platzieren der Gehirne der Embryonen.
- Eisschale 2: Legen Sie eine 1 ml aliquote Trypsin 2,5% und eine 3,5 cm lange Schale mit Hibernate + B27 für den präparierten Hippocampus.
HINWEIS: Die für dieses Verfahren benötigte Zeit hängt von der Erfahrung des Prüfers und der Anzahl der zu sezierenden Embryonen ab. Daher muss das Eis für die benötigte Zeit gefroren bleiben. Hierfür werden Polystyrolschalen empfohlen.
2. Sektion und Aussaat (Abbildung 1)
- Hippocampus-Isolation
HINWEIS: Trächtige Ratten mit Embryonen bei E18 werden unmittelbar vor Beginn des Protokolls in Übereinstimmung mit der lokalen Ethikkommission der Universität Barcelona gemäß den europäischen (2010/63/EU) Vorschriften über die Verwendung und Pflege von Versuchstieren eingeschläfert. In diesem Protokoll wurde die Inhalation von Kohlendioxid (CO2) als Methode der Euthanasie verwendet.- Sezieren Sie die Ratte auf Höhe des Bauchperitoneums mit einer Pinzette und einer Schere. Extrahieren Sie die Gebärmutter mit den E18-Embryonen und legen Sie sie in eine 10 cm lange Schale, die auf Eis gekühlt wurde.
HINWEIS: Es ist wichtig, die Rattenhaare zu vermeiden, die an den Embryonen haften. Es wird empfohlen, reichlich 70% Ethanol zu verwenden, um den Bauch zu sterilisieren. Arbeiten Sie ab diesem Schritt im Inneren der Haube an der Eisschale 1. - Öffnen Sie die embryonalen Säcke und übertragen Sie die Embryonen in die 10-cm-Schale mit HBSS, um sicherzustellen, dass die Embryonen vollständig eingetaucht sind.
- Entfernen Sie den Embryokopf mit einer Schere und legen Sie ihn in die 6 cm lange Schale mit HBSS. Wiederholen Sie diesen Vorgang mit allen Embryonen.
HINWEIS: Um eine Kontamination zu vermeiden, sollte das gesamte Gewebe mit Ausnahme der Embryoköpfe in einem Behälter mit Schraubverschluss entsorgt werden. - Halten Sie den Embryokopf mit einer fein gekrümmten Pinzette und durchstechen Sie die Augenhöhlen mit einer feingeraden Pinzette, die in einem Winkel von 45 ° eintreten, und lassen Sie dann die fein gekrümmte Pinzette los.
HINWEIS: Die Pinzette darf nicht durch das Gehirn gehen, daher ist es wichtig, den Winkel beim Betreten beizubehalten. - Sezieren Sie die Haut und den Schädel mit der OP-Schere, beginnend vom Hinterhauptsknochen bis zum Stirnbein. Entfernen Sie das Gehirn mit einer fein gebogenen Pinzette und legen Sie es in die 6 cm lange Schale mit Hibernate + B27. Wiederholen Sie diesen Vorgang, bis alle Gehirne wiederhergestellt sind.
- Trennen Sie die Telencephalons sagittal mit der fein-geraden Pinzette.
HINWEIS: Ab diesem Schritt wird die Dissektion des Hippocampus unter einem Stereomikroskop durchgeführt. Es wird empfohlen, Gelenklampen zu verwenden, damit das Licht die Präparierfläche von den Seiten beleuchtet. Es wird auch empfohlen, einen schwarzen Hintergrund zu verwenden, da dies mehr Kontrast bietet und den Hippocampus besser unterscheiden kann. - Bereiten Sie eine 10-cm-Schale vor, indem Sie Hibernate + B27-Tropfen in 1 cm Abstand (z. B. im Kreis) platzieren. Geben Sie ein Telencephalon pro Tropfen Hibernate + B27 und visualisieren Sie durch das Sezierfernrohr (1,25-fache Objektivvergrößerung wird empfohlen).
- Schälen Sie vorsichtig die Hirnhäute und entfernen Sie den Thalamus, um den Hippocampus besser zu visualisieren.
- Sezieren Sie den Hippocampus mit der Präzisionsfederschere und legen Sie ihn in die 3,5 cm Schale mit Hibernate + B27 in Eisschale 2. Wiederholen Sie dies für jedes Telencephalon, bis alle Hippocampi gesammelt sind.
- Sammeln Sie alle Hippocampi vorsichtig mit einer Pasteur-Pipette und geben Sie sie in ein 50-ml-Röhrchen.
HINWEIS: Nehmen Sie das Mindestvolumen von Hibernat + B27 beim Sammeln der Hippocampi, um das Trypsin nicht zu verdünnen.
- Sezieren Sie die Ratte auf Höhe des Bauchperitoneums mit einer Pinzette und einer Schere. Extrahieren Sie die Gebärmutter mit den E18-Embryonen und legen Sie sie in eine 10 cm lange Schale, die auf Eis gekühlt wurde.
- Zelldissoziation
- Enzymatische Dissoziation des Hippocampus
- In das 50-ml-Röhrchen, das die Hippocampi enthält, fügen Sie 1 ml 2,5% Trypsin hinzu und bringen Sie es mit HBSS auf ein Volumen von 5 ml. 15 min im Wasserbad bei 37 °C inkubieren.
- Um das Trypsin zu verdünnen, fügen Sie 10 ml vorgewärmtes HBSS hinzu und inkubieren Sie für 5 min im Wasserbad bei 37 °C.
- Die nun als Schleimmasse erscheinenden Hippocampi werden mit einer 1.000 μL Mikropipette in ein 50-ml-Röhrchen überführt, 6 mL vorgewärmtes HBSS hinzugefügt und 5 min im Wasserbad bei 37 °C inkubiert.
- Mechanische Dissoziation des Hippocampus
- Übertragen Sie die Masse in ein 2 ml Rohr mit konischem Boden und nehmen Sie das minimale Volumen. Fügen Sie 1 ml vorgewärmtes DMEM-Medium hinzu. Homogenisieren Sie das Pellet mit einer 1.000 μL Mikropipette durch sanftes Ansaugen auf und ab.
HINWEIS: Es ist wichtig, beim Absaugen keine Blasen zu erzeugen, da Blasen die Zellen lysieren können. - Wiederholen Sie die Auf- und Abaspiration mit einer vorgezogenen Glaspipette (10x-20x), wobei die Spitze mit dem konischen Boden des Röhrchens in Kontakt kommt. Vermeiden Sie es, Blasen zu erzeugen. Am Ende dieses Schritts muss die Mischung durchscheinend sein.
- Sobald die Mischung homogen gemischt wurde, so dass die Mischung durchscheinend ist, wird die Mischung in ein Röhrchen mit 4 ml DMEM-Medien bei 37 °C überführt und mit einer Glaspipette durch Pipettieren auf und ab homogenisiert.
- Übertragen Sie die Masse in ein 2 ml Rohr mit konischem Boden und nehmen Sie das minimale Volumen. Fügen Sie 1 ml vorgewärmtes DMEM-Medium hinzu. Homogenisieren Sie das Pellet mit einer 1.000 μL Mikropipette durch sanftes Ansaugen auf und ab.
- Enzymatische Dissoziation des Hippocampus
- Zellaussaat
- Zählen Sie die Zellen. Die Anzahl der Neuronen in der Lösung kann nach Standardlaborverfahren gezählt werden.
HINWEIS: In bildgebenden Experimenten zum Antikörpernachweis und zur Kalziumaktivität ist eine Konzentration von 50.000 Zellen pro 3,5 cm Schale optimal. - Die Zellen in der Schwebe halten, das berechnete Volumen entnehmen und in 3,5 cm Schalen, die PLL-beschichtete Deckgläser enthalten, oder in die PLL-beschichteten Glasbodenschalen geben.
- Verteilen Sie die Zellen gleichmäßig auf dem Geschirr durch sanftes Schütteln in gekreuzten Bewegungen (hin und her, dann Seite an Seite; wiederholen Sie nach Bedarf) und legen Sie die Schalen in denCO2 (5%) Inkubator.
HINWEIS: Es ist wichtig, gekreuzte Bewegungen zu verwenden, um zu vermeiden, dass sich die Zellen in der Peripherie der Schale absetzen. - Fügen Sie jede Woche etwa 1 ml NB + B27 hinzu, damit die Kultur nicht trocknet.
HINWEIS: Nach 2 Wochen (14 Tage in vitro [div]) sind die Neuronen reif und exprimieren alle Faktoren, die für Experimente verwendet werden sollen. Die durchschnittliche Gesamtzahl der Neuronen, die mit diesem Protokoll erhalten werden, beträgt ungefähr 2,5 x 106 Neuronen, die von durchschnittlich 12 E18-Embryonen pro trächtiger Ratte stammen.
- Zählen Sie die Zellen. Die Anzahl der Neuronen in der Lösung kann nach Standardlaborverfahren gezählt werden.
TEIL 2: Verwendung neuronaler Hippocampus-Kulturen zum Antikörpernachweis in neuronalen Zelloberflächenproteinen
HINWEIS: Dieser Teil des Protokolls zeigt, wie Hippocampus-Kulturen verwendet werden, um Anti-NMDAR-Antikörper im Serum und/oder Liquor von Patienten mit Anti-NMDAR-Enzephalitis zu identifizieren. Fluoreszierende Immunfärbung wird verwendet, um die Reaktivität in den lebenden Neuronen zu visualisieren, aber auch andere Visualisierungsmethoden könnten verwendet werden. Eine geeignete Kontrolle für dieses Experiment wäre Serum oder Liquor von einer gesunden Person. Beachten Sie bei der Verwendung menschlicher Proben, dass eine Genehmigung durch die institutionelle Ethikkommission erforderlich sein kann.
3. Lebende fluoreszierende Immunfärbung
- Verwenden Sie 14 div-Zellen, die auf Deckgläsern gezüchtet wurden (50.000 Zellen pro 3,5 cm Schale mit fünf Deckgläsern).
- Im Inneren der Haube die Deckgläser mit auf 37 °C vorgeheiztem NB abspülen.
- Fügen Sie die Probe hinzu, die in diesem Fall Anti-NMDAR-Antikörper (als primärer Antikörper verwendet) enthält, die in NB-Medien bei 1:200 für Serum oder 1:2 für Liquor verdünnt wurden, und inkubieren Sie 1 h bei 37 °C (im CO2 (5%) Inkubator).
- Spülen Sie vorsichtig mit PBS 3x bei RT ab.
- Fixierlösung (4% Formaldehyd in PBS) zugeben und bei RT 5 min inkubieren.
ACHTUNG: Arbeiten Sie beim Umgang mit 4% Formaldehyd in der Kapuze und tragen Sie die empfohlene persönliche Schutzausrüstung. - 3x mit PBS jeweils 5 min waschen.
- Fügen Sie den sekundären Antikörper Goat Anti-Human AF488 in einer Verdünnung von 1:1000 hinzu und inkubieren Sie ihn bei RT für 1 h.
HINWEIS: Während der Inkubation vor Lichteinwirkung schützen, indem Sie es mit Aluminiumfolie abdecken. - 3x mit PBS jeweils 5 min waschen. Mit destilliertem Wasser abspülen
- Montieren Sie die Deckgläser mit einem flüssigen Montagemedium (z. B. Antifading-Montagemedien mit DAPI; ca. 7 μL), saugen Sie die restliche Flüssigkeit ab und spülen Sie sie mit destilliertem Wasser ab. Die Neuronen sind nun bereit für die Fluoreszenzbildgebung.
ACHTUNG: Tragen Sie beim Umgang mit Montagemedium die empfohlene persönliche Schutzausrüstung.
TEIL 3: Nachweis antikörperpathogener Wirkungen mittels Calcium-Bildgebung
HINWEIS: Dieser Teil des Protokolls zeigt, wie festgestellt werden kann, ob die Antikörper bei Patienten eine funktionelle Wirkung auf die Kulturen haben, was auf eine Pathogenität hindeutet. Um die Signifikanz der Effekte zu erhöhen, wurde ein Pool von Liquor von acht Patienten verwendet. Die Calciumaktivität der lebenden Kulturen wurde nach chemischer Stimulation (NMDA + Glycin) mit dem GECI-Fluoreszenz-Kalziumindikator (GCaMP5G) aufgezeichnet. Diese Studien erfordern ein inverses Fluoreszenzmikroskop mit einer Zellkammer, die die erforderlichen physiologischen Bedingungen der Neuronen aufrechterhalten kann.
4. Kalzium-Bildgebung
- Verwenden Sie 14-18 div-Zellen, die auf Deckgläsern gezüchtet wurden (50.000 Zellen pro 3,5 cm Schale mit fünf Deckgläsern)
- 1 Woche vor der Bildgebung den viralen Vektor pAAV2-CAG-GCaMP5G bei 2,5 x 1010 GC/ml in die Zellen geben und 5-7 Tage inkubieren.
HINWEIS: Dieser kommerziell erhältliche, vorverpackte AAV-Serotyp-2-Vektor überexprimiert den genetisch kodierten Kalziumindikator GCaMP5G unter einem CAG-Promotor. - 1 Tag vor der Bildgebung fügen Sie die Patientenprobe hinzu (in diesem Beispiel ein Pool von Liquor verdünnt 1:25 in NB + B27) und inkubieren für 24 h. Filtrieren Sie menschliche Proben (0,2 μm Porengröße) vor der Verwendung immer, um eine Kontamination zu vermeiden.
HINWEIS: Für diese Studien muss die Kontrolle des Liquors von gesunden Probanden parallel durchgeführt werden. - Bereiten Sie am Tag der Bildgebung den Bildgebungsaufbau vor und stellen Sie die Mikroskopzellkammer auf 37 ° C ein, füllen Sie die Bahn mit destilliertem Wasser und infundieren Sie mit 5% CO2 , um die physiologischen Bedingungen der Zelle aufrechtzuerhalten.
- Waschen Sie die Zellen aus Schritt 3 in der Haube mit 3 ml auf 37 °C vorgewärmtem EPS
- Decken Sie die Zellen mit 2,45 ml EPS ab und überführen Sie sie in die Mikroskopzellkammer. Fügen Sie NBQX (10 μM) hinzu, um die AMPA- und KA-Rezeptoren zu blockieren, um ausschließlich die NMDA-Rezeptorantwort zu visualisieren.
- Im inversen Fluoreszenzmikroskop, das mit einer Quecksilberlampe und einem FITC-Filterwürfel ausgestattet ist, nehmen Sie einen 2-minütigen Film mit Bildern auf, die alle 100 ms aufgenommen werden (spontane Aktivität).
HINWEIS: Es wurde ein 20x NA 0,75 Luftobjektiv verwendet, und Bilder (512 x 512 Pixel, 16-Bit-Graustufen) wurden alle 100 ms mit einer sCMOS-Kamera aufgenommen. - Erfassen Sie den zweiten Film von 4 Minuten mit Bildern, die alle 100 ms aufgenommen wurden. Kurz nach Beginn der Aufnahme Stimulationslösung (NMDA [100 μM] + Glycin [1 μM]) in die Schale geben.
HINWEIS: Das Hinzufügen von Medien in die Schüssel erzeugt Turbulenzen, die die Bildgebungsbedingungen stören können (Fokus, Fluoreszenzintensität und/oder unspezifisches Hintergrundsignal). Geben Sie nicht mehr als 50 μL Lösung in die gefüllte 2,5-ml-Schale, um die Wahrscheinlichkeit solcher Veränderungen zu verringern. - Mit Hilfe von Bildverarbeitungssoftware (hier wurde ImageJ verwendet) extrahieren Sie das Fluoreszenzsignal im Laufe der Zeit, das bei der Stimulation erhalten wird, aus den mit dem Patienten inkubierten Kulturen und Kontroll-Liquorproben.
HINWEIS: Die GCaMP-Sonden durchlaufen bei der Bindung an freie Kalziumionen eine Konformationsänderung, wodurch sie heller werden. Daher korreliert die Zunahme der Fluoreszenzintensität mit einem Kalziumeinstrom aufgrund neuronaler Depolarisation. - Bestimmen Sie die zu analysierenden Regionen von Interesse (ROI). Segmentieren Sie die Somas von Neuronen manuell und fügen Sie die ROIs zum ROI-Manager hinzu (Analyze > Tools > ROI Manager > Add). Speichern Sie den ROI über das ROI-Manager-Menü (Mehr > Speichern).
- Legen Sie die Messwerte fest (Analysieren > Messen festlegen) und wählen Sie den mittleren Grauwert aus. Extrahieren Sie das mittlere Fluoreszenzintensitätsprofil aus den Zellsomas, indem Sie auf Mehr > Multi Measure klicken, und speichern Sie dann die generierte Tabelle als .xls Tabelle.
- Führen Sie statistische Analysen durch, um die Fluoreszenz zwischen den Gruppen zu vergleichen (Liquor der Patienten vs. Liquor der Kontrolle).
Ergebnisse
Etablierung dissoziierter, fötaler, Nagetier-Hippocampus-neuronaler Kulturen
Das hier vorgestellte Protokoll basiert auf den einflussreichen Studien zur Nervenzellkultivierung, die von Banker und Goslindurchgeführt wurden 15. Das Protokoll wurde verfeinert, um neuronale Kulturen mit optimaler Morphologie, Dichte und Reinheit für die Durchführung neuronaler Oberflächenantikörpernachweisstudien zu erhalten. Das Protokoll der Zerlegung und Aussaat ist in drei Teile unterteilt (Abbildung 1A). Der erste Teil, die Hippocampus-Isolierung, besteht aus der chirurgischen Extraktion des lebenden Gewebes (Abbildung 1A, linkes Bild). Wie die Abbildung zeigt, sind trächtige Wistar-Ratten mit E18-Embryonen das wichtigste Ausgangsmaterial für eine erfolgreiche Kultur. Sobald das Gehirn aus den E18-Embryonen extrahiert ist, wird die Mikrochirurgie unter einem Stereomikroskop durchgeführt. Mit geeigneten Werkzeugen (Abbildung 1B) und präziser Handhabung ist es möglich, den Hippocampus vom restlichen Nervengewebe zu trennen. Die Disposition von Geweben in den spezifischen Medien ist in Abbildung 1C dargestellt. Der zweite Teil des Protokolls besteht aus der Dissoziation der Hippocampus-Zellen. Es ist in zwei Schritte unterteilt (Abbildung 1A, mittleres Bild): enzymatische Dissoziation und mechanische Dissoziation des Hippocampus, die zu intakten, dissoziierten Einzelzellen führen. Mit dieser Methode ist es möglich, Zellkulturen ohne Zellaggregate zu erhalten, wie in Abbildung 2A-D dargestellt. Der dritte Teil des Protokolls besteht aus der Zellaussaat (Abbildung 1A, rechtes Bild). Dieser Teil des Protokolls ist entscheidend, um die Dichte und Homogenität der neuronalen Kultur in der Platte anzupassen. Die Zählung der Zellen und die Aussaat von 50.000 Neuronen auf einer Fläche einer 3,5 cm großen Schale bietet eine optimale Dichte, um nicht nur Experimente zur Bestimmung des Vorhandenseins von Antikörpern gegen neuronale Zelloberflächenproteine durchzuführen (Abbildung 3), sondern auch die Pathogenität dieser Antikörper mit Kalziumbildgebung zu analysieren (Abbildung 4).
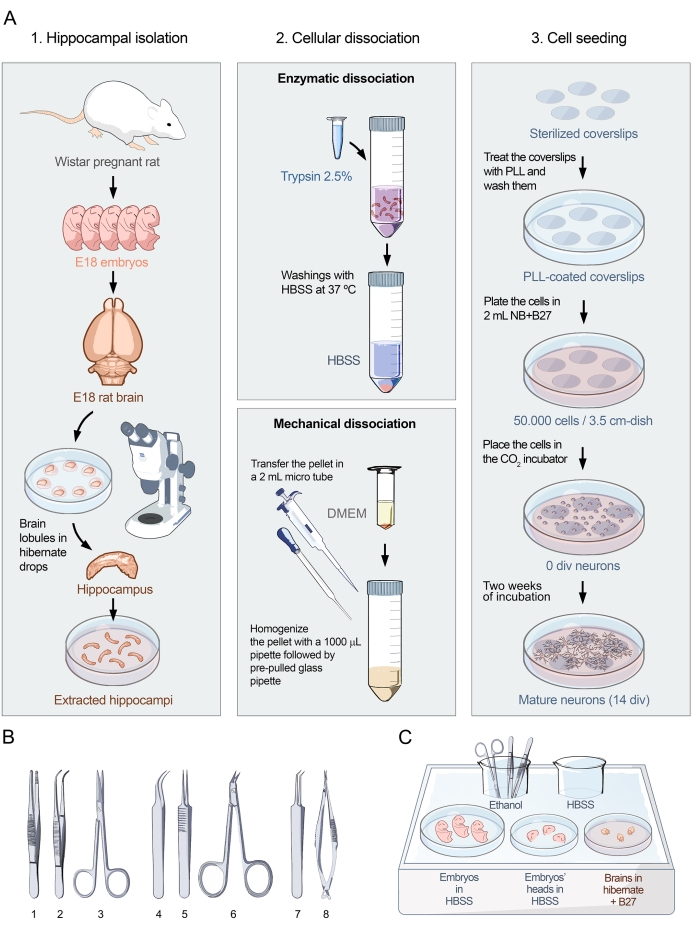
Abbildung 1: Visuelles Protokoll für primäre Kulturen von Hippocampus-Neuronen. (A) Flussdiagramm, das die drei Teile des Protokolls zur Herstellung dissoziierter Zellkulturen von Hippocampus-Neuronen aus embryonalen Ratten bei E18 zeigt. Das Protokoll ist unterteilt in 1. Hippocampus-Isolation, 2. Zelldissoziation und 3. Zellaussaat. (B) Auswahl empfohlener Werkzeuge zur Hippocampus-Isolierung, gruppiert in drei Kategorien: (1- Pinzette, 2- Gebogene Pinzette, 3- Schere) für die Embryonenentnahme, (4- Fein gekrümmte Pinzette, 5- Feingerade Pinzette, 6- Operationsschere) für die Gehirnextraktion und (7- Feinwinkelzange, 8- Präzisionsfederschere) für die Isolierung im Hippocampus. (C) Schematische Darstellung des Eisbehälters 1 mit Platten und Medien, die für die Isolierung des Hippocampus benötigt werden. Embryonen und Köpfe werden in HBSS gelegt, während Gehirne in Hibernate Medium + B27 platziert werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Kulturen von Hippocampus-Neuronen bei 18 div sind reif, miteinander verbunden und exprimieren strukturelle und funktionelle Proteine
Beim Wachstum und der Reifung neuronaler Kulturen lassen sich zwei differenzierte Phasen erkennen: die Polarisationsphase des Neurons (Abbildung 2A,B) und die Phase der dendritischen Entwicklung und Konstruktion des synaptischen Netzwerks (Abbildung 2C,D). Zellen auf 1 div sind gleichmäßig verteilt und haben an der Platte haftet, wodurch eine Lamelle um den Zellkörper herum entwickelt wird, wobei sich kleinere Neuriten auszudehnen beginnen (Abbildung 2A). Nach einigen Tagen in Kultur erstrecken sich die Neuriten eine kurze Strecke. Die Zellen zeigen eine signifikante Polarisation, aber es gibt wenig Nettowachstum (Abbildung 2B). Nach diesem Stadium ist die Synaptogenese prominent und die Neuronen beginnen sich miteinander zu verbinden. Das neuronale Netzwerk wächst weiter und wird komplexer (Abbildung 2C). Bei 18 div sind Neuronen reif und miteinander verbunden; das neuronale Netzwerk wird aufgebaut (Abbildung 2D). Sobald die synaptischen Dornen gebildet und verbunden sind, sind Neuronen vollständig polarisiert und exprimieren alle funktionellen und strukturellen Proteine. Von den vielen Proteinen, die von reifen kultivierten Neuronen exprimiert werden, wurden hier der neuronale Rezeptor NMDA (Abbildung 2E) und das synaptische Protein PSD95 (Abbildung 2F) als repräsentative Marker ausgewählt. Darüber hinaus ist es möglich, Axone selektiv zu visualisieren, indem Neurofilamente (NF) markiert werden (Abbildung 2G) und Dendriten durch das Targeting des MAP2-Proteins visualisiert werden (Abbildung 2H).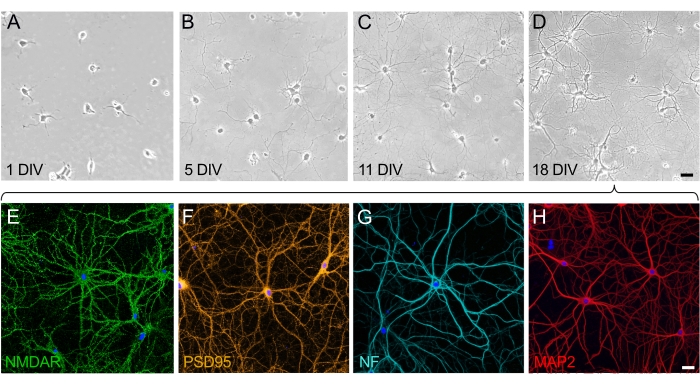
Abbildung 2: Zeitverlauf der Reifung dissoziierter Zellkulturen von Hippocampus-Neuronen. (A-D) Phasenkontrastbilder von Hippocampus-Neuronen während der ersten 18 Kulturtage. (A) Neuronen bei 1 div bei Anheftung an das PLL-beschichtete Substrat. (B) Die Entstehung kleiner Neuriten in Neuronen bei 5 div. (C) Neuronen bei 11 div haben lange Neuriten entwickelt, die sich verlängern und axonale Eigenschaften annehmen. (D) Neuronen bei 18 div sind reif und haben ein neuronales Netzwerk gebildet. Maßstabsbalken (A-D) = 40 μm. (E-H) Repräsentative fluoreszierende Bilder, aufgenommen mit konfokaler Laserscanning-Mikroskopie unter Verwendung selektiver Marker, um reife Neuronen bei 18 div zu zeigen. Neuronale Kulturen wurden fixiert und mit Antikörpern immungefärbt, die selektiv für (E) neuronalen Rezeptor (NMDAR), (F) synaptischen Marker (PSD95), (G) axonalen Marker (Neurofilament, NF) und (H) dendritischen Marker (MAP2) färben. Maßstabsbalken (E-H) = 20 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Antikörper in Patientenproben reagieren mit neuronalen Zelloberflächenantigenen
Die Proben (Serum und Liquor) von Patienten mit Anti-NMDAR-Enzephalitis enthalten Autoantikörper, die das NMDAR auf der Oberfläche von Neuronen erkennen. Die Inkubation der Kulturen mit den Patientenproben erzeugt ein intensives Fluoreszenzsignal auf der Zelloberfläche und den Dendriten (Abbildung 3A,C). Im Gegensatz dazu erzeugen Kontrollproben kein Fluoreszenzsignal, wenn sie den neuronalen Kulturen verabreicht werden (Abbildung 3B,D). Diese Ergebnisse zeigen, wie die Kulturen verwendet werden können, um Patientenproben auf Antikörper zu untersuchen und zur Identifizierung neuartiger Antikörper führen können, die auf die neuronale Zelloberfläche abzielen.
Liquorprobe des Patienten verringert die intrazelluläre Kalziumkonzentration in NMDA-induzierten Kulturen von Hippocampus-Neuronen
Um die Wirkung der Antikörper der Patienten auf die neuronale Aktivität (nach 24-stündiger Behandlung) zu bewerten, wurden intrazelluläre Kalziumtransienten von den kultivierten Neuronen in Echtzeit nach NMDA-vermittelter Stimulation optisch überwacht. Die Anwendung von NMDA erzeugt eine Erhöhung der Fluoreszenzintensität, was durch eine Veränderung der intrazellulären grünen Fluoreszenz angezeigt wird (Abbildung 4A und ergänzendes Video 1). Neuronen, die mit der Kontroll-Liquorprobe behandelt wurden, zeigten einen höheren Unterschied in der Fluoreszenzintensität (56%), wenn der Stimulator angewendet wurde, im Vergleich zu den Zellen, die mit der Liquorprobe des Patienten behandelt wurden. Die Unterschiede in der Fluoreszenzintensität wurden gemessen und die NMDA-vermittelten Stimulationskurven aus den aus dem Soma der Zellen extrahierten Daten verglichen (Abbildung 4B,C). Die Stimulationskurven zeigen, dass es in beiden Szenarien einen intrazellulären Zustrom von Kalzium gab, aber die Kulturen, die mit dem Liquor (graue Linie) der Patienten behandelt wurden, zeigten eine geringere Reaktion als die kontrollbehandelten Kulturen (schwarze Linie). Diese Ergebnisse zeigen, dass die im Liquor der Patienten vorhandenen Antikörper die zelluläre Aktivität aufgrund der Interaktion der Antikörper mit der NMDAR verringern und somit eine pathogene Wirkung hervorrufen.
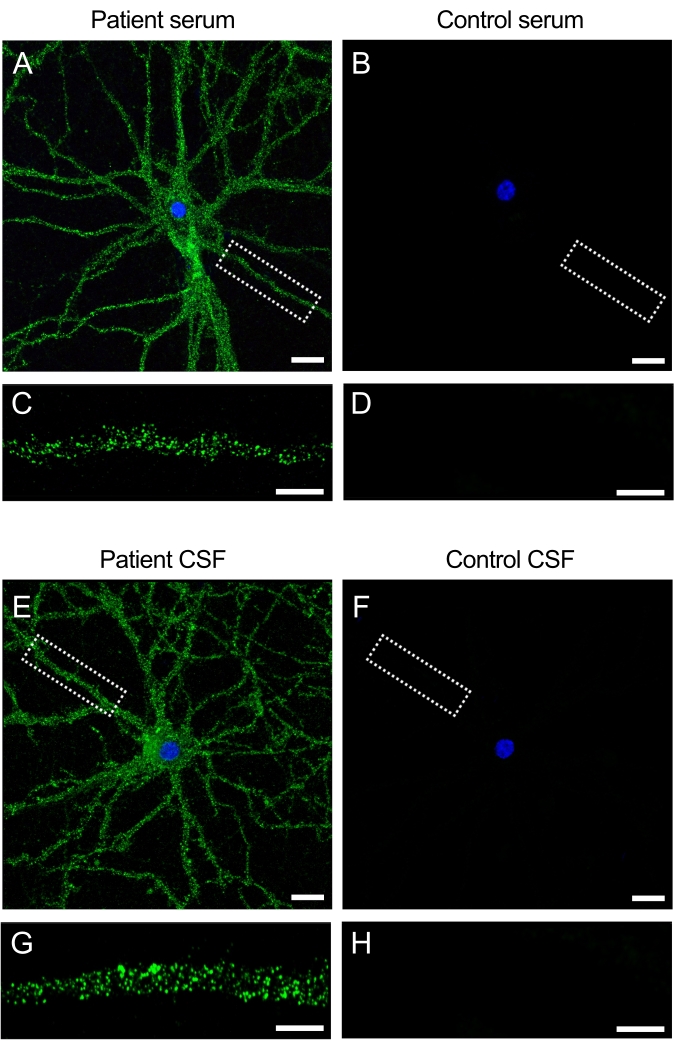
Abbildung 3: Patientenantikörper reagieren mit der Oberfläche neuronaler Kulturen . (A,E) Serum und Liquor von Patienten mit Anti-NMDAR-Enzephalitis reagieren mit der Zelloberfläche lebender Hippocampus-Neuronen lebender Ratten (B,F), während das Serum und der Liquor von Kontrollpersonen keine Reaktivität zeigen. Maßstabsbalken (A,B,E,F) = 20 μm. Bild mit höherer Vergrößerung eines Dendriten (63x), das das typische Oberflächenmuster der Reaktivität für (C,G) Serum und Liquor des Patienten und (D,H) negativ für Kontrollen zeigt. Die Bilder wurden mittels konfokaler Laserscanning-Mikroskopie aufgenommen. Maßstabsbalken = 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
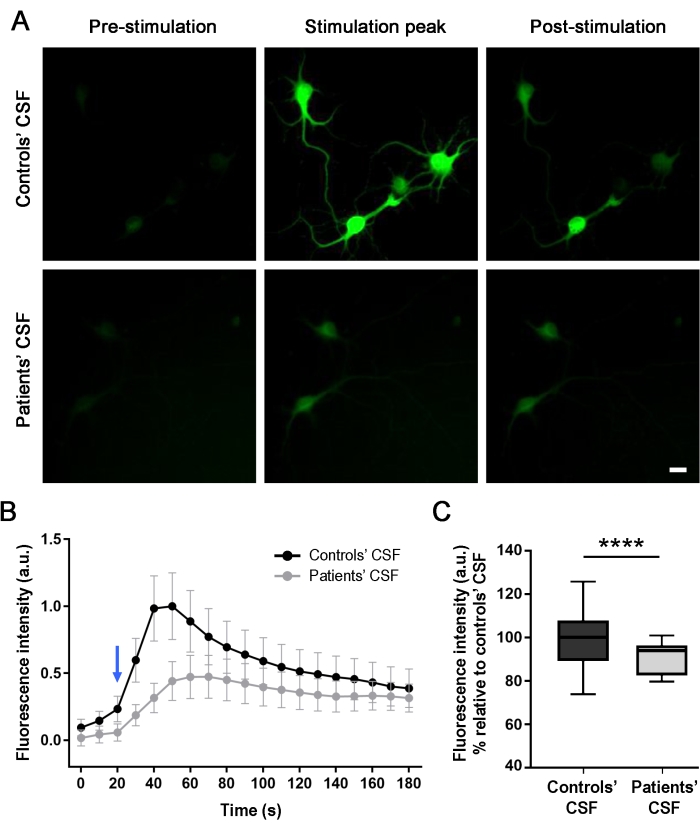
Abbildung 4: Patientenantikörper reduzieren den Kalziumeinstrom in Rattenneuronen, die GCaMP5G exprimieren. (A) Die Verabreichung einer Stimulationslösung (NMDA [100 μM] + Glycin [1 μM]) in Neuronenkulturen löste einen Kalziumeinstrom aus, was durch eine Erhöhung der intrazellulären grünen Fluoreszenz (Stimulationsspitze) im Vergleich zu dem vor der Stimulation aufgenommenen Bild (Prästimulation) angezeigt wird. Nach 120 s nimmt die Fluoreszenzintensität ab und stabilisiert sich (Nachstimulation). Kulturen, die mit dem Liquor der Patienten behandelt wurden, zeigten eine signifikante Reduktion (56%) des NMDA-vermittelten Kalziumanstiegs im Vergleich zum Liquor der Kontrolle. Die Bilder wurden mittels Fluoreszenzmikroskopie aufgenommen. Maßstabsbalken = 20 μm. (B) Eine Darstellung eines der drei unabhängigen Experimente, die die Fluoreszenzintensität über die Zeit (180 s) für die Kulturen darstellt, die mit dem Liquor der Kontrolle (schwarze Linie) und dem Liquor der Patienten (graue Linie) nach NMDA-Stimulation (blauer Pfeil) behandelt wurden. n(Liquor der Kontrollen) = 20 Zellen; n(Liquor der Patienten) = 28 Zellen. Die Daten werden als Mittelwert ± REM dargestellt. (C) Boxplots zeigen den Median, das 25. und 75. Perzentil. Schnurrhaare geben die Minimal- und Maximalwerte an. Die Bewertung der Signifikanz erfolgte durch Zwei-Wege-Varianzanalyse (ANOVA; p < 0,0001) und Mann-Whitney-U-Tests (p < 0,0001). Ein Wert von p < 0,05 wurde als statistisch signifikant angesehen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzendes Video 1: Das Video zeigt zwei Hippocampus-Neuronen, die GCaMP5G nebeneinander exprimieren: Neuron, das mit dem Liquor der Kontrolle behandelt wird (links) vs. Neuronen, die mit dem Liquor der Patienten behandelt werden (rechts). Die Anwendung von NMDAR (Stimulation) führt in beiden Fällen zu einer Erhöhung der intrazellulären Fluoreszenzintensität, jedoch mit einem signifikant höheren Niveau im Neuron, das mit dem Liquor der Kontrolle behandelt wird, als dem, das mit dem Liquor der Patienten behandelt wird. Die Bilder wurden mittels Fluoreszenzmikroskopie aufgenommen und mit ImageJ bearbeitet, wobei die Lookup-Tabelle (LUT) Fire angewendet wurde. 1700 Rahmen (170 s); 5 mal beschleunigt. Maßstabsbalken = 10 μm. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Das wachsende Feld der Antikörper-vermittelten Autoimmunität hat ein Fenster für die Identifizierung neuronaler Autoantikörper geöffnet, die zur Verbesserung der Diagnose und Behandlung von Patienten verwendet werden können. Kulturen von Hippocampus-Neuronen sind ein wesentliches Werkzeug für die Antikörperidentifizierung; Daher ist es wichtig, ein standardisiertes Protokoll durchzuführen, um zuverlässige und reproduzierbare Ergebnisse zu erhalten. Die wichtigsten zu berücksichtigenden Schritte, Einschränkungen und Fehlerbehebung werden hier erläutert.
Die kritischen Schritte dieses Protokolls können in drei Kategorien eingeteilt werden, je nachdem, ob sie die Reinheit, die Homogenität oder die Lebensfähigkeit der Hippocampus-Neuronen beeinflussen.
Reinheit - Um optimale primäre Zellkulturen zu erhalten, muss der Forscher selbstbewusst, geschult und in der Lage sein, schnell zu arbeiten, insbesondere um die Zeit der Dissektion zu minimieren. Auch wenn pyramidale Neuronen der Hauptzelltyp sind, enthält der Hippocampus eine Vielzahl von Interneuronen14. Um Kulturen mit minimalen Gliazellen zu erzeugen, muss der Hippocampus mit dem minimalen umgebenden Gewebe extrahiert werden. Die Verwendung eines schwarzen Hintergrunds während der Dissektion hilft, die Grenzen des Hippocampus unter dem Stereomikroskop zu identifizieren. Darüber hinaus sollte berücksichtigt werden, dass niedrigere Zelldichten zu einer geringeren parakrinen Unterstützung führen und die Aufrechterhaltung der Kultur erschweren13. Daher ist es wichtig, dieses Gleichgewicht im Auge zu behalten. Dies ist wichtig bei bildgebenden Studien, die eine geringe Anzahl von Zellen verwenden (50.000 Neuronen pro 3,5 cm Schüssel). Um zusätzliche Zeit für die Hippocampus-Extraktion zu haben, sollten Hibernate-Medien verwendet werden, die das Gewebe konservieren17. Die Arbeit mit geeigneten chirurgischen Instrumenten ist ebenfalls unerlässlich. Hochpräzise Werkzeuge sind empfindlich, daher sollte die Reproduzierbarkeit der Technik durch sorgfältigen Schutz sichergestellt werden.
Homogenität - Um eine Kultur ohne Zellaggregate zu entwickeln, wurde die mechanische Zelldissoziation durch die Kombination einer vorgezogenen Glaspipette mit einer Standardpipette von 1.000 μL verbessert.
Lebensfähigkeit - In diesem Protokoll wurden keine Antibiotika hinzugefügt, da sie die neuronale Erregbarkeit beeinflussen und die elektrophysiologischen Eigenschaften der kultivierten Neuronen verändern18. Daher ist eine Kontamination sehr wahrscheinlich, wenn die höchsten Sterilitätsstandards nicht eingehalten werden. Auch die Temperatur ist ein Schlüsselfaktor. Das Kalthalten des Gewebes während der Hippocampus-Isolierung verlangsamt den Stoffwechsel und verringert den Zellabbau. Das Gewebe wurde daher bis zum Zelldissoziationsprozess auf Eis gehalten. Darüber hinaus ist es entscheidend, das richtige Gleichgewicht während der enzymatischen Zelldissoziation zu finden, die die Zellen ohne ausgeprägte Zelllyse disaggregiert. In diesem Protokoll wurden die Zeitpunkte der Inkubation mit Trypsin und die nachfolgenden Waschschritte optimiert, um einzelne Zellen mit genügend Platz zu erhalten, um die Schaffung eines geeigneten neuronalen Netzwerks zu ermöglichen.
Kritische Schritte finden sich auch in fluoreszierenden Live-Immunfärbungs- und Kalziumaktivitätsaufzeichnungen aus den neuronalen Kulturen. Um eine erfolgreiche Lebendimmunfärbung zur Bestimmung des Vorhandenseins von Antikörpern gegen Zelloberflächenproteine in Patientenproben durchzuführen, muss eine Permeabilisierung der Zellen vermieden werden, die den Antikörpern den Zugang zu intrazellulären Proteinen ermöglichen würde. Darüber hinaus müssen basierend auf dem Titer der Antikörper die Inkubationszeit und die Probenverdünnung entsprechend angepasst werden (z. B. können Antikörper mit sehr hohem Titer eine Hintergrundfärbung ergeben, die die Interpretation der Ergebnisse erschwert). Bei der Durchführung der Pathogenitätsbewertung der Autoantikörper mit Calcium-Bildgebung muss ein Medium verwendet werden, das für zelluläre Aktivitätsmessungen optimal ist (z. B. ist dieMg2+ -Unterdrückung im Kulturmedium wichtig für eine gute Leistung). Darüber hinaus sollten für die Fluoreszenzbildgebung Medien mit pH-Indikatoren wie Phenolrot vermieden werden, da sie ein unspezifisches Hintergrundsignal einführen.
Es gibt zwei Haupteinschränkungen bei der Verwendung von neuronalen Hippocampus-Kulturen. Erstens müssen im Vergleich zu stabilen Zelllinien kontinuierlich Primärkulturen erzeugt werden, was den regelmäßigen Einsatz von Versuchstieren impliziert. Induzierte pluripotente Stammzelllinien (iPSC) könnten die Notwendigkeit der Verwendung von Tiermodellen ersetzen, aber die Differenzierungsprotokolle für iPSC sind immer noch nicht optimal. Zweitens exprimieren Neuronen, die von iPSC abgeleitet sind, nicht die vollständigen Spektren von Oberflächenproteinen, und daher impliziert das Fehlen von Reaktivität bei Verwendung nicht notwendigerweise die Negativität der Probe19.
Es gibt drei Methoden, um das Vorhandensein von Autoantikörpern im Serum oder Liquor von Patienten mit Verdacht auf AE zu untersuchen: gewebebasierter Assay (TBA) mit Rattenhirngewebe, zellbasierter Assay (CBA) mit HEK-Zellen, die transfiziert wurden, um neuronale Proteine zu exprimieren, und die hier berichtete Anwendung unter Verwendung lebender Kulturen von Hippocampus-Neuronen19. Die Bedeutung der kultivierten Hippocampus-Neuronenmethode liegt in ihrer Fähigkeit, die Reaktivität mit Oberflächen- und intrazellulären Antigenen zu unterscheiden, die nicht leicht durch TBA unterschieden werden können. Außerdem sind primäre neuronale Kulturen, im Gegensatz zu CBA in HEK-transfizierten Zellen, nicht durch das Repertoire der transfizierten Proteine begrenzt. Darüber hinaus können kultivierte Hippocampus-Neuronen verwendet werden, um neuartige Antikörper und ihre Zielantigene in Kombination mit Immunpräzipitation und Massenspektrometrie zu identifizieren und somit das Spektrum identifizierbarer Antikörper zu erweitern. Schließlich ermöglicht es die Beurteilung der pathogenen Wirkungen der Autoantikörper durch Live-Bildgebungsverfahren, die Veränderungen der zellulären Aktivität überwachen können. Zusammenfassend lässt sich sagen, dass die Identifizierung neuer Autoantikörper schließlich die Einleitung spezifischer Immuntherapien ermöglicht, um die Patientenergebnisse zu verbessern.
Offenlegungen
Die Autoren haben keine Interessenkonflikte.
Danksagungen
Wir danken Merche Rivas, Maria Marsal, Gustavo Castro, Jordi Cortés, Alina Hirschmann und Angel Sandoval (ICFO-Institut de Ciències Fotòniques) und Mercedes Alba, Marija Radosevic, David Soto, Xavier Gasull, Mar Guasp und Lidia Sabater (IDIBAPS, Hospital Clínic, Universität Barcelona) für ihre technische Unterstützung und die Bereitstellung von Reagenzien sowie Josep Dalmau und Myrna R. Rosenfeld (IDIBAPS, Hospital Clínic, Universität Barcelona) für ihre kritische Überprüfung des Manuskripts und ihre Mentorschaft. Diese Studie wurde vom Instituto de Salud Carlos III (ISCIII) finanziert und kofinanziert von der Europäischen Union, FIS (PI20/00280, J.P.), Fundació CELLEX (P.L-A.); Ministerio de Economía y Competitividad - Severo Ochoa Programm für Exzellenzzentren in Forschung und Entwicklung (CEX2019-000910-S, P.L-A.); CERCA Programm und Laserlab-Europe (871124, P.L-A.); Ministerio de Ciencia e Innovación (MCIN/AEI/ 10.13039/501100011033, P.L-A.); und Fondo Social Europeo (PRE2020-095721, M.C.).
Materialien
| Name | Company | Catalog Number | Comments |
| 10 cm Cell culture dish | Nunc | 12-565-020 | |
| 12 mm round coverslips | Fisher | NC9708845 | |
| 20x NA 0.75 S Fluor air objective | Nikon | CFI Super Fluor 20X | |
| 3.5 cm Cell culture dish | Nunc | 12-565-90 | |
| 6 cm Cell culture dish | Nunc | 12-565-94 | |
| B27 supplement | Gibco | 17504-044 | |
| Beaker 100 mL | Pirex | - | |
| Borax | Sigma-Aldrich | B9876 | |
| Boric Acid | Sigma-Aldrich | B0252 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Curved forceps | FST | 11009-13 | |
| D-Glucose | Sigma-Aldrich | D9434 | |
| DMEM High Glucose (4.5 g/L), without L-Glutamine, without Phenol Red | Capricorn | DMEM-HXRXA | |
| Female Wistar rat (18-days pregnant) | Janvier | - | |
| Fetal Bovine Serum (FBS) | Biowest | S181B-500 | |
| Fine-angled forceps | FST | 11251-35 | |
| Fine-curved forceps | FST | 11272-30 | |
| Fine-straight forceps | FST | 11251-23 | |
| FITC filter cube | Nikon | Standard Series | |
| Forceps | FST | 11000-12 | |
| Goat anti-Human AF488 | Invitrogen | A11013 | |
| HBSS | Capricorn | HBSS-1A | |
| HEPES | Sigma-Aldrich | H3375 | |
| Hibernate-E medium | Gibco | A12476-01 | |
| Horse Serum (HS) | Thermofisher | 26050088 | |
| Human anti-NMDAR antibody (CSF) | Patient Sample | - | |
| Human anti-NMDAR antibody (Serum) | Patient Sample | - | |
| ImageJ/Fiji | NIH | v1.50i | |
| Inverted fluorescence microscope | Nikon | Eclipse TE2000-U | |
| KCl | Sigma-Aldrich | 44675 | |
| L-Glutamine | Biowest | X0550-100 | |
| Mercury lamp | Nikon | C-HGFI | |
| Microscope cell chamber | Custom-build | - | |
| NaCl | Sigma-Aldrich | S9887 | |
| NBQX | Tocris | 373 | |
| Neurobasal without phenol red | Gibco | 12348-017 | |
| NMDA | Sigma-Aldrich | M3262 | |
| pAAV2-CAG-GCaMP5G | VectorBiolabs | - | |
| Paraformaldehyde 4% | Thermo scientific | J199943-K2 | |
| Penicillin-Streptomycin | Biowest | L0022-100 | |
| Phosphate-Buffered Saline | Gibco | 10010023 | |
| Poly-L-Lysine (PLL) | Peptide international | OKK-35056 | |
| Polystyrene ice tray | - | - | re-used cap of a polysterene box |
| Precision spring-scissors | FST | 15000-08 | |
| ProLong Gold with DAPI (antifading mounting media) | Molecular Probes | P36941 | |
| Scissors | FST | 14068-12 | |
| Sodium pyruvate | Biowest | L0642-100 | |
| Stereo microscope | Zeiss | Stemi 2000 | |
| Surgery scissors | FST | 14081-09 | |
| Trypsin 2.5% | Gibco | 15090046 | |
| Water, sterile endotoxine free | Sigma-Aldrich | W3500 |
Referenzen
- Dalmau, J., Geis, C., Graus, F. Autoantibodies to synaptic receptors and neuronal cell surface proteins in autoimmune diseases of the central nervous system. Physiological Reviews. 97 (2), 839-887 (2017).
- Dalmau, J., Graus, F. Antibody-mediated encephalitis. The New England Journal of Medicine. 378 (9), 840-851 (2018).
- Dalmau, J., et al. Paraneoplastic anti- N -methyl-D-aspartate receptor encephalitis associated with ovarian teratoma. Annals of Neurology. 61 (1), 25-36 (2007).
- Dalmau, J., et al. Anti-NMDA-receptor encephalitis: case series and analysis of the effects of antibodies. Lancet Neurology. 7 (12), 1091-1098 (2008).
- Lai, M., et al. AMPA receptor antibodies in limbic encephalitis alter synaptic receptor location. Annals of Neurology. 65, 424-434 (2009).
- Lancaster, E., et al. Antibodies to the GABAB receptor in limbic encephalitis with seizures: case series and characterisation of the antigen. Lancet Neurology. 9 (1), 67-76 (2010).
- Lai, M., et al. Investigation of LGI1 as the antigen in limbic encephalitis previously attributed to potassium channels: a case series. Lancet Neurology. 9 (8), 776-785 (2010).
- Sabater, L., et al. A novel NREM and REM parasomnia with sleep breathing disorder associated with antibodies against IgLON5: a case series, pathological features, and characterization of the antigen. Lancet Neurology. 13 (6), 575-586 (2014).
- Hughes, E. G., et al. Cellular and synaptic mechanisms of anti-NMDA receptor encephalitis. The Journal of Neuroscience. 30 (17), 5866-5875 (2010).
- Moscato, E. H., et al. Acute mechanisms underlying antibody effects in anti-N-methyl-D-aspartate receptor encephalitis. Annals of Neurology. 76 (1), 108-119 (2014).
- Planagumà, J., et al. Human N-methyl D-aspartate receptor antibodies alter memory and behaviour in mice. Brain. 138 (1), 94-109 (2015).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Research. 126 (3), 397-425 (1977).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nature Protocols. 1 (5), 2406-2415 (2006).
- Benson, D. L., Watkins, F. H., Steward, O., Banker, G. Characterization of GABAergic neurons in hippocampal cell cultures. Journal of Neurocytology. 23 (5), 279-295 (1994).
- Banker, G., Goslin, K. . Culturing Nerve Cells. , (1998).
- Nunez, J. Primary culture of hippocampal neurons from P0 newborn rats. Journal of Visualized Experiments. (19), e895 (2008).
- Brewer, G. J., Price, P. J. Viable cultured neurons in ambient carbon dioxide and hibernation storage for a month. Neuroreport. 7 (9), 1509-1512 (1996).
- Bahrami, F., Janahmadi, M. Antibiotic supplements affect electrophysiological properties and excitability of rat hippocampal pyramidal neurons in primary culture. Iranian Biomedical Journal. 17 (2), 101-106 (2013).
- Ricken, G., et al. Detection methods for autoantibodies in suspected autoimmune encephalitis. Frontiers in Neurology. 9, 841 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten