Method Article
تنقية ومراقبة جودة معقدات السيبتين المؤتلفة لإعادة التكوين الخالي من الخلايا
In This Article
Summary
تعد إعادة تكوين البروتينات الهيكلية الخلوية في المختبر أداة حيوية لفهم الخصائص الوظيفية الأساسية لهذه البروتينات. تصف هذه الورقة بروتوكولا لتنقية وتقييم جودة معقدات السيبتين المؤتلفة ، والتي تلعب دورا مركزيا في انقسام الخلايا والهجرة.
Abstract
Septins هي عائلة من البروتينات الملزمة ل GTP حقيقية النواة المحفوظة والتي يمكن أن تشكل خيوط هيكلية خلوية وهياكل أعلى مرتبة من مجمعات قليلة القسيمات غير المتجانسة. تتفاعل مع المكونات الهيكلية الخلوية الأخرى وغشاء الخلية للمشاركة في الوظائف الخلوية المهمة مثل الهجرة وانقسام الخلايا. نظرا لتعقيد التفاعلات العديدة للسبتين ، والعدد الكبير من جينات السيبتين (13 في البشر) ، وقدرة السيبتين على تكوين مجمعات قليلة القسيمات غير المتجانسة مع تركيبات وحدات فرعية مختلفة ، فإن إعادة التكوين الخالي من الخلايا هي استراتيجية حيوية لفهم أساسيات بيولوجيا السيبتين. تصف هذه الورقة أولا طريقة لتنقية السيبتين المؤتلف في شكلها غير المتجانس قليل القسيمات باستخدام نهج كروماتوغرافيا التقارب المكون من خطوتين. بعد ذلك ، يتم تفصيل عملية مراقبة الجودة المستخدمة للتحقق من نقاء وسلامة مجمعات السيبتين. تجمع هذه العملية بين الرحلان الكهربائي الهلامي الأصلي وتغيير طبيعته ، والمجهر الإلكتروني السلبي للبقع ، والفحص المجهري للتشتت التداخلي. أخيرا ، يتم تقديم وصف لعملية التحقق من قدرة البلمرة لمجمعات السيبتين باستخدام المجهر الإلكتروني السلبي للبقع والمجهر الفلوري. هذا يدل على أنه من الممكن إنتاج سداسي سيبتين بشري عالي الجودة وأوكتامير يحتوي على أشكال مختلفة من septin_9 ، بالإضافة إلى سداسي ذبابة الفاكهة .
Introduction
تم وصف الهيكل الخلوي بشكل كلاسيكي بأنه نظام مكون من ثلاثة مكونات يتكون من خيوط الأكتين والأنابيب الدقيقة والخيوط الوسيطة 1 ، ولكن في الآونة الأخيرة ، تم الاعتراف بالسيبتين كمكون رابع للهيكل الخلوي1. Septins هي عائلة من البروتينات المرتبطة ب GTP المحفوظة في حقيقيات النوى2. تشارك Septins في العديد من الوظائف الخلوية مثل انقسام الخلية3 ، والتصاق الخلية4 ، وحركة الخلية5 ، والتشكل6 ، والعدوى الخلوية7 ، وإنشاء وصيانة قطبية الخلية8. على الرغم من وظائفها المهمة ، فإن كيفية مشاركة السيبتين في مثل هذه العمليات غير مفهومة بشكل جيد.
تنقسم عائلة بروتينات السيبتين إلى عدة مجموعات فرعية (أربعة أو سبعة ، حسب التصنيف) بناء على تشابه تسلسل البروتين2. يمكن لأعضاء العائلات الفرعية المختلفة تشكيل مجمعات قليلة القسيمات غير متجانسة ، وهي اللبنات الأساسية للخيوط والتي بدورها تتجمع في هياكل أعلى مرتبة مثل الحزم والحلقات والشبكات1،9،10،11،12. ينشأ المزيد من التعقيد الجزيئي من وجود متغيرات لصق مختلفة ، مثال على ذلك هو SEPT9 البشري ، حيث يوجد دليل على وظائف محددة لمتغيرات لصق مختلفة13،14،15. بالإضافة إلى ذلك ، يعتمد طول oligomers غير المتجانسة على الأنواع ونوع الخلية. على سبيل المثال ، تشكل Caenorhabditis elegans septins tetramers 16 ، وتشكل سبتين ذبابة الفاكهة الميلانوجاستر سداسيات 17 (الشكل 1A) ، وتشكل Saccharomyces cerevisiae septins أوكتامير18 ، وتشكل السيبتين البشرية كلا من السداسي والأوكتامات 19 (الشكل 1 أ). إن قدرة أشكال السيبتين ، ومتغيرات اللصق ، والسيبتين المعدلة بعد الترجمة من نفس الفصيلة الفرعية على استبدال بعضها البعض في المركب والوجود (المشترك) للأوليغومرات غير المتجانسة ذات الحجم المختلف جعلت من الصعب تحديد الوظائف الخلوية لمختلف مجمعات قلة القلة-غير المتجانسة12.
قدرة أخرى مثيرة للاهتمام من septins هي قدرتها على التفاعل مع العديد من الشركاء ملزمة في الخلية. تربط Septins غشاء البلازما والعضيات الغشائية أثناء الطور البيني وانقسام الخلايا20،21،22. في الخلايا المنقسمة ، تتعاون السيبتين مع أنيلين 23،24،25 والأكتين والميوسين أثناء السيتوكينات26،27. في المراحل المتأخرة من التحلل الخلوي ، يبدو أن السيبتين ينظم مجمعات الفرز الاندوسومية المطلوبة لنظام النقل (ESCRT) لانقطاع منتصف الجسم28. بالإضافة إلى ذلك ، هناك أيضا دليل على وجود السيبتين الموجود على قشرة الأكتين وألياف إجهاد الأكتين للخلايا في خلايا الطورالبيني 29،30،31. في أنواع معينة من الخلايا ، يربط السيبتين أيضا الهيكل الخلوي للأنابيب الدقيقة32,33 وينظمه.
كل هذه الميزات تجعل السيبتين نظام بروتين مثير للاهتمام للغاية للدراسة ، ولكنه أيضا نظام صعب. إن الجمع بين العدد الكبير من الوحدات الفرعية للسيبتين (13 جينا في البشر دون احتساب متغيرات لصق2) مع إمكانية وحدات فرعية من السيبتين من نفس الفصيلة الفرعية لاستبدال بعضها البعض وتشكيل أوليغومرات غير متجانسة مختلفة الحجم يجعل من الصعب استخلاص استنتاج حول الوظيفة الخلوية لسيبتين معين عن طريق التلاعب الجيني. علاوة على ذلك ، فإن التفاعلات المتعددة للسبتين تجعل تفسير تأثيرات أدوات البحث الشائعة مثل الأدوية34 الموجهة إلى مكونات الهيكل الخلوي أو الغشاء مهمة صعبة.
تتمثل إحدى طرق التغلب على هذا الموقف في استكمال البحث في الخلايا بإعادة تكوين السيبتين في المختبر (بدون خلايا). تسمح إعادة التكوين في المختبر بعزل نوع واحد من أوليغومرات السيبتين غير المتجانسة مع تكوين وحدة فرعية محددة وطول18،35،36،37. يمكن بعد ذلك دراسة هذا المركب في بيئة خاضعة للرقابة ، إما بمفردها لاكتشاف الخصائص الهيكلية والفيزيائية الكيميائية الأساسية للسبتين 38،39،40 ، أو بالاشتراك مع الشركاء المرغوبين مثل الأغشية الحيوية النموذجية 11،41،42 ، أو خيوط الأكتين 10،27 ، أو الأنابيب الدقيقة 32،36 لفك تشفير طبيعة التفاعلات.
لذلك ، فإن الطريقة الموثوقة لتنقية مجمعات السيبتين المختلفة بكفاءة أمر حيوي لأبحاث السيبتين. ومع ذلك ، حتى باستخدام نفس البروتوكول ، يمكن أن تعطي عمليات التنقية المختلفة بروتينات ذات نشاط / وظيفة مختلفة أو حتى سلامتها. بالنسبة للبروتينات المتاحة تجاريا مثل الإنزيمات ، يتم التحقق من صحة الوظيفة والنشاط الأنزيمي بعناية43. قد يكون تنفيذ مراقبة الجودة الدقيقة للبروتينات الهيكلية الخلوية أو الهيكلية مثل السيبتين أمرا صعبا ، ولكن من الضروري إجراء تجارب عبر المختبرات قابلة للمقارنة.
تصف هذه الورقة طريقة قوية لتنقية السيبتين المؤتلف عالي الجودة في شكلها غير المتجانس قليل القسيمات بناء على التعبير المتزامن لمتجهين يحتويان على تركيبات أحادية أو ثنائية السيسترونيك (الجدول 1) في خلايا الإشريكية القولونية. تتكون الطريقة من نهج كروماتوغرافي تقارب من خطوتين لالتقاط أوليغومرات سيبتين غير متجانسة تحتوي على كل من سيبتين 6 علامات وسيبتين Strep-II (الشكل 1B ، C). تم استخدام هذا البروتوكول ، الذي تم وصفه لأول مرة في Iv et al.10 ، لتنقية سداسي سبتين ذبابة الفاكهة 11،27،35 ، وسداسي سيبتين البشري10 ، والعديد من أوكتامات السيبتين البشرية التي تحتوي على أشكال أصلية مختلفة (isoform 1 و 3 و 5) 10،32 أو أشكال SEPT9 المتحولة 32 . علاوة على ذلك ، يتم تقديم وصف لمجموعة من التقنيات لتقييم جودة السيبتين المنقى. أولا ، يتم التحقق من سلامة والقياس المتكافئ الصحيح للوحدات الفرعية للحاجز باستخدام تغيير طبيعة الرحلان الكهربائي والمجهر الإلكتروني للإرسال (TEM). بعد ذلك ، يتم فحص وجود oligomers غير المتجانسة للكتلة الجزيئية الصحيحة ووجود المونومرات أو oligomers الأصغر التي تشير إلى عدم الاستقرار المعقد عن طريق الرحلان الكهربائي الأصلي والقياس الضوئي الشامل عبر الفحص المجهري للتشتت التداخلي (iSCAT). أخيرا ، تتكون الخطوة الأخيرة من تقييم نشاط البلمرة للسبتين باستخدام الفحص المجهري الفلوري و TEM.
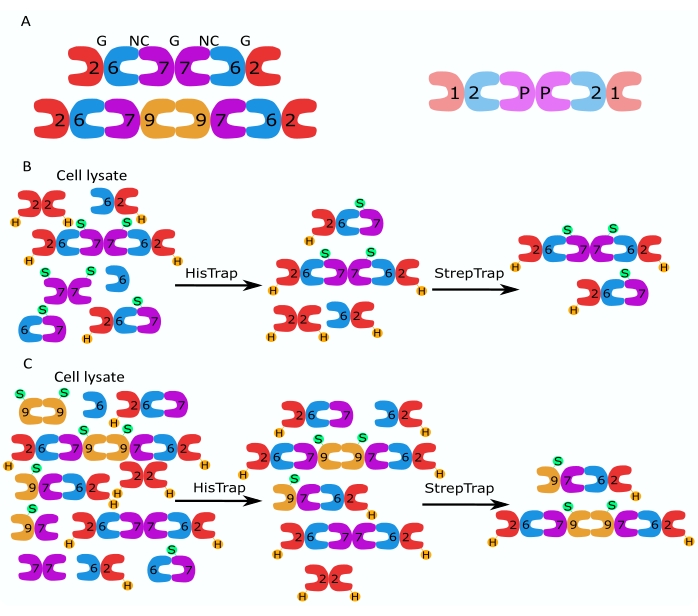
الشكل 1: استراتيجية التنقية. (أ) مخططات أوليغومرات سيبتين غير المتجانسة الموجودة في الخلايا البشرية (اليسرى) وذبابة الفاكهة (اليمنى). تشير الأرقام إلى وحدات فرعية من septin من المجموعات المشار إليها ، وتشير P إلى الفول السوداني. يمكن أن يكون SEPT9 البشري أيا من أشكاله المتساوية. الوحدات الفرعية septin لها شكل غير متماثل وترتبط طوليا بواجهتين متميزتين ، NC: NC وواجهة G: G ، كما يشار إليها ب NC و G ، على التوالي ، أعلى السداسي البشري. (ب، ج) رسم تخطيطي لاستراتيجية الكروماتوغرافيا المكونة من خطوتين ، موضحة ل (B) سداسيات السيبتين البشرية و (C) الأوكتامرات. يشير H إلى علاماته ، بينما يشير S إلى علامات Strep-II. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
1. تنقية أوليغومرات السيبتين غير المتجانسة
- التحول المشترك للخلايا البكتيرية مع ناقلات التعبير
- حدد مجموعة من pnEA واحد وبلازميد pnCSواحد 44 الذي سيتم استخدامه للتعبير. اختر المجموعة اعتمادا على تكوين الوحدة الفرعية المطلوب ل septin hetero-oligomer10,35 وعلى ما إذا كانت علامات الفلورسنت مطلوبة أم لا.
ملاحظة: يتم استخدام المجلد الفائق الأحادي الموسوم نهائيا GFP (msfGFP) الموسومة ب SEPT2 (للسبتين البشري) أو msfGFP- أو GFP الأحادي المحسن (mEGFP) -DSep2 ( لذبابة الفاكهة ) هنا (الجدول 1). - ماصة 1 ميكرولتر من كل بلازميد (~ 1 نانوغرام / ميكرولتر) إلى 100 ميكرولتر من خلايا الإشريكية القولونية BL21 المختصة واحتضانها على الجليد لمدة 20 دقيقة.
- ضع الخلايا في حمام مائي على حرارة 42 درجة مئوية لمدة 40 ثانية ثم احتضنها على الفور لمدة 3 دقائق على الثلج.
- أضف 0.9 مل من وسط مرق الليزوجيني (LB) إلى معلق الخلية واترك الخلايا تنمو لمدة 1 ساعة عند 37 درجة مئوية. صفيحة 100 ميكرولتر من الخلايا على ألواح LB-agar دافئة تحتوي على 100 ميكروغرام / مل أمبيسلين و 100 ميكروغرام / مل سبكتينومايسين وحضين طوال الليل عند 37 درجة مئوية.
- حدد مجموعة من pnEA واحد وبلازميد pnCSواحد 44 الذي سيتم استخدامه للتعبير. اختر المجموعة اعتمادا على تكوين الوحدة الفرعية المطلوب ل septin hetero-oligomer10,35 وعلى ما إذا كانت علامات الفلورسنت مطلوبة أم لا.
- تنمو البكتيرية قبل الاستزراع
- املأ دورق إرلنماير سعة 250 مل ب 100 مل من المرق الرائع (TB) أو وسط LB يحتوي على 100 ميكروغرام / مل أمبيسلين و 100 ميكروغرام / مل سبكتينومايسين.
- اختر مستعمرة واحدة من صفيحة LB-agar مع حلقة تلقيح معقمة وانقلها إلى وسائط جديدة من الخطوة 1.2.1.
- احتضن عند 37 درجة مئوية في حاضنة شاكر دوارة ، إما طوال الليل أو لمدة 6 ساعات على الأقل.
ملاحظة: من هذه المزرعة ، يمكن تحضير مخزون الجلسرين عن طريق خلط المعلق البكتيري 1: 1 مع الجلسرين وتخزينه عند -80 درجة مئوية. يمكن استخدام هذا المخزون في الخطوة 1.2.2. بدلا من مستعمرة تحولت حديثا.
- الثقافة البكتيرية وتحريض تعبير البروتين
- انقل 100 مل من البكتيريا المزروعة إلى 5 لتر من السل أو رطل تحتوي على 50 ميكروغرام / مل أمبيسلين و 50 ميكروغرام / مل سبكتينومايسين.
- قم بتنمية هذه الثقافة عند 37 درجة مئوية في حاضنة شاكر حتى تصل إلى كثافة بصرية (OD) تقاس بطول موجي يبلغ 600 نانومتر في نطاق 2-3 للسبتين غير المسمى أو 0.6-0.8 ل msfGFP / mEGFP المسمى septins وتحفيز التعبير البروتيني عن طريق إضافة تركيز نهائي قدره 0.5 mM IPTG. الحد الأدنى من OD للسبتين المسمى هو تجنب الوصول إلى مرحلة الموت في وقت التعبير الأطول ، كما هو مفصل في الخطوة التالية.
- احتضان الخلايا التي تعبر عن أوليغومرات السيبتين غير المصنفة لمدة 3 ساعات عند 37 درجة مئوية أو الخلايا التي تعبر عن أوليغومرات غير متجانسة موسومة ب msfGFP طوال الليل عند 17 درجة مئوية.
ملاحظة: يتم اختيار وقت التعبير البروتيني القصير للمركبات غير الموسومة ، والذي يتم تسهيله باستخدام وسط السل الأكثر ثراء ، لمنع تدهور البروتين. يتم اختيار وقت التعبير الأطول جنبا إلى جنب مع انخفاض درجة الحرارة للمجمعات ذات العلامات للسماح بالطي الصحيح لعلامة msfGFP.
- التحلل البكتيري وتوضيح المحللة
ملاحظة: من هذه النقطة فصاعدا في إجراء التنقية ، احتفظ بالمحلول المحتوي على البروتين على الثلج أو عند 4 درجات مئوية في جميع الأوقات لمنع تدهور البروتين المحلل للبروتين أو فقدان النشاط.- اجمع الخلايا المستزرعة عن طريق الطرد المركزي عند 4000 × جم لمدة 20 دقيقة عند 4 درجات مئوية. تخلص من المادة الطافية.
- اختياريا ، قم بتجميد الحبيبات في هذه الخطوة وتخزينها في -80 درجة مئوية لمدة 6 أشهر كحد أقصى. إذا تم اختيار هذا الخيار ، فتأكد من إذابة الحبيبات على الجليد قبل المتابعة.
- قم بإذابة الحبيبات في 100 مل من محلول التحلل (الجدول 2) وقم بتحليل الخلايا. اختر أحد الخيارين أدناه
- Sonicate في 7 دورات من 30 ثانية ON و 59 ثانية OFF مع صوتي طرف باستخدام سعة 30٪ (لاحظ أن الإعدادات تعتمد على صوتيكاتور).
- قم بتكسير الخلايا في الصحافة الفرنسية عن طريق تمريرها 3x على الأقل.
- وضح محللة الخلية عن طريق الطرد المركزي عند 20000 × جم لمدة 30 دقيقة عند 4 درجات مئوية واحتفظ بالمادة الطافية. يوصى بالبدء بالخطوة 1.5.1. خلال هذه الخطوة الطرد المركزي.
- اختياريا ، خذ عينة لتغيير طبيعة الكهربائي ، كما هو موضح في القسم 2.
- اجمع الخلايا المستزرعة عن طريق الطرد المركزي عند 4000 × جم لمدة 20 دقيقة عند 4 درجات مئوية. تخلص من المادة الطافية.
- كروماتوغرافيا التقارب للبروتينات الموسومة به
ملاحظة: تنتج هذه الخطوة معقدات تحتوي على SEPT2 البشري أو ذبابة الفاكهة Sep1 باستخدام عمود النيكل (الشكل 1B).- قم بموازنة عمود كروماتوغرافيا عالي الأداء من النيكل سيفاروز معبأ مسبقا مع مخزن سيبتين (الجدول 2).
- قم بتحميل المادة الطافية الموضحة على العمود بسرعة 1 مل / دقيقة واغسل البروتين المرتبط بثلاثة أحجام أعمدة على الأقل من المخزن المؤقت للسبتين.
- قم بتخفيف معقدات السيبتين باستخدام محلول شطف HisTrap بنسبة 50٪ (الجدول 2) عند 1 مل / دقيقة أثناء جمع كسور 0.5 مل لإنتاج تركيز إيميدازول يبلغ 250 مللي مول.
- اختر الكسور التي تحتوي على مجمعات السيبتين ، كما يتضح من الامتصاص البصري للشطف عند 280 نانومتر يتم مراقبته عبر الإنترنت باستخدام نظام كروماتوغرافيا البروتين السائل السريع (FPLC) أو بعد التنقية باستخدام مقياس الطيف الضوئي الصغير الحجم.
ملاحظة: يمتص إيميدازول الضوء عند 280 نانومتر. ربما يفسر هذا سبب عدم عودة ذروة البروتين إلى الامتصاص الصفري بعد شطف السيبتين (الشكل 2 أ).
- كروماتوغرافيا التقارب للبروتينات الموسومة ببكتيريا II
ملاحظة: تنتج هذه الخطوة معقدات تحتوي إما على SEPT7 البشري (السداسيات) أو SEPT9 البشري (الأوكتامر) أو ذبابة الفاكهة باستخدام عمود Strep-Tactin (الشكل 1B). يعتمد عمود الكروماتوغرافيا على نظام البيوتين ستربتافيدين المعدل. يتم تمييز البروتين بالبيوتين المعدل (Strep-II-tag) ، ويحتوي العمود على ستربتافيدين مهندس (Strep-Tactin). على الرغم من تعديله من نظام البيوتين-ستربتافيدين ، لا يوجد تداخل بين نظام Strep-Tactin-Strep-II-tag ونظام البيوتين-ستربتافيدين. يستخدم النظام الموصوف لتجنب التداخل مع مقايسات إعادة التكوين باستخدام البيوتين والستربتافيدين.- قم بموازنة عمود كروماتوغرافيا StrepTactin sepharose عالي الأداء معبأ مسبقا مع مخزن Septin (الجدول 2). قم بتحميل الكسور المحتوية على السيبتين المستردة من عمود النيكل عند 1 مل / دقيقة واغسل البروتين المرتبط بثلاثة أحجام أعمدة على الأقل من المخزن المؤقت للسيبتين.
- قم بتخفيف معقدات السيبتين باستخدام محلول شطف StrepTrap بنسبة 100٪ (الجدول 2) عند 1 مل / دقيقة أثناء جمع كسور 0.5 مل لإنتاج تركيز 2.5 مللي مول ديسثيوبيوتين.
ملاحظة: يجب إذابة ديسثيوبيوتين في المخزن المؤقت للشطف StrepTrap طازجا. - اختر الكسور التي تحتوي على مجمعات السيبتين ، كما هو موضح في الامتصاص البصري للشطف عند 280 نانومتر يتم مراقبته عبر الإنترنت باستخدام نظام FPLC أو بعد التنقية باستخدام مقياس الطيف الضوئي الصغير.
ملاحظة: عادة ما يتم إجراء الرحلان الكهربائي لتغيير طبيعة الأسنان في هذه المرحلة مع عينات من غسل العمود وكسور السيبتين. يمكن عكس ترتيب الأعمدة بنتائج لا يمكن تمييزها ، أي المحللة الموضحة بعد الخطوة 1.4. يمكن أن تخضع لكروماتوغرافيا تقارب Strep-Tactin متبوعة بكروماتوغرافيا تقارب النيكل.
- غسيل الكلى والتخزين
- لإزالة ديسثيوبيوتين من محلول التخزين النهائي ، قم بغسيل مجمعات السيبتين في ~ 1: 300 نسبة حجم العينة إلى المخزن المؤقت مقابل المخزن المؤقت للسبتين (الجدول 2) المكمل ب 1 mM DTT بين عشية وضحاها ، أو لمدة 4 ساعات على الأقل ، عند 4 درجات مئوية باستخدام غشاء غسيل الكلى MWCO 30 كيلو دالتون.
- اختياريا ، ركز السيبتين باستخدام عمود تركيز طرد مركزي MWCO 30 كيلو دالتون حتى التركيز المطلوب. استهدف تركيز 5-7 ميكرومتر ، كما تم قياسه عبر الامتصاص البصري للمحلول عند 280 نانومتر وباستخدام معامل الانقراض النظري المحسوب بواسطة ProtParam (الجدول 3).
- قم بتقسيم مجمعات البروتين إلى حجم القسمة المطلوب ، وقم بتجميد القسمة ، وقم بتخزينها في -80 درجة مئوية.
ملاحظة: يوصى بعدم تخزين البروتين لأكثر من 6 أشهر. بالإضافة إلى ذلك ، يوصى بإجراء تجارب منتظمة لمراقبة الجودة ، خاصة إذا تم تخزين البروتين لفترة أطول من الوقت الموصى به.
2. مراقبة جودة نقاء وسلامة سيبتين غير متجانسة أوليغومر
ملاحظة: تتكون مراقبة جودة hetero-oligomer من مجموعة من التقنيات البيوكيميائية والتصوير التي تسمح بالكشف عن كتلة وسلامة مجمعات السيبتين الموجودة في المحلول.
- تغيير طبيعة الكهربائي للتحقق من تشكيل سيبتين hetero-oligomer مع المكونات الصحيحة
- امزج 10 ميكرولتر من الكسور المحددة مع 10 ميكرولتر من المخزن المؤقت لعينة 2x SDS ، وقم بتحميلها على هلام TGX مسبق الصب بنسبة 4٪ -15٪ ، واملأ النظام بمخزن مؤقت لتشغيل Tris / glycine / SDS.
- قم بتشغيل الرحلان الكهربائي لمدة 35 دقيقة عند 200 فولت وقم بتلطيخ الجل (جدول المواد) لتصور النتائج. يمكن العثور على الأوزان الجزيئية لبروتينات السيبتين الفردية ومجمعات السيبتين غير المتجانسة قليلة القسيمات في الجدول 3.
- قم بقياس الكثافة النسبية لكل شريط داخل كل حارة يحتوي على سبتين منقى في صورة مقلوبة التباين. قم بذلك عن طريق حساب متوسط شدة المستطيلات متساوية الحجم حول كل شريط ومستطيل متساوي الحجم في منطقة بدون أي نطاق في نفس الممر. بعد ذلك ، قم بتطبيع القيم بقسمة شدة كل نطاق على شدة المنطقة بدون نطاقات.
ملاحظة: إذا كانت الكثافة مشبعة (على سبيل المثال، قيم 255 لصورة 8 بت على صورة مقلوبة التباين)، فتخط الحارة.
- توزيع الحجم الأصلي المتوسط للمجموعة عن طريق الرحلان الكهربائي الأصلي
- قم بإعداد 800 مل من مخزن الأنود المؤقت و 200 مل من مخزن الكاثود الأزرق الفاتح في اليوم السابق وتخزينها في الثلاجة. لتحضير المخزن المؤقت للأنود ، قم بتخفيف 40 مل من المخزن المؤقت الجاري 20x مع 760 مل من الماء منزوع الأيونات من النوع الأول (I-water). لتحضير المخزن المؤقت للكاثود الأزرق الفاتح ، قم بتخفيف 10 مل من المخزن المؤقت الجاري 20x و 1 مل من مادة الكاثود المضافة 20x مع 189 مل من I-water. يأتي المخزن المؤقت الجاري ومضافات الكاثود مع مجموعة (جدول المواد).
- قم بإعداد 10 ميكرولتر من العينة عن طريق خلط ~ 500 نانوغرام من السيبتين مع الكمية المطلوبة من المخزن المؤقت للعينة (2.5 ميكرولتر في هذه الحالة ، بسبب استخدام مخزن مؤقت للعينة 4x ؛ انظر جدول المواد) وما يكفي من I-water للوصول إلى حجم 10 ميكرولتر.
- قم بتحميل العينات على الجل واملأ النظام بأنود بارد ومخازن الكاثود.
- قم بتشغيل الرحلان الكهربائي لمدة 115 دقيقة تقريبا عند 150 فولت باستخدام مصدر طاقة لا يتوقف عند التيارات المنخفضة وصبغ الجل (جدول المواد) لتصور النتائج. يمكن العثور على الأوزان الجزيئية للبروتينات والمجمعات الفردية المحسوبة بناء على التسلسل في الجدول 3.
- توزيع الكتلة أحادي الجزيء باستخدام القياس الضوئي الشامل عبر مجهر التشتت التداخلي
- اغسل الشرائح الزجاجية # 1.5 عن طريق صوتنة لهم في منظف بالموجات فوق الصوتية لمدة 5 دقائق في I-water ، و 5 دقائق في الأيزوبروبانول ، وأخيرا ، 5 دقائق في I-water.
- جفف شريحتين زجاجيتين بتيار لطيف من غاز النيتروجين وضع قطرة 7 ميكرولتر من محلول Poly-L-Lysine (PLL) بنسبة 7 ميكرولتر في وسط إحدى الشرائح. بعد ذلك ، ضع مركز الشريحة الأخرى أعلى قطرة PLL ، وقم بتوجيه الشريحتين بشكل متعامد لسهولة الفصل. احتضان لمدة 30 ثانية.
- اغسل عن طريق الغمر في دورق مع I-water 1x وعن طريق تطبيق تيار من I-water 2x مباشرة. ثم جفف الشريحتين بتدفق غاز النيتروجين. يمكن تخزين هذه الشرائح بعد ذلك لمدة 6 أسابيع تقريبا في درجة حرارة الغرفة في الظروف الجافة.
ملاحظة: قم بتسمية جانب الشريحة التي تتم معالجتها باستخدام PLL لتشغيل التجربة بشكل صحيح.
- اغسل عن طريق الغمر في دورق مع I-water 1x وعن طريق تطبيق تيار من I-water 2x مباشرة. ثم جفف الشريحتين بتدفق غاز النيتروجين. يمكن تخزين هذه الشرائح بعد ذلك لمدة 6 أسابيع تقريبا في درجة حرارة الغرفة في الظروف الجافة.
- قبل التجربة مباشرة ، قم بقص قطعة من حشيات 2 × 2 أو 3 × 2 أو 3 × 3 (التي تنتج 4 أو 6 أو 9 غرف / شريحة تصوير ، على التوالي) وألصقها على الجزء المعالج ب PLL من شريحة زجاجية مع تجنب الشريحة الزجاجية والحشيات التي تلامس أي سطح متسخ. ضع الشريحة على منديل ممسحة خفيف واضغط على الحشيات بطرف ماصة لإلصاقها بالبلاستيك الواقي الذي لا يزال على الحشيات.
- قم بتسخين الحاجز المؤقت (الجدول 2) إلى درجة حرارة الغرفة وقم بإذابة البروتينات في متناول اليد (احتفظ بها على الثلج بعد ذلك).
ملاحظة: يظهر iSCAT إشارة بعض المنظفات والجزيئات الصغيرة التي تشبه إشارات البروتين45. DTT هي واحدة من تلك الجزيئات الصغيرة ، ولهذا السبب لا يتم استخدامها لهذه التجربة. لا يوجد سوى أثر DTT قادم من الحاجز المخزن. - ضع الشريحة مع حشيات على نظام القياس الضوئي للكتلة التجارية التي تحتوي على 19 ميكرولتر من المخزن المؤقت للحاجز وركز المجهر باستخدام خيار التركيز البؤري التلقائي. اتبع تعليمات الشركة المصنعة للتحقق مما إذا كان التركيز الذي تم العثور عليه صحيحا. يتم استخدام الهدف القياسي 100x الذي يعد جزءا من الإعداد هنا.
- قم بإنشاء مجلد مشروع أو تحميله لتخزين البيانات باستخدام ملف > مشروع جديد أو ملف > تحميل المشروع.
- ماصة 1 ميكرولتر من العينة على 19 ميكرولتر من قطرة عازلة سيبتين (الخطوة 2.3.5) تستخدم للتركيز والخلط مع تقليل حركة الشريحة عن طريق عدم لمس أي شيء أثناء القيام بذلك. بعد ذلك ، قم بتسجيل مقطع فيديو مكون من 6,000 إطار بالنقر فوق تسجيل.
- للتحليل الصحيح ، سجل العينات التالية: المخزن المؤقت للحاجز ، معيار كتلة البروتين لمعايرة نسبة الإشارة إلى الكتلة (في حالة توفر معايرة حديثة ولم تتغير الظروف البيئية ، يمكن تخطي هذه العينة) ، و 250 نانومتر من مجمعات السيبتين المخففة في المخزن المؤقت للسبتين بدون DTT (وهذا يعطي تركيزا نهائيا ~ 12.5 نانومتر).
- قم بتحليل مقاطع الفيديو باستخدام برنامج الشركة المصنعة للحصول على توزيع كتلة البروتين. تحقق من وجود بيانات جيدة الجودة على النحو التالي.
- إذا كانت قمم أحجام مختلفة من قلة السيبتين غير المتجانسة متداخلة كثيرا أو تم اكتشاف عدد كبير جدا من الأحداث (>3500 حدث لفيديو 6000 إطار مع مجال رؤية منتظم يبلغ 128 بكسل × 34 بكسل يمتد على 10.8 ميكرومتر × 2.9 ميكرومتر) ، قلل تركيز السيبتين النهائي وقم بالقياس مرة أخرى.
- إذا لم يكن هناك عدد كاف من الجزيئات المفردة المقاسة (على الأقل 2,500-3,500 لفيديو مكون من 6,000 إطار مع مجال الرؤية العادي) ، فقم بزيادة تركيز السيبتين والقياس مرة أخرى.
- التصوير المباشر لمجمعات السيبتين عبر المجهر الإلكتروني الناقل للبقع السلبية
- تمييع العينات إلى تركيز حوالي 50 نانومتر في عازلة septin وإعداد محلول تلطيخ (2٪ فورمات يورانيل أو خلات اليورانيل في I-water).
ملاحظة: يجب تحضير فورمات اليورانيل طازجة. - ماصة 4 ميكرولتر من السيبتين المخفف على شبكة مجهرية إلكترونية متوهجة مفرغة واحتضانها لمدة 30 ثانية.
- قم بإزالة معظم محلول البروتين باستخدام ورق ترشيح واغسل الشبكة 2x مع عازلة septin و 1x مع I-water لإزالة السيبتين الممتز بشكل فضفاض.
- وصمة عار مع 2 ٪ خلات يورانيل أو محلول فورمات يورانيل في I-water لمدة 1 دقيقة ، وامتصاص محلول تلطيخ مع ورقة الترشيح ، وتجفيف الشبكة في الهواء لبضع دقائق.
- قم بفحص الشبكة باستخدام مجهر إلكتروني ناقل محاذاة بشكل صحيح للبحث عن مناطق البقع المحسنة وجمع حوالي 100 صورة داخل هذه المناطق المحددة.
- اجمع الصور بتكبير لا يقل عن 50000x للحصول على حجم بكسل يبلغ حوالي 2 Å / pixel وبإلغاء تركيز بؤري يتراوح من -1 ميكرومتر إلى -2 ميكرومتر. استخدم جهد تسارع 200 كيلو فولت. على نحو مفضل ، استخدم إجراء آليا لجمع البيانات ، والذي سيعتمد على برنامج الاستحواذ المتاح.
- أداء معالجة الصور 2D باستخدام برنامج مخصص
- ضع ما لا يقل عن 2000 جسيم باستخدام برنامج مخصص46.
- قم بإجراء محاذاة ثنائية الأبعاد وتصنيفها بشكل متكرر حتى يتم الحصول على الفئات دون مزيد من التحسين. يجب أن تكون خطوة المحاذاة والتصنيف الأولى خالية من المراجع لتجنب أي تحيز في التصنيف.
- استخدم المتوسطات التي تم الحصول عليها من التصنيف الأول الخالي من المراجع كمراجع جديدة لإجراء جولة إضافية من التصنيف. كرر هذه العملية بشكل متكرر حتى لا يتم تحقيق مزيد من التحسين. تأكد من أن كل فئة تعتمد على 50 إلى 100 جسيم منتقى ، وأن الوحدات الفرعية الفردية مرئية بوضوح. يمكن استخدام أدوات برمجية مختلفة (Spider أو Eman أو Relion)46،47،48.
- تمييع العينات إلى تركيز حوالي 50 نانومتر في عازلة septin وإعداد محلول تلطيخ (2٪ فورمات يورانيل أو خلات اليورانيل في I-water).
3. مراقبة الجودة الوظيفية Septin عن طريق تحليل البلمرة
ملاحظة: تتكون مراقبة جودة الوظائف من مجموعة من تقنيات التصوير التي تسمح بالكشف عن مجمعات السيبتين المبلمرة. أدناه ، يشار إلى السيبتين غير المسمى باسم السيبتين "الداكن" ، ويشار إلى المخزن المؤقت المستخدم في بلمرة السيبتين غير المسمى باسم المخزن المؤقت لبلمرة السيبتين "الداكن" (SPB).
- تصوير حزمة Septin عبر الفحص المجهري الفلوري
- تحضير 5x fluoSPB (الجدول 2) ومزيج سيبتين يتكون من 90٪ سيبتين داكن و 10٪ msfGFP-septin بتركيز أعلى بستة أضعاف من التركيز النهائي المطلوب في محلول السيبتين + 1 mM DTT. التركيز النموذجي لهذا الفحص هو 300 نانومتر ، وبالتالي ، فإن التركيز هو 1,800 نانومتر لهذا المزيج.
- بلمرة السيبتين عن طريق خلط ، بهذا الترتيب المحدد ، I-water (يكفي لزيادة الحجم النهائي المطلوب) ، 20٪ 5xfluoSPB (تخفيف نهائي 1: 5) ، 0.05 ميكرومتر PCD ، و 16.67٪ مزيج سيبتين (تخفيف نهائي 1: 6). للحصول على 10 ميكرولتر ، امزج 6.23 ميكرولتر من I-water ، و 2 ميكرولتر من 5xfluoSPB ، و 0.1 ميكرولتر من PCD (بمخزون 5 ميكرومتر) ، و 1.67 ميكرولتر من مزيج السيبتين. احتضان هذا المزيج لمدة 30 دقيقة على الأقل في درجة حرارة الغرفة.
- أضف العينات إلى غرفة التصوير المغسولة ب fluoSPB (الجدول 2) وقم بتصوير حزم السيبتين. تعمل قنوات التدفق المخمول PLL-PEG ، كما هو موضح في البحث السابق10،32 ، بشكل جيد لهذه التجربة.
- تخيل حزمة Septin عبر المجهر الإلكتروني لنقل البقع السلبية
- قم بإعداد 5x darkSPB (الجدول 2) ومزيج سيبتين يتكون من 100٪ سيبتين داكن بتركيز أعلى بست مرات من التركيز النهائي المطلوب في محلول السيبتين + 1 مللي مول DTT. التركيز النموذجي لهذا الفحص هو 300 نانومتر ، وبالتالي ، فإن التركيز هو 1,800 نانومتر لهذا المزيج.
- بلمرة مجمعات السيبتين عن طريق خلط ، بهذا الترتيب المحدد ، I-water (بما يكفي لزيادة الحجم النهائي المطلوب) ، 20٪ 5xdarkSPB ، و 16.67٪ مزيج السيبتين. بالنسبة إلى 5 ميكرولتر ، امزج 3.16 ميكرولتر من I-water ، و 1 ميكرولتر من 5x darkSPB ، و 0.83 ميكرولتر من مزيج السيبتين. احتضان هذا المزيج لمدة 30 دقيقة على الأقل في درجة حرارة الغرفة.
- أضف 3-5 ميكرولتر من العينة إلى شبكة مجهر إلكتروني متوهجة واحتضانها لمدة 1 دقيقة. بعد ذلك ، اغسل الشبكة 2x باستخدام darkSPB (الجدول 2) عن طريق امتصاص السائل بورق ترشيح وإضافة قطرة من المخزن المؤقت darkSPB ، واغسل 1x بالماء ، واحتضن لمدة ~ 30 ثانية مع أسيتات اليورانيل 2٪ ، وصمة عار البقعة ، وجفف العينة بالهواء لبضع دقائق.
- تخيل حزم septin عند 120 كيلو فولت وتكبيرها بين 5000x و 60000x مع إلغاء تركيز تتراوح بين 1-2 ميكرومتر.
النتائج
كما هو مذكور في البروتوكول ، تم زراعة 5 لترات من خلايا الإشريكية القولونية التي تم تحويلها مع البلازميدات المعبرة عن السيبتين ، وتم تحفيز التعبير عن السيبتين بإضافة IPTG. بعد 3 ساعات ، تم جمع الخلايا عن طريق الطرد المركزي ، وإعادة تعليقها في محلول التحلل ، وتحليلها بواسطة صوتنة. ثم تم توضيح المحللة عن طريق الطرد المركزي ، وتم تطبيق المحلول الموضح على عمود HisTrap (الشكل 2 أ). بعد التنقية الأولى ، تم تجميع الكسور المحتوية على السيبتين وتطبيقها على عمود StrepTrap (الشكل 2 ب). ينتج هذا عادة حوالي 3-5 مل من مركب السيبتين ~ 1 ميكرومتر. قبل تجميع الكسور المحتوية على السيبتين ، يمكن استخدام الرحلان الكهربائي الهلامي للتحقق من سلامة الوحدات الفرعية للسيبتين والنسبة المتكافئة بين الوحدات الفرعية المختلفة للسيبتين التي تشكل المجمع. (الشكل 3 أ). إذا أظهر الجل نطاقات مكثفة مماثلة تتوافق مع الأوزان الجزيئية (الجدول 3) للوحدات الفرعية للحاجز ، فيمكن متابعة البروتوكول. إذا لم يكن كذلك ، فمن المستحسن بدء البروتوكول مرة أخرى. في المثال الموضح لأوكتامير السيبتين البشري مع SEPT9_i1 ، يوضح الشكل 3A بوضوح النطاقات المقابلة ل SEPT9_i1 و SEPT6 و SEPT7 و SEPT2 (بالترتيب من أعلى إلى أسفل) بكثافة مماثلة ؛ كان فاصل الثقة 99٪ للكثافة الطبيعية 1.128 ± 0.048 ل SEPT2 ، و 1.092 ± 0.034 ل SEPT6 ، و 1.108 ± 0.040 ل SEPT7 ، و 1.067 ± 0.029 ل SEPT9. إذا تم وضع علامة على SEPT2 ب msfGFP ، فسوف يتحول إلى ما دون SEPT9_i1. اعتمادا على نظام الرحلان الكهربائي المستخدم ووجود علامة TEV-Strep الطرفية C ل SEPT7 (مما يجعلها تهاجر بشكل أبطأ من SEPT7 غير الموسومة) ، تندمج نطاقات SEPT7 و SEPT6 أحيانا بسبب أوزانها الجزيئية المتشابهة. الخطوة التالية هي تجميع الكسور وتحليلها ضد المخزن المؤقت للسبتين باستخدام DTT. بعد غسيل الكلى ، إذا كان التركيز منخفضا جدا (<2 ميكرومتر) أو كانت هناك حاجة إلى تركيز أعلى للتجارب ، فيمكن تضمين خطوة تركيز ، كما هو موضح في البروتوكول. عادة ما تشير التركيزات التي تقل عن 1 ميكرومتر إلى جودة وظيفية سيئة للسبتين. يعمل تركيز مركب السيبتين النهائي بين 3.5 ميكرومتر و 7 ميكرومتر بشكل جيد لمعظم المقايسات في المختبر . عادة ما يتم الحصول على هذه التركيزات عندما يصل الحجم بعد التركيز إلى 0.5-1 مل.
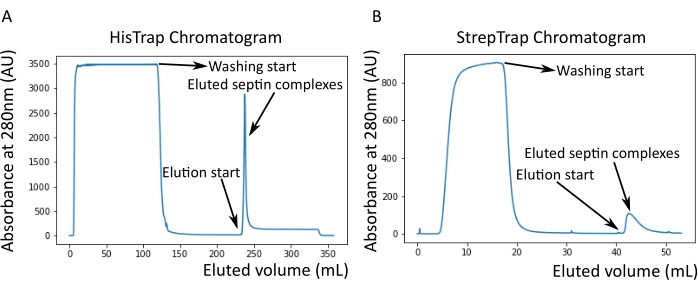
الشكل 2: مثال على الكروماتوجرام المقابل لتنقية octamers_9i1 الحاجز البشري الداكن . (أ) كروماتوجرام عمود HisTrap. بعد ذروة شطف السيبتين ، لا يعود الامتصاص إلى الصفر ، ويرجع ذلك على الأرجح إلى وجود إيميدازول في المخزن المؤقت. ذهب الجزء المجمع من بداية ذروة الشطف حتى استقر الامتصاص عند حوالي 250 مل. (ب) كروماتوجرام عمود StrepTrap. ذهب الجزء المجمع من بداية ذروة الشطف حتى عاد الامتصاص إلى حوالي 0 عند 50 مل. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
لمواصلة مراقبة الجودة ، تم إجراء رحلان كهربائي أصلي ، كما هو موضح في البروتوكول ، (الشكل 3 ب). في المواد الهلامية ، يمكن ملاحظة شريط رئيسي يتوافق مع oligomers غير المتجانسة السليمة ، وعادة ما يمكن ملاحظة شريط ثانوي يتوافق مع dimers. تم العثور على السداسيات البشرية أعلى قليلا من نطاق علامة 242 كيلو دالتون ، بينما تم العثور على الأوكتامات فوق النطاق 480 كيلو دالتون ، فوق كتلتها الجزيئية المحسوبة. تم التحقق من موقع هذه النطاقات من خلال تحليل اللطخة الغربية لمستخلصات الخلايا حقيقية النواة32. وضع العلامات مع الأزواج msfGFP كل سبتمبر 2 مع بروتين msfGFP. يؤدي هذا إلى زيادة الوزن الجزيئي لمجمعات السيبتين بمقدار 53.4 كيلو دالتون (جزيء 26.7 كيلو دالتون / مللي جاويد). ومع ذلك ، على هلام الكهربائي الأصلي ، لا يمكن تمييز الوزن الجزيئي الظاهر للمجمعات الموسومة ب msfGFP عن تلك الخاصة بالمجمعات غير الموسومة.
تقنية تكميلية لاختبار ما إذا كانت معقدات السيبتين سليمة هي القياس الضوئي الشامل بواسطة الفحص المجهري iSCAT. يراقب iSCAT تشتت الضوء للجزيئات التي تهبط على شريحة زجاجية يتم تضخيمها عن طريق التداخل مع الضوء المرجعي ، وعادة ما يكون انعكاس الليزر على الجزء السفلي من الشريحة الزجاجية. بعد ذلك ، يتم استخدام نهج طرح الخلفية لإعطاء تباين للجسيمات. بسبب هذا التصحيح ، تظهر الإشارة قيما إيجابية وسالبة اعتمادا على ما إذا كانت الجسيمات تهبط على الزجاج أو تبتعد عنه49. تتناسب الإشارة المكتشفة طرديا مع الوزن الجزيئي للبروتينات50. ومن ثم، يمكن لمعايرة الإشارة إلى الكتلة بمعيار كتلة أن تحدد كتلة بروتينات العينة. يوضح الشكل 3C مثالا على أوكتامات السيبتين البشرية التي تحتوي على SEPT9_i1. معظم الجسيمات المفردة المكتشفة (~ 50٪) ذات وزن جزيئي متوقع للأكتامات الكاملة التي تحتوي على SEPT9_i1 (423 كيلو دالتون) (الشكل 3C). هناك أيضا جزيئات ذات كتل تتراوح بين 150-300 كيلو دالتون ، ولكن لم يلاحظ وجود ذروة واضحة ، مما يشير إلى احتمال وجود أنواع أخرى من السيبتين بوفرة منخفضة. وبالمثل ، فإن معظم الجسيمات المفردة المكتشفة لسداسي ذبابة الفاكهة الموسوم ب mEGFP لها وزن جزيئي متوقع للسداسيات السليمة (361 كيلو دالتون) (الشكل 3D). تشير قمة واضحة إضافية عند 241 كيلو دالتون إلى وجود رباعيات مستقرة تحتوي على بروتينين من الفول السوداني ، أحدهما DSep1 والآخر mEGFP-DSep2. أخيرا ، تظهر كل من مجمعات سيبتين البشرية والذبابة ذروة حوالي 80 كيلو دالتون يمكن أن تكون مزيجا من المونومرات و dimers ، وربما يتم تضخيمها بواسطة أثر DTT أو أي جزيء صغير آخر يتجمع ، مما يدل على ذروة في الجانب الإيجابي من المؤامرة45.
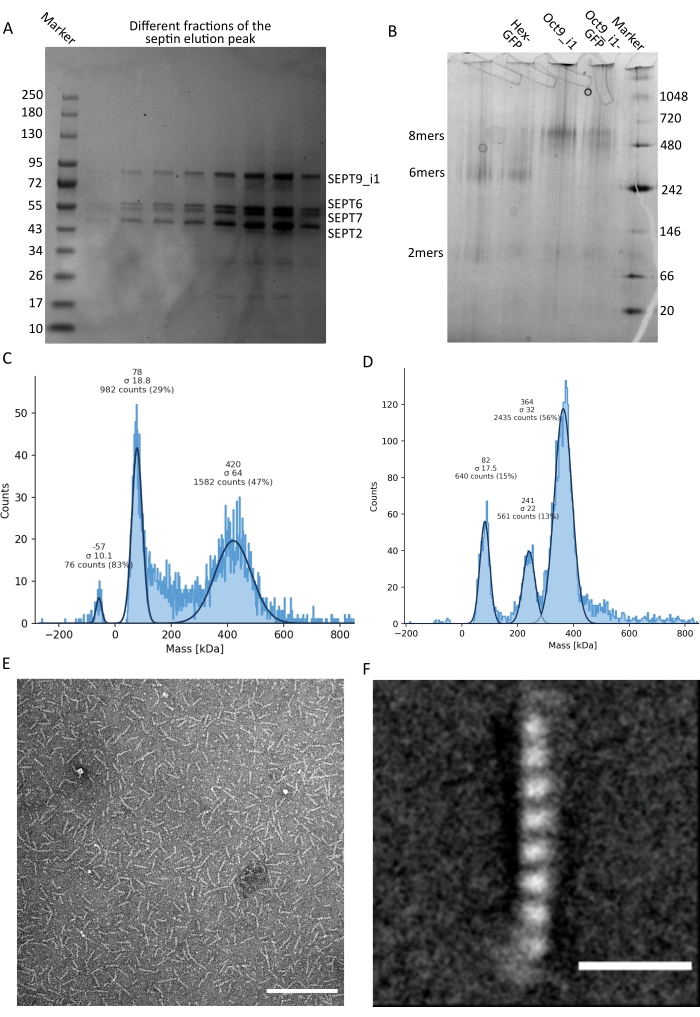
الشكل 3: أمثلة على نتائج مراقبة جودة oligomer . (أ) مثال على جل تغيير طبيعة يوضح أجزاء مختلفة من ذروة الشطف من تنقية octamers_9i1 السيبتين البشري الداكن. (ب) مثال على الرحلان الكهربي الأصلي لمعقدات سبتين مختلفة. (ج، د) أمثلة مختلفة لنتائج الرسم البياني للقياس الضوئي الشامل عند 12.5 نانومتر من معقدات السيبتين: (ج) octamers_9i1 سيبتين الإنسان الداكن و (د) DSep1-msfGFP سداسي سبتين ذبابة الفاكهة . الخطوط هي نوبات غاوسية. (ه) صورة TEM لحاجز بشري مظلم 25 نانومتر octamers_9i1 في عازلة السيبتين. شريط المقياس = 200 نانومتر. (F) صورة متوسط الفئة ل SEPT2-msfGFP octamers_9i1 سيبتين البشري. تكون علامات msfGFP مرئية ككثافات غامضة على الطرفين. شريط المقياس = 10 نانومتر. اللوحتان (E) و (F) هما حقوق الطبع والنشر لشركة علماء الأحياء وقد تم تكييفهما من Iv et al.10 بإذن. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
بالنظر إلى أن كلا من المواد الهلامية الأصلية و iSCAT توفر معلومات متوسطة المجموعة فقط ، فقد تم استخدام المتوسط الطبقي لصور المجهر الإلكتروني النافذ لأوليغومرات سيبتين واحدة للتحقق من سلامة ونقاء المعقدات عن طريق التصور المباشر. في صور TEM لمجمعات septin في المخزن المؤقت septin ، يمكن ملاحظة قضبان بطول 24 نانومتر (hexamers) أو 32 نانومتر (أوكتامات). يمكن رؤية مثال على أوكتامر سيبتين بشري يحتوي على SEPT9_i1 في الشكل 3ه. عند حساب متوسط الفئة ، يمكن ملاحظة كل وحدة فرعية وحسابها ، كما هو موضح في الأوكتامر البشري الموسوم ب msfGFP مع SEPT9_i1 في الشكل 3F. في حالة تسمية oligomer بالفلورسنت ، يمكن ملاحظة كثافات إضافية تتوافق مع SEPT2-msfGFP في نهاية القضبان (الشكل 3F).
يثبت الجمع بين التقنيات المذكورة أعلاه أنه يمكن تنقية الأوكتامرات (أو السداسيات) ذات النسبة المتكافئة الصحيحة والنقاء العالي باستخدام البروتوكول الموصوف. أخيرا ، آخر فحص لمراقبة الجودة هو لوظائف مجمعات السيبتين من حيث قدرتها على البلمرة. في وجود تركيز منخفض للملح (<150 mM KCl مع المخزن المؤقتالموصوف 9) ، إذا لم تكن السيبتين في وجود بروتينات أخرى أو أغشية دهنية سالبة الشحنة ، فإنها تتجمع ذاتيا في حزم9. يتم منع السيبتين من البلمرة عن طريق الاحتفاظ بها في مخزن التخزين المؤقت ، والذي يحتوي على تركيز عال (300 مللي مول). ثم يتم تخفيف أوليغومرات السيبتين غير المتجانسة بنسبة حجم 1: 6 في مخزن مؤقت من نفس التركيبة ولكن بدون KCl لتحقيق تركيز KCl نهائي يبلغ 50 mM. للقيام بالتصوير الفلوري ، يتم استكمال هذا المخزن المؤقت بنظام كسح الأكسجين للحماية من التبييض الضوئي وبمثبط وامض. في الفحص المجهري TIRF ، يمكن ملاحظة مجموعات صغيرة من البروتينات داخل حقل TIRF الضحل (~ 100 نانومتر; الشكل 4 أ ، ب). على المجهر متحد البؤر ، يمكن رؤية مجموعات كبيرة من الهياكل الخيطية تطفو أعلى في المحلول (الشكل 4 ج). أخيرا ، مع TEM ، يمكن ملاحظة حزم صغيرة من السيبتين (الشكل 4D) ، المقابلة للمجموعات التي لاحظها TIRF ، والحزم الكبيرة (الشكل 4E) ، المقابلة للهياكل التي لاحظها الفحص المجهري متحد البؤر. تكشف الأجزاء الداخلية من الشكل 4D ، E أن كلا النوعين من الهياكل يتكون من خيوط طويلة ورفيعة تعمل بالتوازي ، وتشكل حزما ذات نهايات مدببة. معا ، تثبت صور التألق و TEM أن مجمعات السيبتين المنقاة يمكن أن تتبلمر إلى خيوط ، والتي بدورها تتجمع ذاتيا في حزم.
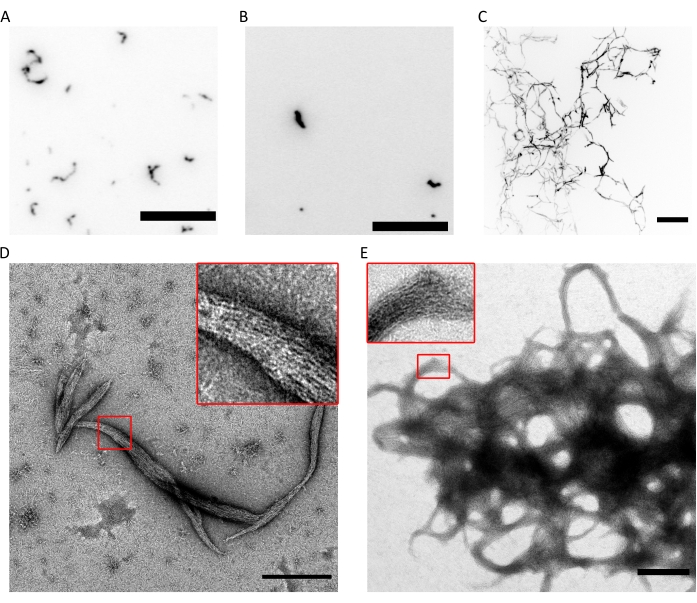
الشكل 4: أمثلة على نتائج مراقبة جودة قدرة البلمرة. (أ) صورة TIRF ل 300 نانومتر من سداسي السيبتين البشري (10٪ سداسيات موسومة ب msfGFP) في fluoSPB. (ب) صورة TIRF لأوكتامات سبتين بشرية 300 نانومتر تحتوي على SEPT9_i1 (10٪ MSFGFP المسمى octamers9_i1) في fluoSPB. (C) إسقاطات الكثافة القصوى البؤرية لمداخن Z عبر ~ 30 ميكرومتر مع 0.5 ميكرومتر من تباعد 300 نانومتر من octamers_9i3 السيبتين البشري في fluoSPB. (أ - ج) شريط المقياس = 10 ميكرومتر وتدرج الرمادي المقلوب. (د، ه) مثال على صور TEM ل (D) حزم صغيرة و (E) كبيرة من octamers_9i1 السيبتين البشري في darkSPB. تظهر الأجزاء الداخلية المناطق التي يمكن فيها ملاحظة خيوط واضحة تعمل بالتوازي داخل الحزمة. قضبان المقياس = 500 نانومتر. اللوحات (C-E) هي حقوق الطبع والنشر لشركة علماء الأحياء وقد تم تكييفها من Iv et al.10 بإذن. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الجدول 1: قائمة البلازميدات. البلازميدات لتنقية أوليغومرات السيبتين باتباع هذا البروتوكول. تم إيداع جميع البلازميدات في Addgene (العمود الأول). الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 2: قائمة المخازن المؤقتة. التراكيب العازلة المستخدمة لتنقية ومراقبة جودة oligomers. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 3: الأوزان الجزيئية ومعاملات الانقراض. قائمة الأوزان الجزيئية (MW) ومعاملات الانقراض البصري (ε) عند طول موجي 280 نانومتر محسوبة باستخدام ProtParam بناء على تسلسل المجمع ، بافتراض الاندماج الخطي لوحدات السيبتين الفرعية ، ومعقدات السيبتين المختلفة ، والوحدات الفرعية الفريدة من نوعها (MW فقط) التي يمكن تنقيتها باستخدام البلازميدات المدرجة في الجدول 1. الرجاء الضغط هنا لتحميل هذا الجدول.
Discussion
تسمح الطريقة الموصوفة هنا بالتنقية القوية ومراقبة الجودة لأوليغومرات سيبتين غير المتجانسة المشكلة مسبقا. فيما يلي بعض القضايا الرئيسية التي يجب مراعاتها من أجل التطبيق الصحيح للطريقة. أثناء خطوات الشطف في عمليات الفصل الكروماتوغرافية ، من المهم استخدام معدل التدفق الموصى به (أو الأقل) لتقليل تخفيف مجمعات السيبتين. بالإضافة إلى ذلك ، لتحقيق أقصى قدر من استعادة البروتين خلال خطوة التركيز النهائية ، يتم توجيه عمود المكثف بطريقة لا يتم فيها دفع المحلول ضد المرشح (عندما يكون هناك مرشح فقط على جانب واحد). إذا ذهب المحلول مباشرة إلى المرشح ، فإن البروتين يلتصق به أكثر بكثير ، مما يقلل بشكل كبير من العائد النهائي. من المهم أيضا مراعاة أن خطوة التركيز ليست ضرورية دائما. عادة ما يعطي انتقاء الكسور فقط من نطاق ضيق حول الذروة في مخطط الكروماتوجرام تركيزا عاليا بدرجة كافية (>3000 نانومتر) للعديد من تطبيقات إعادة التكوين (والتي تعمل عادة بين 10-300 نانومتر). أخيرا ، من أجل مراقبة جودة وظائف مجمعات السيبتين بواسطة الفحص المجهري الفلوري ، من المهم تخميل سطح شرائح الفحص المجهري بشكل صحيح ، لأن مجمعات السيبتين تلتصق بشدة بالزجاج. يمكن إجراء تخميل الشرائح الزجاجية إما عن طريق وظيفة PLL-PEG أو عن طريق تشكيل طبقات ثنائية دهنية محايدة (100٪ DOPC) مدعومة11,32.
مقارنة ببروتوكول التنقية الأصلي الموصوف لأول مرة في Iv et al.10 ، هناك تغيير في تركيبات المخزن المؤقت (الجدول 2). تم تقليل تركيز MgCl 2 من 5 mM إلى2 mM ، وتم تقليل تركيز ودرجة الحموضة من Tris-HCl من 50 mM إلى 20 mM ومن 8.0 إلى 7.4 ، على التوالي. تم إجراء هذه التغييرات لجعل الظروف العازلة متوافقة مع دراسات تفاعلات السيبتين البشري مع الطبقات الثنائية الدهنية وخيوط الأكتين والأنابيب الدقيقة10،11،32. وذلك لأن المؤلفين شكلوا طبقات ثنائية دهنية مدعومة وأكتين مبلمر في F-buffer ، الذي يتطابق تكوينه مع تركيبة darkSPB ، بصرف النظر عن وجود ATP في F-buffer. لم ينتج عن تغيير المخزن المؤقت أي تغييرات في جودة أو عمر السيبتين المنقى مقارنة بالمخازن المؤقتة الأصلية.
طريقة التنقية هذه لا تزال لديها العديد من القيود. أولا ، يمكن أن تختلف محاولات التنقية المختلفة في العائد (0.5-1 مل من مجمعات السيبتين 2-5 ميكرومتر) والجودة الوظيفية ، كما يتم فحصها من خلال قدرة تكوين الحزمة لمجمعات السيبتين المنقى. هذا هو السبب في أنه من المهم للغاية إجراء فحوصات الجودة الموضحة في هذه الورقة باستمرار. يمكن أن يساعد التحكم الجيد في أوقات التعبير والكثافة البصرية للثقافة البكتيرية في تخفيف الفرق في المحصول. ثانيا ، لا يمكن لخط أنابيب التنقية هذا التمييز بين أدوات التشذيب والسداسي أو بين رباعي وأوكتامير (الشكل 1 ب). ومع ذلك ، يمكن استخدام تجارب مراقبة الجودة لإثبات أن غالبية مجمعات السيبتين هي في شكلها الأوليغومر الطويل. في حالة الحاجة إلى توزيع حجم oligomer أضيق ، يمكن إدراج كروماتوغرافيا استبعاد الحجم بين الخطوة 1.6. والخطوة 1.7. من بروتوكول التنقية. ومع ذلك ، فإن هذه الخطوة الاختيارية تقلل بشكل كبير من العائد ، ولا ينصح بها ما لم تكن هناك حاجة ماسة إليها. يأتي القيد الأخير الأكثر جوهرية من استخدام الإشريكية القولونية كنظام تعبير لمجمعات السيبتين المؤتلفة. بطبيعة الحال ، لا يسمح هذا النظام بإجراء تعديلات ما بعد الترجمة (PTMs) ، والتي تم الإبلاغ عنها في الخلايا الحيوانية ، مثل الفسفرة ، والأستيل ، والسومويل6،51،52،53. يمكن إضافة هذه التعديلات بعد الترجمة من خلال تنفيذ استراتيجية تنقية مماثلة في الحشرات أو الخلايا البشرية. علاوة على ذلك ، ناقشت هذه الورقة فقط إعادة تكوين السيبتين من تلقاء نفسها ، لكن الدراسات التي أجريت على الخلايا تشير إلى أن البروتينات التنظيمية مثل البروتينات من عائلة بورغ 54،55 وأنيلين24،25،56 يمكن أن يكون لها تأثيرات كبيرة ولكنها غير مفهومة بشكل جيد على تجميع ووظائف السيبتين ، وبالتالي ، من المهم دمجها في نهاية المطاف في المختبر. الدراسات. تم الإبلاغ عن بروتوكولات لتنقية بروتينات بورغ وأنيلين54,57.
يوفر بروتوكول تنقية السيبتين المذكور هنا طريقة موحدة لتنقية السيبتين في شكل أوليغومر مع القياس الكيميائي الصحيح للوحدة الفرعية ، مما يوفر تقدما مهما على العديد من الدراسات السابقة في المختبر التي تعتمد على وحدات فرعية واحدة من السيبتين. على الرغم من أن بعض السيبتين في سياقات محددة يمكن أن تعمل كوحدة فرعية واحدة2 ، إلا أن مجموعة الأدبيات الحالية تشير بقوة إلى أنه في الخلايا الحيوانية ، تعمل السيبتين في الغالب في المجمعات 9,58. لذلك ، فإن استخدام oligomers-hetero-oligomerss سابقة التكوين ، مثل تلك الموصوفة في هذه الورقة وغيرها10،11،18،32،35،36،37 ، له أهمية كبيرة لدراسة الخصائص الهيكلية والفيزيائية الحيوية للسبتين عبر المختبر إعادة التكوين لتشريح وظائفهم في الخلية. علاوة على ذلك ، فإن السيبتين عبارة عن بروتينات ذاتية التجميع مع العديد من شركاء التفاعل ، بما في ذلك الغشاء والهيكل الخلوي ، مما يجعلها ذات أهمية كبيرة للبيولوجيا التركيبية من أسفل إلى أعلى59،60،61 ودراسات التغيرات التي يسببها البروتين في الخصائص الفيزيائية الحيوية للغشاء مثل الانحناء42،62،63.
Disclosures
يعلن المؤلفون عن عدم وجود مصالح متنافسة أو مالية.
Acknowledgements
نشكر سيسيليا دي أجريلا بينتو وتوماس دي غاراي وكاتارينا هاوسيرمان على مساعدتهم في تجارب القياس الضوئي الشامل (iSCAT). آرجين جاكوبي وويل إيفرز لمساعدتهما في TEM ؛ لوسيا بالداوف لمساعدتها في TIRF ؛ باسكال فيردييه بينارد لنصيحته بشأن الرحلان الكهربائي الأصلي ؛ أغاتا زوبا ومارجولين فينكينوغ لمساعدتهما في إعداد جهود تنقية ذبابة الفاكهة ، وتصوير الخلايا والأنسجة (PICT-IBiSA) ، معهد كوري ، عضو في البنية التحتية الوطنية الفرنسية للبحوث في فرنسا - التصوير الحيوي (ANR10-INBS-04). تلقى هذا البحث تمويلا من المنظمة الهولندية للبحث العلمي (NWO / OCW) من خلال منحة الجاذبية "BaSyC-Building a Synthetic Cell" (024.003.019) ومن الوكالة الوطنية للبحوث (منح ANR ANR-17-CE13-0014: "SEPTIMORF" ؛ ANR-13-JSV8-0002-01: "SEPTIME" ؛ و ANR-20-CE11-0014-01: "SEPTSCORT").
Materials
| Name | Company | Catalog Number | Comments |
| 488nm laser combiner iLAS2 | Gataca | TIRF microscope | |
| 488nm Sapphire laser lines | Coherent | Confocal microscope | |
| 4k X 4k F416 CMOS camera | TVIPS | For JEM-1400plus | |
| 4x sample buffer nativePAGE | Thermo Fisher scientific | BN2003 | |
| 6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (TROLOX) | Sigma-Aldrich | 238813 | To prevent blinking |
| AKTA pure 25 M1 | GE healthcare | 1680311 | |
| Ampicillin | Sigma-Aldrich | A9518-25G | |
| Carbon Type-B, 300 mesh EM grid | Ted pella | 01813-F | |
| Carbon Type-B, 300 mesh EM grid | Electron micoscopy sciences | CF300-Cu | |
| Cover glass #1.5H | Thorslabs | CG15KH | |
| CSU-X1-M1 confocal unit | Yokogawa | Confocal microscope | |
| Desthiobiotin | Sigma-Aldrich | D1411-1G | |
| Dithiothreitol (DTT) | Sigma-Aldrich | D9779 | |
| DNAse | Sigma-Aldrich | 10104159001 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| Eclipse Ti2-E | Nikon instruments | Confocal microscope | |
| EDTA-free protease inhibtor cocktail | Roche | 481761 | |
| HisTrap HP, 5 mL | GE healthcare | 29-0588-3 | |
| iLAS2 azimuthal TIRF illumination system | Gataca | TIRF microscope | |
| Imidazole | Sigma-Aldrich | 1202-1KG | |
| InstantBlue Protein Gel Stain | Westburg Life Sciences | EP ab119211 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher scientific | 10849040 | |
| iXon Ultra 888 EMCCD camera | Andor | Confocal microscope | |
| iXon Ultra 897 EM-CCD | Andor | TIRF microscope | |
| JEM-1400plus | JOEL | TEM microscope TUDelft | |
| kappa-cassein | Sigma-Aldrich | C0406 | |
| LB broth | Sigma-Aldrich | L3022-6X1KG | |
| Lyzozyme | Sigma-Aldrich | 62971-10G-F | |
| Magnesium Chloride | Sigma-Aldrich | M8266-100G | |
| Magnesium sulfate | Sigma-Aldrich | 746452-1KG | |
| Methylecllulose | Sigma-Aldrich | 8074844 | |
| MilliQ system (Integral 10) | Merck-Millipore | I-water dispenser | |
| Mini protean TGX gels | BIORAD | 4561086 | |
| NativeMark unstained protein standard | Invitrogen | LC0725 | For iSCAT and Native gels |
| NativePAGE 4-16% GELS | Thermo Fisher scientific | BN1002BOX | |
| NativePAGE Running Buffer kit | Thermo Fisher scientific | BN2007 | |
| Nikon Ti2-E | Nikon instruments | TIRF microscope | |
| Nr. 1 Menzel coverslips | Thermo Fisher scientific | 11961988 | |
| parafilm | Sigma-Aldrich | P7668 | |
| Plan Apo ×100/1.45 NA oil immersion objective | Nikon instruments | Confocal microscope | |
| PMSF | Sigma-Aldrich | 10837091001 | |
| Poly(L-lysine)-graft-biotinylated PEG (PLL-PEG) | SuSoS | CHF560.00 | |
| Poly-L-lysine solution 0.01% | Sigma-Aldrich | P4832 | For iSCAT glass slides |
| Pottassium Chloride | Sigma-Aldrich | P9541-1KG | |
| Power supply for native gels | CONSORT | S/N 71638 | |
| POWERPAC UNIVERSAL | BIORAD | 042BR31206 | |
| Protocatechuate 3,4-Dioxygenase (PCD) | Sigma-Aldrich | P8279-25UN | oxygen scavenger - enzyme |
| Protocatechuic acid (PCA) | Sigma-Aldrich | 03930590-50MG | oxygen scavenger - reagent |
| Q500 Sonicator | Qsonica | Q500-110 | |
| Quemesa camera | Olympus | For Tecnai Spirit | |
| Refeyn OneMP | Refeyn | ||
| Sample buffer, laemmli 2x concentrate | Sigma-Aldrich | S3401-10vl | |
| Silicon gaskets | Sigma-Aldrich | GBL103250-10EA | |
| Slide-A-Lyzer Dialysis cassettes 30k MWCO 3mL | Thermo Fisher scientific | 66381 | |
| Spectinomycin | Sigma-Aldrich | PHR1441-1G | |
| StrepTrap HP, 1 mL | GE healthcare | 28-9075-46 | |
| Tecnai Spirit microscope | Thermo Scientific, FEI | TEM microscope Institute Curie | |
| Terrific broth | Sigma-Aldrich | T0918-1KG | |
| Tris/Glyine/SDS buffer | BIORAD | 1610772 | |
| Tris-HCl | Sigma-Aldrich | T5941-1KG | |
| Ultrasonic cleaner | Branson | CPX2800H-E | |
| Vivaspin 6, 30,000 MWCO PES | Sartorius | VS0622 |
References
- Mostowy, S., Cossart, P. Septins: The fourth component of the cytoskeleton. Nature Reviews Molecular Cell Biology. 13 (3), 183-194 (2012).
- Shuman, B., Momany, M. Septins from protists to people. Frontiers in Cell and Developmental Biology. 9, 3802 (2022).
- Bridges, A. A., Gladfelter, A. S. Septin form and function at the cell cortex. Journal of Biological Chemistry. 290 (28), 17173-17180 (2015).
- Smith, C., et al. Septin 9 exhibits polymorphic binding to F-actin and inhibits myosin and cofilin activity. Journal of Molecular Biology. 427 (20), 3273-3284 (2015).
- Gilden, J. K., Peck, S., Chen, Y. C. M., Krummel, M. F. The septin cytoskeleton facilitates membrane retraction during motility and blebbing. Journal of Cell Biology. 196 (1), 103-114 (2012).
- Marquardt, J., Chen, X., Bi, E. Architecture, remodeling, and functions of the septin cytoskeleton. Cytoskeleton. 76 (1), 7-14 (2018).
- Van Ngo, H., Mostowy, S. Role of septins in microbial infection. Journal of Cell Science. 132 (9), (2019).
- Fung, K. Y. Y., Dai, L., Trimble, W. S. Cell and molecular biology of septins. International Review of Cell and Molecular Biology. 310, 289-339 (2014).
- Kinoshita, M., Field, C. M., Coughlin, M. L., Straight, A. F., Mitchison, T. J. Self- and actin-templated assembly of mammalian septins. Developmental Cell. 3 (6), 791-802 (2002).
- Iv, F., et al. Insights into animal septins using recombinant human septin octamers 2 with distinct SEPT9 isoforms. Journal of Cell Science. 134 (15), (2021).
- Szuba, A., et al. Membrane binding controls ordered self-assembly of animal septins. eLife. 10, 63349 (2021).
- Kinoshita, M. Assembly of mammalian septins. Journal of Biochemistry. 134 (4), 491-496 (2003).
- Connolly, D., et al. Septin 9 isoform expression, localization and epigenetic changes during human and mouse breast cancer progression. Breast Cancer Research. 13 (4), 76 (2011).
- Connolly, D., et al. Septin 9 amplification and isoform-specific expression in peritumoral and tumor breast tissue. Biological Chemistry. 395 (2), 157-167 (2014).
- Estey, M. P., Di Ciano-Oliveira, C., Froese, C. D., Bejide, M. T., Trimble, W. S. Distinct roles of septins in cytokinesis: SEPT9 mediates midbody abscission. Journal of Cell Biology. 191 (4), 741-749 (2010).
- John, C. M., et al. The Caenorhabditis elegans septin complex is nonpolar. EMBO Journal. 26 (14), 3296-3307 (2007).
- Field, C. M., et al. A purified Drosophila septin complex forms filaments and exhibits GTPase activity. Journal of Cell Biology. 133 (3), 605-616 (1996).
- Bertin, A., et al. Saccharomyces cerevisiae septins: Supramolecular organization of heterooligomers and the mechanism of filament assembly. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8274-8279 (2008).
- Sellin, M. E., Sandblad, L., Stenmark, S., Gullberg, M. Deciphering the rules governing assembly order of mammalian septin complexes. Molecular Biology of the Cell. 22 (17), 3152-3164 (2011).
- Akil, A., et al. Septin 9 induces lipid droplets growth by a phosphatidylinositol-5-phosphate and microtubule-dependent mechanism hijacked by HCV. Nature Communications. 7, 12203 (2016).
- Tanaka-Takiguchi, Y., Kinoshita, M., Takiguchi, K. Septin-mediated uniform bracing of phospholipid membranes. Current Biology. 19 (2), 140-145 (2009).
- Omrane, M., et al. Septin 9 has two polybasic domains critical to septin filament assembly and Golgi integrity. iScience. 13, 138-153 (2019).
- Carim, S. C., Kechad, A., Hickson, G. R. X. Animal cell cytokinesis: The rho-dependent actomyosin-anilloseptin contractile ring as a membrane microdomain gathering, compressing, and sorting machine. Frontiers in Cell and Developmental Biology. 8, 575226 (2020).
- El Amine, N., Kechad, A., Jananji, S., Hickson, G. R. X. Opposing actions of septins and Sticky on Anillin promote the transition from contractile to midbody ring. Journal of Cell Biology. 203 (3), 487-504 (2013).
- Renshaw, M. J., Liu, J., Lavoie, B. D., Wilde, A. Anillin-dependent organization of septin filaments promotes intercellular bridge elongation and Chmp4B targeting to the abscission site. Open Biology. 4 (1), 130190 (2014).
- Vogt, E. T., et al. The ultrastructural organization of actin and myosin II filaments in the contractile ring: new support for an old model of cytokinesis. Molecular Biology of the Cell. 28 (5), 613-623 (2017).
- Mavrakis, M., et al. Septins promote F-actin ring formation by crosslinking actin filaments into curved bundles. Nature Cell Biology. 16 (4), 322-334 (2014).
- Karasmanis, E. P., et al. A septin double ring controls the spatiotemporal organization of the ESCRT machinery in cytokinetic abscission. Current Biology. 29 (13), 2174-2182 (2019).
- Hagiwara, A., et al. Submembranous septins as relatively stable components of actin-based membrane skeleton. Cytoskeleton. 68 (9), 512-525 (2011).
- Calvo, F., et al. Cdc42EP3/BORG2 and septin network enables mechano-transduction and the emergence of cancer-associated fibroblasts. Cell Reports. 13 (12), 2699-2714 (2015).
- Salameh, J., Cantaloube, I., Benoit, B., Poüs, C., Baillet, A. Cdc42 and its BORG2 and BORG3 effectors control the subcellular localization of septins between actin stress fibers and microtubules. Current Biology. 31 (18), 4088-4103 (2021).
- Kuzmić, M., et al. Septin-microtubule association via a motif unique to isoform 1 of septin 9 tunes stress fibers. Journal of Cell Science. 135 (1), (2022).
- Shindo, A., et al. Septin-dependent remodeling of cortical microtubule drives cell reshaping during epithelial wound healing. Journal of Cell Science. 131 (12), (2018).
- Hu, Q., Nelson, W. J., Spiliotis, E. T. Forchlorfenuron alters mammalian septin assembly, organization, and dynamics. Journal of Biological Chemistry. 283 (43), 29563-29571 (2008).
- Mavrakis, M., Tsai, F. C., Koenderink, G. H. Purification of recombinant human and Drosophila septin hexamers for TIRF assays of actin-septin filament assembly. Methods in Cell Biology. 136, 199-220 (2016).
- Nakos, K., Radler, M. R., Spiliotis, E. T. Septin 2/6/7 complexes tune microtubule plus-end growth and EB1 binding in a concentration- and filament-dependent manner. Molecular Biology of the Cell. 30 (23), 2913-2928 (2019).
- Kaplan, C., et al. Absolute arrangement of subunits in cytoskeletal septin filaments in cells measured by fluorescence microscopy. Nano Letters. 15 (6), 3859-3864 (2015).
- Castro, D. K. S. V., et al. A complete compendium of crystal structures for the human SEPT3 subgroup reveals functional plasticity at a specific septin interface. IUCrJ. 7, 462-479 (2020).
- Jiao, F., Cannon, K. S., Lin, Y. -. C., Gladfelter, A. S., Scheuring, S. The hierarchical assembly of septins revealed by high-speed AFM. Nature Communications. 11 (1), 1-13 (2020).
- Bertin, A., et al. Phosphatidylinositol-4,5-bisphosphate promotes budding yeast septin filament assembly and organization. Journal of Molecular Biology. 404 (4), 711-731 (2010).
- Bridges, A. A., Jentzsch, M. S., Oakes, P. W., Occhipinti, P., Gladfelter, A. S. Micron-scale plasma membrane curvature is recognized by the septin cytoskeleton. Journal of Cell Biology. 213 (1), 23-32 (2016).
- Beber, A., et al. Membrane reshaping by micrometric curvature sensitive septin filaments. Nature Communications. 10, 420 (2019).
- Zhou, R., Shi, Y., Yang, G. Expression, purification, and enzymatic characterization of intramembrane proteases. Methods in Enzymology. 584, 127-155 (2017).
- Diebold, M. L., Fribourg, S., Koch, M., Metzger, T., Romier, C. Deciphering correct strategies for multiprotein complex assembly by co-expression: Application to complexes as large as the histone octamer. Journal of Structural Biology. 175 (2), 178-188 (2011).
- Lebedeva, M. A., Palmieri, E., Kukura, P., Fletcher, S. P. Emergence and rearrangement of dynamic supramolecular aggregates visualized by interferometric scattering microscopy. ACS Nano. 14 (9), 11160-11168 (2020).
- Ludtke, S. J., Baldwin, P. R., Chiu, W. EMAN: Semiautomated software for high-resolution single-particle reconstructions. Journal of Structural Biology. 128 (1), 82-97 (1999).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 42166 (2018).
- Frank, J., et al. SPIDER and WEB: Processing and visualization of images in 3D electron microscopy and related fields. Journal of Structural Biology. 116 (1), 190-199 (1996).
- Young, G., Kukura, P. Interferometric scattering microscopy. Annual Review of Physical Chemistry. 70, 301-322 (2019).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Hernández-Rodríguez, Y., Momany, M. Posttranslational modifications and assembly of septin heteropolymers and higher-order structures. Current Opinion in Microbiology. 15 (6), 660-668 (2012).
- Ribet, D., et al. SUMOylation of human septins is critical for septin filament bundling and cytokinesis. Journal of Cell Biology. 216 (12), 4041-4052 (2017).
- Sinha, I., et al. Cyclin-dependent kinases control septin phosphorylation in Candida albicans hyphal development. Developmental Cell. 13 (3), 421-432 (2007).
- Sheffield, P. J., et al. Borg/Septin interactions and the assembly of mammalian septin heterodimers, trimers, and filaments. Journal of Biological Chemistry. 278 (5), 3483-3488 (2003).
- Joberty, G., et al. Borg proteins control septin organization and are negatively regulated by Cdc42. Nature Cell Biology. 3 (10), 861-866 (2001).
- Chen, X., Wang, K., Svitkina, T., Bi, E. Critical roles of a RhoGEF-anillin module in septin architectural remodeling during cytokinesis. Current Biology. 30 (8), 1477-1490 (2020).
- Kučera, O., et al. Anillin propels myosin-independent constriction of actin rings. Nature Communications. 12 (1), 1-12 (2021).
- Hsu, S. C., et al. Subunit composition, protein interactions, and structures of the mammalian brain sec6/8 complex and septin filaments. Neuron. 20 (6), 1111-1122 (1998).
- Olivi, L., et al. Towards a synthetic cell cycle. Nature Communications. 12 (1), 1-11 (2021).
- Hürtgen, D., Härtel, T., Murray, S. M., Sourjik, V., Schwille, P. Functional modules of minimal cell division for synthetic biology. Advanced Biosystems. 3 (6), 1800315 (2019).
- Jia, H., Schwille, P. Bottom-up synthetic biology: Reconstitution in space and time. Current Opinion in Biotechnology. 60, 179-187 (2019).
- Cannon, K. S., Woods, B. L., Crutchley, J. M., Gladfelter, A. S. An amphipathic helix enables septins to sense micrometer-scale membrane curvature. The Journal of Cell Biology. 218 (4), 1128-1137 (2019).
- Lobato-Márquez, D., Mostowy, S. Septins recognize micron-scale membrane curvature. Journal of Cell Biology. 213 (1), 5-6 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved